GAZYVA 1000 mg IV konsantre infüzyon çöz. içeren flakon Farmakolojik Özellikler
{ Obinutuzumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar ATC kodu: L01FA03
Etki mekanizması
Obinutuzumab, IgG1 izotipinin rekombinant monoklonal hümanize ve gliko işlenmiş Tip II anti-CD20 antikorudur. Hematopoietik kök hücrelerin, pro-B hücrelerin, normal plazma hücrelerinin veya diğer normal dokuların değil fakat spesifik olarak, malign olmayan ve malign pre-B ve olgun B lenfositlerin yüzeyindeki CD20 transmembran antijenin ekstraselüler
kulpunu hedef alır. Obinutuzumabın Fc kısmının gliko işlenmesi, gliko işlenmemiş antikorlara kıyasla doğal katil (NK) hücreler, makrofajlar ve monositler gibi immün efektör hücreler üzerindeki FcγRIII reseptörler için daha yüksek afinite sağlar.
Klinik dışı çalışmalarda obinutuzumab doğrudan hücre ölümüne yol açmakta ve FcγRIII pozitif immün efektör hücrelerin katılması yoluyla antikora bağımlı hücresel sitotoksisiteyi (ADCC) ve antikora bağımlı hücresel fagositozu (ADCP) düzenlemektedir. Buna ek olarak, obinutuzumab düşük derecede kompleman bağımlı sitotoksisiteyi (CDC) düzenlemektedir. Hayvan modellerinde obinutuzumab, potent B hücre deplesyonunu ve antitümör etkililiği düzenler. Tip I antikorlara kıyasla, Tip II antikor olan obinutuzumab, eşdeğer dozda CDC'de eş zamanlı bir azalmayla birlikte doğrudan hücre ölümünün indüklenmesinde artışla karakterize edilir. Gliko işlenmemiş antikorlara kıyasla, gliko işlenmiş bir antikor olarak obinutuzumab, eşdeğer bir dozda yüksek antikora bağımlı hücresel sitotoksisite (ADCC) ve fagositoz (ADCP) ile karakterize edilir. Obinutuzumab hayvan modellerinde potent B-hücre deplesyonu ve antitümör etkililiğe aracılık eder.
KLL'li hastalarda yapılan pivotal klinik çalışmada (BO21004/CLL11), GAZYVA uygulanmasıyla değerlendirilebilen hastaların %91'inde (40/44) tedavi dönemi sonunda B hücre deplesyonu (CD19+ B hücre sayısının <0,07 x 10/L olması şeklinde tanımlanmıştır) olmuş ve deplesyon, ilk 6 aylık takip boyunca devam etmiştir. B hücrelerin geri kazanımı, progresif hastalık olmaksızın hastaların %35'inde (14/40) ve progresif hastalık varlığında hastaların %13'ünde (5/40) takip döneminin 12-18 ayında gözlenmiştir.
iNHL'li hastalarda yapılan pivotal klinik çalışmada (GAO4753/GADOLIN), GAZYVA uygulaması ile değerlendirilebilen hastaların %97'sinde (171/176) tedavi dönemi sonunda B hücre deplesyonu olmuş ve %97'sinde (61/63) son dozu takiben 6 aydan fazla deplesyon devam etmiştir. B hücrelerinin geri kazanımı, tedaviye tepkileri ölçülebilir hastaların %11'inde (5/46) takip döneminin 12-18 ayında gözlenmiştir.
Klinik etkililik ve güvenlilik
- Kronik Lenfositik Lösemi
Komorbiditeleri bulunan daha önce tedavi uygulanmamış kronik lenfositik lösemili hastalarda rituximab + klorambusil (RClb) veya tek başına klorambusile (Clb) karşı GAZYVA + klorambusilin (GClb) etkililiğini ve güvenliliğini inceleyen uluslararası, çok merkezli, açık etiketli, randomize, iki aşamalı, üç kollu bir Faz III klinik çalışma gerçekleştirilmiştir.
Katılımdan önce hastalarda CD20+ KLL ve eş zamanlı mevcut tıbbi durumlara ilişkin aşağıdaki ölçütlerden birinin veya ikisinin bulunduğunun belgelenmesi gerekmiştir; 6'dan yüksek komorbidite skoru (CIRS) veya böbrek fonksiyonunda azalma (KrKl <70 mL/dakika). Karaciğer fonksiyonu (Ulusal Kanser Enstitüsü â Evre 3 karaciğer fonksiyon testleri için Ortak Terminoloji Kriterleri (>2 haftalık AST, ALT > 5 x NÜS; bilirubin > 3 x NÜS) ve renal fonksiyonu (KrKl < 30 mL/dk) yetersiz olan hastalar çalışma dışı bırakılmıştır. CIRS tanımına göre göz, kulak, burun, boğaz ve larenks organ sistemi dışında bir veya daha fazla bireysel organ/sistem yetmezlik skoru 4 olarak değerlendirilen hastalar, çalışma dışı bırakılmıştır.
Toplam 781 hasta, GAZYVA + klorambusil, rituximab + klorambusil veya tek başına klorambusil almak üzere 2:2:1 oranında randomize edilmiştir. Evre 1a'da 356 hasta üzerinde GAZYVA + klorambusil ile tek başına klorambusil, Evre 2'de ise 663 hasta üzerinde GAZYVA
+ klorambusil ile rituximab + klorambusil karşılaştırılmıştır.
Hastaların büyük bölümünde GAZYVA, ilk tedavi döngüsünün 1. günü, 8. günü ve 15. günü uygulanan 1.000 mg başlangıç dozu şeklinde intravenöz yolla verilmiştir. Hastalarda infüzyonla ilişkili reaksiyonların oranını azaltmak için bir düzenleme yapılmış ve 140 hasta, ilk GAZYVA dozunu 1. gün [100 mg] ve 2. gün [900 mg] bölünmüş olarak almıştır (bkz. bölüm 4.2 ve 4.4). Sonraki her tedavi döngüsünde (Döngü2 ile 6), hastalar GAZYVA 1.000 mg dozunu yalnızca 1. günde almıştır. Klorambusil, tüm tedavi döngülerinin (1 ile 6) 1. günü ve 15. günü oral yolla 0,5 mg/kg vücut ağırlığı şeklinde verilmiştir.
Demografik veriler ve başlangıç özellikleri, tedavi grupları arasında iyi dengelenmiştir. Hastaların büyük bölümü beyaz (%95) ve erkektir (%61). Hastaların %44'ü 75 yaş veya üzeri olmak üzere, medyan yaş 73'tür. Başlangıçta hastaların %22'sinde Binet Evre A, %42'sinde Binet Evre B ve %36'sında Binet Evre C mevcuttur.
Medyan komorbidite skoru 8'dir ve katılan hastaların %76'sında komorbidite skoru 6'dan yüksek olmuştur. Medyan tahmini KrKl 62 mL/dakika olmuş ve tüm hastaların %66'sında KrKl <70 mL/dakika bulunmuştur. Katılan hastaların yüzde kırk ikisinde hem <70 mL/dakika KrKl, hem de >6 komorbidite skoru belirlenmiştir. Hastaların yüzde otuz dördü yalnızca komorbidite skoru üzerine çalışmaya katılırken, hastaların %23'ü yalnızca bozulmuş böbrek fonksiyonuyla katılmıştır.
En sık bildirilen eş zamanlı tıbbi hastalıklar (%30 veya daha yüksek kesim değeri kullanılarak), MedDRA vücut sistemlerinde: Vasküler hastalıklar (%73), kardiyak hastalıklar (%46), gastrointestinal hastalıklar (%38), metabolizma ve beslenme hastalıkları (%40), böbrek ve idrar hastalıkları (%38), kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları (%33) olmuştur.
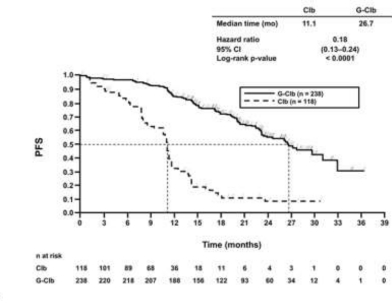
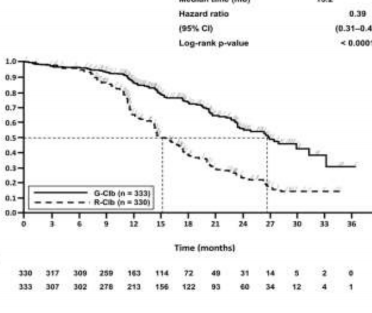
Daha önce tedavi edilmemiş KLL hastalarındaki etkililik verileri Tablo 9'da özetlenmektedir. Progresyonsuz sağkalım (PFS) ve Genel sağkalım (OS) için Kaplan-Meier eğrileri Şekil 1- 4'te verilmektedir.
Tablo 9. BO21004/CLL11 çalışmasından etkililik özeti
| Evre 1a | Evre 2 | ||
| klorambusil N=118 | GAZYVA + klorambusil N= 238 | Rituximab + klorambusil N= 330 | GAZYVA + klorambusil N= 333 |
| 22,8 aylık medyan gözlem süresi | 18,7 aylık medyan gözlem süresi | ||
Birincil sonlanım noktası | ||||
Araştırmacı tarafından değerlendirilen PFS (PFS-IRC)a |
|
| ||
Olay meydana gelen hasta sayısı (%) | 96 (%81,4) | 93 (%39,1) | 199 (%60,3) | 104 (%31,2) |
Medyan PFS süresi (ay) | 11,1 | 26,7 | 15,2 | 26,7 |
Tehlike oranı (%95 GA) | 0,18 [0,13; 0,24] | 0,39 [0,31; 0,49] | ||
p-değeri(Log-sıra testi, tabakalandırılmış ) | <0,0001 | <0,0001 | ||
Kilit ikincil sonlanım noktaları | ||||
IRC-tarafından değerlendirilen PFS (PFS-IRC)a |
|
| ||
Olay meydana gelen hasta sayısı (%) | 90 (%76,3) | 89 (%37,4) | 183 (%55,5) | 103 (%30,9) |
Medyan PFS süresi (ay) | 11,2 | 27,2 | 14,9 | 26,7 |
Tehlike oranı (%95 GA) | 0,19 [0,14; 0,27] | 0,42 [0,33; 0,54] | ||
p-değeri(Log-sıra testi, tabakalandırılmış ) | <0,0001 | <0,0001 | ||
Tedavi bitimindeki yanıt oranı |
|
| ||
Analize dahil edilen hasta sayısı | 118 | 238 | 329 | 333 |
Yanıt verenler (%) | 37 (%31,4) | 184 (%77,3) | 214 (%65,0) | 261 (%78,4) |
Yanıt vermeyenler (%) | 81 (%68,6) | 54 (%22,7) | 115 (%35,0) | 72 (%21,6) |
Yanıt oranındaki fark,(%95 GA) | 45,95 [35,6; 56,3] | 13,33 [6,4; 20,3] | ||
p-değeri (Ki-kare Testi) | <0,0001 | 0,0001 | ||
Tam yanıt verenlerin sayısı (%) | 0 (%0,0) | 53 (%22,3) | 23 (%7,0) | 69 (%20,7) |
Tedavi bitiminde moleküler remisyon |
|
| ||
Analize dahil edilen hasta sayısı | 90 | 168 | 244 | 239 |
MRD negatif (%) | 0 (%0) | 45 (%26,8) | 6 (%2,5) | 61 (%25,5) |
MRD pozitiff (%) | 90 (%100) | 123 (%73,2) | 238 (%97,5) | 178 (%74,5) |
MRD oranındaki farklar, (%95 GA) | 26,79 [19,5; 34,1] | 23,06 [17,0; 29,1] | ||
Olaysız Sağkalım |
|
| ||
Olay meydana gelen hasta sayısı (%) | 103 (%87,3) | 104 (%43,7) | 208 (%63,0) | 118 (%35,4) |
Olaya kadar geçen medyan süre (ay) | 10,8 | 26,1 | 14,3 | 26,1 |
Tehlike oranı (%95 GA) | 0,19 [0,14; 0,25] | 0,43 [0,34; 0,54] | ||
p-değeri (Log-sıra testi, tabakalandırılmış) | <0,0001 | <0,0001 | ||
Yeni anti lösemi tedavisine kadar geçen süre |
|
| ||
Olay meydana gelen hasta sayısı (%) | 65 (%55,1) | 51 (%21,4) | 86(%26,1) | 55(%16,5) |
Olaya kadar geçen medyan süre (ay) | 14,8 | NR | 30,8 | NR |
Tehlike oranı (%95 GA) | 0,24 [0,16; 0,35] | 0,59 [0,42;0,82] | ||
p-değeri(Log-sıra testi,tabakalandırılmış) | <0.0001 | <0,0018 | ||
Genel sağkalım |
|
| ||
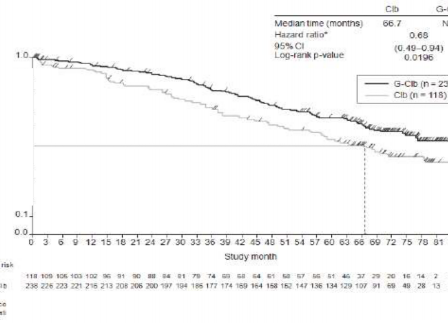
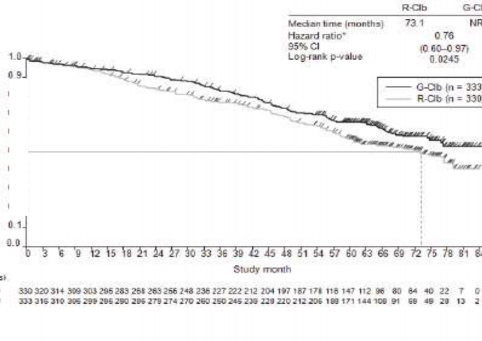
Olay meydana gelen hasta sayısı (%) | 57 (%48,3) | 93 (%39,1) | 147 (%44,5) | 121 (%36,3) |
Olaya kadar geçen medyan süre (ay) | 66,7 | NR | 73,1 | NR |
Tehlike oranı (%95 GA) | 0,68 [0,49; 0,94] | 0,76 [0,60; 0,97] | ||
p-değeri(Log-sıra testi, tabakalandırılmış) | 0,0196 | 0,0245 | ||
Alt grup analizleri
PFS alt grup analizinin bulguları (yani cinsiyet, yaş, Binet evresi, KrKl, CIRS skoru, beta2- mikroglobülin, IGVH durumu, kromozom anormallikleri, başlangıçtaki lenfosit sayısı), genel tedavi amaçlı popülasyonda görülen bulgularla tutarlı olmuştur. Hastalık progresyonu veya ölüm riski, 17p delesyonlu hasta alt grubu dışındaki tüm hastalarda RClb kolu ve Clb koluna kıyasla GClb kolunda azalmıştır. 17p delesyonlu küçük hasta alt grubunda Clb'ye (HR=0,42, p=0,0892) kıyasla yalnızca bir pozitif trend gözlenmiş, RClb'ye kıyasla yarar gözlenmemiştir. Alt gruplar için hastalık progresyon veya ölüm riskindeki azalma GClb'ye karşı Clb için %92 ile %58, GClb'ye karşı RClb için ise %72 ile %29 arasındadır.
Risk altındaki hasta sayısı
Zaman (ay)
Şekil 1. KLL'li hastalarda araştırmacı tarafından değerlendirilen Evre 1a progresyonsuz sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Şekil 2. KLL'li hastalarda Evre 1a'ya ait genel sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Zaman (ay)
Risk altındaki hasta sayısı
Risk altındaki hasta sayısı
Şekil 3. KLL'li hastalarda araştırmacı tarafından değerlendirilen Evre 2 progresyonsuz sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Şekil 4. KLL'li hastalarda Evre 1a'ya ait genel sağkalımın Kaplan-Meier eğrisi (BO21004/CLL11 çalışması)
Risk altındaki hasta sayısı
Zaman (ay)
Yaşam kalitesi
Tedavi dönemi sırasında yapılan QLQC30 ve QLQ-CLL-16 anketlerinde, alt ölçeklerden herhangi birinde anlamlı bir farklılık gözlenmemiştir. Takip sırasında veriler, özellikle tek başına klorambusil kolu için sınırlıdır. Bununla birlikte, bugüne kadar takip sırasında yaşam kalitesi açısından belirgin bir farklılık saptanmamıştır.
Sağlıkla ilişkili yaşam kalitesi değerlendirmeleri, tedavi dönemi boyunca özellikle yorgunluk açısından istatistiksel olarak anlamlı bir fark göstermemektedir; bu durum klorambusil rejimine GAZYVA eklenmesinin hastalarda yorgunluğu arttırmadığını öne sürmektedir.
- Foliküler Lenfoma
Daha önce tedavi edilmemiş foliküler lenfoma (BO21223/GALLIUM):
Faz III, açık etiketli, çok merkezli, randomize bir klinik çalışmada (BO21223/GALLIUM), daha önce tedavi görmemiş Derece 1-3a ilerlemiş (evre II bulky hastalık, evre III/IV) FL olan 1202 hasta değerlendirilmiştir. FL Derece 3b olan hastalar çalışma dışı bırakılmıştır. Hastalar, kemoterapi (bendamustin, CHOP veya CVP) ile kombinasyon halinde GAZYVA (n=601 hasta) veya rituximab (n=601 hasta) ve ardından tam veya kısmi yanıt elde edilen hastalarda GAZYVA veya rituksimab idamesi almak üzere 1:1 olacak şekilde randomize edilmiştir.
GAZYVA, 1. Döngünün ve takip eden döngülerin 1., 8. ve 15. günlerinde 1.000 mg'lık doz olarak intravenöz infüzyon yoluyla verilmiştir. Toplamda, altı döngü GAZYVA (her 28 günde bir), altı döngü bendamustin ile kombinasyon halinde ve altı döngü CHOP veya sekiz döngü CVP ile birlikte toplam sekiz döngü GAZYVA (her 21 günde bir) verilmiştir. GAZYVA kemoterapiden önce uygulanmıştır. Bendamustin, GAZYVA ile kombinasyon halinde verildiğinde 90 mg/m/gün'de tüm tedavi döngüleri için (Döngü1-6) 1. ve 2. Günlerde intravenöz olarak verilmiştir. Standart CHOP ve CVP dozu verilmiştir. Döngü6-8'i takiben, kemoterapi ile kombinasyon halinde, yanıt veren hastalar, hastalık progresyonuna kadar veya 2 yıla kadar her 2 ayda bir GAZYVA idame tedavisi almıştır.
Hasta popülasyonunun demografik verileri ve temel özellikleri, tedavi kolları arasında iyi dengelenmiştir; medyan yaş 59, %81 beyaz, %53 kadın, %79 FLIPI skoru ≥2 ve %7 Evre II (bulky), %35 Evre III ve %57 Evre IV hastalık, %44 bulky hastalığı (>7 cm), %34'ünün başlangıçta en az bir B semptomu vardı ve %97'sinin başlangıçta ECOG performans durumu 0-1 idi. Hastaların %57'si bendamustin, %33'ü CHOP ve %10'u CVP kemoterapisi almıştır.
Önceden tedavi edilmemiş FL hastalarına yönelik etkinlik sonuçları Tablo 10'da özetlenmiştir. Progresyonsuz sağkalım (PFS) için Kaplan-Meier eğrileri Şekil 5'te gösterilmiştir.
Tablo 10: BO21223/GALLIUM çalışmasından daha önce tedavi edilmemiş FL hastalarına ait etkililiğin özeti
| Rituximab idame | Gazyva idame tedavisinin |
tedavisinin takip ettiği | takip ettiği | |
Rituximab + Kemoterapi | Gazyva + Kemoterapi | |
N=601 | N=601 | |
| Medyan gözlem süresi: 34 ay | Medyan gözlem süresi: 35 ay |
Birincil sonlanım noktası |
| |
IRC tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 144 (24%) | 101 (16.8%) |
HR (%95 GA) | 0.66 [0.51, 0.85] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.0012 |
3 yıllık PFS tahmini | 73.3 | 80 |
[%95 GA] | [68.8, 77.2] | [75.9, 83.6] |
Kilit sonlanım noktası |
| |
IRC tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 125 (20.8%) | 93 (15.5%) |
HR (%95 GA) | 0.71 [0.54, 0.93] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.0138 |
Bir sonraki anti-lenfoma tedavisine kadar geçen süre |
| |
Olayla karşılaşan hasta sayısı (%) | 111 (18.5%) | 80 (13.3%) |
HR (%95 GA) | 0.68 [0.51, 0.91] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.0094 |
Genel sağkalım |
| |
Olayla karşılaşan hasta sayısı (%) | 46 (7.7%) | 35 (5.8%) |
HR (%95 GA) | 0.75 [0.49, 1.17] | |
p-değeri (Log-Rank tabakalandırılmış*) | testi, |
0.21 |
İndüksiyon Sonundaki Genel Yanıt Oranı** IR tarafından değerlemdirilen, CT) |
| |
Yanıt verenler (%) (TY, KY) | 522 (86.9%) | 532 (88.5%) |
Yanıt oranındaki fark (%) [%95 GA] |
1.7% [-2.1%, 5.5%] | |
p değeri Haenszel testi) | (Cochran-Mantel- |
0.33 |
Tam Yanıt (TY) | 143 (23.8%) | 117 (19.5%) |
Kısmi Yanıt (KY) | 379 (63.1%) | 415 (69.1%) |
IRC: Bağımsız İnceleme Komitesi; PFS: progresyonsuz sağkalım; HR: Tehlike Oranı; GA: Güven Aralığı
* Tabakalandırma faktörleri kemoterapi rejimi, foliküler lenfoma için FLIPI risk grubu, coğrafi bölge idi.
§ Bu etkinlik ara analizindeki önem düzeyi: 0.012
¶ Veriler Henüz Olgun Değil. Analiz sırasında medyana ulaşılamadı
# çokluk için ayarlanmadı
**Değiştirilmiş Cheson 2007 kriterlerine göre değerlendirilmiştir
â¡ İndüksiyonun Sonu = indüksiyon fazının sonu, monoterapi idamesini içermez
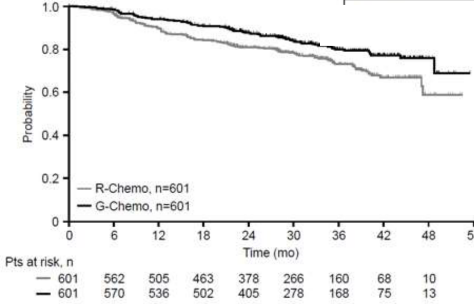
HR, 0.66; %95 GA, 0.51
0.85; p=0.0012
Şekil 5 Daha önce tedavi edilmemiş FL hastalarında IRC tarafından değerlendirilen progresyonsuz sağkalım Kaplan-Meier eğrisi (Çalışma BO21223/GALLIUM)
Alt grup analizlerinin sonuçları
Alt grup analizlerinin sonuçları (çokluk için ayarlanmamış) genel olarak FL popülasyonunda görülen sonuçlarla tutarlıdır ve genel sonucun sağlamlığını desteklemektedir. Değerlendirilen alt gruplar, başlangıçta IPI, FLIPI, Bulky Hastalığı, B Semptomları, Ann Arbor Aşaması ve başlangıçta ECOG'u içermekteydi. FLIPI skoru 0-1 (düşük risk) olan hastalarda, GAZYVA + kemoterapi ve rituximab + kemoterapi arasında fark gözlenmemektedir (IRC-değerli PFS HR
1.17 (%95CI 0.63;2.19, 40 PFS olayı). Bu alt grup %21'den (253/1202) oluşmaktadır ve PFS olaylarının %16.3'ünü (40/245) yaşamıştır. Ek olarak, kemoterapi rejimleri (bendamustin, CHOP ve CVP) genelinde PFS'nin keşif amaçlı alt grup analizleri, GAZYVA artı kemoterapi popülasyonunda görülen sonuçlarla tutarlıydı. Kemoterapi alt grubuna göre gözlemlenen HR'ler aşağıdaki gibidir; CHOP (n = 398): HR 0,77 (%95 GA: 0,50, 1,20), CVP (n = 118):
HR 0,63 (%95 GA: 0,32, 1,21) ve bendamustin (n = 686): HR 0,61 (95) %CI: 0.43, 0.86).
Hasta Bildirimli Sonlanımlar
Tedavi ve takip aşamaları sırasında toplanan FACT-Lym anketine dayanarak, her iki tedavi kolundaki hastalar, Lenfoma alt ölçeğinde başlangıca göre ï³ 3 puanlık bir artış, ï³ 6 puanlık bir artış ile tanımlanan lenfoma ile ilgili semptomlarda klinik olarak anlamlı iyileşmeler yaşanmıştır. FACT Lym TOI'deki başlangıca göre ve FACT Lym Total skorunda başlangıca göre ï³ 7 puanlık bir artış. EQ-5D fayda puanları başlangıçta, tedavi ve takip sırasında benzerdi. HRQOL veya sağlık durumu ölçümlerinde kollar arasında anlamlı bir fark görülmemiştir.
Açık etiket tasarımı nedeniyle, hasta tarafından bildirilen sonuçlar dikkatle yorumlanmalıdır.
Rituximab veya rituximab içeren tedavi rejimi alan foliküler lenfoma hastalarında tedavi sırasında veya 6 ay sonrasına kadar yanıtsızlık veya nüks gelişmesi durumunda (GAO4753g/GADOLIN):
Faz III, açık etiketli, çok merkezli, randomize bir klinik çalışmada (GAO4753g (GADOLIN)), tedavi sırasında yanıt vermeyen veya (indüksiyon veya idame tedavisinin bir parçası olarak rituximab monoterapisi de dahil olmak üzere) son rituximab ya da rituximab içeren bir rejimin son dozunu takiben hastalığı ilerleyen 396 iNHL hastası değerlendirilmiştir. Hastalar, her biri 28 gün süreli 6 döngü şeklinde tek başına bendamustin (B) (n = 202) veya bendamustin ile kombinasyon olarak GAZYVA (G+B) (n = 194= almak üzere 1:1 randomize edilmiştir. Hastalığı ilerlemeyen G+B kolundaki hastalar (yani, indüksiyon bitiminde tam yanıt (CR), kısmi yanıt (PR) veren veya hastalığı stabil seyreden (SD)) hastalar, iki yıl süreyle her iki ayda bir veya (hangisi daha önce ise) hastalık progresyonuna kadar GAZYVA ile idame tedavisi almaya devam etmiştir. Hastalar, bölge, iNHL alttipi (foliküler versus non-foliküler), rituximab-refrakter tip (rituximab monoterapisinden veya kemoterapiyle kombinasyon şeklinde rituximab tedavisinden önce olmak üzere) ve önceki tedavilerin sayısı (≤2'ye karşı
>2) doğrultusunda tabakalandırılmıştır.
Demografik veriler ve başlangıç karakteristikleri iyi dengelenmiştir (medyan yaş 63 yıldır; çoğunluk beyaz ırka mensuptur [%88] ve erkektir [%58]). Hastaların çoğunluğunda foliküler lenfoma (%81) vardır. İlk tanıdan bu yana geçen medyan süre 3 yıldır ve önceki tedavilerin medyan sayısı 2'dir (aralık: 1 ila 10); hastaların %44'ü daha önce 1 kez, %34'ü ise 2 tedavi almıştır.
GAZYVA, Döngü1'in 1, 8 ve 15. ve Döngü2-6'nın 1. Gününde ve hastalık progresyonu meydana gelmeyen hastalara, iki yıl süreyle her iki ayda bir (ya da hangisi daha önce ise) hastalık progresyonuna kadar 1.000 mg kesin dozda intravenöz infüzyon olarak verilmiştir. Bendamustin, tüm tedavi döngülerinin (Döngü1-6) 1 ve 2. Günlerinde, GAZYVA ile kombinasyon şeklinde 90 mg/m/gün, tek başına verildiğinde ise 120 mg/m/gün olarak intravenöz yolla verilmiştir. B kolundaki hastaların %66,7'sine karşılık G+ B ile tedavi edilen hastaların %79,4'ü altı tedavi döngüsünün tamamını almıştır.
Bağımsız İnceleme Komitesine (IRC) dayalı primer analiz değerlendirmesi, tek başına bendamustin alan hastalarla karşılaştırıldığında G+B ve onu takiben GAZYVA idame tedavisi alan iNHL hastalarında hastalık progresyon (PD) veya ölüm riskinde, %45 oranında istatistiksel olarak önemli ve klinik olarak anlamlı bir azalmayı göstermiştir. iNHL popülasyonunda görülen hastalık progresyonu veya ölüm riskindeki azalma foliküler lenfoma hastalarının alt grubundan etkilenmiştir.
GAO4753g çalışmasında yer alan hastaların çoğunluğunda (%81,1) FL mevcuttur. FL popülasyonundaki primer analiz etkililik sonuçları Tablo 11 ve Şekil 6 ve 8'de gösterilmektedir. Hastaların %11,6'sında marjinal zon lenfoma (MZL) ve %7,1'inde küçük lenfositik lenfoma (SLL) mevcuttu. FL olmayan popülasyonda IRC ile değerlendirilen PFS için HR 0,94 (% 95 GA: 0,49, 1,90)' dür. MZL ve SLL alt popülasyonlarındaki etkililiği konusunda kesin bir sonuç çıkarılamamıştır.
Final analizde, B kolundaki FL hastaları için ortalama gözlem süresi 45,9 ay (aralık: 0-100,9 ay) ve G + B kolundaki hastalar için 57,3 ay (aralık: 0,4-97,6 ay) idi, bu da birincil analizden bu yana sırasıyla B ve G + B kollarında ek 25,6 ay ve 35,2 ay ortalama takibi temsil etmektedir. IRC değerlendirmeleri devam etmediği için nihai analizde sadece Araştırmacı (IRC) tarafından değerlendirilen sonlanım noktaları rapor edilmiştir. Genel olarak, araştırmacı tarafından değerlendirilen etkililik sonuçları, birincil analizde gözlemlenenlerle tutarlıdır.
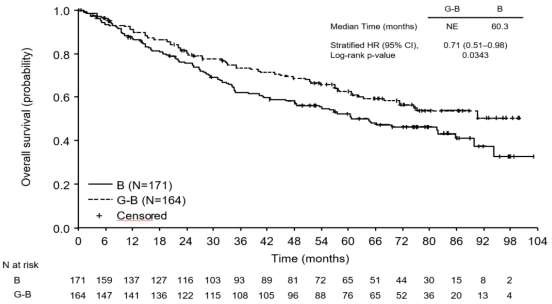
FL'li hastalarda genel sağkalım (OS) daha uzun takip doğrultusunda istikrarlıdır (bkz. Şekil 7); ölüm riski için HR 0,71 (% 95 GA: 0,51, 0,98)'dir.
Tablo 11: GAO4753g/GADOLIN çalışmasından FL hastalarına ait primer etkililik analizi özeti
| Bendamustin N=166 | Gazyva idame tedavisinin takip ettiği Gazyva + Bendamustin N= 155 |
| Medyan gözlem süresi: 20 ay | Medyan gözlem süresi: 22 ay |
FL popülasyonundaki birincil sonlanım noktası |
| |
IRC tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 90 (54,2%) | 54 (34,8%) |
Medyan PFS süresi (ay) (%95 GA) | 13,8 (11,4, 16,2) | NR (22,5,-) |
HR (%95 GA) | 0,48 (0,34, 0,68) | |
p-değeri (Log-Rank testi, tabakalandırılmış*) | <0,0001 | |
İkincil Sonlanım Noktaları |
| |
Araştırmacı tarafından değerlendirilen PFS (PFS-IRC) |
| |
Olayla karşılaşan hasta sayısı (%) | 102 (61,4%) | 62 (40,0%) |
Medyan PFS süresi (ay) (%95 GA) | 13,7 (11,0, 15,5) | 29,2 (17,5,-) |
HR (%95 GA) | 0,48 (0,35, 0,67) | |
p-değeri (Log-Rank testi, tabakalandırılmış*) | <0,0001 | |
En İyi Genel Yanıt (BOR) (IRC-tarafından değerlendirilen) |
| |
Analize dahil edilen hasta sayısı | 161 | 153 |
Yanıt verenler (%) (CR/PR) | 124 (77,0%) | 122 (79,7%) |
Yanıt oranı farkı (%95 GA) | 2,72 (-6,74, 12,18) | |
p-değeri (Cochran-Mantel-Haenszel test,) | 0,6142 | |
Tam Yanıt Verenler (%) | 31 (19,3%) | 24 (15,7%) |
Kısmi Yanıt Verenler (%) | 93 (57,8%) | 98 (64,1%) |
Stabil Hastalık (%) | 18 (11,2%) | 13 (8,5%) |
Yanıt süresi (IRC tarafından değerlendirilen) |
| |
Analize dahil edilen hasta sayısı | 127 | 122 |
Olaylı hasta sayısı (%) | 74 (58,3%) | 36 (29,5%) |
Medyan DOR süresi (ay) (%95 GA) | 11,9 (8,8, 13,6) | NR (25,4,-) |
HR (%95 GA) | 0,36 (0,24, 0,54) | |
Genel sağkalım (henüz olgunlaşmamış) |
| |
Olaylı hasta sayısı (%) | 36 (21,7%) | 25 (16.1%) |
Olaya kadar geçen medyan süre (ay) | NR | NR |
HR (%95 GA) | 0,71 (0,43, 1,19) | |
p-değeri (Log-Rank testi, tabakalandırılmış*) | 0,1976 | |
IRC: Bağımsız İnceleme Komitesi; PFS: progresyonsuz sağkalım; HR: Hazard Oranı; GA: Güven Aralığı, NR
= Ulaşılamadı
*Analize yönelik tabakalandırma faktörleri refrakter tip (rituximab monoterapisi vs. rituximab + kemoterapi) ve önceki tedaviler idi (≤ 2 vs ≥2). Foliküler versus non-foliküler de çalışmaya yönelik bit tabakalandırma faktörü olmasına karşın, foliküler lenfoma hastalarının altgrup analizi için geçerli değildir.
§ Tedavi başlangıcından itibaren 12 ay içerisindeki en iyi yanıt
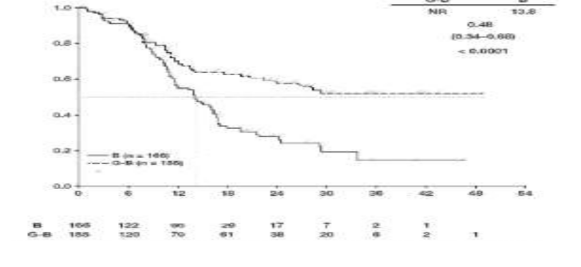
95% GA
Şekil 6: Foliküler lenfoma hastalarında IRC ile değerlendirilen progresyonsuz sağkalıma ait Kaplan-Meier eğrisi (GAO4753g/GADOLIN çalışması)
Şekil 7: Foliküler lenfoma hastalarında genel sağkalıma ait final analizinin Kaplan- Meier eğrisi (GAO4753g/GADOLIN çalışması)
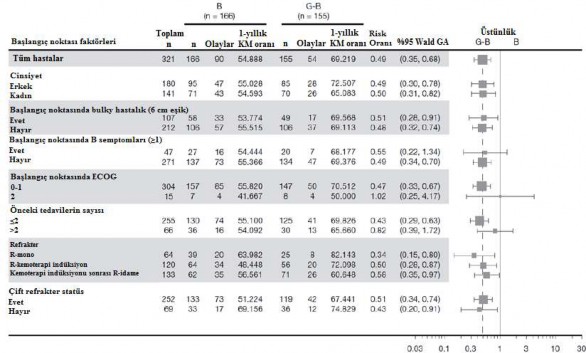
Alt grup analizlerinin sonuçları
Altgrup analizlerinin sonuçları genel olarak FL popülasyonunda görülen sonuçlarla uyumludur ve genel sonucun sağlamlığını desteklemektedir.
Şekil 8: Foliküler lenfomada hasta altgrubuna göre IRC tarafından değerlendirilen PFS* (GAO4753g/GADOLIN çalışması)
Kısa Süreli İnfüzyon Çalışması MO40597 (GAZELLE)
CHOP, CVP veya bendamustin kemoterapisi ile kombinasyon halinde uygulanan obinutuzumab'ın kısa (yaklaşık 90 dakika) süreli infüzyonunun (SDI) güvenliği, daha önce tedavi edilmemiş ilerlemiş foliküler lenfoması olan 113 hastada çok merkezli, açık etiketli, tek kollu bir çalışmada değerlendirilmiştir (Çalışma MO40597/GAZELLE).
Hastalar, ilk obinutuzumab kürünü, Döngü 1'in 1, 8 ve 15'inci günlerinde standart infüzyon hızında almıştır. İlk döngü sırasında herhangi bir Derece ≥3 IRR yaşamayan hastalar, Döngü 2'den itibaren SDI almıştır.
Çalışmanın birincil sonlanım noktası, 2. Döngü sırasında SDI ile ilişkili Derece ≥3 IRR yaşayan ve Derece ≥3 IRR yaşamadan 1. Döngü sırasında standart infüzyon hızında daha önce 3 obinutuzumab uygulaması almış olan hastaların oranıdır.
2. Döngüde SDI alan hastalar arasında Derece ≥3 IRR gözlenmemiştir. 2. Döngüden sonra sadece bir hastada 3. Aşama IRR yaşanmıştır (5. Döngüde hipertansiyon) (bkz. Bölüm 4.8 İstenmeyen Etkiler).
Hasta Bildirimli Sonlanımlar
Tedavi sırasında ve takip dönemlerinde yapılan FACT-Lym anketi ve EQ-5D indeks ölçeğine göre, sağlıkla ilgili yaşam kalitesi pivot çalışma sırasında genel olarak sürdürülmüş olup, kollar arasında anlamlı fark bulunmamıştır. Bununla birlikte, FL hastalarında bendamustine GAZYVA eklenmesi, xFACT-Lym TOI skoru ile ölçülen sağlıkla ilgili yaşam kalitesinde düşüşe kadar geçen süreyi 2,2 ay uzatmıştır (benda ve G+B için sırasıyla medyan 5,6'ya karşı 7,8 ay HR= 0,83; %95 GA: 0,60, 1,13).
İmmünojenisite
İmmünojenisite tayin bulguları; tayin duyarlılığı ve özgüllüğü, tayin metodolojisi, tayinin dolaşımdaki GAZYVA/antikor miktarları açısından gücü, numunelerin kullanımı, numune toplama zamanı, eş zamanlı ilaçlar ve altta yatan hastalıklar dahil birçok faktöre yüksek düzeyde bağımlıdır. Bu nedenlerle, GAZYVA'ya karşı antikorların insidansının diğer ürünlere karşı antikorların insidansıyla karşılaştırılması yanıltıcı olabilir.
BO21004/CLL11 pivot çalışmasında yer alan hastalar, GAZYVA'ya yönelik anti-terapötik antikorlar (ATA) için birden fazla zaman noktasında test edilmiştir. GAZYVA ile tedavi edilen hastalar arasından randomize fazdaki 140 hastadan 8'i ile başlangıç fazındaki 6 hastadan 2'sinin 12 aylık takip sırasındaki ATA testleri pozitif olarak sonuçlanmıştır. Bu hastalardan hiçbiri, ATA ile ilişkili olduğu düşünülen anafilaktik veya aşırı duyarlılık reaksiyonlarıyla karşılaşmadığı gibi, klinik yanıt da etkilenmemiştir.
GAO4753g/GADOLIN çalışmasında tedavi gören iNHL hastalarında başlangıç referansı sonrasında HAHA (İnsan Anti-İnsan Antikoru) gözlenmemiştir. HAHA'nın klinik anlamlılığı bilinmiyor olmasına rağmen HAHA ve klinik süreç arasındaki potansiyel bağlantı gözardı edilmemelidir.
Pediyatrik popülasyon
Pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2.
5.2. Farmakokinetik özellikler
Genel Özellikler
Faz I, Faz II ve Faz III çalışmalarda obinutuzumabı tek başına ya da kemoterapiyle kombinasyon halinde alan 469 iNHL, 342 KLL ve 130 DBBHL (Diffüz Büyük B Hücreli Lenfoma) hastasında farmakokinetik verileri analiz etmek için bir popülasyon farmakokinetik (PK) modeli geliştirilmiştir.
Emilim:
Obinutuzumab intravenöz uygulanır, bu nedenle emilim geçerli değildir. Diğer uygulama şekilleriyle çalışma yapılmamıştır. Popülasyon PK modeline göre; Döngü6, 1. gün infüzyonunun ardından KLL hastalarında tahmini medyan C değeri 465,7 mcg/mL ve EAA(Ï) değeri 8961 mcg.gün/mL, iNHL hastalarında tahmini medyan Cdeğeri 539,3 mcg/mL ve EAA(Ï) değeri 10956 mcg.gün/mL olmuştur.
Dağılım:
İntravenöz uygulama ardından santral kompartımanın dağılım hacmi (KLL hastalarında 2,98 L, iNHL hastalarında 2,97 L) serum hacmine yaklaşır ve bu da, dağılımın büyük oranda plazma ve interstisiyel sıvı ile sınırlı olduğunu göstermektedir.
Biyotransformasyon:
Obinutuzumabın metabolizması doğrudan incelenmemiştir. Antikorlar büyük oranda katabolizmayla temizlenmektedir.
Eliminasyon:
Obinutuzumab klerensi, KLL hastalarında yaklaşık 0,11 L/gün ve iNHL hastalarında yaklaşık 0,08 L/gün olup, medyan eliminasyon tdeğeri KLL hastalarında 26,4 gün ve iNHL hastalarında 36,8 gün olmuştur. Obinutuzumab eliminasyonu, biri doğrusal klerens yolağı ve biri zamanın fonksiyonu olarak değişen doğrusal olmayan klerens yolağı şeklinde klerensi tanımlayan iki paralel yolak içerir. Tedavi başlangıcında doğrusal olmayan zamanla değişen klerens yolağı baskındır ve bu nedenle majör klerens yolağını oluşturur. Tedavi devam ettikçe, bu yolağın etkisi azalır ve doğrusal klerens yolağı belirginleşir. Bu durum hedef aracılı ilaç dağılımını (TMDD) gösterir; CD20 hücrelerinin başlangıçta bol miktarda bulunması obinutuzumabın dolaşımdan hızla çıkarılmasına neden olur. Bununla birlikte, CD20 hücrelerin büyük bölümü obinutuzumaba bağlandığında hedef aracılı ilaç dağılımının farmakokinetik üzerindeki etkisi en aza indirgenir.
Farmakokinetik/farmakodinamik ilişki(ler)
Popülasyon farmakokinetik analizinde, cinsiyetin hastalar arasındaki değişkenliğin bir kısmını açıklayan bir kovaryat olduğu belirlenmiş, erkeklerde kararlı durum klerensi (CLss) %22 daha yüksek ve dağılım hacmi (Vd) %19 daha fazla bulunmuştur. Bununla birlikte, popülasyon analizinin bulguları maruziyetteki farklılıkların anlamlı olmadığını ortaya koymuş (6. Döngüde KLL hastalarında tahmini medyan EAA ve C sırasıyla, kadınlarda 11282 mcg.gün/mL ve 578,9 mcg/mL ve erkeklerde 8451 mcg.gün/mL ve 432,5 mcg/mL'dir; iNHL hastalarında ise tahmini medyan EAA ve C sırasıyla, kadınlarda 13172 mcg.gün/mL ve 635,7 mcg/mL ve erkeklerde 9769 mcg.gün/mL ve 481,3 mcg/mL'dir), ve bu durum cinsiyet temelinde doz ayarlamasının gerekli olmadığını göstermiştir.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon
Obinutuzumabın popülasyon farmakokinetik analizi, yaşın obinutuzumab farmakokinetiğini etkilemediğini göstermiştir. <65 yaşındaki (n=375), 65-75 yaşlarındaki (n=265) ve >75 yaşındaki (n=171) hastalar arasında obinutuzumabın farmakokinetik özelliklerinde anlamlı farklılık gözlenmemiştir.
Pediyatrik popülasyon
Pediyatrik hastalarda obinutuzumabın farmakokinetiğini inceleyen çalışmalar yapılmamıştır. Böbrek yetmezliği
Obinutuzumabın popülasyon farmakokinetik analizi, kreatinin klerensinin obinutuzumab farmakokinetiğini etkilemediğini göstermiştir.
Hafif (kreatinin klerensi KrKl 50-89 mL/dakika, n=464) veya orta düzeyde (KrKl 30-49 mL/dakika, n=106) böbrek bozukluğu olan hastalarda obinutuzumabın farmakokinetik özellikleri, böbrek fonksiyonu normal (KrKl ≥90 mL/dakika, n=383) hastalardakine benzer bulunmuştur. Şiddetli böbrek bozukluğu olan (KrKl 15-29 mL/dakika) hastalarda farmakokinetik veriler sınırlıdır (n=8), bu nedenle doz önerisi yapılamamaktadır.
Karaciğer yetmezliği
Karaciğer bozukluğu olan hastalarda formal farmakokinetik çalışma yapılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Obinutuzumabın karsinojenik potansiyelini belirlemek üzere çalışma yapılmamıştır.
Obinutuzumabın fertilite üzerindeki etkisini değerlendirmek için hayvanlarda spesifik çalışmalar yapılmamıştır. Sinomolgus maymunlarda yapılan tekrarlı doz toksisitesi çalışmalarında obinutuzumab erkek ve dişi üreme organları üzerinde advers etki göstermemiştir.
Gebe sinomolgus maymunlarda geliştirilmiş pre ve postnatal gelişim (ePPND) toksisitesi çalışmasında teratojenik etkilere dair kanıt bulunmamıştır. Bununla birlikte, çiftleşme sonrası
20. günden doğuma kadar 25 ve 50 mg/kg dozlarda (C ve EAA temelinde klinik maruziyetin 2-5 katı) uygulanan haftalık intravenöz obinutuzumab dozları, bebek maymunlarda tam B hücre deplesyonuna yol açmıştır. Doğumdan sonra 28. günde yavruların ilaca maruziyeti, obinutuzumabın kan plasenta bariyerini geçebildiğini göstermektedir. Doğum sonrası 28. günde yavru serumundaki konsantrasyonlar, maternal serumdaki konsantrasyon aralığında olurken, aynı günde sütteki konsantrasyonlar daha düşük bulunmuştur (karşılık gelen maternal serum düzeylerinin %0,5'inden daha düşük); bu durum yavrularda ilaca maruziyetin rahim içinde oluştuğunu göstermektedir. Doğumdan sonra 6 ay içinde B hücre sayıları normal düzeylere dönmüş ve immünolojik fonksiyon geri kazanılmıştır.
Sinomolgus maymunlarda yapılan, haftalık 5, 25 ve 50 mg/kg dozlarda obinutuzumabın (kararlı durumda Cve EAA'ya dayalı olarak klinik maruziyetin 0,7-6 katı) uygulandığı 26 haftalık bir çalışmada, aşırı duyarlılık reaksiyonları kaydedilmiştir ve bu reaksiyonlar sinomolgus maymunlarda hümanize antikorun yabancı kabul edilmesine bağlanmıştır. Bulgular, akut anafilaktik ve anafilaktoid reaksiyonları ve arterit/periarterit, glomerülonefrit ve serozal/adventisiyal inflamasyon gibi immün kompleks aracılı aşırı duyarlılık reaksiyonları ile tutarlı şekilde sistemik inflamasyonun ve infiltratların prevalansında bir artışı içermektedir. Bu reaksiyonlar, doz uygulama ve iyileşme fazları sırasında obinutuzumab ile tedavi edilen 36 hayvanın 6'sında tedavinin planlı olmaksızın sonlandırılmasına yol açmıştır; bu değişimler kısmen geri döndürülebilir olmuştur. İnsanlarda obinutuzumab ile nedensel ilişkili renal toksisite gözlenmemiştir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | A17126 |
| Satış Fiyatı | 58299.93 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 58299.93 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505762630 |
| Etkin Madde | Obinutuzumab |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |