GIOTRIF 30 mg 28 film kaplı tablet Farmakolojik Özellikler
{ Afatinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
ATC kodu : L01EB03
Farmakoterapötik grup : Antineoplastik ajanlar, protein kinaz inhibitörleri
Etki mekanizması:
Afatinib, potent ve selektif bir geri dönüşümsüz Erb B Ailesi blokörüdür. Afatinib, kovalent olarak bağlanır ve ErbB ailesi üyeleri olan EGFR (Erb B1), HER2 (ErbB2), ErbB3 ve ErbB4 tarafından oluşturulan tüm homodimer ve heterodimerlerin sinyallerini geri dönüşümsüz şekilde bloke eder.
Farmakodinamik etkiler:
Reseptör mutasyonları tarafından tetiklenen aberant ErbB sinyali ve/veya amplifikasyonu ve/veya reseptör ligand overekspresyonu, malignant fenotipe katkıda bulunur. EGFR'de mutasyon, akciğer kanserinin farklı bir moleküler alt tipini tanımlar.
ErbB yolağının deregülasyonu ile oluşturulan klinik dışı hastalık modellerinde afatinib, tek ajan olarak, ErbB reseptör sinyallerini etkili olarak bloke ederek tümör büyümesinin inhibisyonunu veya tümörün regresyonunu sağlar. Sık görülen aktive edici EGFR mutasyonları (Del 19, L858R) ve daha az görülen ekson 18'de (G719X) ve ekson 21'deki (L861Q) bazı EGFR mutasyonları ile seyreden KHDAK tümörlerinin afatinibe özellikle
duyarlı olduğu, klinik dışı ve klinik çalışmalarda gösterilmiştir. Ekson 20'de mutasyon eklenmesi ile seyreden KHDAK tümörlerinde sınırlı klinik dışı ve/veya klinik aktivite gözlenmiştir.
Sekonder T790M mutasyonunun edinilmesi, afatinibe karşı kazanılmış direncin majör mekanizmasıdır ve T790M içeren allellerin gen dozları, in vitro direncin derecesi ile koreledir. Afatinib ile progresyon gösteren hastaların tümörlerinin yaklaşık %50'sinde T790M mutasyonu bulunmuştur. Bu durumda T790M hedefli EGFR TKI'ler bir sonraki tedavi seçeneği olarak düşünülebilir. Afatinibe karşı diğer potansiyel direnç mekanizmaları klinik öncesinde düşünülmüş ve MET geni amplifikasyonları klinik olarak gözlenmiştir.
Klinik etkililik ve güvenlilik
EGFR mutasyonları olan küçük hücreli dışı akciğer kanseri hastalarında GIOTRIF LUX-Lung 3
İlk seçenek tedavilerde, EGFR mutasyonları pozitif olan lokal olarak ileri evre veya metastatik KHDAK (evre IIIB veya IV) hastalarında GIOTRIF'in etkililiği ve güvenliliği global, randomize, çok merkezli, açık bir çalışmada değerlendirilmiştir. Hastalar, polimeraz zincir
reaksiyonuna (PCR) dayanan bir metot kullanılarak (TheraScreen : EGFR29 Mutation Kit,
Qiagen Manchester Ltd) 29 farklı EGFR mutasyonu açısından taranmıştır. Hastalar, günde bir kez 40 mg GIOTRIF veya 6 küre kadar pemetrexed/sisplatin almak üzere randomize edilmiştir (2:1). Randomize edilen hastaların %65'i kadındır, medyan yaş 61 yıldır ve referans ECOG performans durumu 0 (%39) veya 1 (%61) olmuştur. Hastaların %26'sı beyaz ve %72'si asyalıdır. Hastaların %89'nda sık görülen EGFR mutasyonları mevcuttur (Del 19 veya L858R).
Primer sonlanım noktası, bağımsız bir gözden geçirme ile tespit edilen progresyonsuz sağkalım süresidir (PFS). İkincil sonlanım noktaları arasında, genel sağkalım süresi ve objektif yanıt oranı bulunmaktadır. Analiz zamanında (14 Kasım 2013), afatinib kolundaki 176 hasta (%76,5) ve kemoterapi kolundaki 70 hasta (%60.9), PFS analizine katkıda bulunan bir olay yani, bağımsız merkezi bir gözden geçirme ile tespit edilen hastalık progresyonu veya ölüm yaşamıştır. Etkililik sonuçları, Şekil 1 ve Tablo 6 ve 7'de sunulmuştur.
LUX-Lung 6
Evre IIIB veya IV EGFR mutasyonları pozitif, lokal olarak ileri veya metastatik akciğer adenokarsinoması olan Asyalı hastalarda GIOTRIF'in etkililiği ve güvenliliği, randomize, çok merkezli, açık bir çalışmada değerlendirilmiştir. LUX-Lung 3'e benzer şekilde, daha önce
tedavi edilmemiş KHDAK hastaları, TheraScreen : EGFR29 Mutation Kit (Qiagen
Manchester Ltd) kullanılarak EGFR mutasyonları açısından taranmıştır. Randomize edilen hastalardan %65'i kadındır, medyan yaş 58 yıldır ve tüm hastalar Asya ırkına mensuptur. Yaygın görülen EGFR mutasyonu olan hastalar çalışma popülasyonunun %89'na karşılık gelmektedir.
Primer sonlanım noktası, bağımsız merkezi bir gözden geçirme ile tespit edilen progresyonsuz sağkalım süresidir, ikincil sonlanım noktaları arasında ise, genel sağkalım (OS) ve objektif yanıt oranı (ORR) bulunur.
Her iki çalışma da, kemoterapi ile karşılaştırıldığında GIOTRIF ile tedavi edilen EGFR mutasyonları pozitif hastalarda, progresyonsuz sağkalım süresinde anlamlı iyileşmeler göstermiştir. Etkililik sonuçları Şekil 1 (LUX-Lung 3) ve Tablo 6 ve 7'de (LUX-Lung 3 ve 6)
özetlenmiştir. Tablo 7, yaygın görülen iki EGFR mutasyonu (Del19 ve L858R) olan hasta alt gruplarındaki sonlanımları göstermektedir.
Şekil 1: LUX-Lung 3 çalışmasında tedavi grubuna göre bağımsız olarak gözden geçirilen âprogresyonsuz sağkalım süresiâ (PFS)â yönünden Kaplan-Meier eğrisi (Genel popülasyon)
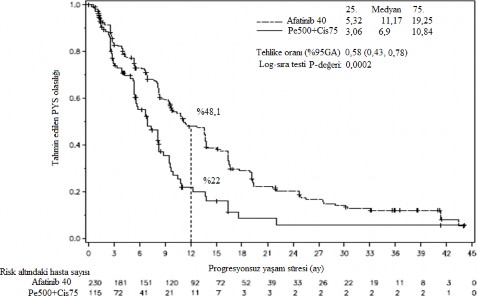
Tablo 6: GIOTRIF'e karşılık pemetreksed/sisplatin (LUX-Lung 3) ve GIOTRIF'e karşılık gemsitabin/sisplatin (LUX-Lung 6) etkililik sonuçları (Bağımsız gözden geçirme)
| LUX-Lung 3 | LUX-Lung 6 | ||
| GIOTRIF
(N=230) | Pemetreksed/ Sisplatin (N=115) | GIOTRIF
(N=242) | Gemsitabin/Sisplatin
(N=122) |
Progresyonsuz sağkalım Ay (medyan) | 11, 2 | 6,9 | 11 | 5,6 |
Tehlike oranı (HR) (%95 GA) | 0,58 (0,43-0,78) | 0,28 (0,2-0,39) | ||
p-değeri | 0,0002 | ï¼0,0001 | ||
1 yıllık PFS oranı | %48,1 | %22 | %46,7 | %2,1 |
Objektif yanıt oranı (CR+PR) | %56,5 | %22,6 | %67,8 | %23 |
Odds Oranı (OR) (%95 GA) | 4,8 (2,89-8,08) | 7,57 (4,52-12,68) | ||
p-değeri | ï¼0,0001 | ï¼0,0001 | ||
Genel sağkalım (OS) Ay (medyan) | 28,2 | 28,2 | 23,1 | 23,5 |
Tehlike oranı (HR) (%95 GA) | 0,88 (0,66-1,17) | 0,93 (0,72-1,22) | ||
p-değeri | 0,385 | 0,6137 | ||
![]()
Tablo 7: Önceden tanımlanmış EGFR mutasyon alt gruplarında (Del-19 ve L858R) GIOTRIF'e karşılık pemetreksed/sisplatin (LUX-Lung 3) ve GIOTRIF'e karşılık gemsitabin/sisplatin (LUX-Lung 6) PFS ve OS etkililik sonuçları (Bağımsız inceleme)
| LUX-Lung 3 | LUX-Lung 6 | ||
Del19 | GIOTRIF
(N=112) | Pemetreksed/ Sisplatin (N=57) | GIOTRIF
(N=124) | Gemsitabin/Sisplatin
(N=62) |
Progresyonsuz sağkalım Ay (medyan) |
13,8 |
5,6 |
13,1 |
5,6 |
Tehlike oranı (HR) (%95 GA) | 0,26 (0,17-0,42) | 0,20 (0,13-0,33) | ||
p-değeri | ï¼0,0001 | ï¼0,0001 | ||
Genel sağkalım (OS) Ay (medyan) | 33,3 | 21,1 | 31,4 | 18,4 |
Tehlike oranı (HR) (%95 GA) | 0,54 (0,36-0,79) | 0,64 (0,44-0,94) | ||
p-değeri | 0,0015 | 0,0229 | ||
L858R | GIOTRIF
(N=91) | Pemetreksed/ Sisplatin (N=47) | GIOTRIF
(N=92) | Gemsitabin/Sisplatin
(N=46) |
Progresyonsuz sağkalım Ay (medyan) |
10,8 |
8,1 |
9,6 |
5,6 |
Tehlike oranı (HR) (%95 GA) | 0,75 (0,48-1,19) | 0,31 (0,19-0,52) | ||
p-değeri | 0,2191 | ï¼0,0001 | ||
Genel sağkalım (OS) Ay (medyan) | 27,6 | 40,3 | 19,6 | 24,3 |
Tehlike oranı (HR) (%95 GA) | 1,30 (0,8-2,11) | 1,22 (0,81-1,83) | ||
p-değeri | 0,2919 | 0,3432 | ||
![]()
GIOTRIF ve kemoterapi için, yaygın görülen mutasyonların (kombine Del 19, ve L858R) önceden tanımlanan alt gruplarında medyan PFS, sırası ile, LUX-Lung 3 çalışmasında, 13.6 aya karşılık 6.9 ay (HR 0,48; %95 GA 0,35-0,66; p<0,0001; N=307) ve LUX-Lung 6
çalışmasında, 11aya karşılık 5,6 aydır (HR 0,24 %95 GA 0,17-0,35; p<0,0001; N=324)
PFS açısından yararlara, hastalıkla ilişkili semptomlardaki iyileşme ve kötüleşmeye kadar geçen zamanda gecikme de eşlik eder (Bkz. Tablo 8). Genel yaşam kalitesi, global sağlık durumu, fiziksel, rol, kognitif, sosyal ve emosyonel fonksiyonların zaman içindeki ortalama skorları GIOTRIF ile anlamlı olarak daha iyi bulunmuştur.
Tablo 8: LUX-Lung 3 ve LUX-Lung 6 çalışmalarında (EORTC QLQ-C30 & QLQ-LC13)
GIOTRIF'e karşılık kemoterapi için semptomlarla ilgili sonuçlar
| LUX-Lung 3 | ||
| Öksürük | Dispne | Ağrı |
İyileşme gösteren | %67'e karşılık %60; | %65'e karşılık %50; | % 60'a karşılık %48; |
hastalar % | p=0,2133 | p=0,0078 | p=0,0427 |
Kötüye gitme zamanında medyan gecikme (ay) | 27'e karşılık 8 HR 0,6; p=0,0062 | 10,4'e karşılık 2,9 HR 0,68; p=0,0129 | 4,2 'ye karşılık 3,1 HR 0,83; p=0,1882 |
| LUX-Lung 6 | ||
| Öksürük | Dispne | Ağrı |
İyileşme gösteren hastalar % | %76'ya karşılık %55; p=0,0003 | %71'e karşılık %48; pï¼0,0001 | % 65'e karşılık %47; p=0,0017 |
Kötüye gitme zamanında medyan gecikme (ay) | 31,1'e karşılık 10,3 HR 0,46; p=0,0001 | 7,7'e karşılık 1,7 HR 0,53; pï¼0,0001 | 6,9'a karşılık 3,4 HR 0,7; p=0,022 |
LUX-Lung 2
LUX-Lung 2, tek kollu bir Faz II çalışmasıdır. Önceden 129 EGFR-TKI tedavisi almamış, EGFR mutasyonları taşıyan Evre IIIB veya Evre IV 129 akciğer adenokarsinoma hastasında yürütülmüştür. Hastalar ilk seçenek (N=61) veya ikinci seçenek (N=68) (yani önceden yapılmış olan 1 kemoterapi rejiminin başarısız olmasından sonra) tedaviye kabul edilmiştir. İlk seçenek tedavisindeki 61 hastada, bağımsız gözden geçirmeye göre doğrulanmış ORR
%65,6 ve DCR %86,9 olmuştur. Bağımsız gözden geçirme ile medyan PFS değeri 12 ay olmuştur. Önceden kemoterapi almış grupta da etkililik benzer şekilde yüksektir (N=68; ORR
%57,4; bağımsız gözden geçirme ile belirlenen medyan PFS 8 ay). Güncelleştirilmiş medyan OS, birinci ve ikinci seçenek tedavi için sırası ile 31,7 ay ve 23,6 aydır.
LUX-Lung 7
LUX-Lung 7, EGFR mutasyonları olan lokal ileri veya metastatik akciğer adenokarsinoma (Evre IIIB veya IV) hastalarında, ilk seçenek olarak, GIOTRIF'in etkililiğini ve güvenliliğini araştıran, randomize, global, açık, bir Faz IIb çalışmasıdır. Hastalar, TheraScreen: EGFR RGQ PCR Kit (Qiagen Manchester Ltd) kullanılarak aktive edici EGFR mutasyonlarının (Del 19 ve/veya L858R) mevcudiyeti açısından taranmıştır. Hastalar (N=319), günde bir kez oral 40 mg GIOTRIF (N=160) veya günde bir kez oral 250 mg geftinib tedavisine (N=159) randomize edilmiştir (1:1). Randomizasyon EGFR mutasyon durumuna göre (Del 19; L858R) ve beyin metastazının varlığına göre (var; yok) tabakalandırılmıştır.
Randomize edilen hastaların %62'si kadındır, medyan yaş 63 yıldır, hastaların %16'sında beyin metastazı vardır, başlangıçtaki ECOG performans durumu 0 (%31) veya 1'dir (%69),
%57'si Asya ırkından ve %43'ü Asya dışı ırklardandır. EGFR mutasyonu olan bir tümör numunesine sahip hastalar, ekson 19 delesyon (%58) veya ekson 21 L858R substitüsyon olarak (%42) sınıflandırılmıştır.
Ko-primer sonlanım noktaları, bağımsız gözden geçirme ile PFS'yi ve OS'yi içerir. Sekonder sonlanım noktaları ORR ve DCR'yi içerir. GIOTRIF, gefitinib ile karşılaştırıldığında, EGFR mutasyonu pozitif olan hastalarda, PFS ve ORR'yi anlamlı olarak iyileştirmiştir. Etkililik sonuçları Tablo 9'da özetlenmiştir.
Tablo 9: Ağustos 2015 tarihli primer analizlere dayanarak, GIOTRIF'e karşılık geftinib için (LUX-Lung 7) etkililik sonuçları
| GIOTRIF
(N=160) | Gefitinib
(n=159) | Tehlike oranı/ Odds oranı (%95 GA) p-değeri |
Medyan PFS (ay), | 11 | 10,9 | HR 0,73 |
Genel çalışma popülasyonu |
|
| (0,57-0,95) |
|
|
| 0,0165 |
18 ay PFS oranı | %27 | %15 |
|
24 ay PFS oranı | %18 | %8 |
|
Medyan OS (ay), Genel çalışma popülasyonu
18. ayda hayatta 24. ayda hayatta | 27,9
%71 %61 | 24,5
%67 %51 | HR 0,86 (0,66, 1,12) 0,2580 |
Objektif yanıt oranı (CR+PR) | %70 | %56 | OR 1,87 (1,12, 2,99) 0,0083 |
Rate-ORR) için p-değeri tabakalandırılmış lojistik regresyona dayanır.
DEL 19 mutasyonları ve L858R mutasyonları olan hastalar için PFS tehlike oranı, afatinibe karşılık geftinib için sırası ile 0,76 (%95 GA [0,55, 1,06]; p=0,1071) ve 0,71 (%95 GA [0,47,
1,06]; p=0,0856) olmuştur.
Daha önce EGFR TKI tedavisi almamış, tümörlerinde yaygın olmayan EGFR mutasyonları bulunan hastalarda GIOTRIF'in etkililiğinin analizi (LUX-Lung-2, LUX-Lung-3 ve LUX- Lung-6)
GIOTRIF'le yapılmış, prospektif tümör genotiplemesi olan üç klinik çalışmada (Faz III çalışmalar olan LUX-Lung-3 ve LUX-Lung-6 ile tek kollu Faz II çalışması LUX-Lung-2) yaygın olmayan EGFR mutasyonları bulunan (Del 19 ve L8858R mutasyonları dışında kalan mutasyonlar olarak tanımlanmıştır) ve daha önce TKI tedavisi almamış toplam 75 ileri evre (Evre IIIb-IV) akciğer adenokarsinoma hastasına ait verilerle bir analiz yapılmıştır. Hastalar oral yoldan günde bir kez, GIOTRIF 40 mg (her 3 çalışmada) veya 50 mg (LUX-Lung-2) ile tedavi edilmiştir.
G719X (N=18), L861Q (N=16) veya S768I substitusyon mutasyonu (N08) barındıran tümörleri olan hastalarda doğrulanmış ORR sırası ile %72,2, %56,3 ve %75'tir ve medyan yanıt süresi sırası ile 13,2 ay, 12,9 ay ve 26,3 aydır.
Ekson 20 insersiyonu bulunan tümörlere sahip hastalarda (N=23), doğrulanmış ORR %8,7 ve medyan yanıt süresi 7,1 aydır. De-novo T790M mutasyonu barındıran tümörlere sahip hastalarda (N=14) doğrulanmış ORR %14,3 ve medyan yanıt süresi 8,3 aydır.
Skuamöz histolojiye sahip KHDAK hastalarında GIOTRIF
Skuamoz histolojiye sahip, ileri evre KHDAK hastalarında ikinci seçenek tedavi olarak GIOTRIF'in etkililiği ve güvenliliği randomize, açık, global bir Faz III çalışmasında (LUX- Lung 8) değerlendirilmiştir. İlk seçenek tedavisi olarak en az 4 kür platin bazlı tedavi alan hastalar, daha sonra, progresyon görülünceye kadar, 1:1 oranında, günde 40 mg GIOTRIF veya 150 mg erlotinib tedavisine randomize edilmiştir. Randomizasyon ırka göre tabakalandırılmıştır (Doğu Asyalılara karşılık Doğu Asyalı olmayanlar). Primer sonlanım noktası progresyonsuz sağkalım süresidir (PFS). OS sekonder kilit sonlanım noktasıdır. Diğer sekonder sonlanım noktaları arasında, ORR, DCR, tümör boyutunda değişiklik ve sağlıkla ilişkili yaşam kalitesi bulunur. Randomize edilen 795 hastanın çoğunluğu erkek (%84) ve beyaz ırktandır (%73), halen sigara içmektedir veya geçmişte içmiştir (%95), başlangıçtaki ECOG performans durumu 1 (%67) ve ECOG 0'dır (%33).
Erlotinib ile karşılaştırıldığında, ikinci seçenek tedavi olarak GIOTRIF, skuamoz KHDAK
hastalarında PFS ve OS'i anlamlı olarak iyileştirmiştir. Tüm randomize edilen hastaları
kapsayan OS değerlerinin primer analizi sırasındaki etkililik sonuçları, Şekil 2 ve Tablo 10'da
özetlenmiştir.
Tablo 10: LUX-Lung 8 çalışmasında tüm randomize edilen hastalara ait, OS primer analizine dayanan, etkililik sonuçları (GIOTRIF'e karşılık erlotinib)
| GIOTRIF
(n=398) | Erlotinib
(n=397) | Tehlike oranı/ Odds oranı (%95 GA) | p-değeri |
PFS |
|
|
|
|
Ay (medyan) | 2,63 | 1,94 | HR 0.81 (0,69,0,96) | 0,0103 |
OS |
|
|
|
|
Ay (medyan) |
|
| HR 0.81 | 0,0077 |
| 7,92 | 6,77 | (0,69,0,95) |
|
12. ayda |
|
|
|
|
hayatta 18. ayda hayatta | %36,4 %22 | %28,2 %14,4 |
|
|
Objektif yanıt oranı (CR+PR) | %5,5 | %2,8 | OR 2,06 (0,98,4,32) | 0,0551 |
Yanıt süresi Ay (medyan) | 7,29 | 3,71 |
|
|
Genel sağkalım tehlike oranı, 65 yaşın altındaki hastalarda 0,68 (%95 GA 0,55, 0,85) ve 65
yaş ve üstündeki hastalarda 0,95 (%95 GA 0,76-1,19) bulunmuştur.
Şekil 2: LUX-lung 8 çalışmasında, tedavi gruplarına göre, OS için Kaplan-Meier eğrisi
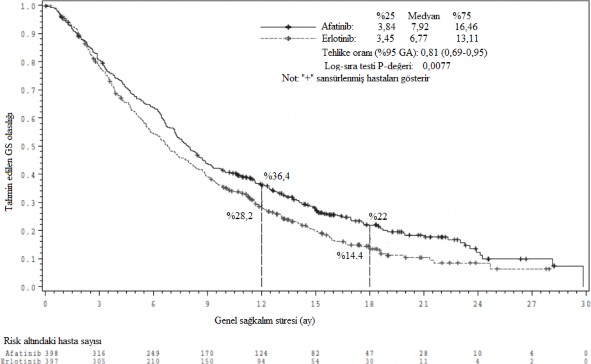
GS: Genel sağkalım
GA: Güven aralığı
PFS açısından yararlara, hastalık ile ilişkili semptomlarda iyileşme ve kötüye gitme zamanında gecikme eşlik etmiştir (Bkz. Tablo 11).
Tablo 11: LUX-Lung 8 çalışmasında (EORTC QOL-C30 & QLQ-LC13) semptom sonlanımları (GIOTRIF'e karşılık erlotinib)
| Öksürük | Dispne | Ağrı |
İyileşen hasta yüzdesi | %43'e karşılık %35 P=0,0294 | %51'e karşılık %44 P=0,0605 | %40'a karşılık %39 P=0.7752 |
Kötüye gitme zamanında gecikme (ay) | 4,5'e karşılık 3,7 HR 0,89; p=0,2562 | 2,6'a karşılık 1,9 HR 0,79; p=0,0078 | 2,5'e karşılık 2,4 HR 0,99; p=0,869 |
aDeğerler, GIOTRIF'e karşılık erlotinib için verilmiştir, p değeri, lojistik regresyona dayanır
EGFR-negatif tümörlerdeki etkililiği tespit edilmemiştir. Pediyatrik popülasyon:
Avrupa İlaç Ajansı, KHDAK endikasyonu için, tüm pediyatrik popülasyon alt gruplarında
GIOTRIF ile yapılan çalışmaların sonuçlarını sunma zorunluluğunu kaldırmıştır (Bkz. Bölüm 4.2 Pediyatrik popülasyon). Ancak başka rahatsızlıklara sahip pediatrik hastalarda pediyatrik çalışma yürütülmüştür.
Faz I/II açık etiketli, doz artırımlı, çok merkezli bir çalışmada, tekrarlayan/dirençli nöroektodermal tümörleri, rabdomiyosarkomu ve/veya tümör histolojisinden bağımsız bilinen ErbB yolu deregülasyonu ile diğer katı tümörleri olan 2 ila 18 yaş arasındaki pediyatrik hastalarda GIOTRIF'in güvenliliği ve etkililiği değerlendirilmiştir. Araştırmanın doz bulma bölümünde toplam 17 hasta tedavi edilmiştir. Denemenin maksimum tolere edilen doz (MTD) genişletme bölümünde, ErbB yolu deregülasyonu için biyobelirteçler tarafından seçilen 39 hasta, 18 mg/m²/gün dozunda GIOTRIF almıştır. Bu genişletme bölümünde, refrakter yüksek dereceli gliomalı (HGG) 6 hasta, diffüz intrinsik pontin gliomalı (DIPG) 4 hasta, ependimomlu
8 hasta ve diğer histolojileri olan 20 hasta olmak üzere 38 hastada objektif yanıt gözlenmemiştir. CLIP2-EGFR gen füzyonlu beynin nöral-glial tümörü olan bir hastada doğrulanmış bir kısmi yanıt vardır (pediyatrik kullanım hakkında bilgi için bkz. bölüm 4.2). Pediyatrik hastalarda GIOTRIF'in advers reaksiyon profili, yetişkinlerde görülen güvenlik profili ile tutarlıdır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
GIOTRIF'in oral uygulanmasından sonra afatinibin Cdeğeri, dozdan sonra yaklaşık olarak 2-5 saat sonra gözlenmiştir. Cve EAAdeğerleri, 20 mg-50 mg GIOTRIF doz aralığı içinde orantısal olan değerlerden biraz daha fazla artmıştır. Afatinibin sistemik maruziyeti, yüksek oranda yağlı bir yemekten sonra uygulandığı zaman, açlıktaki uygulanmasına göre,
%50 (C) ve %39 (EAA) oranında azalmıştır. Çeşitli tümör tiplerinde yapılan klinik çalışmalardan elde edilen popülasyon farmakokinetik verilerine dayanarak, yiyeceklerin GIOTRIF alımından önceki 3 saat içinde veya alındıktan sonra 1 saat içinde tüketilmesi
halinde, EAAdeğerinde ortalama %26 oranında azalma gözlenmiştir. Bu nedenle, GIOTRIF alımından önceki en az 3 saat içinde ve 1 saat sonrasına kadar yiyecek tüketilmemelidir (Bkz. Bölüm 4.2 ve 4.5).
Dağılım:
Afatinibin insan plazma proteinlerine in vitro bağlanma oranı yaklaşık %95'tir. Afatinib proteinlere hem kovalent olmayan (geleneksel protein bağlanması) ve hem de kovalent bağlarla bağlanır.
Biyotransformasyon:
İn vivo koşullarda afatinib için enzim katalizli metabolik reaksiyonların rolü ihmal edilebilir düzeydedir. Proteinlere kovalent bağlanma ürünleri afatinibin dolaşımdaki majör metabolitleridir.
Eliminasyon:
İnsanlarda afatinibin primer atılımı feçes yoluyladır. 15 mg oral afatinib çözeltisinin uygulanmasından sonra, dozun %85,4'ü feçeste ve %4,3'ü idrarda bulunur. Bu miktarın
%88'i ana madde afatinibdir. Afatinibin efektif yarılanma ömrü yaklaşık 37 saattir. Afatinibin kararlı durum plazma konsantrasyonlarına, afatinibin çoklu dozda uygulanmasından sonra 8 gün içinde ulaşılır ve 2,77 kat (EAA) ve 2,11 kat (C) birikim ile sonuçlanır. Afatinib ile 6 aydan daha uzun süre tedavi edilen hastalardaki terminal yarılanma ömrü 344 saat olarak tahmin edilmektedir.
Hastalardaki karakteristik özellikler
Renal yetmezlik:
Tek doz afatinibin %5'nden daha azı böbrekler yoluyla atılır. Tek doz 40 mg GIOTRIF uygulaması sağlıklı gönüllülere karşı renal bozukluğu olan gönüllülerle karşılaştırılmıştır. Maruziyet oranı, orta derecede renal yetmezliği (n=8; Renal Hastalıkta Diyet Modifikasyonu formülüne [MDRD] göre eGFR 30-59 ml/dk/1,73m) olan gönüllülerde, sağlıklı kontrollere göre %101 (C) ve %122 (EAA) olmuştur. Maruziyet oranı, şiddetli renal yetmezliği (n= 8; MDRD formülüne göre eGFR 15-29 ml/dk/1,73m) olan gönüllülerde, sağlıklı kontrollere göre %122 (C) ve %150 (EAA) olmuştur. Bu çalışmaya ve çeşitli tümör tiplerinde yapılan klinik çalışmalardan elde edilen verilerin popülasyon farmakokinetik analizlerine dayanarak, hafif (eGFR 60-89 ml/dk/1,73m) , orta (eGFR 30-59 ml/dk/1,73m) veya şiddetli (eGFR 15-29 ml/dk/1,73m) renal yetmezliği olan hastalarda başlangıç dozunda bir ayarlama yapılması gerekli değildir, ancak şiddetli renal yetmezliği olan hastalar izlenmelidir (Bkz. Aşağıda bulunan âÖzel popülasyonlarda popülasyon farmakinetik analizleriâ ve Bölüm 4.2). GIOTRIF eGFR değeri<15 ml/dk/1,73m olan veya diyalize giren hastalarda çalışılmamıştır.
Hepatik yetmezlik:
Afatinib asıl olarak safra/feçes yolu ile atılır. Hafif (Child Pough A) veya orta (Child Pough B) derecede hepatik yetmezliği olan hastalarla sağlıklı gönüllüler karşılaştırıldığında, tek doz 50 mg GIOTRIF uygulanması sonrasında benzer maruziyetler bulunmuştur. Bu sonuçlar, çeşitli tümör tiplerinde yapılan klinik çalışmalardan elde edilen popülasyon farmakokinetik verileri ile uyumludur (Bkz. Aşağıda, âÖzel popülasyonlarda yapılan popülasyon farmakokinetik analizleriâ). Hafif ve orta derecede hepatik yetmezliği olan hastalarda başlangıç dozunda bir ayarlama yapılmasının gerekli olmadığı düşünülmektedir (Bkz. 4.2). Afatinib farmakokinetiği şiddetli hepatik yetmezliği (Child Pough C) olan hastalarda çalışılmamıştır (Bkz. Bölüm 4.4).
Özel popülasyonlarda yapılan popülasyon farmakokinetik analizleri
GIOTRIF monoterapisi alan 927 kanser hastasında (764'i KHDAK hastası) bir popülasyon farmakokinetik analizi yapılmıştır. Test edilen ve aşağıda verilen kovaryatların hiç birisi için başlangıç dozunda bir uyarlama gerekli görülmemiştir.
Yaş:
Afatinib farmakokinetiği üzerinde yaşın anlamlı bir etkisi gözlenmemiştir (28-87 yaş aralığında).
Vücut ağırlığı
62 kg. ağırlığındaki bir hastaya göre (genel hasta popülasyonundaki medyan vücut ağırlığı), 42 kg. ağırlığındaki bir hasta için plazma maruziyeti (EAA-) %26 oranında artmış [(2,5 yüzdelik) ve 95 kg. ağırlığındaki bir hasta için ise %22 oranında azalmıştır (97,5. yüzdelik).
Cinsiyet
Kadın hastalarda plazma maruziyeti ((EAA, vücut ağırlığına göre düzeltilmiş) erkek
hastalarla karşılaştırıldığında %15 oranında daha yüksektir.
Irk
Asyalı, beyaz ve siyah ırk gruplarını kapsayan popülasyon farmakokinetik analizlerine dayanarak ırkın afatinib farmakokinetiği üzerinde herhangi bir etkisi olmamıştır. Siyah ırk grupları ile ilgili veriler sınırlıdır.
Renal yetmezlik
Kreatinin klerensinin düşmesi (CrCL, Cockcroft Gault ile hesaplanmıştır) ile afatinib maruziyeti orta derecede artmıştır. Yani, CrCL değeri 79 ml/dk olan bir hasta (analiz edilen genel hasta popülasyonundaki medyan CrCL) ile karşılaştırıldığında, CrCL değeri 60 ml/dk veya 30 ml/dk olan bir hastada afatinibe maruziyet (EAA), sırası ile %13 ve %42 oranlarında artmış ve CrCL değeri 90 ml/dk veya 120 ml/dk olan bir hastada ise sırası ile %6 ve %20 oranında azalmıştır.
Hepatik yetmezlik
Normal sınırlar dışında bulunan karaciğer testleri ile tanımlanan hafif ve orta derecede karaciğer yetmezliği olan hastalar, afatinib maruziyetinde anlamlı değişikliklerle ilişkili bulunmamıştır. Orta ve şiddetli derecede karaciğer yetmezliği olan hastalarla ilgili veriler sınırlıdır.
Hastalardaki diğer özellikler/intrinsik faktörler
Afatinib maruziyeti üzerinde anlamlı etki yapan diğer özellikler/ intrinsik faktörler şunlardı: ECOG performans skoru, laktat dehidrogenaz düzeyleri, alkalen fosfataz düzeyleri ve total protein. Bu kovaryatların bireysel etki boyutları klinik olarak anlamlı kabul edilmemiştir. Sigara içme öyküsü, alkol tüketimi (sınırlı veri) veya karaciğer metastazları, afatinib farmakokinetiği üzerinde anlamlı bir etki göstermemiştir.
Pediyatrik popülasyon
18 mg/m afatinib uygulamasından sonra, 2 ila 18 yaş arasındaki pediyatrik hastalarda kararlı durum maruziyeti (EAA ve C), 40-50 mg afatinib verilen yetişkinlerde gözlenen ile karşılaştırılabilirdir.(ayrıca Bkz. Bölüm 4.2. Pediyatrik popülasyon).
İlaç - ilaç etkileşimleri ile ilgili diğer bilgiler
İlaç alımı taşıyıcı sistemleri ile etkileşim
İn vitro veriler, afatinib ile OATP1B1, OATP1B3, OATP2B1, OAT1, OAT3, OCT1, OCT2 ve OCT3 taşıyıcıların inhibisyonuna bağlı ilaç-ilaç etkileşimlerinin olası olmadığını göstermiştir.
Sitokrom P450 (CYP) enzimleri ile etkileşimler
İnsanlarda, enzimlerin katalizlediği metabolik reaksiyonların afatinib metabolizmasında ihmal edilebilir rolleri olduğu bulunmuştur. Afatinib dozunun yaklaşık %2'si FMO3 ile metabolize olmuştur ve CYP3A4-bağımlı N-demetilasyon kantitatif olarak tespit edilemeyecek kadar düşüktür. Afatinib, CYP enzimlerinin inhibitörü veya indükleyicisi değildir. Bu nedenle, GIOTRIF'in, CYP enzimleri ile düzenlenen veya metabolize edilen diğer ilaçlarla etkileşmesi beklenmez.
UDP-glukuronoziltransferaz1A1 (UGTIA1) inhibisyonunun afatinib üzerindeki etkisi
İn vitro veriler, afatinib ile UGT1A1 inhibisyonuna bağlı ilaç-ilaç etkileşmesinin olası olmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Farelere ve sıçanlara tek doz oral uygulanması, afatinibin potansiyel akut toksisitesinin düşük olduğunu göstermiştir. Oral tekrarlı doz çalışmalarında sıçanlarda 26 haftaya kadar veya mini domuzlarda 52 haftaya kadar uygulamalarda ana etkiler, ciltte (sıçanlarda dermal değişiklikler, epitelyal atrofi ve follikülit), gastrointestinal kanalda (sıçanlarda ve mini domuzlarda diyare, midede erozyonlar, epitelyal atrofi) ve böbrekler üzerinde (sıçanlarda papiller nekroz) tanımlanmıştır. Bulgulara bağlı olarak, bu değişiklikler, klinik olarak geçerli düzeylerin altındaki, klinik olarak geçerli düzeylerdeki veya klinik düzeylerin üzerindeki maruziyetlerde ortaya çıkmıştır. Ek olarak, her iki türde de, farmakodinamik etkilerin sonucu olarak çeşitli organlarda epitel atrofisi gözlenmiştir.
Üreme toksisitesi
Etki mekanizmasına dayanarak, GIOTRIF dahil EGFR'i hedef alan tüm ilaçların fötal hasara yol açma potansiyeli vardır. Afatinib ile yapılan embriyo-fötal gelişim çalışmaları, teratojenite ile ilgili bir belirti göstermemiştir. İlişkili total sistemik maruziyet (EAA), hastalardaki düzeylerle karşılaştırıldığında, ya hafif oranda yüksek (sıçanlarda 2,2 kat) veya düşüktür (tavşanlarda 0,3 kat).
Laktasyonun 11. gününde, sıçanlara oral olarak verilen radyoaktif işaretli afatinib anne sütünde atılmıştır.
Dişi ve erkek sıçanlarda maksimum tolere edilen dozlara kadar ilaç verilmesiyle yapılan bir fertilite çalışmasında, fertilite üzerinde anlamlı bir etki gözlenmemiştir. Erkek ve dişi sıçanlarda total sistemik maruziyet (EAA), hastalarda gözlenen ile ya aynı düzeyde ya da daha düşüktür (sırası ile, 1,3 kat ve 0,51 kat).
Sıçanlarda maksimum tolere edilen dozlara kadar yapılan bir çalışmada, pre/post natal gelişim üzerinde anlamlı bir etki ortaya çıkmamıştır. Dişi sıçanlarda en yüksek total sistemik maruziyet (EAA), hastalarda gözlenen düzeylere göre daha düşüktür (0,23 kat).
Fototoksisite
Bir in vitro 3T3 testi, afatinibin fototoksisite potansiyeli olabileceğini göstermiştir.
Karsinojenite
GIOTRIF ile karsinojenite çalışmaları yürütülmemiştir.
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A16642 |
| Satış Fiyatı | 42993.98 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 43187.65 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693090065 |
| Etkin Madde | Afatinib |
| ATC Kodu | L01EB03 |
| Birim Miktar | 30 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 28 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |