GLARIN 100 U/ml SC kullanım için enj. çözelti içeren kartuş (5 kartuş) Kısa Ürün Bilgisi
{ Insulin Glarjin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
GLARİN 100 U/mL sc kullanım için enjeksiyonluk çözelti içeren kartuş Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Enjeksiyonluk çözeltinin her bir mL'si, 100 U (3,64 mg'a eşdeğer) insülin glarjin içermektedir.
Her bir 3 mL'lik çözelti kartuşu 300 U (10,92 mg) insülin glarjin içerir.
İnsülin glarjin, rekombinant DNA teknolojisi ile Escherichia coli kullanılarak üretilmiş bir biyobenzerdir.
Yardımcı maddeler
Sodyum hidroksit pH ayarlayıcı
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kartuşlarda enjeksiyonluk çözelti GLARİN, berrak ve renksiz çözeltidir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Tip 1 diyabetli yetişkin ve 2 yaş ve üzerindeki çocuk hastalarda ve uzun etkili insülinin
gerekli olduğu Tip 2 diyabetli yetişkin hastalarda endikedir.
4.2. Pozoloji ve uygulama şekli
Bu preparatın potensi ünite bazında belirtilmektedir. Bu birim GLARİN'e özeldir ve IU ile veya diğer insülin analoglarının potensi için kullanılan birimler ile aynı değildir (bkz. Bölüm Farmakodinamik özellikler).
GLARİN, uzatılmış etkiye sahip insülin analoğu olan insülin glarjin içermektedir. Her gün aynı saatte olmak şartıyla, günün herhangi bir saatinde, günde bir kez uygulanmalıdır.
İnsülin glarjin dozu ve uygulama zamanı kişiye göre ayarlanmalıdır. Tip 2 diabetes mellitus hastalarında GLARİN oral etkili antidiyabetik tıbbi ürünlerle beraber uygulanabilir.
Uygulama şekli:
GLARİN subkütan uygulanır.
GLARİN intravenöz uygulanmamalıdır. GLARİN'in uzun süreli etkisi subkütan dokuya enjeksiyonuna bağlıdır. Normal subkütan dozun intravenöz yoldan uygulanması şiddetli hipoglisemiye yol açabilir.
GLARİN'in karın, uyluk veya deltoid yoldan uygulanmasından sonra serum insülin veya glukoz seviyelerinde klinik olarak anlamlı farklılıklar bulunmamıştır. Enjeksiyon yerleri her bir enjeksiyonda dönüşümlü olarak kullanılmalıdır. Lipodistrofi ve kütanöz amiloidoz riskini azaltmak için bir enjeksiyon bölgesi içindeki enjeksiyon yerleri her enjeksiyonda dönüşümlü olarak kullanılmalıdır (bkz. Bölüm 4.4 ve 4.8).
GLARİN başka bir insülinle karıştırılmamalı veya seyreltilmemelidir. Karıştırma veya seyreltme, zaman/etki profilini değiştirebilir ve karıştırma ürünün çökmesine yol açabilir.
GLARİN sadece subkütan enjeksiyon için uygundur.
GLARİN'i kullanmadan önce Bölüm 6.6. ve Kullanma Talimatı dikkatle okunmalıdır. (bkz. Bölüm 6.6)
Özel popülasyonlara ilişkin bilgiler:
Sınırlı deneyim nedeniyle, GLARİN'in aşağıdaki hasta gruplarında etkililiği ve güvenliliği değerlendirilememiştir: 2 yaşın altındaki çocuklar, karaciğer yetmezliği veya orta/şiddetli böbrek yetmezliği olan hastalar (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda, azalan insülin metabolizması nedeniyle, insülin ihtiyacı düşebilir.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda, azalan glukoneogenez kapasitesi ve azalan insülin metabolizması nedeniyle, insülin ihtiyacı düşebilir.
Pediyatrik popülasyon:
İnsulin glarjin'in güvenliliği ve etkililiği, adolesanlarda ve 2 yaş ve üzerindeki çocuklarda gösterilmiştir (bkz. Bölüm 5.1). Dozu ve uygulama zamanı kişiye göre ayarlanmalıdır.
2 yaşın altındaki çocuklarda insulin glarjin'in güvenliliği ve etkililiği belirlenmemiştir.
Geriyatrik popülasyon:
Yaşlılarda (65 yaş ve üzeri), böbrek fonksiyonlarının zamanla bozulması, insülin ihtiyacında
sabit bir düşüşe neden olabilir.
Diğer insülinlerden GLARİN'e geçiş
Orta veya uzun etkili insülinden, GLARİN'e geçerken, bazal insülin dozunda bir değişiklik yapılması ve birlikte kullanılan antidiyabetik tedavisinin (ilave regüler insülinlerin veya hızlı etkili insülin analoglarının dozu ve zamanlaması veya oral antidiyabetik ajanların dozu) ayarlanması gerekebilir.
Günde iki kez NPH insülinden GLARİN'e geçiş
Bazal insülinle tedavi şemasını günde iki kez NPH insülinden, günde tek doz GLARİN'e değiştiren hastalar, gece ve sabah erken saatlerde hipoglisemi riskini azaltmak için, tedavinin ilk haftalarında günlük bazal insülin dozlarını % 20-30 oranında azaltmalıdırlar.
İnsülin glarjin 300 ünite/mL'den GLARİN'e geçiş
GLARİN ve insülin glarjin 300 birim/mL biyoeşdeğer değildir ve doğrudan değiştirilemez. Hipoglisemi riskini azaltmak için, bazal insülin rejimini günde bir kez insülin glarjin 300 ünite/ml olan bir insülin rejiminden günde bir kez GLARİN rejimine geçiren hastalar, dozlarını yaklaşık % 20 oranında azaltmalıdır.
İlk haftalardaki bu doz azaltımı, en azından kısmen, öğün vakti alınan insülin artırılarak telafi
edilmeli, bu dönemden sonra doz şeması kişiye göre ayarlanmalıdır.
Diğer insülinlerden GLARİN'e geçiş sırasında ve bunu izleyen ilk haftalarda yakın metabolik kontrol önerilmektedir.
Düzelen metabolik kontrol ve bunun sonucunda insülin duyarlılığında meydana gelen artış nedeniyle dozlama şemasında yeniden ayarlama yapılması gerekebilir. Hastanın vücut ağırlığı veya yaşam tarzı, insülin alım zamanı değiştiğinde ya da hipoglisemiye veya hiperglisemiye duyarlılığı arttıran başka koşulların meydana geldiği durumlarda da doz ayarlaması gerekebilir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
İnsan insülinine karşı antikor oluşumu nedeniyle yüksek insülin dozları ile tedavi edilmekte olan hastalar GLARİN ile düzelen bir insülin yanıtı gösterebilirler.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Takip edilebilirlik
Biyobenzer ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve
seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Diğer tüm terapötik proteinlerde olduğu gibi GLARİN için de potansiyel immunojenisite riski söz konusudur.
GLARİN, diyabetik ketoasidozun tedavisi için uygun bir insülin seçeneği değildir. Bu gibi
durumlarda intravenöz olarak uygulanan regüler insülin önerilmektedir.
Yetersiz kan şekeri kontrolü veya hipoglisemi veya hiperglisemi epizotlarına bir eğilim olması durumunda, doz ayarlaması yapmadan önce hastanın tedavi şemasına uyumu, enjeksiyon yerleri, uygun enjeksiyon tekniği ve diğer ilgili faktörler gözden geçirilmelidir.
Hastanın başka bir tip veya marka insüline geçmesi sıkı bir tıbbi gözlem altında yapılmalıdır. Form, marka (üretici), tip (regüler, NPH, lente, uzun etkili, vs.), orijin (hayvan, insan, insan insülin analoğu) ve/veya üretim yöntemi değişimleri; doz değişim ihtiyacı ile sonuçlanabilir.
Hastalar, lipodistrofi ve kutanöz amiloidoz riskini azaltmak için belirlenen enjeksiyon
yerlerini her enjeksiyonda dönüşümlü olarak kullanmaları konusunda bilgilendirilmelidir. Bu
reaksiyonların oluştuğu enjeksiyonbölgelerine insülin enjeksiyonu yapılmasından sonra, insülin emiliminde gecikme ve glisemik kontrolde kötüleşme olması potansiyel bir risktir. Enjeksiyon yerinin, etkilenmemiş bir bölgeye doğru anlık olarak değiştirilmesinin hipoglisemiye neden olduğu bildirilmiştir. Enjeksiyon bölgesinde değişiklik sonrasında kan glukoz izlemi önerilmektedir ve antidiyabetik ilaçlarda doz ayarlaması dikkate alınabilir.
Hipoglisemi
Hipogliseminin ortaya çıkma zamanı kullanılan insülinlerin etki profiline bağlıdır ve bu nedenle tedavi şeması değiştiğinde değişebilir. GLARİN'in bazal insülin sağlamasının daha sürekli olması nedeniyle daha az gece ve daha fazla erken sabah hipoglisemisi beklenebilir.
Hipoglisemik epizotların özel bir klinik anlam taşıyabileceği hastalarda özellikle dikkatli olunmalıdır ve kan şekeri izlenmesinin yoğunlaştırılması önerilebilir. Bu hastalar şunlardır: Beyni besleyen kan damarlarında veya koroner arterlerde anlamlı daralma (kardiyak veya serebral hipoglisemi komplikasyonları riski) olan hastalar ya da proliferatif retinopatisi olan hastalar, özellikle de bu hastaların fotokoagülasyonla tedavi edilmediği (hipoglisemi sonrası geçici körlük riski) durumlar.
Hastalar, hipogliseminin uyarıcı semptomlarının azaldığı durumların farkında olmalıdırlar. Bazı risk gruplarında hipogliseminin uyarıcı semptomları değişebilir, daha az belirgin olabilir veya hiç görünmeyebilir. Bu hastalar şunlardır;
kan şekeri kontrolü belirgin biçimde düzelmiş olanlar
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Çok sayıda madde glukoz metabolizmasını etkiler ve insülin glarjinin dozunun ayarlanmasını
gerektirebilir.
Kan şekerini düşürücü etkiyi artırabilecek ve hipoglisemi yatkınlığını artırabilecek maddeler; oral antidiyabetik ajanlar, anjiyotensin dönüştürücü enzim (ADE) inhibitörleri, disopiramid, fibratlar, fluoksetin, monoamino oksidaz (MAO) inhibitörleri, pentoksifilin, propoksifen, salisilatlar veya sülfonamid antibiyotikleri içermektedir.
Kan şekerini düşürücü etkiyi azaltabilecek maddeler; kortikosteroidler, danazol, diazoksid, diüretikler, glukagon, izoniazid, östrojenler ve progestojenler, fenotiazin türevleri, somatropin, sempatomimetik ajanlar (örneğin, epinefrin [adrenalin], salbutamol, terbutalin) ve tiroid hormonları, atipik antipsikotik tıbbi ürünler (örneğin klozapin ve olanzapin) ve proteaz inhibitörlerini içermektedir.
Beta-blokörler, klonidin, lityum tuzları veya alkol insülinin kan şekerini düşürücü etkisini kuvvetlendirebilir veya zayıflatabilir. Pentamidin hipoglisemiye yol açabilir ve bazen bunu hiperglisemi izleyebilir.
Bunun yanı sıra, beta-blokörler, klonidin, guanetidin ve rezerpin gibi sempatolitik ilaçların
etkisiyle, adrenerjik karşı-düzenleme belirtileri azalabilir veya kaybolabilir.
Özel popülasyonlara ilişkin ek bilgiler
Herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli olan kadınlar/doğum kontrolü (Kontrasepsiyon)
Oral kontraseptiflerin içindeki östrojen ve progestojenler GLARİN'in kan glukozunu düşürücü etkisini azaltabilir. GLARİN'in oral kontraseptifler üzerindeki etkisine ilişkin veri bulunmamaktadır.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve veya/ doğum /ve veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Klinik olarak gerekli olmadıkça gebelikte GLARİN kullanılmamalıdır.
İnsülin glarjin için, kontrollü klinik çalışmalardan, gebelik ile ilgili klinik veri bulunmamaktadır. Pazarlama sonrası araştırmalarda gebe kadınlardan elde edilen çok sayıda veri (1000'den fazla gebelikteki sonuçlar) gebelikte insülin glarijine ilişkin bir yan etkiye ve insülin glarjine bağlı malformatif ya da feto/neonatal toksisiteye işaret etmemektedir. Hayvan çalışmalarından elde edilen veriler üreme toksisitesine işaret etmemektedir. GLARİN'in gebelik döneminde kullanılması, klinik olarak gerekli olması durumunda düşünülebilir.
Önceden var olan veya gestasyonal diyabeti olan hastalar için hiperglisemi ile ilişkili advers sonlanımların önlenmesi açısından tüm gebelik süresince iyi metabolik kontrolün sürdürülmesi çok önemlidir. İnsülin gereksinimi ilk trimesterde azalabilir ve genellikle ikinci ve üçüncü trimesterde artar. Doğumdan hemen sonra, insülin gereksinimi hızla düşer (artan
hipoglisemi riski). Bu nedenle kan şekerinin dikkatli izlenmesi çok önemlidir.
Laktasyon dönemi
İnsülin glarjinin insan sütüne geçip geçmediği bilinmemektedir. Bir peptid olan insülin glarjin insan sindirim sisteminde sindirilerek aminoasitlere indirgendiği için, ağızdan alınan insülin glarjinin emzirilen yenidoğan/süt çocuklarında metabolik etki yapması beklenmez. Emziren kadınlarda insülin dozu ve diyette ayarlama yapılması gerekebilir.
Üreme yeteneği /Fertilite
Hayvan çalışmaları, fertilite açısından herhangi bir doğrudan zararlı etkiyi işaret etmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Hipoglisemi veya hiperglisemi veya örneğin görme bozukluğunun bir sonucu olarak hastanın konsantre olma ve tepki verme yeteneği etkilenebilir. Bu durum, bu yeteneklerin özellikle önemli olduğu (örn. araç veya makine kullanma gibi) durumlarda bir risk oluşturur.
Hastalara araba kullanırken hipoglisemiden kaçınmak için önlemler almaları tavsiye edilmelidir. Bu durum, hipogliseminin uyarıcı semptomlarına farkına varma yeteneği azalmış veya kaybolmuş kişilerde ya da sık hipoglisemi epizotları yaşayan kişilerde özellikle önemlidir. Bu koşullarda araç veya makine kullanmanın tavsiye edilebilir olup olmadığı düşünülmelidir.
4.8. İstenmeyen etkiler
İnsülin tedavisinin genellikle en sık görülen istenmeyen etkisi olan hipoglisemi (çok yaygın), insülin dozunun insülin gereksinimine oranla fazla yüksek olması halinde meydana gelebilir (bkz. Bölüm 4.4.).
Aşağıda klinik çalışmalarda gözlenen ilgili advers reaksiyonlar sistem organ klasifikasyonuna ve azalan sıklığa göre listelenmiştir: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Her bir sıklık grubunda, istenmeyen etkiler azalan ciddiyet (şiddet) düzeyine göre sıralanmıştır.
Bağışıklık sistemi hastalıkları
Seyrek: Alerjik reaksiyonlar
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hipoglisemi
Sinir sistemi hastalıkları
Çok seyrek: Tat alma duyusunda bozukluk
Göz hastalıkları
Seyrek: Görme bozukluğu, retinopati
Deri ve deri altı doku hastalıkları
Yaygın: Lipohipertrofi
Yaygın olmayan: Lipoatrofi Bilinmiyor: Kütanöz amiloidoz
Kas iskelet bozuklukları, bağ doku ve kemik hastalıkları
Çok seyrek: Kas ağrısı (miyalji)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Enjeksiyon yeri reaksiyonları Seyrek: Ödem
Seçili advers reaksiyonların tanımı
Metabolizma ve beslenme hastalıkları
Şiddetli hipoglisemik ataklar, özellikle eğer tekrarlayan ataklar ise, nörolojik hasarlara yol
açabilirler. Uzayan veya şiddetli hipoglisemik epizotlar yaşamı tehdit edici olabilir.
Pek çok hastada, nöroglikopeni belirti ve semptomları adrenerjik karşıt düzenlenme belirtilerini takip eder. Genellikle, kan glukozundaki düşüş ne kadar fazla ve hızlı olursa, karşı-düzenleme fenomeni ve bunun semptomları o kadar belirgin olur (bkz. Bölüm 4.4).
Bağışıklık sistemi hastalıkları
İnsüline karşı ani gelişen tipte alerjik reaksiyonlar seyrektir. İnsülinlere (insülin glarjin dahil) veya yardımcı maddelere karşı görülen bu tip reaksiyonlar genel deri reaksiyonları, anjiyoödem, bronkospazm, hipotansiyon ve şok ile bağlantılı olabilir ve yaşamı tehdit edici olabilir.
Göz hastalıkları
Glisemik kontrolde belirgin bir değişiklik, göz merceklerinin dolgunluğu ve refraktif
indeksindeki geçici değişikliklerden dolayı, geçici görme bozukluğuna neden olabilir.
Uzun süreli düzelen glisemik kontrol diyabetik retinopatinin ilerleme riskini azaltır. Bununla birlikte, glisemik kontrolde ani düzelme sağlayan yoğun insülin tedavisi de diyabetik retinopatinin geçici bir süre kötüleşmesine neden olabilir. Proliferatif retinopatisi olan hastalarda, özellikle fotokoagülasyon ile tedavi edilmemişse, şiddetli hipoglisemik epizotlar geçici görme kaybına yol açabilir.
Deri ve deri altı doku hastalıkları
Enjeksiyon yerinde lipodistrofi ve kutanöz amiloidoz oluşabilir ve lokal insülin absorpsiyonunu geciktirebilir. Enjeksiyon yerinin devamlı olarak değiştirilmesi bu reaksiyonların azalmasına veya önlenmesine yardımcı olabilir (bkz. Bölüm 4.4).
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Enjeksiyon bölgesindeki reaksiyonlar, kızarıklık, ağrı, kaşıntı, ürtiker, şişme veya enflamasyonu içermektedir. İnsülinlere karşı enjeksiyon yerinde gözlenen çoğu minör reaksiyonlar çoğunlukla birkaç gün veya hafta içinde kaybolur.
Seyrek olarak ve özellikle daha önceki zayıf metabolik kontrol yoğun insülin tedavisi ile düzeltildiğinde, insülin sodyum tutulmasına ve ödeme neden olabilir.
Pediyatrik popülasyon
Genel olarak, 18 yaş ve altındaki hastalar için güvenlilik profili 18 yaş üstü hastalar ile benzerdir.
Pazarlama sonrası çalışmalardan elde edilen yan etki bildirimleri; 18 yaş ve altındaki hastalarda 18 yaş üstü hastalara göre, nispeten daha sık enjeksiyon yeri reaksiyonlarını (enjeksiyon yerinde ağrı, reaksiyon) ve deri reaksiyonlarını (döküntü, ürtiker) içermekteydi. 2 yaş altındaki hastalarda herhangi bir klinik çalışma güvenlilik verisi mevcut değildir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
İnsülin doz aşımı, şiddetli ve bazen uzun süreli ve yaşamı tehdit eden hipoglisemiye yol
açabilir.
Tedavi
Hafif hipoglisemi epizotları çoğunlukla oral karbonhidratlarla tedavi edilebilir. Tıbbi ürünün dozu, öğün alışkanlıkları veya fiziksel aktivitede ayarlamalar gerekebilir.
Koma, nöbet veya nörolojik bozukluğun eşlik ettiği daha şiddetli epizodlar, intramuüsküler/ subkütan glukagon ya da konsantre intravenöz glukoz ile tedavi edilebilir. Hipoglisemi belirgin klinik düzelmeden sonra da tekrarlayabileceği için karbonhidrat alınımının ve hastanın izlenmesinin sürdürülmesi gerekebilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Enjeksiyonluk uzun-etkili insülinler ve analogları ATC Kodu: A10AE04
*GLARİN biyobenzer bir ilaçtır.
Etki mekanizması
GLARİN, insülin glarjin içeren bir antidiyabetiktir. İnsülin glarjin rekombinant DNA teknolojisi ile üretilen bir insan insülini analoğudur. Nötral pH'de düşük çözünürlük göstermek üzere tasarlanmıştır. İnsülin glarjin, GLARİN enjeksiyonluk çözeltinin asidik pH'sında (pH 4) tamamen çözünür. Subkütan enjeksiyonu takiben, asidik çözelti nötralleşerek mikro çökeltilerin oluşmasına yol açar. Bunlardan sürekli az miktarda salıverilen insülin glarjin düzgün, pikler içermeyen, uzun süreli ve öngörülebilir konsantrasyon/zaman profili oluşturur.
İnsülin glarjin M1 ve M2 olmak üzere 2 aktif metabolite metabolize olur. (bkz. Bölüm 5.2)
İnsülin reseptörüne bağlanma: In vitro çalışmalar, insülin glarjin ile M1 ve M2 metabolitlerinin insan insülin reseptörüne afinitesinin insan insülini ile benzer olduğunu göstermektedir.
IGF-1 reseptörüne bağlanma: İnsülin glarjinin insan IGF-1 reseptörüne afinitesi insan insülininin afinitesinden yaklaşık 5 ila 8 kat daha fazladır (ancak IGF-1'in birinden yaklaşık
70 ila 80 kat daha düşüktür), oysa M1 ve M2 IGF-1 reseptörüne insan insülinine kıyasla biraz daha düşük afiniteyle bağlanmaktadır.
Tip I diyabetik hastalarda bulunan toplam insülin konsantrasyonunun (insülin glarjin ve metabolitleri), IGF-1 reseptörlerinin maksimum sayısının yarısı kadarının doygunluğa ulaşması ve sonrasında IGF-1 reseptörü ile başlatılan mitojenik-proliferatif yolağın aktivasyonu için gerekenden belirgin olarak daha düşük olduğu gösterilmiştir. Endojen IGF- 1'in fizyolojik konsantrasyonları mitojenik-proliferatif yolağı aktive edebilir; ancak, GLARİN tedavisi dahil olmak üzere insülin tedavisinde bulunan terapötik konsantrasyonlar IGF-1 yolağını aktive etmek için gereken farmakolojik konsantrasyonlardan belirgin olarak daha düşüktür.
İnsülin glarjin de dahil olmak üzere insülinin primer aktivitesi glukoz metabolizmasının düzenlenmesidir. İnsülin ve analogları, özellikle iskelet kası ve yağ tarafından periferik glukoz alımını uyararak ve hepatik glukoz üretimini inhibe ederek kan glukoz düzeylerini düşürürler. İnsülin, adipositte lipolizi inhibe eder, proteolizi inhibe eder ve protein sentezini artırır.
Klinik farmakoloji çalışmalarında, aynı dozlarda verildiğinde, intravenöz insülin glarjin ve insan insülininin eşit etki gücüne sahip olduğu gösterilmiştir. Tüm insülinlerde olduğu gibi, insülin glarjinin etki süresi fiziksel aktivite ve diğer değişkenlerden etkilenebilmektedir.
Sağlıklı bireylerde veya tip 1 diyabeti olan hastalarda yapılan öglisemik klemp çalışmalarında, subkütan uygulanan insülin glarjinin etki başlangıcı, insan NPH insülinine kıyasla daha yavaş, etki profili düz, piksiz ve etkisi daha uzundur.
![]()
Aşağıdaki grafik hastalarda yapılan bir çalışmanın sonuçlarını göstermektedir.:
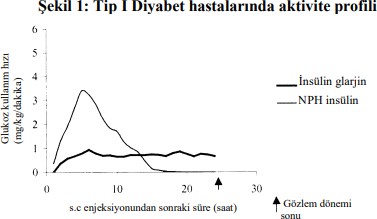
*Sabit plazma glukoz düzeyleri sağlamak üzere infüzyon yapılan glukoz miktarı olarak belirlenmiş (saat başı ortalama değerler)
Subkütan insülin glarjinin daha uzun süreli etkisi, daha yavaş olan absorpsiyon hızıyla doğrudan ilişkilidir ve günde tek doz uygulamayı desteklemektedir. İnsülin glarjin gibi insülin ve insülin analoglarının etki süresi farklı bireylerde ya da bireyin kendisinde belirgin değişkenlik gösterebilir.
Klinik bir çalışmada, hem sağlıklı bireylerde hem de tip 1 diyabeti olan hastalarda intravenöz
insülin glarjin ve insan insülini uygulaması sonrasında hipoglisemi semptomları veya karşı- düzenleme hormon yanıtları benzer olmuştur.
Klinik çalışmalarda, NPH-insülini ve insülin glarjin tedavi gruplarında insan insülini ve insülin glarjinle çapraz tepki gösteren antikorlar aynı sıklıkta gözlenmiştir.
Tip 2 diyabeti olan 1024 hastada günde tek doz insülin glarjinin diyabetik retinopati üzerindeki etkileri açık-etiketli 5 yıllık NPH (günde iki doz) kontrollü bir çalışmada değerlendirilmiştir. Diyabetik retinopatinin erken tedavi çalışmasında (ETDRS), derecesi 3 veya üzerindeki basamakta retinopatisi olan bu hastaların retinopati ilerlemesi fundus fotografisi ile incelendi. İnsülin glarjin ile NPH insülin karşılaştırıldığında, diyabetik retinopatinin ilerlemesinde anlamlı bir farklılık görülmemiştir.
ORIGIN (Outcome Reduction with Initial Glargine INtervention) çalışması çok merkezli, randomize, 2x2 faktorial tasarımlı bir çalışma olup yüksek kardiyovasküler (KV) riski ve açlık glukoz (IFG) ya da glukoz toleransı (IGT) bozuk olan (katılımcıların % 12'si) veya en az bir antidiyabetik oral ilaç ile tedavi edilen tip 2 diabetes mellitus hastası (katılımcıların % 88'i) olan 12537 katılımcı ile yürütülmüştür. Katılımcılar FPG ≤95 mg/dl (5.3 mM) olacak şekilde insülin glarjin (n=6264) tedavisine ya da standart bakıma (n=6273) randomize edilmiştir (1:1).
İlk ko-primer etkinlik sonucu, KV ölümün, ölümcül olmayan miyokard enfarktüsünün (MI) veya ölümcül olmayan inmenin ortaya çıktığı ilk ana kadar geçen süre; ikinci ko-primer etkinlik sonucu ise revaskülarizasyon prosedürünün (koroner, karotid veya periferal) veya kalp yetmezliği nedeniyle hastaneye yatışın veya ilk ko-primer sonuçlardan herhangi birinin ortaya çıktığı ilk ana kadar olan süredir.
İkincil sonlanımlar tüm nedenlere bağlı mortalite ve bir birleşik mikrovasküler sonlanımdır.
İnsülin glarjin standart bakım ile karşılaştırıldığında KV hastalık ve KV mortalite için rölatif riski değiştirmemiştir. İnsülin glarjin ve standart bakım arasında iki birincil sonlanım, bu sonlanımları oluşturan herhangi bir sonlanım bileşeni, tüm nedenlere bağlı mortalite ya da birleşik mikrovasküler sonlanım açısından fark saptanmamıştır.
Çalışma sonunda ortalama insülin glarjin dozu 0,42 U/kg olarak saptanmıştır. Başlangıçta katılımcıların medyan HbA1c değeri % 6,4 iken medyan HbA1c değer aralığı, tedavi sırasında insülin glarjin grubunda % 5,9- 6,4 ve izlem boyunca standart bakım grubunda % 6,2-6,6 bulunmuştur. Şiddetli hipoglisemi oranı (etkilenen katılımcı/yıllarca etkilenen 100 katılımcı) insülin glarjin grubunda 1,05 ve standart bakım grubunda 0,3; doğrulanmış ciddi olmayan hipoglisemi oranları sırasıyla 7,71 ve 2,44 olarak bildirilmiştir. 6 yıllık çalışma boyunca insülin glarjin grubunun % 42'sinde herhangi bir hipoglisemi olayı görülmemiştir.
Tedavideki son muayenede vücut ağırlığında başlangıca göre insülin glarjin grubunda ortalama 1,4 kg artış ve standart bakım grubunda ortalama 0,8 kg azalma saptanmıştır.
Pediyatrik popülasyon:
Randomize, kontrollü bir çalışmada, yaşları 6-15 arasında değişen tip 1 diyabetli pediyatrik hastalar (n=349), 28 hafta süreyle bazal-bolus insülin rejimiyle tedavi edildi; her öğünden önce regüler insan insülini uygulanmıştır. İnsülin glarjin günde bir kez yatmadan önce, NPH insan insülini günde bir veya iki kez uygulandı. Her iki tedavi grubunda glikohemoglobin ve
semptomatik hipoglisemi insidansı üzerinde benzer etkiler gözlenmiştir. Bununla beraber, insülin glarjin grubunda açlık plazma glukozunda başlangıç değerine göre gözlenen düşüş, NPH grubuna kıyasla daha fazla olmuştur. İnsülin glarjin grubunda gözlenen hipoglisemi de daha hafifmiş. Bu çalışmada insülin glarjinle tedavi edilen hastaların 143'ü, ortalama takip süresi 2 yıl olan kontrolsüz devam çalışmasında insülin glarjinle tedaviye devam etmiştir. İnsülin glarjinle tedavinin uzatıldığı bu dönemde, güvenlilikle ilgili yeni bir uyarı işareti saptanmamıştır.
Yaşları 12-18 arasında değişen, tip 1 diyabetli 26 adolesanın dahil edildiği çapraz bir çalışmada, insülin glarjin + insülin lispro, NPH + regüler insan insüliniyle karşılaştırılmıştır. Her bir tedavi, rastgele sıra ile 16 hafta süreyle uygulanmıştır. Yukarıda tanımlanan pediyatrik çalışmada olduğu gibi bu çalışmada da, başlangıç değerine kıyasla açlık plazma glukozunda gözlenen azalma, insülin glarjin grubunda NPH grubundan daha fazlaymış. HbA1c'de başlangıç değerine göre gözlenen değişiklikler her iki tedavi grubunda benzer bulunmuştur. Bununla beraber, gece boyunca kaydedilen kan glukozu değerleri, insülin glarjin/lispro grubunda, NPH/regüler grubuna kıyasla anlamlı derecede daha yüksekmiş (ortalama en düşük nokta sırasıyla 5,4 mM'ye karşılık 4,1 mM). Buna paralel olarak, noktürnal hipoglisemi insidansları insülin glarjin/lispro grubunda % 32, NPH/regüler grubunda % 52 olarak saptanmıştır.
Yaşları 2-6 arasında değişen tip 1 diabetes mellituslu 125 çocuğun dahil edildiği 24 haftalık paralel grup çalışmasında, günde bir kez sabahları uygulanan insülin glarjin ve günde bir veya iki kez bazal insülin olarak uygulanan NPH insülin karşılaştırılmıştır. Her iki gruba da yemeklerden önce bolus insülin verilmiştir.
Tüm hipoglisemilerde insülin glarjinin NPH'a üstünlüğünü gösteren birincil hedef sağlanmadı ve insülin glarjin hipoglisemi olaylarını arttırma trendi göstermiştir (insülin glarjin: NPH oranı (% 95 Cl) =1,18 (0,97-1,44).
Glikohemoglobin ve glukoz değişkenlikleri her iki tedavi grubunda benzer bulunmuştur. Bu
çalışmada güvenlilikle ilgili yeni bir uyarı işareti saptanmamıştır.
5.2. Farmakokinetik özellikler
Emilim:
Sağlıklı bireylerde ve diyabetik hastalarda, insülin glarjinin subkütan enjeksiyonunu takiben, serum insülin konsantrasyonları insan NPH insülinine kıyasla daha yavaş ve çok daha uzun süreli absorpsiyon olduğunu ve bir doruk olmadığını göstermiştir. Dolayısıyla, konsantrasyonlar insülin glarjinin farmakodinamik aktivitesinin zaman profiliyle uyumlu bulunmuştur. Şekil 1'deki grafik insülin glarjin ve NPH insülinin zamana göre aktivite profilini göstermektedir.
Dağılım:
Günde bir kez enjekte edilen insülin glarjin, ilk dozdan sonraki 2-4 gün içinde kararlı durum düzeyine ulaşır.
Biyotransformasyon:
Diyabetik hastalarda subkütan insülin glarjin enjeksiyonundan sonra, insülin glarjin Beta zincirinin karboksil ucunda hızla metabolize olarak, iki aktif metabolit olan M1 (21A-Gly- insülin) ve M2 (21A-Gly-des-30B-Thr-insülin) oluşmaktadır. Plazmada, dolaşımdaki başlıca bileşik M1 metabolitidir. M1'e maruziyet uygulanan insülin glarjin dozuyla birlikte artar. Farmakokinetik ve farmakodinamik bulgular, insülin glarjin ile subkütan enjeksiyonun etkisinin esas olarak M1'e maruziyete dayandığını göstermektedir. İnsülin glarjin ve M2
metaboliti bireylerin büyük çoğunluğunda saptanabilir düzeyde bulunmamıştır ve saptanabildiklerinde de konsantrasyonlarının uygulanan insülin glarjin dozundan bağımsız olduğu bulunmuştur.
Eliminasyon:
İntravenöz yoldan uygulandığında insülin glarjin ve insan insülininin eliminasyon yarılanma ömrü karşılaştırılabilir.
Doğrusallık/doğrusal olmayan durum:
İnsülin glarjinin konsantrasyonları, farmakodinamik aktivitesinin zaman profiliyle uyumlu bulunmuştur.
Hastalardaki karakteristik özellikler
Yaş ve cinsiyet:
Klinik çalışmalarda yaş ve cinsiyete dayanan alt-grup analizleri, insülin glarjin ile tedavi edilen hastalarla bütün araştırma popülasyonu karşılaştırıldığında, güvenlilik ve etkililik açısından herhangi bir farklılık göstermemiştir.
Pediyatrik popülasyon:
Yaşları 2-6 arasında değişen tip 1 diabetes mellituslu çocuklardaki farmakokinetik özellikler bir klinik çalışmada değerlendirilmiştir (bkz. Bölüm 5.1). İnsülin glarjinle tedavi edilen çocuklarda, insülin glarjinin ve aktif metabolitleri olan M1 ve M2'nin plazma “çukur†(vadi) düzeyleri ölçülmüş, plazma konsantrasyonu değerlerinin erişkinlerle benzer olduğu ve kronik kullanımda insülin glarjinin veya metabolitlerinin birikme eğilimi göstermediği saptanmıştır.
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi veriler konvansiyonel güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesi ile ilgili çalışmalar baz alındığında insanlar için özel bir tehlike göstermemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Çinko klorür M-krezol Gliserin
Sodyum hidroksit veya hidroklorik asit Enjeksiyonluk su
6.2. Geçimsizlikler
GLARİN diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
Kartuşun ilk kullanımdan sonraki raf ömrü
Direkt ışıktan ve sıcaklıktan korumak şartıyla, tıbbi ürün maksimum 4 hafta süre ile 25°C'nin altında saklanabilir. Kartuş içeren kalem buzdolabında saklanmamalıdır.
Her enjeksiyondan sonra ışıktan korumak için kalemin kapağı tekrar yerine takılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
Kullanılmamış kartuşlar Buzdolabında (2-8°C'de) saklayınız. Dondurmayınız.
GLARİN'in buzdolabında dondurucu bölme veya soğutma paketi ile doğrudan temasını önleyiniz.
Kartuşları ışıktan korumak için dış karton kutusunda saklayınız. Kullanımdaki kartuşlar
Saklama koşulları için bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Siyah tapa (bromobütil kauçuk) ve başlık (flençli alüminyum) ve kapak (bromobütil veya
izopren kauçuk) içeren kartuşlarda (Tip I, renksiz, cam) 3 m mL çözelti. 5 kartuş içeren ambalajları bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kartuş kullanmadan önce, 1-2 saat süre ile oda sıcaklığında tutulmalıdır.
Kartuş kullanılmadan önce incelenmelidir. Çözelti sadece berrak, renksiz ve görülebilir katı partikül içermeyen ve su benzeri görünüme sahip ise veya su benzeri görünümdeyse kullanılmalıdır. GLARİN çözelti olduğu için, kullanılmadan önce yeniden süspansiyon haline getirilmesi gerekmemektedir.
GLARİN başka bir insülinle karıştırılmamalı veya seyreltilmemelidir. Karıştırma veya
seyreltme, zaman/etki profilini değiştirebilir ve karıştırma ürünün çökmesine yol açabilir. Boş kalemler asla yeniden kullanılmamalıdır ve uygun bir şekilde atılmalıdır.
Herhangi bir kontaminasyonu önlemek için, her bir kullanıma hazır dolu enjeksiyon kalemi
yalnız bir hasta tarafından kullanılmalıdır.
İnsülin glarjin ve diğer insülinler arasındaki ilaç kullanım yanlışlığını önlemek için insülin
etiketi her enjeksiyon öncesi kontrol edilmelidir (bkz. Bölüm 4.4).
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve
“Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| GLARIN | 869828950141 | |
| LANTUS | 8699809950634 | 1,118.16TL |
| TOUJEO | 8699809950863 | 1,787.24TL |
| Diğer Eşdeğer İlaçlar |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Koçak Farma İlaç ve Kimya Sanayi A.Ş.
| Satış Fiyatı | 670.25 TL [ 22 Sep 2023 ] |
| Önceki Satış Fiyatı | 670.25 TL [ 15 Sep 2023 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699828950141 |
| Etkin Madde | Insulin Glarjin |
| ATC Kodu | A10AE04 |
| Birim Miktar | 100 |
| Birim Cinsi | IU |
| Ambalaj Miktarı | 5 |
| Sindirim Sistemi ve Metabolizma > İnsülinler ve Analogları > İnsülin Glargine |
| Yerli ve Beşeri bir ilaçdır. |