GLIVEC 400 mg 30 film kaplı tablet Farmakolojik Özellikler
{ Imatinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, BCR-ABL tirozin kinaz inhibitörleri
ATC kodu: L01EA01
Etki mekanizması:
İmatinib küçük bir molekül yapısına sahip bir protein-tirozin kinaz inhibitörüdür; Bcr- Abl tirozin kinaz (TK) aktivitesini ve birçok reseptör TK'yı kuvvetli bir şekilde inhibe etmektedir: KIT, c-KIT proto-onkogen tarafından kodlanan kök hücre faktörü (Stem cell factor – SCF) reseptörü, diskoidin etki bölgesine ait reseptörler (DDR1 ve DDR2), koloni uyarıcı faktör reseptörü (CSF-1R), trombosit kökenli büyüme faktörü (Platelet derived growth factor – PDGF) reseptörleri alfa ve beta (PDGFR-alfa ve PDGFR-beta). İmatinib aynı zamanda bu reseptör kinazların aktivasyonunun aracılık ettiği hücresel olayları da inhibe edebilmektedir.
Farmakodinamik etkiler:
İmatinib, Bcr-Abl tirozin kinazı in vitro, hücresel ve in vivo seviyelerde güçlü bir şekilde inhibe eden bir protein-tirozin kinaz inhibitörüdür. Bileşik, Philadelphia kromozomu pozitif KML ve akut lenfoblastik lösemi (ALL) hastalarından alınan taze lösemik hücrelerin yanı sıra Bcr-Abl pozitif hücre dizilerinde proliferasyonu seçici olarak inhibe eder ve apoptozu indükler.
Bileşik, in vivo olarak, Bcr-Abl pozitif tümör hücreleri kullanılan hayvan modellerinde
tek ajan olarak anti-tümör aktivite gösterir.
İmatinib, aynı zamanda trombosit türevi büyüme faktörü (Platelet derived growth factor – PDGF), PDGF-R ve kök hücre faktörü (Stem cell factor – SCF), c-KIT tirozin kinazların reseptörü için bir inhibitördür ve PDGF- ve SCF- aracılı hücresel olayları inhibe eder. In vitro olarak, imatinib, aktive edici bir KIT mutasyonunu ekspres eden GIST hücrelerinde proliferasyonu inhibe eder ve apopitozu uyarır. PDGF reseptörünün veya Abl protein tirozin kinazların çeşitli ortak proteinlere füzyonunun veya yapısal PDGF üretiminin bir sonucu olan yapısal aktivasyonun, MDS/MPD, HES/CEL ve DFSP'nin patojenezinde rol oynadığı öne sürülmüştür. Ayrıca, c-KIT ya da PDGFR'nin konstitütif aktivasyonu SM'nin patojenezinde rol oynayan muhtemel nedendir. İmatinib, düzensiz PDGFR veya Abl kinaz aktivitesinin yönlendirdiği sinyalizasyonu ve hücre proliferasyonunu inhibe eder.
Kronik Miyeloid Lösemide Klinik Çalışmalar
GLİVEC'in etkinliği, bir bütün olarak elde edilen hematolojik ve sitogenetik yanıt oranlarını ve hastalıksız sağkalım süresini temel alır. Yeni tanı almış kronik faz KML harici, hastalık ilişkili semptomların iyileşmesi veya sağkalım süresinin artması gibi klinik faydaların olduğunu gösteren kontrollü çalışma yoktur.
İleri evre, blast veya hızlandırılmış faz hastalıkta Philadelphia kromozomu pozitif (Ph +) KML, diğer Ph + lösemiler veya kronik fazda KML'si olan fakat daha önce interferon- alfa (IFN) tedavide başarısız olunan hastalarda üç büyük, uluslararası, açık etiketli, kontrollü olmayan Faz II çalışma yapılmıştır. Yeni tanı almış Ph + KML hastalarında büyük, açık etiketli, çok merkezli, uluslararası, randomize bir Faz III çalışma yürütülmüştür. Ek olarak, iki Faz I çalışmada ve bir Faz II çalışmada çocuklar tedavi edilmiştir.
Tüm klinik çalışmalarda hastaların %38-40'ı ≥ 60 yaşında ve hastaların %10-12'si ≥ 70 yaşındadır.
Kronik faz, yeni tanı konulmuş: Erişkin hastalarda yapılan bu faz III çalışmada, tek ajan GLİVEC veya interferon-alfa (IFN) artı sitarabin (Ara-C) kombinasyonu ile tedavi karşılaştırılmıştır. Yanıtsızlık (6 ayda tam hematolojik yanıt (THY) olmaması, artan WBC, 24 ayda majör sitogenetik yanıt (MSY) olmaması), yanıt kaybı (THY veya MSY kaybı) veya tedaviye şiddetli intolerans gösteren hastaların alternatif tedavi koluna geçmelerine izin verilmiştir. GLİVEC kolunda hastalar, günlük 400 mg ile tedavi edilmiştir. IFN grubunda, hastalar 10 gün / ay boyunca subkutan Ara-C 20 mg / m2 / gün ile kombinasyon halinde subkutan olarak 5 MIU / m2 / gün hedef IFN dozu ile tedavi edilmiştir.
Toplam 1106 (her grupta 553) hasta, randomize edilmiştir. İki kol arasında çalışma başlangıcı özellikleri iyi düzeyde dengelenmiştir. Medyan yaş 51 yıl (aralık 18-70 yıl) olup, hastaların % 21,9'u 60 yaşında veya üzerindedir. % 59'u erkek ve % 41'i kadın; % 89,9'u beyaz ve % 4,7'si siyahi hastalardan oluşmuştur. Son hastanın çalışmaya alınmasından yedi yıl sonra, GLİVEC ve IFN kollarında medyan birinci basamak tedavi süresi sırasıyla 82 ve 8 ay olmuştur. GLİVEC ile ikinci basamak tedavinin medyan süresi 64 aydır. Genel olarak, birinci basamak olarak GLİVEC alan hastalarda verilen ortalama günlük doz, 406±76 mg'dır. Çalışmanın primer etkililik sonlanım noktası, progresyonsuz sağkalımdır. Progresyon, aşağıdaki olaylardan herhangi biri olarak tanımlanmıştır: hızlanmış faz veya blast krizine progresyon, ölüm, THY veya MSY kaybı ya da uygun terapötik tedaviye rağmen bir CHR'ye ulaşamayan hastalarda WBC artışı. Majör sitogenetik yanıt, hematolojik yanıt, moleküler yanıt (minimal rezidüel
hastalığın değerlendirilmesi), hızlandırılmış faza veya blast krizine kadar geçen süre ve hayatta kalma, ana sekonder sonlanım noktalardır. Yanıt verileri Tablo 4'te gösterilmektedir.
Tablo 4: Yeni tanı konulan KML çalışmasındaki yanıtlar (84 aylık veri)
| GLİVEC | IFN+Ara-C |
(En iyi yanıt oranları) | n=553 | n=553 |
Hematolojik yanıt |
|
|
THY oranı n (%) | 534 (%96,6)* | 313 (%56,6)* |
[%95 güven aralığı] | %94,7, %97,9 | %52,4, %60,8 |
Sitogenetik yanıt |
|
|
Majör yanıt n (%) | 490 (%88,6)* | 129 (%23,3)* |
[%95 güven aralığı] | [%85,7, %91,1] | [%19,9, %27,1] |
Tam CyR n (%) | 456 (%82,5)* | 64 (%11,6)* |
Kısmi CyR n (%) | 34 (%6,1) | 65 (%11,8) |
Moleküler Yanıt** |
|
|
12 aydaki majör yanıt (%) | 153/305=%50,2 | 8/83=%9,6 |
24 aydaki majör yanıt (%) | 73/104=%70,2 | 3/12=%25 |
84 aydaki majör yanıt (%) | 102/116=%87,9 | 3/4=%75 |
* p<0,001, Fischer's exact test **Moleküler yanıt oranları erişilebilir örneklere bağlıdır. Hematolojik yanıt kriterleri (bütün yanıtlar 4 hafta sonra doğrulanmalıdır): Kandaki WBC sayısı < 10 x10/l, trombosit sayısı < 450 x10/l, miyelosit+metamiyelosit < %5; kanda blast hücresi veya promiyelositler yok, bazofiller <%20, ekstramedüller tutulum yok Sitogenetik yanıt kriterleri: tam (%0 Ph+ metafazlar), kısmi (%1-35), minör (%36-65) veya minimal (%66-95). Majör yanıt (%0-35), hem kısmi hem tam yanıtları içerir. Majör moleküler yanıt kriterleri: Standart bir başlangıç değeri üzerinden Bcr-Abl transkriptlerinin miktarında (gerçek zamanlı kantitatif ters transkriptaz PCR testi ile ölçülür) ≥ 3 logaritmalık periferik kan azalmasında. | ||
Birinci basamak tedavide tam hematolojik yanıt, majör sitogenetik yanıt ve tam sitogenetik yanıt oranları, son muayene tarihinde yanıtsızlıkların sansürlendiği Kaplan- Meier yaklaşımı kullanılarak hesaplanmıştır. Bu yaklaşım kullanıldığında, GLİVEC ile birinci basamak tedavi için hesaplanan kümülatif yanıt oranları 12 aylık tedaviden 84 aylık tedaviye şu şekilde düzelme göstermiştir: THY %96,4'ten %98,4'e ve TSY
%69,5'ten %87,2'ye.
7 yıllık takipte, GLİVEC grubunda 93 (%16,8) progresif olay olmuştur: 37 (%6,7) hızlanmış faz/blastik kriz (AF/BK) ilerleme, 31 (%5,6) major sitogenetik yanıt (MSY) kaybı, 15 (%2,7) tam hematolojik yanıt (THY) kaybı ya da WBC (beyaz kan hücresi) artışı ve 10 (%1,8) KML ile ilişkisiz ölüm. Buna karşılık IFN+Ara-C grubunda 165 (%29,8) olay olmuş ve bunların 130'u birinci seçenek IFN+Ara-C tedavisi sırasında meydana gelmiştir.
84 ayda akselere faz veya blast krizine ilerlemeyen hastaların tahmini oranı, IFN koluna kıyasla GLİVEC kolunda önemli ölçüde daha yüksekti (%92,5'e karşı %85, p<0.001). Tedavide geçen süre ile birlikte hızlandırılmış faza veya blast krizine yıllık progresyon
oranı azalmış ve dördüncü ve beşinci yıllarda yıllık % 1'den az olmuştur. 84 ayda progresyonsuz sağkalım tahmini oranı GLİVEC grubunda % 81,2 ve kontrol grubunda
% 60,6 bulunmuştur (p <0,001). GLİVEC için herhangi bir türdeki yıllık progresyon oranları da zamanla azalmıştır.
GLİVEC ve IFN+Ara-C gruplarında, sırasıyla, toplam 71 (%12,8) ve 85 (%15,4) hasta ölmüştür. 84 ayda randomize GLİVEC ve IFN+Ara-C gruplarında tahmin edilen genel sağkalım, sırasıyla %86,4'e (83, 90) karşı %83,3 (80, 87) düzeyindedir (p=0,073, log- rank testi). Bu olaya kadar geçen zaman sonlanım noktası, IFN + Ara-C'den GLİVEC'e yüksek geçiş oranından büyük ölçüde etkilenir.
GLİVEC tedavisinin kronik fazdaki, yeni tanı konulmuş KML'deki sağkalım etkisi, aynı rejimde IFN+Ara-C (n=325) kullanılan başka bir Faz III çalışmadan elde edilen birincil verilerle birlikte yukarıda belirtilen GLİVEC verilerinin retrospektif analizinde ayrıntılı olarak incelenmiştir. Bu retrospektif analizde, genel sağkalım bakımından GLİVEC'in IFN+Ara-C karşısındaki üstünlüğü kanıtlanmıştır (p<0,001); 42 ay içinde 47 (%8,5) GLİVEC hastası ve 63 (%19,4) IFN+Ara-C hastası ölmüştür.
GLİVEC tedavisindeki hastalarda sitogenetik yanıt ve moleküler yanıt derecesi, uzun dönem sonuçlar üzerinde açık bir etkiye sahip olmuştur. 12 ayda TSY'si (KSY) olan hastaların tahmini %96'sında (%93) 84 ayda akselere faza/blast krizine progresyon olmazken 12 ayda MSY'si olmayan hastaların sadece %81'inde 84 ayda ilerlemiş KML'ye progresyon olmadığı görülmüştür (genel p<0,001, TSY ile KSY arasında p=0,25). 12 ayda Bcr-Abl transkriptlerinde en az 3 logaritmalık azalması olan hastalarda akselere faza/blast krizine progresyonsuz kalma olasılığı 84 ayda %99 bulunmuştur. 18 aylık dönüm noktası analizine dayanılarak benzer bulgular tespit edilmiştir.
Bu çalışmada günde 400 mg'dan 600 mg'a, ardından günde 600 mg'dan 800 mg'a doz artırımlarına izin verilmiştir. 42 aylık izlem sonrasında 11 hasta sitogenetik yanıtlarında doğrulanmış bir kayıp (4 hafta içinde) deneyimlemiştir. Bu 11 hastanın 4'ünde doz günde 800 mg'a artırılmış olup hastaların 2'si sitogenetik yanıtı tekrar elde etmiş (1'inde kısmi, 1'inde tam; tam yanıt elde eden ayrıca moleküler yanıta da ulaşmıştır), diğer yandan dozları artırılmayan 7 hastanın sadece biri tam sitogenetik yanıtı tekrar elde etmiştir. Doz artırımı öncesindeki hasta popülasyonu (n=551) ile karşılaştırıldığında, dozun günde 800 mg'a yükseltildiği 40 hastada bazı advers reaksiyonların yüzdesi daha yüksek olmuştur. Daha sık görülen advers reaksiyonlar gastrointestinal hemorajileri, konjonktivit ve transaminazlar veya bilirubinde yükselmeyi içermiştir. Diğer advers olaylar daha düşük ya da eşit sıklıkla bildirilmiştir.
Kronik faz, interferon başarısızlığı: 532 hasta, 400 miligramlık başlangıç dozuyla tedavi edilmiştir. Bu hastalar; hematolojik başarısızlık (%29), sitogenetik başarısızlık (%35) veya interferon intoleransı (%36) olmak üzere başlıca 3 gruba ayrılmıştır. Hastalar daha önce medyan 14 ay boyunca ≥25 x 106 IU/hafta dozlarda IFN tedavisi görmüştür ve hepsi de geç kronik fazdadır; tanıdan itibaren geçen medyan süre 32 aydır. Çalışmanın birincil etkililik değişkeni majör sitogenetik yanıt oranıdır (tam yanıt artı kısmı yanıt, kemik iliğinde %0 ila %35 Ph+ metafaz).
Bu çalışmada hastaların %65'i bir majör sitogenetik yanıta ulaşmıştır; hastaların
%53'ünde (doğrulanmış %43) yanıt tamdır (Tablo 3). Hastaların %95'inde tam hematolojik yanıta ulaşılmıştır.
Hızlanmış faz: Hızlanmış faz hastalığı olan 235 yetişkin hasta kaydedilmiştir. İlk 77'sinde tedaviye günde 400 mg ile başlanmıştır; daha sonra çalışma protokolü, daha yüksek GLİVEC dozlarının kullanılmasına olanak tanıyacak şekilde düzenlenmiş ve geriye kalan 158 hasta, başlangıçta 600 mg GLİVEC kullanmıştır.
Birincil etkililik değişkeni, ya tam hematolojik yanıt, lösemi kanıtı olmaması (yani ilik ve kandan blastların temizlenmesi, fakat tam yanıtlar için tüm periferik kan parametrelerinde iyileşme olmaması) ya da kronik faz KML'ye geri dönüş olarak rapor edilen hematolojik yanıt oranı olmuştur. Doğrulanmış hematolojik yanıt, hastaların % 71,5'inde elde edilmiştir (Tablo 3). Önemli olarak, hastaların %27,7'si aynı zamanda majör bir sitogenetik yanıt elde etmiş olup bunların %20,4'ünde (%16 doğrulanmıştır) yanıt tam olmuştur. 600 mg ile tedavi edilen hastalar için, medyan progresyonsuz sağkalım ve genel sağkalım için mevcut tahminler sırasıyla 22,9 ve 42,5 aydır.
Miyeloid blast krizi: Miyeloid blast krizi olan 260 hasta kaydedilmiştir. Bu hastaların 95'i (%37'si), hızlanmış faz veya yine blast krizi nedeniyle daha önce de kemoterapi görmüştür (“önceden tedavi edilmiş olan hastalarâ€), 165 (%63) hastada ise daha önce kemoterapi uygulanmamıştır (“önceden tedavi edilmemiş olan hastalarâ€). İlk 37 hastaya
400 mg ile başlanmış, daha sonra protokol daha yüksek doza izin verecek şekilde değiştirilmiş ve geri kalan 223 hastaya 600 mg başlanmıştır.
Primer etkililik değişkeni, hızlanmış faz çalışmasında olduğu gibi aynı kriterler kullanılarak tam hematolojik yanıt, lösemi kanıtının mevcut olmaması veya kronik faza dönüş olarak tanımlanan, hematolojik yanıt oranı olmuştur. Bu çalışmada hastaların
%31'inde hematolojik yanıt elde edilmiştir (daha önce tedavi görmemiş hastalarda %36, daha önce tedavi görmüş hastalarda %22). 600 mg GLİVEC kullanan hastalardaki hematolojik yanıt oranı, 400 mg GLİVEC kullanmış olanlara kıyasla daha yüksektir (%16'ya karşılık %33, p=0,0220). Daha önceden tedavi edilmemiş ve tedavi edilmiş hastaların mevcut medyan ortalama sağkalımı sırasıyla 7,7 ve 4,7 aydır.
Lenfoid blast krizi: Faz I çalışmalara sınırlı sayıda hasta kaydedilmiştir (n=10). Hematolojik yanıt oranı, 2-3 aylık süre ile %70 bulunmuştur.
Tablo 5: Yetişkin KML çalışmalarında elde edilen yanıtlar
| Çalışma 0110 37 aylık veri Kronik faz, IFN başarısızlığı (n=532) | Çalışma 0109 40,5 aylık veri Hızlanmış faz (n=235) | Çalışma 0102 38 aylık veri Miyeloid blast krizi (n=260) |
| Hastaların yüzdesi (GA) | ||
Hematolojik yanıt | % 95 (92,3-96,3) | % 71 (65,3-77,2) | % 31 (25,2-36,8) |
Tam hematolojik yanıt (THY) | % 95 | % 42 | % 8 |
Lösemi kanıtı yok (NEL) | - | % 12 | % 5 |
Kronik faza dönüş (RTC) | - | % 17 | % 18 |
Majör sitogenetik yanıt | % 65 (61,2-69,5) | % 28 (22-33,9) | %15 (11,2-20,4) |
Tam | % 53 | % 20 | % 7 |
(Onaylanmış) [% 95 GA] Kısmi | % 43 (38,6-47,2) % 12 | % 16 (11,3-21) % 7 | % 2 (0,6-4,4) % 8 |
| Çalışma 0110 37 aylık veri Kronik faz, IFN başarısızlığı (n=532) | Çalışma 0109 40,5 aylık veri Hızlanmış faz (n=235) | Çalışma 0102 38 aylık veri Miyeloid blast krizi (n=260) |
THY: çalışma 0110 [kandaki WBC <10 x10/l, trombosit sayısı <450 x10/l, miyelosit + metamiyelosit <5% ; kanda blast veya promiyelosit yok; bazofiller < %20, ekstramedüller tutulum yok] ve çalışma 0102 ve 0109 [ANC1,5 x10/l, trombosit sayısı 100 x10/l, kanda blast hücresi yok, BM blast hücresi <%5 ve ekstramedüller hastalık yok] NEL: THY ile aynı kriterler; yalnızca ANC 1 x10/l ve trombosit sayısı 20 x10/l (sadece 0102 ve 0109) RTC: BM ve PB blast hücresi<%15; PM ve PB blast hücresi + promiyelosit Oranı <%30, PB bazofil oranı <%20, dalak ve karaciğer hariç ekstramedüller hastalık yok (sadece 0102 ve 0109 için). BM = kemik iliği, PB = periferik kan Majör yanıtta hem tam hem de kısmi yanıtlar birleştirmiştir: tam (%0 Ph+ metafazı), kısmi (%1–35) | |||
Pediyatrik popülasyon: Kronik faz KML'si (n=11) veya blast krizi aşamasında KML'si ya da Ph+ akut lösemileri (n=15) olan, 18 yaş altı toplam 26 pediyatrik hasta bir faz I doz yükseltme çalışmasına kaydedilmiştir. Bu, yoğun ön tedavi görmüş hastalardan oluşan bir popülasyondur: hastaların %46'sı önceden BMT ve %73'ü önceden çoklu ajanlı kemoterapi görmüştür. Hastalar 260 mg/m2/gün (n=5), 340 mg/m2/gün (n=9), 440 mg/m2/gün (n=7) ve 570 mg/m2/gün (n=5) GLİVEC dozları ile tedavi edilmiştir. Kronik faz KML'si ve mevcut sitogenetik verileri olan 9 hastadan 4'ü (%44) ve 3'ü (%33)
%77'lik bir MSY oranıyla sırasıyla tam ve kısmi sitogenetik yanıt elde etmiştir.
Yeni tanı almış ve tedavi edilmemiş, kronik fazda KML'si olan toplam 51 pediyatrik hasta açık-etiketli, çok merkezli, tek kollu bir faz II çalışmaya kaydedilmiştir. Hastalar 340 mg/m2/gün GLİVEC ile tedavi edilmiş, doz sınırlayıcı toksisitesi hariç ara verilmemiştir. GLİVEC tedavisi yeni tanı konmuş pediyatrik KML hastalarında, 8 haftalık tedavi sonrasında %78 THY oranı ile hızlı yanıt sağlamaktadır. Yüksek THY oranına, hastaların %65'inde tam sitojenik yanıt (TSY) gelişimi eşlik etmiş olup bu oran, erişkinlerde gözlenen sonuç ile karşılaştırılabilir niteliktedir. Ek olarak, hastaların
%16'sında kısmı sitojenik yanıt (KSY) gözlenmiş, bu da %81 MSY değerini vermiştir. TSY'ye ulaşan hastaların büyük çoğunluğu, Kaplan-Meier tahmine dayalı 5,6 aylık yanıta kadar geçen medyan süre ile TSY'ye 3 ila 10'uncu aylar arasında ulaşmıştır.
Avrupa İlaç Ajansı, Philadelphia kromozomu (bcr-abl translokasyon) pozitif kronik faz kronik miyeloid lösemide pediyatrik popülasyonun tüm alt kümelerinde GLİVEC ile çalışmaların sonuçları sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım ile ilgili bilgi için bkz. Bölüm 4.2).
Ph+ ALL için klinik çalışmalar
Yeni teşhis edilen Ph+ ALL:
İmatinibin, 55 yaş ve üzeri yeni tanı almış 55 hastada kemoterapi indüksiyonuyla karşılaştırıldığı kontrollü bir çalışmada (ADE10), tek ajan olarak kullanılan imatinib, kemoterapiye kıyasla anlamlı derecede daha yüksek tam hematolojik yanıt oranı ile sonuçlanmıştır (%96,3'e karşılık %50, p=0,0001). Kemoterapiye yanıt vermeyen veya zayıf yanıt veren hastalarda imatinib kurtarma tedavisi olarak kullanıldığında, 11 hastanın 9'unda (%81,8) tam hematolojik yanıt elde edilmiştir. Bu klinik etki, 2 haftalık tedaviden sonra, kemoterapi kolu ile karşılaştırıldığında imatinib ile tedavi edilen hastalarda, bcr-abl transkriptlerinde daha büyük bir azalmayla ilişkilendirilmiştir (p=0,02). Tüm hastalar indüksiyon sonrasında imatinib ve konsolidasyon kemoterapisi almış (bkz. Tablo 4) ve bcr-abl transkriptlerinin düzeyleri sekizinci haftada iki kolda aynı olmuştur. Çalışma tasarımı doğrultusunda beklendiği üzere, iki grup arasında remisyon süresi, hastalıksız sağkalım veya genel sağkalım açısından herhangi bir fark gözlenmemiş, ancak tam moleküler yanıt elde edilen ve minimal rezidüel hastalık düzeyinde kalan hastalarda gerek remisyon süresi (p=0,01) gerekse hastalıksız sağkalım (p=0,02) bakımından sonuçlar daha iyi olmuştur.
Kontrol gruplarına yer verilmeyen dört klinik çalışmada (AAU02, ADE04, AJP01 ve AUS01) yeni tanı almış 211 Ph+ ALL hastasından oluşan bir popülasyonda gözlenen sonuçlar, yukarıda tarif edilen sonuçlar ile uyumludur. Kemoterapi indüksiyonu ile kombinasyon halindeki imatinib (bkz. Tablo 4) %93'lük bir tam hematolojik yanıt oranı (değerlendirilebilir 158 hastanın 147'si) ve %90'lık bir majör sitogenetik yanıt oranı (değerlendirilebilir 21 hastanın 19'u) sonuçlarını vermiştir. Tam moleküler yanıt oranı
%48 bulunmuştur (değerlendirilebilir 102 hastanın 49'u). Hastalıksız sağkalım (DFS) ve genel sağkalım (OS) her durumda 1 yılı geçmiştir ve iki çalışmadaki (AJP01 ve AUS01) geçmiş kontrolden üstün olmuştur (DFS p<0,001; OS p<0,0001).
Tablo 6: İmatinible kombinasyon halinde kullanılan kemoterapi rejimi
Çalışma ADE10 | |
Faz öncesi | DEX 10 mg/m oral, gün 1-5; CP 200 mg/m i.v., gün 3, 4, 5; MTX 12 mg intratekal, gün 1 |
Remisyon indüksiyonu | DEX 10 mg/m oral, gün 6-7, 13-16; VCR 1 mg/m i.v., gün 7, 14; IDA 8 mg/m i.v. (0,5 h), gün 7, 8, 14, 15; CP 500 mg/m i.v. (1 h), gün 1; Ara-C 60 mg/m i.v., gün 22-25, 29-32 |
Konsolidasyon tedavisi I, III, V | MTX 500 mg/m i.v. (24 h), gün 1, 15; 6-MP 25 mg/m oral, gün 1-20 |
Konsolidasyon tedavisi II, IV | Ara-C 75 mg/m i.v. (1 h), gün 1-5; VM26 60 mg/m i.v. (1 h), gün 1-5 |
Çalışma AAU02 | |
İndüksiyon tedavisi (de novo Ph+ ALL) | Daunorubisin 30 mg/m i.v., gün 1-3, 15-16; VCR 2 mg toplam doz i.v., gün 1, 8, 15, 22; CP 750 mg/m i.v., gün 1, 8; Prednizon 60 mg/m oral, gün 1-7, 15-21; IDA 9 mg/m oral, gün 1-28; MTX 15 mg intratekal, gün 1, 8, 15, 22; Ara-C 40 mg intratekal, gün 1,8, 15, 22; Metilprednizolon 40 mg intratekal, gün 1, 8, 15, 22 |
Konsolidasyon (de novo Ph+ ALL) | Ara-C 1000 mg/m/12 h i.v. (3 h), gün 1-4; Mitoksantron 10 mg/m i.v., gün 3-5; MTX 15 mg intratekal, gün 1; |
| Metilprednizolon 40 mg intratekal, gün 1 |
Çalışma ADE04 | |
Faz öncesi | DEX 10 mg/m oral, gün 1-5; CP 200 mg/m i.v., gün 3-5; MTX 15 mg intratekal, gün 1 |
İndüksiyon tedavisi I | DEX 10 mg/m oral, gün 1-5; VCR 2 mg i.v., gün 6, 13, 20; Daunorubisin 45 mg/m i.v., gün 6-7, 13-14 |
İndüksiyon tedavisi II | CP 1 g/m i.v. (1 h), gün 26, 46; Ara-C 75 mg/m i.v. (1 h), gün 28-31, 35-38, 42-45; 6-MP 60 mg/m oral, gün 26-46 |
Konsolidasyon tedavisi | DEX 10 mg/m oral, gün 1-5; Vindesine 3 mg/m i.v., gün 1; MTX 1,5 g/m i.v. (24 h), gün 1; Etoposide 250 mg/m i.v. (1 h) gün 4-5; Ara-C 2 x 2 g/m i.v. (3 h, q 12 h), gün 5 |
Çalışma AJP01 | |
İndüksiyon tedavisi | CP 1,2 g/m i.v. (3 h), gün 1; Daunorubisin 60 mg/m i.v. (1 h), gün 1-3; Vinkristin 1,3 mg/m i.v., gün 1, 8, 15, 21; Prednizolon 60 mg/m/gün oral |
Konsolidasyon tedavisi | Değişimli kemoterapi kürü: MTX 1 g/m i.v. (24 h) gün 1 ile yüksek kemoterapi ve 4 siklus boyunca Ara-C 2 g/m i.v. (q 12 h), gün 2-3 |
İdame | VCR 1,3 g/m i.v., gün 1; Prednizolon 60 mg/m oral, gün 1-5 |
Çalışma AUS01 | |
İndüksiyon- konsolidasyon tedavisi | Hyper-CVAD rejimi: CP 300 mg/m i.v. (3 h, q 12 h), gün 1-3; Vinkristin 2 mg i.v., gün 4, 11; Doksorubisin 50 mg/m i.v. (24 h), gün 4; Değişimli olarak DEX 40 mg/gün gün 1-4 ve 11-14 ya da MTX 1 g/m i.v. (24 h) gün 1 ve Ara-C 1 g/m i.v. (2 h, q 12 h), gün 2-3 (toplam 8 kür). |
İdame | 13 ay boyunca aylık olarak VCR 2 mg i.v.; Prednizolon 200 mg oral, 13 ay boyunca ayda 5 gün |
Tüm tedavi rejimleri CNS profilaksisi için steroid uygulaması içermelidir. | |
Ara-C: sitozin arabinozid; CP: siklofosfamid; DEX: deksametazon; MTX: metotreksat; 6-MP: 6-merkaptopürin; VM26: Teniposit; VCR: vinkristin; IDA: idarubisin; i.v.: intravenöz. | |
Pediyatrik popülasyon: I2301 çalışmasında, Ph+ ALL'si olan toplam 93 pediyatrik, ergen ve genç yetişkin hasta (1 ila 22 yaşları arasında) açık etiketli, çok merkezli, sıralı gruplu, randomize olmayan bir faz III çalışmaya kaydedilmiş ve indüksiyon tedavisinden sonra yoğun kemoterapi ile kombinasyon halinde GLİVEC (340 mg/m2/gün) ile tedavi edilmiştir. GLİVEC, 1-5 arası kohortlarda aralıklı olarak uygulanmış, kohorttan kohorta süre artmış ve GLİVEC daha erken başlamıştır: en düşük yoğunlukta GLİVEC'i grup 1 ve en yüksek yoğunlukta GLİVEC'i grup 5 almıştır (ilk kemoterapi kürleri sırasında sürekli günlük GLİVEC dozlaması ile gün cinsinden en uzun süre). Kohort 5 hastalarında (n=50) kemoterapi ile kombinasyon halinde tedavi kürünün erken dönemlerinde GLİVEC'e sürekli günlük maruziyet, GLİVEC'siz standart kemoterapinin uygulandığı tarihsel kontrollerle (n=120) karşılaştırıldığında 4 yıllık
olaysız sağkalımı (EFS) artırmıştır (sırasıyla %69,6'ya karşılık %31,6). Kohort 5 hastalarında tahmini 4 yıllık GS, tarihsel kontrollerdeki %44,8 değeri ile karşılaştırıldığında %83,6 olmuştur.
Kohort 5'teki 50 hastadan 20'si (% 40) hematopoietik kök hücre nakli almıştır.
Tablo 7: Çalışma I2301'de imatinib ile kombinasyon halinde kullanılan kemoterapi rejimi
Konsolidasyon bloğu 1 (3 hafta) | VP-16 (100 mg/m/gün, IV): 1-5. günler İfosfamid (1,8 g/m/gün, IV): 1-5. günler MESNA (3 saatte bir 360 mg/m/doz, x 8 doz/gün, IV): 1-5. günler G-CSF (5 µg/kg, SC): 6-15. günler veya en düşük değer sonrası ANC > 1500 olana kadar IT Metotreksat (yaşa düzeltilmiş): SADECE 1. gün Üçlü IT tedavisi (yaşa düzeltilmiş): 8., 15. gün |
Konsolidasyon bloğu 2 (3 hafta) | Metotreksat (24 saatte 5 g/m, IV): gün 1 Leucovorin (36 saatte 75 mg/m, IV; 15 mg/m IV veya PO 6 saatte bir x 6 doz)iii: 2. ve 3. günler Üçlü IT tedavisi (yaşa düzeltilmiş): gün 1 ARA-C (3 g/m/doz q 12 h x 4, IV): 2. ve 3. günler G-CSF (5 µg/kg, SC): 4-13 günler en düşük değer sonrası ANC > 1500 olana kadar |
Yeniden indüksiyon bloğu 1 (3 hafta) | VCR (1,5 mg/m/gün, IV): 1, 8 ve 15. günler DAUN (45 mg/m/gün bolus, IV): 1 ve 2. günler CPM (250 mg/m/doz 12 saatte bir x 4 doz, IV): 3 ve 4. günler PEG-ASP (2500 IU/m, IM): gün 4 G-CSF (5 µg/kg, SC): 5-14. günler veya en düşük değer sonrası ANC > 1500 olana kadar Üçlü IT tedavisi (yaşa düzeltilmiş): 1 ve 15. günler DEX (6 mg/m/gün, PO): 1-7 ve 15-21. günler |
Yoğunlaştırma bloğu 1 (9 hafta) | Metotreksat (24 saatte 5 g/m, IV): 1 ve 15. günler Leucovorin (36. saatte 75 mg/m, IV; 15 mg/m IV veya PO 6 saatte bir x 6 doz)iii: 2, 3, 16 ve 17. günler Üçlü IT tedavisi (yaşa düzeltilmiş): 1 ve 22. günler VP-16 (100 mg/m/gün, IV): 22-26. günler CPM (300 mg/m/gün, IV): 22-26. günler MESNA (150 mg/m/gün, IV): 22-26. günler G-CSF (5 µg/kg, SC): 27-36. günler veya en düşük değer sonrası ANC > 1500 olana kadar ARA-C (3 g/m, 12 saatte bir, IV): 43, 44. günler L-ASP (6000 IUnit/m, IM): gün 44 |
Yeniden indüksiyon bloğu 2 (3 hafta) | VCR (1,5 mg/m/gün, IV): 1, 8 ve 15. günler DAUN (45 mg/m/gün bolus, IV): 1 ve 2. günler CPM (250 mg/m/doz 12 saatte bir x 4 doz, iv): 3 ve 4. günler PEG-ASP (2500 IUnit/m, IM): gün 4 G-CSF (5 µg/kg, SC): 5-14. günler veya en düşük değer sonrası ANC > 1500 olana kadar Üçlü IT tedavisi (yaşa düzeltilmiş): 1 ve 15. günler DEX (6 mg/m/gün, PO): 1-7 ve 15-21. günler |
Yoğunlaştırma bloğu 2 (9 hafta) | Metotreksat (24 saatte 5 g/m, IV): 1 ve 15. günler Leucovorin (36. saatte 75 mg/m, IV; 15 mg/m IV veya PO 6 saatte bir x 6 doz)iii: 2, 3, 16, ve 17. günler Üçlü IT tedavisi (yaşa düzeltilmiş): 1 ve 22. günler VP-16 (100 mg/m/gün, IV): 22-26. günler CPM (300 mg/m/gün, IV): 22-26. günler MESNA (150 mg/m/gün, IV): 22-26. günler G-CSF (5 µg/kg, SC): 27-36. günler veya en düşük değer sonrası ANC > 1500 olana kadar ARA-C (3 g/m, 12 saatte bir, IV): 43, 44. günler L-ASP (6000 IUnit/m, IM): gün 44 |
İdame (8 haftalık döngüler) Döngü 1-4 | MTX (24 saatte 5 g/m, IV): gün 1 Leucovorin (36. saatte 75 mg/m, IV; 15 mg/m IV veya PO 6 saatte bir x 6 doz)iii: 2. ve 3. günler Üçlü IT tedavisi (yaşa düzeltilmiş): 1, 29. günler VCR (1,5 mg/m, IV): 1, 29. günler DEX (6 mg/m/gün PO): 1-5.; 29-33. günler 6-MP (75 mg/m/gün, PO): 8-28. günler Metotreksat (20 mg/m/hafta, PO): 8, 15, 22. günler VP-16 (100 mg/m, IV): 29-33. günler CPM (300 mg/m, IV): 29-33. günler MESNA IV 29-33. günler G-CSF (5 µg/kg, SC): 34-43. günler |
İdame (8 haftalık döngüler) Döngü 5 | Kraniyal ışınlama (sadece Blok 5) Tanıda CNS1 ve CNS2 olan tüm hastalar için 8 fraksiyonda 12 Gy Tanıda CNS3 olan hastalar için 10 fraksiyonda 18 Gy VCR (1,5 mg/m/gün, IV): 1, 29. günler DEX (6 mg/m/gün, PO): 1-5; 29-33. Günler 6-MP (75 mg/m/gün, PO): 11-56. günler (Döngü 5'in 1. gününde başlayarak 6-10 günlük kraniyal ışınlama sırasında 6- MP durdurulur. Kraniyal ışınlama tamamlandıktan sonra 1. gün 6- MP'ye başlanır.) Metotreksat (20 mg/m/hafta, PO): 8, 15, 22, 29, 36, 43, 50. günler |
İdame (8 haftalık döngüler) Döngü 6-12 | VCR (1,5 mg/m/gün, IV): 1, 29. günler DEX (6 mg/m/gün, PO): 1-5; 29-33. günler 6-MP (75 mg/m/gün, PO): 1-56. günler Metotreksat (20 mg/m/hafta, PO): 1, 8, 15, 22, 29, 36, 43, 50. günler |
G-CSF = granülosit koloni uyarıcı faktör, VP-16 = etoposid, MTX = metotreksat, IV = intravenöz, SC =
subkutan, IT = intratekal, PO = oral, IM = intramüsküler, ARA-C = sitarabin, CPM = siklofosfamid, VCR
= vinkristin, DEX = deksametazon, DAUN = daunorubisin, 6-MP = 6-merkaptopurin, E.Coli L-ASP = L- asparaginaz, PEG-ASP = PEG asparaginaz, MESNA = 2-merkaptoetan sülfonat sodyum, iii = veya MTX düzeyi <0,1 µM olana kadar, q6h= her 6 saatte bir, Gy = Gray
Çalışma AIT07, kemoterapi ile kombinasyon halinde imatinib ile tedavi edilen 128 hastayı (1 ila <18 yaş) içeren çok merkezli, açık etiketli, randomize, Faz II / III bir çalışmadır. Bu çalışmadan elde edilen güvenlilik verilerinin, imatinibin Ph + ALL hastalarında güvenlilik profili ile uyumlu olduğu görülmektedir.
Nüksetmiş/tedaviye refrakter Ph+ ALL
İmatinib, yineleyen/refrakter Ph+ ALL hastalarında tek ajan olarak kullanıldığında, 411 hastanın 53'ünde yanıt değerlendirilebilmiş, hematolojik yanıt oranı %30 (%9'u tam) ve majör sitogenetik yanıt oranı ise %23 olarak bulunmuştur (Not: 411 hastanın 353'ü, primer yanıt verileri toplanmaksızın genişletilmiş erişim çalışmasında tedavi edilmiştir). 411 yineleyen/refrakter Ph+ ALL hastasından oluşan toplam popülasyonda progresyona kadar geçen medyan süre 2,6 ile 3,1 ay aralığında olurken, değerlendirilebilir 401 hastada medyan genel sağkalım 4,9 ile 9 ay aralığında bulunmuştur. Bu veriler, sadece 55 yaş ve üzeri hastalar dahil edilecek şekilde yeniden analiz yapıldığında da benzer olmuştur.
MDS/MPD'de klinik çalışmalar
Bu endikasyonda GLİVEC ile deneyim çok sınırlıdır ve hematolojik ve sitogenetik yanıt oranlarına dayanmaktadır. Klinik bir fayda veya artan sağkalımı gösteren kontrollü çalışma yoktur. Abl, Kit veya PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit eden hastalıklardan muzdarip çeşitli hasta popülasyonlarında GLİVEC'in test edildiği bir açık etiketli, çok merkezli, faz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışma, günde 400 mg GLİVEC ile tedavi edilen MDS/MPD'li 7 hastayı içermektedir. Üç hasta tam hematolojik yanıt (THY) ve bir hasta kısmi hematolojik yanıt (KHY) vermiştir. Orjinal analiz sırasında, PDGFR gen yeniden düzenlemeleri saptanan dört hastadan üçünde hematolojik yanıt (2 THY ve 1 KHY) gelişmiştir. Bu hastaların yaşları 20 ile 72 arasında değişmektedir.
PDGFR-β yeniden düzenlemesi olan ve GLİVEC ile tedavi edilmiş miyeloproliferatif neoplazmalardan muzdarip hastalarda uzun vadeli güvenlilik ve etkililik verilerini toplamak için gözlemsel bir kayıt çalışması (çalışma L2401) yapılmıştır. Bu kayıt çalışmasında yer alan 23 hasta, medyan 7,2 yıl (0,1 ile 12,7 yıl) boyunca medyan günlük
264 mg (aralık: 100 ile 400 mg) dozda GLİVEC almıştır. Bu kayıt çalışmasının gözlemsel yapısı nedeniyle, kayıtlı 23 hastanın sırasıyla 22, 9 ve 17'si için hematolojik, sitogenetik ve moleküler değerlendirme verileri mevcuttur. Konservatif olarak, eksik verileri olan hastaların yanıt vermeyenler olduğu varsayıldığında, 20/23 (%87) hastada THY, 9/23 (%39,1) hastada TSY ve 11/23 (%47,8) hastada MY gözlemlenmiştir. En az bir geçerli değerlendirmesi olan hastalardan yanıt oranı hesaplandığında, THY, TSY ve MY için yanıt oranı sırasıyla 20/22 (%90,9), 9/9 (%100) ve 11/17 (%64,7) olmuştur.
Ayrıca 13 yayında MDS/MPD'li 24 hasta daha bildirilmiştir. 21 hasta günlük 400 mg GLİVEC ile tedavi edilirken, diğer 3 hasta daha düşük dozlar almıştır. On bir hastada PDGFR gen yeniden düzenlemeleri tespit edilmiştir, bunlardan 9'u bir THY ve 1 KHY elde etmiştir. Bu hastaların yaşları 2 ile 79 arasında değişmiştir. Yakın tarihli bir yayında, bu 11 hastanın 6'sından alınan güncellenmiş bilgiler, tüm bu hastaların sitogenetik remisyonda (32-38 ay aralığında) kaldığını ortaya koymuştur. Aynı yayında, PDGFR gen yeniden düzenlemeleri olan 12 MDS/MPD hastasından (B2225 çalışmasından 5 hasta) uzun süreli takip verileri bildirilmiştir. Bu hastalar medyan 47 ay (24 gün - 60 ay aralığında) GLİVEC almıştır. Bu hastaların 6'sında takip süresi, artık 4 yılın üzerindedir. On bir hasta hızlı THY elde etmiştir; RT-PCR ile ölçüldüğünde 10'unda sitogenetik anormallikler tamamen düzelmiş ve füzyon transkriptleri azalmış ya da kaybolmuştur. Hematolojik ve sitogenetik yanıtlar, sırasıyla medyan 49 ay (19-60 aralığı) ve 47 ay (16-59 aralığı) boyunca sürdürülmüştür. Genel sağkalım tanıdan itibaren 65 aydır (aralık 25-234). Genetik translokasyonu olmayan hastalara GLİVEC uygulaması, genellikle herhangi bir iyileşme sağlamamaktadır.
MDS/MPD'li pediatrik hastalarda kontrollü çalışma yoktur. Dört yayında PDGFR gen yeniden düzenlemeleriyle ilişkili MDS/MPD'li beş (5) hasta bildirilmiştir. Bu hastaların yaşları 3 ay ile 4 yıl arasında değişmiştir ve imatinib günde 50 mg dozda veya günde
92,5 ila 340 mg/m2 arasında değişen dozlarda verilmiştir. Tüm hastalarda tam
hematolojik yanıt, sitogenetik yanıt ve/veya klinik yanıt elde edilmiştir.
HES/CEL ile İlgili Klinik Çalışmalar
Abl, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında GLİVEC'in test edildiği açık-etiketli, çok merkezli bir faz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada HES/CEL'i olan 14 hasta, günde 100 mg ila 1000 mg dozda GLİVEC ile tedavi edilmiştir. Yayınlanmış 35 vaka raporu ve vaka serisinde bildirilen HES/CEL'li 162 hasta daha günlük 75 mg ila 800 mg dozlarında GLİVEC almıştır. 176 hastadan oluşan toplam popülasyonun 117'sinde sitogenetik anormallikler değerlendirilmiştir. Bu 117 hastanın 61'inde FIP1L1- PDGFRα füzyon kinaz tanımlanmıştır. Diğer 3 yayınlanmış raporda dört HES hastasının daha FIP1L1-PDGFRα pozitif olduğu bulunmuştur. 65 FIP1L1-PDGFRα füzyon kinaz pozitif hastanın tümü, aylarca sürdürülen bir THY elde etmiştir (raporlama sırasında sansürlenen 1+ ila 44+ ay arasında). Yakın tarihli bir yayında bildirildiği gibi, bu 65 hastadan 21'i, 28 aylık (aralık 13-67 ay) medyan bir takip süresiyle tam moleküler remisyona ulaşmıştır. Bu hastaların yaşları 25 ile 72 aralığında olmuştur. Ek olarak, olgu raporlarında araştırmacılar tarafından semptomatolojide ve diğer organ disfonksiyon anormalliklerindeki gelişmeler bildirilmiştir. Kalp, sinir, deri/derialtı doku, solunum/göğüs/mediastinal, kas-iskelet/bağ dokusu/vasküler ve gastrointestinal organ sistemlerinde gelişmeler bildirilmiştir.
HES/CEL'li pediyatrik hastalarda kontrollü çalışma yoktur. 3 yayında PDGFR gen yeniden düzenlemeleri ile ilişkili HES ve CEL'li üç (3) hasta bildirilmiştir. Bu hastaların yaşları 2 ila 16 yıl arasında değişmiştir ve imatinib günde 300 mg/m2 veya günlük 200 ila 400 mg arasında değişen dozlarda verilmiştir. Tüm hastalarda tam hematolojik yanıt, tam sitogenetik yanıt ve/veya tam moleküler yanıt elde edilmiştir.
Rezeke edilemeyen ve/veya metastatik GIST'de yapılan klinik çalışmalar
Rezeke edilemeyen veya metastatik malign gastrointestinal stromal tümörleri (GIST) olan hastalarda faz II, açık etiketli, randomize, kontrolsüz çok uluslu bir çalışma yürütülmüştür. Bu çalışmaya 147 hasta kaydedilmiş ve 36 ay boyunca günde bir kez oral olarak 400 mg veya 600 mg kullanımına randomize edilmiştir. Bu hastaların yaşları, 18 ila 83 arasındadır ve patolojik olarak rezeke edilemeyen ve/veya metastatik Kit-pozitif malign GİST tanısına sahiptir. İmmünohistokimya Kit antikoru ile (A-4502, tavşan poliklonal antiserumu, 1:100; DAKO Corporation, Carpinteria, CA) antijen geri kazanımı sonrası avidin-biotin-peroksidaz kompleksi yöntemi ile analize göre rutin olarak yürütülmüştür.
Birincil etkililik kanıtı, objektif yanıt oranlarını temel almıştır. Tümörlerin en az bir hastalık bölgesinde ölçülebilir olması gerekmiş olup, yanıt karakterizasyonu Güneybatı Onkoloji Grubu (SWOG) kriterlerini temel almıştır. Bulgular, Tablo 8'de sunulmaktadır.
Tablo 8: STIB2222 kodlu GIST çalışmasında en iyi tümör yanıtı
| Tüm dozlar (n=147) |
| 400 mg n= 73, 600 mg n=74 |
En iyi yanıt | n (%) |
Tam yanıt | 1 (0,7) |
Kısmi yanıt | 98 (66,7) |
Stabil hastalık | 23 (15,6) |
İlerleyici hastalık | 18 (12,2) |
Değerlendirilemeyen | 5 (3,4) |
Bilinmeyen | 2 (1,4) |
İki doz grubu arasında yanıt oranları bakımından farklılıklar söz konusu olmamıştır. Ara analiz tarihinde önemli sayıda stabil hastalığa sahip hasta, daha uzun süreli tedavi ile kısmi yanıta ulaşmıştır (medyan takip süresi 31 ay). Yanıta kadar geçen medyan süre, 13 hafta olmuştur (%95 GA 12-23). Yanıt veren olgularda tedavi başarısızlığına kadar geçen medyan süre 122 hafta (%95 GA 106-147), genel çalışma popülasyonunda ise 84 hafta (%95 GA 71-109) bulunmuştur. Medyan genel sağkalım noktasına ulaşılamamıştır. 36 aylık izlem sonrasında Kaplan-Meier sağkalım tahmini %68'dir.
İki klinik çalışmada (çalışma B2222 ve gruplar arası çalışma S0033), günlük GLİVEC dozu, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda 800 mg'a yükseltilmiştir. Doz, toplam 103 hastada 800 mg'a çıkarılmıştır; doz yükseltildikten sonra 6 hasta kısmi yanıta ve 21 hasta hastalık stabilizasyonuna ulaşarak
%26'lık genel klinik yarar sonucunu vermiştir. Eldeki güvenlilik verilerinden yola çıkılarak, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda dozun günde 800 mg'a çıkarılmasının, GLİVEC'in güvenlilik profilini etkilemediği görülmektedir.
Adjuvan GIST için klinik çalışmalar
Adjuvan tedavi koşullarında GLİVEC, 773 hasta ile yürütülen çok merkezli, çift kör, uzun süreli, plasebo kontrollü bir faz III çalışmada (Z9001) araştırılmıştır. Bu hastaların yaşları, 18-91 aralığında olmuştur. İmmünhistokimya ile Kit proteini eksprese eden primer GIST yönünde histolojik tanısı bulunan ve en geniş yerinde ≥3 cm tümör büyüklüğüne sahip olan, çalışmaya kayıt öncesindeki 14-70 gün içerisinde primer GIST'i tam gross rezeksiyon ile alınan hastalar dahil edilmiştir. Primer GIST rezeke edildikten sonra hastalar, şu iki koldan birine randomize edilmiştir: bir yıl süreyle GLİVEC 400 mg/gün veya plasebo.
Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden rekürense ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan rekürenssiz sağkalım (RFS) olmuştur.
GLİVEC RFS'de anlamlı uzama sağlamış, GLİVEC grubunda hastaların %75'i 38. ayda rekürenssiz iken plasebo grubundaki hastaların %75'i 20. ayda rekürenssiz kalmıştır (sırasıyla %95 GA [30-hesaplanamaz]; [14-hesaplanamaz]); (tehlike oranı = 0,398 [0,259-0,610], p<0,0001). Bir yıl sonunda genel RFS, plasebo (%82,3) karşısında GLİVEC için anlamlı düzeyde daha iyi bulunmuştur (%97,7) (p<0,0001). Bu şekilde rekürens riski plaseboya oranla %89 azaltılmıştır (tehlike oranı = 0,113 [0,049-0,264]).
Primer GIST'lerine yönelik ameliyatları sonrasında hastalardaki rekürens riski, şu prognoz faktörleri esas alınarak retrospektif şekilde değerlendirilmiştir: tümör büyüklüğü, mitotik indeks, tümör yeri. Mitotik indeks verileri, tedavi amaçlı (ITT) popülasyonu oluşturan 713 hastanın 556'sı için mevcuttu. Birleşik Devletler Ulusal Sağlık Enstitüleri (NIH) ve Silahlı Kuvvetler Patoloji Enstitüsü (AFIP) risk sınıflandırmalarına göre yapılan alt grup analizlerinin sonuçları Tablo 9'da gösterilmektedir. Düşük ve çok düşük risk gruplarında herhangi bir fayda gözlenmemiştir. Genel bir sağkalım faydası gözlenmemiştir.
Tablo 9: NIH ve AFIP risk sınıflandırmasına göre Z9001 çalışması RFS analiz özeti
Risk Kriteri |
Risk Seviyesi |
Hasta yüzdesi (%) |
Olay sayısı/ Hasta sayısı |
Genel tehlike oranı (95% CI)* |
| RFS oranları (%) |
12 aylık | 24 aylık | |||||
GLİVEC Plasebo'ya karşı | GLİVEC Plasebo'ya karşı | GLİVEC Plasebo'ya karşı | ||||
NIH | Düşük | 29,5 | 0/86'e karşı 2/90 | NE | 100'e karşı 98,7 | 100'e karşı 95,5 |
Orta |
25,7 | 4/75'e karşı 6/78 | 0,59 (0,17; 2,10) | 100'e karşı 94,8 | 97,8'e karşı 89,5 | |
Yüksek |
44,8 | 21/140'e karşı 51/127 | 0,29 (0,18; 0,49) | 94,8'e karşı 64,0 | 80,7'ye karşı 46,6 | |
AFIP | Çok düşük | 20,7 | 0/52'e karşı 2/63 | NE | 100'e karşı 98,1 | 100'e karşı 93,0 |
Düşük | 25,0 | 2/70'e karşı 0/69 | NE | 100'e karşı 100 | 97,8'e karşı 100 | |
Orta |
24,6 | 2/70'e karşı 11/67 | 0,16 (0,03; 0,70) | 97,9'a karşı 90,8 | 97,9'a karşı 73,3 | |
Yüksek |
29,7 | 16/84'e karşı 39/81 | 0,27 (0,15; 0,48) | 98,7'ye karşı 56,1 | 79,9'a karşı 41,5 |
*Full takip periyodu- NE-Tahmin edilebilir değil
İkinci bir çok merkezli, açık etiketli faz III çalışmada (SSG XVIII/AIO), cerrahi GIST rezeksiyonu sonrasında olan ve aşağıdaki durumlardan birinin bulunduğu hastalarda 400 mg/gün GLİVEC ile 36 ay karşısında 12 aylık tedavi karşılaştırılmıştır: tümör çapı > 5 cm ve mitotik sayım > 5/50 yüksek güç alanı (HPF); veya tümör çapı > 10 cm ve herhangi bir mitotik sayım veya mitotik sayımı > 10/50 HPF olan herhangi bir büyüklükteki tümör ya da periton boşluğuna doğru rüptüre olan tümörler. Toplam 397 hastadan olur alınmış ve bu hastalar çalışmaya randomize edilmiştir (199 hasta 12 ay kolunda ve 198 hasta 36 ay kolunda) medyan yaş 61 idi [aralık 22 ila 84 yaş]). Medyan takip süresi 54 ay olup (randomizasyondan veri kesme tarihine kadar) ilk hastanın randomize edilişinden veri kesme tarihine kadar geçen medyan süre 83 aydır.
Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden nükse ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan nükssüz sağkalım (RFS) olmuştur.
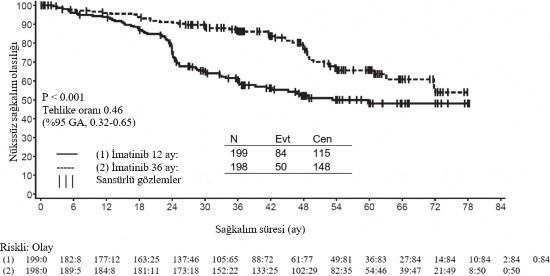
36 aylık GLİVEC tedavisi, 12 aylık GLİVEC tedavisi ile karşılaştırıldığında RFS'de anlamlı ölçüde uzama sağlamıştır (genel tehlike oranı (HR) = 0,46 [0,32, 0,65], p<0,0001) (Tablo 8, Şekil 1).
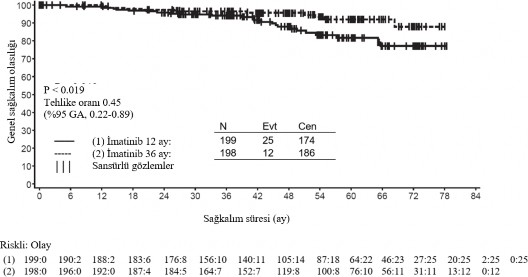
Buna ek olarak, 36 aylık GLİVEC tedavisi, 12 aylık GLİVEC tedavisi ile karşılaştırıldığında genel sağkalım (OS) süresini anlamlı ölçüde uzatmıştır (HR = 0,45 [0,22, 0,89], p=0,0187) (Tablo 8, şekil 2).
Daha uzun süreli tedavi (> 36 ay) yeni rekürenslerin oluşumunu geciktirebilmektedir; ancak, bu bulgunun genel sağkalım üzerindeki etkisi halen bilinmemektedir.
Toplam ölüm sayısı 12 aylık tedavi kolu için 25 ve 36 aylık tedavi kolu için 12 şeklinde olmuştur.
İmatinib ile 36 ay süreli tedavi, ITT analizinde, yani tüm çalışma popülasyonun dahil edildiği analizde, 12 aylık tedaviden daha üstün bulunmuştur. Mutasyon tipine göre yapılan planlı bir alt grup analizinde, ekson 11 mutasyonları olan hastalarda 36 aylık tedavide RFS için tehlike oranı 0,35 olmuştur [%95 GA: 0,22, 0,56].
Gözlemlenen olay sayısının düşük olması sebebiyle, daha az yaygın olan mutasyon alt grupları için herhangi bir sonuç çıkartılamamaktadır.
Tablo 10: 12 aylık ve 36 aylık GLİVEC Tedavisi (SSGXVIII/AIO Çalışması)
| 12 aylık tedavi kolu | 36 aylık tedavi kolu |
RFS | %(GA) | %(GA) |
12 ay | 93,7 (89,2-96,4) | 95,9 (91,9-97,9) |
24 ay | 75,4 (68,6-81,0) | 90,7 (85,6-94) |
36 ay | 60,1 (52,5-66,9) | 86,6 (80,8-90,8) |
48 ay | 52,3 (44,0-59,8) | 78,3 (70,8-84,1) |
60 ay | 47,9 (39,0-56,3) | 65,6 (56,1-73,4) |
Sağkalım |
|
|
36 ay | 94,0 (89,5-96,7) | 96,3 (92,4-98,2) |
48 ay | 87,9 (81,1-92,3) | 95,6 (91,2-97,8) |
60 ay | 81,7 (73,0-87,8) | 92,0 (85,3-95,7) |
Şekil 1 Primer rekürenssiz sağkalım sonlanım noktası için Kaplan-Meier tahminleri (ITT popülasyonu)
Şekil 2 Genel sağkalım için Kaplan-Meier tahminleri (ITT popülasyonu)
C-Kit pozitif GIST olan pediyatrik hastalarda kontrollü çalışma bulunmamaktadır. 7 yayında GIST'li (Kit ve PDGFR mutasyonları olan veya olmayan) onyedi (17) hasta bildirilmiştir. Bu hastaların yaşı, 8 ila 18 aralığında olmuştur ve imatinib, hem adjuvan hem de metastatik koşullarda günde 300 ile 800 mg arasında değişen dozlarda verilmiştir. GIST tedavisi gören pediyatrik hastaların çoğunda c-kit veya PDGFR mutasyonlarını doğrulayan veriler bulunmamakta olup bu durum karışık klinik sonuçlara yol açmış olabilir.
DFSP'de klinik çalışmalar
Günlük 800 mg GLİVEC ile tedavi edilen DFSP'li 12 hastayı içeren faz II, açık etiketli, çok merkezli bir klinik çalışma (çalışma B2225) yürütülmüştür. DFSP'li hastaların yaşı, 23 ile 75 arasında değişmiştir; DFSP metastatiktir, ilk rezektif cerrahiyi takiben lokal olarak nüksetmiştir ve çalışmaya giriş sırasında daha fazla rezektif cerrahiye uygun görülmemiştir. Etkililiğin birincil kanıtı, objektif yanıt oranlarına dayanmıştır. Biri tamamen ve 8'i kısmen olmak üzere, kayıtlı 12 hastadan 9'u yanıt vermiştir. Kısmi yanıt verenlerden üçü, daha sonra ameliyatla hastalıksız hale getirilmiştir. B2225 çalışmasında medyan tedavi süresi, 6,2 aydır ve maksimum süre 24,3 aydır. Yayınlanmış 5 vaka raporunda GLİVEC ile tedavi edilen 6 DFSP hastası daha bildirilmiştir ve yaşları 18 ay ile 49 yıl arasında değişmektedir. Yayınlanmış literatürde bildirilen erişkin hastalar, günlük 400 mg (4 vaka) veya 800 mg (1 vaka) GLİVEC ile tedavi edilmiştir. Üçü tamamen ve 2'si kısmen olmak üzere beş (5) hasta yanıt vermiştir. Yayınlanan literatürde medyan tedavi süresi 4 hafta ile >20 ay arasında değişmektedir. GLİVEC tedavisine yanıt verenlerin neredeyse tamamında translokasyon t(17:22)[(q22:q13)] veya bunun gen ürünü mevcuttur.
DFSP'li pediatrik hastalarda kontrollü çalışma bulunmamaktadır. Üç yayında DFSP ve PDGFR gen yeniden düzenlemelerine sahip beş (5) hasta bildirilmiştir. Bu hastaların yaşı yenidoğan ile 14 yaş arasında değişmektedir ve imatinib günde 50 mg dozda veya günde 400 ila 520 mg/m2 arasında değişen dozlarda verilmiştir. Tüm hastalar, kısmi ve/veya tam yanıt elde etmiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerGLİVEC'in farmakokinetiği 25 - 1000 mg'lık bir doz aralığında değerlendirilmiştir. Plazma farmakokinetik profilleri, 1. günde ve plazmada kararlı düzeylerin elde edildiği
7. ya da 28. günde analiz edilmiştir. Emilim:
İmatinibin ortalama mutlak biyoyararlanımı, % 98'dir. Bir oral dozu takiben plazma imatinib eğri altında kalan alan (EAA) değerlerinde, yüksek oranda hastalar arası değişkenlik görülmüştür. Yüksek yağ içeren bir gıda ile birlikte verildiğinde, imatinibin emilim oranı minimal düzeyde azalmış (C'da %11 azalma ve t'da 1,5 saatlik uzama), açlık koşullarına göre EAA değerinde küçük bir azalma (% 7,4) olmuştur. Geçirilmiş gastrointestinal cerrahinin ilaç emilimi üzerindeki etkisi araştırılmamıştır.
Dağılım:
Klinik açıdan uygun konsantrasyonlarda kullanılan imatinibin plazma proteinlerine bağlanması yaklaşık % 95 olmuş, in vitro deneyler temelinde, daha çok albümin ve alfa- asit-glikoproteine, az miktarda da lipoproteine bağlanmıştır.
Biyotransformasyon:
İnsanlarda dolaşımdaki ana metabolit, ana ilaca benzer in vitro etki gösteren N-demetile edilmiş piperazin türevidir. Bu metabolitin plazma EAA değerinin imatinibin EAA değerinin sadece % 16'sı olduğu bulunmuştur. N-demetile metabolitin plazma proteinlerine bağlanması, asıl bileşiğinkine benzerdir.
İmatinib ve N-demetil metaboliti birlikte, dolaşımdaki radyoaktivitenin yaklaşık %65'ini oluşturmuştur (EAA (0-48saat)). Dolaşımdaki radyoaktivitenin kalan kısmı, bir dizi minör metabolitten oluşmuştur.
İn vitro sonuçlar CYP3A4'ün, imatinib biyotransformasyonunu katalize eden başlıca P450 enzimi olduğunu göstermiştir. Potansiyel eşzamanlı ilaçlardan (asetaminofen, asiklovir, allopurinol, amfoterisin, sitarabin, eritromisin, flulonazol, hidroksiüre, norfloksasin, penisilin V) oluşan bir panelde sadece eritromisin (IC50 50 μM) ve flukonazol (IC50 118 μM) imatinib metabolizmasında klinik açıdan anlamlı olabilecek inhibisyon göstermiştir.
İn vitro koşullarda imatinibin CYP2C9, CYP2D6 ve CYP3A4/5'in markör substratlarının kompetitif bir inhibitörü olduğu gösterilmiştir. İnsan karaciğeri mikrozomlarında Ki değerleri sırasıyla 27, 7,5 ve 7,9 µmol/l bulunmuştur. Hastalarda imatinibin maksimal plazma konsantrasyonları 2–4 µmol/l'dir, dolayısıyla bir arada uygulanan ilaçların CYP2D6 ve/veya CYP3A4/5 aracılı metabolizmasında inhibisyon olasıdır. İmatinib, 5-fluorourasil biyotransformasyonuna müdahale etmemiştir fakat kompetitif CYP2C8 inhibisyonu (Ki = 34,7 μM) sonucu paklitaksel metabolizmasını inhibe etmiştir. Bu Ki değeri, hastalarda beklenen imatinib plazma düzeylerinin çok üzerindedir, dolayısıyla 5-fluorourasil ya da paklitakselin imatinib ile bir arada uygulanması sonucu herhangi bir etkileşim beklenmemektedir.
Eliminasyon:
Oral C işaretli bir imatinib dozundan sonra bileşiğin/bileşiklerin tespitine dayalı olarak, dozun yaklaşık %81'i 7 gün içinde dışkıda (dozun %68'i) ve idrarda (dozun %13'ü) tespit edilmiştir.
Değişmemiş durumdaki imatinib, dozun % 25'ini (% 5 idrar, % 20 feçes) oluşturmuştur, geriye kalan kısım metabolitlerdir.
Plazma farmakokinetiği:
Sağlıklı gönüllülerde oral uygulamanın ardından, imatinibin tdeğeri yaklaşık 18 saat olması günde tek doz şeklindeki pozolojinin uygun olduğu izlenimini vermektedir. Oral olarak 25-1000 mg imatinib uygulandıktan sonra artan dozla birlikte ortalama EAA artışı doğrusal bir seyir izlemiştir. Tekrarlanan dozlarda imatinib kinetiğinde değişiklik olmamış ve günde bir kez uygulandığında kararlı durumda birikim, 1,5-2,5 katı olmuştur.
GIST hastalarında farmakokinetik
GIST hastalarında kararlı durum maruziyeti, aynı dozajda (400 mg/gün) KML hastaları için gözlenenden 1,5 kat daha yüksek olmuştur. GIST hastalarındaki ön popülasyon farmakokinetiği analizine dayalı olarak, üç değişkenin (albümin, WBC ve bilirubin) imatinib farmakokinetiği ile anlamlı ilişkiye sahip olduğu bulunmuştur. Daha düşük albümin değerleri daha düşük klirense (CL/f) sebep olmuş ve daha yüksek WBC düzeyleri CL/f azalmasına neden olmuştur. Ancak bu ilişkiler, doz ayarlamasını gerektirecek ölçüde anlamlı şekilde ön plana çıkmamıştır. Bu hasta popülasyonunda hepatik metastazların varlığı, potansiyel olarak karaciğer yetmezliğine ve azalmış metabolizmaya yol açabilir.
Popülasyon farmakokinetiği
KML hastalarındaki popülasyon farmakokinetiği analizlerine göre yaşın dağılım hacmi üzerinde küçük bir etkisi olmuştur (> 65 yaşındaki hastalarda % 12 artış). Bu değişimin klinik açıdan anlamlı olmadığı düşünülmektedir. Vücut ağırlığının imatinib klerensi üzerindeki etkisine bakıldığında, 50 kg ağırlığındaki bir kişide klerensin 8,5 l/s olması beklenirken, 100 kg ağırlığındaki bir kişideki klerens 11,8 l/s'e yükselmektedir. Bu değişiklikler vücut ağırlığına göre bir doz ayarlaması yapılması için yeterli olarak kabul edilmemiştir. Cinsiyetin imatinib kinetiği üzerinde etkisi olmamıştır.
Çocuklarda farmakokinetik
Erişkin hastalarda olduğu gibi, hem faz I hem de faz II çalışmalarında pediatrik hastalarda oral uygulamadan sonra imatinib hızla emilmiştir. Çocuklarda 260 ve 340 mg/m2 imatinible elde edilen maruziyet değerleri, erişkinlerde sırasıyla 400 ve 600 mg imatinible elde edilenler gibidir. 340 mg/m2 imatinibin birinci ve sekizinci günlerdeki EAAdeğerleri bu ilacın, tekrarlanan günde bir kez dozlardan sonra 1,7 kat biriktiğini göstermiştir.
Hematolojik bozuklukları (KML, Ph+ALL ya da imatinib ile tedavi edilen diğer hematolojik bozukluklar) olan pediyatrik hastalarda birleştirilmiş popülasyon farmakokinetiği analizine dayalı olarak imatinib klerensi, vücut yüzey alanının (VYA) artmasına paralel olarak yükselmektedir. VYA etkisi için düzeltme yapıldıktan sonra, yaş, vücut ağırlığı ve vücut kitle indeksi gibi diğer demografik faktörler, imatinib maruziyeti üzerinde klinik açıdan anlamlı etkiler yapmamıştır. Yapılan analiz, günde bir kere 260 mg/m2 (günde 400 mg'ı geçmemek üzere) ya da günde bir kere 340 mg/m2 alan (günde 600 mg'ı geçmemek üzere) pediyatrik hastalarda imatinib maruziyetinin, günde bir kere 400 mg ya da 600 mg imatinib alan yetişkin hastalardakine benzer olduğunu doğrulamıştır.
Organ fonksiyonu bozukluğu
İmatinib ve metabolitleri, böbrek yoluyla anlamlı miktarda atılmaz. Böbrek fonksiyonlarında hafif ve orta şiddette bozukluk olan hastalar, böbrek fonksiyonları normal hastalardan daha yüksek plazma değerlerine sahip görünmektedir. Artış, yaklaşık olarak 1,5-2 kattır ve imatinibin güçlü bir biçimde bağlandığı plazma alfa asit
glikoprotein (AGP) değerinde 1,5 katlık bir artışa karşılık gelir. Böbrek bozukluğu olan hastalarda imatinibin serbest ilaç klerensi muhtemelen böbrek fonksiyonları normal hastalardakinin bir benzeridir çünkü böbrekler yoluyla atılım imatinib için minör bir eliminasyon yolunu oluşturmaktadır (bkz. Bölüm 4.2 ve 4.4).
Farmakokinetik analiz sonuçlarının kişiden kişiye değişikliklerin söz konusu olduğunu göstermesine rağmen, değişik derecelerde karaciğer yetersizliği olan hastalardaki imatinibe ortalama maruz kalım, karaciğer fonksiyonları normal olan hastalara kıyasla yükselmemiştir (bkz. Bölüm 4.2, 4.4 ve 4.8).
5.3. Klinik öncesi güvenlilik verileri
İmatinibin klinik öncesi güvenliliği sıçanlarda, köpeklerde, maymunlarda ve tavşanlarda değerlendirilmiştir.
Çoklu doz toksisite çalışmaları sıçanlarda, köpeklerde ve maymunlarda hafif ile orta dereceli hematolojik değişiklikler ortaya koymuş, sıçanlarda ve köpeklerde bu değişikliklere kemik iliği değişiklikleri eşlik etmiştir.
Karaciğer, sıçanlarda ve köpeklerde hedef organ olmuştur. İki türde de transaminazlarda hafif ila orta dereceli artışlar ve kolesterol, trigliseritler, total protein ve albümin düzeylerinde hafif düşüşler gözlenmiştir. Sıçan karaciğerinde herhangi bir değişiklik görülmemiştir. İki hafta süreyle tedavi edilen köpeklerde yükselmiş karaciğer enzimleri, hepatoselüler nekroz, safra kanalı nekrozu ve safra kanalı hiperplazisi ile şiddetli karaciğer toksisitesi gözlenmiştir.
İki hafta süreyle tedavi edilen maymunlarda fokal mineralizasyon ve renal tübüllerin dilatasyonu ve tübüler nekroz ile renal toksisite gözlenmiştir. Bu hayvanların birkaçında kan üre azotunda (BUN) ve kreatininde artış gözlenmiştir. 13 haftalık çalışmada sıçanlarda ≥ 6 mg/kg dozlarda serum veya idrar parametrelerinde değişiklikler olmaksızın mesane ve renal papilla transisyonel epitelyum hiperplazisi gözlenmiştir. Kronik imatinib tedavisi ile fırsatçı enfeksiyonların oranında artış gözlenmiştir.
39 haftalık maymun çalışmasında NOAEL (advers etkinin görülmediği düzey), 15 mg/kg olan en düşük dozda saptanmış olup bu doz, vücut yüzeyi bazında 800 mg'lık maksimum insan dozunun yaklaşık üçte biridir. Tedavi, bu hayvanlarda normalde baskılanmış olan malaryal enfeksiyonlarda kötüleşme ile sonuçlanmıştır.
İmatinib, bir in vitro bakteriyel hücre testinde (Ames test), bir in vitro memeli hücre testinde (fare lenfoması) ve bir in vivo sıçan mikronükleus testinde test edildiğinde genotoksik etki göstermemiştir. Metabolik aktivasyon varlığında klastojenisiteye (kromozom aberasyonu) yönelik bir in vitro memeli hücre testinde (Çin hamsterı overi) imatinib için pozitif genotoksik etkiler elde edilmiştir. Üretim prosesinin, son üründe de bulunan iki ara ürünü Ames testinde mutajenisite açısından pozitiftir. Bu ara ürünlerden biri ayrıca fare lenfoma testinde de pozitif sonuç vermiştir.
Bir fertilite çalışmasında çiftleşmeden önce 70 gün süreyle dozlar uygulanan erkek sıçanlarda testiküler ve epididimal ağırlıklar ve hareketli sperm yüzdesi, beden yüzey alanı bazında 800 mg/gün maksimum klinik dozu ile yaklaşık olarak eşit olan 60 mg/kg dozunda azalmıştır. Bu etki, ≤ 20 mg/kg dozlarda görülmemiştir. Köpekte ≥ 30 mg/kg oral dozlarda spermatogenezde de hafif ila orta dereceli bir azalma gözlenmiştir. Dişi sıçanlar, çiftleşmeden önce 14 gün süreyle ve 6. gestasyon gününe kadar dozlar uygulandığında çiftleşme ya da gebe hayvan sayısında herhangi bir etki söz konusu olmamıştır. 60 mg/kg dozunda dişi sıçanlarda önemli ölçüde implantasyon sonrası fetal kayıp ve canlı fetüs sayısında azalma olmuştur. Bu etki ≤ 20 mg/kg dozlarda görülmemiştir.
Sıçanlarla yürütülen bir oral prenatal ve postnatal gelişim çalışmasında 45 mg/kg/gün grubunda gestasyonun 14 ya da 15. gününde kırmızı vajinal akıntı kaydedilmiştir. Aynı dozda ölü doğan yavru sayısı ve ayrıca doğum sonrası 0-4 günler arasında ölen yavru sayısı da artmıştır. F1 yavrularda aynı doz düzeyinde ortalama vücut ağırlıkları doğumdan öldürülene kadar geçen sürede azalmıştır ve prepusyal ayrılma kriterine ulaşan yavru sayısı da hafif azalmıştır. 45 mg/kg/gün dozunda F1 fertilitesi etkilenmemiş, diğer yandan rezorpsiyon sayısında artış ve canlı fetüs sayısında azalma tespit edilmiştir. Gerek anne hayvanlar gerekse F1 nesil için etkinin gözlenmediği düzey (NOEL) 15 mg/kg/gün (800 mg'lık maksimum insan dozunun dörtte biri) olmuştur.
İmatinib organogenez sırasında, vücut yüzey alanı bazında 800 mg/gün maksimum klinik doz ile yaklaşık olarak eşit olan ≥ 100 mg/kg dozlarda sıçanlara uygulandığında teratojen etki göstermiştir. Teratojenik etkiler eksensefali veya ensefalosel, frontal kemiklerin olmaması/eksik olması ve parietal kemiklerin olmamasını içermiştir. Bu etkiler ≤ 30 mg/kg dozlarda görülmemiştir.
Sıçanlarda juvenil gelişim toksikolojisi çalışmasında (doğum sonrası 10 ile 70. gün) bilinen hedef organlara göre yeni hedef organ tanımlanmamıştır. Juvenil toksikoloji çalışmasında, ortalama pediyatrik maruziyet olarak önerilen en yüksek doz olan 340 mg/m2 düzeyinin yaklaşık 0,3 ila 2 katı düzeylerde, büyüme üzerinde geçici etkiler ve vaginal açılma ve prepusyal ayrılmada gecikme gözlenmiştir. Ayrıca, ortalama pediyatrik maruziyet olarak önerilen en yüksek doz olan 340 mg/m2 düzeyinin yaklaşık
2 katı düzeylerde, juvenil hayvanlarda (yaklaşık olarak sütten kesilme döneminde) mortalite gözlemlenmiştir.
2 yıllık sıçan karsinojenisite çalışmasında 15, 30 ve 60 mg/kg/gün olarak imatinib uygulanması, erkeklerde 60 mg/kg/gün dozunda ve dişilerde ≥ 30 mg/kg/gün dozunda yaşam süresi üzerinde istatistiksel açıdan anlamlı azalmaya neden olmuştur. Ölenlerde yapılan histopatolojik inceleme, ölümün temel nedeni ya da öldürülme nedeni olarak kardiyomiyopati (her iki cinsiyet), kronik ilerleyici nefropati (dişiler) ve prepusyal bez papillomunu ortaya koymuştur. Neoplastik değişiklikler açısından hedef organlar böbrekler, mesane, üretra, prepusyal ve klitoral bez, ince bağırsak, paratiroid bezleri, adrenal bezler ve glandüler-olmayan mide olmuştur.
Prepusyal/klitoral bezde papilloma/karsinoma sırasıyla 400 mg/gün veya 800 mg/gün dozlarında insan günlük maruziyetinin 0,5 veya 0,3 katına (EAA bazında) ya da çocuklarda 340 mg/m2/gün dozunda günlük maruziyetin 0,4 katına karşılık gelen (EAA bazında) 30 mg/kg/gün dozundan itibaren gözlenmiştir. Etki gözlenmeyen düzey (NOEL) 15 mg/kg/gün olmuştur. 400 mg/gün veya 800 mg/gün dozlarında insan günlük maruziyetinin sırasıyla 1,7 veya 1 katına (EAA bazında) ya da çocuklarda 340 mg/m2/gün dozunda günlük maruziyetin 1,2 katına karşılık gelen (EAA bazında) 60 mg/kg/gün dozunda renal adenoma/karsinoma, mesane ve üretra papilloması, ince bağırsak adenokarsinomaları, paratiroit bezleri adenomaları, adrenal bezlerde benign ve malign medüller tümörler ve glandüler olmayan mide papillomaları/karsinomaları görülmüştür. Etki gözlenmeyen düzey (NOEL), 30 mg/kg/gün olmuştur.
İnsanlar için sıçan karsinojenisite çalışmasındaki bu bulguların mekanizması ve önemi, henüz açıklığa kavuşturulmamıştır.
Erken dönem klinik çalışmalarda tanımlanmayan non-neoplastik lezyonlar kardiyovasküler sistem, pankreas, endokrin organlar ve dişlerle ilgili olmuştur. En önemli değişiklikler bazı hayvanlarda kalp yetmezliği belirtilerine yol açan kardiyak hipertrofi ve dilatasyonu içermiştir.
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A03432 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504091014 |
| Etkin Madde | Imatinib |
| ATC Kodu | L01EA01 |
| Birim Miktar | 400 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |