GLIVON 200 mg 60 film kaplı tablet Farmakolojik Özellikler
{ Imatinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajan, protein-tirozin kinaz inhibitörü, BCR-ABL tirozin kinaz inhibitörleri
ATC kodu: L01EA01
Etki mekanizması:
İmatinib küçük bir molekül yapısına sahip bir protein-tirozin kinaz inhibitörüdür; Bcr- Abl tirozin kinaz (TK) aktivitesini ve birçok reseptör TK'yı kuvvetli bir şekilde inhibe etmektedir: KIT, c-KIT proto-onkogen tarafından kodlanan kök hücre faktörü (Stem cell factor - SCF) reseptörü, diskoidin etki bölgesine ait reseptörler (DDR1 ve DDR2), koloni uyarıcı faktör reseptörü (CSF-1R), trombosit kökenli büyüme faktörü (Platelet derived growth factor - PDGF) reseptörleri alfa ve beta (PDGFR-alfa ve PDGFR-beta). İmatinib aynı zamanda bu reseptör kinazların aktivasyonunun aracılık ettiği hücresel olayları da inhibe edebilmektedir.
İmatinib, in vitro, hücresel ve in vivo düzeylerde kırılma noktalarının yoğunlaştığı bölge- Abelson (Bcr-Abl) tirozin kinazı güçlü bir şekilde inhibe eden bir protein-tirozin kinaz inhibitörüdür. Bileşik, Bcr-Abl pozitif hücre dizilerinde, Philadelphia kromozom pozitif KML ve ALL hastalarının yeni lösemi hücrelerinde selektif olarak proliferasyonu inhibe etmekte ve apopitozisi uyarmaktadır. Ex vivo periferik kan ve kemik iliği örneklerinin kullanıldığı koloni transformasyontahlillerinde, imatinibKML hastalarındaki Bcr-Abl
Bileşik, in vivo olarak, Bcr-Abl pozitif tümör hücreleri kullanılan hayvan modellerinde tek ajan olarak anti-tümör aktivite gösterir.
İmatinib, aynı zamanda trombosit türevi büyüme faktörü (Platelet derived growth factor - PDGF) ve kök hücre faktörü (Stem cell factor - SCF), c-KIT için reseptör tirozin kinazların bir inhibitörüdür ve PDGF- ve SCF- tarafından yönlendirilen hücresel olayları inhibe eder. In vitro olarak, imatinib, aktive edici bir KIT mutasyonunu ekspres eden GIST hücrelerinde proliferasyonu inhibe eder ve apopitozu uyarır. MDS/MPD, DFSP ve HES patogenezinde; PDGF reseptör veya Abl protein kinazların, farklı ortak proteinlerin birleşimi sonucu sürekli olarak aktif duruma geçmesinin veya sürekli PDGF üretiminin rol oynadığı düşünülmektedir. Ayrıca, c-KIT ya da PDGFR'nin konstitütif aktivasyonu SM'nin patojenezinde rol oynayan muhtemel nedendir. İmatinib, düzensizleşen PDGFR veya ABL kinaz aktivitesinin neden olduğu sinyalizasyonu ve hücre proliferasyonunu inhibe eder.
Kronik Miyeloid Lösemide Klinik Çalışmalar
İmatinibin etkinliği, bir bütün olarak elde edilen hematolojik ve sitogenetik yanıt oranlarını ve hastalıksız sağkalım süresini temel alır. Yeni tanı almış KML harici, hastalık ilişkili semptomların iyileşmesi veya sağkalım süresinin artması gibi klinik faydaların olduğunu gösteren kontrollü çalışma yoktur.
Bütün klinik çalışmalarda hastaların %38-40'ının en az 60, %10-12'sinin en az 70 yaşında olduğu bildirilmiştir.
Kronik faz, yeni tanı konulmuş: Bu faz III çalışmasında, imatinib monoterapisi, interferon-alfa (IFN) + sitarabin (ARA-C) kombinasyonuyla karşılaştırılmıştır. Kullanılan tedaviye yanıt vermeyen hastaların, kullandıkları tedaviyi bırakarak diğer tedaviyi kullanmalarına izin verilmiştir. İmatinib grubundaki hastalarda günde 400 miligramlık doz kullanılmıştır. IFN grubundaki hastalar, hedef alınan günlük subkütan IFN dozu 5 MIU/m + her ayın 10 günü, günde 20 mg/m Ara-C kombinasyonu kullanmıştır.
16 ülkedeki 177 çalışma merkezinden toplam 1106 (her grupta 553) hasta, randomize edilmiştir. Yaşları 18-70 arasında değişmek üzere ortanca 51 olan hastaların
%21,9'unun, 60 yaşında ya da daha ileri yaşta olduğu görülmüştür. Verilerin bu analizde kullanılmak üzere derlendiği sıradaki (son hastanın kaydedilmesinden 7 yıl sonra) ortanca ilk seçenek tedavi süresi imatinib grubunda 82, IFN (kombinasyon) grubunda 8 aydır. İmatinib ile ortanca ikinci seçenek tedavi süresi 64 aydır. İmatinib grubuna ayrılmış olan hastaların %60'ı, başlangıçta kullandıkları ilaca (imatinib) devam etmektedir. Bu hastalarda ortalama imatinib dozu 403±57 mg'dir. Genel olarak, birinci seçenek olarak imatinib alan hastalarda dağıtılan ortalama günlük doz 406±76 mg'dır. IFN + ARA-C grubundaki hastaların yalnızca %2'si başlangıçta kullandıkları tedaviye devam etmektedir. IFN + ARA-C grubunda başlangıçtaki tedaviye devam etmeyen hastalarda bunun en sık rastlanan nedeni (%14), hastaların verdikleri onayı geri çekmesi; imatinib grubuna geçenlerde ise buna en sık (hastaların %26'sında) yol açan neden, şiddetli intolerans ve hastalığın ilerlemesidir (%14). Primer bitiş noktası, hastalıksız sağkalım süresidir. Sekonder sonlanım noktalarının yanıt verileri de Tablo 2'de gösterilmektedir.
Tablo 2 Yeni tanı konulan KML çalışmasındaki yanıt oranları (84 aylık veri)
(En iyi yanıt oranları) | İmatinib n=553 | IFN+Ara-C n=553 |
Hematolojik yanıt THY oranı n (%) |
534 (96,6)* |
313 (56,6)* |
[%95 güven aralığı] | 94,7, 97,9 | 52,4, 60,8 |
Sitogenetik yanıt Majör yanıt n (%) |
490 (88.6)* |
129 (23,3)* |
[%95 güven aralığı] | [85,7, 91,1] | [19,9, 27,1] |
Tam CyR n (%) | 456 (82,5)* | 64 (11,6)* |
Kısmi CyR n (%) | 34 (6,1) | 65 (11,8) |
Moleküler Yanıt** 12 aydaki majör yanıt (%) |
50,2 |
9,6 |
24 aydaki majör yanıt (%) | 70,2 | 25 |
84 aydaki majör yanıt (%) | 87,9 | 75 |
Hematolojik yanıt kriterleri (bütün yanıtlar 4 hafta sonra doğrulanmalıdır):
Sitogenetik yanıt kriterleri:
Majör moleküler yanıt kriterleri:
Birinci basamak tedavide tam hematolojik yanıt, majör sitogenetik yanıt ve tam sitogenetik yanıt oranları, son muayene tarihinde yanıtsızlıkların sansürlendiği Kaplan- Meier yaklaşımı kullanılarak hesaplanmıştır. Bu yaklaşım kullanıldığında, imatinib ile birinci basamak tedavi için hesaplanan kümülatif yanıt oranları 12 aylık tedaviden 84 aylık tedaviye şu şekilde düzelme göstermiştir: THY %96,4'ten %98,4'e ve TSY
%69,5'ten %87,2'ye.
7 yıllık takipte, imatinib grubunda 93 (%16,8) olay olmuştur: 37 (%6,7) hızlanmış faz/blastik kriz (AF/BK) ilerleme, 31 (%5,6) major sitogenetik yanıt (MSY) kaybı, 15 (%2,7) tam hematolojik yanıt (THY) kaybı ya da white blood cell (beyaz kan hücresi) (WBC) artışı ve 10 (%1,8) KML ile ilişkisiz ölüm. Buna karşılık IFN+Ara-C grubunda 165 (%29,8) olay olmuş ve bunların 130'u birinci seçenek IFN+Ara-C tedavisi sırasında meydana gelmiştir.
84 ayda tahmin edilen progresyonsuz sağkalım imatinib grubunda %95 güven aralığı ile
%81.2 (78, 85) ve kontrol grubunda %60.6 (56.5) olmuştur (p < 0.001).
84 ayda hızlanmış faza ya da blast krizine ilerleme olmayan hastaların tahmin edilen oranı, IFN grubu ile karşılaştırıldığında imatinib grubunda anlamlı düzeyde yüksek olmuştur (%85,1 (82,89) karşısında %92,5 (90,95), p <0,001). Yıllık progresyon hızı tedavide geçirilen süre ile birlikte azalmaktadır.
İmatinib ve IFN+Ara-C gruplarında, sırasıyla, toplam 71 (%12,8) ve 85 (%15,4) hasta ölmüştür. 84 ayda randomize imatinib ve IFN+Ara-C gruplarında tahmin edilen genel sağkalım, sırasıyla %86,4 (83, 90) ve %83,3 (80, 87) düzeyindedir (p=0.073, log-rank testi). Buna ek olarak, 84 aylık verilere göre imatinib hastalarında yalnızca 31 (%5,6) ölüm (BMT öncesi) KMLileilişkilendirilmiştir.Bunakarşılık IFN+Ara-C hastalarında
dikkate alınır ve BMT sonrası ya da diğer nedenlerle meydana gelen bütün ölümler sansürlenirse, tahmin edilen 84 aylık sağkalım oranları %93,6 ve %91,1 olmaktadır (p=0,1, log-rank testi).
İmatinib tedavisinin kronik fazdaki, yeni tanı konulmuş KML'deki sağkalım etkisi, aynı rejimde IFN+Ara-C (n=325) kullanılan başka bir Faz III çalışmadan elde edilen birincil verilerle birlikte yukarıda belirtilen imatinib verilerinin retrospektif analizinde ayrıntılı olarak incelenmiştir. Bu yayında, genel sağkalım bakımından imatinibin IFN+Ara-C karşısındaki üstünlüğü kanıtlanmıştır (p<0,001); 42 ay içinde 47 (%8,5) imatinib hastası ve 63 (%19,4) IFN+Ara-C hastası ölmüştür.
İmatinib tedavisindeki hastalarda sitogenetik yanıt ve moleküler yanıt derecesi, uzun dönem sonuçlar üzerinde açık bir etkiye sahip olmuştur. 12 ayda TSY'si (KSY) olan hastaların tahmini %96'sında (%93) akselere faza/blast krizine progresyon olmazken 12 ayda MSY'si olmayan hastaların sadece %81'inde 84 ayda ilerlemiş KML'ye progresyon olmadığı görülmüştür (genel p<0,001, TSY ile KSY arasında p=0,25). 12 ayda Bcr-Abl transkriptlerinde en az 3 logaritmalık azalması olan hastalarda akselere faza/blast krizine progresyonsuz kalma olasılığı 84 ayda %99 bulunmuştur. 18 aylık dönüm noktası analizine dayanılarak benzer bulgular tespit edilmiştir.
Bu çalışmada günde 400 mg'dan 600 mg'a, ardından günde 600 mg'dan 800 mg'a doz artırımlarına izin verilmiştir. 42 aylık izlem sonrasında 11 hasta sitogenetik yanıtlarında doğrulanmış bir kayıp (4 hafta içinde) deneyimlemiştir. Bu 11 hastanın 4'ünde doz günde 800 mg'a artırılmış olup hastaların 2'si sitogenetik yanıtı tekrar elde etmiş (1'inde kısmi, 1'inde tam; tam yanıt elde eden ayrıca moleküler yanıta da ulaşmıştır), diğer yandan dozları artırılmayan 7 hastanın sadece biri tam sitogenetik yanıtı tekrar elde etmiştir. Doz artırımı öncesindeki hasta popülasyonu (n=551) ile karşılaştırıldığında, dozun günde 800 mg'a yükseltildiği 40 hastada bazı advers reaksiyonların yüzdesi daha yüksek olmuştur. Daha sık görülen advers reaksiyonlar gastrointestinal hemorajileri, konjonktivit ve transaminazlar veya bilirubinde yükselmeyi içermiştir. Diğer advers olaylar daha düşük ya da eşit sıklıkla bildirilmiştir.
Kronik faz, interferon tedavisinin başarısız kaldığı hastalar: 532 hasta, 400 miligramlık başlangıç dozuyla tedavi edilmiştir. Bu hastalar; hematolojik başarısızlık (%29), sitogenetik başarısızlık (%35) veya interferon intoleransı (%36) olmak üzere başlıca 3 gruba ayrılmıştır. Hastalar daha önce medyan 14 ay boyunca ≥25 x 10 IU/hafta dozlarda IFN tedavisi görmüştür ve hepsi de geç kronik fazdadır; tanıdan itibaren geçen medyan süre 32 aydır. Çalışmanın birincil etkililik değişkeni majör sitogenetik yanıt oranıdır (tam yanıt artı kısmı yanıt, kemik iliğinde %0 ila %35 Ph+ metafaz).
Bu çalışmada hastaların %65'i bir majör sitogenetik yanıta ulaşmıştır; hastaların
%53'ünde (doğrulanmış %43) yanıt tamdır (Tablo 3). Hastaların %95'inde tam hematolojik yanıta ulaşılmıştır.
Bu çalışmada hastaların %65'inde (%53'ü tam olmak üzere) majör sitogenetik yanıt elde
edilmiştir. Hastaların %95'i bu tedaviye tam hematolojik yanıt vermiştir.
Hızlanmış faz: Bu fazdaki 235 KML vakasanın ilk 77'sinde tedaviye günde 400 mg ile başlanmıştır; daha sonra çalışma protokolü, daha yüksek imatinib dozlarının kullanılmasına olanak tanıyacak şekilde tadil edilmiştir ve geriye kalan 158 hasta, başlangıçta 600 mg imatinibkullanmıştır.
Tam hematolojik yanıt, hiçbir lösemi kanıtının mevcut olmaması (kemik iliğindeki ve
kandaki blast hücrelerinin kaybolması, ancak periferik kan tablosunda, tam yanıt için gereken düzelmenin gerçekleşmemesi) veya kronik faz kronik miyeloid lösemiye dönüş olarak tanımlanan tam hematolojik yanıt ede edilme oranı, bu çalışmanın etkililik konusundaki değerlendirilen primer parametresi olmuştur. Doğrulanmış hematolojik yanıt, hastaların %71,5'inde elde edilmiştir. Bu hastalardan %27,7'sinde ayrıca majör sitogenetik yanıt (%20,4'ünde tam sitogenetik yanıt) alınmış olması önemlidir. 600 mg imatinib kullanan hastalarda bugünkü saptamalara göre tahmini ortanca medyan hastalıksız sağkalım ve genel sağkalım oranları, sırasıyla 22,9 ay ve 42,5 ay olarak hesaplanmıştır.
Miyeloid blast krizi: Bu çalışma, blast krizi gelişmiş olan 260 hasta üzerinde yapılmıştır. Bu hastaların 95'i (%37'si), hızlanmış faz veya yine blast krizi nedeniyle daha önce de kemoterapi görmüştür (âönceden tedavi edilmiş olan hastalarâ), 165 (%63) hastada ise daha önce kemoterapi uygulanmamıştır (âönceden tedavi edilmemiş olan hastalarâ). Başlangıç dozu, ilk 37 hastada 400 miligramdı; daha sonra yapılan protokol tadilatı, daha yüksek dozların kullanılmasına olanak verdiğinden, diğer 223 hasta, başlangıçta 600 mg imatinib kullanmıştır.
Primer etkililik parametresi, hızlanmış faz çalışmasında olduğu gibi yine tam hematolojik yanıt, lösemi kanıtının mevcut olmaması veya kronik faza dönüş olarak tanımlanan, hematolojik yanıt oranı olmuştur. Hastaların %31'inde hematolojik yanıt elde edilmiştir. 600 mg imatinib kullanan hastalardaki hematolojik yanıt oranı, 400 mg imatinib kullanmış olanlara kıyasla daha yüksektir (%16'ya karşılık %33, p=0,0220). Daha önceden tedavi edilmemiş ve tedavi edilmiş hastaların mevcut tahmini ortalama sağkalımı sırasıyla 7,7 ve 4,7 aydır.
Lenfoid blast krizi: Faz I çalışmalara sınırlı sayıda hasta kaydedilmiştir (n=10). Hematolojik yanıt oranı, 2-3 aylık süre ile %70 bulunmuştur.
Tablo 3 KML vakalarında elde edilen yanıtlar
| |||
|
|
|
|
sitogenetik yanıt.
Pediyatrik hastalar: Kronik faz KML'si (n=11) veya blast krizi aşamasında KML'si ya da Ph+ akut lösemileri (n=15) olan, 18 yaş altı toplam 26 pediyatrik hasta bir faz I doz yükseltme çalışmasına kaydedilmiştir. Bu, yoğun ön tedavi görmüş hastalardan oluşan bir popülasyondur: hastaların %46'sı önceden BMT ve %73'ü önceden çoklu ajanlı kemoterapi görmüştür. Hastalar 260 mg/m/gün (n=5), 340 mg/m/gün (n=9), 440 mg/m/gün (n=7) ve 570 mg/m/gün (n=5) imatinib dozları ile tedavi edilmiştir. Sitogenetik verileri mevcut olan 9 kronik faz KML hastasının 4'ünde (%44) ve 3'ünde (%33) sırasıyla tam ve kısmi sitojenik yanıt elde edilmiş olup bu oranlar %77 MCyR değeri ile sonuçlanmıştır.
Yeni tanı almış ve tedavi edilmemiş, kronik fazda KML'si olan toplam 51 pediyatrik hasta açık-etiketli, çok merkezli, tek kollu bir faz II çalışmaya kaydedilmiştir. Hastalar
340 mg/m/gün imatinib ile tedavi edilmiş, doz sınırlayıcı toksisitesi hariç ara verilmemiştir. İmatinib tedavisi yeni tanı konmuş pediyatrik KML hastalarında, 8 haftalık tedavi sonrasında %78 CHR oranı ile hızlı yanıt sağlamaktadır. Yüksek CHR oranına, hastaların %65'inde tam sitojenik yanıt (CCyR) gelişimi eşlik etmiş olup bu oran, erişkinlerde gözlenen sonuç ile karşılaştırılabilir niteliktedir. Ek olarak, hastaların
%16'sında kısmı sitojenik yanıt (PCyR) gözlenmiş, bu da %81 MCyR değerinivermiştir. CCyR'ye ulaşan hastaların büyük çoğunluğu, Kaplan-Meier tahmine dayalı 5.6 aylık yanıta kadar geçen medyan süre ile CCyR'ye 3 ila 10'uncu aylar arasında ulaşmıştır.
Avrupa İlaç Ajansı, Philadelphia kromozomu (bcr-abl translokasyon) pozitif kronik faz kronik miyeloid lösemide pediyatrik popülasyonun tüm alt kümelerinde imatinib ile çalışmaların sonuçları sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım ile ilgili bilgi için bkz. bölüm 4.2).
Ph+ ALL için klinik çalışmalar
Yeni teşhis edilen Ph+ ALL:
Kontrol grubuna yer vererek yapılan ve imatinibin, 55 yaş ve üzeri yeni tanı almış 55 hastada kemoterapi indüksiyonuyla karşılaştırıldığı bir çalışmada (ADE10), tek ajan olarak kullanılan imatinib, kemoterapiye kıyasla anlamlı derecede daha yüksek tam hematolojik yanıt oranı ile sonuçlanmıştır (%50'ye karşılık %96,3, p=0,0001). Kemoterapiye yanıt vermeyen veya zayıf yanıt veren hastalarda imatinib kurtarma tedavisi olarak kullanıldığında, 11 hastanın 9'unda (%81,8) tam hematolojik yanıt elde edilmiştir. Bu klinik etki, 2 haftalık tedaviden sonra, kemoterapi kolu ile karşılaştırıldığında imatinib ile tedavi edilen hastalarda, bcr-abl transkriptlerinde daha büyük bir azalmayla ilişkilendirilmiştir (p=0,02). Tüm hastalar indüksiyon sonrasında imatinib ve konsolidasyon kemoterapisi almış (bkz. Tablo 4) ve bcr-abl transkriptlerinin düzeyleri sekizinci haftada iki kolda aynı olmuştur. Çalışma tasarımı doğrultusunda beklendiği üzere, iki grup arasında remisyon süresi, hastalıksız sağkalım veya genel sağkalım açısından herhangi bir fark gözlenmemiş, ancak tam moleküler yanıt elde edilen ve minimal rezidüel hastalık düzeyinde kalan hastalarda gerek remisyon süresi (p=0.01) gerekse hastalıksız sağkalım (p=0,02) bakımından sonuçlar daha iyi olmuştur.
Kontrol gruplarına yer verilmeyen dört klinik çalışmada (AAU02, ADE04, AJP01 ve AUS01) yeni tanı almış 211 Ph+ ALL hastasından oluşan bir popülasyonda gözlenen sonuçlar, yukarıda tarif edilen sonuçlar ile uyumludur. Kemoterapi indüksiyonu ile kombinasyon halindeki imatinib (bkz. Tablo 4) %93'lük bir tam hematolojik yanıt oranı (değerlendirilebilir 158 hastanın147'si)ve%90'lıkbirmajör sitogenetik yanıt oranı
%48 bulunmuştur (değerlendirilebilir 102 hastanın 49'u). Hastalıksız sağkalım (DFS) ve
genel sağkalım (OS) her durumda 1 yılı geçmiştir ve iki çalışmadaki (AJP01 ve AUS01) geçmiş kontrolden üstün olmuştur (DFS p<0,001; OS p<0,0001).
Tablo 4 İmatinible kombinasyon halinde kullanılan kemoterapi rejimi
Çalışma ADE10 | |
Faz öncesi | DEX 10 mg/m oral, gün 1-5; CP 200 mg/m i.v., gün 3, 4, 5 MTX 12 mg intratekal, gün 1 |
Remisyon indüksiyonu | DEX 10 mg/m oral, gün 6-7, 13-16; VCR 1 mg/m i.v., gün 7, 14; IDA 8 mg/m i.v. (0.5 h), gün 7, 8, 14, 15; CP 500 mg/m i.v. (1 h), gün 1; Ara-C 60 mg/m i.v., gün 22-25, 29-32 |
Konsolidasyon tedavisi I, III, V | MTX 500 mg/m i.v. (24 h), gün 1, 15; 6-MP 25 mg/m oral, gün 1-20 |
Konsolidasyon tedavisi II, IV | Ara-C 75 mg/m i.v. (1 h), gün 1-5; VM26 60 mg/m i.v. (1 h), gün 1-5 |
Çalışma AAU02 | |
İndüksiyon tedavisi (de novo Ph+ ALL) | Daunorubisin 30 mg/m i.v., gün 1-3, 15-16; VCR 2 mg toplam doz i.v., gün 1, 8, 15, 22; CP 750 mg/m i.v., gün 1, 8; Prednizon 60 mg/m oral, gün 1-7, 15-21; IDA 9 mg/m oral, gün 1-28; MTX 15 mg intratekal, gün 1, 8, 15, 22; Ara-C 40 mg intratekal, gün 1,8, 15, 22; Metilprednizolon 40 mg intratekal, gün 1, 8, 15, 22 |
Konsolidasyon (de novo Ph+ ALL) | Ara-C 1000 mg/m/12 h i.v. (3 h), gün 1-4; Mitoksantron 10 mg/m i.v., gün 3-5; MTX 15 mg intratekal, gün 1; Metilprednizolon 40 mg intratekal, gün 1 |
Çalışma ADE04 | |
Faz öncesi | DEX 10 mg/m oral, gün 1-5; CP 200 mg/m i.v., gün 3-5; MTX 15 mg intratekal, gün 1 |
İndüksiyon tedavisi I | DEX 10 mg/m oral, gün 1-5; VCR 2 mg i.v., gün 6, 13, 20; Daunorubisin 45 mg/m i.v., gün 6-7, 13-14 |
İndüksiyon tedavisi II | CP 1 g/m i.v. (1 h), gün 26, 46; Ara-C 75 mg/m i.v. (1 h), gün 28-31, 35-38, 42-45; 6-MP 60 mg/m oral, gün 26-46 |
Konsolidasyon tedavisi | DEX 10 mg/m oral, gün 1-5; Vindesine 3 mg/m i.v., gün 1; MTX 1.5 g/m i.v. (24 h), gün 1; Etoposide 250 mg/m i.v. (1 h) gün 4-5; Ara-C 2 x 2 g/m i.v. (3 h, q 12 h), gün 5 |
Çalışma AJP01 |
|
İndüksiyon tedavisi | CP 1,2 g/m i.v. (3 h), gün 1; Daunorubisin 60 mg/m i.v. (1 h), gün 1-3; Vinkristin 1,3 mg/m i.v., gün 1, 8, 15, 21; Prednizolon 60 mg/m/gün oral |
Konsolidasyon tedavisi | Değişimli kemoterapi kürü: MTX 1 g/m i.v. (24 h) gün 1 ile yüksek kemoterapi ve 4 siklus boyunca Ara-C 2 g/m i.v. (q 12 h), gün 2-3 |
İdame | VCR 1,3 g/m i.v., gün 1; Prednizolon 60 mg/m oral, gün 1-5 |
Çalışma AUS01 rulama Kodu: 1ZW56ak1UZ1AxS3k0M0FyZW56Q3NRak1U | |
İndüksiyon-konsolidasyon tedavisi | Hyper-CVAD rejimi: CP 300 mg/m i.v. (3 h, q 12 h), gün 1-3; Vinkristin 2 mg i.v., gün 4, 11; Doksorubisin 50 mg/m i.v. (24 h), gün 4; Değişimli olarak DEX 40 mg/gün gün 1-4 ve 11-14 ya da MTX 1 g/m i.v. (24 h) gün 1 ve Ara-C 1 g/m i.v. (2 h, q 12 h), gün 2-3 (toplam 8 kür). |
İdame | 13 ay boyunca aylık olarak VCR 2 mg i.v.; Prednizolon 200 mg oral, 13 ay boyunca ayda 5 gün |
Tüm tedavi rejimleri CNS profilaksisi için steroid uygulaması içermelidir. | |
Ara-C: sitozin arabinozid; CP: siklofosfamid; DEX: deksametazon; MTX: metotreksat; 6-MP: 6- merkaptopürin; VM26: Teniposide; VCR: vinkristin; IDA: idarubisin; i.v.: intravenöz. | |
Pediyatrik hastalar: I2301 çalışmasında, Ph+ ALL'si olan toplam 93 pediyatrik, ergen ve genç yetişkin hasta (18 ila 22 yaşları arasındaki 4 hasta dahil) açık etiketli, çok merkezli, sıralı gruplu, randomize olmayan bir faz III çalışmaya kaydedilmiş ve indüksiyon tedavisinden sonra yoğun kemoterapi ile kombinasyon halinde imatinib (340 mg/m/gün) ile tedavi edilmiştir. İmatinib 1. gruptan 5. gruba doğru artan süre ve daha erken imatinib tedavisi olacak şeklilde aralıklı olarak uygulanmıştır; en düşük imatinib yoğunluğu grup 1'de ve en yüksek imatinib yoğunluğu grup 5'tedir (ilk kemoterapi tedavi kürleri sırasında sürekli günlük imatinib doz uygulaması ile gün olarak en uzun süre). Grup 5 hastalarında (n=50) kemoterapi ile kombinasyon halinde tedavi kürünün erken dönemlerinde imatinibe sürekli günlük maruziyet, imatinibsiz standart kemoterapinin uygulandığı tarihsel kontrollerle (n=120) karşılaştırıldığında 4 yıllık olaysız sağkalımı (EFS) artırmıştır (sırasıyla %69,6'ya karşılık %31,6). Grup 5 hastalarında tahmini 4 yıllık GS, tarihsel kontrollerdeki %44,8 değeri ile karşılaştırıldığında %83,6 olmuştur.
Nüksetmiş/tedaviye dirençli Ph+ ALL
İmatinib, yineleyen/refraktör Ph+ ALL hastalarında tek ajan olarak kullanıldığında, 411 hastanın 53'ünde yanıt değerlendirilebilmiş, hematolojik yanıt oranı %30 (%9'u tam) ve majör sitogenetik yanıt oranı ise %23 olarak bulunmuştur (Not: 411 hastanın 353'ü, primer yanıt verileri toplanmaksızın genişletilmiş erişim çalışmasında tedavi edilmiştir). 411 yineleyen/refraktör Ph+ ALL hastasından oluşan toplam popülasyonda progresyona kadar geçen medyan süre 2,6 ile 3,1 ay aralığında olurken, değerlendirilebilir 401 hastada medyan genel sağkalım 4.9 ile 9 ay aralığında bulunmuştur. Bu veriler, sadece 55 yaş ve üzeri hastalar dahil edilecek şekilde yeniden analiz yapıldığında da benzer olmuştur.
SM ile İlgili Klinik Çalışmalar
ABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında imatinibin test edildiği açık-etiketli, çok merkezli bir faz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada tedavi edilen ve 45'inde hematolojik hastalıklar, 140'ında da çeşitli solid tümörler bulunan 185 hastadan 5'inde SM saptanmıştır. SM hastaları günlük 100 mg ila 400 mg imatinib ile tedavi edilmiştir. Yayınlanmış 10 vaka raporu ve vaka serisinde, yaşları 26 ila 85 arasında değişen 25 SM hastası daha bildirilmiştir. Bu hastalara da günlük 100 mg ila 400 mg dozda imatinib uygulanmıştır. SM için tedavi edilen toplam popülasyonun (30 hasta) 10'unda (%33) tam hematolojik yanıt, 9'unda (%30) kısmi hematolojik yanıt elde edilmiştir (toplam yanıt oranı %63). Sitogenetik anormallikler yayınlanmış raporlarda ve çalışma B2225'te tedavi edilen 30 hastanın 21'inde değerlendirilmiştir. Bu 21 hastanın sekizinde FIP1L1-PDGFR-alfa füzyon kinaz saptanmıştır. Çalışma B2225'te tedavi edilen hastalarda ortanca medyan tedavi süresi 13 ay olmuş (aralık: 1,4-22,3 ay), yayınlanmış literatürde yanıt veren hastalarda ise aralık 1 ay ila 30 ayın üzerinde bir süre
HES ile İlgili Klinik Çalışmalar
ABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında imatinibin test edildiği açık-etiketli, çok merkezli bir faz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada, toplam 185 hastadan (45'i hematolojik hastalık, 140'ında çeşitli solid tümörler saptanmıştır) HES'i olan 14 hasta günde 100 mg ila 1000 mg dozda imatinib ile tedavi edilmiştir. Yayınlanmış 35 vaka raporu ve vaka serisinde, HES'i olan ve yaşları 11 ila 78 arasında değişen 162 hasta daha bildirilmiştir. Bu hastalara, günde 75 mg ila 800 mg dozda imatinib verilmiştir. HES için tedavi edilen toplam popülasyonun (176 hasta) 107'sinde (%61) tam hematolojik yanıt, 16'sında ise (%9) kısmi hematolojik yanıt elde edilmiştir (toplam yanıt oranı %70). Yayınlanmış raporlarda ve çalışma B2225'te, tedavi edilen 176 hastadan 117'sinde sitogenetik anormallikler değerlendirilmiştir. Bu 117 hastanın 61'i, FIP1L1-PDGFR-alfa füzyon kinaz pozitif bulunmuştur. Tüm bu FIP1L1-PDGFR- alfa füzyon kinaz pozitif hastalarda, tam hematolojik yanıt elde edilmiştir. 115 hastada FIP1L1-PDGFR- alfa füzyon ya negatif bulunmuştur ya da bilinmemektedir. Bunların 62'sinde (%54) ya tam (n=46) ya da kısmi (n=16) hematolojik yanıt elde edilmiştir. Ayrıca, vaka raporlarında araştırmacılar tarafından, semptomatoloji ve diğer organ fonksiyon bozukluğu anormalliklerinde iyileşmeler bildirilmiştir. Kalp, sinir, cilt/ciltaltı dokusu, solunum/toraks/mediasten, kas-iskelet/bağ dokusu/vasküler ve gastrointestinal organ sistemlerinde iyileşmeler bildirilmiştir.
Rezeke edilemeyen ya da metastatik GIST'de yapılan klinik çalışmalar
Rezektabl olmayan veya metastatik malign gastrointestinal stromal tümörleri (GIST) olan hastalarda faz II, açık etiketli, randomize, kontrolsüz çok uluslu bir çalışma yürütülmüştür. Bu çalışmaya 147 hasta kaydedilmiş ve 36 ay boyunca günde bir kez oral olarak 400 mg veya 600 mg kullanımına randomize edilmiştir. Bu hastalar 18 ila 63 yaşında olup, rezektabl olmayan ve/veya metastatik Kit-pozitif malign GIST patolojik tanısına sahiptir. İmmünohistokimya Kit antikoru ile (A-4502, tavşan poliklonal antiserumu, 1:100; DAKO Corporation, Carpinteria, CA) antijen geri kazanımı sonrası avidin-biotin-peroksidaz kompleksi yöntemi ile analize göre rutin olarak yürütülmüştür.
Birincil etkililik kanıtı objektif yanıt oranlarını temel almıştır. Tümörlerin en az bir hastalık bölgesinde ölçülebilir olması gerekmiş olup, yanıt karakterizasyonu Güneybatı Onkoloji Grubu (SWOG) kriterlerini temel almıştır. Bulgular Tablo 5'te sunulmaktadır.
Tablo 5 STIB2222 kodlu GIST çalışmasında en iyi tümör yanıtı
![]()
Tüm dozlar (n=147) 400 mg n= 73
600 mg n=74
Yanıtlar n (%)
![]()
İki doz grubu arasında yanıt oranları bakımından farklılıklar söz konusu olmamıştır. Ara analiz tarihinde önemli sayıda stabil hastalığa sahip hasta, daha uzun süreli tedavi ile kısmi yanıta ulaşmıştır (medyan takip süresi 31 ay). Yanıta kadar geçen medyan süre 13 hafta olmuştur (%95 GA 12-23). Yanıt veren olgularda tedavi başarısızlığına kadar
36 aylık izlem sonrasında Kaplan-Meier sağkalım tahmini %68'dir.
İki klinik çalışmada (çalışma B2222 ve gruplar arası çalışma S0033), günlük imatinib dozu, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda 800 mg'a yükseltilmiştir. Doz, toplam 103 hastada 800 mg'a çıkarılmıştır; doz yükseltildikten sonra 6 hasta kısmi yanıta ve 21 hasta hastalık stabilizasyonuna ulaşarak
%26'lık genel klinik yanıt sonucunu vermiştir. Eldeki güvenlilik verilerinden yola çıkılarak, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda dozun günde 800 mg'a çıkarılmasının, imatinibin güvenlilik profilini etkilemediği görülmektedir.
Adjuvan GIST için klinik çalışmalar
Adjuvan tedavi koşullarında imatinib, 773 hasta ile yürütülen çok merkezli, çift kör, uzun süreli, plasebo kontrollü bir faz III çalışmada (Z9001) araştırılmıştır. Bu hastaların yaşları 18-91 aralığında olmuştur. İmmünhistokimya ile KIT proteini eksprese eden primer GIST yönünde histolojik tanısı bulunan ve en geniş yerinde ≥3 mm tümör büyüklüğüne sahip olan, çalışmaya kayıt öncesindeki 14-70 gün içersinde primer GIST'i tam gross rezeksiyon ile alınan hastalar dahil edilmiştir. Primer GIST rezeke edildikten sonra hastalar şu iki koldan birine randomize edilmiştir: bir yıl süreyle imatinib 400 mg/gün veya plasebo.
Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden rekürense ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan rekürenssiz sağkalım (RFS) olmuştur.
İmatinib RFS'de anlamlı uzama sağlamış, imatinib grubunda hastaların %75'i 38. ayda rekürenssiz iken plasebo grubundaki hastaların %75'i 20. ayda rekürenssiz kalmıştır (sırasıyla %95 GA [30-hesaplanamaz]; [14-hesaplanamaz]); (tehlike oranı = 0,398 [0,259-0,610], p<0,0001). Bir yıl sonunda genel RFS, plasebo (%82,3) karşısında imatinib için anlamlı düzeyde daha iyi bulunmuştur (%97,7) (p<0,0001). Bu şekilde rekürens riski plaseboya oranla %89 azaltılmıştır (tehlike oranı = 0,113 [0,049-0,264]).
Primer GIST'lerine yönelik ameliyatları sonrasında hastalardaki rekürens riski, şu prognoz faktörleri esas alınarak retrospektif şekilde değerlendirilmiştir: tümör büyüklüğü, mitotik indeks, tümör yeri. Mitotik indeks verileri, tedavi amaçlı (ITT) popülasyonu oluşturan 713 hastanın 556'sı için mevcut idi. Birleşik Devletler Ulusal Sağlık Enstitüleri (NIH) ve Silahlı Kuvvetler Patoloji Enstitüsü (AFIP) risk sınıflandırmalarına göre yapılan alt grup analizlerinin sonuçları Tablo 6'da gösterilmektedir. Düşük ve çok düşük risk gruplarında herhangi bir fayda gözlenmemiştir. Genel bir sağkalım faydası gözlenmemiştir.
Tablo 6 NIH ve AFIP risk sınıflandırmasına göre Z9001 deneyi RFS analiz özeti
|
|
|
|
| ||
| ||||||
| ||||||
*Full takip periyodu- NE-Tahmin edilebilir değil
İkinci bir çok merkezli, açık etiketli faz III çalışmada (SSG XVIII/AIO), cerrahi GIST rezeksiyonu sonrasında olan ve aşağıdaki durumlardan birinin bulunduğu hastalarda 400 mg/gün imatinib ile 36 ay karşısında 12 aylık tedavi karşılaştırılmıştır: tümör çapı > 5 cm ve mitotik sayım > 5/50 yüksek güç alanı (HPF); veya tümör çapı > 10 cm ve herhangi bir mitotik sayım veya mitotik sayımı > 10/50 HPF olan herhangi bir büyüklükteki tümör ya da periton boşluğuna doğru rüptüre olan tümörler. Toplam 397 hastadan olur alınmış ve bu hastalar çalışmaya randomize edilmiştir (199 hasta 12 ay kolunda ve 198 hasta 36 ay kolunda) medyan yaş 61 idi [aralık 22 ila 84 yaş]). Medyan takip süresi 54 ay olup (randomizasyondan veri kesme tarihine kadar) ilk hastanın randomize edilişinden veri kesme tarihine kadar geçen medyan süre 83 aydır.
Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden nükse ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan nükssüz sağkalım (RFS) olmuştur.
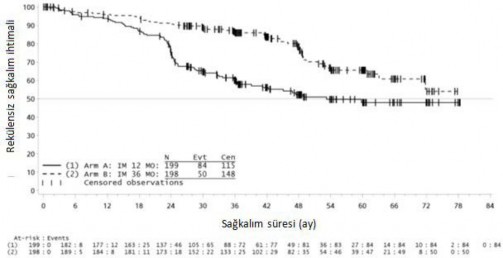
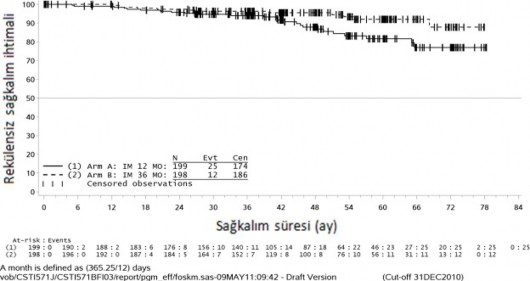
36 aylık imatinib tedavisi, 12 aylık imatinib tedavisi ile karşılaştırıldığında RFS'de anlamlı ölçüde uzama sağlamıştır (genel tehlike oranı (HR) = 0,46 [0,32, 0,65], p<0,0001) (Tablo 7, Şekil 1).
Buna ek olarak, 36 aylık imatinib tedavisi, 12 aylık imatinib tedavisi ile karşılaştırıldığında genel sağkalım (OS) süresini anlamlı ölçüde uzatmıştır (HR = 0,45 [0,22, 0,89], p=0,0187) (Tablo 7, şekil 2).
Daha uzun süreli tedavi (> 36 ay) yeni rekürenslerin oluşumunu geciktirebilmektedir; ancak, bu bulgunun genel sağkalım üzerindeki etkisi halen bilinmemektedir.
Toplam ölüm sayısı 12 aylık tedavi kolu için 25 ve 36 aylık tedavi kolu için 12 şeklinde olmuştur.
İmatinib ile 36 ay süreli tedavi, ITT analizinde, yani tüm çalışma popülasyonun dahil
edildiği analizde, 12 aylık tedaviden daha üstün bulunmuştur. Mutasyon tipine göre yapılan planlı bir alt grup analizinde, ekson 11 mutasyonları olan hastalarda 36 aylık tedavide RFS için tehlike oranı 0.35 olmuştur [%95 GA: 0.22, 0.56].
Gözlemlenen olay sayısının düşük olması sebebiyle, daha az yaygın olan mutasyon alt grupları için herhangi bir sonuç çıkartılamamaktadır.
Tablo 7 12 aylık ve 36 aylık İmatinib Tedavisi (SSGXVIII/AIO Çalışması)
| ||
|
| |
Şekil 1 Primer rekürenssiz sağkalım sonlanım noktası için Kaplan-Meier tahminleri (ITT popülasyonu)
Şekil 2 Genel sağkalım için Kaplan-Meier tahminleri (ITT popülasyonu)
Karaciğer yetersizliği olan hastalarda yapılan klinik çalışmalar
Çeşitli derecelerde (hafif, orta şiddette veya şiddetli; karaciğer fonksiyon bozukluğunun sınıflandırılması için bkz. Tablo 8) karaciğer yetersizliği olan hastalarda yapılan bir çalışmada imatinibe ortalama maruz kalım (doza göre normalize edilmiş EAA değeri), karaciğer fonksiyonu normal olan hastalara kıyasla artmamıştır. Bu çalışma sırasında hafif karaciğer bozukluğu olan hastalarda günde 500 mg, diğer hastalarda günde 300 mg imatinib, güvenle kullanılmıştır. Orta-ileri derecede şiddetli karaciğer yetersizliği olan hastalarda yalnızca 300 miligramlık doz kullanılmıştır ama farmakokinetik analiz bunun, 400 miligramla güvenle yükseltilebileceğini göstermiştir (bkz. bölüm 4.2, 4.4, 4.8 ve
5.2)
Tablo 8 Karaciğer yetersizliğinin sınıflandırılması
| |
Böbrek yetmezliği olan hastalarda yürütülen klinik çalışmalar
Değişen derecelerde (hafif, orta ve şiddetli - böbrek fonksiyonu sınıflandırması için bkz. aşağıda Tablo 9) böbrek yetmezliği olan hastalarla yürütülen bir çalışmada, maruz kalınan ortalama imatinib (doz normalize EAA), böbrek fonksiyonları normal olan hastalarla karşılaştırıldığında 1,5-2 kat artmıştır, bu da, imatinibin güçlü bir biçimde bağlandığı bir protein olan AGP'nin plazma düzeyinde benzer bir artışa karşılık gelir. Maruz kalınan imatinib ile böbrek bozukluğunun şiddeti arasında bir hiçbir korelasyon gözlemlenmemiştir. Bu çalışmada, hafif böbrek yetmezliği olan hastalarda günlük 800 mg ve orta düzeyde böbrek yetmezliği olan hastalarda günlük 600 mg güvenle kullanılmıştır. Sınırlı sayıda hasta kaydedildiği için orta düzeyde böbrek yetmezliği olan hastalarda günlük 800 mg dozu test edilmemiştir. Aynı şekilde, şiddetli böbrek yetmezliği olan yalnızca 2 hasta düşük (100 mg) doza kaydedilmiş ve daha yüksek dozların hiçbiri test edilmemiştir. Çalışmaya hiçbir hemodiyaliz hastası kaydedilmemiştir. Literatür verileri, son evre böbrek hastalığı olan ve hemodiyaliz uygulanan bir kişide günlük 400 mg dozun çok iyi tolere edildiğini göstermiştir. Diyaliz, imatinibin plazma kinetiklerini engellememiştir. Böbrekler yoluyla atılım imatinib için minör bir eliminasyon yolu olduğundan, şiddetli böbrek yetmezliği olan ve diyaliz uygulanan hastalara 400 mg'lik başlangıç dozu ile tedavi uygulanabilmektedir. Ancak, bu hastalarda dikkatli olunması önerilmektedir. Tolere edilememesi halinde doz azaltılabilir ya da etki görülmemesi halinde doz artırabilir arttırılabilir (bkz. bölüm 4.2, 4.4, ve 5.2).
Tablo 9 Böbrek fonksiyonu sınıflandırması
Böbrek yetersizliği Böbrek fonksiyon testleri
![]()
Hafif
Orta
![]()
Şiddetli
5.2. Farmakokinetik özellikler
Genel özelliklerİmatinibin farmakokinetiği 25 - 1000 mg'lık bir doz aralığında değerlendirilmiştir. Plazma farmakokinetik profilleri 1. günde ve plazmada kararlı düzeylerin elde edildiği 7. ya da 28. günde analiz edilmiştir.
Emilim:
Tablet formülünün ortalama mutlak biyoyararlanımı %98'dir. Bir oral dozu takiben plazma imatinib eğri altında kalan alan (EAA) değerlerinde, yüksek oranda hastalar arası değişkenlik (%40-60) görülmüştür. Yüksek yağ içeren bir gıda ile birlikte verildiğinde, imatinibin emilim oranı minimal düzeyde azalmış (C'da %11 azalma ve t'da 1,5 saatlik uzama), açlık koşullarına göre EAA değerinde küçük bir azalma (%7,4) olmuştur.
Dağılım:
Klinik açıdan uygun konsantrasyonlarda kullanılan imatinibin plazma proteinlerine bağlanması yaklaşık %95 olmuş, in vitro deneyler temelinde, daha çok albümin ve alfa- asit-glikoproteine, az miktarda da lipoproteine bağlanmıştır.
Biyotransformasyon:
![]()
İnsanlarda, dolaşımdaki temel metaboliti ana ilaç ile in vitro benzer etki gücünde (potens) olduğu gösterilmiş N-demetillenmiş piperazin (CGP71588) türevidir. Bu metabolitin plazma EAA değerinin imatinibin EAA değerinin sadece %16'sı olduğu bulunmuştur.N-demetile metabolitin plazma proteinlerine bağlanması, asıl bileşiğinkine benzerdir.
İmatinib ve N-demetil metaboliti birlikte, dolaşımdaki radyoaktivitenin yaklaşık %65'ini oluşturmuştur (EAA (0-48saat)). Dolaşımdaki radyoaktivitenin kalan kısmı bir dizi minör metabolitten oluşmuştur.
İn vitro sonuçlar CYP3A4'ün, imatinib biyotransformasyonunu katalize eden başlıca P450 enzimi olduğunu göstermiştir. Potansiyel eşzamanlı ilaçlardan (asetaminofen, asiklovir, allopurinol, amfoterisin, sitarabin, eritromisin, flulonazol, hidroksiüre, norfloksasin, penisilin V) oluşan bir panelde sadece eritromisin (IC50 50 μM) ve flukonazol (IC50 118 μM) imatinib metabolizmasında klinik açıdan anlamlı olabilecek inhibisyon göstermiştir.
İn vitro koşullarda imatinibin CYP2C9, CYP2D6 ve CYP3A4/5'in markör substratlarının kompetitif bir inhibitörü olduğu gösterilmiştir. İnsan karaciğeri mikrozomlarında Ki değerleri sırasıyla 27, 7,5 ve 7,9 µmol/l bulunmuştur. Hastalarda imatinibin maksimal plazma konsantrasyonları 2â4 µmol/l'dir, dolayısıyla bir arada uygulanan ilaçların CYP2D6 ve/veya CYP3A4/5 aracılı metabolizmasında inhibisyon olasıdır. İmatinib, 5-fluorourasil biyotransformasyonuna müdahale etmemiştir fakat kompetitif CYP2C8 inhibisyonu (Ki = 34,7 μM) sonucu paklitaksel metabolizmasını inhibe etmiştir. Bu Ki değeri, hastalarda beklenen imatinib plazma düzeylerinin çok üzerindedir, dolayısıyla 5-fluorourasil ya da paklitakselin imatinib ile bir arada uygulanması sonucu herhangi bir etkileşim beklenmemektedir.
Eliminasyon:
İmatinibin C-işaretli tek oral dozundan sonra, dozun yaklaşık %81'i 7 gün içinde feçesle (dozun %68'i) veidrarla(dozun%13'ü)itrahedilmiştir. Değişmemiş durumdaki
metabolitlerdir.
Doğrusallık / doğrusal olmayan durum:
Sağlıklı gönüllülerde oral uygulamanın ardından, imatinibin t değeri yaklaşık 18 saat olması günde tek doz şeklindeki pozolojinin uygun olduğu izlenimini vermektedir. Oral olarak 25-1000 mg imatinib uygulandıktan sonra artan dozla birlikte ortalama EAA artışı doğrusal bir seyir izlemiştir. Tekrarlanan dozlarda imatinib kinetiğinde değişiklik olmamış ve günde bir kez uygulandığında birikim, kararlı ilaç konsantrasyonunun 1,5- 2,5 katı olmuştur.
Farmakokinetik / farmakodinamik ilişkiler:
Popülasyon farmakokinetiği
KML hastalarındaki popülasyon farmakokinetiği analizlerine göre yaşın dağılım hacmi üzerinde küçük bir etkisi olmuştur (>65 yaşındaki hastalarda %12 artış). Bu değişimin klinik açıdan anlamlı olmadığı düşünülmüştür. Vücut ağırlığının imatinib klirensi üzerindeki etkisine bakıldığında, 50 kg ağırlığındaki bir kişide klirensin 8,5 l/s, olması beklenirken, 100 kg ağırlığındaki bir kişideki klirens 11,8 l/s'e yükselmektedir. Bu değişiklikler vücut ağırlığına göre bir doz ayarlaması yapılması için yeterli olarak kabul edilmemiştir. Cinsiyetin imatinib kinetiği üzerinde etkisi olmamıştır.
GIST hastalarında farmakokinetik
GIST hastalarında kararlı durum maruziyeti, aynı dozajda (400 mg/gün) KML hastaları için gözlenenden 1,5 kat daha yüksek olmuştur. GIST hastalarındaki ön popülasyon farmakokinetiği analizine dayalı olarak, üç değişkenin (albümin, WBC ve bilirubin) imatinib farmakokinetiği ile anlamlı ilişkiye sahip olduğu bulunmuştur. Daha düşük albümin değerleri daha düşük klirense (CL/f) sebep olmuş ve daha yüksek WBC düzeyleri CL/f azalmasına neden olmuştur. Ancak bu ilişkiler, doz ayarlamasını gerektirecek ölçüde anlamlı şekilde ön plana çıkmamıştır. Bu hasta popülasyonunda hepatik metastazların varlığı potansiyel olarak karaciğer yetmezliğine ve azalmış metabolizmaya yol açabilir.
Çocuklarda farmakokinetik
Bir Faz I ve Faz II çalışmasında oral imatinib, pediyatrik hastalarda da, erişkin hastalardaki gibi hızla emilmiştir. Çocuklarda 260 ve 340 mg/m imatinible elde edilen EAA değerleri, erişkinlerde sırasıyla 400 ve 600 mg imatinible elde edilenler gibidir. 340 mg/m imatinibin birinci ve sekizinci günlerdeki EAA değerleri bu ilacın, tekrarlanan dozlardan sonra 1.7 kat biriktiğini göstermiştir.
Hematolojik bozuklukları (KML, Ph+ALL ya da imatinib ile tedavi edilen diğer hematolojik bozukluklar) olan pediyatrik hastalarda birleştirilmiş popülasyon farmakokinetiği analizine dayalı olarak imatinib klirensi vücut yüzey alanının (VYA) artmasına paralel olarak yükselmektedir. VYA etkisi için düzeltme yapıldıktan sonra, yaş, vücut ağırlığı ve vücut kitle indeksi gibi diğer demografik faktörler imatinib maruziyeti üzerinde klinik açıdan anlamlı etkiler yapmamıştır. Yapılan analiz, günde bir kere 260 mg/m (günde 400 mg'ı geçmemek üzere) ya da günde bir kere 340 mg/m alan (günde 600 mg'ı geçmemek üzere) pediyatrik hastalarda imatinib maruziyetinin, günde bir kere 400 mg ya da 600 mg imatinib alan yetişkin hastalardakine benzer olduğunu doğrulamıştır.
Organ fonksiyonu bozukluğu
İmatinib ve metabolitleri böbrek yoluyla anlamlı miktarda atılmaz. Böbrek
fonksiyonlarında hafif ve orta şiddette bozukluk olan hastalar, böbrek fonksiyonları
normal hastalardan daha yüksek plazma değerlerine sahip görünmektedir. Artış yaklaşık
olarak 1,5-2 kattır ve imatinibin güçlü bir biçimde bağlandığı plazma alfa asit glikoprotein (AGP) değerinde 1,5 katlık bir artışa karşılık gelir. Böbrek bozukluğu olan hastalarda imatinibin serbest ilaç klirensi muhtemelen böbrek fonksiyonları normal hastalardakinin bir benzeridir çünkü böbrekler yoluyla atılım imatinib için minör bir eliminasyon yolunu oluşturmaktadır (bkz. bölüm 4.2, 4.4 ve 5.1).
Farmakokinetik analiz sonuçlarının kişiden kişiye değişikliklerin söz konusu olduğunu göstermesine rağmen, değişik derecelerde karaciğer yetersizliği olan hastalardaki imatinibe ortalama maruz kalım, karaciğer fonksiyonları normal olan hastalara kıyasla yükselmemiştir (bkz. bölüm 4.2, 4.4, 4.8, 5.1 ve 5.2)
5.3. Klinik öncesi güvenlilik verileri
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
Nobel İlaç Sanayii ve Tic. Anomim Şirketi
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |