GRAFALON 5 ml IV infüzyonluk çözelti konsantresi içeren 1 flakon Kısa Ürün Bilgisi
{ Immunglobulin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
GRAFALON
20 mg/mL I.V. infüzyonluk çözelti konsantresi içeren flakon Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Tavşanlardan elde edilen anti âinsan T- lenfositâ immünoglobulini 20 mg/mL
Yardımcı maddeler
Her 1 mL'de;
Sodyum dihidrojen fosfat dihidrat 1,56 mg
Yardımcı maddeler için 6.1.'e bakınız.
3. FARMASÖTİK FORMU
Berrak ila hafif opak ve renksiz ila açık sarı infüzyon için konsantre çözelti
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
İmmün cevabın supresyonu
GRAFALON, genellikle diğer immünsüpresif tıbbi ürünlerle kombine olarak immün sistemi baskılamak ve böylece organ transplantasyonlarından sonraki akut rejeksiyonu veya Graft Versus Host Hastalığını önlemek için kullanılır. Genellikle aşağıda belirtilen durumlarda uygulanır:
Allojenik solid organ transplantasyonu yapılmış hastalarda akut transplant rejeksiyonunun
önlenmesi
GRAFALON, allojenik solid organ transplantasyonunu takiben immünosupresyonu arttırmak için diğer immünsüpresif tıbbi ürünlerle (örneğin glukokortikosteroidler, purin antagonistleri, kalsinörin inhibitörleri veya mTOR inhibitörleri gibi) kombine olarak kullanılır.
Allojenik solid organ transplantasyonunu takiben kortikosteroide dirençli akut rejeksiyonun tedavisi
GRAFALON, allojenik solid organ transplantasyonunu takiben yapılan metilprednizolon tedavisinin terapötik etkisinin yetersiz kaldığı durumlarda kortikosteroid dirençli akut rejeksiyon krizinin tedavisinde kullanılır.
Allojenik kök hücre transplantasyonundan (SCT) sonra yetişkinlerde Graft-Versus-Host hastalığının (GVHD) önlenmesi
GRAFALON, hematolojik malignitesi olan yetişkinlerde uyumlu akraba dışı donörlerden yapılan kök hücre transplantasyonunu takiben, standart Siklosporin A/metotreksat profilaksisi ile kombine olarak Graft-Versus-Host hastalığının (GVHD) önlenmesinde kullanılır.
4.2. Pozoloji ve uygulama şekli
GRAFALON, sadece organ transplantasyonunu izleyen veya kök hücre transplantasyonlarından önce hazırlama amacıyla yapılan immünsüpresif tedavi uygulamalarında deneyimi olan hekimler tarafından reçete edilmelidir. GRAFALON'un kalifiye tıbbi gözetim altında uygulanması gerekmektedir.
Pozoloji/uygulama sıklığı ve süresi
GRAFALON'un dozu endikasyona bağlıdır. Doz önerileri vücut ağırlığı temel alınarak
belirlenir.
Allojenik solid organ transplantasyonu yapılmış hastalarda akut transplant rejeksiyonunun
önlenmesi
Tavsiye edilen GRAFALON doz aralığı 2 ile 5 mg/kg/gün'dür. En yaygın kullanılan dozajlar
3 ile 4 mg/kg/gün arasındadır. Tedavi, transplantasyonun yapılacağı gün, ya ameliyat öncesinde, ya ameliyat sırasında ya da derhal ameliyat biter bitmez başlamalıdır. Tavsiye edilen tedavi süresi, hastanın durumuna, seçilen günlük doza ve eşzamanlı immünsüpresif rejime bağlı olarak 5 ile 14 gün arasında değişir.
Allojenik solid organ transplantasyonunu takiben kortikosteroide dirençli akut rejeksiyonun tedavisi
Tavsiye edilen GRAFALON doz aralığı 3 ile 5 mg/kg/gün'dür. En yaygın kullanılan dozajlar 3 ile 4 mg/kg/gün arasındadır. Tedavi süresi, nakledilen organın durumuna ve vücudun verdiği klinik tepkiye bağlı olarak genelde 5 ile 14 gün arasında değişir.
Allojenik kök hücre transplantasyonundan (SCT) sonra yetişkinlerde Graft-Versus-Host hastalığının (GVHD) önlenmesi
Kök hücre transplantasyonuna yönelik miyeloablatif hazırlama rejimi kapsamında, tavsiye edilen GRAFALON dozu, genellikle kök hücre transplantasyonundan önceki 1-3 gün içinde başlanarak uygulanmak üzere 20 mg/kg/gün'dür.
Uygulama şekli
İntravenöz kullanım (seyreltme sonrası)
GRAFALON, pH değeri 3,7 ï± 0,3 olan, hipotonik bir infüzyon çözeltisi konsantresidir, doğrudan enjekte edilmez. Hastaya intravenöz uygulanmadan önce 9 mg/mL (% 0,9) sodyum klorür çözeltisinde seyreltilmesi gerekmektedir. Gerekli osmolaliteyi sağlamak için 1:7 oranında bir seyreltme (Her 1 mL GRAFALON'a 6 mL sodyum klorür solüsyonu eklenir) tavsiye edilmektedir. Daha büyük oranlarda seyreltme ve buna bağlı olarak pH değerinin yükselmesi durumunda parçacık oluşumu baş gösterebilir. Gözle görülür şekilde partikül içeren çözeltiler kullanılamaz.
Solid organ transplantasyonlarında standart infüzyon süresi 4 saattir, kök hücre transplantasyonlarında ise 4 ila 12 saatlik infüzyon süreleri tavsiye edilmektedir. İntraoperatif uygulamalarda genellikle 0,5 ila 2 saat arasında infüzyon süreleri uygulanmaktadır.
Uygulama esnasında hastanın aşırı duyarlılık ve anafilaksiye dair herhangi bir semptom gösterip göstermediği yakın takibe alınmalıdır. GRAFALON'un ilk dozunun verilmesi sırasında, ilk 30 dakikada daha düşük bir infüzyon hızı uygulanmalıdır. Herhangi bir intolerans semptomu görülmezse infüzyon hızı arttırılabilir. Hekim, anafilaktik veya anafilaktoid reaksiyon durumlarında derhal müdahale etmeye hazır olmalı ve uygun tıbbi tedaviye başlamalıdır.
Santral venöz kateter ile yapılan infüzyona alternatif olarak; büyük, debisi yüksek periferik bir damar da seçilebilir. Sistemik ve lokal toleransı arttırmak açısından infüzyondan önce metil prednisolon ve/veya antihistaminik verilmesi tavsiye edilir. Enjeksiyon yerinde standart hijyen kurallarına uyulması, infüzyon hızının azaltılması ve/veya venöz giriş noktasının değiştirilmesi gibi hususlar göz önünde bulundurulmalıdır.
GRAFALON'a sodyum heparin katılamaz, aynı yoldan sodyum heparin verilemez (bkz. Bölüm 6.2).
Özel popülasyonlara ilişkin ek bilgiler Böbrek / karaciğer yetmezliği
Böbrek/karaciğer yetmezliği olan hastalarda özel bir doz ayarlamasına gerek yoktur. Karaciğer yetmezliğinde, trombosit ve koagülasyon parametrelerinin dikkatle izlenmesi tavsiye edilir. (Bkz. Bölüm Özel kullanım uyarıları ve önlemleri).
Pediyatrik popülasyon
Halihazırda eldeki mevcut bilgiler Bölüm 4.8 ve 5.1'de açıklanmaktadır, ancak pozolojiye ilişkin bir öneride bulunmak mümkün değildir. Mevcut bilgiler, çocuk hastalarda erişkin hastalara kıyasla farklı dozlara gereksinim olmadığını göstermektedir.
Geriyatrik popülasyon
Yaşlı hastalardaki (ï³ 65 yaş) deneyimler sınırlıdır, ancak bu hastalarda diğer yaş gruplarına kıyasla farklı bir dozaja gereksinimi olduğuna dair bir bilgi bulunmamaktadır.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri

tam olarak önlenemez. Bu durum, henüz bilinmeyen ya da yeni görülen virüsler ve diğer patojenler için de geçerlidir.
GRAFALON için alınan önlemlerin insan immün yetmezliği virüsü (HIV), Hepatit B virüsü (HBV) ve Hepatit C virüsü (HCV) gibi zarflı virüslere ve Hepatit A ve Parvovirüs B19 gibi zarfsız virüslere karşı etkili olduğu kabul edilmektedir.
Bu ürün insan kanından elde edildiğinden, virüsler gibi enfeksiyöz ajanların ve teorik olarak Creutzfeldt-Jacob (CJD) hastalığı ajanlarının bulaşma riskini taşıyabilir.
Hekim bu ürünlerin riskleri ve yararları hakkında hastaya bilgi vermelidir.
Gerektiğinde acil tedavinin sağlanabilmesi için GRAFALON uygulanan hastalar, donanım ve personel açısından yeterli laboratuvar ve tıbbi destek olanaklarına sahip kurumlarda bakılmalıdır. GRAFALON, kalifiye tıbbi gözetim altında uygulanmalı ve monitörize edilmelidir.
Aşırı duyarlılık reaksiyonları
GRAFALON kullanımı ile ilişkili aşırı duyarlılık reaksiyonları bildirilmiştir.
İlk GRAFALON uygulamasından önce anamnez yoluyla hastada, özellikle tavşan proteinlerine karşı, alerjik yatkınlık olup olmadığının belirlenmesi tavsiye edilir.
Tekrarlanan GRAFALON tedavileri ya da başka üreticilerin tavşan immünoglobulini preparatları ile yapılan tedaviler şeklindeki re-ekspozisyon durumlarında önceki GRAFALON tedavisinde hassasiyet meydana gelmiş olabileceğinden, anafilaktik reaksiyon geliştirme riski daha yüksektir.
Ağır trombositopeni
GRAFALON trombositopeniyi ve dolayısıyla kanama riskini arttırabileceğinden, ağır trombositopeni geliştiren (trombosit/ïL oranı 50.000'den az olan) solid organ transplantasyonu yapılan hastalarda, GRAFALON tedavisine ara verilmeli ya da tedavi durdurulmalıdır. Klinik personel gerekli acil önlemleri almak üzere hazırlıklı olmalıdır.
Karaciğer hastalıkları
GRAFALON'un, karaciğer hastalığı olan hastalara dikkatli uygulanması gerekmektedir. Önceki pıhtılaşma bozuklukları daha kötüye gidebilir. Trombosit ve koagülasyon parametrelerinin dikkatle izlenmesi tavsiye edilir.
Kardiyovasküler hastalıklar
GRAFALON'un, kardiyovasküler hastalığı olduğu bilinen veya olmasından şüphe edilen hastalara dikkatli uygulanması gerekmektedir. Hipotansiyonu olan veya ortostatik semptomu (örn.bilinç kaybı, halsizlik, kusma, mide bulantısı gibi belirtiler) olan kardiyak dekompensasyonlu hastalarda infüzyonun yavaşlatılması/kesilmesi düşünülmelidir.
Enfeksiyonlar
İmmünsüpresif tedavi genel olarak enfeksiyon riskini arttırır. GRAFALON uygulanan hastalarda artan bakteriyel, viral, mikotik ve/veya paraziter enfeksiyon riski söz konusudur. Takip ve tedavi ile ilgili uygun önlemlerinin alınması gerekir.
Kök hücre transplantasyonu uygulanan hastalarda CMV (Sitomegalovirüs) ve EBV (Epstein- Barr Virüs) durumunun izlenmesi ve yeterli preemptif tedavi uygulanması tavsiye edilir.
Aşılama
Hastalar, GRAFALON ile tedavi sırasında uygulanan cansız aşıların daha az etkin olabileceği hakkında bilgilendirilmelidir. İmmün sistemi bastırılmış hastalarda zayıflatılmış canlı virüs aşıları kontrendikedir.
Sodyum:
Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. Kullanıma hazır infüzyon çözeltisinin sodyum içeriği daha yüksektir ve bu durum seyreltme için kullanılan sodyum klorür çözeltisindeki miktardan kaynaklanmaktadır.
Hayvansal kaynaklı madde:
GRAFALON, etkin madde olarak tavşanlardan elde edilen anti âinsan T- lenfositâ immünoglobulini içerir. Etkin maddenin üretim sürecinde kültür ortamı olarak sığır serumu kullanılır. Son üründen sığır serumu tamamen uzaklaştırılmıştır.
İzlenebilirlik
Biyolojik tıbbi ürünlerin izlenebilirliğini iyileştirmek üzere, uygulanan ürünün adı ve seri
numarası açıkça kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Etkileşim çalışmaları yapılmamıştır. İmmünsüpresif tıbbi ürünler
GRAFALON ile eşzamanlı olarak başka immünsüpresif tıbbi ürünler rutin olarak uygulanmaktadır. GRAFALON ile kortikosteroidler, purin antagonistleri, kalsinörin inhibitörleri veya mTOR inhibitörleri arasında doğrudan bir etkileşim gözlenmemiştir. Ancak, bu tıbbi ürünlerin eşzamanlı olarak verilmesi enfeksiyon, trombositopeni ve anemi risklerini arttırabilir. Bu yüzden, kombine immünsüpresif tedavi alan hastaların dikkatle izlenmesi ve gereken adaptasyonun yapılması tavsiye edilir.
Aşılama
İmmün sistemi baskılanmış hastalarda zayıflatılmış canlı virüs aşıları kontrendikedir. Diğer aşılara karşı antikor yanıtı zayıf gerçekleşebilir (bakınız Bölüm 4.4.).
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon
Çocuk hastalarda deneyim sınırlıdır, ek bilgi bulunmamaktadır.
Geriyatrik popülasyon
Yaşlı hastalardaki (ï³ 65 yaş) deneyimler sınırlıdır, ek bilgi bulunmamaktadır.
4.6. Gebelik ve laktasyon
Genel
tavsiye
Gebelik kategorisi C
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)
Veri bulunmamaktadır.
Gebelik dönemi
GRAFALON'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ ve-veya/ embriyonal / fetal gelişim/ ve-veya / doğum/ ve-veya / doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (Bkz. Bölüm 5.3.). İnsanlara yönelik potansiyel risk bilinmemektedir.
Tedavi için karar, hastanın durumu göz önünde bulundurularak ve ilacın yararları/riskleri değerlendirilerek ilgili hekim tarafından verilmelidir.
Laktasyon dönemi
GRAFALON'un emziren kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. İnsan IgG'sinin plasenta bariyerini geçebildiği veya anne sütüne geçebildiği göz önünde bulundurulmalıdır.
Tedavi için karar, hastanın durumu göz önünde bulundurularak ve ilacın yararları/riskleri değerlendirilerek ilgili hekim tarafından verilmelidir.
Üreme yeteneği (fertilite)
İnsanlardaki üreme yeteneğini (fertiliteyi) etkileyip etkilemediği bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Geçerli değildir.
4.8. İstenmeyen etkiler
Güvenlilik profili özetiGRAFALON immünsüpresif özellikleri olan bir immünoglobulindir. Bu grup ürünlerle ilgili olarak iyi bilinen advers etkiler; sitokin salınımı ile ilişkili semptomlar, anafilaksi ve diğer alerjik vakalar şeklindeki aşırı duyarlılık reaksiyonları, enfeksiyon duyarlılığında artış ve malignansi oluşumlarını içermektedir.
Bu bölümde açıklanan advers reaksiyonlar ve sıklığı, rejeksiyon önleme endikasyonlu böbrek transplantasyonu yapılan (136 hasta) ve allojenik kök hücre transplantasyonu öncesi hazırlanan (106 hasta) toplam 242 hastanın katıldığı 6 klinik araştırmaya dayanan entegre güvenlilik analizi ile incelenmiştir. İncelenen hastaların %94'ünde en az bir advers etki görülmüştür. Rapor edilen advers reaksiyonlar kısmen ilgili prosedürlerden, yani renal transplantasyonlardan (idrar yolları enfeksiyonu, böbrek yetmezliği) ve allojenik kök hücre transplantasyonlarından (pansitopeni, mukozal enflamasyon) sonra tipik olarak baş gösteren yaygın komplikasyonlardan kaynaklanmaktadır.
Aşağıdaki tabloda GRAFALON ile bildirilen advers reaksiyonlar listelenmiş ve sıklık ve sistem
organ sınıfına göre sınıflandırılmıştır.
Sıklık gruplandırmaları aşağıdaki skalaya göre tanımlanmıştır:
Çok yaygın (ï³1/10); yaygın (ï³1/100 ile <1/10); yaygın olmayan (ï³1/1.000 ile <1/100); seyrek (<1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Her sıklık gruplandırmasında istenmeyen etkiler azalan ciddiliğe göre sıraya koyulmuştur.
Advers reaksiyonların listesi
Enfeksiyonlar ve enfestasyonlar
Çok yaygın CMV enfeksiyonu*, idrar yolu enfeksiyonu*
Yaygın Bakteriyel sepsis**, zatürre**, piyelonefrit*, herpes enfeksiyonu, influenza, oral kandidiyaz, bronşit, rinit, sinüzit, nazofarinjit, cilt enfeksiyonu
Yaygın olmayan Kateter yeri enfeksiyonu, Epstein-Barr virüs enfeksiyonu,
gastrointestinal enfeksiyon, erizipel, yara enfeksiyonu
(Kistler ve polipler de dahil olmak üzere) iyi huylu vekötü huylu neoplazmalar
Yaygın Lenfoproliferatif bozukluk*
Kan ve lenf sistemi hastalıkları
Çok yaygın Anemi
Yaygın Pansitopeni**, trombositopeni, lökopeni
Yaygın olmayan Polisitemi
Bağışıklık sistemi hastalıkları
Yaygın Anafilaktik şok**/anafilaktik reaksiyon, aşırı duyarlılık
Metabolizma ve beslenme hastalıkları
Yaygın Hiperlipidemi
Yaygın olmayan Vücutta sıvı toplanması, hiperkolesterolemi
Sinir sistemi hastalıkları
Çok yaygın Baş ağrısı, titreme
Yaygın Parestezi
Göz hastalıkları
Yaygın Fotofobi
Kardiyak hastalıklar
Yaygın Taşikardi
Vasküler hastalıklar
Çok yaygın Yüzde ve boyunda kızarma
Yaygın Hipotansiyon*, venooklüzif hastalık, hipertansiyon
Yaygın olmayan Şok**, lenfosel
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın Nefes darlığı
Yaygın Öksürük, epistaksi
Gastrointestinal hastalıklar
Çok yaygın Kusma, mide bulantısı, ishal, karın ağrısı
Yaygın Stomatit
Yaygın olmayan Reflü özofajit, dispepsi
Hepato-bilier hastalıklar
Yaygın Hiperbilirubinemi
Deri ve deri altı doku hastalıkları
Yaygın Eritem, şiddetli kaşıntı (prürit), döküntü
Yaygın olmayan İlaç erüpsiyonu
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın Miyalji, artralji, sırt ağrısı, müsküloskeletal katılık
Böbrek ve idrar hastalıkları
Yaygın Renal tübüler nekroz*, hematüri
Yaygın olmayan Böbrek yetmezliği**, renal nekroz*
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın Pireksi**, grip nöbeti
Yaygın Güçsüzlük, göğüs ağrısı, hipertermi, mukozal inflamasyon, periferik ödemler
Yaygın olmayan Ödem
Araştırmalar
Yaygın Kan kreatinininde artış*, pozitif sitomegalovirüs antijeni, C- reaktif proteinde artış
Yaygın olmayan Hepatik enzimlerde artış
* ciddi reaksiyon
** bireysel hallerde fatal sonuç veren ciddi reaksiyon
Seçili advers reaksiyonların tanımı Sitokin salımı ile ilişkili semptomlar
Bu reaksiyonlar sitokin salınımına bağlı olarak baş gösterir ve ateş, grip nöbeti, baş ağrısı, bulantı, kusma, taşikardi ve kan dolaşımı değişimlerini içerir. Bu reaksiyonlar sitokin salımı sendromu olarak özetlenebilir. GRAFALON'un uygulanması sırasında veya sonrasında sık görülürler. Semptomlar genellikle kolaylıkla kontrol altına alınabilir. Profilaktik ilaç tedavisi yoluyla bu semptomları hafifletmek mümkündür.
Aşırı duyarlılık reaksiyonları
Cilt kızarması, döküntü, eritem, ödem, bronkospazmlı veya bronkospazmsız dispne ve öksürük, uygulama sırasında ve sonrasında yaygın olarak görülen reaksiyonlardır. Bu reaksiyonlar genel olarak tedaviye iyi yanıt verir. Uygun profilaktik ilaç tedavisi uygulayarak bu semptomları iyileştirmek mümkündür. Anafilaksi/anafilaktik şok görülürse, infüzyona derhal son verilmesi gerekir. GRAFALON'un uzun süreli ve daha düşük dozajlı uygulandığı tedavi süreçlerinde görülen serum hastalığı nadiren ağır seyreder ve genellikle semptomatik tedaviye iyi yanıt verir.
Hematolojik değişimler
GRAFALON uygulamasının ardından, trombositopeni ve lökopeni olarak gözlemlenen trombosit ve lökosit sayımındaki geçici değişimler olmaktadır. GRAFALON uygulamalarının ardından anemi de çok yaygın olarak gözlemlenir.
Enfeksiyonlar
İmmünsüpresif tedavi uygulanan hastaların enfeksiyonlara karşı duyarlılığı daha yüksektir. GRAFALON uygulanan hastaların çoğu, solid organ transplantasyonunu izleyen ilk yıl içerisinde bakteriyel, viral veya mikotik kökenli enfeksiyonlar geliştirmiştir. İdrar yolu enfeksiyonları çok yaygın bakteriyel enfeksiyonlardır; çok yaygın viral enfeksiyonlar ise sitomegalovirüsünün (CMV) neden olduğu enfeksiyonlardır. Yaygın olarak bildirilen enfeksiyonlar arasında bakteriyel sepsis, bakteriyel zatürre, piyelonefrit, herpetik viral enfeksiyonlar ve oral kandidiyaz vardır. EBV / Epstein-Barr enfeksiyonları, CMV zatürresi ve CMV gastroenterit yaygın olmayan viral enfeksiyonlar arasındadır. Sistemik kandidiyaz yaygın olmayan bir fungal enfeksiyondur. Enfeksiyonların çoğunluğu tedaviyle iyileştirilebilmektedir. Yaşamı tehdit eden ve hatta ölüme neden olan enfeksiyonların varlığı da bildirilmiştir. Hastanın uygun şekilde moniterizasyonu ve profilaktik tedavisi, enfeksiyon oranını azaltabilir.
Malignite
Genel olarak araştırmalara ve yayınlara bakıldığında GRAFALON tedavilerini izleyen malignite vakaları genellikle düşük olup bu vakaların sayısı diğer immünsüpresif medikasyon kombinasyonlarında gözlenen vakaların sayısı ile hemen hemen aynıdır. Post-transplant lenfoproliferatif hastalık sadece allojenik kök hücre transplantasyonu yapılan hastalarda (%1,7) rapor edilmiştir.
Hemoliz
Seyrek (her 1000 hastada 1'den az): GRAFALON uygulamasıyla ilişkili olarak hemoliz olayları bildirilmiş ve izole vakalarda fatal seyir görülmüştür.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon
Eldeki mevcut veri sınırlıdır. Mevcut bilgiler, çocuk hastalarda GRAFALON'un güvenlik
profilinin yetişkin hastalardakine göre önemli bir fark göstermediğine işaret etmektedir.
Yaşlı hastalar
Yaşlılar (ï³65 yaş) geçirdikleri uzun süreli kronik hastalıklar ve buna bağlı tedaviler nedeniyle genel immünosupresyona karşı daha duyarlı olabilirler. Ayrıca, immün sistem mekanizmalarındaki biyolojik düşüş nedeniyle de yaşlıların enfeksiyon geliştirme riskinin daha yüksek olduğu düşünülmektedir. Bununla birlikte, bu popülasyonda GRAFALON kullanımından kaynaklanan herhangi bir advers reaksiyon raporlanmamıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Dozun aşılması durumunda, derhal geniş spektrumlu antibiyotik, antimikotik ve antiviral tedavi uygulanması tavsiye edilmektedir. GRAFALON tedavisi durdurulmalı ve eşzamanlı başka immünsüpresif tedaviler ise hemograma (özellikle lökositlere ve lenfositlere) göre ayarlanmalıdır. Trombosit sayımı yakından izlenmeli ve uygun görüldüğü şekilde replasman tedavisi başlatılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastikler ve İmmünomodülatör Ajanlar/ Selektif İmmünosupresanlar
ATC kodu: L04AA04
GRAFALON, bir lenfoblastoid hücre dizisi olan Jurkat hücreleriyle immünize edilmiş tavşanlardan elde edilen bir poliklonal anti-T-lenfosit immünoglobulinidir. T-hücre belirteçlerinin Jurkat hücreleri üzerindeki ekspresyonu GRAFALON'un lenfositler üzerindeki etkileriyle tutarlıdır. GRAFALON'un Jurkat hücrelerinin diğer yüzey antijenlerine karşı da antikor içerdiği belirlenmiştir.
GRAFALON uygulanan hastalarda gerçekleştirilen lenfosit alt küme analizleri, Jurkat hücre dizisi tarafından ekspresyonu yapılan yüzey proteinlerini taşıyan lenfosit alt kümelerinde azalma olduğunu göstermektedir.
GRAFALON, insan lenfositlerine karşı sitotoksik etkilidir. Veriler, aktifleştirilmiş lenfositlerin daha duyarlı olduğunu göstermektedir.
GRAFALON, T-hücrelerini (CD3 vasıtasıyla) veya lenfositleri aktifleştirmemiştir, ancak T- hücrelerinin bir anti-CD3 antikoru tarafından aktivasyonunu engellemiştir.
GRAFALON, adezyon moleküllerine bağlanarak insan melanoma hücrelerinin göçünü azaltmıştır.
Domuz böbrekleri GRAFALON ile veya GRAFALON olmadan inkübe edilmiş insan lenfositleriyle perfüze edildiğinde, GRAFALON'un ilavesi ile böbrek damarlarında vasküler direncin düşmesi ve böbrekte daha az lenfosit tutulması, anti-adezif özelliklerle (anti-LFA-1 ve anti-ICAM-1 aktivitesi) açıklanabilir.
GRAFALON, rhesus maymunlarında deri grefti ömrünü uzatmaktadır. Bu modelde immünosupresyon belirgin olup lökopeni ve lenfopeni gözlenmiştir. GRAFALON, cynomolgus maymunlarında iskemi / reperfüzyon hasarlarında lenfosit ve nötrofil adezyonunu engelleyerek faydalı bir etki göstermiştir.
GRAFALON ile standart tedavi uygulanan renal transplant hastalarında lökosit ve trombosit sayısı önce düşmüş, ancak transplantasyonu izleyen 10 gün içerisinde tekrar normal düzeye dönmüştür. Lenfosit ve lenfosit alt popülasyonlarının sayımlarında da anlamlı bir düşüş görülmüştür. CD2, CD3, CD4 ve CD8 sayımlarında düşüş izlenmiştir. CD8 ilk 20 post-operatif
gün içerisinde normal düzeye dönmüş, ancak CD2, CD3 ve CD4 için aynı durum geçerli olmamıştır.
Böbrek transplantasyonu yapılan hastalarda, uygulanan standart GRAFALON tedavisinin lenfosit alt popülasyonları üzerinde etkili olduğu ve CD4/CD8 oranında 66 aya kadar süren bir tersine dönüş gerçekleştiği bildirilmiştir.
9 mg/kg'lık tek bir yüksek GRAFALON dozunun ardından, TNF-ï¡ ve IL-10 yükselmiş, IL-
12p40 hafifçe düşmüş, IL-12p70 ise stimüle olmamıştır.
Kök hücre transplantasyonu çalışması
Uyumlu akraba dışı donör greftleriyle yapılan iki yıllık bir kök hücre transplantasyonu izleme çalışmasının sonuçları, standart GVHD profilaksisine ek olarak GRAFALON verilen hastalarda akut Graft-Versus-Host Hastalığı (aGVHD), kronik GVHD (kGVHD) ve GVHD ilişkili mortalite sıklığının azaldığını göstermiştir.
Metodlar:
Araştırma Avrupa çapında 10 ülke ve 31 merkezde Faz 3 prospektif, açık ve çok merkezli bir çalışma şeklinde yürütülmüştür. Hematolojik maligniteli 202 erişkin hasta, Siklosporin ve Metotreksata ilave olarak GRAFALON uygulanan veya uygulanmayan tedavi gruplarına göre randomize edilerek ayrılmıştır. Kök hücre transplantasyonundan önce Gün -3, Gün -2 ve Gün
-1'de 20 mg/kg GRAFALON uygulanmıştır. Myeloablatif hazırlığın ardından akraba dışı donörlerden periferik kan (n=164; %82) veya kemik iliği (n=37; %18) grefti nakledilen 201 hasta tam analiz seti kapsamına dahil edilmiştir ve randomize olarak belirlenen tedavi şekillerine göre analiz edilmiştir (GRAFALON n=103, kontrol n=98). Primer son nokta erken tedavi başarısızlığıdır: III-IV dereceli, ağır aGVHD veya transplantasyonu izleyen 100 gün içerisinde ölüm gözlenmiştir.
Sonuçlar:
Siklosporin A ve Metotreksat ile uygulanan standart GVHD profilaksisine GRAFALON eklendiğinde tüm GVHD şekillerinin sıklığı gerilemiştir: Akut GVHD (ağırlık grupları I-IV, II- IV ve III-IV) ve kronik GVHD (ağırlık grupları sınırlı ve yaygın). Tedavi grupları arasında tekrarlama, transplantasyonla ilişkili mortalite ve genel sağkalım bakımlarından fark görülmemiştir.
Primer son nokta: Erken tedavi başarısızlığı sıklığı, %34,7 olan kontrol grubuna kıyasla, %21,4 olarak gerçekleşmiştir (düzeltilmiş eşitsizlik oranı [odds ratio] 0,56, güven aralığı [GA] [0,28â 1,11]; p=0,0983).
GRAFALON grubunda kümülatif III-IV dereceli aGVHD sıklığı %11,7 kontrol grubunda ise
%25,5 olarak gerçekleşmiştir (düzeltilmiş tehlike oranı [TO] 0,48, GA [0,24-0,96]; p=0,0392).
Kümülatif II-IV dereceli aGVHD sıklığı ise GRAFALON grubunda %33,0 kontrol grubunda
%52,0 dir. (düzeltilmiş TO 0,55, GA [0,35-0,85]; p=0,0077).
2 yıllık kümülatif yaygın kronik GVHD sıklığı %12,2'ye karşı %45,0 olarak belirlenmiştir (düzeltilmiş TO 0,196, GA [0,10-0,39]; p<0,0001).
Şekil 1 GRAFALON grubunda kontrol grubuna
kıyasla kök hücre kaynağına ve hastalığın durumuna göre düzeltilmiş primer ve sekonder etkinlik parametreleri için göreceli risk (noktasal kestirimci ve %95 GA)
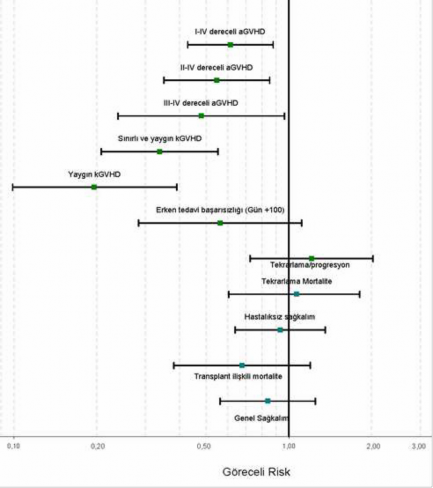
Pediyatrik popülasyon
GRAFALON'un çocuklarda kullanımına ilişkin birçok bildiri yayınlanmıştır. Bu bildiriler, bu ürün ile çocuk hastalardaki geniş deneyimi yansıtmakta ve çocuk hastalardaki güvenlik ve etkinlik profilleri ile yetişkin hastalardakiler arasında önemli bir fark olmadığını ortaya koymaktadır.
Ancak, çocuk hastalarda dozaja ilişkin tam bir fikir birliği bulunmamaktadır. Pozoloji, yetişkinlerde olduğu gibi, çocuk hastalarda da endikasyon, uygulama rejimi ve diğer immünsüpresif ajanlarla kombinasyona bağlıdır. Hekim çocuk hastalarda uygun dozajı belirlerken bu faktörleri göz önünde bulundurmalıdır.
5.2. Farmakokinetik özellikler
Farmakokinetik veriler toksikolojik çalışmaların toksikokinetik bölümlerinden elde edilmiştir. GRAFALON hızlı absorbe edilir ve eliminasyonu yavaştır. Sistemik maruz kalış, tüm doz düzeylerinde orantılı olmuş ve tekrarlanan dozlarda, cinsiyete göre değişmeksizin, artmıştır. Prednisolon ile arasında herhangi bir ilaç-ilaç etkileşimi görülmemiştir.
Emilim:
GRAFALON, intravenöz uygulanır ve bu nedenle biyoyararlanımı %100'dür.
Dağılım:
GRAFALON'un yarı ömrü yaklaşık 14 gün olup (7 gün süreyle 4 mg/kg/gün dozaj durumunda) doza ve uygulama süresine bağlı olarak bu süre 4 ile 45 gün arasında değişebilir.
Biyotransformasyon:
GRAFALON, diğer vücut proteinleri gibi protein metabolizmasına tabidir. Eliminasyon:
Literatür araştırmaları, T-hücre spesifik antikorların total tavşan IgG'ine kıyasla daha hızlı elimine edildiğini göstermektedir.
5.3. Klinik öncesi güvenlilik verileri
Non-klinik toksikoloji çalışmaları kapsamında GRAFALON'un tek-doz çalışmasıtavşanlarda, cynomolgus maymunlarında ve rhesus maymunlarında; tekrarlanan-doz çalışması ise rhesus maymunlarında araştırılmıştır. GRAFALON'a karşı tolerans iyidir. Gözlemlenen bu etkilerin bazıları GRAFALON'un, immünosupresyon ve, başta T-lenfositler olmak üzere, lenfosit sayısında belirgin düşüş şeklinde kendini gösteren spesifik farmakodinamik etkisinden kaynaklanmaktadır. Yüksek dozlarda (250 ile 300 mg/kg), rhesus maymunlarında anafilaktik reaksiyonlar gözlenmiştir. Prednisolon ile birlikte uygulanması GRAFALON'un toksisitesini azaltmıştır. Serum hastalığı görülmemiş ve klinik belirtilerde GRAFALON'un tek başına uygulandığı duruma kıyasla belirgin bir düzelme olmuştur.
Kedilerde yapılan bir güvenlilik farmakolojisi çalışmasında MSS, kardiyovasküler veya solunum sistemleri üzerinde bir etki görülmemiştir.
Genotoksik aktivite, bölgesel tahrişler ve anti-glomerüler bazal membran antikorları gözlemlenmemiştir. Karsinojenite veya reprodüktif toksisite çalışmaları yapılmamıştır.
6. FARMASÖTİK ÖZELLİKLER
Yardımcı maddeler
Sodyum dihidrojen fosfat dihidrat Fosforik asit (% 85) (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
GRAFALON infüzyon çözeltisi konsantresi glukoz, kan, kan türevleri, lipit içeren çözeltiler ve
sodyum heparinle karıştırılmamalıdır.
6.3. Raf ömrü
6.3. Raf ömrü
Seyreltilmiş solüsyonların oda sıcaklığında 24 saat süreyle kimyasal ve fiziksel açıdan kullanılırlığını koruduğu kanıtlanmıştır. Ancak seyreltilen ürün, mikrobiyolojik açıdan derhal
kullanılmalıdır. Eğer derhal kullanılmazsa, kullanıma kadar geçen süreden ve saklama
şartlarından uygulayıcı sorumludur.
6.4. Saklamaya yönelik özel tedbirler
2°C-8°C arasında buzdolabında saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız.
Işıktan koruyunuz, bunun için flakonu kutusunda saklayınız. Seyreltilmiş tıbbi ürünün saklama koşulları için Bölüm 6.3.'e bakınız.
6.5. Ambalajın niteliği ve içeriği
5 mL çözelti içeren 1 flakonluk veya 10 flakonluk ambalaj.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi atıkların kontrolü yönetmeliğiâ ve âAmbalaj atıklarının kontrolü yönetmeliğiâne uygun olarak imha edilmelidir.
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| GAMUNEX | 8699702980844 | |
| GAMUNEX-C | 869976980214 | |
| GENIVIG | 8699783980023 | 31,981.32TL |
| OCTAGAM | 8699686980090 | 67,181.33TL |
| TEGELINE | 8699538983651 | 64,079.99TL |
| Diğer Eşdeğer İlaçlar |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Fresenius Medikal A.Ş
| Geri Ödeme Kodu | A00971 |
| Satış Fiyatı | 27206.61 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 27212.24 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Mor Reçeteli bir ilaçdır. |
| Barkodu | 8699684980023 |
| Etkin Madde | Immunglobulin |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |