HAEMATE-P FAKTOR VIII 500 IU 1 flakon Kısa Ürün Bilgisi
{ Insan Koagulasyon Faktoru VIII }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
HAEMATE P 500 IU I.V. enjeksiyon/infüzyon için toz içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin maddeler:
İnsan Koagülasyon Faktör VIII (FVIII: C- Faktör VIII Aktivitesi) 500 IU (50 IU/ mL) Von Willebrand Faktör (VWF: RCo- Ristosetin Kofaktör Aktivitesi) 1200 IU (120 IU/ mL)
HAEMATE P 500 de; Von Willebrand Faktör için spesifik aktivite yaklaşık 3 -17 VWF: RCo/ mg protein, Faktör VIII için spesifik aktivite 2- 6 IU FVIII/ mg protein dir.*
Faktör VIII in potens değeri (IU) Avrupa Farmakopesi Kromojenik Analiz Yöntemi ne göre hesaplanır.
Sodyum klorür 40-80 mg
Sodyum sitrat 70-140 mg
Sodyum hidroksit (eser miktarda pH ayarlamak için)
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyon ya da infüzyonluk çözelti hazırlamak için toz ve çözücüsü Hazırlanmış çözelti renksiz, berrak ila hafif opalesan bir çözelti.
4.1. Terapötik endikasyonlar
Von Willebrand hastalığında (VWH) hemoraji ya da cerrahi kanamaların tedavisinde ve profilaksisinde, tek başına desmopressin (DDAVP) tedavisinin yetersiz kaldığı ya da kontrendike olduğu durumlarda kullanılır.
Hemofili A (konjenital Faktör VIII eksikliğinde) hastalığında kanamaların profilaksisi ve tedavisinde kullanılır.
4.2. Pozoloji ve uygulama şekli
Uygulanacak doz; hastanın klinik durumuna, kanamanın şiddetine, ölçülen VWF ve FVIII eksikliğinin derecesine göre, bu konuda uzman doktorlar tarafından belirlenmelidir.
Pozoloji/Uygulama sıklığı ve süresi:
Von Willebrand hastalığının tedavisinde;
Genellikle, 1 IU /kg VWF: RCo uygulanması halinde; VWF: RCo sirkülasyon seviyesi 0.02 IU/ mL (% 2) oranında artar.
VWF: RCo seviyesi 0.6 IU/mL den (%60) büyük ve FVIII: C seviyesi 0.4 IU/mL den (%40) büyük olmalıdır.
Kanamanın durması için vücut ağırlığına göre; 40 - 80 IU/ kg VWF ve 20 - 40 IU FVIII/ kg kullanılması tavsiye edilir.
Başlangıç dozu için gereken miktar 80 IU/ kg VWF dür. Özellikle Tip III Von Willebrand hastalarında, gerekli seviyenin korunabilmesi için diğer tiplere göre daha fazla doz uygulanması gerekebilir.
Cerrahi müdahalelerde ve şiddetli travmalarda hemorajinin önlenmesinde; Aşırı kanamadan korunmak için kanama sırasında ya da sonrasında cerrahi müdahalelerden 1 ya da 2 saat önce enjekte edilmelidir. Uygun doz her 12 - 24 saat arasında tekrarlanmalıdır. İçeriğinde VWF bulunduran FVIII preparatlarıyla yapılan uzun süreli tedavilerde, hastada FVIII seviyesinde aşırı artış görülebileceği dikkate alınmalıdır. Tedaviden 24- 48 saat sonra verilen FVIII dozunun azaltılması veya doz intervalinin genişletilmesi kontrolsüz FVIII artışını engelleyecektir.
Hemofili A hastalığının tedavisinde;
Uygulanacak FVIII seviyesi miktarı uluslararası birim (IU) olarak belirlenir ve FVIII ürünleri için güncel WHO standardı ile hesaplanır. Plazmadaki FVIII aktivitesi (FVIII-C) ya yüzde olarak (normal insan plazması) ile ilgili olarak ya da IU (plazmadaki FVIII için belirlenen uluslararası standarda göre) ifade edilir.
1 IU FVIII-C normal insan plazmasındaki 1 mL FVIII miktarına eşdeğerdir. Gerekli FVIII miktarı hesaplanırken deneysel bulgular temel alınır.
Vücut ağırlığının her 1 kg için 1 IU FVIII plazmadaki FVIII aktivitesini normal aktivitenin %
2 oranında artırır (2 IU/ kg).
Gerekli miktar aşağıdaki formüle göre hesaplanır:
Vücut Ağırlığı (kg) X İstenen FVIII miktarı (% ya da IU/ dL) x 0.5
Uygulama miktarı ve uygulama sıklığı her bir bireyin klinik etkinlik düzeyine göre belirlenir. Aşağıdaki hemorajik olgularda faktör VIII düzeyi o döneme ait plazma aktivitesi düzeyinin (normalin % si ya da IU/dL olarak) altına düşmemelidir.
Aşağıdaki tablo ameliyatlardaki ve kanamalı olgularda kullanılacak dozun miktarını belirleyebilmek için kullanılabilir:
Hemoraji derecesi/ Cerrahi müdahalenin tipi | Gerekli FVIII seviyesi (% ya da IU/dL) | Doz sıklığı (saat) /Tedavinin süresi (gün) |
Hemoraji | ||
Erken hemartroz, kas kanamaları ya da oral kanamalar | 20 - 40 | Her 12 - 24 saatte bir yapılır. En az 1 gün boyunca kanama boyunca acısı ve kanamanın şiddeti azalıncaya kadar infüzyon tekrar edilir. |
Daha yoğun hemartroz: Kas kanamaları, ya da hematom | 30 - 60 | Acısı ve kanamanın şiddeti azalıncaya kadar 3 -4 gün boyunca infüzyon her 12 ila 24 saat de bir tekrar edilir. |
Hayati tehlike yaratan hemoraji | 60 - 100 | İyileşme gerçekleşinceye kadar infüzyon 8 ila 24 saatte de bir tekrar edilir. |
Cerrahi | ||
Diş çekilmesi gibi küçük müdahalelerde | 30 - 60 | Her 24 saat de bir 1 gün boyunca iyileşme gerçekleşinceye kadar infüzyon tekrar edilir. |
Büyük cerrahi müdahalelerde | 80 - 100 (preoperatif ve postoperatif) | Yeterli iyileşme gerçekleşinceye kadar infüzyon her 8 ila 24 saatte bir tekrar edilir. Sonraki 7 gün boyunca Faktör VIII seviyesi en az % 30 - % 60 (IU/dL) oluncaya kadar tedaviye devam edilir. |
Tedavinin devam ettiği sırada tekrarlanan infüzyon periyodu ve uygun görülen faktör VIII seviyesi belirtilmelidir. Özellikle majör cerrahi girişim olgularında, yerine koyma tedavisinin koagülasyon analiziyle (plazma faktörü VIII aktivitesi) titiz olarak izlenmesi zorunludur. Faktör VIII e cevap verme durumu bireylerde farklılık gösterebilir.
Ciddi hemofili A hastalığı olanlarda kanamaya karşı uzun süreli profilaksi için 2 ila 3 günlük aralıklarla, vücut ağırlığının her kg. için 20 ila 40 IU faktör VIII verilmelidir. Eğer gerekiyorsa başka tedavi önlemleri de alınmalıdır.
Bazı durumlarda özellikle genç hastalarda uygulanacak doz aralıklarını kısaltmak yada yüksek dozlarda uygulamak gerekebilir.
4.4. Özel kullanım uyarıları ve önlemleri
Uygulama şekli:
HAEMATE P intravenöz yolla uygulanır.
Ürünü hazırlandığında uygulamadan önceki sıcaklığı oda yada vücut sıcaklığında olmalıdır. Hastanın rahat edebileceği bir yerde intravenöz yolla yavaş bir şekilde uygulanır. Ürün şırınga içine çekilir çekilmez hemen kullanılmalıdır.
Yüksek dozda faktör uygulanması gerekli olan durumlarda bu uygulama infüzyon olarak yapılabilir. Bunun için kullanıma hazır ürün uygun bir infüzyon sistemine transfer edilir.
Enjeksiyon ya da infüzyon dakikada 4 mLyi geçmemelidir. Ani değişmeler için hasta gözlenmelidir. Eğer HAEMATE P kullanımı ile ilgili herhangi bir değişiklik meydana gelirse infüzyon oranı düşürülebilir ya da uygulama kesilebilir ve hastanın klinik koşulları belirlenmelidir.(Ayrıca bakınız Bölüm 4.4.)
Genel talimatlar:
Çözelti berrak veya hafif opak olmalıdır. Filtre edildikten/çekildikten sonra (aşağıya bakınız) hazırlanmış ürün uygulanma öncesi çökeltiye veya renk bozulmasına karşı göz ile incelenmelidir. Artık içeren (kalıntı/parçacık) veya berrak olmayan çözeltileri kullanmayınız. Mix2Vial setini içeren filtreler artık içeren kalıntı ya da parçacıkları tamamiyle söker. Filtrasyon dozaj hesaplarını etkilemez. Çözeltiyi, filtrasyondan sonra da toz parçacıkları yada partiküller içeriyorsa kullanmayınız.
Hazırlanma ve enjektöre çekilme aseptik şartlarda gerçekleştirilmelidir.
Uygulama sonrası kullanılmayan ürün veya atık madde, yerel gerekliliklere uygun şekilde bertaraf edilmelidir.
Hazırlanması:
Çözücüyü oda sıcaklığına getiriniz. Toz ve çözücü flakonlarının kapaklarının çıkarıldığından ve stoperlerin aseptik bir solüsyonla silinerek Mix2Vial paketinin açılmasından önce kendiliğinden kuruduğundan emin olunuz.
l.Kapağı soyarak Mix2Vial paketini açınız. Mix2Vial i blister paketinden çıkarmayınız,
l
2
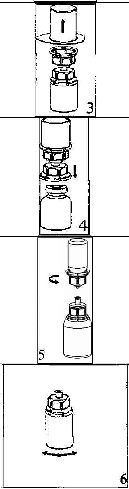
2. Çözücü flakonu düz ve temiz bir yüzey üzerine yerleştiriniz ve flakonu sıkıca tutunuz. Blister paketi ile birlikte aldığınız Mix2Vial setinin mavi adeptör ucunun tepe noktasını çözücü flakonun stoperinin üzerine doğru itiniz.
3. Kenarından tutarak ve dikey şekilde yukarıya doğru çekerek, blister paketini Mix2Vial setinden dikkatlice çıkarınız. Sadece blister paketini çekerek çıkardığınızdan ve Mix2Vial setini çıkarmadığınızdan emin olun.
4. Toz flakonunu düz ve sağlam bir zemin üzerine yerleştiriniz. Çözücü flakonunu takılı olan Mix2Vial setiyle birlikte ters çevirin ve saydam adaptör ucunun tepe noktasını, toz flakonun stoperinden aşağıya doğru bastırınız. Çözücü otomatik olarak toz flakonunun içine akacaktır.
5. Bir elinizle Mix2Vial setinin ürün tarafını, diğer elinizle de çözücü tarafını tutunuz ve ürünün çözülmesi sırasında aşırı köpük oluşmasını önlemek için seti dikkatli bir şekilde iki parçaya ayırınız. Çözücü flakonunu mavi Mix2Vial adaptörü takılı şekilde atınız.
6. Tozun tamamen çözündüğünden emin oluncaya kadar ürün flakonunu saydam adaptör takılı şekilde hafifçe sağa sola çeviriniz. Çalkalamayınız.
7. Boş, steril bir şırıngaya hava çekiniz. Ürün flakonu yukarıya doğru iken, şırıngayı Mix2Vialın Luer Lock bağlantı parçasına bağlayınız. Ürün flakonuna hava enjekte ediniz.
8. Şırınganın pistonunu basılı tutarak sistemi baş aşağı çeviriniz ve konsantreyi, pistonu yavaşça geriye çekerek şırıngaya alınız.
8
9. Çözelti şırıngaya aktarıldıktan sonra, şırınganın gövdesini sıkıca tutunuz (şırınganın sapını aşağıya bakacak şekilde tutarak) ve saydam Mix2Vial adaptörünü şırıngadan ayırınız.
Çözeltiyi hemen yavaş intravenöz enjeksiyonla veya infüzyonla uygulayınız Ve ürün dolu şırangaya kanın girmediğinden emin olunuz.
Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği:
HAEMATE P nin böbrek/karaciğer yetmezliği olan hastalarda kullanımı ile ilgili yapılan bir klinik çalışma yoktur. Bu nedenle HAEMATE P nin bu hastalarda kullanımında tedbirli olunmalı ve hasta açısından yarar/ zarar değerlendirmesi yapıldıktan sonra kullanılmalıdır.
Pediyatrik popülasyon:
Hemofili A hastalığına sahip çocuklarda HAEMATE P nin dozajı ile ilgili herhangi bir klinik çalışma bulunmamaktadır.
Bu nedenle çocuk vücut ağırlığı (kgda) başına dozun ayarlanmasıyla kullanılabilir. İnfüzyon hızı düşük tutulmalıdır. HAEMATE P nin çocuklarda kullanımında tedbirli olunmalı ve çocuk açısından yarar/ zarar değerlendirmesi yapıldıktan sonra kullanılmalıdır.
9
Geriyatrik popülasyon:
HAEMATE P nin 65 yaş üzerindeki yaşlı hastalarda kullanımı üzerine ve tedaviye cevapta yaşlılar ve gençler arasında farklılık olmadığını gösterebilecek klinik çalışmalar yeterli değildir.
4.3. Kontrendikasyonlar
4.4. Özel kullanım uyarıları ve önlemleri
Virüs Güvenilirliği:
İnsan kanı veya plazmasından hazırlanan tıbbi ürünlerin kullanımından kaynaklanan enfeksiyonların önüne geçmek için alınan standart önlemler, vericilerin seçilmesini, münferit bağışların ve plazma havuzlarının belli enfeksiyon belirteçleri için izlenmesini ve virüslerin etkisizleştirilmesi/uzaklaştırılması için etkili üretim basamaklarını kapsamaktadır. Buna karşın, insan kanı veya plazmasından hazırlanan ürünler uygulandığında, enfeksiyona neden olacak ajanların geçişi olasılığı bertaraf edilememektedir. Bu durum bilinmeyen veya gelişmekte olan virüsler ve diğer patojenler için de geçerlidir.
Bu ilacın üretiminde kullanılan plazmalar Creutzfeldt Jacob (deli dana) ve new variant Creutzfeldt Jacob hastalıklarına karşı teorik enfeksiyon riskini minimize edebilmek için hazırlanmış prosedüre uygun olarak seçilen donörlerden alınmıştır. Yine de insan kanı ve plazmasından elde edilmiş ürünlerde enfeksiyon etkenlerinin bulaşma riski kesin olarak dışlanamaz. Bu durum henüz bilinmeyen patojenler için de geçerlidir.
Alınan önlemlerin HIV, HBV ve HCV gibi kapalı virüsler için etkili olduğu düşünülmektedir.
Alınan önlemler, HAV ve parvovirus B19 gibi kapalı olmayan virüsler için kısmi koruyuculuğa sahiptir.
Parvovirus B19 enfeksiyonu, gebelerde (fetusun enfeksiyonu) ve bağışıklık sistemi yetersiz veya eritropoiesis artışı görülen hastalarda (örn. hemolitik anemi) ciddi seyredebilmektedir.
Düzenli/tekrarlanan plazma kaynaklı ürünleri alan hastalar için uygun aşılama düşünülmelidir (Hepatit A ve Hepatit B).
Hasta ile ürün serisi arasındaki bağıntıyı koruyabilmek amacı ile, hastaya her HAEMATE P uygulandığında ürünün ismi ve seri numarasının kayıt edilmesi önemle tavsiye edilmektedir.
İntravenöz protein ürünlerinin kullanımında, alerjik tipi aşırı duyarlılık reaksiyonları görülebilir. Hastalar aşırı duyarlılık reaksiyonlarının neden olacağı ürtiker, genel ürtiker, göğüste sıkışma, göğüste hırıltı, hipotansiyon ve anafilaksi için bilgilendirilmelidir. Bu semptomlar görüldüğü takdirde hastaya ilacın kullanımını derhal kesmesi ve doktoruna başvurması gerektiği söylenmelidir. Hasta şoka girerse; şok tedavisinde geçerli olan tıbbi standart tedaviler uygulanmalıdır.
Von Willebrand Hastalığı
Özellikle klinik ya da laboratuar risk faktörleri bilinen hastalarda trombotik vakaların oluşma riski bulunmaktadır. Bu nedenle risk altındaki hastalar, olası trombozis belirtilerinin erken safhada teşhis edilebilmesi için yakinen takip edilmelidirler.
VWF ürünleri kullanıldığında, hastada Faktör VIII aktivitesi (FVIII: C) seviyesinin aşırı ve kontrolsüz yükselmesini önlemek için tedavi devam ettiği sürece hastalar uzman bir doktor tarafından sürekli gözlenmelidir. İçeriğinde FVIII bulunduran VWF ürünleri alan hastalar, plazmadaki FVIII: C seviyesinin sürekli artışını önlemek için takip edilmelidir. FVIII: C seviyesinin aşırı yükselmesi trombotik vakaların oluşma riskini artırır, bu nedenle anti-trombotik önlemler göz önünde bulundurulmalıdır.
Von Willebrand olan hastalarında başta Tip III hastaları olmak üzere VWF ye karşı doğal olarak antikor (inhibitör) gelişebilir. Eğer uygulanan doz ile plazmada istenen FVIII: C seviyesine ulaşılamaz veya kanama kontrol altına alınamaz ise, uygulanacak doz için VWF inhibitörü performansı tekrar hesaplamalıdır. İnhibitör seviyesi yüksek olan hastalarda tedavinin etkin olmadığı ve diğer terapötik olasılıklar düşünülmelidir.
Hemofili A
Faktör VIII e karşı vücutta antikor (inhibitör) oluşumu hemofili A hastalarının tedavisinde rastlanan, bilinen bir komplikasyondur. Bu inhibitörler genellikle Faktör VIII prokoagülan aktivitesine karşı gelişen immunoglobulinlerdir ve miktarı, plazmanın her bir mL sinde bulunan BU (Bethesda Unitsj cinsinden hesaplanır. Antikor gelişme riski antihemofilik Faktör VIII e maruz kalındığında olur ve bu riskin oluşma ihtimali maruz kalınan ilk 20 gün içinde yüksektir. Nadiren maruz kalınan ilk 100 gün sonrasında inhibitör gelişimi görülür. İnsan koagülasyon Faktörü VIII ile tedavi gören hastalarda inhibitör gelişimi uygun klinik araştırmalar ve laboratuar testleriyle dikkatli bir şekilde gözlenmelidir. İnhibitör seviyesi yüksek olan hastalarda tedavi etkin değil ise diğer tedavi seçenekleri düşünülmelidir (bakınız: Bölüm 4.8. İstenmeyen Etkiler)
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
HAEMATE P diğer tıbbi ürünlerle karıştırılmamalıdır ve ilacın infüzyonu ayrı bir damardan yapılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin hiçbir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü ( Kontrasepsiyon)
HAEMATE P nin çocuk doğurma potansiyeli bulunan kadınlarda kullanıldığında üreme kapasitesini etkileyip etkilemediğine ilişkin yeterli veri mevcut değildir. Bu nedenle çocuk doğurma potansiyeli bulunan kadınlarda planlanmış bir gebelikten önce uygun bir alternatif tedaviye geçilmelidir.
Gebelik dönemi
HAEMATE P nin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. HAEMATE P gebelik döneminde gerekli olmadıkça kullanılmamalıdır.
Bu durum Von Willebrand Hastalığı için farklıdır. Çünkü bu hastalık otozomal kalıtsal bir hastalıktır. Kadınlar erkeklere göre daha fazla etkilenir, çünkü kanama riski daha fazladır (örneğin menstürasyon, hamilelik, doğum ve jinekolojik komplikasyonlar gibi). Pazarlama deneyimlerine dayanılarak Von Willebrand Faktör; akut kanamaların önlenmesinde ve tedavisinde önerilmektedir. Bununla birlikte hamile veya emziren kadınlarda Von Willebrand Faktör kullanımı ile ilgili herhangi bir klinik çalışma bulunmamaktadır.
Bu nedenle, VWF ve FVIII preparatları gebelik döneminde gerekli olmadıkça kullanılmamalıdır.
Laktasyon dönemi
Etkin maddenin insan sütüyle atılıp atılmadığı bilinmemektedir. Etkin maddenin süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Emzirmenin durdurulup durdurulmayacağına yada HAEMATE P tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken emzirmenin çocuk açısından faydası ve HAEMATE P tedavisinin emziren anne açısından faydası dikkate alınmalıdır.
Üreme yeteneği / Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
Klinik denemeler ve pazarlama deneyimlerinde elde edilen advers etkiler aşağıdaki sıklık derecelerine göre verilmiştir.
Çok yaygın (> 1/10); yaygın (>1/100 ila < 1/10); yaygın olmayan (>1/1.000 ila < 1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Kan ve lenf sistemi hastalıkları
Çok seyrek:
Hipervolemi (çok fazla miktarda veya sık uygulama gerektiren durumlarda veya cerrahi olaylar öncesinde, sonrasında ya da cerrahi müdahaleler sırasında inhibitör oluşan tüm hastalar hipervolemi açısından gözlenmelidir). İntravasküler hemoliz, hematokrit değerinin düşmesi açısından A, B ve AB kan gruplu hastalar kontrol altında tutulmalıdır.
Bağışıklık sistemi hastalıkları
Çok seyrek:
Anjioödemin de dahil olduğu alerjik reaksiyon
Anafilaktik reaksiyon
Anafilaktik şok
VWF ve FVIII e karşı inhibitör gelişimi ve sonucunda yetersiz klinik cevap.
Sinir sistemi hastalıkları
Çok seyrek:
Baş ağrısı
Uyuşukluk
Huzursuzluk
Sersemlik ve yorgunluk
Kardiyak hastalıkları
Çok seyrek:
Hipotansiyon
Taşikardi
Vasküler hastalıkları
Çok seyrek:
Trombozis
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Çok seyrek:
Dispne
Hışırtı
Gastrointestinal hastalıkları
Çok seyrek:
Mide bulantısı
Kusma
Deri ve deri altı doku hastalıkları
Çok seyrek:
Ürtiker
Kaşıntı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları :
Çok seyrek:
Hipersensitivite reaksiyonlar
4.9. Doz aşımı ve tedavisi
Bugüne kadar VWF ve FVIII in yüksek dozda ve aşırı kullanımından kaynaklanan herhangi bir yan etki raporu bildirilmemiştir. Bununla birlikte, yüksek dozda FVIII ile VWF içeren ürünlerin kullanımında trombozis riski unutulmamalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antihemorajikler: Koagülasyon Faktörleri, Von Willebrand Faktör ve Koagülasyon Faktör VIII kombinasyonu ATC Kodu: B02BD06
Etki Mekanizması: Von Willebrand Faktör
HAEMATE P insan vücudunda doğal olarak bulunan VWF ile aynı şekilde etki eder. VWF eksikliği olan hastalarda hemostatik anormalliklerin düzeltilmesi için uygulanan VWF iki şekilde görev yapar:
1. VWF, vasküler zedelenmenin olduğu vasküler subendotelyumda trombosit adezyonunu sağlar (hem vasküler subendotelyuma bağlanarak hem de trombosit yüzeyine bağlanarak), primer hemostaz sağlayarak kanama zamanını kısaltır. İçerikte bulunan yüksek miktardaki büyük moleküler ağırlıklı VWF-multimerler sebebiyle bu etki çok kısa zamanda oluşur.
2. VWF içeren ürünler FVIII eksikliğinin düzeltilmesinde daha geç etki gösterirler. İntravenöz uygulamada VWF endojen FVIII e (hasta tarafından normal olarak üretilen) bağlanır ve böylece bu faktörün stabilizasyonunu sağlayarak hızlı bir şekilde indirgenmesini engeller. Bundan dolayı, saf VWF ün (çok düşük miktarda FVIII içeren VWF ürünü) FVIII seviyesini normale getirmesi ikincil bir etkidir ve ilk infüzyondan bir müddet sonra gerçekleşir.
FVIII içeren VWF preparatları ise ilk infüzyondan sonra hemen FVIII: C seviyesini yeniden yapılandırarak normal seviyesine getirir.
Faktör VIII
HAEMATE P, insan vücudunda bulunan endojen FVIII ile aynı etkileri gösterir. Hemofilik hastalara infüzyon yapıldığı zaman FVIII hastanın dolaşımındaki VWF e bağlanır. Aktive edilmiş Faktör VIII, aktive edilmiş Faktör VIII kofaktörü gibi davranarak, Faktör X un aktive edilmiş Faktör X a dönüşmesini hızlandırır. Aktive olan Faktör X, protrombini trombin haline çevirir. Daha sonra trombin fibrinojeni fibrine dönüştürür ve pıhtılaşma gerçekleştirilir.
5.2. Farmakokinetik özellikler
Von Willebrand Faktör
HAEMATE P nin farmakokinetiği kanama olmayan durumdaki 28 VWF hastası (Tip I n=10; Tip IIA n=10; Tip IIM n=1; Tip III n=7) üzerinde değerlendirilerek aşağıdaki sonuçlar bulunmuştur.
Emilim:
Uygulama yeri açısından (intravenöz) ilaç direkt kana karışır. VWF: RCo (Ristosetin kofaktör aktivitesi) doruk plazma düzeyine genellikle enjeksiyondan sonraki 50 dakika içinde erişilir.
Dağılım:
Ortalama Tutulma Süresi (MRT) 13.7 saat ( 3.0 - 44.6 saat)
Plazma Konsantrasyon-Zaman Eğrisinin Altında Kalan Alan (EAA): 1664 IU/ dL X saat (aralık: 142-3846 IU/ dL X saat)
Biyotransformasyon:
VWF: RCo aktivitesi için in vivo geri kazanım 1.9 {(IU/ dL)/ (IU/ kg)} dir (aralık: 0.6-4.5 {(IU/ dL)/(IU/ kg)}
Eliminasyon:
VWF: RCo nin ortalama terminal yarılanma zamanı (iki kompartımanlı model için) 9.9 saattir (2.8 - 51.1 saat). Başlangıcındaki ortalama yarılanma ömrü 1.47 saattir (0.28-13.86 saat)
Ortalama klerens 4.81 mL/ kg/ saat (aralık: 2.08-53.0 mL/ kg/ saat).
Doğrusallık/ Doğrusal olmayan durum: Doz cevap ilişkisi doğrusaldır.
Faktör VIII Emilim:
Uygulama yeri açısından (intravenöz) ilaç direkt kana karışır.
İntravenöz enjeksiyon sonrasında, plazmadaki Faktör VIII aktivitesi (FVIII: C) hızla yükselir bunu hızlı bir düşüş izler ve sonradan aktivitedeki düşme yavaş olarak azalan bir ivme gösterir. FVIII doruk seviyesi enjeksiyondan 1 ile 1.5 saat içinde erişir.
Dağılım:
Ortalama Tutulma Suresi (MRT) 19.0 saattir (14.8 - 40.0 saat)
Plazma Konsantrasyon-Zaman Eğrisinin Altında Kalan Alan (EAA): 36.1 {% X saat}/ {IU/ kg} (14.8 - 72.4 {% X saat}/ {IU/ kg})
Biyotransformasyon:
Faktör VIII için in vivo geri kazanım ortalama her IU/ kg için: 1.73 IU/ dL dir (her IU/ kg için 0.5- 4.13 IU/ dL)
Eliminasyon:
Hemofili A hastalarında ortalama yarılanma zamanı 12.6 saat (5.0- 27.7 saat) Ortalama klerens 2.8 mL /saat/ kg (1.4 - 6.7 mL/ saat/ kg)
Doğrusallık/ Doğrusal olmayan durum: Doz cevap ilişkisi doğrusaldır.
5.3. Klinik öncesi güvenlik verileri
HAEMATE P etken madde olarak insan plazmasından elde edilen Faktör VIII ve Von Willebrand Faktör içerir. HAEMATE P nin tek doz uygulanması çeşitli hayvan türlerinde toksik etki göstermemiştir. Heterolog insan proteini uygulanmasıyla izlenen antikor gelişimi nedeniyle sıradan hayvan kobaylarında tekrarlanan dozlarla (kronik toksisite, kanserojenik, mutajenik) yapılan ön klinik çalışmalar uygun bir performans göstermez.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
İnsan albumin Aminoasetik asit Sodyum klorür Sodyum sitrat
6.2. Geçimsizlikler
Bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır, sıvısı ve çözücüsü bu bölüm 6.1. deki durumdan hariç tutulmalıdır.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
HAEMATE P yi 25 °C nin altındaki oda sıcaklığında saklayınız. Dondurmayınız. Donmuş ürünü çözüp kullanmayınız.
6.5. Ambalajın niteliği ve içeriği
Plastik disk ve alimünyum kapaktan oluşan lastik infüzyon tıpası ile mühürlenmiş Tip II camdan (Avr. Far) yapılmış renksiz enjeksiyon flakonları.
Çözücü flakon (enjeksiyonluk su): Plastik disk ve alimünyum kapaktan oluşan lastik infüzyon tıpası ile mühürlenmiş renksiz Tip I (Avr. Far) camdan yapılmış enjeksiyon flakonları.
HAEMATE P 500 IU içeriği: 1 adet toz içeren flakon
1 adet 10 mL enjeksiyonluk su içeren flakon
2 adet alkollü bez
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelik lerine uygun olarak imha edilmelidir.
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| BERIATE-P | 8699738980467 | |
| ESPEROCT | 8699676791200 | 18,725.38TL |
| FACTOR | 8699743980025 | |
| FAKTOR | 8697507980144 | 5,466.74TL |
| HAEMATE-P | 8699738980207 | |
| Diğer Eşdeğer İlaçlar |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
Farma-Tek İlaç Sanayi ve Ticaret A.Ş.
| Geri Ödeme Kodu | A03511 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8699738980153 |
| Etkin Madde | Insan Koagulasyon Faktoru VIII |
| ATC Kodu | B02BD06 |
| Birim Miktar | 500 |
| Birim Cinsi | IU |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > Anti hemofilik faktor viii |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |