HAEMONINE 1000 IU/10 ml IV enjeksiyonluk çözelti hazırlamak için toz ve çözücü Farmasötik Özellikler
{ Faktor Ix }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Toz:
Arginin Lizin,
Sodyum sitrat, Sodyum klorür
Çözücü:
Enjeksiyonluk su
6.2. Geçimsizlikler
Bu tıbbi ürün, diğer tıbbi ürünlerle karıştırılmamalıdır.
İnsan koagülasyon faktörü IX'in bazı infüzyon ekipmanlarının iç yüzeylerine adsorpsiyonu
sonucu tedavi hataları oluşabileceğinden, yalnızca verilen infüzyon setleri kullanılmalıdır.
6.3. Raf ömrü
24 ay
Sulandırıldıktan sonra hemen kullanılmalı, dondurulmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklayınız.
Ürünü, dış karton kutusu içinde saklayınız ve ışıktan koruyunuz.
6.5. Ambalajın niteliği ve içeriği
1 paket HAEMONINE 1000 IU/10 mL IV enjeksiyonluk çözelti hazırlamak
için toz ve çözücü aşağıdakileri içerir:
Tip I (Av. Far.) klorobütil kauçuk tıpalı Tip I cam (Av. Far.) flakon içerisinde toz
Tip I (Av. Far.) bromobütil kauçuk tıpalı Tip I cam (Av. Far.) flakon içerisinde çözücü (10 mL)
Aynı paket 1 adet tek kullanımlık enjektör (10 mL), 1 adet çift filtreli transfer sistemi ve bir adet kelebek kanül içerir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tüm üretimin basamaklarındamutlaksteriliteninsağlandığından emin olunmalıdır.
Şekil 1
Şekil 3
Şekil 2
Konsantrenin çözündürülmesi: |
|
Açılmamış flakonlardaki çözücü (enjeksiyonluk su) ve tozu oda sıcaklığına (15ºC-25ºC) getirin. Eğer ısıtma için bir su banyosu kullanılıyorsa, suyun flakonların kapakları veya stoperleri ile temas etmediğinden kesin olarak emin olun. Aksi takdirde ilaçta bulaşma oluşabilir.
Kauçuk tıpaların merkezi bölümlerini açıkta bırakmak için her iki flakonun da kapakları çıkarınız. Ürün ve çözücü flakonlarının kauçuk tıpalarının dezenfekte edildiğinden emin olunuz.
Transfer sisteminin ambalajını çıkartınız (2). Transfer sisteminin mavi kısmını, dik pozisyondaki çözücü içeren flakona yerleştiriniz (3).
Transfer sistemi ambalajının kalan kısmını çıkarınız. Şimdi transfer sisteminin saydam kısmı görünür olacaktır.
Ürün flakonunu düz bir yüzeye koyunuz.
Transfer sistemini batırdığınız çözücü flakonu baş aşağı çeviriniz. Adaptörün saydam kısmının sivri ucunu ürün flakonunun tıpasına doğru itiniz (4) Ürün flakonundaki basınç çözücünün ürün flakonuna akmasını sağlayacaktır (5) Transfer sisteminin mavi kısmını çözücü flakon ile birlikte derhal çıkarınız. Çözücü flakonunu üzerindeki transfer sisteminin mavi kısmı ile birlikte atınız. (6) Ürün flakonunun hafifçe kendi etrafında çevrilmesi tozun çözünmesine yardımcı olacaktır. Sert şekilde çalkalamayınız, her türlü köpük oluşumundan kaçınınız! Çözücü berrak veya hafif opak görünümde olacaktır.
Kullanıma hazır çözelti çözündürüldükten hemen sonra kullanılmalıdır. Bulanık ve gözle görünür partiküller içeren çözeltileri kullanmayınız.
Şekil 4
Şekil 5 Şekil 6
10
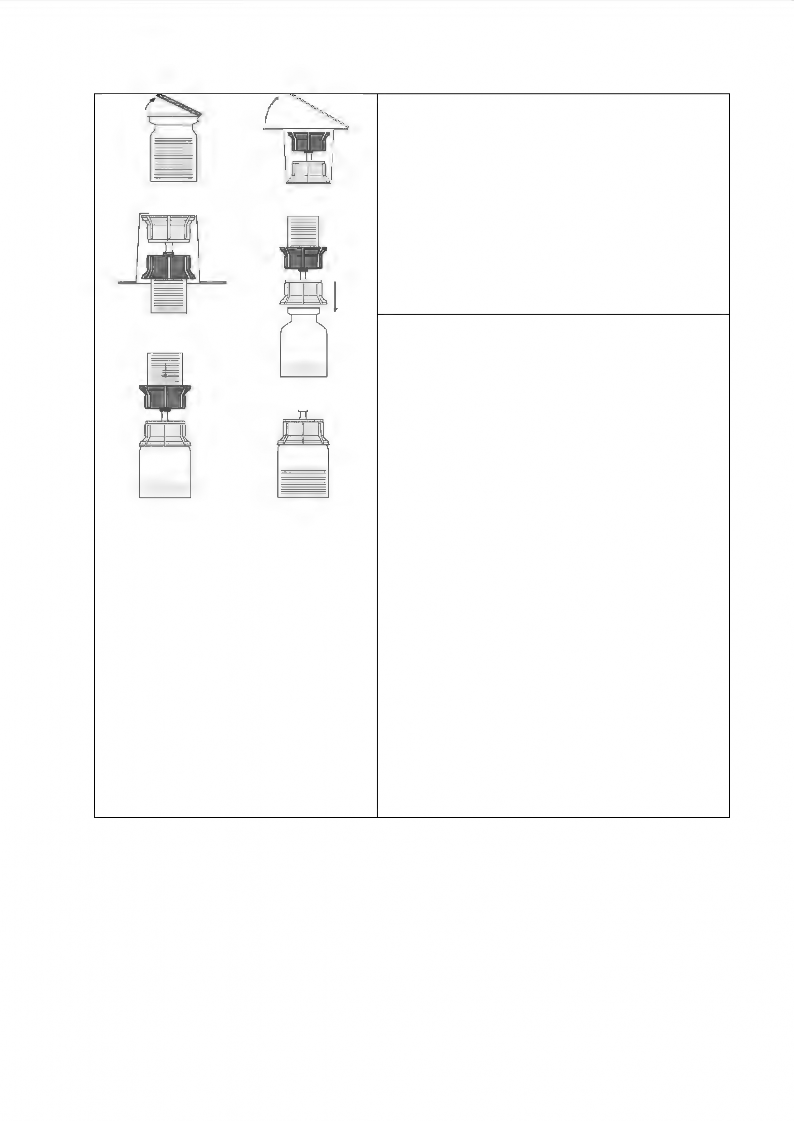
Şekil 7 | Enjeksiyon: |
Tozu yukarıda tanımlandığı şekilde çözüldükten sonra transfer sisteminin saydam kısmı ile Luer-Lock bağlantısı bulunan kapalı enjektörü substrat flakonuna doğru itiniz (7). Bu çözünmüş ilacı enjektöre kolayca çekmenizi sağlayacaktır. Transfer sistemi kendi dahili filtresine sahip olduğundan dolayı ayrı bir filtre gerekli değildir.
Transfer sisteminin saydam kısmı ile flakonu enjektörden dikkatli şekilde ayırınız. Kapalı kelebek iğneyi kullanarak ilacı yavaş intravenöz enjeksiyon ile derhal uygulayınız. Enjeksiyon hızı 2-3 mL /dakikayı geçmemelidir.
Kelebek iğne kullanıldıktan sonra, koruyucu kapak ile emniyete alınmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller ‘Tıbbi ürünlerin kontrolü yönetmeliği' ve ‘Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliği'ne uygun olarak imha edilmelidir.
 En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir.
En Yaygın Alerji Türleri
Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AIMAFIX-D | 8699650982006 | |
| ALPROLIX | 8683125910090 | 27,790.76TL |
| BENEFIX | 8681308274465 | 19,686.75TL |
| BERININ-P | 8681624980033 | |
| BETAFACT | 8699538983620 | |
| Diğer Eşdeğer İlaçlar |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
MAXİCELLS İLAÇ SANAYİ ANONİM ŞİRKETİ
| Satış Fiyatı | 11456.1 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 11456.1 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Turuncu Reçeteli bir ilaçdır. |
| Barkodu | 8682109319898 |
| Etkin Madde | Faktor Ix |
| ATC Kodu | B02BD04 |
| Birim Miktar | 1000/10 |
| Birim Cinsi | IU/ML |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > K Vitamini ve Diğer Hemostatikler > İnsan Faktör IX Konsantresi |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |