HIBERIX 1 şırınga Kısa Ürün Bilgisi
{ Hib Polisakkaridin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
HIBERIX 0,5 mL IM/SC Enjeksiyon İçin Liyofilize Toz İçeren Flakon ve Çözücü İçeren Kullanıma Hazır Enjektör
Haemophilus influenzae tip b (Hib) aşısı
Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
1 doz (0,5 mL) içerisinde:
Haemophilus influenzae tip b polisakkarid (PRP) poliribosilribitol fosfat 10 mikrogram Taşıyıcı protein olarak tetanoz toksoidine konjuge yaklaşık 25 mikrogram HIBERIX, tetanoz toksoidine kovalent olarak bağlanmış, Hib'in saflaştırılmış poliribozil- ribitol-fosfat kapsüler polisakkaridinden (PRP) oluşan liyofilize bir aşıdır.
Hib polisakkaridi, Hib'in 20,752 suşundan hazırlanır. Siyanojen bromür ile aktive edilip, bir adipik hidrazid ayrıştırıcı ile derive edildikten sonra karbodiimid kondenzasyonu aracılığı ile tetanoz toksoidi ile birleştirilir. Konjugat saflaştırıldıktan sonra stabilizatör olarak laktozun varlığında liyofilize edilir.
HIBERIX biyolojik maddeler ve Hib konjuge aşıları üretimi için Dünya Sağlık Örgütü'nün
gereklerine uygundur.
Yardımcı maddeler
Hib içeren tozda:
Laktoz (stabilizatör olarak) (sığır sütünden elde edilir) 12,6 mg Çözücüde:
Sodyum klorür 4,5 mg
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk süspansiyon için toz ve çözücü.
Liyofilize aşı cam flakonda beyaz bir toz olarak sunulmaktadır. Steril çözücü içeren kullanıma hazır enjektör 0,5 mL serum fizyolojik solüsyon içerir.
İğne koruyucusunu çıkarınız (bazen sert olabilir).
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
HIBERIX, Hib'in neden olduğu hastalığa karşı, iki aylıktan itibaren bütün bebeklerin aktif
bağışıklanması için endikedir.
HIBERIX, Haemophilus influenzae'nın diğer tiplerine bağlı oluşan hastalığa veya diğer mikroorganizmaların nedenolduğumenenjitekarşıkorumasağlamaz.
4.2. Pozoloji ve uygulama şekli
Pozoloji / Uygulama sıklığı ve süresi
Primer aşılama takvimi, yaşamın ilk 6 ayı içinde 2 ay ara ile verilen üç dozu içerir ve iki aylıktan itibaren başlatılabilir. Uzun dönemli korunma sağlamak amacıyla yaşamın ikinci yılında (12- 23 aylık) bir rapel doz önerilmektedir.
Daha önce aşılanmamış 6 ila 12 ay aralığındaki bebeklere, aralarında bir ay bırakılan 2 doz uygulanmalıdır, bunu yaşamın ikinci yılında bir rapel doz izlemelidir. Daha önce aşılanmamış 1-5 yaşlarındaki çocuklara bir doz aşı uygulanmalıdır.
Aşılama şemaları ülkeden ülkeye değişkenlik gösterdiğinden farklı ulusal önerilere göre her ülkenin şeması uyarlanabilir.
Uygulama şekli:
Sulandırılan aşı intramüsküler enjeksiyon içindir. Bununla birlikte, trombositopenili ya da kanama bozukluğu olan hastalarda aşı subkütan olarak uygulanmalıdır.
Özel popülasyona ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:
Böbrek/karaciğer yetmezliği olan hastalarla ilgili çalışma mevcut değildir.
Geriyatrik popülasyon:
HIBERIX yalnızca bebeklerde kullanılmaktadır.
4.3. Kontrendikasyonlar
HIBERIX, aşının herhangi bir bileşenine karşı aşırı duyarlılığı olduğu bilinen kişilere veya daha önceki Hib aşılamaları sonrasında aşırı duyarlılık belirtileri gösteren kişilere uygulanmamalıdır. Diğer aşılarda olduğu gibi, akut ciddi ateşli hastalığı olan kişiler için HIBERIX ile aşılama ertelenmelidir. Bununla birlikte, minör bir enfeksiyonun varlığı aşılama için bir kontrendikasyon değildir.
4.4. Özel kullanım uyarıları ve önlemleri
Aşılamadan önce tıbbi öykünün incelenmesi (özellikle daha önceki aşılamalar ve istenmeyen olayların meydana gelme olasılığı ile ilgili olarak) ve bir klinik muayene yapılması iyi bir klinik uygulamadır.
Bütün diğer enjektabl aşılarda olduğu gibi aşının uygulanması sonrasında ortaya çıkabilecek anafilaktik olay için gerekli tıbbi tedavi ve gözetim olanakları hazır bulundurulmalıdır. Aşılanan bireyler bu amaçla aşılama sonrasında sağlıklı göründüklerine ve anlık bir yan etki görülmediğine emin olununcaya kadar tıbbi gözetim altında bulundurulmalıdırlar. Bunun için belli bir süre verilmesi mümkün değildir.
İnsan İmmünyetmezlik Virüsü (HIV), HIBERIX için bir kontrendikasyon olarak görülmemektedir.
Tetanoz toksoidi bileşenine karşı sınırlı immün yanıt oluşabilmesine rağmen, HIBERIX ile tek
başına aşılama rutin tetanoz aşılamasının yerine geçemez.
Hib aşılarının alınmasının ardından kapsüler polisakkarid antijeninin idrar ile atıldığı tanımlanmıştır. Bu nedenle Hib hastalığından şüphe edilen durumlarda aşılamadan sonraki 1-2 hafta içinde antijen saptama tanısal bir değer taşımayabilir.
Trombositopenili ya da kanama bozukluğu olan bireylere yapılacak intramüsküler bir uygulama sonrasında kanama oluşabileceğinden, bu kişilere HIBERIX derin subkütan enjeksiyon olarak uygulanmalıdır. (bkz. 4.2 Pozoloji ve Uygulama Şekli)
Çok prematüre bebekler (gebeliğin 28. haftasından önce doğanlar) ve özellikle solunum sistemi gelişimi eksikliği hikayesi olanlarda primer bağışıklama serilerinin uygulanmasında potansiyel apne riskine karşı 48-72 saat solunum sisteminin izlenmesi gerekmektedir. Bu grup bebekte aşılamanın yararı yüksek olduğundan, aşılama alıkonmamalı ve ertelenmemelidir.
Özellikle adolesanlarda, iğne ile enjeksiyona karşı bir psikojenik yanıt olarak, aşılamanın ardından, hatta aşılama öncesinde, senkop (bayılma) görülebilir. Buna geçici görme bozukluğu, parestezi ve toparlanma sırasında tonik-klonik hareketler gibi birçok nörolojik belirti eşlik edebilir. Bayılma sebebiyle oluşabilecek yaralanmaları önlemek için gerekli prosedürlerin uygulamaya hazır bulundurulması önemlidir.
HIBERIX, hiçbir koşulda damar içine uygulanmamalıdır.
HIBERIX her dozunda 1 mmol (23 mg)'dan az sodyum ihtiva eder, yani esasında “sodyum
içermezâ€.
Biyolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve
seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
HIBERIX, diğer bir inaktive veya canlı aşıdan herhangi bir süre önce, sonra ya da eşzamanlı
olarak uygulanabilir.
HIBERIX, GlaxoSmithKline aşılarından DTPa aşısı veya DTPw-HB aşısı ile aynı enjektörde karıştırılabilir. Diğer enjektabl aşılar daima değişik aşılama bölgelerine uygulanmalıdırlar.
Diğer aşılarla olduğu gibi, immün sistemi baskılayan tedavi uygulanan ya da immün yetmezliği olan hastalarda aşılamanın ardından yeterli yanıt elde edilemeyebilir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
HIBERIX'in yetişkinlerde kullanımı amaçlanmadığından veri mevcut değildir.
Gebelik dönemi
HIBERIX'in yetişkinlerde kullanımı amaçlanmadığından gebelik döneminde kullanımının güvenliliği konusunda yeterli insan verisi ve yeterli hayvan üreme çalışması mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve-veya embriyonal/fetal gelişim ve-veya doğum ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
HIBERIX'in yetişkinlerde kullanımı amaçlanmadığından laktasyon döneminde kullanımının güvenliliği konusunda yeterli insan verisi ve hayvan üreme çalışması mevcut değildir. Bu nedenle emzirme döneminde uygulanmamalıdır.
Üreme yeteneği/ Fertilite
Veri mevcut değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Uygulanamaz.
4.8. İstenmeyen etkiler
İstenmeyen etkilerin sıklığı aşağıdaki gibi sınıflandırılmıştır:
Çok yaygın ≥1/10
Yaygın ≥1/100, <1/10 Yaygın olmayan ≥1/1000, <1/100 Seyrek ≥1/10000, <1/1000
Çok seyrek <1/10000
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Klinik çalışma verileri
Aşağıda yer alan sıklık gruplamaları yaklaşık 3000 bebekle gerçekleştirilen Hib-097 ve yaklaşık 1200 bebekle gerçekleştirilen DTPa-HBV-IPV-011 çalışmalarının analizine dayanmaktadır.
Aşılama ile en azından olası bir ilişkisi olduğu düşünülen advers reaksiyonlar sistem organ
sınıfı ve sıklığa göre listelenmektedir.
Her bir sıklık gruplaması içinde istenmeyen etkiler azalan ciddiyet sırasına göre sunulmaktadır.
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah kaybı
Psikiyatrik hastalıklar
Çok yaygın: Ağlama, irritabilite, huzursuzluk
Sinir sistemi hastalıkları
Çok yaygın: Somnolans
Seyrek: Konvülziyonlar (febril konvülziyonlar dahil)
Gastrointestinal hastalıklar
Çok yaygın: Diyare Yaygın: Kusma
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Ateş, enjeksiyon bölgesinde şişme, ağrı ve kızarıklık
Pazarlama sonrası veriler
İstenmeyen etkiler aşağıdaki sıklıkta listelenmiştir:
Çok seyrek <1/10000
Bağışıklık sistemi hastalıkları
Çok seyrek: Alerjik reaksiyonlar (anafilaktik ve anafilaktoid reaksiyonlar dahil), anjiyoödem
Sinir sistemi hastalıkları
Çok seyrek: Hipotonik-hiporesponsif dönem, senkop veya enjeksiyona vazovagal tepkiler
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok seyrek: Apne [bkz. Özel kullanım uyarıları ve önlemleri – çok prematüre (gebeliğin 28. haftasında veya önce doğan) bebeklerde apne]
Deri ve deri altı doku hastalıkları
Çok seyrek: ürtiker, döküntü (lokal veya yayılmış dahil)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok seyrek: Enjeksiyon yapılan uzvun yaygın olarak şişmesi, enjeksiyon bölgesinde sertlik
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Aşırı dozu takiben gözlenenadversolayprofilininHIBERIX'in önerilen dozuyla gözlenen
Çözücüyü toza ekleyiniz. Toz tamamen çözücüde çözünene dek çalkalanmalıdır.
Sulandırılan aşı berrak ila opalesan ve renksiz bir çözeltidir.
Aşı sulandırıldıktan hemen sonra kullanılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
iFarmakoterapötik grubu: Kombine bakteriyel ve viral aşılar (haemophilus influenzae B,
konjuge saflaştırılmış antijen)
ATC kodu J07AG01
Primer aşılama
Tablo 1'de, Birleşik Devletler, Avrupa, Güney Amerika ve Güney-Doğu Asya'daki bebeklere 6 haftalıktan itibaren yaşamın ilk 6 ayında HIBERIX ile 3 doz primer aşılamanın yapıldığı 4 klinik çalışmadan elde edilen immünojenite sonuçları sunulmaktadır.
Çeşitli aşılama planları değerlendirilmiştir ve HIBERIX, rutin olarak önerilen diğer aşılarla birlikte eşzamanlı olarak uygulanmıştır.
HIBERIX'in incelenen tüm 3-dozlu şemalarda immünojenik olduğu belirlenmiştir. Aşılama programının tamamlanmasından bir ay sonra bebeklerin %96,6-99,4'ünde ≥0,15 µg/ml anti- PRP konsantrasyonu (kısa süreli korumaya işaret eden bir düzey) elde edilmiştir.
Tablo 1: HIBERIX ile primer aşılamadan bir ay sonra ≥0,15 µg/ml'lik bir antikor konsantrasyonuna sahip gönüllü yüzdesi
Çalışma | Primer aşılama sırasındaki yaş | N | Eşzamanlı olarak uygulanan aşılar | ≥0,15 µg/ml anti-PRP'li gönüllü %'si (%95 GA) |
Hib-097 | 2-4-6 ay | 1590 | DTPa-HBV- IPV PCV13 HRV | 96,6 (95,6;97,4) |
DTPw-HBV-Hib- 008 PRI | 2-4-6 ay | 171 | DTPw-HBV | 99,4 (96,8;100) |
DTPa-HBV- IPV-005 | 3-4-5 ay | 410 | DTPa-HBV- IPV or DTPa-HBV- IPV + OPV (3.dozda) | 99,0 (97,5;99,7) |
DTPw- HBV=Hib Kft- 001 | 6-10-14 hafta | 175 | DTPw-HBV | 99,4 (96,9;100) |
GA: Güven Aralığı
DTwP-HBW: Kombine Difteri, Tetanoz, Boğmaca (tüm hücre) ve Hepatit B aşısı
DTPa-HBV-IPV: Kombine Difteri, Tetanoz, Boğmaca (aselüler), Hepatit B ve Poliomiyelit aşısı HRV: İnsan Rotavirüs Aşısı
N: Protokol (ATP) kohortuna göre gönüllülerin sayısı
OPV: Oral Polio Aşısı
PCV13: 13-valanlı Konjuge Pnömokok Aşısı
PRP: Poliribozilribitol fosfat
Ayrıca, DTPa ile birlikte tek doz HIBERIX uygulanmış, 22-26 aylık aşılanmamış küçük çocuklarda (Çalışma Hib-036), gönüllülerin %100'ü [N=54, %95 CI (93,4;100)] aşılamadan bir ay sonra ≥1,0 µg anti-PRP konsantrasyonlarına ulaşmıştır. Bu veriler, 1 yaş ve üzerindeki çocuklarda tek bir HIBERIX dozunu desteklemektedir.
Rapel aşılama:
3 dozluk primer aşılama şemasından sonra HIBERIX ile yapılan rapel aşılamaya verilen antikor yanıtları Tablo 2'de sunulmaktadır. Rapel dozdan bir ay sonra, tüm çocuklarda ≥0,15 µg/ml anti-PRP konsantrasyonları ve çocukların en az %99,1'inde ≥1,0 µg/ml anti-PRP konsantrasyonları (Hib'ye uzun süreli immünite ile korelasyon halinde bir konsantrasyon) gözlenmiştir (Tablo 2).
Tablo 2: HIBERIX ile rapel aşılamadan bir ay sonra ≥1,0 µg/ml'lik bir antikor konsantrasyonuna sahip gönüllü yüzdesi
Çalışma | N | Primer aşılama sırasındaki yaş | Rapel aşılama sırasındaki yaş | Rapel aşılama ile eşzamanlı olarak uygulanan aşılar | ≥1,0 µg/ml anti PRP'li gönüllü %'si (%95 GA) |
Hib-097 | 336 | 2-4-6 ay | 15-18 ay | DTPa | 99,1 (97,4;99,8) |
DTPw- HBVHib- 008 BST | 161 | 2-4-6 ay | 18 ay | DTPw-HBV | 99,4 (96,6;100) |
DTPw- HBV=Hib Kft-003 | 74 | 6-10-14 hafta | 15-18 ay | DTPw-HBV | 100 (95,1;100) |
GA: Güven Aralığı
N: ATP kohortundaki gönüllü sayısı
DTPa: Kombine Difteri, Tetanoz, Boğmaca (aselüler) Aşısı
DTPw-HBV:Kombine Difteri, Tetanoz, Boğmaca (tüm hücre) ve Hepatit B Aşısı
PRP: Poliribozilribitol fosfat
5.2. Farmakokinetik özellikler
Aşılar için farmakokinetik özelliklerin incelenmesi gerekmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Uygulanamaz.
Flakonun tüm içeriğini çekiniz
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Liyofilize Hib aşısı
Laktoz (sığır sütünden elde edilir)
Çözücü
Sodyum klorür ve enjeksiyonluk su (%0,9 serum fizyolojik solüsyonu)
6.2. Geçimsizlikler
HIBERIX, GlaxoSmithKline aşılarından Infanrix (DTPa aşısı) veya Tritanrix HB ( DTPw-HB aşısı) ile aynı enjektörde karıştırılabilir. Diğer enjektabl aşılar daima değişik aşılama bölgelerine uygulanmalıdırlar.
HIBERIX diğer aşılar ile aynı enjektörde karıştırılmamalıdır (onaylı kombinasyonlar hariç).
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
Liyofilize aşı, +2 - +8°C arasında ışıktan korunarak saklanmalıdır. Liyofilize aşı
dondurulmaktan etkilenmez.
Çözücü, buzdolabında (+2 - +8°C arasında) ya da oda ısısında (25°C'ye kadar) saklanabilir. Dondurulmamalıdır.
6.5. Ambalajın niteliği ve içeriği
Liyofilize aşı bir cam flakon içerisinde beyaz toz olarak sunulmaktadır.
Steril çözücü (serum fizyolojik solüsyon (%0,9)) gözle görülür partikül içermeyen, berrak ve renksiz sıvıdır ve kullanıma hazır enjektör içinde sunulmaktadır.
Bromobütil tip I lastik tıpalı, 3 ml'lik renksiz, tip I cam flakon ve FM27 kauçuk uç başlıklı, FM457 boromobütil tip I kauçuk tıpalı renksiz, tip I cam 1,25 ml'lik kullanıma hazır enjektörler, Avrupa Farmakopesi gereklerine uygun olarak yapılmıştır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
Hem çözücü hem de kullanıma hazırlanan aşı rekonstitüsyon veya uygulanma öncesinde herhangi bir yabancı parçacık ve/veya fiziksel görünümünde değişiklik açısından görsel olarak incelenmelidir. Bunlardan birinin görülmesi durumunda çözücü ya da kullanıma hazırlanmış aşıyı kullanmadan atınız.
Kullanıma hazırlama ve aşının uygulanması
HIBERIX, kullanıma hazır enjektördeki çözücünün tümü toz içeren flakona eklenerek hazırlanmalıdır.
Enjektöre iğne takmak için, Resim 1 ve Resim 2'de verilen talimatları dikkatlice okuyunuz.
Bununla birlikte HIBERIX enjektörü resimle gösterilen çizimden biraz farklı olabilir.
İğne
Enjektör
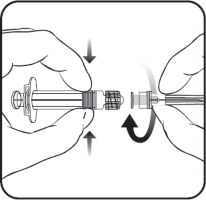
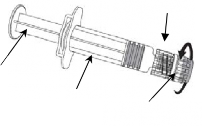
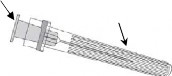
Resim 1 Resim 2
Enjektörü piston veya Luer Kilit Adaptöründen (LKA) değil, her zaman enjektörün gövdesinden tutunuz ve iğneyi şırınga ekseninde tutunuz (Resim 2'de gösterildiği şekilde). Belirtilen şekilde yapılmaması, LKA'nın bozulmasına ve sızıntı yapmasına neden olabilir.
Şırınganın birleştirilmesi sırasında LKA bozulursa, yeni bir aşı dozu (yeni şırınga ve flakon) kullanılmalıdır.
Enjektör başlığını saat yönünün tersine çevirerek açınız (Resim 1'de gösterildiği şekilde).
Aşı uygulanırken yeni bir iğne kullanılmalıdır. İğneyi enjektörden çıkartınız ve 2. basamağı
tekrar ederek enjeksiyon iğnesini takınız.
Yukarıda Geçimsizlikler bölümünde bahsedildiği üzere, HIBERIX, tek dozlu Tritanrix HB veya Infanrix aşıları ile karıştırılabilir. Bu durumda HIBERIX paketinde mevcut olan çözücü, sıvı aşı ile yer değiştirir.
HIBERIX ile beraber karıştırılmak amaçlı kullanılan aşının kabının tek dozluk kap olduğundan emin olunuz. HIBERIX paketinde bulunan çözücü içeren kullanıma hazır enjektörü kullanmadan atınız.
Kombine aşı, diğer aşı içeriğinin beyaz Hib toz içeren flakona ilave edilmesiyle sulandırılır. Hızlıca hazırlanan kombine aşı, sulandırılmış tek bileşenli HIBERIX aşısı ile aynı şekilde uygulanır.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| HIBERIX | 8699522967360 | 749.90TL |
| HİBERİX | 8699716962812 | |
| LIKIT | 8699636960257 | |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | 749.9 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 749.9 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522967360 |
| Etkin Madde | Hib Polisakkaridin |
| ATC Kodu | J07AG01 |
| Birim Miktar | |
| Birim Cinsi | |
| Ambalaj Miktarı | 1 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > Bakteriyel Aşılar > HIB (Hemofilus İnfluenza B), Konjuge Antijen Arıtılmış |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |