HIZENTRA 10 G/50 ml S.C. uygulama için enjeksiyonluk çözelti (1 flakon) Farmakolojik Özellikler
{ Human Immunoglobulin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmün serumlar ve immünoglobulinler: İmmünoglobulinler,
normal insan, ekstravasküler uygulama için
ATC kodu: J06BA01
İnsan normal immünoglobulini, başlıca enfeksiyöz ajanlara karşı geniş antikor spektrumuna sahip immünoglobulin G (IgG) içerir.
İnsan normal immünoglobulini normal popülasyonda bulunan IgG antikorların içerir. Genellikle 1000 donörden az olmamak üzere, havuzlanmış plazmadan hazırlanır. Doğal insan plazması ile yakın orantılı immünoglobulin G alt sınıfları dağılımına sahiptir.
Etki mekanizması
İmmün yetmezlikte, HİZENTRA'nın yeterli dozları anormal derecede düşük immünoglobulin G antikor seviyelerini normal aralığa getirebilir ve böylece enfeksiyonlara karşı yardımcı olur.
Replasman tedavisi dışındaki endikasyonlardaki etki mekanizması tam olarak açıklanmamıştır, ancak immünomodülatör etkileri içermektedir.
PID
Pivotal ileriye dönük açık etiketli, tek kollu ve çok merkezli bir Avrupa çalışmasında, yaşları 3 ve 60 arasında değişen ve primer immün yetmezlik sendromu olan toplam 51 gönüllü 41 haftaya kadar HİZENTRA ile tedavi edilmiştir. Her hafta uygulanan ortalama doz 0,12 g/kg vücut ağırlığıdır. 7,99 – 8,25 g/l ortalama konsantrasyon ile kesintisiz IgG dip düzeyleri tedavi dönemi boyunca sağlanmıştır. Gönüllüler toplam 1831 haftalık HİZENTRA infüzyonu almıştır.
İleriye dönük açık etiketli, tek kollu ve çok merkezli bir ABD çalışmasında, yaşları 5 ve 72 arasında değişen primer immün yetmezlik sendromu olan toplam 49 gönüllü 15 aya kadar HİZENTRA ile tedavi edilmiştir. Her hafta uygulanan ortalama doz 0,23 g/kg vücut ağırlığıdır. 12,53 g/L'lik ortalama konsantrasyon ile kesintisiz IgG dip düzeyleri tedavi dönemi boyunca sağlanmıştır. Gönüllüler toplam 2264 haftalık HİZENTRA infüzyonu almıştır. Klinik çalışmalar süresince HİZENTRA alan gönüllülerde etkililik periyodu boyunca herhangi bir ciddi bakteriyel enfeksiyon rapor edilmemiştir.
Manuel yoldan uygulama ve pompa destekli uygulama yoluyla uygulanan daha yüksek infüzyon hızlarının güvenliliği ve tolerabilitesini değerlendirmek amacıyla yaşları 2 ila 75
arasında değişen 49 PİD'li gönüllü; açık etiketli, çok merkezli, paralel kollu, randomize olmayan bir faz IV HILO (HİZENTRA Etiket Optimizasyonu) çalışmasına kaydedilmiştir ve en az 12 hafta boyunca HİZENTRA ile tedavi edilmiştir (2 ila 18 yaşın altındaki 11 pediyatrik hasta, 18 ila 65 yaşındaki 35 yetişkin hasta ve 65 yaş üzerindeki 3 geriyatrik hasta). Manuel itme tekniğiyle HİZENTRA alan ilk hasta grubunda (n=16), her hafta 30, 60 ve 120 ml/saat/bölge akış hızında her hafta 2 ila 7 infüzyon uygulanmıştır (bkz. Bölüm 4.2). Pompa destekli uygulama yoluyla HİZENTRA alan ikinci hasta grubunda (n=18), 25, 50, 75 ve 100 ml/saat/bölge akış hızında haftalık HİZENTRA infüzyonları uygulanmıştır. Üçüncü grupta, haftalık HİZENTRA dozlarının pompa destekli uygulamasıyla bölge başına 25, 40 ve 50 ml infüzyon hacimleri değerlendirilmiştir (n=15). Üç grubun tümünde, her bir infüzyon parametresi 4 hafta boyunca kullanılmış ve bu süre sonunda gereken minimum geçerli infüzyon sayısını başarıyla tamamlayan gönüllüler sıradaki daha yüksek infüzyon parametresine geçebilmiştir.
Primer sonlanım noktası, daha yüksek infüzyon parametresine yanıt veren gönüllülerin
yüzdesidir:
Grup İnfüzyon parametresi ve yanıt oranı (%)
1. Manuel itme akış hızları | 30 ml/sa/bölge | 60 ml/sa/bölge | 120 ml/sa/bölge | - |
%100 | %100 | %87,5 | - | |
2. Pompa destekli akış hızları | 25 ml/sa/bölge | 50 ml/sa/bölge | 75 ml/sa/bölge | 100 ml/sa/bölge |
%77,8 | %77,8 | %66,7 | %61,1 | |
3. Pompa destekli hacimler | 25 ml/bölge | 40 ml/bölge | 50 ml/bölge | - |
%86,7 | %73,3 | %73,3 | - |
Yanıt veren: Pompa destekli grupta, bir infüzyon parametresi için 4 infüzyonda 3 ve üzeri geçerli infüzyon yapılan bir gönüllü; manuel itme grubunda, bir infüzyon parametresi için %60 ve üzerinde geçerli infüzyonu olan bir gönüllü. 1 ve üzeri infüzyon bölgesi başına planlanan akış hızı/hacminin %95 ve üzerine ulaşıldıysa, infüzyon geçerli olarak kabul edilmektedir.
Genel olarak, şiddetli lokal reaksiyonlar olmayan infüzyonların sayısıyla toplam infüzyonların sayısının (tolerabilite) karşılaştırması tüm infüzyon parametreleri için tüm gruplarda 0,98 ve üzeridir. Tüm gönüllülerde 1. Günde başlangıçta ve çalışma sonunda serum IgG dip konsantrasyonları arasında klinik açıdan anlamlı hiçbir fark gözlemlenmemiştir.
KİDP
KİDP'si olan hastalarda HİZENTRA'nın güvenlilik, etkililik ve tolerabilitesi çok merkezli, çift kör, randomize, plasebo-kontrollü, paralel gruplu bir faz III PATH (Polinötropati ve HİZENTRA ile Tedavisi) çalışmasında değerlendirilmiştir. IVIg ile daha önceden tedavi edilen ve yanıt veren, kesin veya muhtemel KİDP'si olan 172 yetişkin haftalık 0,2 g/kg vücut ağırlığı HİZENTRA, haftalık 0,4 g/kg vücut ağırlığı HİZENTRA veya plasebo gruplarına randomize edilmiştir ve ardından 24 hafta süreyle takip edilmişlerdir. Ortalama maruziyet süresi 0,2 g/kg vücut ağırlığı HİZENTRA grubunda 118,9 gün ve 0,4 g/kg vücut ağırlığı HİZENTRA grubunda 129 gün olmuştur (her bir grupta maksimum maruziyet sırasıyla 167 gün ve 166 güne kadar). Gönüllüler genellikle paralel olarak 4 infüzyon bölgesi kullanmıştır (paralel olarak 8 bölgeye kadar). Toplamda, plasebo grubunda 57 gönüllüye 1514 infüzyon, 0,2 g/kg vücut ağırlığı HİZENTRA grubunda 57 gönüllüye 2007 infüzyon ve 0,4 g/kg vücut ağırlığı HİZENTRA grubunda 58 gönüllüye 2218 infüzyon uygulanmıştır (toplamda 5739 infüzyon).
Primer etkililik sonlanım noktası KİDP relapsına sahip gönüllülerin yüzdesi (başlangıç ile karşılaştırıldığında ayarlanan İnflamatuvar Nöropati Vakası ve Tedavisi ï›INCATï skorunda ≥
1 puan artışı olarak tanımlanmıştır) veya HİZENTRA tedavi periyodundan başka herhangi bir
nedenle geri çekilen hastaların yüzdesi olmuştur.
Her iki HİZENTRA dozu, primer sonlanım noktası açısından plaseboya karşı üstünlük göstermiştir. HİZENTRA ile tedavi edilen gönüllülerin istatistiksel olarak anlamlı daha az bir yüzdesi, 0,4 g/kg vücut ağırlığı için % 32,8 ve 0,2 g/kg vücut ağırlığı için % 38,6, plasebo ile tedavi edilen gönüllülerin % 63,2'si ile karşılaştırıldığında, KİDP relapsına sahiptir veya başka nedenlerle geri çekilmiştir (sırasıyla p<0,001 veya p= 0,007). Yalnızca relaps dikkate alındığında; KİDP relaps oranları, % 56,1'lik plasebo oranı ile karşılaştırıldığında, 0,4 g/kg vücut ağırlığı HİZENTRA için % 19,0 ve 0,2 g/kg vücut ağırlığı HİZENTRA için % 33,3 olmuştur (sırasıyla p<0,001 veya p= 0,012). Buna göre; 24 haftalık tedavi periyodu boyunca, HİZENTRA % 0,4 g/kg vücut ağırlığı ve 0,2 g/kg vücut ağırlığı gruplarında sırasıyla gönüllülerin % 81 ve % 67'sinde relapsı önlerken; plasebo grubunda gönüllülerin% 44'ünde relaps gözlenmemiştir.
KİDP relaps süresi (Şekil 1) değerlendirilmiş ve Kaplan-Meier tahminleri esas alınarak ilgili KİDP relaps olasılıkları plasebo için % 58,8, 0,2 g/kg vücut ağırlığı HİZENTRA için % 35,0 ve 0,4 g/kg vücut ağırlığı HİZENTRA için % 22,4 olmuştur. Plasebo ile karşılaştırıldığında düşük doz ve yüksek doz için tehlike oranı (% 95 güven aralığı) sırasıyla 0,48 (0,27, 0,85) ve 0,25 (0,12, 0,49) olmuştur. 0,2 g/kg vücut ağırlığı HİZENTRA ve 0,4 g/kg vücut ağırlığı HİZENTRA grupları arasında gözlemlenen fark istatistiksel anlamlılığa ulaşmamıştır.
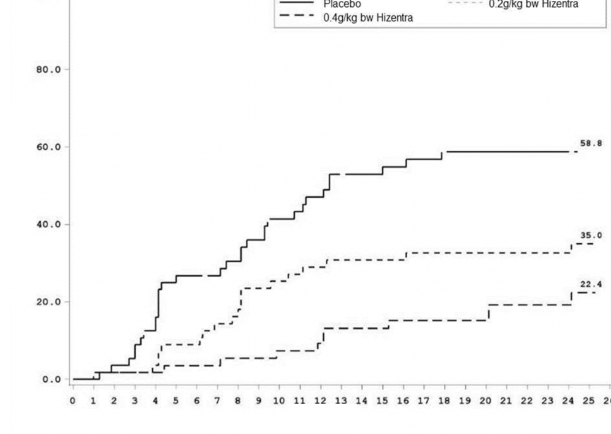
Hafta
------ Plasebo 0,2g/kg vücut ağırlığı HİZENTRA
- 0,4g/kg vücut ağırlığı HİZENTRA
Relaps olasılığı (%)
Şekil 1: KİDP Relapsı için Kaplan-Meier Zaman Grafiği
Etkililik skorlarında (INCAT skoru, ortalama kavrama gücü ve Medikal Araştırma Konseyi toplam skoru), plasebo grubundaki gönüllüler kötüleşirken, her iki HİZENTRA dozu
grubundaki gönüllüler stabil kalmıştır. Yüksek doz HİZENTRA grubundaki gönüllüler Rasch- yerleşik Genel Engellilik Ölçeği (R-ODS) Yüzde Birlik Skoru'nda stabil kalmıştır. Her iki HİZENTRA doz grubundaki gönüllüler elektrofizyoloji parametrelerinde stabil kalmıştır.
Bir faz III, çok merkezli, 48 haftalık açık etiketli genişletme çalışmasına, PATH çalışmasından KİDP'li 82 hasta dahil edilmiştir. Genişletme çalışması, iki haftalık 0,2 g/kg vücut ağırlığı ve 0,4 g/kg vücut ağırlığı dozlarında uygulanan HİZENTRA idame tedavisinin uzun dönem etkililik ve güvenliliğini araştırmıştır. Çalışma tasarımı nedeniyle, aynı gönüllüler çalışma sırasında her iki dozu da alabilir; etkililik değerlendirme periyodu boyunca 72 gönüllü 0,4 g/kg doz ve 73 gönüllü ise 0,2 g/kg doz almıştır. Ortalama etkililik değerlendirme periyodu 0,2 g/kg vücut ağırlığı grubunda 125,8 gün (aralık: 1-330) iken, ve 0,4 g/kg vücut ağırlığı grubunda ise 196,1 gündür (aralık: 1-330). 0,4 g/kg vücut ağırlığı dozunda herhangi bir relaps olmaksızın pivotal PATH çalışmasını tamamlayan ve genişletme çalışmasında başlangıçta bu dozu alan hastaların relaps oranı % 5,6 (1/18 hasta) olmuştur. PATH genişletme çalışmasında 0,4 g/kg vücut ağırlığı alan tüm hastaların % 9,7'sinde (7/72 hasta) relaps meydana gelmiştir. 0,2 g/kg vücut ağırlığı dozunda herhangi bir relaps olmaksızın PATH çalışmasını tamamlayan ve genişletme çalışmasında başlangıçta bu dozu alan hastaların relaps oranı % 50 (3/6 hasta) olmuştur. Genişletme çalışmasında 0,2 g/kg vücut ağırlığı alan tüm hastaların % 479'unda (35/73 hasta) relaps meydana gelmiştir. PATH çalışmasını tamamlayan ve genişletme çalışmasında 0,4 g/kg vücut ağırlığından 0,2 g/kg vücut ağırlığındaki düşük doza titre edilen hastaların % 67,9'unda (19/28 hasta) herhangi bir relaps meydana gelmemiş olup; relaps meydana gelen 9 hastalanın tamamı 0,4 g/kg vücut ağırlığı dozu ile tedavi sonrası 4 hafta içerisinde iyileşmiştir. Genişletme çalışmasında hiç relaps yaşamayan hastalar için; kavrama kuvveti, MRC toplam skoru ve R-ODS yüzde birlik skoru başlangıç değeri ile karşılaştırıldığında stabil kalmıştır.
Pediyatrik popülasyon
HİZENTRA'nın güvenliliği ve etkililiği yaşları 2 – 18 arasında değişen pediyatrik hastalarda kanıtlanmıştır. HİZENTRA yaşları 2 – <12 arasında değişen PID'li 68 pediyatrik hastada ve yaşları 12 – <18 arasında değişen 57 pediyatrik hastada değerlendirilmiştir. Yetişkin gönüllülerle karşılaştırıldığında; farmakokinetik, güvenlilik ve etkililik profilleri bakımından herhangi bir farklılık gözlenmemiştir. İstenen serum IgG seviyelerine ulaşmak için herhangi bir pediyatrik-spesifik doz ayarlamasına ihtiyaç duyulmamıştır. PID'li yetişkin ve pediyatrik çalışma hastaları arasında farmakodimamik özelliklerde herhangi bir fark gözlenmemiştir.
HİZENTRA klinik çalışmalarda KİDP'si olan ve 18 yaşın altındaki pediyatrik hastalarda değerlendirilmemiştir.
Geriyatrik popülasyon
65 yaşından büyük ve 18 – 65 yaş arası PID hastaları arasında güvenlilik veya etkililikte herhangi bir genel farklılık gözlenmemiştir. Klinik çalışmalarda, HİZENTRA 65 yaşından büyük ve PID'li 13 hastada değerlendirilmiştir.
65 yaşından büyük KİDP'li hastalar ve 18 – 65 yaş arasındaki KİDP'li hastalar arasında güvenlilik veya etkililik bakımından herhangi bir genel farklılık gözlenmemiştir. KİDP'li hastalarla gerçekleştirilen klinik çalışmalarda, 65 yaşından büyük 61 gönüllü HİZENTRA ile tedavi edilmiştir.
5.2. Farmakokinetik özellikler
Genel Özellikler
Emilim:
SCIg alımı, lokal bölgeden lenf sistemine, ardından vasküler boşluğa difüzyon aracılığı ile sağlanır.
Dağılım:
HİZENTRA'nın subkutan uygulamasını takiben; pik serum seviyelerine yaklaşık 2 gün sonra ulaşılır. Toplam serum IgG, IgG alt sınıfları ve spesifik IgG'lerin serum konsantrasyonları, doz aralığı boyunca stabildir.
Biyotransformasyon:
IgG ve IgG kompleksleri retiküloendotelyal sistemin hücrelerinde parçalanır.
Eliminasyon:
Yarılanma ömrü, özellikle primer immün yetmezlikte, hastadan hastaya değişkenlik gösterebilir.
PID
HİZENTRA ile gerçekleştirilen bir klinik faz III çalışmasında (n=46); gönüllüler haftalık 0,06 – 0,24 g/kg vücut ağırlığı medyan doz alırken, 29 haftalık bir periyod boyunca kesintisiz dip seviyelerine (medyan 8,1 g/L) ulaşmışlardır.
Ampirik Popülasyon Farmakokinetik modelleri ile gerçekleştirilen simülasyonlar; idame tedavisi boyunca HİZENTRA subkutan olarak her iki haftada bir haftada iki kez uygulanırsa, karşılaştırılabilir IgG maruziyet seviyelerinin (EAA, C) sağlanabildiğini öne sürmektedir.
Bu simülasyonlar aynı zamanda; HİZENTRA'nın haftalık idame dozu haftada birden daha sık orantılı miktarlarda uygulandığında (örn. haftada 2 kez, haftada 3 kez, haftada 5 kez veya günlük), karşılaştırılabilir serum IgG dip seviyelerine ulaşıldığını da öne sürmektedir.
Atlanılan 2-3 günlük doz simülasyonu, devamlı olarak alınan günlük dozla karşılaştırıldığında medyan serum IgG seviyelerinde ≤ % 4'lük bir azalma ile sonuçlanmıştır. Günlük dozlamaya yeniden başlandığında atlanılan dozları değiştirerek, medyan konsantrasyon profili 2-3 günde iyileşmiştir. Ancak; günlük dozlama tekrar başlandığında atlanılan dozlar değiştirilmezse, IgG dip seviyelerinin kararlı duruma dönmesi 5-6 hafta kadar sürmüştür.
KİDP:
PATH çalışmasında (n=172); gönüllüler haftalık sırasıyla 0,2 g/kg vücut ağırlığı ve 0,4 g/kg vücut ağırlığı doz alırken, 24 haftalık bir periyod boyunca kesintisiz dip seviyelerine ulaşmışlardır. 0,4 g/kg vücut ağırlığı grubunda HİZENTRA tedavisinden sonra ortalama (SD) IgG dip konsantrasyonu 20,4 (3,24) g/L ve 0,2 g/kg vücut ağırlığı grubunda ise 15,4 (3,06) g/l olmuştur. PATH çalışmasında popülasyon farmakokinetik modelleri ile gerçekleştirilen simülasyonlar; KİDP hastalarında iki haftada bir haftada iki defa HİZENTRA dozu uygulandığında, karşılaştırılabilir bir IgG maruziyetine (C, EAA, C) ulaşıldığını öne sürmektedir. Bu simülasyonlar aynı zamanda; KİDP hasta popülasyonunda HİZENTRA'nın haftalık idame dozu birkaç doza bölünerek daha sık uygulandığında (haftada
2 – 7 defa), buna uygun olarak karşılaştırılabilir bir IgG maruziyeti elde edildiğini da öne
sürmektedir.
Hastalardaki karakteristik özellikler
Pediyatrik popülasyon:
Yetişkin ve pediyatrik çalışma PID hastaları arasında farmakokinetik parametrelerde herhangi bir farklılık gözlenmemiştir.
HİZENTRA, KİDP'si olan 18 yaşından küçük hastalarda klinik çalışmalarda değerlendirilmemiştir.
Geriyatrik popülasyon:
65 yaşından büyük PİD hastaları ve 18 – 65 yaş arasındaki hastalar arasında farmakokinetik parametrelerde herhangi bir genel farklılık gözlenmemiştir.
65 yaşından büyük KİDP hastaları ve 18 – 65 yaş arasındaki hastalar arasında farmakokinetik parametrelerde herhangi bir genel farklılık gözlenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
İmmünoglobulinler insan vücudunun normal bir bileşenidir. L-prolin, fizyolojik, esansiyel olmayan bir amino asittir.
HİZENTRA'nın güvenliliği, yardımcı madde L-proline özel referansla çeşitli klinik öncesi çalışmalarda değerlendirilmiştir. Klinik dışı veriler güvenlilik farmakolojisi ve toksisite çalışmaları temelinde insanlarda özel risk ortaya koymamıştır.
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
Csl Behring Biyoterapi İlaç Dış Tic. A.Ş
| Satış Fiyatı | 31352.71 TL [ 25 Apr 2025 ] |
| Önceki Satış Fiyatı | 31352.71 TL [ 18 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Mor Reçeteli bir ilaçdır. |
| Barkodu | 8681624980279 |
| Etkin Madde | Human Immunoglobulin |
| ATC Kodu | J06BA01 |
| Birim Miktar | 10 |
| Birim Cinsi | G |
| Ambalaj Miktarı | 1 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > İmmünoglobülinler > Immunoglobulins, normal human, for extravascular administration |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |