HUMIRA 40 mg/0.4 ml S.C. enjeksiyon için kullanıma 2 hazır enjektör Kısa Ürün Bilgisi
{ Adalimumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
HUMIRA 40 mg/0,4 mL enjeksiyonluk çözelti içeren kullanıma hazır enjektör
Steril
UYARI
Diğer TNF bloke edici ajanlarda olduğu gibi, HUMIRA kullanan hastalarda (klinikte sıklıkla yaygın veya akciğer dışı tutulum gösterenler de dahil) tüberküloz vakaları gözlenmiştir. Eğer aktif tüberküloz tanısı konulursa HUMIRA tedavisine başlanmamalıdır (bkz. Bölüm 4.3).
Hastalar tüberkülin deri testi yapılarak inaktif (latent) tüberküloz açısından değerlendirilmelidir. İnaktif tüberküloz enfeksiyonu için tüberkülin deri testi yapılırken, hasta daha önce Bacille Calmette-Guerin (BCG) ile aşılanmış olsa dahi, 5 mm veya daha yüksek indurasyon boyutu pozitif olarak kabul edilmelidir. İnaktif tüberküloz teşhis edilen hastalarda HUMIRA tedavisine başlanmadan önce yerel öneriler doğrultusunda uygun bir anti- tüberküloz profilaksisi yapılmalıdır.
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir kullanıma hazır enjektör, 40 mg/0,4 mL adalimumab içerir.
Adalimumab “Çin Hamster Yumurtalık†hücrelerinde üretilen bir rekombinant insan
monoklonal antikorudur.
Yardımcı maddeler
Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti
Berrak, renksiz, partikül içermeyen çözelti.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Romatoid artritHUMIRA, metotreksat ile kombinasyon halinde aşağıdaki durumlar için endikedir:
Erişkin hastalarda orta ila şiddetli derecede aktif romatoid artrit tedavisinde, metotreksat dahil hastalık modifiye edici anti-romatizmal ilaçlar ile tedaviye karşın yeterli cevap alınamadığında,
Önceden metotreksat tedavisi almamış erişkin hastalarda şiddetli, aktif ve progresif
romatoid artrit tedavisinde
HUMIRA metotreksata karşı intolerans durumunda veya metotreksat ile tedaviye devam edilmesinin uygun olmadığı durumlarda monoterapi olarak verilebilir.
HUMIRA ve metotreksat kombinasyonunun, eklem hasarının progresyon hızını azalttığı ve fiziksel fonksiyonu iyileştirdiği radyografik ölçütlerle gösterilmiştir.
Jüvenil idiyopatik artrit Poliartiküler jüvenil idiyopatik artrit
HUMIRA, 2 yaşından itibaren, metotreksat ile kombine olarak, bir veya daha fazla hastalık modifiye edici anti-romatizmal (DMARD) ilaca karşı yetersiz yanıt alınan aktif poliartiküler jüvenil idiyopatik artrit tedavisinde endikedir. HUMIRA, metotreksata karşı intolerans durumunda veya metotreksat ile tedaviye devam edilmesinin uygun olmadığı durumlarda monoterapi olarak verilebilir (bkz. Bölüm 5.1). HUMIRA 2 yaşından küçük çocuklarda araştırılmamıştır.
Entezit ile ilişkili artrit
HUMIRA, konvansiyonel tedaviye yetersiz yanıt veren veya konvansiyonel tedaviye intoleransı olan 6 yaş ve üstü hastalarda, entezit ile ilişkili artritin tedavisinde endikedir (bkz. Bölüm 5.1).
Aksiyal spondiloartrit Ankilozan spondilit (AS)
HUMIRA, konvansiyonel tedaviye yeterli yanıt alınamayan şiddetli, aktif ankilozan spondilitli erişkinlerin tedavisinde endikedir.
Radyografik olarak AS kanıtı olmayan aksiyal spondiloartrit
HUMIRA, yüksek CRP ve/veya MRI ile objektif inflamasyon bulgularının olduğu ancak radyografik olarak AS kanıtı bulunmayan ve non-steroid anti-inflamatuvar ilaçlara yetersiz yanıt veren veya bu ilaçlara intoleransı olan ciddi aksiyal spondiloartritli erişkin hastalarda
endikedir.
Psöriyatik artrit
HUMIRA, hastalığı modifiye edici anti-romatizmal ilaçlarla tedavi edilmesine karşın yeterli yanıt alınamayan aktif ve progresif psöriyatik artritli erişkin hastalarda endikedir.
HUMIRA'nın hastalığın poliartiküler simetrik alt tipleri olan hastalarda periferik eklem hasarının progresyon hızını azalttığı (bkz. Bölüm 5.1) ve fiziksel fonksiyonu iyileştirdiği radyografik ölçütlerle gösterilmiştir.
Psöriyazis
HUMIRA, erişkinlerde siklosporin, metotreksat veya PUVA gibi sistemik tedaviler ile yanıt alınamayan, bu ilaçların kontrendike olduğu veya bu tedavileri tolere edemeyen hastalarda orta ila şiddetli derecede plak psöriyazis tedavisinde kullanılır
Pediyatrik plak psöriyazis
HUMIRA, siklosporin, metotreksat veya PUVA gibi sistemik tedaviler ile cevap alınamayan, bu ilaçların kontrendike olduğu veya bu tedavileri tolere edemeyen adolesanlarda ve 4 yaşından itibaren çocuklarda şiddetli kronik plak psöriyazis tedavisinde endikedir.
Hidradenitis suppurativa (HS)
HUMIRA, konvansiyonel sistemik HS tedavisine yeterli yanıt vermeyen erişkinlerde ve 12 yaşından itibaren ergenlerde, orta ila şiddetli derecede aktif hidradenitis suppurativa (akne inversa) tedavisinde endikedir (bkz. Bölüm 5.1 ve 5.2).
Crohn hastalığı
HUMIRA, bir kortikosteorid ve/veya bir immünosupresan ile yapılan tedaviye, uygun doz ve tam ve yeterli sürelerde kullanıldığı halde yanıt alınamayan veya bu tip tedavilere karşı medikal kontrendikasyonu bulunan erişkinlerde orta ila şiddetli derecedeki, aktif Crohn hastalığının tedavisinde endikedir.
Pediyatrik Crohn hastalığı
HUMIRA, primer beslenme tedavisini, kortikosteroidi ve/veya bir immünomodülatörü içeren tedaviye yeterli yanıt vermeyen ya da bu tip tedavilere intolerans gösteren veya bu tür tedavilerin kontrendike olduğu pediyatrik hastalarda (6 yaşından itibaren) orta ila şiddetli derecedeki aktif Crohn hastalığının tedavisinde endikedir.
Ülseratif kolit
HUMIRA, kortikosteroidler ve 6-merkaptopurin (6-MP) veya azatioprin (AZA) gibi konvansiyonel tedavilere yeterli yanıt vermeyen veya bu tip tedavilere intoleransı olan veya bu tür tedavilere kontrendikasyonu olan erişkin hastalarda orta ila şiddetli derecedeki aktif ülseratif kolit tedavisinde endikedir.
Pediyatrik ülseratif kolit
HUMIRA, kortikosteroidler ve/veya 6-merkaptopurin (6-MP) veya azatioprin (AZA) gibi konvansiyonel tedavilere yeterli yanıt vermeyen veya bu tip tedavilere intoleransı olan veya bu tür tedavilere medikal kontrendikasyonları olan pediyatrik hastalarda (6 yaşından itibaren) orta ila şiddetli derecedeki aktif ülseratif kolit tedavisinde endikedir.
Üveit
HUMIRA, kortikosteroidlere yeterli yanıt vermeyen, kortikosteroid kullanımının azaltılması gereken veya kortikosteroid tedavisinin uygun olmadığı erişkin hastalarda enfeksiyöz olmayan orta, arka ve panüveit tedavisinde endikedir.
Pediyatrik üveit
HUMIRA, konvansiyonel tedaviye yeterli yanıt vermeyen veya konvansiyonel tedaviyi tolere edemeyen ya da konvansiyonel tedavinin uygun olmadığı 2 yaşından itibaren pediyatrik hastalarda enfeksiyöz olmayan, kronik anterior üveit tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
HUMIRA tedavisi, HUMIRA'nın endike olduğu durumların tanı ve tedavisinde deneyimli uzman doktorlar tarafından başlatılmalı ve gözlenmelidir. Oftalmologlara, HUMIRA ile tedaviye başlamadan önce uygun bir uzmana danışmaları önerilir (bkz. Bölüm 4.4).
HUMIRA ile tedavi olan hastalara özel bir uyarı kartı verilir.
Enjeksiyon tekniği konusunda eğitilen hastalar, doktor tarafından uygun bulunursa ve doktor takibi ile HUMIRA enjeksiyonlarını kendileri yapabilirler.
HUMIRA tedavisi sırasında diğer eşlik eden terapiler (örn., kortikosteroidler ve/veya
immünomodülatör ajanlar) optimize edilmelidir.
Erişkin yaş grubu:
Romatoid artrit
Romatoid artriti olan erişkin hastalar için önerilen HUMIRA dozu, iki haftada bir tek doz olarak subkütan enjeksiyon yoluyla uygulanan 40 mg adalimumabdır. HUMIRA ile tedavi sırasında metotreksata devam edilmelidir.
HUMIRA tedavisi sırasında glukokortikoidler, salisilatlar, non-steroid anti-inflamatuvar ilaçlara ya da analjezik ilaçlara devam edilebilir. Metotreksat dışındaki hastalık modifiye edici anti-romatizmal ilaçların kombinasyonu ile ilgili olarak Bölüm 4.4 ve 5.1'e bakınız.
HUMIRA ile monoterapi sırasında, tedaviye verdikleri yanıtlarında azalma meydana gelen bazı hastalarda, adalimumabın doz sıklığının haftada bir defa 40 mg'a ya da iki haftada bir 80 mg'a yükseltilmesi faydalı olabilir.
Mevcut veriler klinik yanıta çoğunlukla 12 haftalık tedavi süresi içinde ulaşıldığını düşündürmektedir. 12 haftalık tedavi ile yeterli yanıt elde edilemeyen olgularda tedaviye devam kararı dikkatle gözden geçirilmelidir.
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Tedaviye ara verilmesi
Ameliyat öncesi veya ciddi bir enfeksiyon oluştuğunda tedaviye ara verilmesi gerekebilir.
Eldeki veriler, tedaviye 70 gün veya daha uzun süre ara verildikten sonra HUMIRA tedavisine tekrar başlanmasının, tedavi kesilmeden önceki aynı klinik yanıt ve benzer güvenlilik profili ile sonuçlandığını göstermektedir.
Psöriyatik artrit, ankilozan spondilit ve radyografik olarak AS kanıtı olmayan aksiyal
spondiloartrit
Psöriyatik artrit, ankilozan spondilit, ve radyografik olarak AS kanıtı olmayan aksiyal spondiloartrit hastaları için önerilen HUMIRA dozu, iki haftada bir tek doz olarak subkütan enjeksiyon yoluyla uygulanan 40 mg adalimumabdır.
Mevcut veriler klinik yanıta çoğunlukla 12 haftalık tedavi süresi içinde ulaşıldığını düşündürmektedir. 12 haftalık tedavi ile yeterli yanıt elde edilemeyen olgularda tedaviye devam kararı dikkatle gözden geçirilmelidir
Psöriyazis
Erişkin hastalar için önerilen HUMIRA dozu, subkütan enjeksiyon yoluyla 80 mg başlangıç dozunu takiben, başlangıç dozundan bir hafta sonra başlamak üzere iki haftada bir subkütan enjeksiyon yoluyla uygulanan 40 mg'dır.
16 haftalık tedavi ile yeterli yanıt elde edilemeyen olgularda tedaviye devam kararı dikkatle
gözden geçirilmelidir.
İki haftada bir 40 mg HUMIRA'ya yetersiz yanıt veren hastalar, 16 haftanın sonrasında dozlama sıklığının haftada bir kez 40 mg'a ya da 2 haftada bir 80 mg'a çıkarılmasından yarar sağlayabilir. Dozlama sıklığı haftada bir kez 40 mg'a ya da iki haftada bir 80 mg'a artırıldıktan sonra yetersiz yanıt veren hastalarda haftalık HUMIRA tedavisine devam etmenin yararları ve riskleri tekrar dikkatle gözden geçirilmelidir (bkz. Bölüm 5.1). Dozlama sıklığının haftada bir kez 40 mg'a ya da iki haftada bir 80 mg'a arttırılmasıyla yeterli cevaba ulaşılırsa, sonrasında doz iki haftada bir 40 mg'a düşürülebilir.
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Hidradenitis suppurativa
Hidradenitis suppurativa (HS) hastası erişkinler için önerilen HUMIRA doz rejimi, ilk olarak
enjeksiyon şeklinde uygulanan) ve bunun ardından iki hafta sonra 15. günde 80 mg'dır (bir günde 40 mg'lık iki enjeksiyon şeklinde uygulanan). İki hafta sonra (29. gün), tedaviye haftada bir kez 40 mg veya iki haftada bir kez 80 mg (bir günde 40 mg'lık iki enjeksiyon şeklinde uygulanan) dozla devam edilir. Gerekli görülmesi halinde, HUMIRA tedavisi sırasında antibiyotiklere devam edilebilir (bkz. Bölüm 4.4). HUMIRA tedavisi sırasında hastanın, HS lezyonlarını her gün bir topikal antiseptik kullanarak temizlemesi önerilmektedir.
12 haftalık tedavi ile yeterli yanıt elde edilemeyen olgularda tedaviye devam kararı dikkatle
gözden geçirilmelidir.
Tedaviye ara verilmesi durumunda, HUMIRA tedavisine haftada bir kez 40 mg ya da iki
haftada bir 80 mg dozda tekrar başlanabilir (bkz. Bölüm 5.1).
Devam edilen uzun süreli tedavinin yararı ve riski periyodik olarak değerlendirilmelidir (bkz.
Bölüm 5.1).
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Crohn hastalığı
Orta ila şiddetli derecede Crohn hastalığı için erişkin hastalarda önerilen HUMIRA indüksiyon doz rejimi subkütan enjeksiyon yoluyla 0. haftada 80 mg ve bunu takiben 2.haftada 40 mg'dır. Daha hızlı bir yanıt alınması gerekli görüldüğünde, 0. haftada 160 mg (bir günde 40 mg'lık 4 enjeksiyon olarak ya da ardışık iki günde günde iki kez 40 mg enjeksiyon olarak), ardından 2. haftada 80 mg (bir günde iki kez 40 mg enjeksiyon olarak), indüksiyon dozu sırasındaki yan etki risklerinin daha yüksek olacağının farkında olarak kullanılabilir.
İndüksiyon tedavisinden sonra, önerilen idame dozu iki haftada bir subkütan enjeksiyon yoluyla uygulanan 40 mg'dır. Alternatif olarak, HUMIRA tedavisi kesildiğinde hastalığın belirti ve bulguları nüks ederse, HUMIRA tekrar uygulanabilir. Bir önceki dozdan 8 hafta sonra tekrar uygulamaya dair çok az deneyim mevcuttur.
İdame tedavisi boyunca, kortikosteroidler klinik uygulama kılavuzları ile uyumlu olarak azaltılabilir.
İki haftada bir 40 mg'a olan yanıtında azalma olan bazı hastalar, HUMIRA doz sıklığının
haftada bir 40 mg'a ya da 2 haftada bir 80 mg'a yükseltilmesinden yarar görebilir.
Tedaviye 4. haftaya dek cevap vermeyen bazı hastalar, idame tedavisine 12. hafta boyunca devam edilmesinden yarar görebilir. 12 haftalık tedavi ile yeterli yanıt elde edilemeyen olgularda tedaviye devam kararı dikkatle gözden geçirilmelidir.
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Ülseratif kolit
ardışık gün boyunca iki 40 mg'lık enjeksiyon halinde uygulanabilir) ve 2. haftada 80 mg'dır (bir günde iki 40 mg'lık enjeksiyon olarak verilir). İndüksiyon tedavisinden sonra önerilen doz, subkütan enjeksiyon yoluyla uygulanan iki haftada bir 40 mg'dır.
İdame tedavisi boyunca, kortikosteroidler klinik uygulama kılavuzları ile uyumlu olarak azaltılabilir.
Tedaviye verdikleri yanıtlarında azalma olan bazı hastalar, HUMIRA doz sıklığının haftada bir
40 mg'a ya da 2 haftada bir 80 mg'a yükseltilmesinden yarar görebilir.
Mevcut veriler klinik yanıta çoğunlukla 2-8 haftalık tedavi süresi içinde ulaşıldığını göstermektedir. 2-8 haftalık tedavi ile yanıt elde edilemeyen olgularda HUMIRA tedavisine devam edilmemelidir.
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Üveit
Üveit görülen erişkin hastalar için önerilen HUMIRA dozu, 80 mg başlangıç dozunu takiben, başlangıç dozundan bir hafta sonra başlamak üzere iki haftada bir 40 mg'dır. Tek başına HUMIRA ile tedaviye başlanılması konusunda sınırlı deneyim bulunmaktadır. HUMIRA ile tedavi; kortikosteroidlerle ve/veya diğer biyolojik olmayan immünomodülatör ajanlarla kombinasyon ile başlatılabilir. Eşzamanlı kortikosteroidlerin dozu HUMIRA ile tedavi uygulanmasına başladıktan iki hafta sonra klinik uygulamaya uygun şekilde azaltılabilir.
Devam eden uzun süreli tedavinin fayda ve riskinin yıllık bazda değerlendirilmesi önerilir (bkz.
Bölüm 5.1).
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir. Pediyatrik yaş grubu Jüvenil idiyopatik artrit
2 yaş ve üstü poliartiküler jüvenil idiyopatik artrit
Poliartiküler jüvenil idiyopatik artriti olan hastalar için önerilen HUMIRA dozu, vücut ağırlığına bağlı olarak seçilir (Tablo 1). HUMIRA, subkütan enjeksiyon yoluyla iki haftada bir uygulanır.
Tablo 1. Poliartiküler Jüvenil İdiyopatik Artritli Hastalar için HUMIRA Dozu
Hasta Ağırlığı | Doz Rejimi |
10 kg ila < 30 kg arası | İki haftada bir 20 mg |
≥ 30 kg | İki haftada bir 40 mg |
Mevcut veriler, klinik yanıtın genellikle 12 haftalık tedavi içinde sağlandığını göstermektedir.
Bu zaman diliminde yanıt vermeyen bir hastada tedaviye devam kararı dikkatle gözden
geçirilmelidir.
2 yaş altındaki çocuklarda bu endikasyonda HUMIRA' nın kullanımı bulunmamaktadır. HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da mevcut olabilir.
Entezit ile ilişkili artrit
6 yaş üzerindeki entezit ile ilişkili artriti olan hastalar için önerilen HUMIRA dozu, vücut ağırlığına bağlı olarak seçilir (Tablo 2). HUMIRA, subkütan enjeksiyon yoluyla iki haftada bir uygulanır.
Tablo 2. Entezit ile İlişkili Artriti Olan Hastalar için HUMIRA Dozu
Hasta Ağırlığı | Doz Rejimi |
15 kg ila < 30 kg arası | İki haftada bir 20 mg |
≥ 30 kg | İki haftada bir 40 mg |
HUMIRA 6 yaş altındaki entezit ile ilişkili artritli çocuklarda çalışılmamıştır.
HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Psöriyatik artrit ve ankilozan spondilit de dahil olmak üzere aksiyal spondiloartrit
Pediyatrik popülasyonda psöriyatik artrit ve ankilozan spondilit endikasyonlarında, HUMIRA ile ilgili bir kullanım bulunmamaktadır.
Pediyatrik plak psöriyazis
Pediyatrik plak psöriyazisli 4-17 yaş arasındaki hastalar için önerilen HUMIRA dozu, vücut ağırlığına bağlı olarak seçilir (Tablo 3). HUMIRA, subkütan enjeksiyon yoluyla uygulanır.
Tablo 3. Plak Psöriyazisli Pediyatrik Hastalar için HUMIRA Dozu
Hasta Ağırlığı | Doz Rejimi |
15 kg ila < 30 kg arası | 20 mg'lık başlangıç dozunu takiben, başlangıç dozundan bir hafta sonra verilmeye başlanan iki haftada bir 20 mg |
≥ 30 kg | 40 mg'lık başlangıç dozunu takiben, başlangıç dozundan bir hafta sonra verilmeye başlanan iki haftada bir 40 mg |
16 haftalık tedavi ile yeterli yanıt elde edemeyen hastalarda tedaviye devam kararı dikkatle
gözden geçirilmelidir.
HUMIRA ile tekrar tedaviye devam edilirse, doz ve tedavi süresi yukarıdaki kılavuz bilgilerine göre uygulanmalıdır.
değerlendirilmiştir.
4 yaş altındaki çocuklarda bu endikasyonda HUMIRA'nın kullanımı bulunmamaktadır. HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Adolesan hidradenitis suppurativa (12 yaşından itibaren, en az 30 kg ağırlığında)
HUMIRA ile hidradenitis suppurativa (HS) hastası olan ergenlerde henüz çalışma yapılmamıştır. HUMIRA'nın pozolojisi bu hastalarda farmakokinetik modelleme ve simülasyon ile belirlenmektedir (bkz. Bölüm 5.2).
Önerilen HUMIRA doz rejimi, 0. haftada 80 mg ve ardından 1. haftadan itibaren subkütan enjeksiyon yoluyla uygulanan iki haftada bir 40 mg'dır.
İki haftada bir 40 mg HUMIRA tedavisine yetersiz yanıt veren ergenlik çağındaki hastalarda, dozaj sıklığının her hafta 40 mg'a ya da 2 haftada bir 80 mg'a yükseltilmesi düşünülebilir.
Gerekli görülmesi halinde, HUMIRA tedavisi sırasında antibiyotiklere devam edilebilir. HUMIRA tedavisi sırasında hastanın, HS lezyonlarını her gün bir topikal antiseptik kullanarak temizlemesi önerilmektedir.
12 haftalık tedavi ile yeterli yanıt elde edemeyen hastalarda tedaviye devam kararı dikkatle
gözden geçirilmelidir.
Tedavinin kesilmesi durumunda, HUMIRA tedavisi yeniden uygun şekilde verilebilir.
Devam edilen uzun süreli tedavinin yararı ve riski periyodik olarak değerlendirilmelidir (bkz.
Bölüm 5.1).
12 yaş altındaki çocuklarda bu endikasyonda HUMIRA'nın kullanımı bulunmamaktadır. HUMIRA, bireysel tedavi ihtiyaçlarına bağlı olarak diğer yitilikler ve/veya formlarda da
mevcut olabilir.
Pediyatrik Crohn hastalığı
Crohn hastalığı olan 6-17 yaş arasındaki hastalar için önerilen HUMIRA dozu, vücut ağırlığına bağlı olarak seçilir (Tablo 4). HUMIRA, subkütan enjeksiyon yoluyla uygulanır.
Hasta Ağırlığı | İndüksiyon Dozu | 4. Haftada Başlayan İdame Dozu |
< 40 kg | 0. haftada 40 mg ve 2. haftada 20 mg
Tedaviye daha hızlı bir yanıt gerekli görüldüğünde, daha yüksek indüksiyon dozu kullanımıyla advers olay riskinin daha yüksek olabileceği konusunda dikkatli davranılarak aşağıdaki doz kullanılabilir: 0. haftada 80 mg ve 2. haftada 40 mg | İki haftada bir 20 mg |
Tablo 4. Crohn Hastalığı Olan Pediyatrik Hastalar için HUMIRA Dozu
Hasta Ağırlığı | İndüksiyon Dozu | 4. Haftada Başlayan İdame Dozu |
|
Tedaviye daha hızlı bir yanıt gerekli görüldüğünde, daha yüksek indüksiyon dozu kullanımıyla advers olay riskinin daha yüksek olabileceği konusunda dikkatli davranılarak aşağıdaki doz kullanılabilir: 0. haftada 160 mg ve 2. haftada 80 mg | |
Tedaviye yetersiz yanıt veren bazı hastalarda, HUMIRA doz sıklığının arttırılması yarar sağlayabilir:
< 40 kg: haftada bir 20 mg
4.3. Kontrendikasyonlar
HUMIRA aşağıdaki durumlarda kontrendikedir:
Adalimumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı
hipersensitivite gösteren hastalarda;
4.4. Özel kullanım uyarıları ve önlemleri
65 yaş üstü hastalarda ölümle sonuçlanabilecek ciddi enfeksiyon riski 65 yaş altındakilere göre daha yüksektir.
İzlenebilirlik
Biyolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
Enfeksiyonlar
TNF-bloke edici ajan alan hastalar ciddi enfeksiyonlara daha fazla duyarlıdır. Akciğer fonksiyon yetmezliği enfeksiyon gelişme riskini arttırabilir. Hastalar HUMIRA tedavisinden önce, tedavisi sırasında ve tedavisinden sonra, tüberküloz dahil olmak üzere enfeksiyonlar açısından yakından izlenmelidir. Adalimumabın eliminasyonu dört aya kadar sürebildiğinden, izlemeye bu dönem boyunca da devam edilmelidir.
HUMIRA tedavisi, kronik veya lokalize enfeksiyonlar dahil aktif enfeksiyonları olan hastalarda, enfeksiyon kontrol altına alınana kadar başlatılmamalıdır. Tüberküloza maruz kalan hastalarda veya tüberküloz ya da endemik mikoz (histoplazmoz, koksidiyomikoz veya blastomikoz) riski yüksek bölgelere seyahat etmiş olan hastalarda HUMIRA tedavisi başlatılmadan önce tedavinin risk ve yararları değerlendirilmelidir (bkz. Diğer fırsatçı enfeksiyonlar).
HUMIRA tedavisi sırasında yeni bir enfeksiyon gelişen hastalar yakından izlenmelidir ve tam bir tanısal değerlendirmeye tabi tutulmalıdır. Bir hastada yeni bir ciddi enfeksiyon veya sepsis geliştiğinde HUMIRA uygulaması kesilmelidir ve enfeksiyon kontrol altına alınana dek uygun antimikrobiyal veya antifungal tedavi başlatılmalıdır. Tekrarlayan enfeksiyon öyküsü olan hastalarda veya hastada enfeksiyona predispozisyon yaratan, eş zamanlı immünosüpresif ilaçların kullanımı dahil altta yatan nedenler bulunduğunda, doktorlar HUMIRA kullanımı konusunda dikkatli olmalıdır.
Ciddi enfeksiyonlar
HUMIRA kullanan hastalarda bakteriyel, mikobakteriyel, invazif fungal, parazitik, viral ya da listeriyozis, lejyonellozis ve pnömosistis gibi diğer fırsatçı enfeksiyonlara bağlı olarak sepsisi de içeren ciddi enfeksiyonlar bildirilmiştir.
Klinik çalışmalarda görülen diğer ciddi enfeksiyonlar arasında pnömoni, piyelonefrit, septik artrit ve septisemi yer almaktadır. Enfeksiyonlarla bağlantılı olarak hastaneye yatışa sebep olabilen ya da fatal sonuçlar bildirilmiştir.
Tüberküloz
HUMIRA almakta olan hastalarda reaktivasyon ve yeni başlayan tüberküloz dahil olmak üzere, tüberküloz ortaya çıktığı bildirilmiştir. Bu bildirimler pulmoner ve ekstrapulmoner (dissemine) tüberküloz durumlarını içermektedir.
HUMIRA tedavisine başlanmadan önce bütün hastalar gerek aktif gerekse inaktif (latent) tüberküloz enfeksiyonu yönünden değerlendirilmelidir. Bu değerlendirme, kişide tüberküloz hikayesi veya daha önce aktif tüberkülozu olan hastalar ile temas öyküsü ve önceki ve/veya halen sürmekte olan immünosüpresif tedaviler dahil ayrıntılı bir tıbbi değerlendirme içermelidir. Bütün hastalarda uygun tarama testleri (tüberkülin deri testi ve akciğer röntgeni gibi) yapılmalıdır (yerel öneriler uygulanabilir). Bu testlerin yönteminin ve sonuçlarının “Hasta Uyarı Kartıâ€na kaydedilmesi önerilmektedir. Doktorlara, özellikle ağır hastalığı olan veya immünkompromize hastalarda yalancı negatif tüberkülin deri testi sonuçlarının alınma riski hatırlatılmalıdır.
Eğer aktif tüberküloz tanısı konulursa HUMIRA tedavisine başlanmamalıdır (bkz. Bölüm 4.3). Aşağıda belirtilen tüm durumlarda tedavinin fayda/risk oranı dikkatle değerlendirilmelidir.
Latent tüberküloz kuşkusu olması halinde, tüberküloz tedavisinde uzman olan bir hekime danışılmalıdır.
Latent tüberküloz teşhis edildiğinde HUMIRA başlanmadan önce yerel öneriler doğrultusunda anti-tüberküloz profilaksisi başlanmalıdır.
Tüberküloz için test sonucu negatif olan, ancak tüberküloz enfeksiyonu açısından çeşitli ve anlamlı riski bulunan hastalarda ve önceden geçirilmiş aktif ya da inaktif tüberküloz öyküsü olup yeterli tedavi aldığından emin olunamayan hastalarda HUMIRA'ya başlanmadan önce anti-tüberküloz profilaksisi düşünülmelidir.
HUMIRA ile tedavi edilen hastalarda, tüberküloz profilaksisi uygulanmasına rağmen tüberküloz reaktivasyonu ortaya çıkmıştır. Daha önce başarılı bir şekilde aktif tüberküloz tedavisi görmüş olan bazı hastalarda, HUMIRA ile yapılan tedavi sırasında yeniden tüberküloz gelişmiştir.
Diğer fırsatçı enfeksiyonlar
HUMIRA uygulanan hastalarda invazif fungal enfeksiyonlar dahil fırsatçı enfeksiyonlar bildirilmiştir. Bu enfeksiyonlar, TNF bloke edici ajan alan hastalarda her zaman teşhis edilememiştir, bu da uygun tedavinin gecikmesine ve bazen fatal sonuçlara neden olmuştur.
Ateş, kırıklık, kilo kaybı, terleme, öksürme, dispne ve/veya pulmoner infiltratlar gibi bulgu ve semptomlar ya da eş zamanlı şok ile birlikte veya şok olmaksızın diğer ciddi bir sistemik hastalık gelişen hastalarda invazif bir fungal enfeksiyon varlığından şüphelenilmeli ve HUMIRA uygulaması derhal durdurulmalıdır. Bu hastalarda, teşhis ve ampirik antifungal tedavi uygulaması, invazif fungal enfeksiyonlu hastaların tedavisinde uzman bir doktora danışılarak gerçekleştirilmelidir.
Hepatit B reaktivasyonu
HUMIRA dahil, TNF bloke edici ajan kullanan ve hepatit B virüsünün kronik taşıyıcısı olan hastalarda (örn. yüzey antijen pozitif) hepatit B reaktivasyonu ortaya çıkmıştır. Bazı olgular fatal sonuçlanmıştır. HUMIRA tedavisine başlamadan önce hastalar HBV enfeksiyonu açısından test edilmelidir. Hepatit B enfeksiyonu için testleri pozitif bulunan hastalar için hepatit B tedavisinde uzman bir hekime danışılması önerilmektedir.
HUMIRA tedavisine ihtiyaç duyan HBV taşıyıcıları, tedavi boyunca ve tedavinin kesilmesinden sonra bir kaç ay süreyle aktif HBV enfeksiyonunun bulgu ve semptomları bakımından yakından izlenmelidir. HBV taşıyıcısı hastalarda TNF bloke edici ajan tedavisiyle birlikte, HBV reaktivasyonunu önleme amaçlı antiviral tedavi uygulaması konusunda yeterli veri bulunmamaktadır. HBV reaktivasyonu gelişen hastalarda HUMIRA tedavisi durdurulmalı ve uygun bir destek tedavisi ile birlikte etkili antiviral tedavisine başlanmalıdır.
Nörolojik olaylar
HUMIRA dahil TNF bloke edici ajanlar, nadir olgularda multipl skleroz ve optik nörit gibi santral sinir sistemi demiyelinizan hastalıklar ve Guillain-Barré sendromu dahil periferik demiyelinizan hastalıkların ortaya çıkması veya bu hastalıkların klinik semptomlarının alevlenmesi ve/veya radyografik bulguların ortaya çıkması ile ilişkili bulunmuştur. Hastalarına HUMIRA tedavisi uygulayacak olan doktorlar, önceden var olan ya da yakın zamanda başlamış santral veya periferik sinir sistemi demiyelinizan hastalıkları bulunan hastalarda HUMIRA kullanma kararını dikkatle gözden geçirmelidir. Bu bozukluklardan herhangi biri ortaya çıktığı takdirde HUMIRA'nın kesilmesi düşünülmelidir. Orta üveit ile merkezi demiyelinizan bozukluklar arasında bilinen bir ilişki mevcuttur. Enfeksiyöz olmayan orta üveit hastalarında önceden mevcut olan veya gelişmekte olan merkezi demiyelinizan bozuklukların değerlendirilmesine yönelik olarak HUMIRA tedavisine başlanmadan önce ve tedavi sırasında düzenli şekilde nörolojik değerlendirme gerçekleştirilmelidir.
Alerjik reaksiyonlar
alerjik reaksiyon gelişirse HUMIRA uygulaması derhal kesilerek uygun tedaviye başlanmalıdır.
İmmünosüpresyon
HUMIRA ile tedavi edilen 64 romatoid artrit hastasıyla yapılan bir çalışmada, gecikmiş tipte hipersensitivitenin baskılanması, immünoglobulin düzeylerinin baskılanması veya efektör T-, B-, NK-hücrelerinin, monosit/makrofajların ve nötrofillerin sayılarında değişme olduğuna ilişkin kanıtlar bulunmamıştır.
Maligniteler ve lenfoproliferatif hastalıklar
TNF bloke edici ajanlarla yürütülen kontrollü klinik çalışmalarda, TNF bloke edici ajan verilen hastalarda kontrol hastalarına kıyasla lenfoma dahil daha fazla sayıda malignite olgusu gözlemlenmiştir. Ancak bunlar seyrek olarak ortaya çıkmıştır. Pazarlama sonrası dönemde, TNF bloke edici ajanlarla tedavi edilen hastalarda lösemi olguları bildirilmiştir. Uzun bir geçmişe sahip, yüksek derecede aktif, inflamatuvar hastalığı olan romatoid artrit hastalarında, arka planda lenfoma ve lösemi riski artmaktadır; bu durum ise risk tahminini zorlaştırmaktadır. Mevcut bilgiler ile, bir TNF bloke edici ajan ile tedavi edilen hastalarda olası bir lenfoma, lösemi ya da diğer malignitelerin gelişme riski göz ardı edilemez.
Pazarlama sonrası dönemdeki adalimumab dahil TNF bloke edici ajanlarla tedavi edilen (tedavi başlangıcı ≤ 18 yaş) çocuklar, adolesanlar ve genç erişkinler (22 yaşına kadar olanlar) arasında, bazıları ölümcül olmak üzere, maligniteler bildirilmiştir. Bu vakaların yaklaşık yarısı lenfoma olmuştur. Diğer vakalar, genellikle immünosüpresyon ile bağlantılı nadir maligniteler de dahil olmak üzere, çeşitli diğer maligniteler olmuştur. TNF bloke edici ajanlar ile tedavi edilen çocuklar ve adolesanlarda malignite gelişmesi riski göz ardı edilemez.
Adalimumab ile tedavi edilen hastalarda, pazarlama sonrası dönemde seyrek olarak hepatosplenik T hücreli lenfoma teşhis edilmiştir. Nadir görülen bu T hücreli lenfoma türü, çok agresif bir seyre sahiptir ve genelde ölümcüldür. HUMIRA ile görülen bu hepatosplenik T hücreli lenfoma vakalarının bazıları, inflamatuvar bağırsak hastalığı için HUMIRA ile eş zamanlı azatiyoprin veya 6-merkaptopürin kullanılan genç erişkinlerde görülmüştür. Azatiyoprin veya 6-merkaptopürin ile HUMIRA kombinasyonunun neden olabileceği potansiyel risk dikkatlice değerlendirilmelidir. HUMIRA ile tedavi edilen hastalarda, hepatosplenik T hücreli lenfoma gelişmesi riski göz ardı edilemez (bkz. Bölüm 4.8).
HUMIRA kullanan 60 yaş üzeri hastalarda, periyodik servikal kanser taramasına devam
edilmelidir.
Malignite öyküsü olan ya da HUMIRA kullanırken malignite gelişen ve tedaviye devam edilen hastaları içeren bir çalışma yapılmamıştır. Bu nedenle böyle hastalarda HUMIRA tedavisine devam kararı daha dikkatli bir şekilde gözden geçirilmelidir (bkz. Bölüm 4.8).
HUMIRA tedavisine başlanmadan önce ve tedavi esnasında bütün hastalar, özellikle geniş kapsamlı immünosupresan tedavi geçmişi olan hastalar veya PUVA tedavisi geçmişi olan psöriyazis hastaları, melanoma-dışı cilt kanseri varlığı açısından değerlendirilmelidir. Adalimumab dahil TNF bloke edici ajanlar ile tedavi edilen hastalarda melanoma ve Merkel hücreli karsinoma da bildirilmiştir (bkz. Bölüm 4.8).
Bir başka TNF bloke edici ajan olan infliksimab kullanımını değerlendiren tespit amaçlı bir klinik çalışmada, orta ila şiddetli derecede kronik obstrüktif akciğer hastalığı (KOAH) olan hastalar, kontrol grubu hastalar ile karşılaştırıldığında, infliksimab uygulanan hasta grubunda çoğunlukla akciğer veya baş ve boyunda olmak üzere daha fazla maligniteler bildirilmiştir. Bütün hastalarda yoğun sigara içme hikayesi vardı. Bu nedenle, KOAH hastalarında ve yoğun sigara içilmesine bağlı malignite riski artmış olan hastalarda herhangi bir TNF bloke edici ajan kullanılırken dikkatli olunmalıdır.
Mevcut veriler ile adalimumab tedavisinin displazi gelişimi veya kolon kanseri geliştirme riskini etkileyip etkilemediği bilinmemektedir. Artmış displazi veya kolon karsinoma riski olan (örn., uzun süreli ülseratif kolit veya primer sklerozan kolanjit hastaları) veya önceden displazi ya da kolon karsinoma geçmişi olan tüm ülseratif kolit hastalarında, tedaviden önce ve hastalık süresince düzenli aralıklarla displaziye yönelik tarama yapılmalıdır. Bu değerlendirme, yerel önerilere uygun bir şekilde gerçekleştirilecek kolonoskopi ve biyopsileri kapsamalıdır.
TNF bloke edici ajanın kullanımına bağlı olarak lösemi-kan kanseri (akut myeloid lösemi, kronik lenfositik lösemi ve kronik myeloid lösemi) geliştiği bildirilmiştir.
Hematolojik reaksiyonlar
TNF bloke edici ajanlar ile aplastik anemi dahil pansitopeni olguları seyrek olarak bildirilmiştir. HUMIRA ile tıbbi açıdan önemli sitopeni de (örn. trombositopeni, lökopeni) dahil olmak üzere, hematolojik sisteme ait advers olaylar bildirilmiştir. Bütün hastalara, HUMIRA kullanmakta iken kan diskrazilerini belirten bulgu ve semptomların (örn. inatçı ateş, morarma, kanama, solukluk) gelişmesi halinde hemen doktora başvurmaları tavsiye edilmelidir. Varlığı doğrulanmış önemli hematolojik anormalliklerin bulunduğu hastalarda, HUMIRA tedavisine son verilmesi değerlendirilmelidir.
Aşılamalar
Adalimumab veya plasebo ile tedavi edilen romatoid artritli 226 erişkin üzerinde yürütülen bir çalışmada, standart 23 valanlı pnömokok aşısına ve trivalan influenza virüs aşısına karşı benzer antikor yanıtları gözlemlenmiştir. HUMIRA almakta olan hastalarda enfeksiyonun canlı aşılar yoluyla ikincil iletimi konusunda veri bulunmamaktadır.
Pediyatrik hastalara, eğer mümkünse, HUMIRA tedavisine başlamadan önce güncel immünizasyon kılavuzlarına uygun olarak tüm bağışıklık aşılarını tamamlamaları önerilir.
HUMIRA tedavisi almakta olan hastalara, canlı aşılar hariç, eş zamanlı aşılar uygulanabilir. Anne karnında adalimumaba maruz kalan bebeklerde, anneye gebelik sırasında yapılan son adalimumab enjeksiyonunu takip eden 5 ay içinde canlı aşı (örn. BCG aşısı) uygulaması önerilmemektedir.
Konjestif kalp yetmezliği
Başka bir TNF bloke edici ajan ile yapılan bir klinik çalışmada konjestif kalp yetmezliğinde kötüleşme ve konjestif kalp yetmezliğine bağlı mortalitede artış gözlemlenmiştir. HUMIRA tedavisi gören hastalarda da konjestif kalp yetmezliğinin ağırlaştığı olgular bildirilmiştir. HUMIRA, hafif kalp yetmezliği (NYHA sınıfı I/II) olan hastalarda dikkatle kullanılmalıdır. HUMIRA, orta ila şiddetliderecedekalpyetmezliğindeko ntrendikedir (bkz. Bölüm 4.3).
Konjestif kalp yetmezliği semptomları yeni ortaya çıkan veya kötüleşen hastalarda HUMIRA
tedavisi kesilmelidir.
Otoimmün süreçler
HUMIRA ile tedavi otoimmün antikorların oluşmasına yol açabilir. Uzun dönemli HUMIRA tedavisinin otoimmün hastalık gelişmesi üzerindeki etkisi bilinmemektedir. Eğer bir hastada HUMIRA tedavisinden sonra lupus benzeri sendromunu düşündüren semptomlar gelişirse ve hastanın çift-sarmallı DNA'ya karşı antikor testleri pozitif ise, HUMIRA tedavisine daha fazla devam edilmemelidir (bkz. Bölüm 4.8).
TNF bloke edici ajan ve biyolojik hastalık modifiye edici anti-romatizmal ilaçların (DMARD) birlikte uygulanması
Anakinra ve başka bir TNF bloke edici ajan olan etanerseptin birlikte kullanıldığı klinik çalışmalarda ciddi enfeksiyonlar görülmüş ve tek başına etanersept kullanımına göre ek bir yarar sağlanmamıştır. Etanersept ve anakinra kombinasyon tedavisinde görülen advers olayların doğası gereği, benzer toksisiteler anakinra ile diğer TNF bloke edici ajanların kombinasyonunda da ortaya çıkabilir. Bu nedenle, adalimumab ve anakinra kombinasyonu önerilmemektedir (bkz. Bölüm 4.5).
Adalimumabın biyolojik hastalık modifiye edici diğer anti-romatizmal ilaçlarla (örn. anakinra ve abatasept) ya da diğer TNF bloke edici ajanlar ile eşzamanlı kullanımı, ciddi enfeksiyonlar ve diğer potansiyel farmakolojik etkileşimlerin dahil olduğu olası enfeksiyon riski artışı nedeniyle önerilmemektedir (bkz. Bölüm 4.5).
Cerrahi
HUMIRA tedavisindeki hastalarda cerrahi prosedürlerle ilgili güvenlilik deneyimi kısıtlıdır. Eğer bir cerrahi prosedür planlanıyorsa, adalimumab yarılanma-ömrünün uzun oluşu dikkate alınmalıdır. HUMIRA tedavisinde iken cerrahi işlem gereken bir hasta, enfeksiyonlar açısından yakından izlenmeli ve uygun önlemler alınmalıdır. HUMIRA almakta iken artroplasti uygulanan hastalara ilişkin güvenlilik deneyimi kısıtlıdır.
İnce bağırsak obstrüksiyonu
Crohn hastalığı tedavisine yanıt alınamaması, ameliyat gerektirebilecek sabit fibrotik striktür varlığına işaret edebilir. Mevcut veriler, HUMIRA'nın striktürlere neden olmadığını veya kötüleştirmediğini göstermektedir.
Geriyatrik popülasyon
HUMIRA ile tedavi edilen 65 yaş üzerindeki vakalarda (%3,7) ciddi enfeksiyon görülme sıklığı 65 yaş ve altındaki vakalara (%1,5) göre daha yüksektir. Bazı vakalar ölüm ile sonuçlanmıştır. Enfeksiyon riski daha yüksek olduğu için yaşlılar tedavi edilirken özellikle dikkat edilmelidir.
Pediyatrik popülasyon
HUMIRA ile 2 yaş altındaki çocuklarda çalışma yapılmamıştır. Aşılamalar bölümüne bakınız.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
HUMIRA monoterapi olarak ve metotreksat ile eşzamanlı olarak romatoid artrit, poliartiküler jüvenil idiyopatik artrit ve psöriyatik artrit hastalarında incelenmiştir. HUMIRA'nın metotreksat ile birlikte verildiği durumlarda monoterapi şeklinde kullanıma kıyasla antikor oluşumu daha düşüktür. HUMIRA'nın metotreksat olmaksızın uygulanması, antikor oluşumunda artış, ayrıca adalimumabın klerensinde artma ve etkililiğinde azalma ile sonuçlanmıştır (bkz. Bölüm 5.1).
HUMIRA ve anakinra kombinasyonu önerilmemektedir (bkz. Bölüm 4.4). HUMIRA ve abatasept kombinasyonu önerilmemektedir (bkz. Bölüm 4.4). Özel popülasyonlara ilişkin ek bilgiler
Böbrek/Karaciğer yetmezliği:
Böbrek ya da karaciğer yetmezliği olan hastalarda klinik etkileşim çalışması gerçekleştirilmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyonda klinik etkileşim çalışması gerçekleştirilmemiştir.
Geriyatrik popülasyon:
Geriyatrik popülasyonda klinik etkileşim çalışması gerçekleştirilmemiştir.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi B.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınların gebeliği önlemek için etkili kontrasepsiyon önlemleri almaları ve bu önlemlere son HUMIRA enjeksiyonundan sonra en az beş ay süreyle devam etmeleri önerilmektedir.
Gebelik dönemi
1500'den fazlası ilk trimesterde olmak üzere adalimumab maruziyeti olan, canlı doğumla sonuçlanan ve çıktıları bilinen, geniş sayıdaki (yaklaşık 2100) gebelikten prospektif olarak toplanmış veriler, adalimumabın yenidoğanlarda malformasyon oranlarını arttırdığına işaret etmemektedir.
Bir prospektif kohort çalışmasında, en az ilk trimester sırasında adalimumab ile tedavi edilen romatoid artrit (RA) veya Crohn hastalığı (CH) olan 257 kadın ve adalimumab ile tedavi edilmemiş RA veya CH olan120kadınkayıtaltın aalınmıştır. Çalışmanın primer sonlanım
noktası, majör doğum kusurlarının doğum prevalansıdır. Majör doğum kusuru olan en az bir canlı doğum ile sonuçlanan gebelik oranı adalimumab ile tedavi edilen RA hastası kadınlarda 6/69 (%8,7) iken tedavi edilmeyenlerde 5/74 (%6,8) (düzeltilmemiş risk oranı 1,31, % 95 GA 0,38-4,52), adalimumab ile tedavi edilen CH tanılı kadınlarda 16/152 (%10,5) iken tedavi edilmeyenlerde 3/32 (%9,4) (düzeltilmemiş risk oranı 1,14, %95 GA 0,31-4,16) olarak bulunmuştur. RA ve CH için kombine (temel farklılıklara göre hesaplanan) düzeltilmiş risk oranı 1,10'dur (%95 GA 0,45-2,73). İkincil sonlanım noktaları olan kendiliğinden düşük, minör doğum kusurları, erken doğum, doğum ölçüleri ve ciddi veya fırsatçı enfeksiyonlar için adalimumab ile tedavi edilen ve tedavi almamış kadınlar arasında belirgin farklılıklar bulunmamakla birlikte ölü doğum veya malignite vakası bildirilmemiştir. Çalışma küçük örnek boyutlarını ve randomize olmayan çalışma dizaynını içeren metodolojik limitlere sahip olduğu için verilerin yorumlanması değişiklik gösterebilir.
Maymunlarda yürütülen bir gelişimsel toksisite çalışmasında herhangi bir maternal toksisite, embriyotoksisite ya da teratojenite göstergesi bulunmamıştır. Adalimumabın postnatal toksisite üzerindeki etkisine ilişkin klinik öncesi veri bulunmamaktadır (bkz. Bölüm 5.3).
TNF-alfa'yı inhibe etmesi nedeniyle, gebelik sırasında verilen adalimumab yenidoğanda normal immün yanıtları etkileyebilir. Adalimumab gebelik sırasında sadece ihtiyaç duyulduğu takdirde kullanılmalıdır.
Bununla birlikte, adalimumab gebelik sırasında alındığında plasentadan bebeğin serumuna geçebilir. Sonuç olarak da bu bebeklerde enfeksiyon riskinde artışa neden olabilir. Anne karnında adalimumab maruziyeti bulunan bebeklerde, anneye gebelik sırasında yapılan son adalimumab enjeksiyonunu takip eden 5 ay içinde canlı aşı (örn. BCG aşısı) uygulaması önerilmez.
Laktasyon dönemi
Yayımlanan literatürden elde edilen kısıtlı bilgiye göre; insan sütünde anne serum seviyesinin %0,1 ila %1 konsantrasyonlarındaki adalimumab varlığı, adalimumabın anne sütüne çok düşük konsantrasyonlarda geçtiğini göstermektedir. Oral yolla verilip sindirilen immünoglobülin G proteinleri, intestinal proteolize uğrar ve düşük biyoyararlanıma sahiptir. Anne sütü ile beslenen yeni doğanlara/bebeklere etkisi beklenmemektedir. Sonuç olarak, HUMIRA emzirme dönemi boyunca kullanılabilir.
Üreme yeteneği/ Fertilite
Adalimumabın fertilite üzerindeki etkilerine ilişkin klinik öncesi veri bulunmamaktadır (bkz.
Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
HUMIRA'nın taşıt ve makine kullanma yeteneği üzerine minör etkisi bulunabilir. HUMIRA uygulanmasını takiben vertigo ve görme bozukluğu görülebilir (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
HUMIRA pivotal kontrollü ve açık etiketli çalışmalarda 60 aya kadar veya daha uzun süreyle 9506 hasta üzerinde incelenmiştir. Bu çalışmalar hastalık süresi kısa ya da uzun olan romatoid artrit, jüvenil idiyopatik artrit (poliartiküler jüvenil idiyopatik artrit ve entezit ile ilişkili artrit) hastalarının yanı sıra aksiyal spondiloartrit (ankilozan spondilit, radyografik olarak AS kanıtı olmayan aksiyal spondiloartrit), psöriyatik artrit, Crohn hastalığı, ülseratif kolit, psöriyazis, hidradenitis suppurativa ve üveit hastalarını kapsamaktadır. Pivotal kontrollü çalışmalarda HUMIRA uygulanan 6089 hasta ve kontrollü dönem sırasında plasebo ya da aktif karşılaştırma ajanı uygulanan 3801 hasta dahil edilmiştir.
Pivotal çalışmaların çift-kör, kontrollü dönemlerinde advers olaylar nedeniyle tedaviyi bırakan hastaların oranı, HUMIRA alan hastalar için %5,9 ve kontrol tedavisi alan hastalar için %5,4 olmuştur.
En yaygın olarak bildirilen advers reaksiyonlar; enfeksiyonlar (örn. nazofaranjit, üst solunum yolu enfeksiyonu ve sinüzit), enjeksiyon yeri reaksiyonları (eritem, kaşıntı, hemoraji, ağrı ya da şişme), baş ağrısı ve kas-iskelet ağrısıdır.
HUMIRA için ciddi advers reaksiyonlar bildirilmiştir. HUMIRA gibi TNF bloke edici ajanlar immün sistemi etkilemekte ve bu ajanların kullanımı, vücudun enfeksiyona ve kansere karşı olan savunmasını etkileyebilmektedir. HUMIRA kullanımı ile fatal ve yaşamı tehdit eden enfeksiyonlar (sepsis, fırsatçı enfeksiyonlar ve TB dahil), HBV reaktivasyonu ve çeşitli maligniteler de (lösemi, lenfoma ve HSTCL dahil) bildirilmiştir.
Ciddi hematolojik, nörolojik ve otoimmün reaksiyonlar da bildirilmiştir. Bu reaksiyonlar seyrek pansitopeni, aplastik anemi, santral ve periferik demiyelinizan olay bildirimlerini ve lupus, lupusla ilişkili durum ve Stevens-Johnson sendromu bildirimlerini içermektedir.
İstenmeyen etkiler
Klinik çalışma deneyimleri ve pazarlama sonrası deneyimlerine dayanan advers reaksiyonlar, aşağıda sistem-organ sınıfı ve sıklık derecesine göre gösterilmektedir; çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1000 ila< 1/100), seyrek (≥ 1/10000 ila < 1/1000), çok seyrek (< 1/10000) ve bilinmiyor (sıklığı eldeki verilerden hareketle tahmin edilemiyor). Her sıklık derecesi grubundaki istenmeyen olaylar, olayın şiddet düzeyinde azalma sırasına göre listelenmiştir. Çeşitli endikasyonlar arasında en sık görülme frekansı gösterilmektedir. Bölüm 4.3, Bölüm 4.4 ve Bölüm 4.8'de daha fazla bilgi olması durumunda, Sistem Organ Sınıfı başlıkları yıldız işareti (*) ile belirtilmiştir.
Enfeksiyon ve enfestasyonlar*
Çok yaygın: Solunum yolu enfeksiyonları, (alt ve üst solunum yolu enfeksiyonları, pnömoni, sinüzit, farenjit, nazofarenjit ve herpes virüsüne bağlı pnömoni dahil)
Yaygın: Sistemik enfeksiyonlar (sepsis, kandidiyazis ve influenza dahil) intestinal enfeksiyonlar (viral gastroenterit dahil), deri ve yumuşak doku enfeksiyonları (paronişi, selülit, impetigo, nekrotizan fasiit ve herpes zoster dahil), kulak enfeksiyonları, oral enfeksiyonlar (herpes simpleks, oral herpes ve diş enfeksiyonları dahil), üreme sistemi enfeksiyonları (vulvovajinal mikotik enfeksiyon dahil), üriner sistem enfeksiyonları (piyelonefrit dahil), fungal enfeksiyonlar, eklem enfeksiyonları
Yaygın olmayan: Nörolojikenfeksiyonlar(viralmenenjit dahil), fırsatçı enfeksiyonlar ve
tüberküloz (koksidiyoidomikoz, histoplazmoz ve mikobakteri avum kompleks enfeksiyonu dahil), bakteriyal enfeksiyonlar, göz enfeksiyonları, divertikülit
İyi huylu, kötü huylu ve tanımlanmamış neoplazmalar (kist ve polipler dahil olmak
üzere)*
Yaygın: İyi huylu neoplazma, melanom hariç cilt kanseri (bazal hücre karsinomu
ve skuamöz hücreli karsinom dahil)
Yaygın olmayan: Lenfoma**, solid organ neoplazmalar (meme kanseri, akciğer neoplazması ve tiroid neoplazma dahil), melanom**
Seyrek: Lösemi
Bilinmiyor: Hepatosplenik T-hücreli lenfoma, Merkel hücresi karsinomu (cildin nöroendokrin karsinomu) , Kaposi sarkomu
Kan ve lenf sistemi hastalıkları*
Çok yaygın: Lökopeni (nötropeni ve agranülositoz dahil), anemi
Yaygın: Lökositoz, trombositopeni
Yaygın olmayan: İdiyopatik trombositopenik purpura
Seyrek: Pansitopeni
Bağışıklık sistemi hastalıkları*
Yaygın: Aşırı duyarlılık, alerjiler (mevsimsel alerji dahil) Yaygın olmayan: Sarkoidosis, vaskülit
Seyrek: Anafilaksi
Metabolizma ve beslenme hastalıkları
Çok yaygın: Yükselmiş lipid değerleri.
: Yaygın: Hipokalemi, yükselmiş ürik asit değerleri, anormal kan sodyum
değerleri, hipokalsemi, hiperglisemi, hipofosfatemi, dehidratasyon
Psikiyatrik hastalıklar
Yaygın: Ruh hali değişikliği (depresyon dahil), anksiyete, insomnia
Sinir sistemi hastalıkları*
Çok yaygın: Baş ağrısı
Yaygın: Parestezi (hipoastezi dahil), migren, sinir kökü sıkışması Yaygın olmayan: Serebrovasküler olay (SVO), tremor, nöropati
Seyrek: Multipl skleroz, demiyelinizan hastalıklar (örn. optik nörit, Guillain-
Barré sendromu)
Göz hastalıkları
Yaygın: Görme bozukluğu, konjonktivit, blefarit, gözde şişme Yaygın olmayan: Diplopi
Kulak ve iç kulak hastalıkları
Yaygın: Vertigo
Yaygın olmayan: Sağırlık, kulak çınlaması
Kardiyak hastalıklar*
Yaygın: Taşikardi
Seyrek: Kardiyak arest
Vasküler hastalıklar
Yaygın: Hipertansiyon, ciltte kızarıklık, hematom
Yaygın olmayan: Vasküler arteriyel oklüzyon, tromboflebit, aortik anevrizma
Solunum, göğüs bozuklukları ve mediyastinal hastalıklar*
Yaygın: Astım, dispne, öksürük
Yaygın olmayan: Pulmoner emboli, interstisyel akciğer hastalığı, kronik obstrüktif akciğer hastalığı, pnömonit, plevral efüzyon
Seyrek: Pulmoner fibrosis
Gastrointestinal hastalıklar
Çok yaygın: Abdominal ağrı, bulantı ve kusma
Yaygın: Gİ hemoraji, dispepsi, gastroözofajeal reflü hastalığı, sicca sendromu Yaygın olmayan: Pankreatit, disfaji, yüz ödemi
Seyrek: İntestinal perforasyon
Hepatobiliyer hastalıklar*
Çok yaygın: Karaciğer enzimlerinin artması
Yaygın olmayan: Kolesistit ve kolelitiyazis, hepatik steatoz, yükselmiş bilirubin değerleri
Seyrek: Hepatit, hepatit B enfeksiyonunun tekrarlaması (reaktivasyonu)
otoimmün hepatit
Bilinmiyor: Karaciğer yetmezliği
Deri ve deri altı doku hastalıkları
Çok yaygın: Döküntü (cilt döküntüsü) (eksfoliyatif döküntü dahil)
Yaygın: Psöriyazisin yeni oluşması veya kötüleşmesi (palmoplantar püstüler psöriyazis dahil) , ürtiker, morarma (purpura dahil), dermatit (egzama dahil), onikoklazis, hiperhidrozis, alopesi, pirürit
Yaygın olmayan: Gece terlemesi, skar
Seyrek: Eritema multiforme, Stevens-Johnson sendromu, anjioödem, kütanöz vaskulit, likenoid cilt reaksiyonu
Bilinmiyor: Dermatomiyosit semptomlarının kötüleşmesi
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Çok yaygın: Kas-iskelet ağrısı
Yaygın: Kas spazmları (kan kreatin fosfokinaz değerlerinin yükselmesi
dahil)
Yaygın olmayan: Rabdomiyoliz, sistemik lupus eritematozus Seyrek: Lupus benzeri sendrom
Böbrek ve idrar yolu hastalıkları
Yaygın: Renal yetmezlik, hematüri
Yaygın olmayan: Noktüri
Üreme sistemi ve meme hastalıkları
Yaygın olmayan: Erektil disfonksiyon
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar*
Çok yaygın: Enjeksiyon yerinde reaksiyon (enjeksiyon yeri eritemi dahil)
Yaygın: Göğüs ağrısı, ödem, pireksi (ateş) Yaygın olmayan: İnflamasyon
Araştırmalar*
Yaygın: Koagülasyon ve kanama bozuklukları (uzamış aktive parsiyel tromboplastin zamanı dahil), pozitif oto antikor testi (çift sarmal DNA antikor dahil), yükselmiş kan laktat dehidrojenaz düzeyleri
Bilinmiyor: Kilo artışı
Yaralanma ve zehirlenme
Yaygın: Yara yerinde iyileşmede gecikme
*Daha fazla bilgi, Bölüm 4.3, 4.4 ve 4.8'de bulunmaktadır.
**Açık etiketli uzatma çalışmalarını içermektedir.
Hidradenitis suppurativa
Haftada bir kez HUMIRA uygulanarak tedavi edilen HS hastaları için güvenlilik profili, HUMIRA'nın bilinen güvenlilik profiliyle tutarlılık göstermiştir.
Üveit
HUMIRA ile iki haftada bir tedavi uygulanan üveit hastalarındaki güvenlilik profili HUMIRA'nın bilinen güvenlilik profiliyle tutarlılık göstermiştir.
Seçilen advers reaksiyonların tanımı:
Enjeksiyon yeri reaksiyonları
Erişkin ve çocuklarda yürütülen pivotal kontrollü klinik çalışmalarda HUMIRA ile tedavi edilen hastaların %12,9'unda enjeksiyon yeri reaksiyonları (eritem ve/veya kaşıntı, hemoraji, ağrı ya da şişme) görülmesine karşın plasebo ya da aktif kontrol alanların %7,2'sinde de bu reaksiyonlar görülmüştür. Enjeksiyon yeri reaksiyonları genellikle ilacın kesilmesini gerektirmemiştir.
Enfeksiyonlar
HUMIRA ile tedavi edilen hastalarda hasta yılı başına 1,51, plasebo ve aktif kontrol ajanı ile tedavi edilen hastalarda hasta yılı başına 1,46 olmuştur. Enfeksiyonlar primer olarak nazofarenjit, üst solunum yolu enfeksiyonu ve sinüzit olmuştur. Hastaların çoğu enfeksiyon iyileştikten sonra HUMIRA tedavisine devam etmiştir.
Ciddi enfeksiyonların insidansı, HUMIRA ile tedavi edilen hastalarda hasta yılı başına 0,04, plasebo ve aktif kontrol ajanı ile tedavi edilen hastalarda hasta yılı başına 0,03 olmuştur.
HUMIRA ile gerçekleştirilen kontrollü, açık etiketli erişkin ve pediyatrik çalışmalarda bildirilen ciddi enfeksiyonlar (nadiren ortaya çıkan fatal enfeksiyonlar dahil) arasında tüberküloz (miliyer ve ekstrapulmoner yerleşimler dahil) ve invazif fırsatçı enfeksiyonlar (örn. dissemine veya ekstrapulmoner histoplazmozis, blastomikoz, koksidioidomikoz, pnömosistis, kandidiyazis, aspergillozis ve listeriyozis) bulunmaktadır. Tüberküloz olgularının çoğu tedavi başlatıldıktan sonraki ilk sekiz ay içerisinde görülmüştür ve latent hastalığın yeniden ortaya çıkışını yansıtıyor olabilir.
Maligniteler ve lenfoproliferatif bozukluklar
Jüvenil idiyopatik artrit (poliartiküler jüvenil idiyopatik artrit ve entezit ile ilişkili artrit) hastalarındaki bir HUMIRA çalışması sırasında 655,6 hasta yılı maruziyeti olan 249 pediyatrik hastada malignite gözlemlenmemiştir. Buna ilave olarak, Crohn hastalığı olan pediyatrik hastalarda HUMIRA çalışmaları sırasında 498,1 hasta yılı maruziyeti olan 192 pediyatrik hastada malignite gözlemlenmemiştir. Kronik plak psöriyazisi olan pediyatrik hastalardaki bir HUMIRA çalışmasında 80 hasta yılına maruz kalan 77 pediyatrik plak psöriyazis hastasında malignite gözlemlenmemiştir. Ülseratif kolitli pediyatrik hastalarda gerçekleştirilen bir HUMIRA çalışmasında, 65,3 hasta yılı maruziyeti olan 93 pediyatrik hastada malignite gözlemlenmemiştir. Pediyatrik üveit hastalarındaki bir HUMIRA çalışmasında 58,4 hasta yılı maruziyeti olan 60 pediyatrik hastada da malignite görülmemiştir.
Orta ila şiddetli derecede aktif romatoid artrit, psöriyatik artrit, ankilozan spondilit, radyografik olarak ankilozan spondilit kanıtı olmayan aksiyal spondiloartrit, Crohn hastalığı, ülseratif kolit, psöriyazis, hidradenitis suppurativa ve üveiti olan erişkin hastalarda yürütülen en az 12 haftalık pivotal HUMIRA çalışmalarının kontrollü dönemleri sırasında lenfoma ve melanoma-dışı cilt kanseri dışındaki maligniteler, HUMIRA tedavisindeki 5291 hastada 1000 hasta yılı başına 6,8 (4,4, 10,5) oranında (%95 GA) iken; buna karşın 3444 kontrol hastasında 1000 hasta yılı başına
6,3 (3,4, 11,8) oranında gözlemlenmiştir (medyan tedavi süresi HUMIRA için 4 ay, kontrol tedavisi hastaları için ise 3,8 ay idi). Melanoma-dışı cilt kanserlerinin oranı (%95 GA), HUMIRA tedavisindeki hastalarda 1000 hasta yılı başına 8,8 (6, 13), kontrol hastalarında ise 1000 hasta yılı başına 3,2 (1,3, 7,6) olmuştur. Bu cilt kanserleri arasında skuamöz hücreli karsinomlar, HUMIRA tedavisindeki hastalarda 1000 hasta yılı başına 2,7 (1,4, 5,4), kontrol
hastalarında 1000 hasta yılı başına 0,6 (0,1, 4,5) oranında ortaya çıkmıştır. Lenfomaların oranı
(%95 GA), HUMIRA tedavisindeki hastalarda 1000 hasta yılı başına 0,7 (0,2, 2,7), kontrol
hastalarında da 1000 hasta yılı başına 0,6 (0,1, 4,5) olmuştur.
arasındaki pazarlama sonrası deneyimlere göre ağırlıklı olarak romatoid artrit hastalarında bildirilen malignite oranı, 1000 hasta yılı başına ortalama 2,7'dir. Bildirilen melanoma-dışı cilt kanserleri ve lenfomaların oranı, sırasıyla 1000 hasta tedavi yılı başına yaklaşık olarak 0,2 ve 0,3'tür (bkz. Bölüm 4.4).
Adalimumab ile tedavi edilen hastalarda, pazarlama sonrası dönemde nadir olarak hepatosplenik T hücreli lenfoma vakaları bildirilmiştir (bkz. Bölüm 4.4).
Otoantikorlar
RA I-V çalışmalarında değişik zaman noktalarında hastaların serum örneklerinde otoantikor testleri yapılmıştır. Bu çalışmalarda HUMIRA ile tedavi edilen hastaların %11,9'unda, plasebo ve aktif kontrol ajanıyla tedavi edilen hastaların %8,1'inde başlangıç döneminde negatif olan anti-nükleer antikorların 24. haftada pozitif titrelerde olduğu bildirilmiştir. Bütün romatoid artrit ve psöriyatik artrit çalışmalarında HUMIRA ile tedavi edilen 3441 hastadan 2'sinde yeni başlayan lupusa benzer sendromu düşündüren klinik belirtiler gözlemlenmiştir. Tedavinin kesilmesinden sonra hastalarda düzelme olmuştur. Hiçbir hastada lupus nefriti veya santral sinir sistemi semptomları gelişmemiştir.
Hepatobiliyer olaylar
HUMIRA ile romatoid artrit ve psöriyatik artrit hastalarında yürütülen 4 ila 104 hafta aralığında kontrol periyodu olan Faz 3 kontrollü klinik çalışmalarda, HUMIRA ile tedavi gören hastaların
%3,7'sinde ALT yükselmeleri ≥ 3 x NÜS (normalin üst sınırı) iken, kontrol grubunda bu oran %1,6'dır.
HUMIRA'nın kontrollü Faz 3 çalışmalarında 4 ila 17 yaş arasındaki poliartiküler jüvenil idiopatik artriti olan hastalarda ve 6 ila 17 yaş arasındaki entezit ile ilişkili artriti olan hastalarda,
≥ 3 x NÜS ALT yükselmeleri HUMIRA ile tedavi edilen hastalarda %6,1 ve kontrol tedavisi alan hastalarda %1,3'tür. ALT yükselmelerinin çoğu eş zamanlı metotreksat kullanımında görülmüştür. 2 ila 4 yaş arasındaki poliartiküler jüvenil idiyopatik artriti olan hastalardaki HUMIRA Faz 3 çalışmasında ≥ 3 x NÜS olan herhangi bir ALT yükselmesi gerçekleşmemiştir.
HUMIRA ile Crohn hastalarında ve ülseratif kolit hastalarında yürütülen 4 ila 52 hafta aralığında kontrol periyodu olan Faz 3 kontrollü klinik çalışmalarda, HUMIRA ile tedavi edilen hastaların %0,9'unda ALT yükselmeleri ≥3 x NÜS olmakla birlikte, kontrol grubunda da bu oran %0,9'dur.
Pediyatrik Crohn hastalığı olan hastalarda yürütülen, tedavinin 52. haftasına dek vücut ağırlığına göre ayarlanan indüksiyon tedavisinin ardından vücut ağırlığına göre ayarlanan iki idame doz rejimlerinin etkililik ve güvenliliğinin araştırıldığı bir HUMIRA Faz 3 çalışmasında başlangıçta eş zamanlı olarak immünosupresan alan 4 hastanın da içinde yer aldığı hastaların
%2,6'sında (5/192) ALT yükselmeleri ≥ 3 x NÜS olarak görülmüştür.
HUMIRA ile plak psöriyazis hastalarında yürütülen 12 ila 24 hafta aralığında kontrol periyot süresi olan Faz 3 kontrollü klinik çalışmalarda, HUMIRA ile tedavi edilen hastaların %1,8'inde ALT yükselmeleri ≥ 3 x NÜS olmakla birlikte, kontrol tedavisi grubunda da bu oran %1,8'dir.
Plak psöriyazisli pediyatrik hastalar ile yapılan HUMIRA Faz 3 çalışmasında ≥3 x NÜS ALT artışı olmamıştır.
HUMIRA ile yapılan kontrollü çalışmalarda (0. haftadaki 160 mg ve 2. haftadaki 80 mg'lık başlangıç dozlarını takiben 4. haftadan itibaren haftada bir kez 40 mg), kontrol dönemi süresi 12-16 hafta arasında değişen hidradenitis suppurativa hastalarında, ≥ 3 x NÜS şeklindeki ALT artışları HUMIRA ile tedavi edilen hastaların %0,3'ünde ve kontrol grubundaki hastaların
%0,6'sında ortaya çıkmıştır.
Erişkin üveit hastaları üzerinde 80 haftaya varan süreyle gerçekleştirilen, HUMIRA tedavisi ve kontrol tedavisinin sırasıyla 166,5 gün ve 105 günlük medyan (ortanca) maruziyet olan kontrollü HUMIRA çalışmalarında (başlangıç dozu 0. haftada 80 mg dozunu takiben 1. haftadan başlanarak iki haftada bir 40 mg), HUMIRA tedavisi uygulanan hastaların %2,4'ünde ve kontrol tedavisi uygulanan hastaların %2,4'ünde ≥ 3 x NÜS düzeyinde ALT yükselmeleri ortaya çıkmıştır.
Pediyatrik ülseratif kolitli hastalarda (N=93) yürütülen; vücut ağırlığına göre ayarlanan indüksiyon dozları ile 0. haftada ve 1. haftada 2,4 mg/kg (maksimum 160 mg) ve 2. haftada 1,2 mg/kg (maksimum 80 mg) dozunun ardından (N=63) veya 0. haftada 2,4 mg/kg (maksimum 160 mg) indüksiyon dozu, 1. haftada plasebo ve 2. haftada 1,2 mg/kg (maksimum 80 mg) dozunun ardından (N=30) iki haftada bir 0,6 mg/kg (maksimum 40 mg) idame dozunun (N=31) ve haftalık 0,6 mg/kg (maksimum 40 mg) idame dozunun (N=32) etkililiğinin ve güvenliliğinin değerlendirildiği kontrollü Faz 3 HUMIRA çalışmasında, hastaların %1,1'inde (1/93) ≥ 3 X NÜS düzeyinde ALT yükselmeleri ortaya çıkmıştır.
Tüm endikasyonlar için yapılan klinik çalışmalara dahil olan hastalarda ALT değerlerindeki yükselme asemptomatik olup, vakaların çoğunda geçici olmuştur ve tedavinin devamı esnasında bu durum ortadan kalkmıştır. Bununla beraber, pazarlama sonrası raporları, adalimumab alan hastalarda otoimmün hepatiti de kapsayan hepatit gibi karaciğer yetmezliğinin öncesinde seyredebilen ciddi karaciğer bozuklukları daha az olmakla beraber karaciğer yetmezliği bildirilmiştir.
Azatiyoprin / 6-merkaptopurin ile eşzamanlı tedavi
Erişkin Crohn hastalarında yapılan çalışmalarda, HUMIRA'nın tek başına kullanımı ile kıyaslandığında, HUMIRA ve azatiyoprin/6-merkaptopurin kombinasyonunda daha yüksek malignite olasılığı ve ciddi enfeksiyona bağlı yan etkiler görülmüştür.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon
Genel olarak, pediyatrik hastalardaki advers reaksiyonlar sıklık ve tip olarak erişkin hastalarda görülenlere benzerlik göstermiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr ; tel 0 800314 0008;faks:03 122183599).
4.9. Doz aşımı ve tedavisi
Klinik çalışmalar sırasında doz kısıtlayıcı toksisite gözlemlenmemiştir. Değerlendirilen en yüksek doz düzeyi 10 mg/kg'lık multipl intravenöz dozlar olup önerilen dozun yaklaşık 15 katıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünosüpresanlar, Tümör Nekröz Faktörü alfa (TNF-alfa)
inhibitörleri
ATC kodu: L04AB04
Etki mekanizması
Adalimumab, TNF'ye spesifik olarak bağlanır ve TNF'nin p55 ve p75 hücre yüzey reseptörleriyle etkileşimini bloke ederek bu faktörün biyolojik fonksiyonunu nötralize eder.
Adalimumab, lökosit migrasyonundan sorumlu adezyon moleküllerinin düzeylerinin değişmesi de dahil TNF tarafından indüklenen veya düzenlenen biyolojik yanıtları da modüle eder (ELAM-1, VCAM-1 ve ICAM-1 için IC50 değeri 0,1-0,2 nM).
Farmakodinamik etkiler
Romatoid artrit hastalarında HUMIRA tedavisinden sonra inflamasyonun akut faz reaktanlarında (C-reaktif protein (CRP) ve eritrosit sedimentasyon hızı (ESR)) ve serum sitokinlerinin (IL-6) düzeylerinde bazal değerlere göre hızlı bir azalma gözlenmiştir. Kıkırdak hasarından sorumlu olan ve dokunun yeniden yapılanması sürecine yol açan matriks metalloproteinazların (MMP-1 ve MMP-3) düzeyleri de HUMIRA uygulamasından sonra düşmüştür. HUMIRA ile tedavi edilen hastalarda kronik inflamasyonun hematolojik bulgularında çoğunlukla düzelme meydana gelmiştir.
Poliartiküler jüvenil idiyopatik artrit, Crohn hastalığı, ülseratif kolit ve hidradenitis suppurativa hastalarında, HUMIRA tedavisinden sonra CRP düzeylerinde de hızlı bir düşüş gözlemlenmiştir. Crohn hastalarında, TNF alfa ekspresyonundaki anlamlı azalma da dahil olmak üzere, kolondaki inflamasyon göstergelerini eksprese eden hücre sayısında düşüş olduğu gözlemlenmiştir. İntestinal mukozada yapılan endoskopik çalışmalarda, adalimumab ile tedavi edilen hastalarda mukoza iyileşmesine ilişkin kanıtlar olduğu gösterilmiştir.
Klinik etkililik ve güvenlilik Romatoid artrit (RA)
HUMIRA, bütün romatoid artrit klinik çalışmalarında 3000'i aşkın hasta üzerinde değerlendirilmiştir. HUMIRA'nın etkililiği ve güvenliliği beş adet randomize, çift-kör ve iyi- kontrollü çalışmada belirlenmiştir. Bazı hastalar 120 ay ve üstü sürelerle tedavi edilmiştir.
HUMIRA 40 mg/0,4 mL'nin enjeksiyon bölgesi ağrısı, iki randomize, aktif kontrollü, tek-kör,
iki periyod çapraz karşılaştırma çalışmalarıyla değerlendirilmiştir.
RA I çalışmasında en az bir tane hastalık modifiye edici anti-romatizmal ilaç tedavisiyle başarısız kalınan ve haftada 12,5-25 mg (metotreksat intoleransı durumunda 10 mg) metotreksat tedavisiyle yeterli etki görülmeyen ve metotreksat dozu haftada 10-25 mg arasında sabit seyreden, 18 yaş ve üstü 271 orta ila şiddetli derecede aktif romatoid artrit hastası değerlendirilmiştir. Hastalara 24 hafta süreyle 2 haftada bir 20, 40 veya 80 mg HUMIRA veya plasebo dozları verilmiştir.
RA II çalışmasında en az bir adet hastalık modifiye edici anti-romatizmal ilaç tedavisiyle başarısız kalınan, 18 yaş ve üstü 544 orta ila şiddetli aktif romatoid artrit hastası değerlendirilmiştir. 26 hafta süreyle, 20 veya 40 mg dozunda HUMIRA subkütan enjeksiyon yoluyla (alternatif haftalarda plasebo verilmek üzere) iki haftada bir, ya da her hafta uygulanmış ve aynı süreyle her hafta plasebo verilmiştir. Başka hiçbir hastalık modifiye edici ilacın kullanılmasına izin verilmemiştir.
RA III çalışmasında haftada 12,5-25 mg metotreksat tedavisiyle yeterli etki görülmeyen veya 10 mg/hafta metotreksata intoleransı olan 18 yaş ve üstü 619 orta ila şiddetli derecede aktif romatoid artrit hastası değerlendirilmiştir. Bu çalışmada üç grup vardır. İlk gruba 52 hafta süreyle her hafta plasebo enjeksiyonu uygulanmıştır. İkinci gruba 52 hafta süreyle her hafta 20 mg HUMIRA verilmiştir. Üçüncü gruba dönüşümlü olarak alternatif haftalarda plasebo enjeksiyonları yapılmak üzere iki haftada bir 40 mg HUMIRA uygulanmıştır. İlk 52 hafta tamamlandıktan sonra, 457 hasta 10 yıla varan süreyle iki haftada bir 40 mg HUMIRA/MTX uygulanan açık etiketli bir uzatma fazına kaydedilmiştir.
RA IV çalışmasında, 18 yaş ve üstü 636 orta ila şiddetli derecede aktif romatoid artrit hastasında primer olarak güvenlilik değerlendirilmiştir. Hastaların ya hiç hastalık modifiye edici anti- romatizmal ilaç kullanmamış olmalarına ya da tedavinin en az 28 gün stabil olması şartıyla, mevcut romatolojik tedavilerini sürdürmelerine izin verilmiştir. Bu tedavi rejimleri metotreksat, leflunomid, hidroksiklorokin, sulfasalazin ve/veya altın tuzlarını içermektedir. Hastalar 24 hafta süreyle iki haftada bir 40 mg HUMIRA veya plasebo alacak şekilde randomize edilmiştir.
RA V çalışmasında, daha önce hiç metotreksat kullanmamış, erken dönemli (ortalama hastalık süresi 9 aydan daha az), orta ila şiddetli derecede aktif romatoid artriti olan 799 erişkin hasta değerlendirilmiştir. Bu çalışmada 104 hafta süreyle iki haftada bir 40 mg HUMIRA ve metotreksat kombinasyon tedavisi ile iki haftada bir 40 mg HUMIRA monoterapisi ve metotreksat monoterapisinin, romatoid artrit bulgu ve semptomları ile eklem hasarındaki progresyon hızını azaltmadaki etkililiği incelenmiştir. İlk 104 haftanın tamamlanmasından sonra, 497 hasta 10 sene boyunca iki haftada bir 40 mg HUMIRA'nın uygulandığı açık etiketli faz çalışmasına dahil edilmiştir.
RA VI ve VII çalışmalarında, 18 yaş ve üstü, 60 orta ila şiddetli derecede aktif romatoid artrit hastası değerlendirilmiştir. Çalışmaya dahil edilen hastalar, HUMIRA 40 mg/0,8mL kullanan ve ortalama enjeksiyon bölgesi ağrısı en az 3 cm (0-10 cm VAS (görsel analog skor)) olan veya HUMIRA 40 mg/0,8 mL yeni kullanmaya başlayan biyolojik naif hastalardır. Hastalar, takip eden dozlarında karşı tedaviyi alacak şekilde tek doz HUMIRA 40 mg/0,8 mL veya HUMIRA 40 mg/0,4 mL'ye randomize edilmiştir.
noktası 24. veya 26. haftalarda ACR 20 (ACR: American College of Rheumatology) yanıtına ulaşan hastaların yüzdesidir. RA V çalışmasında primer sonlanım noktası, 52. haftada ACR 50 yanıtı elde edilen hastaların yüzdesidir. RA III ve V çalışmalarında 52. haftada hastalık progresyonunun (röntgen sonuçlarıyla saptanan) gerilemesi, ilave primer sonlanım noktası olmuştur. RA III çalışmasında aynı zamanda yaşam kalitesindeki değişimlerde primer sonlanım noktası olmuştur. RA VI ve VII çalışmasındaki primer sonlanım noktası, 0-10 cm VAS ile ölçülen enjeksiyon akabinde ortaya çıkan enjeksiyon bölgesi ağrısı olmuştur.
ACR yanıtı
HUMIRA ile tedavi edilen ve ACR 20, 50 ve 70 yanıtlarına ulaşan hastaların yüzdesi RA I, II ve III çalışmaları arasında tutarlı olmuştur. İki haftada bir 40 mg dozu ile alınan sonuçlar Tablo 7'de özetlenmektedir.
Tablo 7. Plasebo Kontrollü Çalışmalarda ACR Yanıtları (Hastaların Yüzdesi)
Yanıt | RA I Çalışması* | RA II Çalışması* | RA III Çalışması* | |||
Plasebo/ MTX n=60 | HUMIRA/ MTX n=63 | Plasebo n=110 | HUMIRA n=113 | Plasebo/ MTX n=200 | HUMIRA/ MTX n=207 | |
ACR 20 |
|
|
|
|
|
|
6. ay | %13,3 | %65,1 | %19,1 | %46 | %29,5 | %63,3 |
12. ay | GD | GD | GD | GD | %24 | %58,9 |
ACR 50 |
|
|
|
|
|
|
6. ay | %6,7 | %52,4 | %8,2 | %22,1 | %9,5 | %39,1 |
12. ay | GD | GD | GD | GD | %9,5 | %41,5 |
ACR 70 |
|
|
|
|
|
|
6. ay | %3,3 | %23,8 | %1,8 | %12,4 | %2,5 | %20,8 |
12. ay | GD | GD | GD | GD | %4,5 | %23,2 |
*p < 0,01, plaseboya karşı HUMIRA GD= Geçerli değil
RA I-IV çalışmalarında ACR yanıtı kriterlerinin bütün bireysel bileşenleri (duyarlı ve şiş eklemlerin sayısı, doktor ve hasta tarafından yapılan hastalık aktivitesi ve ağrı değerlendirmeleri, iş göremezlik indeksi (HAQ) skorları ve CRP (mg/dL) değerleri), 24. veya
26. haftalarda plaseboya göre düzelme göstermiştir. RA III çalışmasında bu düzelmeler 52 hafta boyunca sürdürülmüştür.
RA III çalışmasının açık etiketli uzatma fazında 10 yıla kadar izlenen hastaların çoğunluğunda ACR yanıt oranları devam etmiştir. İki haftada bir 40 mg HUMIRA dozuna randomize edilmiş olan 207 hastadan 114'ü, 5 yıl boyunca iki haftada bir 40 mg HUMIRA almaya devam etmiştir. Bu hastalar arasında 86 hastada (%75,4) ACR 20 yanıtları, 72 hastada (%63,2) ACR 50 yanıtları ve 41 hastada (%36) ACR 70 yanıtları elde edilmiştir. 207 hastadan 81'i iki haftada bir 40 mg HUMIRA tedavisine 10 sene boyunca devam etmişlerdir. Bunlar arasında, 64 hastada (%79) ACR 20 yanıtları, 56 hastada (%69,1) ACR 50 yanıtları ve 43 hastada (%53,1), ACR 70 yanıtları elde edilmiştir.
RA IV çalışmasında HUMIRA artı standart tedavi gören hastaların ACR 20 yanıtı, plasebo artı
standart tedavi ile tedavi edilen hastalardaki yanıta göre istatistiksel anlamlılık taşıyacak şekilde daha iyi olmuştur (p < 0,001).
RA I-IV çalışmalarında, HUMIRA ile tedavi gören hastalarda tedaviye başlandıktan sonra bir- iki hafta gibi erken bir sürede, plasebo alan hastalar ile karşılaştırıldığında istatistiksel olarak anlamlı ACR 20 ve 50 yanıtlarına ulaşılmıştır.
Erken dönemdeki ve daha önce metotreksat kullanmamış romatoid artrit hastalarının yer aldığı RA V çalışmasında, HUMIRA ve metotreksat ile yapılan kombinasyon tedavisi 52. haftada, metotreksat monoterapisi ve HUMIRA monoterapisinden daha hızlı ve anlamlı olarak daha yüksek ACR yanıtları sağlamış ve bu yanıtlar 104. haftaya kadar sürdürülebilmiştir (bkz. Tablo 8).
Tablo 8. RA V Çalışmasındaki ACR Yanıtları (Hastaların Yüzdesi)
Yanıt | MTX n=257 | HUMIRA n=274 | HUMIRA/MTX n=268 | p değeri | p değeri | p değeri |
ACR 20 |
|
|
|
|
|
|
52. hafta | %62,6 | %54,4 | %72,8 | 0,013 | < 0,001 | 0,043 |
104. hafta | %56 | %49,3 | %69,4 | 0,002 | < 0,001 | 0,14 |
ACR 50 |
|
|
|
|
|
|
52. hafta | %45,9 | %41,2 | %61,6 | < 0,001 | < 0,001 | 0,317 |
104. hafta | %42,8 | %36,9 | %59 | < 0,001 | < 0,001 | 0,162 |
ACR 70 |
|
|
|
|
|
|
52. hafta | %27,2 | %25,9 | %45,5 | < 0,001 | < 0,001 | 0,656 |
104. hafta | %28,4 | %28,1 | %46,6 | < 0,001 | < 0,001 | 0,864 |
RA V çalışması için yapılan açık etiketli uzatma çalışmasında, 10 yıla varan bir süre boyunca takip edildiğinde ACR yanıt oranları korunmuştur. İki haftada bir HUMIRA 40 mg grubuna randomize edilmiş olan 542 hastanın 170'i, iki haftada bir HUMIRA 40 mg tedavisine 10 yıl boyunca devam etmiştir. Bunlar arasında yer alan 154 hastada (%90,6) ACR 20, 127 hastada (%74,7) ACR 50 ve 102 hastada (%60) ACR 70 yanıtları elde edilmiştir.
52. haftada HUMIRA/metotreksat kombinasyon tedavisi gören hastaların %42,9'unda klinik remisyon (DAS28 (CRP) < 2,6) sağlanırken, bu oran metotreksat monoterapisi alan hastalarda
%20,6 ve HUMIRA monoterapisi alan hastalarda %23,4 olmuştur. HUMIRA/metotreksat kombinasyon tedavisi, yakın dönemde tanı konulmuş orta ila şiddetli romatoid artriti olan hastalarda “düşük düzey hastalık hali†sağlanmasında metotreksat ve HUMIRA monoterapilerinden klinik ve istatistik olarak daha üstündür (sırasıyla p < 0,001 ve p < 0,001). İki monoterapi kolundaki yanıtlar benzerdir (p = 0,447). Açık etiketli uzatma çalışmasına katılan ve ilk olarak HUMIRA monoterapisi ya da HUMIRA/metotreksat kombinasyon tedavisi grubuna randomize edilmiş olan 342 hastanın 171'i 10 yıllık HUMIRA tedavisini tamamlamıştır. Bunlar arasında yer alan 109 hastanın (%63,7) 10 yıl sonunda remisyonda olduğu bildirilmiştir.
Radyografik yanıt
HUMIRA ile tedavi edilen hastalardaki ortalama romatoid artrit süresinin yaklaşık 11 yıl olduğu RA III çalışmasında, yapısal eklem hasarı radyografik olarak değerlendirilmiş ve modifiye Total Sharp Skoru (mTSS) ve bileşenlerinde, erozyon skorunda ve eklem aralığı daralma skorunda değişim şeklinde ifade edilmiştir. HUMIRA/metotreksat hastaları 6 ve 12. aylarda, tek başına metotreksat alan hastalara kıyasla anlamlı olarak daha az radyografik progresyon göstermişlerdir (bkz. Tablo 9).
RA III çalışmasının açık etiketli uzatma fazında, bir grup hastada, yapısal harabiyetin progresyon hızındaki azalma 8 ve 10 yıl süreyle devam etmiştir. Başlangıçta iki haftada bir 40 mg HUMIRA ile tedavi edilen 207 hastadan 81'i 8. yılda radyografik olarak değerlendirilmiştir. Bu hastaların 48'inde, 0,5 veya daha az mTSS değişimi olarak tanımlanan, yapısal hasarda ilerleme olmaması durumu tespit edilmiştir. Başlangıçta iki haftada bir 40 mg HUMIRA ile tedavi edilen 207 hastadan 79'u 10. yılda radyografik olarak değerlendirilmiştir. Bu hastaların 40'ında, 0,5 veya daha az mTSS değişimi olarak tanımlanan, yapısal hasarda ilerleme olmaması durumu tespit edilmiştir.
Tablo 9. RA III Çalışmasında 12 Ay Boyunca Radyografik Ortalama Değişimler
| Plasebo/ MTX | HUMIRA/MTX iki haftada bir 40 mg | Plasebo/MTX- HUMIRA/MTX (%95 GA) | p değeri |
Total Sharp Skoru | 2,7 | 0,1 | 2,6 (1,4, 3,8) | < 0,001 |
Erozyon skoru | 1,6 | 0 | 1,6 (0,9, 2,2) | < 0,001 |
EAD skoru | 1 | 0,1 | 0,9 (0,3, 1,4) | 0,002 |
RA V çalışmasında, yapısal eklem hasarı radyografik olarak değerlendirilmiş olup modifiye Total Sharp Skorunda değişim şeklinde ifade edilmiştir (Tablo 10'a bakınız).
Tablo 10. RA V Çalışmasında 52. haftada Radyografik Ortalama Değişimler
| MTX n=257 (%95 GA) | HUMIRA n=274 (%95 GA) | HUMIRA/ MTX n=268 (%95 GA) |
p değeri |
p değeri |
p değeri |
Total Sharp skoru | 5,7 (4,2-7,3) | 3 (1,7-4,3) | 1,3 (0,5-2,1) | < 0,001 | 0,002 | < 0,001 |
Erozyon skoru | 3,7 (2,7-4,7) | 1,7 (1-2,4) | 0,8 (0,4-1,2) | < 0,001 | 0,0082 | < 0,001 |
EAD skoru | 2 (1,2-2,8) | 1,3 (0,5-2,1) | 0,5 (0-1) | < 0,001 | 0,0037 | 0,151 |
p değeri, HUMIRA monoterapisiveHUMIRA/metotreksat kombinasyon tedavisi arasında
GA: Güven Aralığı
52 haftalık ve 104 haftalık tedavilerden sonra progresyon göstermeyen (modifiye Total Sharp skorunda başlangıç dönemine göre değişim ï‚£0,5) hastaların yüzdesi, HUMIRA/metotreksat kombinasyon tedavisi ile (sırasıyla %63,8 ve %61,2), metotreksat monoterapisi (sırasıyla
%37,4 ve %33,5, p < 0,001) ve HUMIRA monoterapisine (sırasıyla %50,7, p < 0,002 ve %44,5, p < 0,001) kıyasla anlamlı derecede daha yüksektir.
RA V çalışması için yapılan açık etiketli uzatma çalışmasında, başlangıçta metotreksat monoterapisi, HUMIRA monoterapisi ve HUMIRA/metotreksat kombinasyon tedavisi gruplarına randomize edilen hastaların, 10. yılda modifiye Total Sharp Skoru'nda başlangıca göre elde edilen ortalama değişiklik sırasıyla 10,8, 9,2 ve 3,9 olarak belirlenmiştir. Radyografik progresyon saptanmayan hastaların oranları ise sırasıyla %31,3, %23,7 ve %36,7 olmuştur.
Yaşam kalitesi ve fiziksel fonksiyon
Orijinal uygunlukta ve iyi-kontrollü gerçekleştirilen dört çalışmada, Sağlık Değerlendirme Anketi'nin (HAQ) iş göremezlik indeksi kullanılarak sağlığa ilişkin yaşam kalitesi ve fiziksel fonksiyon değerlendirilmiştir; bu değerlendirmeler RA III çalışmasının 52. haftası için önceden tanımlanmış bir primer sonlanım noktasıdır. Dört çalışmanın tamamında, HUMIRA'nın bütün dozları/doz şemaları plasebo ile karşılaştırıldığında 6. ayda HAQ anketinin iş göremezlik indeksinde başlangıç dönemine göre istatistiksel olarak anlamlı bir iyileşme olduğu görülmüş ve aynı durum RA III çalışmasında 52. haftada da gözlemlenmiştir. Bu dört çalışmanın hepsinde Kısa Sağlık Çalışma Formu (SF 36) sonuçları HUMIRA'nın bütün dozları/doz şemaları için bu bulguları desteklemektedir (fiziksel bileşen özeti (PCS) skorları istatistiksel anlamlılık taşıyacak şekilde); aynı zamanda ağrı ve vitalite skorları ise, iki haftada bir 40 mg dozu için istatistiksel olarak anlamlıdır. Kronik hastalık tedavisi fonksiyonel değerlendirme (FACIT) skorlarının değerlendirildiği üç çalışmanın hepsinde de (RA I, III, IV çalışmaları), bu skorlar ile ölçülen yorgunlukta istatistiksel olarak anlamlı bir azalma vardır.
RA III çalışmasında fiziksel fonksiyonda iyileşme elde eden ve tedaviye devam eden hastaların çoğunda iyileşme, açık etiketli tedavinin 520. haftası boyunca (120 ay) da korunmuştur. Yaşam kalitesindeki iyileşmeler 156. haftaya (36 ay) kadar ölçülmüş ve iyileşmelerin bu dönem boyunca korunduğu görülmüştür.
RA V çalışmasında HAQ iş göremezlik indeksi ve SF 36'nın fiziksel bileşenindeki iyileşmeler, HUMIRA/metotreksat kombinasyon tedavisi ile, metotreksat monoterapisi ve HUMIRA monoterapisine kıyasla 52. haftada daha yüksektir ve bu yükseklik 104. haftada da devam etmektedir (p < 0,001). Açık etiketli uzatma çalışmasını tamamlayan 250 hastada 10 yıllık tedavi boyunca fiziksel fonksiyonlardaki iyileşme sürdürülmüştür.
Enjeksiyon yerinde ağrı
Birleştirilen çapraz geçişli RA VI ve VII çalışmaları için, HUMIRA 40 mg/0,8 mL ve HUMIRA 40 mg/0,4 mL arasında dozajdan hemen sonra enjeksiyon yeri ağrısı için istatistiksel olarak anlamlı bir fark gözlemlenmiştir (ortalama VAS 3,7 cm'ye karşın 1,2 cm, 0-10 cm ölçeği, p < 0,001). Bu, enjeksiyon bölgesinde ağrıdaki% 84'lük medyan bir azalmayı temsil eder.
Aksiyal spondiloartrit Ankilozan spondilit (AS)
İki haftada bir HUMIRA 40 mg; 24 hafta süreli, randomize çift-kör, plasebo kontrollü iki çalışmada, konvansiyonel tedaviye yeterli yanıt vermeyen aktif ankilozan spondilitli (tüm gruplarda ortalama bazal hastalık aktivitesi skoru [Bath Ankilozan Spondilit Hastalık Aktivitesi İndeksi (BASDAI)] 6,3 idi) 393 hasta üzerinde değerlendirildi. 79 hasta (%20,1) eş zamanlı olarak hastalık modifiye edici ilaçlar ile 37 hasta (%9,4) ise yine eş zamanlı olarak glukokortikoidler ile tedavi edilmiştir. Kör dönemini; hastalara iki haftada bir HUMIRA 40 mg uygulanan, 28 haftaya kadar süren, ilave bir açık etiketli dönem izlemiştir. 12, 16 veya 20. haftalarda ASAS 20 yanıtı elde edilemeyen hastalara (n=215, %54,7), açık etikete erken kaçış prensibiyle iki haftada bir subkütan adalimumab 40 mg uygulanmıştır ve bu hastalar daha sonra, çift-kör istatistik analizlerde yanıt vermeyenler olarak kabul edilmiştir.
315 hastalı daha büyük AS I çalışmasının sonuçları, HUMIRA ile tedavi edilen hastaların, ankilozan spondilit bulgu ve semptomlarında plaseboya kıyasla istatistiksel olarak anlamlı derecede daha fazla iyileşme sağladıklarını göstermiştir. Anlamlı yanıt ilk kez 2. haftada gözlemlenmiş ve 24. haftaya kadar sürdürülmüştür (Tablo 11).
Tablo 11. Plasebo Kontrollü AS I Çalışması Etkililik Yanıtları ̶ Bulgu ve Semptomlarda Azalma
Yanıt | Plasebo N=107 | HUMIRA N=208 |
ASAS 20 |
|
|
2. hafta | %16 | %42*** |
12. hafta | %21 | %58*** |
24. hafta | %19 | %51*** |
ASAS 50 |
|
|
2. hafta | %3 | %16*** |
12.hafta | %10 | %38*** |
24. hafta | %11 | %35*** |
ASAS 70 |
|
|
2. hafta | %0 | %7** |
12. hafta | %5 | %23*** |
24. hafta | %8 | %24*** |
|
|
|
BASDAI 50 |
|
|
2. hafta | %4 | %20*** |
12. hafta | %16 | %45*** |
24 hafta | %15 | %42*** |
***, ** p < 0,001 ve p < 0,01 düzeyinde istatistiksel olarak anlamlı (2, 12 ve 24. haftalarda HUMIRA ve plasebo arasındaki tüm karşılaştırmalar için
HUMIRA ile tedavi edilen hastalarda gerek SF-36, gerekse Ankilozan Spondilit Yaşam Kalitesi Anketi'nde (ASQoL) 12. haftadaanlamlıolarakdahabüyük iyileşme elde edilmiş ve bu
iyileşme 24. haftaya kadar kalıcı olmuştur.
Aktif ankilozan spondiliti olan 82 erişkin hastada yürütülen daha küçük çift-kör, plasebo kontrollü AS II çalışmasında benzer eğilimler (istatistiksel olarak tümü anlamlı olmayan) görüldü.
Radyografik olarak AS kanıtı olmayan aksiyal spondiloartrit
Radyografik olmayan aksiyal spondiloartrit (nr-axSpA) hastalarında HUMIRA'nın güvenliliği ve etkililiği, iki randomize, çift-kör, plasebo-kontrollü çalışma ile değerlendirilmiştir. Nr- axSpA I çalışmasında, aktif nr-axSpA hastaları değerlendirilmiştir. Nr-axSpA II çalışması ise, HUMIRA ile açık etiketli tedavi sırasında remisyon sağlanan aktif nr-axSpA hastalarında gerçekleştirilen bir tedavi çekilme çalışmasıdır.
nr-axSpA I çalışması
nr-axSpA I çalışmasında, iki haftada bir HUMIRA 40 mg tedavisi NSAİİ'ye yeterli yanıt vermeyen, ≥ 1 NSAİİ'yi tolere edemeyen ya da NSAİİ kullanımı için kontrendikasyonu bulunan 185 aktif nr-axSpA hastasında, (HUMIRA ile tedavi edilen hastalarda başlangıç ortalama hastalık aktivitesi skoru [Bath Ankylosing Spondylitis Disease Activity Index (BASDAI)] 6,4 iken, plasebo ile tedavi edilen hastalarda bu değer 6,5 idi) 12 haftalık, randomize, çift-kör, plasebo-kontrollü bir çalışmada değerlendirilmiştir.
33 hasta (%18) eşzamanlı olarak hastalık modifiye edici anti-romatizmal ilaçlarla ve 146 hasta (%79) ise başlangıçta yine eş zamanlı olarak NSAİİ'lerle tedavi edilmiştir. Çift-kör dönemini, hastalara iki haftada bir subkütan yolla HUMIRA 40 mg uygulanan ve 144 haftaya kadar süren ilave bir açık etiketli dönem izlemiştir. 12. haftadaki sonuçlar, HUMIRA ile tedavi edilen hastalardaki aktif radyografik olmayan aksiyal spondiloartrit belirti ve semptomlarında plasebo ile tedavi edilen hastalara kıyasla istatistiksel olarak anlamlı bir iyileşme göstermiştir (Tablo 12).
Tablo 12. Plasebo Kontrollü nr-AksiyalSpA I Çalışmasındaki Etkililik Yanıtları
Çift-Kör 12. Haftadaki Yanıt | Plasebo N=94 | HUMIRA N=91 |
ASAS 40 | %15 | %36*** |
ASAS 20 | %31 | %52** |
ASAS 5/6 | %6 | %31*** |
ASAS Kısmi Remisyon | %5 | %16* |
BASDAI 50 | %15 | %35** |
ASDAS | -0,3 | -1,0*** |
ASDAS İnaktif Hastalık | %4 | %24*** |
hs-CRP | -0,3 | -4,7*** |
SPARCCh MRI Sarkoiliak Eklemler | -0,6 | -3,2** |
SPARCC MRI Omurga | -0,2 | -1,8** |
Başlangıca kıyasla ortalamadeğişiklik
***, **, * HUMIRA ve plasebo arasında yapılan tüm karşılaştırmalar için, sırasıyla p < 0,001,
< 0,01 ve < 0,05 düzeyinde istatistiksel olarak anlamlı.
Açık etiketli uzatma çalışmasında, 156. hafta boyunca HUMIRA tedavisi ile belirti ve semptomlarda iyileşme korunmuştur.
İnflamasyonun inhibisyonu
HUMIRA ile tedavi edilmiş olan hastalarda sırasıyla, 156 ve 104 hafta boyunca hem hs-CRP ölçümlerinde hem de sakroiliak eklemler ve omurganın MRG (Manyetik rezonans görüntüleme) ile ölçülen inflamasyon belirtilerinde anlamlı iyileşme korunmuştur.
Yaşam kalitesi ve fiziksel fonksiyon
Sağlıkla ilişkili yaşam kalitesi ve fiziksel fonksiyon, HAQ-S ve SF-36 anketleri kullanılarak değerlendirilmiştir. HUMIRA'nın, başlangıçtan 12. haftaya kadar HAQ-S toplam skoru ve SF- 36 Fiziksel Bileşen Skoru'nda (PCS) plaseboya kıyasla istatistiksel olarak anlamlı ölçüde daha büyük bir iyileşme sağlandığı gösterilmiştir. Açık etiketli uzatma çalışmasında sağlıkla ilişkili yaşam kalitesi ve fiziksel fonksiyonda iyileşme 156 hafta boyunca korunmuştur.
nr-axSpA II çalışması
≥ 2 NSAİİ'ye karşı yetersiz yanıt veren ya da NSAİİ'yi tolere edemeyen veya kontrendikasyonu olan 673 aktif nr-axSpA (ortalama başlangıç hastalık aktivitesi [BASDAI] 7 idi) hastası, 28 hafta süreyle iki haftada bir 40 mg HUMIRA uygulanan nr-axSpA II çalışmasının açık etiketli fazına dahil edilmiştir.
Bu hastalarda ayrıca, MRG'de sakroiliak eklemlerde veya omurgada objektif inflamasyon kanıtı veya yükselmiş hs-CRP düzeyleri görülmüştür. Açık etiketli fazda en az 12 hafta süreyle remisyon elde edilmiş olan hastalar (N=305) (16, 20, 24 ve 28. haftalarda ASDAS < 1,3), daha sonra ilave 40 hafta süreyle iki haftada bir 40 mg HUMIRA tedavisine devam etmek (N=152) veya plasebo (N=153) almak üzere çift-kör, plasebo-kontrollü periyoda randomize edilmiştir (toplam çalışma süresi 68 hafta). Çift kör dönemde alevlenme gösteren hastaların en az 12 hafta süreyle, iki haftada bir kurtarıcı 40 mg HUMIRA tedavisi almasına izin verilmiştir.
Primer etkililik sonlanım noktası, çalışmanın 68. haftası itibariyle alevlenme görülmeyen hastaların oranıdır. Alevlenme, dört hafta arayla gerçekleştirilen iki ardışık vizitte kaydedilen ASDAS ≥ 2,1 olarak tanımlanmıştır. Plaseboya kıyasla HUMIRA kullanan hastaların daha büyük bir oranında, çift-kör dönem süresince hastalık alevlenmesi kaydedilmemiştir (%70,4'e karşılık %47,1, p < 0,001) (Şekil 1).
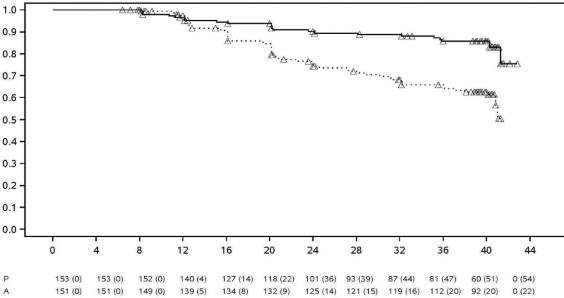
Şekil 1. nr-axSpA II Çalışmasında Alevlenme Zamanlamalarını Özetleyen Kaplan- Meier Eğrileri
Alevlenme görülmemesi olasılığı |
Zaman (Hafta) |
Tedavi Plasebo HUMIRA ∆ Sansür |
Not: P=Plasebo (risk sayısı (alevlenmiş)); A= HUMIRA (Risk sayısı ((alevlenmiş))
Tedavi çekilme grubuna dahil olup alevlenme gösteren 68 hastadan 65'i, 12 haftalık HUMIRA ile kurtarma tedavisi fazını tamamlamıştır. 37'sinde (%56,9) açık etiketli tedaviye başladıktan 12 hafta sonrasında yeniden remisyon sağlanmıştır (ASDAS < 1,3).
68. hafta itibariyle sürekli olarak HUMIRA alan hastalarda, çalışmanın çift kör fazında tedavi çekilmesi grubuna randomize edilmiş olanlara kıyasla, aktif nr-axSpA belirti ve semptomlarında istatistiksel açıdan anlamlı olarak daha fazla iyileşme sağlanmıştır (Tablo 13).
Tablo 13. Plasebo Kontrollü Nr-axSpA II Çalışmasında Etkililik Yanıtları
68. haftada çift kör yanıtları | Plasebo N=153 | HUMIRA N=152 |
ASAS 20 | %47,1 | % 70,4*** |
ASAS 40 | %45,8 | % 65,8*** |
ASAS Kısmi Remisyon | %26,8 | % 42,1** |
ASDAS İnaktif Hastalık | %33,3 | % 57,2*** |
Kısmi Hastalık | %64,1 | % 40,8*** |
***, ** HUMIRA ve plasebo arasında yapılan tüm karşılaştırmalar için, sırasıyla p < 0,001, p < 0,01 düzeyinde istatistiksel olarak anlamlı.
Psöriyatik artrit
İki haftada bir 40 mg şeklindeuygulananHUMIRA,PsAI
ve PsA II adlarındaki plasebo
kontrollü iki çalışmada, orta ila şiddetli derecedeki aktif psöriyatik artrit (PsA) hastalarında incelenmiştir. 24 hafta süreli PsA I çalışmasında, non-steroid anti-inflamatuvar ilaç tedavisine yetersiz yanıt veren 313 erişkin hasta tedavi edilmiştir; bunların yaklaşık %50'si metotreksat almıştır. 12 hafta süreli PsA II çalışmasında, DMARD tedavisine yetersiz yanıt veren 100 hasta tedavi edilmiştir. İki çalışmanın bitiminde 383 hasta, açık etiketli uzatma çalışmasına alınmıştır ve bu çalışmada iki haftada bir 40 mg HUMIRA uygulanmıştır.
İncelenen hasta sayısının az olması nedeniyle, HUMIRA'nın ankilozan spondilit benzeri psöriyatik artropati hastaları üzerinde gösterdiği etkililik ile ilgili kanıtlar yetersizdir.
Tablo 14. Plasebo Kontrollü Psöriyatik Artrit Çalışmalarında ACR Yanıtları (Hastaların Yüzdesi)
| PsA I Çalışması | PsA II Çalışması | ||
Yanıt | Plasebo N=162 | HUMIRA N=151 | Plasebo N=49 | HUMIRA N=51 |
ACR 20 |
|
|
|
|
12. hafta | %14 | %58*** | %16 | %39* |
24. hafta | %15 | %57*** | GD | GD |
ACR 50 |
|
|
|
|
12. hafta | %4 | %36*** | %2 | %25*** |
24. hafta | %6 | %39*** | GD | GD |
ACR 70 |
|
|
|
|
12. hafta | %1 | %20*** | %0 | %14* |
24. hafta | %1 | %23*** | GD | GD |
PsA I çalışmasındaki ACR yanıtları, eş zamanlı metotreksat tedavisi uygulandığında veya uygulanmaksızın, benzer niteliktedir. Açık etiketli uzatma çalışmasında ACR yanıtları 136. haftaya kadar korunmuştur.
Psöriyatik artrit çalışmalarında radyografik yanıtlar değerlendirilmiştir. Çalışmanın çift-kör döneminin başlangıç ve 24. haftasında, hastalara HUMIRA veya plasebo uygulanırken ve tüm hastalar açık-etiketli HUMIRA tedavisindeyken 48. haftada hastaların el, bilek ve ayak radyografileri incelenmiştir. Distal interfalangiyal eklemleri içeren (romatoid artrit için kullanılan TSS ile aynı olmayan) modifiye Total Sharp Skoru (mTSS) kullanılmıştır.
HUMIRA tedavisinin periferal eklem hasarı gelişmesini azaltması plasebo ile karşılaştırılıp, başlangıçtan itibaren değişim olarak ölçüldüğünde, mTSS skoru (ortalama ±SD) plasebo grubunda 0,8±2,5 (24. haftada) ve HUMIRA grubunda 0,0±1,9 (48. haftada) olmuştur (p <
0,001).
HUMIRA ile tedavi edilen ve başlangıçtan itibaren 48. haftaya kadar radyografik progresyon olmayan hastaların (n=102) % 84'ünde, tedavinin 144 haftalık süresi boyunca radyografik progresyon görülmemiştir.
HUMIRA ile tedavi edilen hastalar 24. haftada, HAQ ve Kısa Sağlık Çalışma Formu (SF-36) olarak değerlendirildiğinde, plasebo alan hastalara kıyasla fiziksel fonksiyonlarda istatistiksel
olarak anlamlı iyileşme göstermiştir. Fiziksel fonksiyonların iyileşmesi, açık etiketli uzatma
çalışmasında 136. haftaya kadar sürdürülmüştür.
Psöriyazis
HUMIRA'nın güvenliliği ve etkililiği randomize, çift-kör çalışmalarda sistemik tedavi veya fototerapi adayı olan erişkin kronik plak psöriyazis (Ps) (≥ %10 BSA (vücut yüzey alanı) tutulumu ve Psöriyazis Alan ve Şiddet İndeksi (PASI) ≥ 12 veya ≥ 10) hastalarında değerlendirilmiştir. Psöriyazis çalışması I ve II'ye kayıt edilen hastaların %73'ü önceden sistemik tedavi veya fototerapi görmüştür. HUMIRA'nın güvenliliği ve etkililiği ayrıca randomize, çift-kör bir çalışmada (psöriyazis çalışması III) sistemik tedavi adayı olan ve el ve/veya ayak psöriyazisi ile birlikte orta ila şiddetli derecede kronik plak psöriyazisi bulunan erişkin hastalarda değerlendirilmiştir.
Psöriyazis I çalışmasında (REVEAL) üç tedavi dönemi içinde 1212 hasta değerlendirilmiştir. A döneminde, hastalar plasebo veya başlangıç 80 mg HUMIRA dozunu takiben, başlangıç dozundan bir hafta sonra başlanarak iki haftada bir 40 mg HUMIRA almışlardır. 16 haftalık tedaviden sonra en az PASI 75 yanıtına ulaşan hastalar (PASI skorunda başlangıca göre en az
%75 düzelme olması) B dönemine girmişler ve iki haftada bir açık etiketli olarak 40 mg HUMIRA almışlardır. 33. haftada PASI 75 yanıtını koruyan ve A döneminde orijinal olarak aktif tedaviye randomize edilmiş olan hastalar, tekrar randomize edilerek C döneminde ilave 19 haftalık bir süre boyunca, iki haftada bir 40 mg HUMIRA tedavisi veya plasebo almışlardır. Tüm tedavi gruplarında ortalama başlangıç PASI skoru 18,9 idi ve başlangıçtaki Hekimin Global Değerlendirme (PGA) skoru “orta†(dahil edilen hastaların % 53'ü), “şiddetli†(% 41) ila “çok şiddetli†(% 6) oranında değişmiştir.
Psöriyazis II çalışmasında (CHAMPION), 271 hastada metotreksat ve plasebo karşısında HUMIRA'nın etkililiği ve güvenliliği karşılaştırılmıştır. Hastalar, başlangıç dozu olarak MTX 7,5 mg almışlar ve daha sonra doz, 12. haftaya kadar arttırılarak maksimum 25 mg'a ulaşacak şekilde plasebo veya 16 hafta boyunca 80 mg HUMIRA başlangıç dozunu takiben iki haftada bir 40 mg HUMIRA (başlangıç dozundan bir hafta sonra başlayarak) verilmiştir. 16 haftalık tedavinin ötesinde HUMIRA ve MTX'ı karşılaştıran veri mevcut değildir.8. hafta ve/veya 12. haftada ≥ PASI 50 yanıtına ulaşan MTX alan hastalarda, doz daha fazla arttırılmamıştır. Tüm tedavi gruplarında ortalama başlangıç PASI skoru 19,7 idi ve başlangıçtaki PGA skoru “hafif†(< %1) “orta†(%48) “şiddetli†(%46) “çok şiddetli†(%6) oranında değişmiştir.
Tüm Faz II ve Faz III psöriyazis çalışmalarına katılan hastalar en az 108 hafta daha HUMIRA verilen açık etiketli uzatma çalışmasına katılmaya uygundular.
Psöriyazis I ve II çalışmalarında, primer sonlanım noktası başlangıca kıyasla 16. haftada PASI 75 yanıtına ulaşan hastaların oranı idi (bkz. Tablo 15 ve 16).
Tablo 15. Ps I Çalışması (REVEAL) -16. Haftada Etkililik Sonuçları
| Plasebo N=398 n (%) | HUMIRA 40 mg iki haftada bir N=814 n (%) |
≥ PASI 75 | 26 (6,5) | 578 (70,9) |
PASI 100 | 3 (0,8) | 163 (20) |
PGA: Temiz/minimal | 17 (4,3) | 506 (62,2) |
oğrulama Kodu: 1ZW56ak1Uak1Uak1USHY3S3k0SHY3S3k0 | ||
![]()
Tablo 16. Ps II Çalışması (CHAMPION) -16. Haftada Etkililik Sonuçları
| Plasebo N=53 n (%) | MTX N=110 n (%) | HUMIRA 40 mg iki haftada bir N=108 n (%) |
≥ PASI 75 | 10 (18,9) | 39 (35,5) | 86 (79,6) |
PASI 100 | 1 (1,9) | 8 (7,3) | 18 (16,7) |
PGA:Temiz/minimal | 6 (11,3) | 33 (30,0) | 79 (73,1) |
Psöriyazis I çalışmasında, PASI 75 yanıtına ulaşan ve 33. haftada plasebo almak üzere yeniden randomize edilen hastaların %28'i, HUMIRA'ya devam edenlerin %5'ine kıyasla (p < 0,001) “yeterli yanıtın kaybıâ€nı yaşamıştır (33. haftadan sonra ve 52. hafta veya öncesinde 33. haftaya kıyasla PASI skorunda en az 6 puanlık artış ile başlangıca kıyasla < PASI 50 yanıtı ile sonuçlanan PASI skoru). Plaseboya tekrar randomize edildikten sonra yeterli yanıt veremeyen ve ardından açık etiketli uzatma çalışmasına alınan hastaların %38 (25/66) ve %55'i (36/66) sırasıyla 12 ve 24 haftalık tekrar tedaviyi takiben yeniden PASI 75 yanıtına ulaşmıştır.
16 ve 33. haftalarda PASI 75 yanıtına ulaşan toplam 233 hasta Psöriyazis I çalışmasında 52 hafta devamlı HUMIRA tedavisi almış ve açık etiketli uzatma çalışmasında HUMIRA almaya devam etmiştir. İlave 108 haftalık açık etiketli tedaviden sonra (toplam 160 hafta) bu hastalardaki PASI 75 ve temiz veya minimal PGA yanıt oranları sırasıyla %74,7 ve %59 olmuştur. Advers olaylar veya etkililik görülmemesinden dolayı çalışmadan ayrılan veya doz yükseltilen tüm hastaların yanıt vermeyen hasta olarak değerlendirildiği bir analizde, bu hastalardaki PASI 75 veya temiz veya minimal PGA yanıt oranları, ilave 108 haftalık açık etiketli tedaviden sonra (toplam 160 hafta) sırasıyla %69,6 ve %55,7 olmuştur.
Toplam 347 stabil yanıt veren hasta, açık etiketli bir uzatma çalışmasında tedaviyi durdurma ve tekrar tedavi değerlendirmeye katılmıştır. Tedaviyi durdurma periyodunda, psöriyazis semptomları zaman içerisinde geri dönmüş, medyan nüks (PGA “orta†veya daha kötü) süresi yaklaşık 5 ay olmuştur. Bu hastaların hiçbirinde tedaviyi durdurma döneminde rebound etkisi görülmemiştir. Tekrar tedavi dönemine alınan hastaların toplam %76,5'inin (218/285), tedaviyi durdurma döneminde nüks yaşayıp yaşamadıklarından bağımsız şekilde 16 haftalık tekrar tedaviden sonra PGA yanıtı “temiz†veya “minimal†idi (tedaviyi durdurma döneminde nüks yaşayan ve yaşamayan hastalarda sırasıyla %69,1 [123/178] ve %88,8 [95/107]). Tekrar tedavi döneminde, tedaviyi durdurma döneminden önce gözlenenle benzer bir güvenlilik profili gözlenmiştir.
DLQI'de (Dermatoloji Yaşam Kalitesi İndeksi) plasebo (Psöriyazis I ve II çalışması) ve MTX (Psöriyazis II çalışması) ile karşılaştırıldığında, başlangıca göre 16. haftada anlamlı düzelmeler olduğu gösterilmiştir. Psöriyazis I çalışmasında, SF-36'nın fiziksel ve mental skorlarındaki iyileşmeler plasebo düzeyleri ile karşılaştırıldığında anlamlıdır.
Açık etiketli bir uzatma çalışmasında, PASI skorunun %50'nin altında olması nedeniyle dozu
sırasıyla, hastaların %26,4'ünde (92/349) ve %37,8'inde (132/349) PASI 75 yanıtı elde edilmiştir.
Psöriyazis III çalışmasında (REACH) orta ila şiddetli derecede kronik plak psöriyazisi ve el ve/veya ayak psöriyazisi bulunan 72 hastada HUMIRA'nın etkililiği ve güvenliliği plasebo ile karşılaştırılmıştır. Hastalar başlangıç dozu olarak 80 mg ve bunu takiben iki haftada bir 40 mg HUMIRA (ilk dozdan 1 hafta sonra başlayacak şekilde) ya da 16 hafta boyunca plasebo almışlardır. 16. haftada, plasebo alan hastalara kıyasla HUMIRA alan hastaların istatistiksel olarak anlamlı derecede büyük bir çoğunluğunda el ve/veya ayaklarda ‘temiz' veya ‘hemen hemen temiz' PGA sonucu elde edilmiştir (sırasıyla %30,6'ya kıyasla %4,3, [P=0,014]).
Psöriyazis IV çalışmasında, orta ila şiddetli derecede tırnak psöriyazisi olan 217 erişkin hastada HUMIRA tedavisinin etkililiği ve güvenliliği plasebo ile karşılaştırılmıştır. Hastalara başlangıç dozu olarak 80 mg HUMIRA, başlangıç tedavisini takiben 26 hafta boyunca iki haftada bir HUMIRA 40 mg (başlangıç dozundan bir hafta sonra başlayacak şekilde) ya da plasebo verilmiş ve ardından 26 haftalık ek bir süre daha açık etiketli HUMIRA tedavisi uygulanmıştır. Tırnak psöriyazis değerlendirmeleri modifiye edilmiş Tırnak Psöriyazisi Şiddet İndeksi (mNAPSI), Hekimin Tırnak Psöriyazisine İlişkin Genel Değerlendirmesi (PGA-F) ve Tırnak Psöriyazis Şiddet İndeksi'ni (NAPSI) içermiştir (bkz. Tablo 17). HUMIRA deri tutulumu derecesi farklı olan (BSA ≥ %10 [hastaların %60'ı] ve BSA < %10 ve ≥ %5 [hastaların %40'ı]) tırnak psöriyazisli hastalarda tedavi yararı göstermiştir.
Tablo 17. Psöriyazis IV Çalışmasında 16, 26 ve 52. Haftalarda Elde Edilen Etkililik Sonuçları
Sonlanım Noktası | 16. Hafta Plasebo Kontrollü | 26. Hafta Plasebo Kontrollü | 52. Hafta Açık Etiketli | ||
Plasebo N=108 | HUMIRA 40 mg, iki haftada bir N=109 | Plasebo N=108 | HUMIRA 40 mg, iki haftada bir N=109 | HUMIRA 40 mg, iki haftada bir N=80 | |
≥ mNAPSI 75 (%) | 2,9 | 26 | 3,4 | 46,6 | 65 |
PGA-F'de temiz/minimal ve ≥ 2 derece düzelme (%) | 2,9 | 29,7 | 6,9 | 48,9 | 61,3 |
Toplam Tırnak NAPSI Skorundaki Yüzde Değişiklik (%) |
-7,8 |
-44,2 |
-11,5 |
-56,2 |
-72,2 |
HUMIRA ile tedavi edilen hastalar, 26. haftada DLQI'de plaseboya kıyasla istatistiksel olarak anlamlı düzelmeler göstermiştir.
Hidradenitis suppurativa
HUMIRA'nın güvenliliği ve etkililiği randomize, çift-kör, plasebo-kontrollü çalışmalarda ve sistemik antibiyotik tedavisini tolere edemeyen, bu tedavi için bir kontrendikasyonun bulunduğu ya da en az 3 aylık bir denemede yeterli yanıt alınamayan orta ila şiddetli derecede hidradenitis suppurativa (HS) olan erişkin hastalarda gerçekleştirilen bir açık etiketli uzatma çalışmasında değerlendirilmiştir. HS I ve HS II çalışmalarındaki hastalarda, en az 3 apse ya da inflamatuvar nodülün bulunduğu ve hastalığın Hurley II yada III evresinde olduğu
HS I çalışmasında (PIONEER I), 307 hasta iki tedavi döneminde değerlendirilmiştir. A döneminde hastalara plasebo ya da HUMIRA (0. haftada 160 mg, 2. haftada 80 mg başlangıç dozu ve 4. haftadan itibaren 11. haftaya kadar haftada bir kez 40 mg) uygulanmıştır. Çalışma sırasında eşzamanlı antibiyotik kullanımına izin verilmemiştir. 12 haftalık tedaviden sonra A döneminde HUMIRA kullanan hastalar, B döneminde tekrar üç tedavi grubundan (haftada bir kez HUMIRA 40 mg, iki haftada bir HUMIRA 40 mg ya da 12 -35. haftalar arasında plasebo) birine randomize edilmiştir. A döneminde plasebo grubuna randomize edilmiş olan hastalar, B döneminde de haftada bir kez HUMIRA 40 mg uygulanan gruba ayrılmıştır.
HS II çalışmasında (PIONEER II), 326 hasta iki tedavi döneminde değerlendirilmiştir. A döneminde hastalara plasebo ya da HUMIRA (0. haftada 160 mg ve 2. haftada 80 mg başlangıç dozu ve 4. haftadan itibaren 11. haftaya kadar haftada bir kez 40 mg) uygulanmıştır. Hastaların
%19,3'ü, başlangıçtaki oral antibiyotik tedavisine çalışma boyunca devam etmiştir. 12 haftalık tedaviden sonra A döneminde HUMIRA kullanan hastalar, B döneminde tekrar üç tedavi grubundan (haftada bir kez HUMIRA 40 mg, iki haftada bir 40 mg HUMIRA ya da 12-35. haftalar arasında plasebo) birine randomize edilmiştir. A döneminde plasebo grubuna randomize edilmiş olan hastalar, B döneminde plasebo uygulanan gruba ayrılmıştır.
HS I ve HS II çalışmalarına katılan hastalar, haftada bir kez HUMIRA 40 mg kullanımının değerlendirildiği açık etiketli bir uzatma çalışmasına kayıt için uygun bulunmuştur. Tüm adalimumab popülasyonunda ortalama maruziyet 762 gündür. Üç çalışmanın tümünde, hastalar çalışma boyunca lezyonlarını her gün topikal antiseptikle temizlemiştir.
Klinik yanıt
İnflamatuvar lezyonlardaki azalma ile ve apse ve akıntılı fistüllerdeki kötüleşmenin önlenmesi, Hidradenitis Suppurativa Klinik Yanıtı (HiSCR; apse ve akıntılı fistül sayısında başlangıca göre artış olmaksızın, toplam apse ve inflamatuvar nodül sayısında %50 azalma) kullanılarak değerlendirilmiştir. HS ile ilişkili deri ağrısındaki azalma, çalışmaya dahil edilen 11 puanlık bir ölçü üzerinden başlangıç skoru 3 ya da daha yüksek olan hastalarda Sayısal Derecelendirme Ölçeği kullanılarak değerlendirilmiştir. 12 haftada, HUMIRA ile tedavi edilen grupta HiSCR elde edilen hasta oranının plaseboya kıyasla anlamlı ölçüde daha yüksek olduğu belirlenmiştir. HS II çalışmasında, 12. haftada hastaların anlamlı ölçüde daha büyük bir bölümünde HS ile ilişkili deri ağrısında klinik açıdan önemli bir azalma ortaya çıkmıştır (bkz. Tablo 18). HUMIRA ile tedavi edilen hastalarda, tedavinin ilk 12 haftasında hastalığın alevlenme riski anlamlı ölçüde azalmıştır.
| HS I Çalışması | HS II Çalışması | ||
Plasebo |
Haftada bir kez HUMIRA 40 mg |
Plasebo | Haftada bir kez HUMIRA 40 mg | |
Hidradenitis Suppurativa Klinik Yanıtı (HiSCR) | N = 154 40 (%26) | N = 153 64 (%41,8) | N=163 45 (%27,6) | N=163 96 (%58,9) |
Deri Ağrısında ≥ %30 Azalma | N = 109 27 (%24,8) | N = 122 34 (%27,9) | N=111 23 (%20,7) | N=105 48 (%45,7) |
Tablo 18. 12. Haftadaki Etkililik Sonuçları – HS I ve II Çalışmaları
![]()
* p < 0,05, *** p < 0,001, plaseboya kıyasla HUMIRA
Haftada bir kez 40 mg HUMIRA tedavisi, apseler ve akıntılı fistüllerdeki kötüleşme riskini anlamlı ölçüde azaltmıştır. HS I ve HS II çalışmalarının ilk 12 haftasında, plasebo grubunda apselerin (sırasıyla %23'e kıyasla %11,4) ve akıntılı fistüllerin (sırasıyla %30'a kıyasla %13,9) kötüleştiği hasta oranının, HUMIRA grubuna kıyasla yaklaşık iki kat yüksek olduğu belirlenmiştir.
12 haftada Dermatoloji Yaşam Kalitesi İndeksi (DLQI; HS I ve II çalışması) ile ölçülen deriye spesifik sağlıkla ilişkili yaşam kalitesi, Tedaviden Memnuniyet Anketi (TSQM; HS I ve HS II çalışmaları) ile ölçülen hastanın ilaç tedavisinden genel memnuniyeti ve SF-36 fiziksel bileşen özet skoru (HS I çalışması) ile ölçülen fiziksel sağlıkta başlangıca göre elde edilen düzelmenin plaseboya kıyasla daha büyük olduğu gösterilmiştir.
12. haftada haftada bir kez 40 mg HUMIRA'ya kısmi yanıt veren hastalarda bu şekilde tedaviye devam edildiğinde 36. haftadaki HiSCR oranının, doz uygulama sıklığı iki haftada bire düşürülen ya da tedaviyi bırakmış olan hastalara kıyasla daha yüksek olduğu belirlenmiştir (bkz. Tablo 19).
Tablo 19. Haftada Bir Kez HUMIRA Uygulaması Olan Tedavinin 12. Haftada Tekrar
Düzenlenmesinden Sonra 24 ve 36. Haftada HiSCRElde Edilen Hasta Oranı
| Plasebo (tedaviyi bırakan) N = 73 | İki haftada bir HUMIRA 40 mg N = 70 | Haftada bir kez HUMIRA 40 mg N = 70 | |
24. hafta | 24 (%32,9) | 36 (%51,4) | 40 (%57,1) | |
36. hafta | 22 (%30,1) | 28 (%40) | 39 (%55,7) | |
veren hastalar. | ||||
12 haftada en azından kısmi yanıt veren ve sürekli olarak haftada bir kez HUMIRA tedavisi kullanan hastalarda, 48. haftadaki HiSCR oranı %68,3 ve 96. haftada bu oran %65,1 olarak saptanmıştır. 96 hafta boyunca uzun süreli 40 mg HUMIRA ile tedavi esnasında yeni bir güvenlilik bulgusu tespit edilmemiştir.
HS I ve HS II çalışmalarında 12. haftada HUMIRA tedavisini bırakmış olan hastalarda, haftada bir kez 40 mg HUMIRA tedavisinin yeniden başlatılmasından 12 hafta sonra HiSCR oranı, tedavinin bırakılmasından önce gözlenmiş olan seviyeye benzer oranlara geri dönmüştür (%56).
Crohn hastalığı
HUMIRA'nın dozlarının güvenliliği ve etkililiği, 1500'ü aşkın orta ila şiddetli derecede aktif
Crohn hastasında (Crohn HastalığıAktiviteİndeksi (CDAI)≥220 ve ≤ 450) randomize, çift-
kör, plasebo kontrollü-çalışmalarda değerlendirilmiştir. Aminosalisilatların, kortikosteroidlerin ve/veya immünomodülatör ajanların stabil dozlarda eş zamanlı kullanımına izin verilmiş ve hastaların %80'i bu ilaçlardan en az birini almaya devam etmiştir.
Klinik remisyonun indüksiyonu (CDAI < 150 olarak tanımlanmıştır) iki çalışmada, CD I (CLASSIC I) ve CD II çalışması (GAIN) değerlendirilmiştir. CD I çalışmasında daha önce TNF bloke edici ajan kullanmamış olan 299 hasta dört tedavi grubundan birine randomize edilmiştir:
0. ve 2. haftada plasebo, 0. haftada 160 mg ve 2. haftada 80 mg HUMIRA, 0. haftada 80 mg ve
2. haftada 40 mg HUMIRA, 0. haftada 40 mg ve 2. haftada 20 mg HUMIRA. CD II çalışmasında infliksimaba yanıtı kaybolmuş veya infliksimabı tolere edemeyen 325 hasta, 0. haftada 160 mg ve 2. haftada 80 mg HUMIRA veya 0. hafta ve 2. haftada plaseboya randomize edilmişlerdir. Primer yanıt vermeyen hastalar çalışmanın dışında bırakılmış ve bu nedenle bu hastalar daha fazla değerlendirilmemiştir.
Klinik remisyonun idamesi CD III çalışmasında (CHARM) değerlendirilmiştir. CD III çalışmasında 854 hasta, önce açık etiketli olarak 0. haftada 80 mg HUMIRA ve 2. haftada 40 mg HUMIRA almışlardır. Hastalar daha sonra 4. haftada iki haftada bir 40 mg HUMIRA, haftada bir 40 mg HUMIRA veya plaseboya randomize edilmişlerdir. Toplam çalışma süresi 56 haftadır. 4. haftada klinik yanıt veren hastalar (CDAI≥70'de düşüş) yanıt vermeyenlerden ayrı olarak analiz edilmişlerdir. 8. haftadan sonra kortikosteroidin azaltılarak kesilmesine izin verilmiştir.
CD I ve CD II çalışması remisyon indüksiyonu ve yanıt oranları Tablo 20'de sunulmaktadır.
Tablo 20. Klinik Remisyon ve Klinik Yanıt İndüksiyonu (Hastaların Yüzdesi)
| CD I Çalışması: Önceden İnfliksimab Kullanmamış Hastalar | CD II Çalışması: Önceden İnfliksimab Kullanmış Hastalar | |||
| Plasebo N=74 | HUMIRA 80/40 mg N = 75 | HUMIRA 160/80 mg N=76 | Plasebo N=166 | HUMIRA 160/80 mg N=159 |
4. hafta |
|
|
|
|
|
Klinik remisyon | %12 | %24 | %36* | %7 | %21* |
Klinik yanıt (CR-100) | %24 | %37 | %49** | %25 | %38** |
Bütün p-değerleri HUMIRA ve plasebonun ikili karşılaştırmalarıdır
* p < 0,001
** p < 0,01
8. haftada, 160/80 mg HUMIRA ve 80/40 mg HUMIRA indüksiyon rejimleriyle benzer remisyon oranları gözlenmiş ve 160/80 mg HUMIRA grubunda advers olaylar daha sık olarak bildirilmiştir.
CD III çalışmasında, 4. haftada hastaların %58'i (499/854) klinik yanıt vermiş ve primer analizde değerlendirilmiştir. 4. haftadaki klinik yanıt alınanların %48'i, daha önce başka TNF bloke edici ajan uygulanmış olan hastalardır. Remisyonun idamesi ve yanıt oranları Tablo 21'de sunulmaktadır.
Klinik remisyon sonuçları, daha önce TNF bloke edici ajan uygulanmasına bağlı olmaksızın
rölatif olarak sabit kalmıştır.
56. haftada plasebo ile karşılaştırıldığında hastalığa bağlı hastaneye yatma ve cerrahi müdahale HUMIRA ile istatistiksel olarak anlamlı bir şekilde azalmıştır.
Tablo 21. Klinik Remisyon ve Yanıtın Sürdürülmesi (Hasta Yüzdesi)
| Plasebo | 40 mg HUMIRA iki haftada bir | 40 mg HUMIRA haftada bir |
26. hafta | N=170 | N=172 | N=157 |
Klinik remisyon | %17 | %40* | %47* |
Klinik yanıt (CR-100) | %27 | %52* | %52* |
>=90 gün boyunca kortikosteroid kullanılmayan hastalarda remisyon | %3 (2/66) | %19 (11/58)** | %15 (11/74)** |
56. hafta | N=170 | N=172 | N=157 |
Klinik remisyon | %12 | %36* | %41* |
Klinik yanıt (CR-100) | %17 | %41* | %48* |
>=90 gün boyunca kortikosteroid kullanılmayan hastalarda remisyon | %5 (3/66) | %29 (17/58)* | %20 (15/74)** |
* p < 0,001 HUMIRA ve plasebo arasındaki tüm karşılaştırma oranları için
** p < 0,02 HUMIRA ve plasebo arasındaki tüm karşılaştırma oranları için
4. haftada yanıt vermeyen hastalar arasından, HUMIRA idame grubunda 12. haftada yanıt verenlerin oranı %43 iken plasebo idame hastalarında bu oran %30 olmuştur. Bu sonuçlar 4. haftada yanıt vermeyen bazı hastaların, sürdürülen idame tedavisinden 12. haftada yarar görebileceğini düşündürmektedir. 12. haftadan sonra sürdürülen tedavi anlamlı ölçüde daha fazla yanıtla sonuçlanmamıştır (bkz. Bölüm 4.2).
CD I çalışmasında 117/276 hasta ve CD II ve CD III çalışmalarında ise 272/777 hasta en az 3 yıl boyunca açık etiketli olarak adalimumab tedavisi ile izlenmiştir. Sırasıyla 88 ve 189 hasta klinik remisyonda kalmaya devam etmiştir. Klinik yanıt (CR-100) sırasıyla 102 ve 233 hastada korunmuştur.
Yaşam kalitesi
CD I ve CD II çalışmasında plaseboyla karşılaştırıldığında, HUMIRA 80/40 mg HUMIRA ve 160/80 mg HUMIRA tedavisine randomize edilmiş hastalarda 4 haftada hastalığa özgü inflamatuvar bağırsak hastalığı anketi (IBDQ) total skorunda istatistiksel olarak anlamlı düzelme elde edilmiş ve CD III çalışmasının 26. ve 56. haftalarında adalimumab tedavi gruplarında IBDQ başlangıç skorlarında plasebo grubuna kıyasla istatistiksel olarak anlamlı düzelme görülmüştür.
Ülseratif kolit
Çoklu HUMIRA dozlarının güvenliliği ve etkililiği, randomize, çift-kör, plasebo-kontrollü
çalışmalarda orta ila şiddetli derecede ülseratif koliti (6-12 arasında Mayo skoru ile birlikte
endoskopi alt skorun 2-3 arasında olması) bulunan erişkin hastalarda değerlendirilmiştir.
UC I çalışmasında, daha önce TNF-bloke edici ajan kullanmamış 390 hasta ya 0. ve 2. haftalarda plasebo, 0. haftada 160 mg HUMIRA ve 2. haftada 80 mg HUMIRA ya da 0. haftada 80 mg HUMIRA ve ardından 2. haftada 40 mg HUMIRA alacak şekilde randomize edilmiştir.
2. haftadan sonra her iki adalimumab kolundaki hastalar iki haftada bir 40 mg HUMIRA almışlardır. 8. haftadaki klinik remisyon (>1 alt skor olmaksızın Mayo skoru ≤ 2 olarak tanımlanmıştır) değerlendirilmiştir.
UC II çalışmasında, 248 hasta 0. haftada 160 mg, 2. haftada 80 mg ve sonrasında iki haftada bir 40 mg HUMIRA almış, 246 hasta ise plasebo almıştır. Klinik sonuçlar 8. haftadaki remisyon indüksiyonu ve 52. haftadaki remisyon idamesi yönünden değerlendirilmiştir.
160/80 mg HUMIRA ile indüksiyon dozu alanlarda, UC I çalışmasında (sırasıyla %18'e karşı
%9, p=0,031) ve UC II çalışmasında (sırasıyla %17'ye karşı %9, p=0,019) 8. haftada plaseboya karşı istatistiksel olarak anlamlı düzeyde daha yüksek oranlarda klinik remisyon sağlanmıştır. UC II çalışmasında, 8. haftada remisyonda olan HUMIRA tedavisi alanlardan 21/41 (%51) hasta 52. haftada remisyondadır. UC II genel çalışma popülasyonunun sonuçları Tablo 22'de gösterilmektedir.
Tablo 22. UC II Çalışmasında Yanıt, Remisyon ve Mukozal İyileşme (Hastaların Yüzdesi)
| Plasebo | İki haftada bir HUMIRA 40 mg |
52. hafta | N=246 | N=248 |
Klinik yanıt | %18 | %30* |
Klinik Remisyon | %9 | %17* |
Mukozal İyileşme | %15 | %25* |
≥ 90 gün boyunca steroidsiz remisyon | %6 (N=140) | %13 * (N=150) |
8. ve 52. hafta |
|
|
Sürdürülen Yanıt | %12 | %24** |
Sürdürülen Remisyon | %4 | %8* |
Sürdürülen Mukozal İyileşme | %11 | %19* |
Klinik remisyon, alt skor > 1 olmaksızın Mayo skoru ≤ 2'dir; Klinik yanıt, başlangıçtan Mayo skoru ≥ 3 puana ve rektal kanama alt skoru [RBS] ≥1'de ≥%30 ilave azalma ya da 0 veya 1'lik bir mutlak RBS; *p < 0,05 HUMIRA ve plasebo arasındaki tüm karşılaştırma oranları için **p < 0,001 HUMIRA ve plasebo arasındaki tüm karşılaştırma oranları için | ||
8. haftada yanıt veren hastalardan %47'si 52. haftada da yanıt vermiş, %29'u remisyona girmiş,
%41'inde mukozal iyileşme tespit edilmiş ve %20'si de 90 gün veya daha uzun süreyle steroidsiz remisyona girmiştir.
Hastaların yaklaşık %40'ı infliksimab ile anti-TNF tedavisinde başarısız olmuşlardır. Anti-TNF ile tedavi görmemiş (naif) hastalardakine kıyasla, bu hastalarda adalimumab etkililiği azalmıştır. Önceki anti-TNFtedavisindebaşarısızolanhastalar arasında, 52. haftada plasebo
UC I ve UC II çalışmalarındaki hastalar, açık etiketli uzun süreli uzatma çalışmasına geçiş hakkına sahip olmuştur. Devam eden 3 yıllık tedavide kısmi Mayo skoruna göre hastaların
%75'i (301/402) klinik remisyona devam etmiştir.
Hastaneye yatış oranları
UC I ve UC II çalışmalarının 52 haftalık süresi boyunca, tüm nedenlere bağlı ve ülseratif kolit ilişkili hastaneye yatış oranlarının plasebo kolu ile karşılaştırıldığında adalimumab ile tedavi edilen kolda daha düşük olduğu gözlemlenmiştir. Tüm nedenlere bağlı hastaneye yatış sayısı, adalimumab ile tedavi edilen grupta hasta yılı başına 0,18 iken bu oran plasebo grubunda hasta yılı başına 0,26 olmuştur. Aynı şekilde ülseratif kolit ile ilişkili hastaneye yatışların oranları, sırasıyla adalimumab ve plasebo kollarında hasta yılı başına 0,12'ye karşı 0,22 olmuştur.
Yaşam kalitesi
UC II çalışmasında, adalimumab ile yürütülen tedavi İnflamatuvar Bağırsak Hastalığı Anketi (IBDQ) skorlarında iyileşmelerle sonuçlanmıştır.
Üveit
HUMIRA'nın güvenliliği ve etkililiği randomize, çift-kör, plasebo-kontrollü iki çalışmada (UV I ve II), izole anterior üveit görülen hastalar dahil edilmeyerek, enfeksiyöz olmayan orta, posterior ve panüveit görülen erişkin hastalarda değerlendirilmiştir. Hastalar 80 mg'lık bir HUMIRA başlangıç dozu ve onu takiben ilk dozdan bir hafta sonra başlanarak iki haftada bir uygulanan 40 mg HUMIRA veya plasebo almıştır. Tek bir biyolojik olmayan immünosupresanın eşzamanlı stabil dozlarına izin verilmiştir.
UV I çalışmasında kortikosteroid (10 ila 60 mg/gün dozunda oral prednizon) tedavisine rağmen aktif üveiti olan 217 hasta değerlendirilmiştir. Çalışma başında tüm hastalara 2 haftalık standart 60 mg/günlük prednizon dozu uygulanmış ve bunu takiben zorunlu doz azaltma programı takip edilerek 15. haftada kortikosteroid tamamen kesilmiştir.
UV II çalışmasında hastalıklarının kontrol altında tutulması için başlangıç noktasında kronik kortikosteroid tedavisine (10 ila 35 mg/gün oral prednizon) gereksinim duyan inaktif üveiti olan 226 hasta değerlendirilmiştir. Hastalar zorunlu doz azaltma programına alınmış ve 19. haftada kortikosteroid tamamen kesilmiştir.
Primer etkililik sonlanım noktası her iki çalışmada da ‘tedavide başarısızlık ortaya çıkana kadar geçen süre' şeklinde belirlenmiştir. Tedavi başarısızlığı, inflamatuvar koryoretinal ve/veya inflamatuvar retinal vasküler lezyonlar, ön kamara (AC) hücre değerlendirmesi, vitröz bulanıklık (VH) derecelendirmesi ve en iyi düzeltilmiş görme keskinliğini (BCVA) esas alan çok bileşenli bir sonuç temelinde tanımlanmıştır.
UV I ve UV II çalışmalarını tamamlayan hastalar, süresi başlangıçta 78 hafta olarak planlanan, kontrolsüz, uzun süreli bir uzatma çalışmasına kaydolmaya uygun bulunmuştur. Hastaların HUMIRA'ya erişimleri olana kadar, 78. haftadan sonra çalışma medikasyonuna devam etmelerine izin verilmiştir.
Klinik yanıt
Her iki çalışmadan elde edilen sonuçlar HUMIRA ile tedavi uygulanan hastalarda plasebo alan hastalardakine kıyasla tedavi başarısızlığı riskinde istatistiksel açıdan anlamlı azalma ortaya koymuştur (bkz. Tablo 23). Her iki çalışma da, HUMIRA'nın plaseboya kıyasla tedavi başarısızlığı oranında erken ve uzun süreli bir etki ortaya çıkardığını göstermiştir (bkz. Şekil 2).
Tablo 23. UV I ve UV II Çalışmalarında Tedavide Başarısızlık Ortaya Çıkana
Kadar Geçen Süre
Analiz Tedavi | N | Başarısızlık N (%) | Başarısızlığa Kadar Geçen Medyan Süre (ay) | HR | HR 'ye ilişkin %95 GA | P Değeri |
UV I Çalışmasında 6. hafta veya Sonrasında Tedavide Başarısızlık Ortaya Çıkana Kadar Geçen Süre Primer analiz (ITT) | ||||||
Plasebo 107 84 (78,5) 3 -- -- -- Adalimumab 110 60 (54,5) 5,6 0,5 0,36, 0,7 < 0,001 | ||||||
UV II Çalışmasında 2. hafta veya Sonrasında Tedavide Başarısızlık Ortaya Çıkana Kadar Geçen Süre Primer analiz (ITT) | ||||||
Plasebo | 111 | 61 (55) | 8,3 | -- | -- | -- |
Adalimumab | 115 | 45 (39,1) | NE | 0,57 | 0,39, 0,84 | 0,004 |
Not: 6. hafta veya sonrasında (UV I çalışması) ya da 2. hafta veya sonrasında (UV II çalışması) tedavide başarısızlık olay olarak sayılmıştır. Tedavi başarısızlığı dışındaki nedenlerden kaynaklanan tedaviyi bırakma olayları, bırakma zamanı sırasında dahil edilmemiştir. Tedavinin bir faktör olduğu orantılı tehlikeler regresyonunda plasebo karşısında adalimumabın HR değeri. Log rank testinden 2-yönlü P değeri. NE = hesaplanabilir değil. Risk altındaki hastaların yarısından azında bir olay meydana gelmiştir. | ||||||
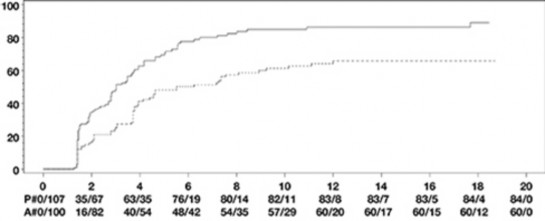
TEDAVIDE BAŞARISIZLIK ORANI (%)
Şekil 2. 6. Hafta veya Sonrasında (UV I Çalışması ) ya da 2. Hafta veya Sonrasında (UV II Çalışması) Tedavide Başarısızlık Ortaya Çıkana Kadar Geçen Süreyi Özetleyen Kaplan-Meier Eğrileri
SÜRE(AY)ip Adresi:https://www.turkiye.gov.tr/saglik-titck-ebys
![]()
TEDAVİDE BAŞARISIZLIK ORANI (%)
UV I Çalışması Tedavi Plasebo ![]() Adalimumab
Adalimumab
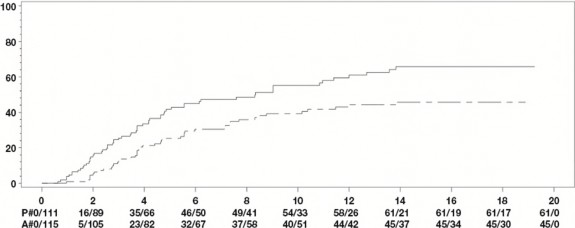
SÜRE (AY)
UV II Çalışması Tedavi ![]() Plasebo
Plasebo ![]() Adalimumab
Adalimumab
Not: P# = Plasebo (Olay Sayısı/Risk Altındakilerin Sayısı); A# = HUMIRA (Olay Sayısı/Risk Altındakilerin Sayısı).
UV I çalışmasında tedavi başarısızlığı bileşenlerinin her birinde plasebo karşısında adalimumab lehine istatistiksel olarak anlamlı farklılıklar gözlemlenmiştir. UV II çalışmasında görüş keskinliği konusunda istatistiksel olarak anlamlı farklılıklar gözlenmiştir ve diğer tüm bileşenlerin sayısal açıdan adalimumab lehine olduğu görülmüştür.
UV I ve UV II çalışmalarının kontrolsüz uzun süreli uzatmasına dahil edilen 424 hastadan 60'ı uygun görülmemiştir (örn., katarakt ameliyatı veya vitrektomi nedeniyle, sapmalar nedeniyle veya diyabetik retinopatiye bağlı sekonder komplikasyonlar nedeniyle) ve primer etkililik analizinden çıkarılmıştır. Kalan 364 hastadan, 269 hasta (%74) açık etiketli adalimumab tedavisini 78 hafta boyunca almışlardır. Gözlemlenen veri yaklaşımına göre, eşzamanlı olarak günde ≤ 7,5 mg steroid alan 216 hastada (%80,3) hastalık sakindi (aktif inflamatuvar lezyon bulunmamaktadır, AC hücre derecesi ≤ 0,5+, VH derece ≤ 0,5+) kalmıştır ve 178 (%66,2) hasta steroid almadan hastalık sakin kalmıştır. BCVA, 78. haftada gözlerin %88,6'sında iyileştirilmiş veya korunmuştur (< 5 harf bozulması). 78. haftadan sonraki veriler bu sonuçlarla genel olarak tutarlıdır, ancak bu sürenin sonunda kayıtlı hasta sayısı azalmıştır. Genel olarak, hastalar arasında adalimumab tedavisini bırakanların %18'i advers olaylardan ve %8'i yetersiz yanıttan dolayı çalışmayı bırakmıştır.
Yaşam kalitesi
Görüşle ilişkili işlev konusunda hasta tarafından bildirilen sonuçlar her iki klinik çalışmada NEI VFQ-25 kullanılarak değerlendirilmiştir. HUMIRA, UV I çalışmasında genel görme, oküler ağrı, yakın görme, mental sağlık ve toplam skor, UV II çalışmasında ise genel görme ve mental sağlık olmak üzere, alt skorların çoğunda istatistiksel olarak anlamlı ortalama farklarla sayısal açıdan üstünlük sergilemiştir. Görmeyle ilişkili etkilerin UV I çalışmasında renk görüşü, UV II çalışmasında ise renk görüşü, periferik görüş ve yakın görüş için sayısal açıdan HUMIRA lehine olmadığı görülmüştür.
İmmünojenisite
Anti-adalimumab antikorlarının oluşumu adalimumabın klirensinde artış, etkililiğinde ise azalma ile ilişkilidir. Anti-adalimumab antikorları varlığıyla advers olaylar arasında görünür bir bağıntı bulunmamaktadır.
RA I, II ve III çalışmalarındaki hastalar, 6'dan 12. aya kadar olan dönemde anti-adalimumab antikorları bakımından çok sayıda zaman noktasında test edilmiştir. Pivotal çalışmalarda, anti- adalimumab antikorları, adalimumab ile tedavi edilen hastaların %5,5'inde (58/1053) saptanmış, plasebo ile bu oran %0,5 (2/370) olmuştur. Eşzamanlı metotreksat verilmeyen hastalarda insidans %12,4 iken, adalimumabın metotreksata ilave olarak verildiği hastalarda
%0,6 olmuştur.
4-17 yaş arasındaki poliartiküler jüvenil idiyopatik artrit hastalarında, adalimumab ile tedavi edilen hastaların %15,8'inde (27/171) anti-adalimumab antikorları saptanmıştır. Eş zamanlı metotreksat verilmeyen hastalarda insidans %25,6 (22/86) iken, adalimumabın metotreksata ilave olarak verildiği hastalarda %5,9 (5/85) olmuştur. 2-4 yaşları arasında ya da 4 yaş ve üzeri olan, 15 kg'ın altındaki poliartiküler jüvenil idiyopatik artrite sahip hastaların %7'sinde (1/15) anti-adalimumab antikorları belirlenmiştir ve bir hasta eş zamanlı metotreksat almıştır.
Adalimumab ile tedavi edilen entezit ile ilişkili artrit hastalarında, anti-adalimumab antikorları hastaların %10,9'unda (5/46) tespit edilmiştir. Eş zamanlı metotreksat verilmeyen hastaların insidansı adalimumabın metotreksata ilave olarak verildiği hastalarla karşılaştırıldığında % 13,6 (3/22)'ya karşı % 8,3 (2/24) olmuştur.
Psöriyatik artritli hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 376 hastanın 38'inde (%10) saptanmıştır. Eşzamanlı metotreksat verilmeyen hastalarda insidans
%13,5 (24/178 hasta) iken, adalimumabın metotreksata ilave olarak verildiği hastalarda %7 olmuştur (14/198 hasta).
Ankilozan spondilitli hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 204 hastanın 17'sinde (%8,3) saptanmıştır. Eşzamanlı metotreksat verilmeyen hastalarda insidans 16/185 (%8,6) iken, adalimumabın metotreksata ilave olarak verildiği hastalarda 1/19 (%5,3) olmuştur.
Non-radyografik aksiyal spondiloartrit hastalarında, anti-adalimumab antikorları, adalimumab ile devamlı olarak tedavi edilmiş olan 152 hastadan 8'inde (%5,3) saptanmıştır.
Crohn hastalığı olan hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 269 hastanın 7'sinde (%2,6) saptanmış ve ülseratif kolit hastalığı olan hastalarda ise 487 hastanın 19'unda (%3,9) tespit edilmiştir.
Psöriyazisli erişkin hastalarda anti-adalimumab antikorları, adalimumab monoterapisi ile tedavi edilen 920 hastanın 77'sinde (%8,4) saptanmıştır.
Uzun dönem adalimumab monoterapi tedavisi alan, çekilme ve tekrar tedavi çalışmalarına dahil olmuş plak psöriyazisli erişkin hastalarda tekrar tedavi çalışması sonrası anti-adalimumab antikor oranı (11/482 hasta, %2,3), çekilme çalışması öncesi gözlemlenen oran ile (11/590 hasta, %1,9) benzer olmuştur.
Pediyatrik psöriyazisi olan hastalarda, 0,8 mg/kg adalimumab monoterapisi ile tedavi edilen
5/38 hastada (%13) anti-adalimumab antikorları saptanmıştır.
Orta ila şiddetli derecede hidradenitis suppurativa hastalarında, adalimumab ile tedavi edilen 10/99 hastada (%10,1) anti-adalimumab antikorları saptanmıştır.
Adalimumab alan orta ila şiddetli derecede aktif pediyatrik Crohn hastalarında anti- adalimumab antikoru gelişme oranı %3,3 olmuştur.
Enfeksiyöz olmayan erişkin üveit hastaları arasında adalimumab tedavisi uygulanan hastaların
%4,8'inde (12/249) anti-adalimumab antikorlar tespit edilmiştir.
Adalimumab alan orta ila şiddetli derecede aktif pediyatrik ülseratif kolitli hastalarda, anti- adalimumab antikoru gelişme oranı %3 olmuştur.
İmmünojenisite analizleri ürün için spesifik olduğundan bu üründeki antikor oranlarının başka ürünlerle karşılaştırılması uygun değildir.
Pediyatrik popülasyon
Jüvenil idiyopatik artrit (JIA) Poliartiküler jüvenil idiyopatik artrit (JIA)
HUMIRA'nın güvenlilik ve etkililiği, çeşitli JIA başlangıç tiplerinin (en sık olarak romatoid
faktör negatif ya da pozitif poliartrit ve yaygın oligoartrit) görüldüğü aktif poliartiküler ya da poliartiküler seyirli jüvenil idiyopatik artiriti olan çocuklarda yapılan iki çalışmada (JIA I ve II) değerlendirilmiştir.
pJIA I
HUMIRA'nın güvenliliği ve etkililiği poliartiküler jüvenil idiyopatik artrit olan 171 çocukta (4-17 yaş) çok merkezli, randomize, çift-kör, paralel-gruplu bir çalışmada değerlendirilmiştir. Açık etiketli giriş fazında (OL LI) hastalar, MTX (metotreksat) ile tedavi edilen veya edilmeyen (hiç MTX kullanmayan veya çalışmadan en az 2 hafta önce MTX tedavisi sonlandırılmış hastalar) olmak üzere iki gruba alınmışlardır. Hastalarda stabil NSAİİ ve/veya prednison (≤ 0,2 mg/kg/gün veya maksimum 10 mg/gün) kullanımına devam edilmiştir. OL LI fazında, tüm hastalara 16 hafta boyunca iki haftada bir 24 mg/m'den maksimum 40 mg'a kadar HUMIRA uygulanmıştır. Hastaların yaş ve OL LI fazında aldıkları minimum, medyan (ortanca) ve maksimum dozlara göre dağılımı Tablo 24'de sunulmaktadır.
Tablo 24. Hastaların Yaş ve OL LI Fazında Aldıkları Adalimumab Dozuna Göre Dağılımı
Yaş Grubu | Başlangıçtaki hasta sayısı n (%) | Minimum, medyan ve maksimum doz |
4-7 yaş | 31 (18,1) | 10, 20 ve 25 mg |
8-12 yaş | 71 (41,5) | 20, 25 ve 40 mg |
13-17 yaş | 69 (40,4) | 25, 40 ve 40 mg |
Pediyatrik ACR 30 yanıtını16.haftadagösterenhastalar, çift-kör fazda randomize edilmeye
uygunbulunmuşvebuhastalarayamaksimum 40 mg'a kadar HUMIRA 24 mg/m verilmiş ya
da bu hastalar ilave 32 hafta boyunca veya hastalık alevlenene kadar iki haftada bir plasebo almıştır. Hastalık alevlenme kriterleri, 6 Pediyatrik ACR temel kriterinden ≥3'ünde başlangıca göre ≥%30 kötüleşme, ≥2 aktif eklem, ve 6 kriterin en fazla 1'inde > %30 iyileşme olarak tanımlanmıştır. Hastalar 32 hafta sonra veya hastalık alevlenmesinde açık etiketli uzatma fazına kaydedilmek üzere uygun kabul edilmişlerdir.
Tablo 25. JIA Çalışmasında Ped ACR 30 Yanıtları
Kol | MTX | MTX verilmeyen | ||
Faz |
|
| ||
OL-LI 16. hafta |
|
| ||
Ped ACR 30 yanıtı (n/N) | %94,1 (80/85) | %74,4 (64/86) | ||
Etkililik Sonuçları | ||||
Çift kör 32. hafta | HUMIRA / MTX (N = 38) | Plasebo / MTX (N = 37) | HUMIRA (N = 30) | Plasebo (N = 28) |
32. hafta sonunda hastalık alevlenmeleri (n/N) | %36,8 (14/38) | %64,9 (24/37) | %43,3 (13/30) | %71,4 (20/28) |
Hastalık alevlenmesine kadar geçen medyan süre | >32 hafta | 20 hafta | >32 hafta | 14 hafta |
30/50/70 yanıtları
16. haftada yanıt verenler (n=144) arasından, çalışma boyunca HUMIRA alan hastalarda OLE fazında Pediyatrik ACR 30/50/70/90 yanıtları 6 yıla varan bir süre boyunca sürdürülmüştür. Başlangıçta yaş grubu 4-12 olan 11 hasta ile başlangıçta yaş grubu 13-17 olan 8 hasta olmak üzere toplamda 19 hasta tedaviye 6 yıl veya daha uzun süre boyunca devam etmiştir.
Yanıtların genel olarak iyi olduğu ve tek başına HUMIRA tedavisine kıyasla ve metotreksat kombinasyonu ile tedavi edilen hastalarda daha az sayıda antikor geliştiği saptanmıştır. Bu sonuçlara bakarak HUMIRA'nın, metotreksat ile kombinasyon halinde kullanılması ve metotreksat kullanımının uygun olmadığı hastalarda monoterapi olarak kullanılması önerilmektedir (bkz. Bölüm 4.2).
pJIA II
HUMIRA'nın güvenlilik ve etkililiği, orta ila şiddetli derecede aktif poliartiküler JIA olan 32 çocukta (2 ila 4 yaş ya da 4 yaş ve üzeri ve vücut ağırlığı < 15 kg) yapılan açık etiketli, çok merkezli bir çalışmada değerlendirilmiştir. Hastalara en az 24 hafta boyunca subkütan enjeksiyon yoluyla tek doz olarak iki haftada bir maksimum 20 mg'a kadar olmak üzere 24 mg/mg vücut yüzey alanı dozunda HUMIRA uygulanmıştır. Çalışma sırasında hastaların çoğu eşzamanlı MTX kullanmış, daha az sayıda ise kortikosteroid ya da NSAİİ kullanımı bildirilmiştir.
12. ve 24. haftalarda, gözlemlenen veri yaklaşımı kullanılarak elde edilen, Pediyatrik ACR 30
yanıtları sırasıyla %93,5 ve%90olaraksaptanmıştır.12. ve 24. haftalarda Pediyatrik
%83,3/%73,3/%36,7 olarak belirlenmiştir. 24. haftada yanıt veren (Pediyatrik ACR 30) hastalar (n=27/30) arasında, bu dönem boyunca HUMIRA uygulanan hastalarda Pediyatrik ACR 30 yanıtları OLE fazında 60 haftaya varan bir süre boyunca sürdürülmüştür. Toplam olarak 20 hastada tedaviye 60 hafta ya da daha uzun bir süre devam edilmiştir.
Entezit ile ilişkili artrit
HUMIRA'nın güvenliliği ve etkililiği, çok merkezli, randomize, çift-kör bir çalışmada entezit ile ilişkili artriti olan 46 pediyatrik hastada (6 ila 17 yaş arası) değerlendirilmiştir. Hastalar, 12 hafta boyunca iki haftada bir en fazla 40 mg'a kadar 24 mg/m vücut yüzey alanında HUMIRA veya plasebo olacak şekilde randomize edilmiştir. Çift-kör periyodunu takiben açık etiketli periyotta hastalar ilave 192 hafta boyunca her iki haftada bir 24 mg/m vücut yüzey alanında HUMIRA'yı en fazla 40 mg'a kadar subkütan olarak almaya devam etmişlerdir. Primer sonlanım noktası, artritli aktif eklem sayısında (deformasyona veya ağrı ve/veya hassasiyeti olan eklemlerde hareket kaybına bağlı olmayan şişme), başlangıca göre 12. haftadaki değişimdir. Plasebo grubundaki hastalarda ortalama -%11,6 (medyan yüzde değişim -%50) olan bu azalma HUMIRA grubundaki hastalarda ortalama -%62,6'dır (medyan yüzde değişim
-%88,9). 156 hafta boyunca OL döneminde, çalışmaya devam eden HUMIRA grubundaki 31 hastanın 26'sında (%84) aktif artritli eklem sayısındaki düzelme korunmuştur. İstatiksel olarak anlamlı olmamasına rağmen hastaların çoğunluğu entezitli bölge sayısı, hassas eklem sayısı, şişmiş eklem sayısı, Pediyatrik ACR 50 yanıtı ve Pediyatrik ACR 70 yanıtı gibi sekonder sonlanım noktalarında klinik iyileşme göstermiştir.
Pediyatrik plak psöriyazis
HUMIRA'nın etkililiği şiddetli kronik plak psöriyazisli (PGA ≥ 4 ya da >%20 BSA tutulumu ya da >%10 BSA tutulumu ile beraber çok kalın lezyonlar ya da PASI ≥ 20 ya da ≥ 10 ile birlikte klinik olarak ilişkili yüz, genital ya da el/ayak tutulumu ile tanımlandığı üzere) 4 yaş ve üzeri olan ve topikal tedavi ve helioterapi ya da fototerapi ile yetersiz şekilde kontrol edilen
114 pediyatrik hastanın katıldığı randomize, çift-kör, kontrollü bir çalışmada değerlendirilmiştir.
Hastalar iki haftada bir HUMIRA 0,8mg/kg (40 mg'ye kadar), iki haftada bir 0,4 mg/kg (20 mg'ye kadar) ya da haftalık metotreksat 0,1- 0,4 mg/kg (25 mg'ye kadar) almıştır. 16. haftada 0,8 mg/kg HUMIRA'ya randomize edilen hastalar, iki haftada bir 0,4 mg/kg yada metotreksata randomize edilen hastalara göre daha fazla pozitif etkililik yanıtı (PASI 75 gibi) göstermişlerdir.
Tablo 26. 16. Haftada Pediyatrik Plak Psöriyazis Etkililik Sonuçları
| MTX N=37 | İki haftada bir HUMIRA 0.8mg/kg N=38 |
PASI 75 | 12 (%32,4) | 22 (%57,9) |
PGA: Temiz/minimal | 15 (%40,5) | 23 (%60,5) |
PASI 75 ve PGA temiz ya da minimal elde eden hastalar, 36 haftaya kadar tedaviden kesilmiş ve hastalık kontrolü kaybı açısındanizlenmiştir(yaniPGA'nın en az 2 derece kötüleşmesi).
Daha sonra hastalar ek 16 hafta süreyle, iki haftada bir 0,8 mg/kg adalimumab ile tekrar tedavi edilmiş ve tekrar tedavi süresinde gözlemlenen yanıt oranları önceki çift kör dönemle benzer bulunmuştur: %78,9'luk PASI 75 yanıtı (19 hastadan 15'i) ve %52,6'lık PGA temiz ya da minimal (19 hastadan 10'u).
Çalışmanın açık etiket döneminde, PASI 75 ve PGA temiz ya da minimal yanıtları yeni güvenlik bulgusu olmadan ilave 52 haftaya kadar korunmuştur.
Adolesan hidradenitis suppurativa
Hidradenitis suppurativa (HS) hastası olan adolesanlarda çalışma yapılmamıştır. Adolesan hastalardaki HS tedavisi için adalimumab etkililiği erişkin HS hastalarında gösterilen etkililik ve maruziyet-yanıt ilişkisine ve hastalığın seyrinin, patofizyolojisinin ve ilaç etkililiğinin, erişkinlerdekiyle aynı maruziyet düzeylerinde büyük ölçüde benzer olmasına bağlı olarak öngörülmüştür. Adolesan HS popülasyonunda önerilen adalimumab dozunun güvenliliği, erişkinlerde ve benzer veya daha sık dozdaki pediyatrik hastalarda adalimumabın çapraz endikasyon güvenlilik profiline dayanmaktadır (bkz. Bölüm 5.2).
Pediyatrik Crohn hastalığı
HUMIRA, Pediyatrik Crohn Hastalığı Aktivitesi İndeksi (PCDAI) skoru > 30 şeklinde tanımlanan orta ila şiddetli derecede Crohn hastalığı (CD) olan 6-17 (sınırlar dahil) yaşları arasındaki 192 pediyatrik hastada, vücut ağırlığına (< 40 kg ya da ≥ 40 kg) dayanan dozlardaki indüksiyon ve idame tedavisinin etkililiği ve güvenliliğini değerlendirmek üzere tasarlanmış çok merkezli, randomize, çift-kör bir klinik çalışmada değerlendirilmiştir. Hastalar, CD için uygulanan konvansiyonel tedavinin (bir kortikosteroid ve/veya bir immünomodülatör içeren) başarısız olduğu hastalardan oluşmuştur. Hastaların, daha önce uygulanan infliksimab tedavisine verdikleri yanıtın ortadan kalkmış olması ya da infliksimabı tolere edememiş olmaları mümkündür.
Tüm hastalara, başlangıç vücut ağırlıklarına dayanarak belirlenen bir dozda açık etiketli HUMIRA indüksiyon tedavisi uygulanmıştır: ≥ 40 kg olan hastalar için 0. haftada 160 mg ve
2. haftada 80 mg, < 40 kg olan hastalar için sırasıyla 80 mg ve 40 mg'dır.
Hastalar 4. haftada, Tablo 27'de gösterildiği gibi, o andaki vücut ağırlıklarına bağlı olarak 1:1 oranında Düşük Doz ya da Standart Doz idame rejimlerine randomize edilmiştir.
Tablo 27. İdame Rejimi | ||
Hasta Ağırlığı | Düşük Doz | Standart Doz |
< 40 kg | İki haftada bir 10 mg | İki haftada bir 20 mg |
≥ 40 kg | İki haftada bir 20 mg | İki haftada bir 40 mg |
Etkililik sonuçları
Çalışmanın primer sonlanım noktası olarak, 26. haftada PCDAI skorunun ≤ 10 olması şeklinde tanımlanan klinik remisyon kullanılmıştır.
Klinik remisyon ve klinik yanıt (PCDAI skorunun başlangıca göre en az 15 puan düşmesi olarak tanımlanmıştır) oranlarıTablo28'desunulmuştur. Kortikosteroidler ya da
Tablo 28. Pediyatrik CD Çalışması PCDAI Klinik Remisyon ve Yanıt
| Standart Doz İki haftada bir 40/20 mg N = 93 | Düşük Doz İki haftada bir 20/10 mg N = 95 | P değeri* |
26. hafta |
|
|
|
Klinik remisyon | %38,7 | %28,4 | 0,075 |
Klinik yanıt | %59,1 | %48,4 | 0,073 |
52. hafta |
|
|
|
Klinik remisyon | %33,3 | %23,2 | 0,1 |
Klinik yanıt | %41,9 | %28,4 | 0,038 |
* Standart dozun p değerine karşı düşük dozun p değeri karşılaştırması | |||
Tablo 29. Pediyatrik CD Çalışması Kortikosteroidlerin ve İmmünomodülatörlerin
Kesilmesi ve Fistula Remisyonu
| Standart Doz İki haftada bir 40/20 mg | Düşük Doz İki haftada bir 20/10 mg | P değeri |
Kesilen kortikosteroidler | N= 33 | N=38 |
|
26. hafta | %84,8 | %65,8 | 0,066 |
52. hafta | %69,7 | %60,5 | 0,42 |
İmmünomodülatörlerin Kesilmesi |
N=60 |
N=57 |
|
52. hafta | %30 | %29,8 | 0,983 |
Fistula remisyonu | N=15 | N=21 |
|
26. hafta | %46,7 | %38,1 | 0,608 |
52. hafta | %40 | %23,8 | 0,303 |
Her iki tedavi grubu için, başlangıçtan 26. ve 52. haftaya kadar Vücut Kütle İndeksi ve büyüme hızında istatistiksel olarak anlamlı artışlar (düzelme) gözlemlenmiştir.
Her iki tedavi grubunda, yaşam kalitesi parametreleri (IMPACT III dahil) için başlangıca göre istatistiksel ve klinik olarak anlamlı düzelmeler de elde edilmiştir.
Pediyatrik CD çalışmasında yer alan 100 hasta (n = 100), açık etiketli uzun süreli uzatma çalışmasına devam etmiştir. 5 yıllık adalimumab tedavisinden sonra, çalışmaya devam eden 50 hastanın %74'ü (37/50) klinik remisyonda kalmaya devam ederken %92'si (46/50) PCDAI'ya göre klinik yanıtı sürdürmüştür.
Pediyatrik ülseratif kolit
HUMIRA'nın güvenliliği ve etkililiği, orta ila şiddetli ülseratif koliti olan (merkezi olarak okunan endoskopiyle doğrulanan şekilde, 6-12 arasında Mayo skoru ile birlikte endoskopi alt
skorun 2-3 arasında olması)vekonvansiyoneltedaviyeyeterli yanıt vermeyen veya
konvansiyonel tedaviye intoleransı olan 5 ila 17 yaşındaki 93 pediyatrik hastada yürütülen çok merkezli, randomize, çift kör bir çalışmada değerlendirilmiştir. Çalışmadaki hastaların yaklaşık
%16'sı bir önceki anti-TNF tedavisinde başarısız olmuştur. Çalışmaya kayıt sırasında kortikosteroid alan hastaların 4. haftadan sonra kortikosteroid tedavilerini kademeli olarak azaltmalarına izin verilmiştir.
Çalışmanın indüksiyon döneminde 77 hasta, indüksiyon dozları ile 0. haftada ve 1. haftada 2,4
mg/kg (maksimum 160 mg) ve 2. haftada 1,2 mg/kg (maksimum 80 mg) veya 0. haftada 2,4
mg/kg (maksimum 160 mg), 1. haftada plasebo ve 2. haftada 1,2 mg/kg (maksimum 80 mg) HUMIRA ile çift kör tedavi almak üzere 3:2 oranında randomize edilmiştir. Her iki grup 4. haftada ve 6. haftada 0,6 mg/kg (maksimum 40 mg) almıştır. Çalışma tasarımında yapılan bir değişikliğin ardından, indüksiyon dönemine kaydedilen diğer 16 hasta, 0. haftada ve 1. haftada 2,4 mg/kg (maksimum 160 mg) ve 2. haftada 1,2 mg/kg (maksimum 80 mg) indüksiyon dozu HUMIRA ile açık etiketli tedavi koluna alınmıştır.
8. haftada, Kısmi Mayo Skoru'na (KMS; KMS'de ≥2 puanlık azalma ve başlangıca göre ≥ %30 azalma olarak tanımlanır) göre klinik yanıt gösteren 62 hasta, her hafta 0,6 mg/kg (maksimum 40 mg) dozunda veya iki haftada bir 0,6 mg/kg (maksimum 40 mg) HUMIRA dozu ile çift kör idame tedavisi almak üzere eşit şekilde randomize edilmiştir. Çalışma tasarımında yapılan değişiklikten önce, KMS'ye göre klinik yanıt gösteren 12 ek hasta, plasebo almak üzere randomize edilmiş, ancak doğrulayıcı etkililik analizine dahil edilmemiştir.
Hastalık alevlenmesi, en az 3 puanlık (8. haftada KMS 0 ila 2 olan hastalar için), en az 2 puanlık (8. haftada KMS 3 ila 4 olan hastalar için) veya en az 1 puanlık (8. haftada KMS 5 ila 6 olan hastalar için) KMS artışı olarak tanımlanmıştır.
12. haftada veya sonrasında hastalık alevlenmesi kriterlerini karşılayan hastalar, yeniden 2,4 mg/kg (maksimum 160 mg) ya da 0,6 mg/kg (maksimum 40 mg) indüksiyon dozu almak üzere randomize edilmiştir ve sonrasında ilgili idame dozu rejimini almaya devam etmiştir.
Etkililik sonuçları
Çalışmanın ortak primer sonlanım noktaları, 8. haftada KMS'ye göre klinik remisyon (KMS ≤ 2 ve > 1 alt skor bulunmaması olarak tanımlanır) ve 8. haftada KMS'ye göre klinik yanıt elde eden hastalarda 52. haftada TMS'ye (Tam Mayo Skoru) göre klinik remisyondur (Mayo Skoru
≤ 2 ve > 1 alt skor bulunmaması olarak tanımlanır).
Her bir çift kör HUMIRA indüksiyon grubu hastalar için 8. haftada KMS'ye göre klinik
remisyon oranları Tablo 30'da sunulmaktadır.
Tablo 30: 8. Haftada KMS'ye Göre Klinik Remisyon
| HUMIRA N=30 | HUMIRA 0. haftada ve 1. haftada maksimum 160 mg N=47 |
Klinik remisyon | 13/30 (%43,3) | 28/47 (%59,6) |
haftada maksimum 160 mg /
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
40 mg'lık tek bir dozun subkütan uygulanmasından sonra adalimumabın emilim ve dağılımı yavaştır ve doruk serum konsantrasyonlarına uygulamadan yaklaşık 5 gün sonra ulaşılmaktadır. HUMIRA ile yapılan 3 çalışmada, 40 mg'lık tek bir subkütan dozu takiben ortalama mutlak biyoyararlanım %64 olmuştur. 0,25 ile 10 mg/kg arasında değişen tek intravenöz dozdan sonraki konsantrasyonlar, dozla orantılıdır.
0,5 mg / kg (~ 40 mg) dozdan sonra, klirens 11 ila 15 ml/saat arasında değişmiş, dağılım hacmi (V) 5 ila 6 litre arasında değişmiş ve ortalama terminal faz yarı ömrü yaklaşık iki hafta olmuştur. Çeşitli romatoid artritli hastalardaki sinoviyal sıvıdaki adalimumab konsantrasyonları serumdakine göre % 31-96 arasında değişmiştir.
Erişkin romatoid artritli hastaların, 2 haftada bir 40 mg dozunda subkütan HUMIRA uygulamasını takiben ortalama kararlı durum konsantrasyonları eşzamanlı uygulanan metotreksat olmaksızın yaklaşık 5 mikrogram/mL ve eşzamanlı uygulanan metotreksat ile 8-9 mikrogram/mL olmuştur. Kararlı durumda serum adalimumabın çukur düzeyleri iki haftada bir ve haftada bir 20, 40 ve 80 mg'lık subkütan dozu takiben doz ile kabaca orantılı biçimde yükselmiştir.
4-17 yaşları arasındaki poliartiküler jüvenil idiyopatik artrit (JIA) hastalarına iki haftada bir subkütan olarak 24 mg/m (maksimum 40 mg) uygulanmasının ardından kararlı durum serum adalimumab çukur konsantrasyonu (20. haftadan 48 haftaya kadar ölçülen değerler), metotreksat olmadan adalimumab kullanımında 5,6±5,6 mikrogram/mL (%102 CV) ve metotreksat ile birlikte kullanımında 10,9 ± 5,2 mikrogram/mL (%47,7 CV) olmuştur.
24 mg/m dozda adalimumab uygulanan 2-4 yaş arasında veya 4 yaş üzerinde olup vücut ağırlığı < 15 kg olan JIA hastalarında, ortalama kararlı durum serum adalimumab çukur konsantrasyonları, metotreksat olmadan adalimumab kullanımında 6±6,1 mikrogram/mL (%101 CV) ve metotreksat ile birlikte kullanımında 7,9 ± 5,6 mikrogram/mL (%71,2 CV) olmuştur.
6 ila 17 yaş arasındaki entezit ile ilişkili artritli hastalarda subkütan enjeksiyon yoluyla iki haftada bir 24 mg/m (maksimum 40 mg) uygulanması sonrasında ortalama kararlı durum (24. haftada ölçülen değerler) serum adalimumab çukur konsantrasyonları metotreksat olmadan adalimumab kullanımında 8,8±6,6 mikrogram/mL ve metotreksat ile birlikte kullanımında 11,8
± 4,3 mikrogram/mL olmuştur.
Erişkin non-radyografik aksiyal spondiloartrit hastalarında iki haftada bir 40 mg dozunda subkütan olarak uygulanan adalimumab tedavisi sonrasında, 68. haftada ortalama (±SD) çukur kararlı durum konsantrasyonu 8 ± 4,6 mikrogram/mL olmuştur.
Erişkin psöriyazisli hastalarda, iki haftada bir adalimumab 40 mg monoterapisiyle 5 mikrogram/mL olan ortalama kararlı durum çukur konsantrasyonuna ulaşılmıştır
Kronik plak psöriyazis hastalığı olan pediyatrik hastalara 0,8 mg/kg (maksimum 40 mg) subkütan yoldan her hafta ortalama ±SD kararlı durum adalimumab konsantrasyonu yaklaşık olarak 7,4±5,8 mikrogram/mL (% 79) CV) olmuştur.
Erişkin hidradenitis suppurativa hastalarında, 0. haftada 160 mg ve ardından 2. haftada 80 mg HUMIRA dozu ile, 2. hafta ve 4. haftada yaklaşık 7 ila 8 mikrogram/mL adalimumab serum taban konsantrasyonları elde edilmiştir. 12. hafta ile 36. hafta arasındaki ortalama sabit durum taban konsantrasyonu, haftada bir kez adalimumab 40 mg tedavisi sırasında yaklaşık 8 ila 10 mikrogram/mL olarak saptanmıştır.
Adolesan HS hastalarındaki adalimumab maruziyeti popülasyon farmakokinetik modellemesi kullanılarak ve diğer pediyatrik hastalardaki (pediyatrik psoriyazis, jüvenil idiyopatik artrit, pediyatrik Crohn hastalığı ve entezit ile ilişkili artrit) çapraz endikasyon farmakokinetiğine dayalı simülasyonla öngörülmüştür. Tavsiye edilen adolesan HS dozu, iki haftada bir 40 mg'dır. Adalimumaba maruziyet vücut ağırlığından etkilenebileceğinden, yüksek vücut ağırlığına sahip ve yetersiz yanıt alan adolesanlar, erişkinler için tavsiye edilen her hafta 40 mg doz uygulamasından faydalanabilir.
Crohn hastalığı olan hastalarda, 0. haftada 80 mg HUMIRA yükleme dozunu takiben 2. haftada 40 mg HUMIRA dozu ile indüksiyon döneminde ortalama 5,5 mikrogram/mL olan serum adalimumab çukur konsantrasyonlarına ulaşılmıştır. 0. haftada 160 mg HUMIRA yükleme dozunu takiben 2. haftada 80 mg HUMIRA ile indüksiyon döneminde ortalama 12 mikrogram/mL serum adalimumab çukur konsantrasyonlarına ulaşılmıştır. İki haftada bir 40 mg HUMIRA idame dozu alan Crohn hastalarında ortalama 7 mikrogram/mL olan ortalama kararlı durum çukur düzeyleri gözlemlenmiştir.
Orta ila şiddetli derecede Crohn hastalığı olan pediyatrik hastalarda, açık etiketli adalimumab indüksiyon dozu, 40 kg'lık vücut ağırlığı kesme noktasına (cut-off) bağlı olarak 0 ve 2. haftalarda sırasıyla 160/80 ya da 80/40 mg olmuştur. 4. haftada hastalar, vücut ağırlıklarına bağlı olarak 1:1 oranında standart doz (iki haftada bir 40/20 mg) ya da düşük doz (iki haftada bir 20/10 mg) idame tedavisi gruplarına randomize edilmiştir. 4. haftada ulaşılan ortalama (±SD) serum adalimumab çukur konsantrasyonları, ≥ 40 kg olan hastalar (160/80 mg) için 15,7
± 6,6 mikrogram/mL ve < 40 kg olan hastalar (80/40 mg) için 10,6 ± 6,1 mikrogram/mL olarak
belirlenmiştir.
Randomize edildikleri tedavi grubunda kalan hastalar için, 52. haftadaki ortalama (±SD) serum adalimumab çukur konsantrasyonları, standart doz grubu için 9,5±5,6 mikrogram/mL ve düşük doz grubu için 3,5±2,2 mikrogram/mL olarak saptanmıştır. 52 hafta boyunca iki haftada bir adalimumab tedavisi almaya devam eden hastalarda ortalama çukur konsantrasyonları sürdürülmüştür. Dozu haftalık rejimden haftalık rejime yükseltilen hastalar için, 52. haftada adalimumabın ortalama (±SD) serum konsantrasyonları 15,3 ± 11,4 mikrogram/mL (40/20 mg, haftalık) ve 6,7 ± 3,5 mikrogram/mL (20/10 mg, haftalık) olmuştur.
Ülseratif kolit hastalarında, 0. haftada 160 mg HUMIRA yükleme dozunu takiben 2. haftada
80 mg HUMIRA dozu indüksiyon periyodu sırasında yaklaşık 12 mikrogram/mL'lik adalimumab serum çukur konsantrasyonlarına ulaşılmıştır. İki haftada bir HUMIRA 40 mg idame dozu alan ülseratif kolit hastalarında, yaklaşık 8 mikrogram/mL'lik ortalama kararlı durum çukur seviyeleri gözlemlenmiştir.
Pediyatrik ülseratif kolit hastalaraikiha ftadabir0,6mg/kg(ma ksimum 40 mg) vücut ağırlığına
dayalı dozlamanın subkütan uygulamasının ardından 52. haftada ortalama kararlı durum serum adalimumab dip konsantrasyonu 5,01±3,28 -mikrogram/mL olmuştur. Her hafta 0,6 mg/kg (maksimum 40 mg) alan hastalar için 52. haftada ortalama (±SD) kararlı durum serum adalimumab dip konsantrasyonu 15,7±5,6 mikrogram /mL olmuştur.
Erişkin üveit hastalarında, 0. haftada 80 mg HUMIRA yükleme dozu ve onu takiben 1. haftadan itibaren iki haftada bir 40 mg adalimumab yaklaşık 8 ila 10 mikrogram/mL'lik ortalama kararlı durum konsantrasyonları ile sonuçlanmıştır.
Pediyatrik üveit hastalarında adalimumab maruziyeti, diğer pediyatrik hastalar üzerinden (pediyatrik psöriyazis, jüvenil idiyopatik artrit, pediyatrik Crohn hastalığı ve entezit ile ilişkili artrit) popülasyon farmakokinetik modellemesi ve çapraz endikasyon farmakokinetiğine dayalı simülasyon kullanılarak hesaplanmıştır. 6 yaşından küçük çocuklarda yükleme dozu kullanımı ile ilgili herhangi bir klinik maruziyet verisi bulunmamaktadır. Öngörülen maruziyet hesaplamaları, metotreksat yokluğunda yükleme dozunun başlangıçta sistemik maruziyeti arttırabileceğine işaret etmektedir.
Adalimumab maruziyeti ve etkililiği, popülasyon farmakokinetik ve farmakokinetik/ farmakodinamik modelleme ve simülasyonu ile 2 haftada bir 80 mg ile tedavi alan hastalar ile haftada bir 40 mg ile tedavi edilen hastaların (RA, HS, ÜK, CH veya Ps'li erişkin hastalar, adolesan HS'li hastalar ve 40 kg ve üzerindeki pediyatrik CH ve ÜK hastaları dahil) karşılaştırılabilir olduğu görülmüştür.
Pediyatrik popülasyonda maruziyet-yanıt ilişkisi
JIA hastalarında (poliartiküler JIA ve entezit ile ilişkili artrit) yürütülen klinik çalışmaya dayanarak, maruziyet-cevap ilişkisi, plazma konsantrasyonları ile PedACR 50 yanıtı arasında saptanmıştır. Olası en yüksek PedACR 50 yanıt (EC50) olasılığının yarısını oluşturan belirgin adalimumab plazma konsantrasyonu, 3 mikrogram/mL (% 95 GA:1-6 mikrogram/mL)'dir.
Şiddetli kronik plak psöriyazisi olan pediyatrik hastalarda adalimumab konsantrasyonu ve etkililiği arasındaki maruz kalma-cevap ilişkisi sırasıyla PASI 75 ve PGA temiz veya minimal için belirlenmiştir. PASI 75 ve PGA temiz veya minimal, her ikisi de benzer görünen yaklaşık 4,5 mikrogram/mL'lik EC50 ile (sırasıyla %95 GA 0,4-47,6 ve 1,9-10,5) artan adalimumab konsantrasyonları ile artmıştır.
Dağılım:
0,25 ile 10 mg/kg arasında değişen tek intravenöz dozdan sonraki konsantrasyonlar dozla orantılıdır. 0,5 mg/kg (~ 40 mg) dozdan sonra, boşluklar 11 ila 15 mL/saat arasında değişmiş, dağılım hacmi (Vss) 5 ila 6 litre arasında değişmiş ve ortalama terminal faz yarı ömrü yaklaşık iki hafta olmuştur. Çeşitli romatoid artritli hastalardaki sinoviyal sıvıdaki adalimumab konsantrasyonları serumdakine göre % 31-96 arasında değişmiştir.
Biyotransformasyon:
Adalimumabın biyotransformasyonu klinik çalışmalarda incelenmemiştir.
Eliminasyon:
1300'den fazla romatoid artrit hastasından alınan veriler üzerinde yürütülen popülasyon farmakokinetik analizleri, adalimumabın görünür klirensinin vücut ağırlığında artış ile arttığını açığa çıkarmıştır. Kilo farklılıklarına göre uyarlama yapıldıktan sonra cinsiyet ve yaşın, adalimumab klirensini minimal düzeyde etkiledikleri görülmüştür. Serbest adalimumab (anti- adalimumab antikorlarına [AAA] bağlı olmayan) serum seviyelerinin, AAA düzeyleri ölçülebilen hastalarda daha düşük olduğu gözlenmiştir.
Doğrulsallık/Doğrusal olmayan durum:
0,25 ila 10 mg/kg arasında değişen tek intravenöz dozlardan sonra, konsantrasyonlar dozla orantılıydı.
Hastalardaki karakteristik özellikler
Karaciğer/Böbrek yetmezliği:
Karaciğer ya da böbrek yetmezliği olan hastalarda HUMIRA ile çalışma yapılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
5.3. Klinik öncesi güvenlilik verileri
Sinomolgus maymunlarında 0, 30 ve 100 mg/kg dozlarında bir embriyo-fetal gelişimsel toksisite/perinatal gelişim çalışması yapılmış (9-17 maymun/grup) ve fetüslerde adalimumaba bağlı hasara ilişkin bulgular görülmemiştir. Kemirgen TNF'sine karşı sınırlı çapraz reaktivitesi olan bir antikor ve kemirgenlerde nötralizan antikor gelişimi için uygun bir model bulunmadığından adalimumab ile ne karsinojenisite çalışmaları ne de fertilite ve postnatal toksisite için standart değerlendirme çalışmaları gerçekleştirilmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mannitol Polisorbat 80 Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları bulunmadığından bu tıbbi ürün başka tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
Tek bir kullanıma hazır enjektör maksimum 25ºC'ye kadar, oda sıcaklığında 14 gün saklanabilir. Enjektör ışıktan korunmalıdır ve 14 gün içinde kullanılmazsa atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
HUMIRA 40 mg/0,4 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör, piston tıpası (bromobutil lastik) ve iğne kılıfında (termoplastik elastomer) bir iğne ile birlikte tek kullanımlık kullanıma hazır enjektör (Tip I cam) içerir.
2 adet kullanıma hazır enjektör (0,4 mL steril çözelti); her biri 1 alkollü ped ile birlikte blisterde ambalajlanmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
HUMIRA 40 mg/0.4 mL Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör bir doktorun rehberliği ve gözetimi altında kullanılmak içindir. Gerekli uygun tıbbi takibin yapılması ve uygun enjeksiyon tekniğinin hastaya yeterince öğretilmesinden sonra, doktorun karar vermesi durumunda hasta HUMIRA enjeksiyonunu kendi kendine uygulayabilir.
HUMIRA, aynı enjektör veya flakonda başka bir ilaç ile karıştırılmamalıdır.
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€'ne uygun olarak imha edilmelidir.
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| HUMIRA | 8680656080513 | 5,407.68TL |
| HUMİRA | 8699548951558 | |
| HYRIMOZ | 8681428951505 | 10,096.80TL |
| SIMLANDI | 8699514950301 | 10,601.58TL |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
AbbVie Tibbi İlaçlar San. Tic. Ltd. Şti.
| Geri Ödeme Kodu | A16708 |
| Satış Fiyatı | 10836.61 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 10836.61 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680656080414 |
| Etkin Madde | Adalimumab |
| ATC Kodu | L04AB04 |
| Birim Miktar | 40 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 2 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar > Adalimumab |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |