HUMİRA 40 mg/0.8ML enj. ÇÖZ. 1 MODİFİYE ENJEKSİYON Farmakolojik Özellikler
{ Adalimumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Tümör nekröz faktörü alfa (TNF-alfa) inhibitörleri ATC kodu: L04AB04
Etki mekanizması
Adalimumab, Tümör Nekroz Faktörü (TNF)ne spesifik olarak bağlanır ve TNFnin p55 ve p75 hücre yüzey reseptörleriyle etkileşimini bloke ederek bu faktörün biyolojik fonksiyonunu nötralize eder.
Adalimumab, lökosit migrasyonundan sorumlu adezyon moleküllerinin düzeylerinin değişmesi de dahil TNF tarafından indüklenen veya düzenlenen biyolojik yanıtları da modüle eder (ELAM-1, VCAM-1 ve ICAM-1 için IC50 değeri 1-2 X 10-10 M).
Farmakodinamik etkiler
Romatoid artrit hastalarında HUMIRA tedavisinden sonra inflamasyonun akut faz reaktanlannda (C-reaktif protein (CRP) ve eritrosit sedimentasyon hızı (ESR)) ve serum sitokinlerinin (IL-6) düzeylerinde bazal değerlere göre hızlı bir azalma gözlenmiştir. Kıkırdak hasarından sorumlu olan doku yeniden yapılanması sürecine yol açan matriks metalloproteinazların (MMP-1 ve MMP-3) düzeyleri de HUMIRA uygulamasından sonra düşmüştür. HUMIRA ile tedavi edilen hastalarda kronik inflamasyonun hematolojik bulgularında çoğunlukla düzelme meydana gelmiştir.
Crohn hastalarında CRP düzeylerinde de hızlı bir azalma gözlemlenmiştir. Buna ek olarak Crohn hastalığı bulunan hastaların kolonundaki insan lökosit antijeni (HLA-DR) ve miyeloperoksidaz (MPO) gibi enflamasyon belirteçleri ve TNF ekspresyonunda belirgin azalma gözlenmiştir.
Poliartiküler jüvenil idiyopatik artrit hastalarında da CRP düzeylerinde hızlı bir azalma gözlemlenmiştir.
Klinik Çalışmalar Romatoid Artrit
HUMIRA, bütün romatoid artrit klinik çalışmalarında 3000i aşkın hasta üzerinde değerlendirilmiştir. Bazı hastalar 60 ayı geçen sürelerle tedavi edilmiştir. HUMIRAnın romatoid artrit tedavisindeki etkililiği ve güvenliliği beş adet randomize, çift kör ve iyi kontrollü çalışmada değerlendirilmiştir.
I numaralı çalışmada, en az bir tane hastalık modifiye edici anti-romatizmal ilaçla tedavide başarısız kalınan ve haftada 12.5-25 mg (metotreksat intoleransı olanlarda 10 mg) metotreksat tedavisiyle yeterli etki görülmeyen ve metotreksat dozu haftada 10-25 mg arasında sabit seyreden, 18 yaş ve üstü 271 orta veya şiddetli aktif romatoid artrit hastası değerlendirilmiştir.
Hastalara 24 hafta süreyle 2 haftada bir, 20, 40 veya 80 mg HUMIRA ya da plasebo dozları verilmiştir.
II numaralı çalışmada en az bir adet hastalık modifiye edici anti-romatizmal ilaçla tedavide başarısız kalınan, 18 yaş ve üstü 544 orta veya şiddetli aktif romatoid artrit hastası değerlendirilmiştir. Yirmi altı hafta süreyle, 20 veya 40 mg dozunda subkütan HUMIRA enjeksiyonu (alternatif haftalarda plasebo verilmek üzere) iki haftada bir, ya da her hafta uygulanmış ve plasebo grubuna aynı süreyle her hafta plasebo verilmiştir. Başka hiçbir hastalık modifiye edici ilacın kullanılmasına izin verilmemiştir.
III numaralı çalışmada haftada 12.5-25 mg (metotreksat intoleransı olanlarda 10 mg) metotreksat tedavisiyle yeterli etki görülmeyen ve metotreksat dozu haftada 12.5-25 mg arasında sabit seyreden, 18 yaş ve üstü 619 orta veya şiddetli aktif romatoid artrit hastası değerlendirilmiştir. Bu çalışmada üç grup vardır. İlk gruba 52 hafta süreyle her hafta plasebo enjeksiyonu uygulanmıştır. İkinci gruba 52 hafta süreyle her hafta 20 mg HUMIRA uygulanmıştır. Üçüncü gruba dönüşümlü olarak alternatif haftalarda plasebo enjeksiyonları yapılmak üzere iki haftada bir 40 mg HUMIRA uygulanmıştır. Hastalar daha sonra, 60 aya varan süreyle iki haftada bir 40 mg HUMIRA uygulanan açık etiketli bir uzatma fazına kaydedilmiştir.
IV numaralı çalışmada, 18 yaş ve üstü 636 orta veya şiddetli aktif romatoid artrit hastasında primer olarak güvenlilik değerlendirilmiştir. Hastaların ya hiç hastalık modifiye edici anti- romatizmal ilaç kullanmamış olmalarına ya da tedavinin en az 28 gün stabil olması şartıyla, mevcut romatolojik tedavilerini sürdürmelerine izin verilmiştir. Bu tedavi rejimleri metotreksat, leflunomid, hidroksiklorokin, sulfasalazin ve/veya altın tuzlarını içermektedir.
Hastalar 24 hafta süreyle 2 haftada bir 40 mg HUMIRA veya plasebo alacak şekilde randomize edilmiştir.
V numaralı çalışmada, daha önce hiç metotreksat kullanmamış, erken dönemli (ortalama hastalık süresi 9 aydan daha az), orta derecede veya şiddetli aktif romatoid artriti olan 799 erişkin hasta değerlendirilmiştir. Bu çalışmada 104 hafta süreyle iki haftada bir HUMIRA 40 mg ve metotreksat kombinasyon tedavisi ile iki haftada bir HUMIRA 40 mg monoterapisi ve metotreksat monoterapisinin, romatoid artrit bulgu ve semptomları ve eklem hasarındaki progresyon hızını azaltmadaki etkililiği incelenmiştir.
Çalışma I, II ve IIIde primer sonlanım noktası ve Çalışma IVde sekonder sonlanım noktası 24. veya 26. haftalarda ACR 20 yanıtına ulaşan hastaların yüzdesidir. V numaralı çalışmada primer sonlanım noktası, 52. haftada ACR 50 yanıtı elde edilen hastaların yüzdesidir. III ve V numaralı çalışmaların ilave primer sonlanım noktaları 52. haftada hastalık progresyonunun (röntgen sonuçlarıyla saptanan) gerilemesi olmuştur. Çalışma IIIde aynı zamanda yaşam kalitesindeki değişimler de primer sonlanım noktası olmuştur.
ACR Yanıtı
HUMIRA ile tedavi edilen ve ACR 20, 50 ve 70 yanıtlarına ulaşılan hastaların yüzdesi I, II ve
III numaralı çalışmalar arasında tutarlı olmuştur. İki haftada bir 40 mg dozu ile alınan sonuçlar Tablo 2de özetlenmektedir.
Tablo 2: Plasebo Kontrollü Çalışmalarda ACR Yanıtları (Hastaların Yüzdesi)
Yanıt | Çalışma Ia* | Çalışma IIa* | Çalışma IIIa* | ||
Plasebo/MTXc HUMIRAb/MTXc | Plasebo | HUMIRAb | Plasebo/MTXc | HUMIRAb/MTXc | |
n=60 n=63 | n=110 | n=113 | n=200 | n=207 | |
ACR 20 | %13.3 %65.1 | %19.1 | %46.0 | %29.5 | %63.3 |
6 | GD GD | GD | GD | %24.0 | %58.9 |
ay 12 ay ACR 50 | %6.7 %52.4 | %8.2 | %22.1 | %9.5 | %39.1 |
6 | GD GD | GD | GD | %9.5 | %41.5 |
ay 12 ay ACR 70 | %3.3 %23.8 | %1.8 | %12.4 | %2.5 | %20.8 |
6 | GD GD | GD | GD | %4.5 | %23.2 |
ay 12 ay | |||||
aÇalışma Ide 24. haftada, Çalışma IIde 26. haftada ve Çalışma IIIte 24 ve 52. haftalarda b İki haftada bir uygulanan 40 mg HUMIRA
c MTX= Metotreksat
*p<0.01, plaseboya karşı HUMIRA
GD= Geçerli değil
I-IV numaralı çalışmalarda ACR yanıtı kriterlerinin bütün bireysel bileşenleri (duyarlı ve şiş eklemlerin sayısı, doktor ve hasta tarafından yapılan hastalık aktivitesi ve ağrı değerlendirmeleri, iş göremezlik indeksi (HAQ) skorları ve CRP (mg/dl) değerleri), 24. veya 26. haftalarda plaseboya göre düzelme göstermiştir. III numaralı çalışmada bu düzelmeler 52 hafta boyunca devamlı olmuştur. Bunlara ek olarak, açık etiketli uzatma fazında izlenen hastaların çoğunluğunda ACR yamt oranları 104 hafta boyunca devam etmiştir. 207 hastadan 114 hasta, 60 ay boyunca iki haftada bir 40 mg HUMIRA almaya devam etmiştir. Bu hastalar arasında 86, 72 ve 41 hastada, 60. ayda sırasıyla ACR 20/50/70 yanıtları elde edilmiştir.
IV numaralı çalışmada HUMIRA artı standart tedavi ile tedavi edilen hastaların ACR 20 yanıtı, plasebo artı standart tedavi ile tedavi edilen hastalardaki yanıta göre istatistiksel anlamlılık taşıyacak şekilde daha iyiydi (p<0.001).
I-IV numaralı çalışmalarda, HUMIRA ile tedavi edilen hastalarda tedaviye başlandıktan sonra bir-iki hafta gibi erken bir sürede, plasebo ile karşılaştırıldığında istatistiksel olarak anlamlı ACR 20 ve 50 yanıtlarına ulaşılmıştır.
Erken dönemdeki ve daha önce metotreksat kullanmamış romatoid artrit hastalarının yer aldığı V numaralı çalışmada, HUMIRA ve metotreksat ile yapılan kombinasyon tedavisi 52.
haftada, metotreksat monoterapisi ve HUMIRA monoterapisinden daha hızlı ve anlamlı olarak daha büyük ACR yanıtları elde edilmiş ve bu yanıtlar 104. haftada kalıcı olmuştur (Tablo 3e bakınız).
Tablo 3: Çalışma Vte ACR Yanıtları _(hastaların yüzdesi)_
Yanıt | MTX n=257 | HUMIRA n=274 | HUMIRA/MTX n=268 | p değeria | p değerib | p değeric |
ACR 20 | ||||||
52. Hafta | %62.6 | %54.4 | %72.8 | 0.013 | <0.001 | 0.043 |
104. Hafta | %56.0 | %49.3 | %69.4 | 0.002 | <0.001 | 0.140 |
ACR 50 | ||||||
52. Hafta | %45.9 | %41.2 | %61.6 | <0.001 | <0.001 | 0.317 |
104. Hafta | %42.8 | %36.9 | %59.0 | <0.001 | <0.001 | 0.162 |
ACR 70 | ||||||
52. Hafta | %27.2 | %25.9 | %45.5 | <0.001 | <0.001 | 0.656 |
104. Hafta | %28.4 | %28.1 | %46.6 | <0.001 | <0.001 | 0.864 |
a p değeri metotreksat monoterapisi ve HUMIRA/metotreksat kombinasyon tedavisi arasında Mann-Whitney U testi kullanılarak yapılan çiftli kıyaslamadan elde edilmiştir.
b p değeri HUMIRA monoterapisi ve HUMIRA/metotreksat kombinasyon tedavisi arasında Mann-Whitney U testi kullanılarak yapılan çiftli kıyaslamadan elde edilmiştir.
c p değeri HUMIRA monoterapisi ve metotreksat monoterapisi arasında Mann-Whitney U testi kullanılarak yapılan çiftli kıyaslamadan elde edilmiştir.
52. haftada HUMIRA/metotreksat kombinasyon tedavisi gören hastaların %42.9unda klinik remisyon (DAS28<2.6) sağlanırken, bu oran metotreksat monoterapisi alan hastalarda %20.6 ve HUMIRA monoterapisi alan hastalarda %23.4 olmuştur. HUMIRA/metotreksat kombinasyon tedavisi, yakın dönemde tanı konulmuş orta ile şiddetli romatoid artriti olan hastalarda düşük düzeyli hastalık hali sağlanmasında metotreksat ve HUMIRA monoterapilerinden klinik ve istatistik olarak daha üstündür (sırasıyla p <0.001 ve p <0.001).
İki monoterapi kolundaki yanıtlar benzerdir (p=0.447).
Radyografik Yanıt
Hastalardaki ortalama romatoid artrit süresinin yaklaşık 11 yıl olduğu III numaralı çalışmada, yapısal eklem harabiyeti radyografik olarak değerlendirilmiş ve modifiye total Sharp skoru ve bileşenlerinde, erozyon skorunda ve eklem aralığı daralma skorunda değişim şeklinde ifade edilmiştir. HUMIRA/metotreksat hastaları 6 ve 12. aylarda, tek başına metotreksat alan hastalara kıyasla anlamlı olarak daha az radyografik progresyon göstermişlerdir (Tablo 4e bakınız). Açık etiketli uzatma fazına ilişkin bilgiler, bir grup hastada yapısal harabiyetin progresyon hızındaki azalmanın 60 aya kadar süreyle de devam etmekte olduğuna işaret etmektedir. Başlangıçta iki haftada bir 40 mg HUMIRA ile tedavi edilen 207 hastadan 113ü,
5. yılda radyografik olarak değerlendirilmiştir. Bu hastalardan 66 hastada, 0 veya daha az TSS değişimi olarak tanımlandığında, yapısal hasarda ilerleme tespit edilmemiştir.
Tablo 4: Çalışma IIIte 12 Ay Boyunca Radyografik Ortalama Değişimler
Plasebo/MTXa | HUMIRA/MTX iki haftada bir 40 mg | Plasebo/MTX- HUMIRA/MTX (%95 Güven Aralığıb) | p değeri | |
Total Sharp skoru | 2.7 | 0.1 | 2.6 (1.4, 3.8) | <0.001c |
Erozyon skoru | 1.6 | 0.0 | 1.6 (0.9, 2.2) | <0.001 |
EADd skoru | 1.0 | 0.1 | 0.9 (0.3, 1.4) | 0.002 |
a Metotreksat
b Metotreksat ve HUMIRA arasında değişim skorlarındaki farklılıkların %95 güven
aralıkları
c Sıralı analize (rank analysis) dayalı olarak d Eklem Aralığında Daralma
V numaralı çalışmada, yapısal eklem hasarı radyografik olarak değerlendirilmiş ve modifiye total Sharp skorunda değişim şeklinde ifade edilmiştir (Tablo 5e bakınız).
Tablo 5: Çalışma Vte 52. Haftada Radyografik Ortalama Değişimler
MTX n=257 (%95 Güven Aralığı) | HUMIRA n=274 (%95 Güven Aralığı) | HUMIRA/M TX n=268 (%95 Güven Aralığı) | p değeria | p değerib | p değeric | |
Total Sharp skoru | 5.7 (4.2-7.3) | 3.0 (1.7-4.3) | 1.3 (0.5-2.1) | <0.001 | 0.0020 | <0.001 |
Erozyon skoru | 3.7 (2.7-4.7) | 1.7 (1.0-2.4) | 0.8 (0.4-1.2) | <0.001 | 0.0082 | <0.001 |
EAD skoru | 2.0 (1.2-2.8) | 1.3 (0.5-2.1) | 0.5 (0-1.0) | <0.001 | 0.0037 | 0.151 |
a p değeri metotreksat monoterapisi ve HUMIRA/metotreksat kombinasyon tedavisi arasında
Mann-Whitney U testi kullanılarak yapılan çiftli kıyaslamadan elde edilmiştir.
b p değeri HUMIRA monoterapisi ve HUMIRA/metotreksat kombinasyon tedavisi arasında Mann-Whitney U testi kullanılarak yapılan çiftli kıyaslamadan elde edilmiştir.
c p değeri HUMIRA monoterapisi ve metotreksat monoterapisi arasında Mann-Whitney U testi kullanılarak yapılan çiftli kıyaslamadan elde edilmiştir.
52 haftalık ve 104 haftalık tedavilerden sonra progresyon göstermeyen (modifiye total Sharp skorunda başlangıç dönemine göre değişim <0.5) hastaların yüzdesi, HUMIRA/metotreksat kombinasyon tedavisi ile (sırasıyla %63.8 ve %61.2), metotreksat monoterapisi (sırasıyla %37.4 ve %33.5, p<0.001) ve HUMIRA monoterapisine (sırasıyla %50.7, p<0.002 ve %44.5, p<0.001) kıyasla anlamlı derecede daha yüksektir.
Yaşam Kalitesi ve Fiziksel Fonksiyon
Başlangıçtaki dört adet yeterli ve iyi kontrollü çalışmanın hepsinde de, Sağlık Değerlendirme Anketinin (HAQ) iş göremezlik indeksi kullanılarak sağlığa ilişkin yaşam kalitesi ve fiziksel fonksiyon değerlendirilmiştir; bu değerlendirmeler III numaralı çalışmanın 52. haftası için önceden tanımlanmış bir primer sonlanım noktasıdır. Dört çalışmanın tümünde, HUMIRAnın bütün dozları/doz şemaları plasebo ile karşılaştırıldığında 6. ayda HAQ anketinin iş göremezlik indeksinde başlangıç dönemine göre istatistiksel olarak anlamlı bir iyileşme olduğu görülmüş ve aynı durum III numaralı çalışmada 52. haftada da gözlenmiştir.
Kısa Sağlık Araştırma Formu (SF 36) sonuçları dört çalışmanın tümünde, fiziksel bileşen özeti (PCS) skorları istatistiksel anlamlılık taşıyacak şekilde, HUMIRAnın bütün dozları/doz şemaları için bu bulguları desteklemektedir; ağrı ve canlılık alan skorları ise, iki haftada bir 40 mg dozu için istatistiksel olarak anlamlıdır. Kronik hastalık tedavisi fonksiyonel değerlendirme (FACIT) skorlarının değerlendirildiği üç çalışmanın hepsinde de (Çalışma I, III, IV), bu skorlar ile ölçülen yorgunluk istatistiksel olarak anlamlı bir azalma vardır.
III numaralı çalışmada fiziksel fonksiyondaki iyileşmeler, açık etiketli tedavinin 260.
haftasında (60 ay) da devam etmektedir. Yaşam kalitesindeki iyileşmeler 156. haftaya (36 ay) kadar ölçülmüştür ve iyileşmelerin bu döneme kadar kalıcı olduğu görülmüştür.
V numaralı çalışmada HAQ iş göremezlik indeksi ve SF 36nın fiziksel bileşenindeki iyileşmeler, HUMIRA/metotreksat kombinasyon tedavisi ile, metotreksat monoterapisi ve HUMIRA monoterapisine kıyasla 52. haftada daha yüksektir ve bu yükseklik 104. haftada da devam etmektedir (p <0.001).
Poliartiküler jüvenil idiyopatik artrit (JIA)
HUMIRAnın güvenlik ve etkinliği poliartiküler jüvenil idiyopatik artrit olan 171 çocukta (4¬
17 yaş) çok merkezli, randomize, çift-kör, paralel-gruplu bir çalışmada değerlendirildi. Açık etiket giriş fazında (OL LI) hastalar, MTX (metotreksat) ile tedavi edilen veya MTX (metotreksat) ile tedavi edilmeyen şeklinde iki grupta kademelendirildiler. MTX ile tedavi edilmeyenler katmanında bulunan hastalar metotreksata naif veya çalışmadaki ilaç uygulamasından en az iki hafta önce metotreksat tedavisi kesilen hastalardı. Hastalar NSAID ve/veya prednisonun stabil dozlarında (<0.2 mg/kg/gün veya maksimum 10 mg/gün) kaldılar.
OL LI fazında, tüm hastalar 16 hafta boyunca iki haftada bir 24 mg/m2den maksimum 40 mga kadar HUMIRA aldılar. Hastaların yaş ve OL LI fazında aldıkları minimum, ortalama ve maksimum dozlara göre dağılımı Tablo 6da sunulmaktadır.
Tablo 6
Hastaların yaş ve OL LI fazında aldıkları adalimumab dozuna göre dağılımı
Yaş Grubu | Başlangıçtaki hasta sayısı | Minimum, ortalama ve |
n(%) | maksimum doz |
4-7 yaş | 31 (18.1) | 10, 20 ve 25 mg |
8-12 yaş | 71 (41.5) | 20, 25 ve 40 mg |
13-17 yaş | 69 (40.4) | 25, 40 ve 40 mg |
16. haftada Pediatrik ACR 30 yanıtı gösteren hastalar, çift-kör (DB) fazda randomize edilmeye ve hastalık alevleninceye kadar veya ilave bir 32 hafta süresince iki haftada bir plasebo veya 24 mg/m den maksimum 40 mga kadar HUMIRA almaya uygunlardı.Hastalık alevlenme kriteri, 6 Pediatrik ACR temel kriterinden 3 veya 3ten fazlasında başlangıçtan >%30 kötüleşme, >2 aktif eklem, ve 6 kriterin en fazla 1inde >%30 iyileşme olarak tanımlanmıştır. 32 haftadan sonra veya hastalık alevlenmesinde, hastalar açık etiket uzama fazına kaydolmak için uygunlardı.
Tablo 7
JIA Çalışmasında Pediatrik ACR Yanıtları
Katman | MTX olan | MTX olmayan | ||
Faz | ||||
OL-LI 16 hafta | ||||
Pediatrik ACR 30 yanıtı (n/N) | %94.1 (80/85) | %74.4 (64/86) | ||
Çift Kör | HUMIRA (n=38) | Plasebo (n=37) | HUMIRA (n=30) | Plasebo (n=28) |
32. haftanın sonunda hastalık alevlenmesia (n/N) | %36.8 (14/38) | %64.9 (24/37)b | %43.3 (13/30) | %71.4 (20/28)c |
Hastalık alevlenmesine ortalama zaman | >32 hafta | 20 hafta | >32 hafta | 14 hafta |
a 48. haftada Pediatrik ACR 30/50/70 yanıtları plasebo ile tedavi edilen hastalara göre önemli ölçüde daha fazladır.
b p=0.015 c p=0.031
16. haftada yanıt verenler (n=144) arasından, çalışma boyunca HUMIRA alan hastalarda OLE fazında Pediatrik ACR 30/50/70/90 yanıtları iki yıla kadar devam ettirilmiştir.
Tüm yanıtlar genel olarak iyiydi ve tek başına HUMIRA ile tedavi edilen hastalara göre HUMIRA ve metotreksat kombinasyonu ile tedavi edilen hastaların çok azında antikor gelişmiştir. Bu sonuçlar dikkate alındığında, HUMIRA, metotreksat ile kombinasyon halinde kullanılmak üzere ve metotreksat kullanması uygun olmayan hastalarda monoterapi olarak kullanılmak üzere önerilmektedir.
Psöriyatik Artrit
İki haftada bir 40 mg şeklinde uygulanan HUMIRA, Çalışma VI ve Çalışma VII adlarındaki plasebo kontrollü iki çalışmada, orta dereceli ile şiddetli aktif psöriyatik artrit hastalarında incelenmiştir. Yirmi dört hafta süreli Çalışma VIda, non-steroid anti-enflamatuvar ilaç tedavisine yetersiz yanıt veren 313 erişkin hasta tedavi edilmiştir; bunların yaklaşık %50si metotreksat almaktaydı. On iki hafta süreli Çalışma VIIde, DMARD tedavisine yetersiz yanıt
veren 100 hasta tedavi edilmiştir. İki çalışmanın bitiminde, 383 hasta açık etiketli uzatma çalışmasına alınmıştır ve bu çalışmada iki haftada bir 40 mg HUMIRA uygulanmıştır.
İncelenen hasta sayısının küçük olması nedeniyle, HUMIRAnın ankilozan spondilit benzeri psöriyatik artropati hastaları üzerinde gösterdiği etkililiği konusundaki veriler yetersizdir (Tablo 8e bakınız).
Tablo 8: Plasebo Kontrollü Psöriyatik Artrit Çalışmalarda ACR Yanıtları
(Hastaların Yüzdesi)
Çalışma VI | Çalışma VII | |||
Yanıt | Plasebo | HUMIRA | Plasebo | HUMIRA |
N=162 | N=151 | N=49 | N=51 | |
ACR 20 | ||||
12 hafta | %14 | %58*** | %16 | %39* |
24 hafta | %15 | %57*** | GD | GD |
ACR 50 | ||||
12 hafta | %4 | %36*** | %2 | %25*** |
24 hafta | %6 | %39*** | GD | GD |
ACR 70 | ||||
12 hafta | %1 | %20*** | %0 | %14* |
24 hafta | %1 | %23*** | GD | GD |
*** p<0.001, | HUMIRA ve plase | bo arasındaki tüm | karşılaştırmalar için. | |
p<0.05, HUMIRA ve plasebo arasındaki tüm karşılaştırmalar için.
GD= Geçerli değil.
Çalışma Vldaki ACR yanıtları, eş zamanlı metotreksat tedavisi uyugulandığında veya uygulanmaksızın, benzer niteliktedir. Açık etiketli uzatma çalışmasında ACR yanıtları, 136.
haftaya kadar devam etmiştir.
Psöriyatik artrit çalışmalarında radyografik yanıtlar değerlendirilmiştir. Çalışmanın çift kör döneminde, hastalara HUMIRA veya plasebo uygulanırken, başlangıçta ve 24. haftada, ayrıca çalışmanın açık etiketli döneminde, bütün hastalara HUMIRA uygulanırken 48. haftada, el, bilek ve ayak radyografileri çekilmiştir. Distal inter falanjiyal eklemleri içeren (romatoid artrit için kullanılan TSS ile aynı olmayan) Modifiye Total Sharp Skoru (mTSS) kullanılmıştır.
HUMIRA tedavisinin periferal eklem hasarı gelişmesini azaltması, plasebo ile karşılaştırıldığında, başlangıçtan itibaren değişim olarak alındığında, mTSS skoru (ortalama + SD) 0.8±2.5 plasebo grubunda (24. haftada) ve 0.0±1.9 HUMIRA grubunda (48. haftada) olmuştur; (p<0.001).
HUMIRA ile tedavi edilen ve başlangıçtan itibaren 48. haftaya kadar radyografik progresyon olmayan hastalardan (n=102) %84ünde, tedavinin 144 haftalık süresi boyunca radyografik progresyon görülmemiştir.
HUMIRA ile tedavi edilen hastalar 24. haftada, HAQ ve Kısa Sağlık Araştırma Formu (SF 36) olarak değerlendirildiğinde, plasebo uygulanan hastalara göre istatistiksel olarak önemli fiziksel fonksiyon gelişmesi göstermiştir. Fiziksel fonksiyonların iyileşmesi, açık etiketli uzatma çalışmasında 136. haftaya kadar devam etmiştir.
Ankilozan Spondilit
İki haftada bir HUMIRA 40 mg, 24 hafta süreli, randomize çift-kör, plasebo kontrollü iki çalışmada, konvansiyonel tedaviye yeterli yanıt vermeyen aktif ankilozan spondilitli (tüm gruplarda ortalama bazal hastalık aktivitesi skoru [Bath Ankilozan Spondilit Hastalık
Aktivitesi İndeksi (BASDAI)] 6.3 idi) 393 hasta üzerinde değerlendirildi. Yetmiş dokuz hasta (%20.1) eş zamanlı olarak hastalık modifiye edici ilaçlar ile, ve 37 hasta (%9.4) ise yine eş zamanlı olarak glukokortikoidler ile de tedavi edilmiştir. Kör dönemi, hastalara iki haftada bir HUMIRA 40 mg uygulanan, 28 haftaya kadar süren, ilave bir açık etiketli dönem izlemiştir.
12, 16 veya 20. haftalarda ASAS 20 yanıtı elde edilemeyen hastalara (n=215, %54.7), açık etikete erken kaçış prensibiyle iki haftada bir subkütan adalimumab 40 mg uygulanmıştır, ve bu hastalar daha sonra, çift kör istatistik analizlerde yanıt vermeyenler olarak kabul edilmiştir.
315 hastalı daha büyük çalışmada (VIII) sonuçlar, HUMIRA ile tedavi edilen hastaların, ankilozan spondilit bulgu ve semptomlarında plaseboya kıyasla istatistiksel olarak anlamlı derecede daha fazla iyileşme sağladıklarını göstermiştir. Anlamlı yanıt ilk kez 2. haftada gözlenmiştir ve 24. haftaya kadar devam etmiştir (Tablo 9).
Tablo 9: Plasebo Kontrollü AS Çalışmasında (Çalışma VIII) Etkinlik Yanıtları
Bulgu ve Semptomlarda Azalma
Yanıt | Plasebo N=107 | HUMIRA N=208 |
ASASa 20 | ||
2 hafta | %16 | %42*** |
12 hafta | %21 | %58*** |
24 hafta | %19 | %51*** |
ASAS 50 | ||
2 hafta | %3 | %16*** |
12 hafta | %10 | %38*** |
24 hafta | %11 | %35*** |
ASAS 70 | ||
2 hafta | %0 | * * % |
12 hafta | %5 | %23*** |
24 hafta | %8 | %24*** |
BASDAIb 50 | ||
2 hafta | %4 | %20*** |
12 hafta | %16 | %45*** |
24 hafta | %15 | %42*** |
, p<0.001 düzeyinde istatistiksel olarak anlamlı, 2, 12 ve 24. haftalarda HUMIRA ve
plasebo arasındaki tüm karşılaştırmalar için < 0.01 a Ankilozan Spondilit değerlendirmeleri b Bath Ankilozan Spondilit Hastalık Aktivitesi İndeksi
HUMIRA ile tedavi edilen hastalarda gerek SF 36, gerekse Ankilozan Spondilit Yaşam Kalitesi Anketinde (ASQoL) 12. haftada anlamlı olarak daha büyük iyileşme elde edilmiştir ve bu iyileşme 24. haftaya kadar kalıcı olmuştur.
Aktif ankilozan spondiliti olan 82 erişkin hastanın alındığı daha küçük, randomize çift kör, plasebo kontrollü çalışmada (IX) da benzer eğilimler görülmüştür (tamamı istatistiksel yönden anlamlı değildir).
Crohn Hastalığı
Multipl HUMIRA dozlarının güvenliliği ve etkililiği, 1400ü aşkın orta dereceli veya şiddetli Crohn hastalığı bulunan hastada (Crohn Hastalığı Aktivite İndeksi (CDAI) >220 ve <450) randomize, çift-kör, plasebo kontrollü çalışmalarda değerlendirilmiştir. Çalışmaya katılan hastaların 478 (%32)i, endikasyon bölümünde (Bkz. 4.1) belirtilen popülasyona karşılık gelen şiddetli hastalığa sahipti (CDA skoru >300dü ve eşzamanlı olarak kortikosteroid ve/veya immünsupresan kullanmaktaydılar). Aminosalisilatların, kortikosteroidlerin ve/veya immünomodülatör ajanların stabil dozlarda konkomitan kullanımına izin verilmiştir ve hastaların %79u bu ilaçlardan en az birini almaya devam etmiştir.
Klinik remisyonun indüksiyonu (CDAI<150 olarak tanımlanmıştır) iki çalışmada, (M02-403 ve M04-691 çalışmaları) değerlendirilmiştir. M02-403 çalışmasında daha önce TNF antagonisti kullanmamış olan 299 hasta dört tedavi grubundan birine randomize edilmiştir; plasebo grubu 0. haftada ve 2. haftada plasebo almış, 160/80 grubu 0. haftada 160 mg ve 2.
haftada 80 mg HUMIRA almıştır, 80/40 grubu 0. haftada 80 mg ve 2. haftada 40 mg HUMIRA almıştır ve 40/20 grubu 0. haftada 40 mg ve 2. haftada 20 mg HUMIRA almıştır.
M04-691 çalışmasında infliksimaba yanıtı kaybolmuş veya tolere edemeyen 325 hasta, 0.
haftada 160 mg ve 2. haftada 80 mg HUMIRA veya 0. hafta ve 2. haftada plaseboya randomize edilmişlerdir.
Klinik remisyonun idamesi M02-404 çalışmasında değerlendirilmiştir. M02-404 çalışmasında 854 hasta, önce açık etiketli olarak 0. haftada 80 mg HUMIRA ve 2. haftada 40 mg HUMIRA almışlardır. Hastalar daha sonra 4. haftada iki haftada bir 40 mg HUMIRA veya plaseboya randomize edilmişlerdir, toplam çalışma süresi 56 haftadır. 4. haftada klinik yanıt veren hastalar (CR-70=CDAI>70 kadar düşüş) 4. haftada klinik yanıt vermeyenlerden ayrı olarak analiz edilmişlerdir. Sekizinci haftadan sonra kortikosteroidin azaltılarak kesilmesine izin verilmiştir.
Klinik Sonuçlar
M02-403 ve M04-691 çalışmasında hastaların daha önce TNF antagonisti almasına veya infliksimaba maruz kalmasına bakılmaksızın 4. haftada plaseboya kıyasla 160/80 mg HUMIRA ile tedavi edilen gruplarda istatistiksel olarak anlamlı ölçüde daha büyük klinik remisyon indüksiyonu sağlanmıştır (bakınız Tablo 10).
Tablo 10: Klinik Remisyon İndüksiyonu ve Yanıt (Hastaların Yüzdesi)
CLASSIC I: Önceden İnfliksimab Kullanmamış Hastalar | GAIN: Önceden İnfliksimab Kullanmış Hastalar | |||
Plasebo N=74 | HUMIRA 160/80 mg N=76 | Plasebo N=166 | HUMIRA 160/80 mg N=159 | |
Hafta 4 | ||||
Klinik remisyon | %12 | %36* | %7 | * <N % |
Klinik yanıt (CR- 100) | %24 | %50** | %25 | %38** |
Klinik yanıt (CR- 70) | %34 | %58** | %34 | %52** |
Bütün p-değerleri H1 | UMIRA ve plasebonun eşlenik karşılaştırmalarıdır | |||
p<0.001
** p<0.01
M02-404 çalışmasında 4. haftada hastaların %58i (499/854) klinik yanıt vermiş ve primer analizde değerlendirilmiştir. Dördüncü haftada klinik yanıt verenlerden %48i daha önce başka anti-TNF tedaviler uygulanmış olan hastalardır. Dördüncü haftada klinik remisyona giren hastalar içinde, 26 ve 56. haftalarda klinik yanıt veren hastaların oranı, plasebo idame gruplarıyla karşılaştırıldığında, HUMIRA idame gruplarında istatistiksel olarak anlamlı ölçüde daha fazladır. İlaveten, başlangıçta konkomitan kortikosteroid alan hastalar içinde, 26 ve 56. haftalarda plasebo idame grubundaki hastalarla karşılaştırıldığında HUMIRA idame gruplarında en az 90 gün için kortikosteroid kullanımını kesebilen hastaların oranı istatistiksel olarak anlamlı ölçüde daha fazladır (bakınız Tablo 11).
Tablo 11: Klinik Remisyon ve Yanıtın İdamesi _(Hastaların Yüzdesi)_
Plasebo | İki haftada bir 40 mg HUMIRA | Haftada bir 40 mg HUMIRA | |
Hafta 26 | N=170 | N=172 | N=157 |
Klinik remisyon | %17 | %40* | %47* |
Klinik yanıt (CR-100) | %27 | %52* | %52* |
Klinik yanıt (CR-70) | %28 | %54* | %56* |
En az 90 güna steroidsiz remisyonda olan hastalara | %3 (2/66) | %19 (11/58)** | %15 (11/74)** |
Hafta 56 | N=170 | N=172 | N=157 |
Klinik remisyon | %12 | %36* | * % |
Klinik yanıt (CR-100) | 17% | 41%* | 48%* |
Klinik yanıt (CR-70) | 18% | 43%* | 49%* |
En az 90 güna steroidsiz remisyonda olan hastalara | 5% (3/66) | 29% (17/58)* | 20% (15/74)** |
*p<0.001 HUMIRA ve plasebo oranların eşlenik karşılaştırmaları için **p<0.02 HUMIRA ve plasebo oranların eşlenik karşılaştırmaları için a Başlangıçta kortikosteroid alanlardan
56. haftada plasebo ile karşılaştırıldığında hastalığa bağlı hospitalizasyon ve cerrahi HUMIRA ile istatistiksel olarak anlamlı bir şekilde azaltılmıştır.
M02-403 çalışmasında 117/276 hasta ve M04-691 ile M02-404 çalışmalarından 272/777 hasta en az 3 yıl boyunca açık etiketli olarak adalimumab tedavisi ile izlenmiştir. Sırasıyla 88 (%75.2) ve 189 (%69.5) hasta klinik remisyonda kalmaya devam etmiştir. Klinik yanıt (CR- 70) sırasıyla 107 (%91.5) ve 248 (%91.2) hastada devam ettirilmiştir.
135 hastanın dahil olduğu bir endoskopi çalışması (M05-769) HUMIRAnın mukozal iyileşmedeki etkisini göstermiştir. 12. haftada plasebo verilen hastaların %13.1i ile karşılaştırıldığında HUMIRA ile tedavi edilen hastaların %27.4ünde mukozal iyileşme
olmuştur (p=0.056) ve 52. haftada plasebo verilen hastaların %0ı ile karşılaştırıldığında HUMIRA ile tedavi edilen hastaların %24.2sinde mukozal iyileşme olmuştur (p<0.001).
Tablo 11de sunulan klinik remisyon sonuçları, önceki TNF antagonisti maruziyetinden bağımsız olarak oldukça sabit kalmıştır.
Çalışma sırasında remisyona girenlerden 4. haftada yanıt verenler içinde, HUMIRA idame gruplarındaki hastaların remisyonda kalma süresi plasebo idame grubundaki hastalardan anlamlı ölçüde daha uzundur (bakınız Şekil 1).
Şekil 1: CHARM Çalışmasında Klinik Remisyona Ulaşan Hastalar için Klinik Remisyondaki Günler
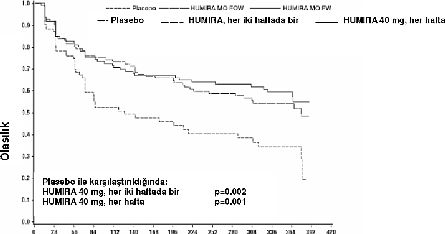
Klinik remisyon günü
Dördüncü haftada yanıt vermeyen hastalar arasından, HUMIRA idame grubunda 12. haftada yanıt verenlerin oranı %43 iken plasebo idame hastalarında bu oran %30 olmuştur. Bu sonuçlar 4. haftada yanıt vermeyen bazı hastaların, sürdürülen idame tedavisinden 12. haftada yarar görebileceğini düşündürmektedir.
On ikinci haftadan sonra sürdürülen tedavi anlamlı ölçüde daha fazla yanıtla sonuçlanmamıştır (bakınız bölüm 4.2).
Hasta Tarafından Bildirilen Sonlanımlar
M02-403 ve M04-691 çalışmalarında plaseboyla karşılaştırıldığında, HUMIRA 160/80 mg tedavisine randomize edilmiş hastalarda 4 haftada hastalığa özgü inflamatuar barsak hastalığı anketinde (IBDQ) istatistiksel olarak anlamlı düzelme olmuştur. Plasebo grubuyla karşılaştırıldığında adalimumab tedavi gruplarında M02-404 çalışmasının 26. ve 56.
haftalarında IBDQ başlangıç skorlarında başlangıca göre istatistiksel olarak anlamlı düzelme görülmüştür.
Psöriyazis
HUMIRAnın güvenliliği ve etkililiği, randomize, çift kör çalışmalarda sistemik terapi veya fototerapi adayları olan kronik plak psöriyazisli erişkin hastalarda (>%10 BSA tutulumu ve Psöriyazis Alan ve Şiddet İndeksi (PASI) >12 veya >10) araştırılmıştır. Psöriyazis Çalışmaları
I ve IIye katılan hastaların %73ü daha önce sistemik terapi veya fototerapi almışlardır.
Psöriyazis Çalışması I (M03-656)de üç tedavi dönemi içinde 1212 hasta değerlendirilmiştir.
A Döneminde, hastalar plasebo veya başlangıç 80 mg HUMIRA dozunu takiben, başlangıç dozundan bir hafta sonra başlanarak iki haftada bir 40 mg HUMIRA almışlardır. On altı haftalık tedaviden sonra en az PASI 75 yanıtına ulaşan hastalar (PASI skorunda başlangıca göre en az %75 düzelme olması) B Dönemine girmişler ve iki haftada bir açık etiketli olarak 40 mg HUMIRA almışlardır. Hafta 33de >PASI 75 yanıtım sürdüren ve A Döneminde orijinal olarak aktif terapiye randomize edilmiş olan hastalar, tekrar randomize edilerek C Döneminde 19 hafta boyunca, iki haftada bir 40 mg HUMIRA tedavisi veya plasebo almışlardır. Bütün tedavi gruplarında ortalama başlangıç PASI skoru 18.9 olup, başlangıç Doktor Global Değerlendirme (PGA) skoru orta dereceli (dahil edilen hastaların %53ü) ile şiddetli (%41) veya çok şiddetli (%6) arasındadır.
Psöriyazis Çalışması II (M04-716)de, 271 hastada metotreksat ve plasebo karşısında HUMIRAnın etkililiği ve güvenliliği karşılaştırılmıştır. Hastalar plasebo, başlangıç dozu olarak MTX 7.5 mg almışlar ve daha sonra doz, hafta 12ye kadar artırılarak 25 mg maksimum doza ulaşmıştır veya 16 hafta boyunca 80 mg HUMIRA başlangıç dozunu takiben iki haftada bir 40 mg (başlangıç dozundan bir hafta sonra başlayarak) verilmiştir.
On altı haftalık tedavinin ötesinde HUMIRA ve MTXı karşılaştıran veriler mevcut değildir.
Hafta 8 ve/veya hafta 12de > PASI 50 yanıtına ulaşan MTX alan hastalarda, doz daha fazla artırılmamıştır. Bütün tedavi gruplarında ortalama bazal PASI skoru 19.7 olup bazal PGA skoru hafif (<%1) ile orta dereceli (%48) ve şiddetli (%46) ile çok şiddetli (%6) arasındadır.
Faz II ve Faz III psöriyazis çalışmalarına katılan hastaların hepsi, ilave en az 108 hafta HUMIRA verilen açık etiketli uzatma çalışmasına (M03-658) dahil olmak için uygundu.
Psöriyazis Çalışmaları I ve IIde, primer sonlanım noktası, başlangıca göre hafta 16da PASI 75 yanıtına ulaşan hastaların oranıdır (Tablo 12 ve 13).
Tablo 12: Ps Çalışma I (REVEAL) 16. Haftadaki Etkinlik Sonuçları
Plasebo N=398 n (%) | iki haftada bir HUMIRA 40 mg N=814 n (%) | |
>PASI 75a | 26 (6.5) | 578 (70.9)b |
PASI 100 | 3 (0.8) | 163 (20.0)b |
PGA: temiz/minimal | 17 (4.3) | 506 (62.2)b |
a PASI 75 yanıtına ulaşan hastaların yüzdesi, merkeze göre ayarlanmış oran olarak hesaplanmıştır b p<0.001, HUMIRAya karşı plasebo
Tablo 13: Ps Çalışma II (CHAMPION) 16. Haftadaki Etkinlik Sonuçları
o laN | MTX N=110 n (%) | iki haftada bir HUMIRA 40 mg N=108 n (%) | |
>PASI 75 | 10 (18.9) | 39 (35.5) | 86 (79.6) a b |
PASI 100 | 1 (1.9) | 8 (7.3) | 18 (16.7) c d |
PGA: Temiz/minimal | 6 (11.3) | 33 (30.0) | 79 (73.1) a b |
a p<0.001 HUMIRAya karşı plasebo b p<0.001 HUMIRAya karşı metotreksat c p<0.01 HUMIRAya karşı plasebo d p<0.05 HUMIRAya karşı metotreksat
Psöriyazis Çalışması Ide, PASI 75 yamtı veren ve hafta 33te plaseboya yeniden randomize edilen hastaların %28ine karşılık HUMIRAya devam edenlerin %5inde, p<0.001, yeterli yanıt kaybı meydana gelmiştir (33. haftadan sonra ve 52. haftada veya daha önce PASI skorunda başlangıca göre <PASI 50 yanıtı ile 33. haftada göre PASI skorunda minimum 6 puanlık artış olması). Plaseboya yeniden randomizasyondan sonra yeterli yanıtı kaybeden hastalardan daha sonra açık etiketli uzatma çalışmasına katılanların %38i (25/66) ve %55inde (36/66) sırasıyla, yeniden tedaviden 12 ve 24 hafta sonra PASI 75 yanıtı elde edilmiştir.
16. hafta ve 33. haftada, PASI 75 yanıtı veren toplam 233 kişi, Psöriyazis Çalışması Ide (M053-656) 52 hafta süreyle sürekli HUMIRA tedavisi görmüştür ve açık etiketli uzatma çalışmasında HUMIRAya devam edilmiştir. 108 haftalık ek bir açık etiketli tedaviden sonra (toplam 160 hafta), bu hastalardaki PASI 75 ve PGA temiz veya minimal yanıt oranları sırasıyla %74.7 ve %59.0dır.
Psöriyazis Çalışması IIde (M04-716) toplam 94 hasta HUMIRA tedavisine randomize edilmiştir ve açık etiketli uzatma çalışmasında HUMIRAya devam edilmiştir. Ek bir 108 haftalık açık etiketli tedaviden sonra (toplam 124 hafta), bu hastalardaki PASI 75 ve PGA temiz veya minimal yanıt oranları sırasıyla %58.1 ve %46.2dir.
Açık etiketli uzatma çalışmasında kesilme ve yeniden tedavi değerlendirmesine toplam 347 stabil yanıt veren hasta katılmıştır. Ortalama nüksetme süresi (PGA orta derecede veya daha kötüye doğru gerileme) yaklaşık 5 aydır. Kesilme periyodu sırasında bu hastaların hiçbiri ribaund yaşamamıştır. Yeniden tedavi periyoduna giren hastaların toplamda %76.5i (218/285), kesilme sırasında hastalığın nüksedip nüksetmemesinden bağımsız olarak, 16 haftalık yeniden tedaviden sonra PGA temiz veya minimal yanıtı vermiştir (Kesilme periyodunda nüksetme görülen veya görülmeyen hastalarda sırasıyla %69.1 [123/178] ve %88.8 [95/107]).
DLQIde (Dermatoloji Yaşam Kalitesi İndeksi) plasebo (Çalışma I ve II) ve MTX (Çalışma II) ile karşılaştırıldığında, başlangıca göre 16. haftada anlamlı düzelmeler olduğu gösterilmiştir. Çalışma Ide, SF 36nın fiziksel ve zihinsel bileşenlerinin toplam skorlarındaki düzelmeler de plaseboya göre anlamlıdır.
Açık etiketli bir uzatma çalışmasında, PASI skorunun %50nin altında olması nedeniyle dozu iki haftada bir 40 mgdan haftada 40 mga yükseltilen hastalar, doz yükseltildikten 12 hafta sonra değerlendirildiğinde, hastaların 93/349unda (%26.6) yeniden PASI 75 yanıtı elde edilmiştir.
İmmünojenite
Anti-adalimumab antikorlarının oluşumu, adalimumabın klerensinde artış, etkinliğinde ise azalma ile ilişkilidir. Anti-adalimumab antikorları varlığıyla advers olaylar arasında görünür bir bağıntı bulunmamaktadır.
RA Çalışmaları I, II ve IIIdeki hastalar, 6dan 12. aya kadar olan dönemde anti-adalimumab antikorları bakımından çok sayıda zaman noktasında test edilmiştir. Pivotal çalışmalarda, anti- adalimumab antikorları, adalimumab ile tedavi edilen 1053 hastanın 58inde (%5.5) saptanmış, plasebo ile bu oran 2/370 (%0.5) olmuştur. Eş zamanlı metotreksat verilmeyen hastalarda insidans %12.4 iken, adalimumabın metotreksata ilave olarak verildiği hastalarda %0.6 idi.
Poliartiküler jüvenil idiyopatik artrit hastalarında, adalimumab ile tedavi edilen 171 hastanın 27sinde (%15.8) adalimumab antikorları saptanmıştır. Eş zamanlı metotreksat verilmeyen hastalarda insidans 22/86 (%25.6) iken, adalimumabın metotreksata ilave olarak verildiği hastalarda 5/85 (%5.9) oldu.
Psöriyatik artritli hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 376 hastanın 38inde (%10) saptanmıştır. Eş zamanlı metotreksat verilmeyen hastalarda insidans %13.5 (24/178 hasta) iken, adalimumabın metotreksata ilave olarak verildiği hastalarda %7 oldu (198 hastadan 14ü).
Ankilozan spondilitli hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 204 hastanın 17sinde (%8.3) saptanmıştır. Eş zamanlı metotreksat verilmeyen hastalarda insidans 16/185 (%8.6) iken, adalimumabın metotreksata ilave olarak verildiği hastalarda 1/19 (%5.3) oldu.
Crohn hastalığı olan hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 269 hastanın 7sinde (%2.6) saptanmıştır.
Psöriyazisli hastalarda anti-adalimumab antikorları, adalimumab ile tedavi edilen 920 hastanın 77sinde (%8.4) saptanmıştır.
5.2. Farmakokinetik özellikler
Emilim: 40 mglık tek bir dozun subkütan uygulanmasından sonra adalimumabın absorpsiyonu ve dağılımı yavaştır ve doruk serum konsantrasyonlarına uygulamadan yaklaşık 5 gün sonra ulaşılmaktadır. HUMIRA ile yapılan 3 çalışmada, 40 mglık tek bir subkütan dozu takiben, ortalama mutlak biyoyararlanımı %64 olmuştur. 0.25 ile 10 mg/kg arasında değişen tek intravenöz dozdan sonraki konsantrasyonlar dozla orantılıdır.
Dağılım: 0.5 mg/kg (~40 mg) dozlarından sonra klerensler tipik olarak 11-15 ml/saat arasında olup dağılım hacmi (Vss) 5-6 litre arasında ve ortalama terminal faz yarı ömrü ortalama iki haftadır. Bir kaç romatoid artritli hastada sinovyal sıvıdaki adalimumab konsantrasyonları, serum konsantrasyonlarına göre %31-96 arasında değişmektedir. Romatoid artritli hastalarda
2 haftada bir 40 mg dozunda subkütan HUMIRA uygulamasını takiben ortalama kararlı durum konsantrasyonları eş zamanlı uygulanan metotreksat olmaksızın yaklaşık 5 mikrogram/ml ve eş zamanlı uygulanan metotreksat ile 8-9 mikrogram/mldır. Kararlı durumda serum adalimumabın çukur düzeyleri 2 haftada bir ve haftada bir 20, 40 ve 80 mglık subkütan dozu takiben doz ile kabaca orantılı biçimde yükselmiştir. Romatoid artrit hastalarının sinovyal sıvılarındaki adalimumab konsantrasyonları serumdaki konsantrasyonun %31-%96sı arasındadır.
Poliartiküler jüvenil idiyopatik artrit (JIA) hastalarına iki haftada bir subkutan olarak 24 mg/m (maksimum 40 mga kadar) uygulanmasının ardından kararlı durum serum adalimumab çukur konsantrasyonu, HUMIRA monoterapide 5.6 ± 5.6 ^g/ml (%102 CV) ve metotreksat ile birlikte 10.9 ± 5.2 ^g/mldir (%47.7 CV).
Crohn hastalığı olan hastalarda, 0. haftada 80 mg HUMIRA yükleme dozunu takiben 2.
haftada 40 mg HUMIRA dozu ile indüksiyon döneminde ortalama 5.5 mikrogram/ml olan serum adalimumab vadi konsantrasyonlarına ulaşılmıştır. 0. haftada 160 mg HUMIRA yükleme dozunu takiben 2. haftada 80 mg HUMIRA ile, indüksiyon döneminde ortalama
12 mikrogram/ml serum adalimumab vadi konsantrasyonlarına ulaşılmıştır. İki haftada bir 40 mg HUMIRA idame dozu alan Crohn hastalığı hastalarında ortalama 7 mikrogram/ml olan ortalama kararlı durum vadi düzeyleri gözlemlenmiştir.
Psöriyazisli hastalarda, iki haftada bir adalimumab 40 mg monoterapisiyle 5 mikrogram/ml olan ortalama kararlı durum vadi konsantrasyonuna ulaşılmıştır.
Metabolizma: Serbest adalimumabın (anti-adalimumab antikorlara (AAA) bağlanmayan) serum düzeylerinin ölçülebilir AAA bulunan hastalarda daha düşük olduğu gözlemlenmiştir.
Itrah: 1300den fazla hastadan alınan veriler üzerinde yürütülen popülasyon farmakokinetik analizleri, adalimumab görünür klirensinin vücut ağırlığında artış ile arttığını açığa çıkarmıştır. Kilo farklılıklarına göre uyarlama yapıldıktan sonra, cinsiyet ve yaşın adalimumab klirensini minimal düzeyde etkiledikleri görülmüştür.
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi veriler tek doz toksisitesi, yinelenen doz toksisitesi ve genotoksisite çalışmalarına dayanarak insanlarda özel bir tehlike olmadığını göstermiştir.
Sinomologus maymunlarında 0, 30 ve 100 mg/kg dozlarında bir embriyo-fetal gelişimsel toksisite/perinatal gelişim çalışması yapılmış (her bir grupta 9-17 maymun vardır) ve fetüslerde adalimumaba bağlı hasara ilişkin bulgular görülmemiştir. Adalimumab ile karsinojenisite çalışmaları, fertilite ve postnatal toksisite için standart değerlendirme çalışmaları yapılmamıştır çünkü kemirgen TNFsine karşı sınırlı çapraz reaktivitesi olan bir antikor ve kemirgenlerde nötralizan antikor gelişimi için uygun bir model bulunmamaktadır.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Abbott Laboratuvarları İthalat İhracat Tic. Ltd. Şti.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699548951572 |
| Etkin Madde | Adalimumab |
| İthal ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |