IDEBEX 90 mg 30 film kaplı tablet Kısa Ürün Bilgisi
{ Idebenon }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
İDEBEX 90 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
İdebenon 90 mg
Yardımcı maddeler
Lesitin (Soya) (E322) 0,35 mg
Gün batımı sarısı (E110) 0,079 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Turuncu renkli, oblong, bikonveks film kaplı tabletler.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
İDEBEX; serebral arteriyoskleroz, inme ve beyin kanaması sonucunda meydana gelen bulgular, yaşlanmaya bağlı bilişsel eksiklik, kronik serebrovasküler hastalık, multi infarkt demans, hafif ve orta şiddette Alzheimer tipi demans ile ilişkili irade zayıflaması, konuşma bozuklukları, hafıza kaybı, dikkat süresinin kısalması, psikomotor aktivite azalması ve depresyon gibi vasküler ve dejeneratif serebral patolojilerin semptomlarının tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/ uygulama sıklığı ve süresi:
Tedavi, Alzheimer hastalığı tanı ve tedavisinde deneyimli bir hekim tarafından başlatılmalı ve kontrol edilmelidir. Tedaviye sadece, hastanın ilaç almasını düzenli olarak izleyecek bir bakıcının varlığında başlanmalıdır. Tanı, güncel rehberler doğrultusunda yapılmalıdır.
İDEBEX tedavisine düşük doz (günde 3 kez bir İDEBEX 45 mg film kaplı tablet) ile başlanmalıdır. Tedavinin yetersiz olduğu durumlarda, hastanın klinik durumuna göre günlük doz günde 3 kez bir İDEBEX 90 mg film kaplı tablete artırılabilir.
İDEBEX için önerilen maksimum günlük doz 360 mg'dır.
Uygulama şekli:
Oral yolla kullanılır.
İDEBEX, yemeklerden sonra bir bardak su ile birlikte alınmalıdır. Tabletler çiğnenmemelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Orta şiddetli böbrek yetmezliği olan hastalarla yapılan çalışmalarda idebenonun inaktif metabolitlerinin plazma konsantrasyonlarında artış gözlenmiştir. Bu nedenle hafif ve orta şiddetli böbrek yetmezliği olan hastalarda İDEBEX dikkatli kullanılmalıdır. Şiddetli böbrek yetmezliği olan hastalarda idebenonun kullanımına ilişkin veri bulunmadığından, bu hastalarda İDEBEX kullanılmamalıdır.
Karaciğer yetmezliği:
Hafif karaciğer yetmezliği olan hastalarla yapılan çalışmalarda, idebenonun inaktif metabolitlerinin plazma konsantrasyonlarında artış gözlenmiştir. Bu nedenle hafif karaciğer yetmezliği olan hastalarda İDEBEX dikkatli kullanılmalıdır. Orta veya şiddetli karaciğer yetmezliği olan hastalarda İDEBEX kullanılmamalıdır.
Pediyatrik popülasyon:
12 yaşın altındaki hastalarda idebenonun güvenliliği ve etkililiği henüz belirlenmemiştir. Mevcut veriler bölüm 5.1 ve 5.2'de açıklanmaktadır, ancak pozoloji hakkında herhangi bir öneri yapılamaz.
Geriyatrik popülasyon:
65 yaşın üzerindeki hastalarda, idebenonun etkililiği ve güvenliliğine dair yeterli veri mevcut değildir. Bu nedenle, İDEBEX 65 yaşın üzerindeki hastalarda dikkatli kullanılmalıdır.
4.3. Kontrendikasyonlar
İDEBEX, idebenon'a ya da İDEBEX'in içeriğindeki yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.
İDEBEX lesitin (soya yağı) ihtiva eder. Fıstık ya da soyaya alerjisi olan hastalar, bu tıbbi ürünü kullanmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
Alerjik reaksiyon ve hipersensitivite reaksiyonları konusunda dikkatli olunmalıdır. Muhtemel semptomlar nefes almada zorluk, yutkunmada zorluk, şişlik, göğüste sıkışma, deri döküntüleri ve ürtikerdir.
Dozaj ve kullanım genellikle durumun ciddiyetine, hastanın tıbbi geçmişine ve mevcut sağlık durumuna bağlıdır.
Doktor hastanın aşağıdaki durumları hakkında bilgi sahibi olmalıdır:
Hamilelik veya emzirme,
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İn vitro çalışmalardan elde edilen veriler idebenonun ve metaboliti QS10'un, klinik olarak ilgili idebenon veya QS10 konsantrasyonlarında, sitokrom P450 izoformları CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6 ve 3A4'ün sistemik inhibisyonunu kullanmadığını göstermiştir. Ayrıca CYP1A2, CYP2B6 veya CYP3A4'ün herhangi bir indüksiyonu gözlenmemiştir.
İn vivo idebenon hafif bir CYP3A4 inhibitörüdür. 32 sağlıklı gönüllüde yapılan bir ilaç etkileşim çalışmasından elde edilen veriler, günde üç kez 300 mg oral idebenon uygulamasının ilk gününde bir CYP3A4 substratı olan midazolamın metabolizmasını, her iki ilaç birlikte uygulandığında değişmediğini göstermektedir. Midazolam günde üç kez 300 mg idebenon ile kombinasyon olarak uygulandığında, tekrarlanan uygulamadan sonra, midazolamın Cve EAA değerleri sırasıyla %28 ve %34 artmıştır. Bu nedenle alfentanil, astemizol, terfenadin, sisaprid, siklosporin, fentanil, pimozid, kinidin, sirolimus, takrolimus veya ergot alkaloidleri (ergotamin, dihidroergotamin) gibi dar bir terapötik indekse sahip olduğu bilinen CYP3A4 substratları idebenon kullanan hastalarda dikkatle uygulanmalıdır.
İdebenon; dabigatran eteksilat, digoksin veya aliskirenin olası maruziyet artışlarıyla P- glikoproteini (p-gp) inhibe edebilir. İdebenon, in vitro olarak, p-gp için bir substrat değildir.
Özel popülasyonlara ilişkin ek bilgiler
İDEBEX için özel popülasyonlara ilişkin herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
İDEBEX için pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadırlar.
Gebelik dönemi
İDEBEX ile ilgili gebe kadınlarda kullanıma ilişkin yeterli veri mevcut değildir. Gebe kadınlarda idebenonun güvenliği belirlenmemiştir. Hayvan çalışmaları, üreme toksisitesi ile ilgili doğrudan veya dolaylı zararlı etkileri göstermemektedir. İdebenon, sadece terapötik etkinin yararının herhangi bir potansiyel riske ağır bastığı düşünülürse, hamile kadınlara veya çocuk doğurma potansiyeli bulunan kadınlara uygulanmalıdır.
Laktasyon dönemi
Hayvanlar üzerinde yapılan çalışmalar, idebenonun anne sütüne geçtiğini göstermektedir. Fareler üzerinde yürütülen çalışmalar idebenonun anne sütüne geçtiğini ortaya koyduğundan, ilacın anne açısından önemi dikkate alınarak emzirmenin ya da ilaçla tedavinin kesilmesine karar verilmelidir.
Emziren kadınlar İDEBEX kullanmamalıdır.
Üreme yeteneği/Fertilite
İdebenonun insan fertilitesi üzerindeki etkisine ilişkin veri mevcut değildir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Orta ve şiddetli Alzheimer hastalığı genellikle araba kullanma performansının veya makine kullanma yeteneğinin azalmasına neden olur. Bununla birlikte, İDEBEX'in araç ve makine kullanma yeteneği üzerinde etkisi yoktur veya ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
İdebenon için en sık bildirilen advers reaksiyonlar hafif ve orta şiddette diyare (genellikle tedavinin kesilmesini gerektirmez), nazofarenjit, öksürük ve sırt ağrısıdır.
Advers etkiler sistem-organ sınıfına göre aşağıdaki sıklık kategorileri kullanılarak listelenmektedir:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar Çok yaygın: Nazofarenjit Bilinmiyor: Bronşit
Kan ve lenf sistemi hastalıkları
Bilinmiyor: Agranülositoz, anemi, lökositopeni, trombositopeni, nötropeni
Bağışıklık sistemi hastalıkları
Bilinmiyor: Hipersensitivite reaksiyonları
Metabolizma ve beslenme hastalıkları
Bilinmiyor: Kolesterol seviyesinde artış, gliserit seviyesinde artış
Sinir sistemi hastalıkları
Bilinmiyor: Nöbet, deliryum, halüsinasyonlar, ajitasyon, diskinezi, hiperkinezi, poriomani, baş dönmesi, baş ağrısı, huzursuzluk, sersemlik (stupor)
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın: Öksürük
Gastrointestinal hastalıklar
Yaygın: Diyare
Bilinmiyor: Bulantı, kusma, anoreksi, dispepsi
Hepato-biliyer hastalıklar
Bilinmiyor: Aspartat aminotransferaz seviyesinde artış, alanin aminotransferaz seviyesinde artış, alkalin fosfataz seviyesinde artış, laktat dehidrojenaz seviyesinde artış, gamma-glutamil transferaz seviyesinde artış, bilirubin seviyesinde artış, kan üre azotu seviyesinde artış, hepatit
Deri ve deri altı doku hastalıkları
Bilinmiyor: Döküntü, pruritus
Kas-iskelet sistemi, bağ doku ve kemik hastalıkları
Yaygın: Sırt ağrısı Bilinmiyor: Ekstremite ağrısı
Böbrek ve idrar yolu hastalıkları
Bilinmiyor: Azotemi, kromatüri
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Bilinmiyor: Halsizlik (malez)
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
İDEBEX'in doz aşımı sonucunda meydana gelen herhangi bir toksisite vakası bildirilmemiştir.
Klinik çalışmalarda, bölüm 4.8'de bildirilenle uyumlu bir güvenlik profili gösteren 2250 mg / güne kadar dozlar uygulanmıştır.
İDEBEX'in spesifik bir antidotu bulunmamaktadır. Böyle bir durumda hastaya destekleyici tedavi verilmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer Psikostimülan ve Nootropikler ATC kodu: N06BX13
Etki mekanizması
Farklı bir etki mekanizmasına sahip olan idebenon, Alzheimer tedavisinde kullanılan potansiyel sitoprotektif bir ilaçtır. İdebenon gibi antioksidan ve serbest radikal etkili bileşikler, β-amiloid'e bağlı nörotoksisiteyi ve bilişsel fonksiyondaki bozulmaları düzeltebilir. Lipid peroksidasyonunu engelleme yeteneği nedeniyle idebenon, hücre membranlarını ve mitokondriyi oksidatif hasardan korur. Antioksidan özelliği ile merkezi sinir sistemini serebral iskemi ve sinir hasarına karşı korur. İdebenon aynı zamanda iskemi durumunda ATP formasyonunu koruyarak ETC (elektron transport zinciri) ile etkileşime girer. Bu bileşik aynı zamanda Alzheimer'da ve diğer nörodejeneratif hastalıkların tedavisinde önemli olan sinir gelişim faktörünü stimüle eder. Yapılan in vitro ve in vivo çalışmalar idebenonun iskemi nedeniyle oluşan sinir hücre hasarını azalttığını, nörotransimitter bozuklukları ve/veya serebral metabolizmayı düzelttiğini ve öğrenmeyi kolaylaştırdığını göstermektedir. Bunlara ek olarak, hafıza, dikkat toplanması ile oriyantasyon üzerine etkili olduğu ve hastalığın ilerlemesini yavaşlattığı gösterilmiştir.
Klinik etkililik ve güvenlilik
Prospektif, randomize, çift kör, plasebo kontrollü, çok merkezli bir çalışmada, hafif ila orta derecede Alzheimer tipi demansı (DAT) olan hastalarda idebenonun iki dozu ile çalışılmıştır. 300 hasta 6 ay boyunca plasebo (n=100), günde 3 kez 30 mg idebenon (n=100) veya günde 3 kez 90 mg idebenon (n=100) almak üzere randomize edilmiştir. 6 aylık tedaviden sonra günde 3 kez 90 mg idebenon alan grubun ADAS-total ve ADAS-Cog değişkenlerinde istatistiksel olarak anlamlı düzelmeler gözlenmiştir.
Tablo 1: Başlangıçtaki ADAS total skor değerine göre seçilen hastalar. Başlangıçtan 6. aya kadarki ADAS skorundaki ortalama değişim (parantez içindekiler plasebo düzeltilmiş değişimler); | ||||
ADAS Total'deki ciddiyet | Her bir gruptaki kişi sayısı (Pla/30/90) |
Plasebo |
30 mg |
90 mg |
ADAS-Cog | 40/43/43 | -5,3 | -5,8 (-0,5) | -7,8 (-2,5) |
≥20 | 30/27/25 | -5,7 | -6,6 (-0,9) | -9,1 (-3,5) |
≥30 | 20/19/77 | -6,8 | -8,0 (-1,3) | -10,7 (-4) |
≥40 | 13/10/9 | -7,9 | -11,9 (-4) | -14,8 (-6,9) |
≥50 |
|
|
|
|
ADAS-NonCog |
|
|
|
|
≥20 | 40/43/43 | -1,8 | -2,2 (-0,4) | -3,3 (-1,5) |
≥30 | 30/27/25 | -1,7 | -2,7 (-1) | -4,2 (-2,5) |
≥40 | 20/19/77 | -2,4 | -3,3 (-1) | -4,9 (-2,5) |
≥50 | 13/10/9 | -3,5 | -4,0 (-0,5) | -7,3 (-3,3) |
Plasebo-düzeltilmiş değişimler yuvarlanmayan değerlerden hesaplanmıştır. | ||||
CGI-Düzelmesi, ADAS-Cog ve ADAS-nonCog ölçümleri için yapılan analizde günde 3 kez 90 mg alınan idebenonun, plaseboya göre anlamlı oranda üstünlük sağladığı görülmüştür.
Tablo 2: 6 aylık tedaviden sonraki iyileşme oranları Tedaviye yanıt verenlerin toplam hasta sayısına oranı ve yanıt verenlerin yüzdesi | |||||||
Değişkenler | Plasebo |
| 30 mg |
| 90 mg |
| P değeri |
| Oran | % | Oran | % | Oran | % | |
Tüm hastalar |
|
|
|
|
|
|
|
ADAS-Cog | 34/83 | 41 | 35/79 | 44,3 | 47/85 | 55,3 | 0,031 |
ADAS-Noncog | 11/83 | 13,3 | 20/79 | 25,3 | 21/85 | 24,7 | 0,035 |
CGI-İyileşme | 56/83 | 67,5 | 57/79 | 72,2 | 71/87 | 81,6 | 0,018 |
ADAS-Total≥20 |
|
|
|
|
|
|
|
ADAS-Cog | 24/48 | 50 | 29/51 | 56,9 | 38/51 | 74,5 | 0,006 |
ADAS-Noncog | 9/48 | 18,8 | 16/51 | 31,4 | 20/51 | 39,2 | 0,014 |
CGI-İyileşme | 23/48 | 47,9 | 34/51 | 66,7 | 46/52 | 88,5 | 0,000 |
İlişkili iyileşme: ADAS-Cog; en az -6 puan; ADAS-nonCog: en az -4 puan; CGI-İyileşme: | |||||||
'az' ila “çok fazlaâ€. Tedaviler arasındaki P değerleri Mantel – Haenteszel x testten hesaplanmıştır. | |||||||
90 mg İdebenon ile tedaviye yanıt veren hastaların %'lik oranı plaseboya kıyasla daha üstün bulunmuştur.
Yapılan tüm değerlendirmelerde, güvenlilik ile ilgili olumsuz bir bulguya rastlanmamıştır. Bu çalışmanın sonuçları, DAT hastalarının tedavisinde idebenonun etkili ve güvenli olduğunu göstermiştir.
Hafif ila orta derecede Alzheimer tipi demansı (DAT) olan hastalarda, idebenonun etkililik ve güvenliliğinin değerlendirildiği 2 yıllık, prospektif, randomize, çift kör, çok merkezli ve 3 paralel gruptan oluşan bir çalışma gerçekleştirilmiştir. Toplam 450 hasta, 12 ay boyunca plasebo ve ardışık 12 ay boyunca da günde 3 kez 90 mg idebenon almak (n=153) veya 24 ay boyunca günde 3 kez 90 mg idebenon almak (n=148) veya 24 ay boyunca günde 3 kez 120 mg idebenon almak (n=149) üzere randomize edilmiştir. Plasebonun kullanıldığı kontrol periyodu boyunca (tedavinin ilk yılı) idebenon, birincil etkililik değişkeni ADAS-total ve tüm ikincil etkililik değişkenlerinde istatistiksel olarak anlamlı, doza bağımlı düzelmeler meydana getirmiştir. Tedavinin ikinci yılı boyunca etkililiğin kaybolduğuna dair bir bulgu gözlenmemekle birlikte, 12. ayda yapılan vizitlere göre ikinci yılda çoğu etkililik değişkenlerinin daha da düzeldiği saptanmıştır. Ayrıca tedavinin ikinci yılı boyunca, açık bir şekilde doza bağlı olarak etkililiğin (plasebo/90 mg idebenon < 90 mg idebenon < 120 mg idebenon) arttığı gözlenmiştir.
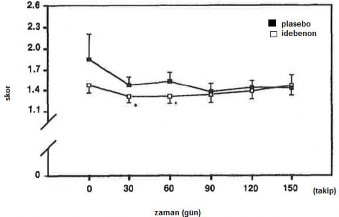
Hafif ila orta şiddetli vasküler kökenli mental bozukluğu olan 108 yaşlı hasta ile yapılan randomize, çift kör, plasebo kontrollü, çok merkezli bir çalışmada hastalar 120 gün boyunca, günde 2 kez 45 mg oral idebenon tedavisi almışlardır. 120 gün sonra ilaç tedavisi kesilmiş ve 30 gün boyunca hasta takip edilmiştir. Çalışmanın 90. gününde İdebenon grubunda hastanın modunda, davranışlarında, uykusunda ve hafızasında belirgin bir iyileşme gözlenirken, plasebo grubunda ise kötüleme gözlenmiştir. Çalışmanın sonunda (150. gün) İdebenon alan hastaların
%50'sinde global durumunda iyileşme gözlenirken, geri kalan %50'sinde ise herhangi bir gerileme gözlenmemiştir. Plasebo alan hastaların %66'sının durumu kötüleşmiş ya da aynı kalmıştır.
| Şekil 1 Demans için GBS derecelendirme skalası: emosyonel bozulma: veriler ortalama ± Standart Hata Ortalaması. *t0 vs t30 ve t0 vs t60 idebenon, P<0,006 |
Tedavi sonrası yapılan değerlendirmede, idebenonun multipl infarktlı demans tedavisinde etkili olduğu kanıtlanmıştır. Hafıza, dikkat ve bilişsel fonksiyonlardaki iyileşmeleri gösteren testlerde, plaseboya göre idebenon tedavisiyle, anlamlı oranda düzelmiş skorlar elde edilmiştir. İlacın iyi tolere edildiği ve multipl infarktlı demansı olan hastalarda etkili olduğu bildirilmiştir. Tedaviden önce veya sonra, hastaların laboratuar değerlerinde herhangi bir değişiklik gözlenmemiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
İdebenon, oral uygulamanın ardından gastrointestinal sistemden hızlı bir şekilde emilir. İdebenon, sağlıklı gönüllülerde 30-180 mg tek doz uygulanmasının ardından 0,9-2,1 saat içerisinde 327-1.957 µg/L maksimum plazma konsantrasyonlarına (Cmaks) ulaşır. İdebenon dozu 30 ile 180 mg aralığında artırıldığında, plazma konsantrasyonları da doğrusal olarak artar. Sağlıklı gönüllülerde idebenonun tekrarlı doz uygulamasının ardından (10 gün boyunca günde 2 kez 45 mg ya da 7 gün boyunca günde 3 kez 30-120 mg) ölçülen Cmaks değerleri (369-1.896 µg/L aralığında) ile tek doz uygulanmasının ardından ölçülen değerler arasında anlamlı bir fark yoktur. Bu da tekrarlı doz uygulaması boyunca kayda değer ilaç birikiminin olmadığını göstermektedir.
İdebenonun absorbsiyonu, tokluk durumunda açlık durumuna göre daha yüksektir. Kahvaltıdan önce ya da sonra tek doz 100 mg idebenon alan 3 sağlıklı gönüllüde Cmaks değerleri açlık durumunda 439 µg/L ve tokluk durumunda 787 µg/L ve eğri altındaki alan (EAA) değerleri açlık durumunda 2.795 µg/L.s ve tokluk durumunda 4.158 µg/L.s olarak bulunmuştur.
Dağılım:
Deneysel veriler idebenonun kan-beyin bariyerini geçtiğini ve serebral dokuda önemli konsantrasyonlarda dağıldığını göstermiştir. Oral uygulamayı takiben, gözün aköz hümorunda farmakolojik olarak ilgili idebenon konsantrasyonları saptanabilir.
Uzun süreler boyunca kullanılması durumunda dahi idebenon birikme eğilimi göstermemektedir. Deneysel veriler idebenonun hematoensefalik bariyeri geçtiğini ve beyin dokusu seviyesinde anlamlı konsantrasyonlar halinde dağıldığını ortaya koymuştur.
Biyotransformasyon:
Metabolizma; yan zincirin oksidatif kısalması, kinon halkasının indirgenmesi ve glukuronidlere ve sülfatlara konjügasyon yoluyla meydana gelir. İdebenon, idebenon konjugatlarını (glukuronidler ve sülfatlar [IDE-C]) ve faz I metabolitleri QS10, QS6 ve QS4'ü ve bunların ilişkili faz II metabolitlerini (glukuronidler ve sülfatlar [QS10 + QS10-C, QS6 + QS6-C, QS4
+ QS4-C]) oluşturan yüksek bir ilk geçiş metabolizması gösterir. Plazmada ana metabolitler IDE-C ve QS4 + QS4-C'dir.
Eliminasyon:
İdebenonun renal klirensi güçlüdür. Sağlıklı gönüllülere radyoaktif olarak işaretlenmiş tek doz 90 mg idebenon uygulanmasının ardından 7 gün sonra, % 79,8'inin (ilk 8 saatte %60,2'si) idrarla; % 7,1'inin dışkı ile atıldığı gözlenmiştir.
Sağlıklı gönüllülerde tek doz idebenonun terminal plazma eliminasyon yarılanma ömrü (t), 2,6 ila 21,7 saat arasında değişmektedir. Bu çeşitliliğin, çalışmalar arasındaki metodoloji farlılıklardan kaynaklandığı düşünülmektedir. Tekrarlı uygulamalardan sonra idebenonun vücutta birikmediği görüldüğünden, bazı bireylerde bildirilen yüksek tdeğerleri muhtemelen
klinik olarak anlamlı değildir.
Doğrusallık/doğrusal olmayan durum:
Sağlıklı erişkin erkek gönüllülerle yapılan bir çalışmada oral yolla 1.050 mg'a kadar tek doz ve
2.250 mg'a kadar tekrarlı dozlarda alınan idebenonun doğrusal farmakokinetik özellik gösterdiği gözlenmiştir.
5.3. Klinik öncesi güvenlilik verileri
Geleneksel güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite, karsinojenik potansiyel, üreme ve gelişme toksisitesi çalışmalarına dayanan klinik öncesi çalışmalar idebenonun insanlara yönelik özel bir tehlike ortaya koymadığını göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Povidon
Kolloidal silikon dioksit Kroskarmelloz sodyum Mannitol SD 200 Magnezyum stearat Sodyum lauril sülfat
Opadry II 85G23634 Orange*
* içeriği olarak;
Polivinil alkol
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
30 ve 90 film kaplı tablet, PVC-PVDC/Alüminyum blister ambalaj içerisinde kullanma talimatıyla beraber karton kutuda ambalajlanmıştır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
İLAÇ GENEL BİLGİLERİ
Neutec İlaç San. Tic.A.Ş.
| Geri Ödeme Kodu | A14778 |
| Satış Fiyatı | 763.88 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 763.88 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680881093593 |
| Etkin Madde | Idebenon |
| ATC Kodu | N06BX13 |
| Birim Miktar | 90 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Sinir Sistemi > Psikostimülan İlaçlar |
| Yerli ve Beşeri bir ilaçdır. |