IMATIS 100 mg 120 film tablet Klinik Özellikler
{ Imatinib }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
İMATİS'in endikasyonları:
Yeni tanı konmuş Philadelphia kromozomu pozitif kronik faz kronik miyeloid lösemi (KML) hastalarında,
4.2. Pozoloji ve uygulama şekli
Tedavi, hematolojik malign hastalıklar ve malign sarkomlar bulunan hastaların tedavisinde deneyimi olan bir doktor tarafından başlatılmalıdır.
Tedavi, hasta yarar sağladığı sürece devam ettirilmelidir.
Kronik Miyeloid Lösemide (KML) Dozaj
İMATİS'in önerilen dozu, kronik fazdaki erişkin KML hastaları için 400 mg/gündür. Kronik faz KML, aşağıdaki tüm kriterlerin karşılandığı durum olarak tanımlanır: kanda ve kemik iliğinde blast < %15, periferik kan bazofilleri < %20, trombosit > 100 x 10/L. İMATİS'in önerilen dozu, akselere fazdaki erişkin hastalar için 600 mg/gündür. Akselere faz, aşağıdakilerden herhangi birinin varlığı olarak tanımlanır: kanda ve kemik iliğinde blast ≥
%15 fakat < %30, kanda ve kemik iliğinde blast artı promiyelosit ≥ %30 (< %30 blasta neden olur) , periferik kan bazofilleri ≥ %20, trombosit < 100 x 10/L (tedaviden ilişkisiz olarak). İMATİS'in önerilen dozu, blast krizindeki erişkin hastalar için 600 mg/gündür. Blast krizi, kanda veya kemik iliğinde ~ %30 blast ya da hepatosplenomegali harici bir ekstramedüller hastalık olarak tanımlanır.
İlaca bağlı oluşan ciddi advers etki ve ağır lösemiyle ilişkili nötropeni veya trombositopeni gelişmemiş olması koşuluyla, hastalığın ilerlemesi (herhangi bir zamanda), en az 3 aylık tedaviden sonra tatmin edici bir hematolojik yanıt alınamaması, 12 aylık tedaviye rağmen sitogenetik cevap elde edilmemesi veya daha önce elde edilmiş olan hematolojik ve/veya sitogenetik yanıtın kaybolması gibi durumlarda; kronik fazda hastalık bulunanlarda dozun 400 mg'dan 600 mg'a yükseltilmesi, ya da hızlanmış faz veya blast krizi bulunan hastalarda da dozun 600 mg'dan maksimum 800 mg günlük doza yükseltilmesi düşünülebilir.
Philadelphia kromozomu pozitif, akut lenfoblastik lösemide (Ph+ ALL) dozaj
Ph+ ALL hastalarında önerilen İMATİS dozajı, remisyon indüksiyon kemoterapi şemaları çerçevesinde belirlenir.
Hipereozinofilik sendrom ve sistemik mastositozda dozaj
Yetişkin hipereozinofilik sendrom ve sistemik mastositoz hastalarında önerilen İMATİS dozajı, günde 100 mg'dır. Yanıtsız hallerde 400 mg'a dek çıkılabilir. Bu doz aşılamaz.
Gastrointestinal Stromal Tümörlerde (GIST) dozaj
Yetişkin, rezeke edilemeyen ve/veya metastatik malign GIST hastalarında önerilen İMATİS dozajı, günde 400 mg'dır .
Değerlendirmelerin tedaviye yetersiz yanıtı ortaya koymaları durumunda, advers ilaç reaksiyonları göstermeyen hastalarda dozun 400 mg'dan 600 mg veya 800 mg'a yükseltilmesi düşünülebilir.
GIST rezeksiyonunu takiben yetişkin hastaların adjuvan tedavisinde önerilen İMATİS dozu 400 mg/gün'dür. Önerilen tedavi süresi 36 aydır. Adjuvan tedavi ortamında, İMATİS ile optimum tedavi süresi bilinmemektedir.
Advers reaksiyonlar için doz ayarlamaları Hematolojik olmayan advers reaksiyonlar
İMATİS kullanıldığında eğer ciddi hematolojik olmayan advers reaksiyon gelişirse, tedavi bu olay ortadan kalkıncaya kadar durdurulmalıdır. Daha sonra, olayın ilk ciddiyetine göre değişecek şekilde tedavi devam ettirilir.
Eğer bilirubin, normal sınırın üst limitini (NSÜL) 3 kattan fazla aşacak şekilde yükselirse ya da karaciğer transaminazlarında NSÜL değerinin 5 katından fazla artış olursa, İMATİS, bilirubin düzeyleri < 1,5 x NSÜL ve transaminaz düzeyleri < 2,5 x NSÜL seviyesine ininceye kadar durdurulmalı ve daha sonra da azaltılmış günlük dozlarla devam ettirilmelidir. Yetişkinlerde doz 400 mg'dan 300 mg'a veya 600 mg'dan 400 mg'a veya 800 mg'dan 600
mg'a, çocuklarda ise 260 mg/m/gün'den 200 mg/m/gün'e veya 340 mg/m/gün'den 260 mg/m/gün'e düşürülmelidir.
Hematolojik advers reaksiyonlar
Ağır nötropeni ve trombositopeni geliştiği takdirde dozun azaltılması ya da tedavinin kesilmesi aşağıdaki tabloda belirtildiği şekilde düzenlenmelidir.
Tablo 1 Nötropeni ve trombositopeni için doz ayarlamaları
Eozinofili ile ilişkili SM ve FIP1L1 -PDGFR-alfa füzyon kinaz ile birlikte HES (başlangıç dozu 100 mg) | ANC<1,0x10/L ve/veya trombosit sayısı < 50 x10/L | ANC≥1,5x10/L ve trombosit sayısı ≥ 75x10/L oluncaya kadar İMATİS tedavisi durdurulur. Eğer sitopeni 4 hafta devam ederse ve hala lösemiyle ilişkili değil ise ANC 4.3. KontrendikasyonlarAktif maddeye veya eksipiyanlardan herhangi birine karşı aşırı duyarlılık.
4.4. Özel kullanım uyarıları ve önlemleriİMATİS, başka ilaçlarla eşzamanlı olarak kullanıldığında önemli ilaç etkileşimleri görülme potansiyeli bulunmaktadır. İMATİS, proteaz inhibitörleri, azol antifungaller, belirli makrolitler (bkz. Bölüm 4.5), dar terapötik pencereye sahip CYP3A4 substratları (örn. siklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanil, alfentanil, terfenadin, bortezomib, dosetaksel, kinidin) veya varfarin ve diğer kumarin türevleri ile birlikte verildiğinde dikkatli olunmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
İmatinib ve CYP3A4 enzimini indükleyen tıbbi ürünlerin (örn. deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital veya Hypericum perforatum [Sarı kantaron]) eşzamanlı kullanımı, İMATİS maruziyetini önemli ölçüde azaltarak terapötik başarısızlık riskini artırabilir. Bu nedenle kuvvetli CYP3A4 indükleyicilerinin ve imatinibin eşzamanlı uygulamasından kaçınılmalıdır (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler).
Hipotiroidizm: İmatinib tedavisi sırasında levotiroksin replasmanı yapılan tiroidektomi hastalarında klinik hipotiroidizm olguları bildirilmiştir (bkz. Bölüm 4.5). Bu tür hastalarda tiroid stimule edici hormon (TSH) düzeyleri yakından izlenmelidir.
Hepatotoksisite: İmatinib temel olarak karaciğerde metabolize olur ve atılımın yalnızca %13'ü böbrekler aracılığıyladır. Karaciğer disfonksiyonu (hafif, orta şiddette ve şiddetli) olan hastalarda, periferik kan sayımları ve karaciğer enzimleri dikkatli bir şekilde izlenmelidir (bkz. Bölüm 4.2 Pozoloji ve uygulama şekli, Bölüm İstenmeyen etkiler, Bölüm Farmakodinamik özellikler, ve Bölüm Farmakokinetik özellikler). GIST hastalarında karaciğer yetmezliğine sebebiyet verebilecek karaciğer metastazları görülmesi olasıdır.
İmatinib ile karaciğer yetmezliği ve hepatik nekroz dahil karaciğer hasarı vakaları gözlenmiştir. İmatinib, yüksek doz kemoterapi rejimleri ile kombine edildiğinde ciddi hepatik reaksiyonlarda bir artış bildirilmiştir. İmatinib, karaciğer fonksiyon bozukluğu potansiyeli olan kemoterapi kürleriyle birlikte kullanılacaksa, karaciğer fonksiyonlarının izlenmesi tavsiye edilir (bkz. Bölüm Diğer tıbbi ürünler ile etkileşimler, Bölüm İstenmeyen etkiler).
Sıvı retansiyonu: İmatinib alan yeni tanı konulmuş KML hastalarının yaklaşık % 2,5'inde ciddi sıvı retansiyonu (plevral efüzyon, ödem, pulmoner ödem, assit, yüzeysel ödem) ortaya çıktığı bildirilmiştir. Bu nedenle, hastalarda düzenli aralıklarla kilo kontrolü önerilir. Beklenmedik, ani bir kilo artışı dikkatli araştırılmalı ve gerektiğinde uygun destek tedavisi uygulanmalı ve terapötik önlemler alınmalıdır. Klinik çalışmalarda, yaşlı hastalarda ve daha önceden kardiyak hastalık hikayesi bulunanlarda bu olayların insidanslarının arttığı saptanmıştır. Kardiyak disfonksiyonu olan hastalarda dikkatli olunmalıdır.
Kalp hastalığı ya da böbrek yetmezliği olan hastalar: Kalp hastalığı, kalp yetmezliği açısından risk faktörleri bulunan veya böbrek yetmezliği hikayesi olan hastalar dikkatlice takip edilmeli, kalp veya böbrek yetmezliğini düşündüren belirti ve semptomları olan her hasta değerlendirilmeli ve tedavi edilmelidir. Miyokardiyum içinde hipereozinofili sendromu (HES) hücrelerinin gizli sızdırmasının görüldüğü hastalarda izole kardiyojenik şok/sol ventrikül disfonksiyonu olguları, imatinib tedavisine başlanmasıyla beraber oluşan HES hücre degranülasyonu ile ilişkilendirilmiştir. Bu durumun sistemik steroidler kullanılarak, dolaşımı destekleyen önlemler alarak ve imatinib tedavisini geçici olarak durdurarak düzeltilebileceği bildirilmiştir. Yaygın olmayan kardiyak yan etkiler bildirildiği için, HES/CEL (kronik eozinofilik lösemi) popülasyonunda İMATİS tedavisine başlamadan önce dikkatli bir yarar/zarar (risk) değerlendirmesi yapılmalıdır. Miyelodisplastik/miyeloproliferatif hastalıklar (MDS/MPD) ve sistemik mastositoz yüksek eozinofil düzeyleri ile ilişkili olabilir. Bu nedenle, eozinofil düzeylerinin yüksek olduğu MDS/MPD vakalarında, sistemik mastositoz (SM) vakalarında ve HES vakalarında imatinib uygulanmadan önce kardiyoloji uzmanı tarafından değerlendirme yapılmalı, ekokardiyografik inceleme yapılmalı ve serum troponin düzeyleri ölçülmelidir. Bunlardan birinde anormallik tespit edilirse kardiyoloji uzmanı ile beraber takip edilmeli ve tedavi başlangıcında imatinible birlikte 1-2 hafta boyunca 1-2 mg/kg dozunda sistemik steroid kullanılması düşünülmelidir.
Gastrointestinal kanama: Rezeke edilemeyen ve/veya metastatik GIST'li hastalarda yürütülen bir çalışmada gerek gastrointestinal gerekse tümör içi hemorajiler bildirilmiştir (bkz. bölüm İstenmeyen etkiler). Eldeki verilere dayanılarak, GIST'li hastaları her iki hemoraji tipi açısından daha yüksek risk altına sokan herhangi bir predispozan faktör tanımlanmamıştır (örn. tümör büyüklüğü, tümör yeri, pıhtılaşma bozuklukları). Vaskülarite artışı ve kanamaya yatkınlıkta artış, GIST'in doğasında yer aldığından ve hastalığın klinik seyrinin parçası olduğundan, tüm hastalarda hemoraji izlemi ve kontrolüne yönelik standart uygulamalar ve prosedürler uygulanmalıdır.
Ayrıca, KML, ALL ve diğer hastalıkları olan hastalarda pazarlama sonrası deneyimde nadir bir gastrointestinal hemoraji nedeni olarak gastrik antral vasküler ektazi (GAVE) bildirilmiştir (bkz. Bölüm İstenmeyen etkiler). Gerektiğinde, İMATİS tedavisinin bırakılması düşünülmelidir.
Tümör lizis sendromu: Tümör lizis sendromu (TLS) meydana gelme olasılığı nedeniyle, İMATİS başlatılmadan önce klinik açıdan anlamlı dehidrasyonun düzeltilmesi ve yüksek ürik asit düzeylerinin tedavisi önerilmektedir (bkz. Bölüm İstenmeyen etkiler).
Hepatit B reaktivasyonu: Hepatit B virüsü (HBV) kronik taşıyıcısı olan hastalarda, BCR-ABL tirozin kinaz inhibitörleri ile tedavi sonrası, Hepatit B reaktivasyonu ortaya çıkmıştır. Bazı vakalar, karaciğer nakli veya ölüme sebep olan akut karaciğer yetmezliği veya fulminan hepatit ile sonuçlanır.
İMATİS tedavisine başlanmadan önce, hastalar HBV enfeksiyonu açısından test edilmelidir. Pozitif HBV serolojisine sahip (aktif hastalığı olanlar dahil) ve tedavi sırasında HBV enfeksiyonu için pozitif test sonucu veren hastalarda, tedavi başlatılmadan önce karaciğer hastalığı ve HBV tedavisi konusunda uzman hekimlere danışılmalıdır. İMATİS ile tedaviye ihtiyaç duyan HBV taşıyıcıları, tedavi boyunca ve tedavi sonlandırıldıktan sonra birkaç ay boyunca aktif HBV enfeksiyonu bulgu ve belirtileri için yakından izlenmelidir (bkz. Bölüm 4.8).
Fototoksisite: İMATİS tedavisi ile ilişkili fototoksisite riski nedeniyle doğrudan güneş ışığına maruziyetten kaçınılmalı ya da maruziyet en aza indirilmelidir. Hastalara, koruyucu kıyafetler ya da yüksek güneş koruma faktörüne (SPF) sahip güneş kremlerinin kullanımı gibi önlemler almaları söylenmelidir.
Trombotik mikroanjiyopati: BCR-ABL tirozin kinaz inhibitörleri (TKI'lar), imatinib için bireysel vaka raporları dahil olmak üzere trombotik mikroanjiyopati (TMA) ile ilişkilendirilmiştir (bkz. Bölüm 4.8). Eğer İMATİS alan bir hastada TMA ile ilişkili laboratuar ya da klinik bulgular meydana gelirse, tedavi bırakılmalı ve ADAMTS13 aktivitesi ve anti-ADAMTS13-antikorunun belirlenmesi dahil olmak üzere TMA için kapsamlı bir değerlendirme yapılmalıdır. Eğer düşük ADAMTS13 aktivitesi ile birlikte anti-ADAMTS13-antikoru yükselmişse, İMATİS tedavisi yeniden başlatılmamalıdır.
Laboratuvar testleri: İMATİS ile tedavi sırasında düzenli olarak tam kan sayımları yapılmalıdır. KML hastalarında imatinib tedavisi, nötropeni ya da trombositopeni ile ilişkilendirilmiştir. Bununla birlikte, bu sitopenilerin ortaya çıkışı, hastalığın tedavi edildiği evreye bağlıdır ve kronik fazda KML bulunan hastalarla karşılaştırıldığında, hızlanmış fazda KML ya da blast krizinde bulunan hastalarda daha sık olmaktadır. Bu durumda, 4.2 Pozoloji ve uygulama şekli bölümünde önerildiği gibi İMATİS tedavisi kesilebilir ya da dozu azaltılabilir.
İMATİS alan hastalarda karaciğer fonksiyonu (transaminazlar, bilirubin, alkalen fosfataz) düzenli olarak takip edilmelidir.
Böbrek fonksiyonu bozuk olan hastalarda, imatinib plazma maruziyetinin, böbrek fonksiyonu normal olan hastalara kıyasla daha yüksek olduğu görülmektedir; bunun olası nedeni imatinibi bağlanan bir protein olan alfa-asit glikoproteinin (AGP) plazma düzeylerinin bu hastalarda daha yüksek olmasıdır. Böbrek bozukluğu olan hastalarda en düşük başlangıç dozu verilmelidir. Şiddetli böbrek bozukluğu olan hastalar dikkatle tedavi edilmelidir. Doz, tolere edilmiyorsa azaltılabilir (bkz. Bölüm 4.2 ve 5.2).
Uzun süreli imatinib tedavisi, böbrek fonksiyonunda klinik olarak anlamlı azalma ile ilişkili olabilir. Bu nedenle imatinib tedavisine başlanmadan önce böbrek fonksiyonu değerlendirilmeli ve tedavi sırasında yakından izlenmeli, böbrek fonksiyon bozukluğu açısından risk faktörleri gösteren hastalara özellikle dikkat edilmelidir. Böbrek fonksiyon bozukluğu gözlenirse, standart tedavi kılavuzları uyarınca uygun kontrol ve tedavi reçete edilmelidir. Pediyatrik popülasyon İmatinib alan çocuklarda ve ergenlik öncesi çocuklarda görülen büyüme geriliğine ilişkin vaka raporları alınmıştır. KML pediyatrik popülasyonundaki gözlemsel bir çalışmada iki küçük alt kümede pubertal durum veya cinsiyet fark etmeksizin medyan boy standart sapma skorlarında 12 ve 24 ay sonra istatistiksel olarak anlamlı (fakat klinik anlamlılığı belirsiz) bir azalma bildirilmiştir. İmatinib tedavisi görmekte olan çocuklarda büyümenin yakından izlenmesi önerilir (bkz. Bölüm 4.8).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriİmatinibin plazma konsantrasyonlarını değiştiren ilaçlar
İmatinibin plazma konsantrasyonlarını artırabilen ilaçlar: Sitokrom P450 izoenzimlerinden CYP3A4 aktivitesini inhibe eden maddeler (örn. indinavir, lopinavir/ritonavir, ritonavir, sakinavir, telaprevir, nelfinavir ve boseprevir gibi proteaz inhibitörleri; ketokonazol, itrakonazol, posakonazol ve varikonazol gibi azol antifungal ajanlar; eritromisin, klaritromisin ve telitromisin gibi belirli makrolidler) metabolizmayı azaltabilir ve imatinib konsantrasyonlarını artırabilirler. Sağlıklı deneklere tek doz ketokonazol (bir CYP3A4 inhibitörü) ile birlikte uygulandığında, imatinibe maruz kalma durumunda anlamlı bir artış ortaya çıkmıştır (imatinibin ortalama C ve EAA değerleri sırasıyla % 26 ve % 40 artmıştır). İMATİS, CYP3A4 izoziminin inhibitörleri ile birlikte verilirken dikkatli olunmalıdır.
İmatinibin plazma konsantrasyonlarını azaltabilen ilaçlar: CYP3A4 aktivitesini indükleyen maddeler (örn. deksametazon, fenitoin, karbamazepin, rifampisin, fenobarbital, fosfenitoin, pirimidon ya da St. John's Wort olarak da bilinen Hypericum perforatum ile eşzamanlı uygulama İMATİS'e maruz kalmayı belirgin şekilde azaltabilir ve bu durum tedavinin başarısız olma riskini arttırabilir. Tedavi öncesi verilen birden fazla 600 mg rifampisin dozunun ardından tek bir 400 mg imatinib dozunun uygulanması, C ve EAA değerlerinde, rifampisin tedavisinin olmadığı durumdaki ilgili değerlerin en az %54 ve %74'ü oranında düşüşe neden olmuştur. İmatinib ile tedavi edilen malign gliomalı hastalarda karbamazepin, okskarbazepin ve fenitoin gibi enzim indükleyici antiepileptik ilaçlar (EIAED'ler) alırken benzer sonuçlar gözlenmiştir. İmatinib için plazma EAA, EIAED kullanmayan hastalara kıyasla %73 azalmıştır. Rifampisin veya diğer güçlü CYP3A4 indükleyicileri ile imatinibin birlikte kullanımından kaçınılmalıdır.
İmatinib ile plazma konsantrasyonu değişebilen ilaçlar: İmatinib, simvastatinin (CYP3A4 substratı) ortalama C ve EAA değerlerini sırasıyla 2- ve 3,5 kat artırmaktadır ve bu durum CYP3A4'ün imatinib tarafından inhibe edildiğini göstermektedir. Bu nedenle İMATİS, dar bir terapötik pencereye sahip CYP3A4 substratlarıyla (örn. siklosporin, pimozid, takrolimus, sirolimus, ergotamin, diergotamin, fentanil, alfentanil, terfenadin, bortezomib, dosetaksel, kinidin) birlikte uygulandığında dikkatli olunmalıdır. İMATİS, CYP3A4 tarafından metabolize edilen diğer ilaçların da plazma konsantrasyonunu artırabilir (örn. triazolo-benzodiazepinler, dihidropiridin kalsiyum kanal blokörleri, bazı HMG-KoA redüktaz inhibitörleri, örn. statinler, vs.). İmatinib kullanımı ile birlikte bilinen artmış kanama riski nedeniyle (örn. hemoraji), anti- koagülasyon gerektiren hastalar varfarin gibi kumarin türevleri yerine düşük molekül ağırlıklı ya da standart heparin ile tedavi edilmelidir.
In vitro ortamda imatinib, CYP3A4 aktivitesini etkileyen konsantrasyonların benzeri konsantrasyonlarda sitokrom P450 izoenzimlerinden CYP2D6 aktivitesini de inhibe etmektedir. Günde iki kez 400 mg dozda uygulanan imatinibin CYP2D6-aracılı metoprolol metabolizması üzerinde zayıf bir inhibitör etkisi vardır; metoprolol C ve EAA değerleri yaklaşık %23 kadar artar (%90 GA [1,16 – 1,30]). İmatinib, CYP2D6 substratları ile bir arada uygulandığında doz ayarlamalarının gerekli olmadığı görülmektedir ancak metoprolol gibi dar terapötik pencereye sahip CYP2D6 substratları ile dikkatli olunması tavsiye edilir. Metoprolol ile tedavi edilen hastalarda klinik izlem göz önünde bulundurulmalıdır.
İmatinib in vitro ortamda parasetamol O- glukuronidasyon 58,5 mikromol/l Ki değeri ile inhibe eder. Bu inhibisyon in vivo koşullarda, 400 mg imatinib ve 1000 mg parasetamol uygulamasının ardından görülmemiştir. Daha yüksek imatinib ve parasetamol dozları çalışılmamıştır. Bu nedenle yüksek dozda İMATİS ve parasetamol eşzamanlı uygulanırken dikkatli olunmalıdır.
Levotiroksin kullanan tiroidektomi hastalarında İMATİS eşzamanlı kullanıldığında levotiroksine plazma maruziyeti azalabilir (bkz. Bölüm Özel kullanım uyarıları ve önlemleri). Bu nedenle dikkat önerilir. Bununla birlikte gözlenen etkileşimin mekanizması halen bilinmemektedir.
Tüm Ph+ ALL hastalarında kemoterapiyle eşzamanlı olarak imatinib uygulanmasıyla ilgili klinik deneyim vardır (bkz. Bölüm Farmakodinamik özellikler), ancak imatinib ve kemoterapi rejimleri arasındaki ilaç-ilaç etkileşimleri iyi tanımlanmamıştır. İmatinibin advers etkileri, örn. hepatotoksisite, miyelosupresyon ya da diğerleri artış gösterebilir ve L- asparaginaz ile eşzamanlı kullanımın hepatatoksite artışıyla ilişkili olabileceği bildirilmiştir (bkz. Bölüm İstenmeyen etkiler). Bu nedenle, İMATİS'in kombinasyonda kullanımı özel dikkat gerektirmektedir.
Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin klinik etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyonPediyatrik popülasyona ilişkin klinik etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyonGebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon) Çocuk doğurma potansiyeli bulunan kadınlara tedavi sırasında ve tedavi durdurulduktan sonra en az 15 gün boyunca etkili bir kontrasepsiyon uygulamaları önerilmelidir.Gebelik dönemiImatinibin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. İMATİS, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm Klinik öncesi güvenlilik verileri). İmatinibin gebe kadınlarda kullanımına ilişkin klinik çalışmalar mevcut değildir. İmatinib alan kadınlarda spontan düşükler ve bebekte konjenital anomalilerle ilgili pazarlama sonrası raporlar mevcuttur. İMATİS, beklenen fayda, potansiyel riske ağır basmadığı sürece gebelik sırasında kullanılmamalıdır. Gebelik sırasında kullanılması durumunda, hastaya fetüs üzerindeki potansiyel riskleri hakkında bilgi verilmelidir.
Laktasyon dönemiİmatinibin insan sütüne geçişi hakkında sınırlı bilgi vardır. Emziren iki kadında yapılan çalışmalar hem imatinibin hem de aktif metabolitinin anne sütüne geçebileceğini ortaya koymuştur. Tek bir hastada incelenen süt plazma oranı, imatinib için 0,5 ve metabolit için 0,9 olarak belirlenerek metabolitin süte daha fazla geçtiğini düşündürmüştür. İmatinib ve metabolitinin toplam konsantrasyonu ve bebeklerin maksimum günlük süt alımı düşünüldüğünde, toplam maruziyetin düşük olması beklenir (bir terapötik dozun ~%10'u). Bununla birlikte, bebeğin imatinibe düşük dozlarda maruz kalmasının etkileri bilinmediğinden, anneler İMATİS tedavisi sırasında ve tedavi durdurulduktan sonra en az 15 gün boyunca bebeklerini emzirmemelidir.
Üreme yeteneği/FertiliteYapılan klinik dışı çalışmalarda, üreme parametreleri üzerinde etkiler gözlenmiş olsa da dişi ve erkek farelerin fertiliteleri etkilenmemiştir. (bkz. Bölüm 5.3) İmatinib alan hastalarda ilacın fertilite ve gametogenez üzerindeki etkileri ile ilgili çalışmalar yapılmamıştır. İMATİS tedavisi gören ve fertilite konusunda endişe duyan hastalar hekimlerine danışmalıdır.
4.7. Araç ve makine kullanımı üzerindeki etkilerHastalara imatinib ile tedavi sırasında baş dönmesi, somnolans ya da bulanık görme gibi istenmeyen etkiler yaşayabilecekleri bildirilmelidir. Bu nedenle, araba ya da araç kullanırken dikkatli olunması önerilmelidir.
4.8. İstenmeyen etkilerİleri aşamalarda maligniteleri olan hastalarda, altta yatan hastalık, progresyon ve sayısız tıbbi ürünün eşzamanlı uygulanması ile bağlantılı çeşitli semptomlar nedeniyle advers reaksiyonların nedensellik ilişkisinin değerlendirilmesini zorlaştıran sayısız karmaşıklaştırıcı tıbbi durum mevcut olabilir.
KML klinik çalışmalarında ilaçla ilişkili advers reaksiyonlar nedeniyle ilacın kesilmesi durumu, yeni tanı konan hastaların %2,4'ünde, interferon tedavisinin başarısız olmasından sonra geç kronik fazdaki hastaların %4'ünde, interferon tedavisinin başarısız olmasından sonra hızlanmış fazdaki hastaların %4'ünde ve interferon tedavisinin başarısız olmasından sonra blast krizindeki hastaların %5'inde gözlenmiştir. GIST çalışmasında ilaç, hastaların %4'üne ilaçla ilişkili advers reaksiyonlar nedeniyle kesilmiştir. İki istisna haricinde advers reaksiyonlar tüm endikasyonlarda benzer olmuştur. GIST ile karşılaştırıldığında KML hastalarında daha fazla miyelosüpresyon görülmüştür, bu durum olasılıkla altta yatan hastalık ile ilişkilidir. Rezekte edilemeyen ve/veya metastatik GIST'li hastalarda yürütülen bir çalışmada 7 (%5) hasta CTC derece 3/4 GI kanamalar (3 hasta), tümör içi kanamalar (3 hasta) ya da ikisini birden (1 hasta) yaşamıştır. GI tümör bölgeleri GI kanamaların kaynağı olmuş olabilir (bkz. bölüm 4.4). GI ve tümör kanamaları ciddi ve bazen ölümcül olabilmektedir. Her iki endikasyonda en sık bildirilen (≥%10) ilaçla ilişkili advers reaksiyonlar hafif bulantı, kusma, ishal, abdominal ağrı, yorgunluk, kas ağrısı, kas krampları ve döküntü olmuştur. Yüzeysel ödemler tüm çalışmalarda yaygın bir bulgu olmuş ve temelde periorbital ya da alt uzuv ödemleri şeklinde tarif edilmiştir. Bununla birlikte, bu ödemler nadiren şiddetli olmuş ve diüretiklerle, diğer destekleyici önlemlerle veya imatinib dozu azaltılarak kontrol edilebilmiştir.
İmatinib Ph+ ALL hastalarında yüksek doz kemoterapi ile kombine edildiğine transaminaz yükselmesi ve hiperbilirubinemi formunda geçici karaciğer toksisitesi gözlenmiştir. Sınırlı güvenlilik veritabanı göz önünde bulundurulduğunda, çocuklarda şu ana kadar bildirilen advers olaylar, erişkin Ph+ ALL hastalarında bilinen güvenlilik profili ile uyumludur. Ph+ ALL hastası çocuklardaki güvenlilik veritabanı çok sınırlı olmakla birlikte herhangi bir yeni güvenlilik endişesi tanımlanmamıştır.
Plevral efüzyon, assit, pulmoner ödem ve yüzeysel ödemin eşlik ettiği ya da etmediği hızlı kilo artışı gibi çeşitli advers reaksiyonlar kolektif olarak “sıvı tutulumu†şeklinde tarif edilebilir. Bu reaksiyonlar genellikle imatinib tedavisi geçici olarak durdurularak ve diüretiklerle ya da diğer uygun destekleyici bakım önlemleriyle kontrol edilebilmektedir.
Diğer yandan, bu reaksiyonların bazıları şiddetli ya da yaşamı tehdit edici olabilmektedir ve blast krizi olan çeşitli hastalar plevral efüzyon, konjestif kalp yetmezliği ve böbrek yetmezliğinden oluşan kompleks bir klinik öykü ile yaşamlarını kaybetmiştir. Pediyatrik klinik çalışmalarda özel bir güvenlilik bulgusu söz konusu olmamıştır.
Advers reaksiyonlar en sık görülen en önce olmak üzere ve şu sınıflandırma uygulanarak sıklıklarına göre sıralanmıştır: Çok yaygın (≥1/10); yaygın (≥ 1/100, < 1/10); yaygın olmayan (≥ 1/1.000, < 1/100); seyrek (≥ 1/10.000, < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Aşağıda bildirilen advers reaksiyonlar ve sıklıkları, KML ve GIST için yürütülen çalışmalara dayanmaktadır.
Laboratuvar testi anormallikleri HematolojiKML'de başta nötropeni ve trombositopeni olmak üzere sitopeniler tüm çalışmaların devamlı bir bulgusu olmuş, ≥ 750 mg gibi daha yüksek dozlarda daha sık oldukları düşünülmüştür (faz I çalışma). Bununla birlikte, sitopenilerin ortaya çıkışı, aynı zamanda açıkça hastalığın evresine de bağlı olmuştur. Sitopeniler, yeni tanı konulan KML vakalarında, diğer vakalara kıyasla daha seyrektir. Evre 3 veya 4 nötropenilerin (ANC <1,0x10/L) ve trombositopenilerin (trombosit sayısı <50x10/L) blast krizindeki ve hızlanmış fazdaki sıklığı, yeni tanı konulan kronik faz KML vakalarındakinin 4-6 katıdır. Yeni tanı kronik faz KML vakalarında % 16,7 nötropeni ve % 8,9 trombositopeni görülürken, bu oranlar hızlanmış ve blastik fazda sırasıyla, % 59-64 ve % 44-63 olarak bildirilmiştir. Yeni tanı konulmuş olan kronik faz KML vakalarında evre 4 nötropeni (ANC <0,5x10/L) ve trombositopeni (trombosit sayısı <10x10/L), sırasıyla yalnızca % 3.6 ve <%1 oranında görülmüştür. Nötropenik ve trombositopenik periyotların ortalama süresi genellikle sırasıyla 2 ve 3. haftalar arasında ve 3 ve 4. haftalar arasında yer almıştır. Bu olaylar, genellikle İMATİS ile tedavinin dozu azaltılarak ya da tedavi kesilerek kontrol edilebilir, ancak bazı nadir vakalarda kalıcı olarak tedavinin bırakılmasına neden olabilir. Pediyatrik KML hastalarında en sık gözlenen toksisiteler; nötropeni, trombositopeni ve anemi dahil olmak üzere 3 ya da 4. derece sitopeniler olmuştur. Bunlar genellikle ilk birkaç ay içerisinde gerçekleşmektedir.
Rezeke edilemeyen ya da metastatik malign GIST (çalışma B2222) bulunan hastalarda, sırasıyla hastaların % 5,4 ve % 0,7'sinde evre 3 ve 4 anemi bildirilmiştir ve bu durum en azından bazı hastalarda gastrointestinal ya da intra-tümöral kanamayla ilişkili olabilir. Sırasıyla hastaların % 7,5 ve %2,7'sinde evre 3 ve 4 nötropeni ve hastaların % 0.7'sinde evre 3 trombositopeni görülmüştür. Hiçbir hastada evre 4 trombositopeni gelişmemiştir. Özellikle tedavinin ilk 6 haftasında beyaz kan hücresi (WBC) ve nötrofil sayılarında azalmalar ortaya çıkmış, bu değerler daha sonra nispeten sabit kalmıştır.
BiyokimyaKML hastalarında transaminazlarda (< % 5) ya da bilirubinde (< %1) ciddi artışlar olmuştur ve genellikle doz azaltılarak ya da kesilerek (bu epizodların ortalama süresi yaklaşık 1 hafta olmuştur) kontrol altına alınmıştır. KML hastaların % 1'inden azında karaciğer laboratuar anormallikleri nedeniyle tedavi sürekli olarak kesilmiştir. GIST hastalarının (çalışma B2222) %6,8'inde 3. veya 4. evre ALT (alanin aminotransferaz); %4,8'inde 3. veya 4. evre AST (aspartat aminotransferaz) yükselmeleri kaydedilmiş; bilirubin düzeyi yükselen hastaların oranı %3'ün altında kalmıştır.
Nadir sitolitik ve kolestatik hepatit ve karaciğer yetmezliği olguları söz konusu olmuştur; yüksek doz parasetamol kullanan bir hasta dahil olmak üzere bunların bazıları ölümle sonuçlanmıştır. Seçili advers reaksiyonların tanımlanması Hepatit B reaktivasyonu BCR-ABL TKI'lerle ilişkili olarak hepatit B reaktivasyonu bildirilmiştir. Bazı vakalarda, karaciğer nakliyle veya ölümle sonuçlanan akut karaciğer yetmezliği veya fulminan hepatit ortaya çıkmıştır (bkz. Bölüm 4.4).
Şüpheli advers reaksiyonların raporlanması Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisiTerapötik dozlardan daha yüksek dozlarla deneyim sınırlıdır. İmatinib doz aşımı ile ilgili bireysel vakalar spontan olarak ve literatürde bildirilmiştir. Genellikle, bu vakalarda bildirilen sonuçlar düzelme ya da iyileşme şeklinde olmuştur. Doz aşımı halinde, hasta gözlem altında tutulmalı ve uygun semptomatik tedavi uygulanmalıdır.
Farklı doz aralıklarında bildirilen olaylar aşağıda verilmiştir: Erişkinlerde doz aşımı: 1200 ila 1600 mg (1 ila 10 gün arasında değişen sürelerle): Bulantı, kusma, diyare, döküntü, eritem, ödem, şişme, yorgunluk, kas spazmları, trombositopeni, pansitopeni, karın ağrısı, baş ağrısı, iştahta azalma.
1800 ila 3200 mg (6 gün boyunca günde 3,200 mg'a kadar dozlar): Güçsüzlük, miyalji, CPK düzeyinde yükselme, bilirubin düzeyinde yükselme, gastrointestinal ağrı. 6400 mg (tek doz): Literatürde yer alan bir vakada, bulantı, kusma, karın ağrısı, pireksi, yüzde şişme, nötrofil sayısında azalma, transaminaz düzeylerinde yükselme görülen bir hasta bildirilmiştir. 8 ila 10 g (tek doz): Kusma ve gastrointestinal ağrı bildirilmiştir.
Pediyatrik doz aşımı: 400 mg'lık tek doza maruz kalan 3 yaşındaki bir erkek çocukta kusma, diyare ve anoreksi; 980 mg'lık tek doza maruz kalan 3 yaşındaki diğer bir erkek çocukta ise lökosit sayısında azalma ve diyare görülmüştür.
Doz aşımı durumunda hasta gözlemlenmeli ve uygun destek tedavisi verilmelidir.
Farmakoterapötik grup: Antineoplastik ajan, protein-tirozin kinaz inhibitörü. ATC kodu: L01EA01 Etki mekanizması: İmatinib küçük bir molekül yapısına sahip bir protein-tirozin kinaz inhibitörüdür; Bcr-Abl tirozin kinaz (TK) aktivitesini ve birçok reseptör TK'yı kuvvetli bir şekilde inhibe etmektedir: KIT, c-KIT proto-onkogen tarafından kodlanan kök hücre faktörü (Stem cell factor - SCF) reseptörü, diskoidin etki bölgesine ait reseptörler (DDR1 ve DDR2), koloni uyarıcı faktör reseptörü (CSF-1R), trombosit kökenli büyüme faktörü (Platelet derived growth factor – PDGF) reseptörleri alfa ve beta (PDGFR-alfa ve PDGFR-beta). İmatinib aynı zamanda bu reseptör kinazların aktivasyonunun aracılık ettiği hücresel olayları da inhibe edebilmektedir.
Farmakodinamik etkiler: İmatinib, in vitro, hücresel ve in vivo düzeylerde kırılma noktalarının yoğunlaştığı bölge- Abelson (Bcr-Abl) tirozin kinazı güçlü bir şekilde inhibe eden bir protein-tirozin kinaz inhibitörüdür. Bileşik, Bcr-Abl pozitif hücre dizilerinde, Philadelphia kromozom pozitif KML ve ALL hastalarının yeni lösemi hücrelerinde selektif olarak proliferasyonu inhibe etmekte ve apopitozisi uyarmaktadır.
Bileşik, in vivo olarak, Bcr-Abl pozitif tümör hücreleri kullanılan hayvan modellerinde tek ajan olarak anti-tümör aktivite gösterir.
İmatinib, aynı zamanda trombosit türevi büyüme faktörü (Platelet derived growth factor - PDGF) ve kök hücre faktörü (Stem cell factor - SCF), c-KIT için reseptör tirozin kinazların bir inhibitörüdür ve PDGF- ve SCF- tarafından yönlendirilen hücresel olayları inhibe eder. In vitro olarak, imatinib, aktive edici bir KIT mutasyonunu ekspres eden GIST hücrelerinde proliferasyonu inhibe eder ve apopitozu uyarır. PDGF reseptörünün veya Abl protein tirozin kinazların çeşitli ortak proteinlere füzyonunun veya yapısal PDGF üretiminin bir sonucu olan yapısal aktivasyonun, MDS/MPD, HES ve DFSP'nin patogenezinde rol oynadığı öne sürülmüştür. Ayrıca, c-KIT ya da PDGFR'nin konstitütif aktivasyonu SM'nin patogenezinde rol oynayan muhtemel nedendir. İmatinib, düzensiz PDGFR veya Abl kinaz aktivitesinin yönlendirdiği sinyalizasyonu ve hücre proliferasyonunu inhibe eder.
Kronik Miyeloid Lösemide Klinik Çalışmalarİmatinibin etkinliği, bir bütün olarak elde edilen hematolojik ve sitogenetik yanıt oranlarını ve hastalıksız sağkalım süresini temel alır. Yeni tanı almış KML harici, hastalık ilişkili semptomların iyileşmesi veya sağkalım süresinin artması gibi klinik faydaların olduğunu gösteren kontrollü çalışma yoktur.
İleri evre, blast veya hızlandırılmış faz hastalıkta Philadelphia kromozomu pozitif (Ph +) KML, diğer Ph + lösemiler veya kronik fazda KML'si olan fakat daha önce interferon-alfa (IFN) tedavisinde başarısız olunan hastalarda üç büyük, uluslararası, açık etiketli, kontrollü olmayan Faz II çalışma yapılmıştır. Yeni tanı almış Ph + KML hastalarında büyük, açık etiketli, çok merkezli, uluslararası, randomize bir Faz III çalışma yürütülmüştür. Ek olarak, iki Faz I çalışmada ve bir Faz II çalışmada çocuklar tedavi edilmiştir. Bütün klinik çalışmalarda hastaların %38-40'ının en az 60, %10-12'sinin en az 70 yaşında olduğu bildirilmiştir.
Kronik faz, yeni tanı konulmuş: Bu faz III çalışmasında, imatinib monoterapisi, interferon-alfa (IFN) + sitarabin (Ara-C) kombinasyonuyla karşılaştırılmıştır. Yanıtsızlık (6 ayda tam hematolojik yanıt (CHR) olmaması, artan WBC, 24 ayda majör sitogenetik yanıt (MCyR) olmaması), yanıt kaybı (CHR veya MCyR kaybı) veya tedaviye şiddetli intolerans gösteren hastaların alternatif tedavi koluna geçmelerine izin verilmiştir. İmatinib grubundaki hastalarda günde 400 miligramlık doz kullanılmıştır. IFN grubunda, hastalar 10 gün/ay boyunca subkutan Ara-C 20 mg/m/gün ile kombinasyon halinde subkutan olarak 5 MIU/m/gün hedef IFN dozu ile tedavi edilmiştir.
Toplam 1106 (her grupta 553) hasta, randomize edilmiştir. İki kol arasında çalışma başlangıcı özellikleri iyi düzeyde dengelenmiştir. Medyan yaş 51 yıl (aralık 18-70 yıl) olup, hastaların %21,9'u 60 yaşında veya üzerindedir. % 59'u erkek ve % 41'i kadın; % 89,9'u beyaz ve % 4,7'si siyah hastalardan oluşmuştur. Son hastanın çalışmaya alınmasından yedi yıl sonra, imatinib ve IFN kollarında medyan birinci basamak tedavi süresi sırasıyla 82 ve 8 ay olmuştur. İmatinib ile ikinci basamak tedavinin medyan süresi 64 aydır. Genel olarak, birinci basamak olarak imatinib alan hastalarda verilen ortalama günlük doz 406±76 mg'dır. Çalışmanın primer etkililik sonlanım noktası progresyonsuz sağkalımdır. Progresyon, aşağıdaki olaylardan herhangi biri olarak tanımlanmıştır: hızlanmış faz veya blast krizine progresyon, ölüm, CHR veya MCyR kaybı ya da uygun terapötik tedaviye rağmen bir CHR'ye ulaşamayan hastalarda WBC artışı. Ana sitogenetik yanıt, hematolojik yanıt, moleküler yanıt (minimal rezidüel hastalığın değerlendirilmesi), hızlandırılmış faza kadar geçen süre veya blast krizi ve hayatta kalma, ana sekonder sonlanım noktalarıdır. Yanıt verileri Tablo 2'de gösterilmektedir.
Tablo 2 Yeni tanı konulan KML çalışmasındaki yanıt oranları (84 aylık veri)
**Moleküler yanıt oranları erişilebilir verilere bağlıdır. Hematolojik yanıt kriterleri (bütün yanıtlar ≥4 hafta sonra doğrulanmalıdır):Kandaki lökosit sayısı < 10 x10/L, trombosit sayısı < 450 x10/L, miyelosit+metamiyelosit < %5; kanda blast hücresi veya promiyelosit yok, bazofiller <%20, kemik iliği dışında hastalık yok Sitogenetik yanıt kriterleri: tam (%0 Ph+ metafazlar), kısmi (%1-35), minör (%36-65) veya minimal (%66-95). Majör yanıt (%0-35), hem kısmi hem tam yanıtları içerir [1]. Majör moleküler yanıt kriterleri: Gerçek-zaman kantitatif revers kriptaz polimeraz zincir reaksiyonuyla ölçülen Bcr-Abl transkriptlerinin periferik kanda, başlangıç düzeyine göre en az 3 log azalması.
Birinci basamak tedavide tam hematolojik yanıt, majör sitogenetik yanıt ve tam sitogenetik yanıt oranları, son muayene tarihinde yanıtsızlıkların sansürlendiği Kaplan-Meier yaklaşımı kullanılarak hesaplanmıştır. Bu yaklaşım kullanıldığında, imatinib ile birinci basamak tedavi için hesaplanan kümülatif yanıt oranları 12 aylık tedaviden 84 aylık tedaviye şu şekilde düzelme göstermiştir: THY %96,4'ten %98,4'e ve TSY %69,5'ten %87,2'ye.
7 yıllık takipte, imatinib grubunda 93 (%16,8) olay olmuştur: 37 (%6,7) hızlanmış faz/blastik kriz (AF/BK) ilerleme, 31 (%5,6) major sitogenetik yanıt (MSY) kaybı, 15 (%2,7) tam hematolojik yanıt (THY) kaybı ya da white blood cell (beyaz kan hücresi) (WBC) artışı ve 10 (%1,8) KML ile ilişkisiz ölüm. Buna karşılık IFN+Ara-C grubunda 165 (%29,8) olay olmuş ve bunların 130'u birinci seçenek IFN+Ara-C tedavisi sırasında meydana gelmiştir.
Tedavide geçen süre ile birlikte hızlandırılmış faza veya blast krizine yıllık progresyon oranı azalmış ve dördüncü ve beşinci yıllarda yıllık % 1'den az olmuştur. 84 ayda progresyonsuz sağkalım tahmini oranı imatinib grubunda %81,2 ve kontrol grubunda %60,6 bulunmuştur (p < 0,001). İmatinib için herhangi bir türdeki yıllık progresyon oranları da zamanla azalmıştır.
İmatinib ve IFN+Ara-C gruplarında, sırasıyla, toplam 71 (%12,8) ve 85 (%15,4) hasta ölmüştür. 84 ayda randomize imatinib ve IFN+Ara-C gruplarında tahmin edilen genel sağkalım, sırasıyla %86,4 (83, 90) ve %83,3 (80, 87) düzeyindedir (p=0,073, log-rank testi). Bu olaya kadar geçen zaman sonlanım noktası, IFN + Ara-C'den imatinibe yüksek geçiş oranından büyük ölçüde etkilenir. İmatinib tedavisinin kronik fazdaki, yeni tanı konulmuş KML'deki sağkalım etkisi, aynı rejimde IFN+Ara-C (n=325) kullanılan başka bir Faz III çalışmadan elde edilen birincil verilerle birlikte yukarıda belirtilen imatinib verilerinin retrospektif analizinde ayrıntılı olarak incelenmiştir. Bu yayında, genel sağkalım bakımından imatinibin IFN+Ara-C karşısındaki üstünlüğü kanıtlanmıştır (p<0,001); 42 ay içinde 47 (%8,5) imatinib hastası ve 63 (%19,4) IFN+Ara-C hastası ölmüştür.
İmatinib tedavisindeki hastalarda sitogenetik yanıt ve moleküler yanıt derecesi, uzun dönem sonuçlar üzerinde açık bir etkiye sahip olmuştur. 12 ayda TSY'si (KSY) olan hastaların tahmini %96'sında (%93) akselere faza/blast krizine progresyon olmazken 12 ayda MSY'si olmayan hastaların sadece %81'inde 84 ayda ilerlemiş KML'ye progresyon olmadığı görülmüştür (genel p<0,001, TSY ile KSY arasında p=0.25). 12 ayda Bcr-Abl transkriptlerinde en az 3 logaritmalık azalması olan hastalarda akselere faza/blast krizine progresyonsuz kalma olasılığı 84 ayda %99 bulunmuştur. 18 aylık dönüm noktası analizine dayanılarak benzer bulgular tespit edilmiştir.
Bu çalışmada günde 400 mg'dan 600 mg'a, ardından günde 600 mg'dan 800 mg'a doz artırımlarına izin verilmiştir. 42 aylık izlem sonrasında 11 hasta sitogenetik yanıtlarında doğrulanmış bir kayıp (4 hafta içinde) deneyimlemiştir. Bu 11 hastanın 4'ünde doz günde 800 mg'a artırılmış olup hastaların 2'si sitogenetik yanıtı tekrar elde etmiş (1'inde kısmi, 1'inde tam; tam yanıt elde eden ayrıca moleküler yanıta da ulaşmıştır), diğer yandan dozları artırılmayan 7 hastanın sadece biri tam sitogenetik yanıtı tekrar elde etmiştir. Doz artırımı öncesindeki hasta popülasyonu (n=551) ile karşılaştırıldığında, dozun günde 800 mg'a yükseltildiği 40 hastada bazı advers reaksiyonların yüzdesi daha yüksek olmuştur. Daha sık görülen advers reaksiyonlar gastrointestinal hemorajileri, konjonktivit ve transaminazlar veya bilirubinde yükselmeyi içermiştir. Diğer advers olaylar daha düşük ya da eşit sıklıkla bildirilmiştir.
Kronik faz, interferon tedavisinin başarısız kaldığı hastalar: 532 hasta, 400 miligramlık başlangıç dozuyla tedavi edilmiştir. Bu hastalar; hematolojik başarısızlık (%29), sitogenetik başarısızlık (%35) veya interferon intoleransı (%36) olmak üzere başlıca 3 gruba ayrılmıştır. Hastalar daha önce medyan 14 ay boyunca ≥25x10 IU/hafta dozlarda IFN tedavisi görmüştür ve hepsi de geç kronik fazdadır; tanıdan itibaren geçen medyan süre 32 aydır. Çalışmanın birincil etkililik değişkeni majör sitogenetik yanıt oranıdır (tam yanıt artı kısmi yanıt, kemik iliğinde %0 ila %35 Ph+ metafaz).
Bu çalışmada hastaların %65'i bir majör sitogenetik yanıta ulaşmıştır; hastaların %53'ünde (doğrulanmış %43) yanıt tamdır (Tablo 3). Hastaların %95'inde tam hematolojik yanıta ulaşılmıştır.
Hızlanmış faz: Bu fazdaki 235 KML vakasının ilk 77'sinde tedaviye günde 400 mg ile başlanmıştır; daha sonra çalışma protokolü, daha yüksek imatinib dozlarının kullanılmasına olanak tanıyacak şekilde tadil edilmiştir ve geriye kalan 158 hasta, başlangıçta 600 mg imatinib kullanmıştır.
Tam hematolojik yanıt, hiçbir lösemi kanıtının mevcut olmaması (kemik iliğindeki ve kandaki blast hücrelerinin kaybolması, ancak periferik kan tablosunda, tam yanıt için gereken düzelmenin gerçekleşmemesi) veya kronik faz kronik miyeloid lösemiye dönüş olarak tanımlanan tam hematolojik yanıt elde edilme oranı, bu çalışmanın etkililik konusundaki değerlendirilen primer parametresi olmuştur. Doğrulanmış hematolojik yanıt, hastaların % 71,5'inde elde edilmiştir (Tablo 3). Bu hastalardan % 27,7'sinde ayrıca majör sitogenetik yanıt (% 20,4'ünde [doğrulanmış %16] tam sitogenetik yanıt) alınmış olması önemlidir. 600 mg imatinib kullanan hastalarda bugünkü saptamalara göre tahmini ortanca (medyan) hastalıksız sağkalım ve genel sağkalım oranları, sırasıyla 22,9 ay ve 42,5 ay olarak hesaplanmıştır. Miyeloid blast krizi: Bu çalışma, blast krizi gelişmiş olan 260 hasta üzerinde yapılmıştır. Bu hastaların 95'i (%37'si), hızlanmış faz veya yine blast krizi nedeniyle daha önce de kemoterapi görmüştür (“önceden tedavi edilmiş olan hastalarâ€), 165 (%63) hastada ise daha önce kemoterapi uygulanmamıştır (“önceden tedavi edilmemiş olan hastalarâ€). Başlangıç dozu, ilk 37 hastada 400 miligramdı; daha sonra yapılan protokol tadilatı, daha yüksek dozların kullanılmasına olanak verdiğinden, diğer 223 hasta, başlangıçta 600 mg imatinib kullanmıştır.
Primer etkililik parametresi, hızlanmış faz çalışmasında olduğu gibi yine tam hematolojik yanıt, lösemi kanıtının mevcut olmaması veya kronik faza dönüş olarak tanımlanan, hematolojik yanıt oranı olmuştur. Hastaların %31'inde hematolojik yanıt elde edilmiştir (daha önce tedavi görmemiş hastalarda %36, daha önce tedavi görmüş hastalarda %22). 600 mg imatinib kullanan hastalardaki hematolojik yanıt oranı, 400 mg imatinib kullanmış olanlara kıyasla daha yüksektir (%16'ya karşılık %33, p=0,0220). Daha önceden tedavi edilmemiş ve tedavi edilmiş hastaların mevcut tahmini ortalama sağkalımı sırasıyla 7,7 ve 4,7 aydır.
Lenfoid blast krizi: Faz I çalışmalara sınırlı sayıda hasta kaydedilmiştir (n=10). Hematolojik yanıt oranı, 2-3 aylık süre ile %70 bulunmuştur.
Tablo 3 KML vakalarında elde edilen yanıtlar
THY: çalışma 0110 [kandaki WBC <10 x10/L, trombosit sayısı <450x10/L, miyelosit + metamiyelosit <5% ; kanda blast veya promiyelosit yok; bazofiller < %20, kemik iliği dışında hastalık yok] ve çalışma 0102 ve 0109 [ANC≥1,5 x10/L, trombosit sayısı ≥100 x 10/L, kanda blast hücresi yok, BM blast hücresi oranı <%5 ve BM dışında hastalık yok] NEL: THY ile aynı kriterler; yalnızca ANC ≥1 x10/L ve trombosit sayısı ≥20 x10/L (çalışma 0102 ve 0109'da) RTC: BM ve PB blast hücresi oranı <%15; BM ve PB blast hücresi + promiyelosit oranı <%30, PB bazofil oranı <%20, dalak ve karaciğer hariç BM dışında hastalık yok (çalışma 0102 ve 0109'da) ANC = mutlak nötrofil sayısı, BM = kemik iliği, PB = periferik kan, WBC = lökosit sayısı Majör yanıt = tam (%0 Ph+ metafaz) + kısmi (% 1-35) yanıt
Pediyatrik hastalar: Kronik faz KML'si (n=11) veya blast krizi aşamasında KML'si ya da Ph+ akut lösemileri (n=15) olan, 18 yaş altı toplam 26 pediyatrik hasta bir faz I doz yükseltme çalışmasına kaydedilmiştir. Bu, yoğun ön tedavi görmüş hastalardan oluşan bir popülasyondur: hastaların %46'sı önceden BMT ve %73'ü önceden çoklu ajanlı kemoterapi görmüştür. Hastalar 260 mg/m/gün (n=5), 340 mg/m/gün (n=9), 440 mg/m/gün (n=7) ve 570 mg/m/gün (n=5) imatinib dozları ile tedavi edilmiştir. Sitogenetik verileri mevcut olan 9 kronik faz KML hastasının 4'ünde (%44) ve 3'ünde (%33) sırasıyla tam ve kısmi sitojenik yanıt elde edilmiş olup bu oranlar %77 MCyR değeri ile sonuçlanmıştır.
Yeni tanı almış ve tedavi edilmemiş, kronik fazda KML'si olan toplam 51 pediyatrik hasta açık-etiketli, çok merkezli, tek kollu bir faz II çalışmaya kaydedilmiştir. Hastalar 340 mg/m/gün imatinib ile tedavi edilmiş, doz sınırlayıcı toksisitesi hariç ara verilmemiştir. İmatinib tedavisi yeni tanı konmuş pediyatrik KML hastalarında, 8 haftalık tedavi sonrasında %78 CHR oranı ile hızlı yanıt sağlamaktadır. Yüksek CHR oranına, hastaların %65'inde tam sitojenik yanıt (CCyR) gelişimi eşlik etmiş olup bu oran, erişkinlerde gözlenen sonuç ile karşılaştırılabilir niteliktedir. Ek olarak, hastaların %16'sında kısmi sitojenik yanıt (PCyR) gözlenmiş, bu da %81 MCyR değerini vermiştir. CCyR'ye ulaşan hastaların büyük çoğunluğu, Kaplan-Meier tahmine dayalı 5.6 aylık yanıta kadar geçen medyan süre ile CCyR'ye 3 ila 10'uncu aylar arasında ulaşmıştır.
Avrupa İlaç Ajansı, Philadelphia kromozomu (bcr-abl translokasyon) pozitif kronik faz kronik miyeloid lösemide pediyatrik popülasyonun tüm alt kümelerinde imatinib ile çalışmaların sonuçları sunma zorunluluğunu iptal etmiştir (pediyatrik kullanım ile ilgili bilgi için bkz. Bölüm 4.2).
Ph+ ALL için klinik çalışmalar Yeni teşhis edilen Ph+ ALL: Kontrol grubuna yer vererek yapılan ve imatinibin, 55 yaş ve üzeri yeni tanı almış 55 hastada kemoterapi indüksiyonuyla karşılaştırıldığı bir çalışmada (ADE10), tek ajan olarak kullanılan imatinib, kemoterapiye kıyasla anlamlı derecede daha yüksek tam hematolojik yanıt oranı ile sonuçlanmıştır (%50'ye karşılık %96.3, p=0.0001). Kemoterapiye yanıt vermeyen veya zayıf yanıt veren hastalarda imatinib kurtarma tedavisi olarak kullanıldığında, 11 hastanın 9'unda (%81.8) tam hematolojik yanıt elde edilmiştir. Bu klinik etki, 2 haftalık tedaviden sonra, kemoterapi kolu ile karşılaştırıldığında imatinib ile tedavi edilen hastalarda, bcr-abl transkriptlerinde daha büyük bir azalmayla ilişkilendirilmiştir (p=0.02). Tüm hastalar indüksiyon sonrasında imatinib ve konsolidasyon kemoterapisi almış (bkz. Tablo 4) ve bcr- abl transkriptlerinin düzeyleri sekizinci haftada iki kolda aynı olmuştur. Çalışma tasarımı doğrultusunda beklendiği üzere, iki grup arasında remisyon süresi, hastalıksız sağkalım veya genel sağkalım açısından herhangi bir fark gözlenmemiş, ancak tam moleküler yanıt elde edilen ve minimal rezidüel hastalık düzeyinde kalan hastalarda gerek remisyon süresi (p=0.01) gerekse hastalıksız sağkalım (p=0.02) bakımından sonuçlar daha iyi olmuştur.
Kontrol gruplarına yer verilmeyen dört klinik çalışmada (AAU02, ADE04, AJP01 ve AUS01) yeni tanı almış 211 Ph+ ALL hastasından oluşan bir popülasyonda gözlenen sonuçlar, yukarıda tarif edilen sonuçlar ile uyumludur. Kemoterapi indüksiyonu ile kombinasyon halindeki imatinib (bkz. Tablo 4) %93'lük bir tam hematolojik yanıt oranı (değerlendirilebilir 158 hastanın 147'si) ve %90'lık bir majör sitogenetik yanıt oranı (değerlendirilebilir 21 hastanın 19'u) sonuçlarını vermiştir. Tam moleküler yanıt oranı %48 bulunmuştur (değerlendirilebilir 102 hastanın 49'u). Hastalıksız sağkalım (DFS) ve genel sağkalım (OS) her durumda 1 yılı geçmiştir ve iki çalışmadaki (AJP01 ve AUS01) geçmiş kontrolden üstün olmuştur (DFS p<0.001; OS p<0.0001).
Tablo 4 İmatinible kombinasyon halinde kullanılan kemoterapi rejimi
Pediyatrik hastalar: I2301 çalışmasında, Ph+ ALL'si olan toplam 93 pediyatrik, ergen ve genç yetişkin hasta (1 ila 22 yaşları arasında) açık etiketli, çok merkezli, sıralı gruplu, randomize olmayan bir faz III çalışmaya kaydedilmiş ve indüksiyon tedavisinden sonra yoğun kemoterapi ile kombinasyon halinde imatinib (340 mg/m/gün) ile tedavi edilmiştir. İmatinib 1. gruptan 5. gruba doğru artan süre ve daha erken imatinib tedavisi olacak şekilde aralıklı olarak uygulanmıştır; en düşük imatinib yoğunluğu grup 1'de ve en yüksek imatinib yoğunluğu grup 5'tedir (ilk kemoterapi tedavi kürleri sırasında sürekli günlük imatinib doz uygulaması ile gün olarak en uzun süre). Grup 5 hastalarında (n=50) kemoterapi ile kombinasyon halinde tedavi kürünün erken dönemlerinde imatinib'e sürekli günlük maruziyet, imatinibsiz standart kemoterapinin uygulandığı tarihsel kontrollerle (n=120) karşılaştırıldığında 4 yıllık olaysız sağkalımı (EFS) artırmıştır (sırasıyla %69,6'ya karşılık %31,6). Grup 5 hastalarında tahmini 4 yıllık GS, tarihsel kontrollerdeki %44,8 değeri ile karşılaştırıldığında %83,6 olmuştur. Kohort 5'teki 50 hastadan 20'si (% 40) hematopoietik kök hücre nakli almıştır.
Tablo 5 Çalışma I2301'de imatinib ile kombinasyon halinde kullanılan kemoterapi rejimi
G-CSF = granülosit koloni uyarıcı faktör, VP-16 = etoposid, MTX = metotreksat, IV = intravenöz, SC = subkutan, IT = intratekal, PO = oral, IM = intramüsküler, ARA-C = sitarabin, CPM = siklofosfamid, VCR= vinkristin, DEX = deksametazon, DAUN = daunorubisin, 6-MP = 6-merkaptopurin, E.Coli L- ASP = L- asparaginaz, PEG-ASP = PEG asparaginaz, MESNA = 2-merkaptoetan sülfonat sodyum, iii = veya MTX düzeyi <0,1 pM olana kadar, 6 saatte bir = her 6 saatte bir, Gy = Gray
Çalışma AIT07, kemoterapi ile kombinasyon halinde imatinib ile tedavi edilen 128 hastayı (1 ila <18 yaş) içeren çok merkezli, açık etiketli, randomize, Faz II / III bir çalışmadır. Bu çalışmadan elde edilen güvenlilik verilerinin, imatinibin Ph + ALL hastalarında güvenlilik profili ile uyumlu olduğu görülmektedir.
Nüksetmiş/tedaviye dirençli Ph+ ALLİmatinib, yineleyen/refraktör Ph+ ALL hastalarında tek ajan olarak kullanıldığında, 411 hastanın 53'ünde yanıt değerlendirilebilmiş, hematolojik yanıt oranı %30 (%9'u tam) ve majör sitogenetik yanıt oranı ise %23 olarak bulunmuştur (Not: 411 hastanın 353'ü, primer yanıt verileri toplanmaksızın genişletilmiş erişim çalışmasında tedavi edilmiştir). 411 yineleyen/refraktör Ph+ ALL hastasından oluşan toplam popülasyonda progresyona kadar geçen medyan süre 2,6 ile 3,1 ay aralığında olurken, değerlendirilebilir 401 hastada medyan genel sağkalım 4,9 ile 9 ay aralığında bulunmuştur. Bu veriler, sadece 55 yaş ve üzeri hastalar dahil edilecek şekilde yeniden analiz yapıldığında da benzer olmuştur.
SM ile İlgili Klinik ÇalışmalarABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında imatinibin test edildiği açık-etiketli, çok merkezli bir faz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada tedavi edilen ve 45'inde hematolojik hastalıklar, 140'ında da çeşitli solid tümörler bulunan 185 hastadan 5'inde SM saptanmıştır. SM hastaları günlük 100 mg ila 400 mg imatinib ile tedavi edilmiştir. Yayınlanmış 10 vaka raporu ve vaka serisinde, yaşları 26 ila 85 arasında değişen 25 SM hastası daha bildirilmiştir. Bu hastalara da günlük 100 mg ila 400 mg dozda imatinib uygulanmıştır. SM için tedavi edilen toplam popülasyonun (30 hasta) 10'unda (%33) tam hematolojik yanıt, 9'unda (%30) kısmi hematolojik yanıt elde edilmiştir (toplam yanıt oranı %63). Sitogenetik anormallikler yayınlanmış raporlarda ve çalışma B2225'te tedavi edilen 30 hastanın 21'inde değerlendirilmiştir. Bu 21 hastanın sekizinde FIP1L1-PDGFR-alfa füzyon kinaz saptanmıştır. Çalışma B2225'te tedavi edilen hastalarda ortanca (medyan) tedavi süresi 13 ay olmuş (aralık: 1,4-22,3 ay), yayınlanmış literatürde yanıt veren hastalarda ise aralık 1 ay ila 30 ayın üzerinde bir süre arasında değişmiştir.
HES/CEL ile İlgili Klinik ÇalışmalarABL, KIT ya da PDGFR protein tirozin kinazlarla ilişkili yaşamı tehdit edici hastalıkları olan farklı hasta popülasyonlarında imatinibin test edildiği açık-etiketli, çok merkezli bir faz II klinik çalışma (çalışma B2225) yürütülmüştür. Bu çalışmada, HES'i olan 14 hasta günde 100 mg ila 1000 mg dozda imatinib ile tedavi edilmiştir. Yayınlanmış 35 vaka raporu ve vaka serisinde bildirilen HES/CEL'li 162 hasta daha günlük 75 mg ila 800 mg dozlarında imatinib almıştır. 176 hastadan oluşan toplam popülasyonun 117'sinde sitogenetik anormallikler değerlendirilmiştir. Bu 117 hastanın 61'inde FIP1L1-PDGFRα füzyon kinaz tanımlanmıştır. Diğer 3 yayınlanmış raporda dört HES hastasının daha FIP1L1-PDGFRα pozitif olduğu bulunmuştur. 65 FIP1L1-PDGFRα füzyon kinaz pozitif hastanın tümü, aylarca sürdürülen bir CHR elde etmiştir (raporlama sırasında sansürlenen 1+ ila 44+ ay arasında). Yakın tarihli bir yayında bildirildiği gibi, bu 65 hastadan 21'i, 28 aylık (aralık 13-67 ay) ortalama bir takip süresiyle tam moleküler remisyona ulaşmıştır. Bu hastaların yaşları 25 ile 72 aralığında olmuştur. Ek olarak, olgu raporlarında araştırmacılar tarafından semptomatolojide ve diğer organ disfonksiyon anormalliklerindeki gelişmeler bildirilmiştir. Kalp, sinir, deri/derialtı doku, solunum/göğüs/mediastinal, kas-iskelet/bağ dokusu/vasküler ve gastrointestinal organ sistemlerinde gelişmeler bildirilmiştir. HES/CEL'li pediyatrik hastalarda kontrollü çalışma yoktur. 3 yayında PDGFR gen yeniden düzenlemeleri ile ilişkili HES ve CEL'li üç (3) hasta bildirilmiştir. Bu hastaların yaşları 2 ila 16 yıl arasında değişmiştir ve imatinib günde 300 mg/m veya günlük 200 ila 400 mg arasında değişen dozlarda verilmiştir. Tüm hastalar tam hematolojik yanıt, tam sitogenetik yanıt ve/veya tam moleküler yanıt elde etmiştir. Rezeke edilemeyen ya da metastatik GIST'de yapılan klinik çalışmalarRezektabl olmayan veya metastatik malign gastrointestinal stromal tümörleri (GIST) olan hastalarda faz II, açık etiketli, randomize, kontrolsüz çok uluslu bir çalışma yürütülmüştür. Bu çalışmaya 147 hasta kaydedilmiş ve 36 ay boyunca günde bir kez oral olarak 400 mg veya 600 mg kullanımına randomize edilmiştir. Bu hastalar 18 ila 83 yaşında olup, rezektabl olmayan ve/veya metastatik Kit-pozitif malign GIST patolojik tanısına sahiptir. İmmünohistokimya Kit antikoru ile (A-4502, tavşan poliklonal antiserumu, 1:100; DAKO Corporation, Carpinteria, CA) antijen geri kazanımı sonrası avidin-biotin-peroksidaz kompleksi yöntemi ile analize göre rutin olarak yürütülmüştür.
Birincil etkililik kanıtı objektif yanıt oranlarını temel almıştır. Tümörlerin en az bir hastalık bölgesinde ölçülebilir olması gerekmiş olup, yanıt karakterizasyonu Güneybatı Onkoloji Grubu (SWOG) kriterlerini temel almıştır. Bulgular Tablo 6'da sunulmaktadır.
Tablo 6 STIB2222 kodlu GIST çalışmasında en iyi tümör yanıtı
Tüm dozlar (n=147) 400 mg n=73600 mg n=74Yanıtlar n (%)
Tam yanıt 1 (0,7) Kısmi yanıt 98 (66,7) Stabil hastalık 23 (15,6) İlerleyici hastalık 18 (12,2)
Değerlendirilemeyen 5 (3,4) Bilinmeyen 2 (1,4)
İki doz grubu arasında yanıt oranları bakımından farklılıklar söz konusu olmamıştır. Ara analiz tarihinde önemli sayıda stabil hastalığa sahip hasta, daha uzun süreli tedavi ile kısmi yanıta ulaşmıştır (medyan takip süresi 31 ay). Yanıta kadar geçen medyan süre 13 hafta olmuştur (%95 GA 12-23). Yanıt veren olgularda tedavi başarısızlığına kadar geçen medyan süre 122 hafta (%95 GA 106-147), genel çalışma popülasyonunda ise 84 hafta (%95 GA 71- 109) bulunmuştur. Medyan genel sağkalım noktasına ulaşılamamıştır. 36 aylık izlem sonrasında Kaplan-Meier sağkalım tahmini %68'dir.
İki klinik çalışmada (çalışma B2222 ve gruplar arası çalışma S0033), günlük imatinib dozu, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda 800 mg'a yükseltilmiştir. Doz, toplam 103 hastada 800 mg'a çıkarılmıştır; doz yükseltildikten sonra 6 hasta kısmi yanıta ve 21 hasta hastalık stabilizasyonuna ulaşarak %26'lık genel klinik yanıt sonucunu vermiştir. Eldeki güvenlilik verilerinden yola çıkılarak, 400 mg veya 600 mg daha düşük günlük dozlarında progrese olan hastalarda dozun günde 800 mg'a çıkarılmasının, imatinibin güvenlilik profilini etkilemediği görülmektedir. Adjuvan GIST için klinik çalışmalarAdjuvan tedavi koşullarında imatinib, 773 hasta ile yürütülen çok merkezli, çift kör, uzun süreli, plasebo kontrollü bir faz III çalışmada (Z9001) araştırılmıştır. Bu hastaların yaşları 18- 91 aralığında olmuştur. İmmünhistokimya ile KIT proteini eksprese eden primer GIST yönünde histolojik tanısı bulunan ve en geniş yerinde ≥3 cm tümör büyüklüğüne sahip olan, çalışmaya kayıt öncesindeki 14-70 gün içersinde primer GIST'i tam gross rezeksiyon ile alınan hastalar dahil edilmiştir. Primer GIST rezeke edildikten sonra hastalar şu iki koldan birine randomize edilmiştir: bir yıl süreyle imatinib 400 mg/gün veya plasebo.
Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden rekürense ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan rekürenssiz sağkalım (RFS) olmuştur.
İmatinib RFS'de anlamlı uzama sağlamış, imatinib grubunda hastaların %75'i 38. ayda rekürenssiz iken plasebo grubundaki hastaların %75'i 20. ayda rekürenssiz kalmıştır (sırasıyla %95 GA [30-hesaplanamaz]; [14-hesaplanamaz]); (tehlike oranı = 0.398 [0.259-0.610], p<0.0001). Bir yıl sonunda genel RFS, plasebo (%82.3) karşısında imatinib için anlamlı düzeyde daha iyi bulunmuştur (%97.7) (p<0.0001). Bu şekilde rekürens riski plaseboya oranla %89 azaltılmıştır (tehlike oranı = 0.113 [0.049-0.264]).
Primer GIST'lerine yönelik ameliyatları sonrasında hastalardaki rekürens riski, şu prognoz faktörleri esas alınarak retrospektif şekilde değerlendirilmiştir: tümör büyüklüğü, mitotik indeks, tümör yeri. Mitotik indeks verileri, tedavi amaçlı (ITT) popülasyonu oluşturan 713 hastanın 556'sı için mevcut idi. Birleşik Devletler Ulusal Sağlık Enstitüleri (NIH) ve Silahlı Kuvvetler Patoloji Enstitüsü (AFIP) risk sınıflandırmalarına göre yapılan alt grup analizlerinin sonuçları Tablo 7'de gösterilmektedir. Düşük ve çok düşük risk gruplarında herhangi bir fayda gözlenmemiştir. Genel bir sağkalım faydası gözlenmemiştir.
Tablo 7 NIH ve AFIP risk sınıflandırmasına göre Z9001 çalışması RFS analiz özeti
*Full takip periyodu- NE-Tahmin edilebilir değil
İkinci bir çok merkezli, açık etiketli faz III çalışmada (SSG XVIII/AIO), cerrahi GIST rezeksiyonu sonrasında olan ve aşağıdaki durumlardan birinin bulunduğu hastalarda 400 mg/gün imatinib ile 36 ay karşısında 12 aylık tedavi karşılaştırılmıştır: tümör çapı > 5 cm ve mitotik sayım > 5/50 yüksek güç alanı (HPF); veya tümör çapı > 10 cm ve herhangi bir mitotik sayım veya mitotik sayımı > 10/50 HPF olan herhangi bir büyüklükteki tümör ya da periton boşluğuna doğru rüptüre olan tümörler. Toplam 397 hastadan olur alınmış ve bu hastalar çalışmaya randomize edilmiştir (199 hasta 12 ay kolunda ve 198 hasta 36 ay kolunda) medyan yaş 61 idi [aralık 22 ila 84 yaş]). Medyan takip süresi 54 ay olup (randomizasyondan veri kesme tarihine kadar) ilk hastanın randomize edilişinden veri kesme tarihine kadar geçen medyan süre 83 aydır.
Çalışmanın birincil sonlanma noktası, randomizasyon tarihinden nükse ya da herhangi bir nedene bağlı ölüme kadar geçen süre şeklinde tanımlanan nükssüz sağkalım (RFS) olmuştur.
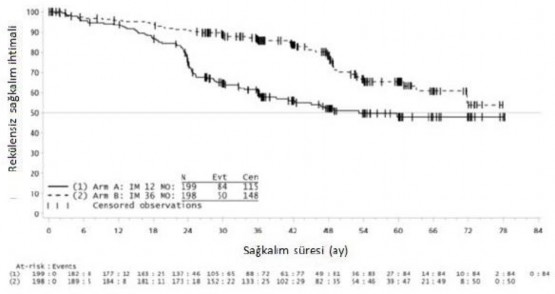
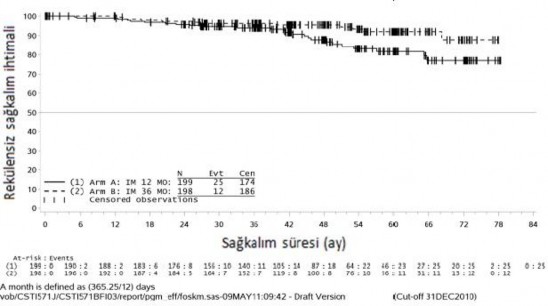
36 aylık imatinib tedavisi, 12 aylık imatinib tedavisi ile karşılaştırıldığında RFS'de anlamlı ölçüde uzama sağlamıştır (genel tehlike oranı (HR) = 0.46 [0.32, 0.65], p<0.0001) (Tablo 8, Şekil 1).
Buna ek olarak, 36 aylık imatinib tedavisi, 12 aylık imatinib tedavisi ile karşılaştırıldığında genel sağkalım (OS) süresini anlamlı ölçüde uzatmıştır (HR = 0.45 [0.22, 0.89], p=0.0187) (Tablo 8, şekil 2). Daha uzun süreli tedavi (> 36 ay) yeni rekürenslerin oluşumunu geciktirebilmektedir; ancak, bu bulgunun genel sağkalım üzerindeki etkisi halen bilinmemektedir.
Toplam ölüm sayısı 12 aylık tedavi kolu için 25 ve 36 aylık tedavi kolu için 12 şeklinde olmuştur.
İmatinib ile 36 ay süreli tedavi, ITT analizinde, yani tüm çalışma popülasyonun dahil edildiği analizde, 12 aylık tedaviden daha üstün bulunmuştur. Mutasyon tipine göre yapılan planlı bir alt grup analizinde, ekson 11 mutasyonları olan hastalarda 36 aylık tedavide RFS için tehlike oranı 0.35 olmuştur [%95 GA: 0.22, 0.56].
Gözlemlenen olay sayısının düşük olması sebebiyle, daha az yaygın olan mutasyon alt grupları için herhangi bir sonuç çıkartılamamaktadır. Tablo 8 12 aylık ve 36 aylık İmatinib Tedavisi (SSGXVIII/AIO Çalışması)
Şekil 1 Primer rekürenssiz sağkalım sonlanım noktası için Kaplan-Meier tahminleri (ITT popülasyonu)
Şekil 2 Genel sağkalım için Kaplan-Meier tahminleri (ITT popülasyonu)
C-Kit pozitif GIST olan pediyatrik hastalarda kontrollü çalışma yoktur. 7 yayında GIST'li (Kit ve PDGFR mutasyonları olan veya olmayan) onyedi (17) hasta bildirilmiştir. Bu hastaların yaşı 8 ila 18 aralığında olmuştur ve imatinib, hem adjuvan hem de metastatik koşullarda günde 300 ila 800 mg arasında değişen dozlarda verilmiştir. GIST tedavisi gören pediyatrik hastaların çoğunda c-kit veya PDGFR mutasyonlarını doğrulayan veriler bulunmamakta olup bu durum karışık klinik sonuçlara yol açmış olabilir.
İLAÇ GENEL BİLGİLERİ
Deva Holding A.Ş.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Geri Ödeme Kodu | A12986 |
| Satış Fiyatı | 14589.08 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 14589.08 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699525097910 |
| Etkin Madde | Imatinib |
| ATC Kodu | L01EA01 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 120 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |