IMBRUVICA 140 mg mg film kaplı tablet (30 adet) Farmakolojik Özellikler
{ Ibrutinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörleri, ATC kodu: L01EL01.
Etki mekanizması
İbrutinib küçük moleküllü, güçlü bir BTK (Bruton tirozin kinaz) inhibitörüdür. İbrutinib, BTK aktif bölgesindeki bir sistein molekülüyle (Cys-481) kovalent bağ oluşturarak, BTK enzimatik aktivitesinin sürekli inhibisyonuna yol açar. Tec kinaz ailesinin bir üyesi olan BTK,
![]()
molekülüdür. BCR yolağı, Mantle hücreli lenfoma (MHL), yaygın büyük B hücreli lenfoma
(DLBCL), foliküler lenfoma ve KLL dahil, çeşitli B-hücreli malignitelerin patogenezinde rol oynamaktadır. BTK'nin B hücresi yüzey reseptörleri aracılı gerçekleşen sinyal iletimindeki rolü, B-hücre trafiği, kemotaksis ve adhezyon için gerekli yolakların aktivasyonuyla sonuçlanır. Preklinik çalışmalar, ibrutinibin in-vivo malign B-hücre çoğalması ve sağ kalımının yanı sıra, in-vitro hücre göçü ve substrat adezyonunu engellediğini göstermektedir. Klinik öncesi tümör modellerinde, ibrutinib ve venetoklaks kombinasyonu, her iki ajanın tek başına kullanılmasına kıyasla artmış hücresel apoptoz ve anti-tümör aktivite ile sonuçlanmıştır. İbrutinib tarafından gerçekleştirilen BTK inhibisyonu, KLL hücrelerinin bir hücre sağkalım yolu olan BCL-2'ye bağımlılığını arttırırken, venetoklaks da BCL-2'yi inhibe ederek apoptoza öncülük eder.
Lenfositoz
Tedaviye başlanmasıyla birlikte, IMBRUVICA ile tedavi edilen KLL hastalarının yaklaşık dörtte üçünde sıklıkla lenfadenopatide küçülme ile ilişkili, geri dönüşümlü bir lenfosit artışı (yani başlangıca göre %50 ve üzerinde bir artış ve mutlak sayısı 5.000/mcL'nin üzerinde) gözlenmiştir. Bu etki ayrıca IMBRUVICA ile tedavi gören relaps ya da refrakter MHL hastalarının da üçte birinde görülmüştür. Gözlenen bu lenfositoz farmakodinamik bir etkidir ve diğer klinik bulguların yokluğunda progresif hastalık olarak değerlendirilmemelidir. Her iki hastalık tipinde de lenfositoz tipik olarak IMBRUVICA tedavisinin ilk ayında meydana gelir ve tipik olarak MHL hastalarında medyan 8 hafta ve KLL hastalarında medyan 14 haftada düzelir. Bazı hastalarda dolaşımdaki lenfosit sayısında büyük artışlar görülmüştür (örneğin >400.000/mcL).
IMBRUVICA ile tedavisi gören WM'li hastalarda lenfositoz gözlenmemiştir.
In vitro platelet agregasyonu
Bir in vitro çalışmada, ibrutinib kolajen etkisi ile oluşan platelet agregasyon inhibisyonu göstermiştir. İbrutinib, platelet agregasyonunun diğer agonistlerini kullanarak anlamlı bir platelet agregasyon inhibisyonu göstermemiştir.
Kardiyak elektrofizyoloji ve QT/QTc aralığı üzerindeki etki
İbrutinibin QTc aralığı üzerindeki etkisi, plasebo ve pozitif kontrollerle randomize, çift kör ayrıntılı bir QT çalışmasında 20 sağlıklı erkek ve kadın gönüllüde değerlendirilmiştir. İbrutinib 1.680 mg'lik supraterapötik bir dozda QTc aralığını klinik olarak ilgili bir derecede uzatmamıştır. İbrutinib ile plasebo arasındaki başlangıçtaki düzeltilmiş ortalama bakımından farklılıklar için 2 yanlı %90 GA'nın en büyük üst sınırı 10 ms'nin altında olmuştur. Aynı çalışmada, QTc aralığında konsantrasyona bağlı bir kısalma gözlenmiştir (1.680 mg'lık supraterapötik dozu takiben 719 ng/mL Cdeğerinde -5,3 ms [%90 GA: -9,4, -1,1]).
Klinik etkililik ve güvenlilik MHL
Relaps ya da refrakter MHL hastalarında IMBRUVICA'nın güvenliliği ve etkililiği, 111 hastayı kapsayan açık-etiketli, çok-merkezli bir Faz 2 çalışmada değerlendirilmiştir (PCYC- 1104-CA Çalışması). Medyan yaş 68 yıl idi (aralık: 40 ila 84 yıl), hastaların %77'si erkek ve
%92'si beyaz ırktandı. ECOG performans durumu 3 ya da üzerinde olan hastalar çalışmaya alınmamıştır. Tanıdan itibaren geçen medyan süre 42 aydı; önceki tedavilerin medyan sayısı 3 olup (aralık: 1 ila 5 tedavi), hastaların %35'ine daha önceden yüksek doz kemoterapi,
%43'üne bortezomib, %24'üne lenalidomid ve %11'ine de daha önce otolog veya allojenik kök hücre nakli uygulanmıştır. Başlangıçta, taramada hastaların %39'unda kitlesel (bulky) hastalık (≥5 cm), %49'unda Basitleştirilmiş MHL Uluslararası Prognostik İndeks (MIPI) ile
ölçülen yüksek riskli skor ve%72'sindedeilerlem iş hastalık mevcuttu (ekstranodal tutulum
ve/veya kemik iliği tutulumu).
IMBRUVICA hastalık progresyonu veya kabul edilemez toksisite meydana gelene kadar oral olarak günde bir kez 560 mg dozda uygulandı. Tümör yanıtı, non-Hodgkin lenfoma (NHL) için revize edilmiş Uluslararası Çalışma Grubu (IWG) kriterlerine göre değerlendirildi. Bu çalışmadaki birincil sonlanım noktası, araştırmacı tarafından değerlendirilen genel yanıt oranıydı (ORR). IMBRUVICA'ya verilen yanıtlar Tablo 2'de gösterilmektedir.
Tablo 2: Relapslı ya da Refrakter MHL Hastalarında ORR ve DOR (PCYC-1104-CA Çalışması)
| Toplam N = 111 |
ORR (%) | 67,6 |
%95 GA (%) | (58,0;76,1) |
CR (%) | 20,7 |
PR (%) | 46,8 |
Medyan DOR (CR+PR) (ay) | 17,5 (15,8, NR) |
İlk yanıta kadar geçen medyan süre, ay (aralık) | 1,9 (1,4-13,7) |
CR'ye kadar geçen medyan süre, ay (aralık) | 5,5 (1,7-11,5) |
GA = güven aralığı; CR = tam yanıt; DOR = yanıt süresi; ORR = genel yanıt oranı; PR = kısmi yanıt; NR = ulaşılmamıştır
Bir Bağımsız İnceleme Komitesi (IRC) etkililik verilerini ilave olarak değerlendirmiş ve
%69'luk bir ORR, %21'lik bir CR ve %48'lik bir PR oranı ortaya koymuştur. IRC DOR'yi 19,6 ay olarak saptanmıştır.
IMBRUVICA'ya verilen genel yanıt bortezomib ve lenalidomidi kapsayan geçmiş tedaviden ya da temelde yatan risk/prognoz faktörlerinden, kitlesel (bulky) hastalık, cinsiyet ya da yaştan bağımsız olarak gözlenmiştir.
IMBRUVICA'nın güvenliliği ve etkililiği, daha önce en az bir tedavi görmüş 280 MHL hastasını kapsayan randomize, açık etiketli, çok merkezli Faz 3 çalışmada ortaya konmuştur (Çalışma MCL3001). Hastalar, 21 gün süreyle günde bir kez oral yoldan 560 mg IMBRUVICA ya da ilk kürün 1, 8 ve 15. günlerinde 175 mg ve onu takiben her 21 günlük kürün 1, 8 ve 15. günlerinde intravenöz yoldan 75 mg temsirolimus alacak şekilde 1:1 oranında randomize edilmiştir. Her iki kolda da tedaviye, hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam edilmiştir. Medyan hasta yaşı 68 idi (aralık: 34 ila 88); hastaların %74'ü erkek ve %87'si beyaz ırktandı. Tanıdan itibaren geçen medyan süre 43 aydı ve önceki tedavilerin medyan sayısı 2 olup (aralık: 1 ila 9 tedavi), hastaların %51'ine daha önceden yüksek doz kemoterapi, %18'ine bortezomib, %5'ine lenalidomid ve %24'üne de daha önce kök hücre nakli uygulanmıştır. Başlangıçta, taramada hastaların %53'ünde kitlesel (bulky) hastalık (≥5 cm), %21'inde Basitleştirilmiş MIPI ile ölçülen yüksek riskli skor,
%60'ında ekstranodal hastalık ve %54'ünde de kemik iliği tutulumu mevcuttu.
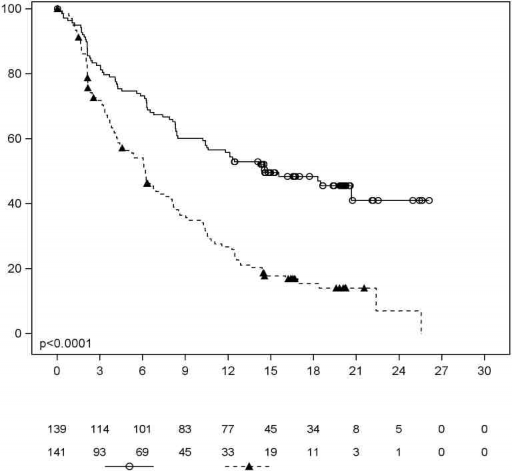
Progresyonsuz sağkalım (PFS), IRC tarafından non-Hodgkin lenfoma (NHL) için revize edilmiş Uluslararası Çalışma Grubu (IWG) kriterlerine göre değerlendirildi. MCL3001 çalışmasına yönelik etkililik sonuçları Tablo 3'te ve PFS için Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 3: Relaps veya Refrakter MHL Hastalarında Etkililik Sonuçları (Çalışma MCL3001)
Sonlanım Noktası | IMBRUVICA N = 139 | Temsirolimus N = 141 |
PFS | ||
Medyan PFS (%95 GA), (ay) | 14,6 (10,4, NE) | 6,2 (4,2, 7,9) |
| HR = 0,43 [%95 GA: 0,32, 0,58] | |
ORR (%) | 71,9 | 40,4 |
p değeri | p < 0,0001 | |
NE = tahmin edilemez; HR = tehlike oranı; GA = güven aralığı; ORR = genel yanıt oranı;
PFS = progresyonsuz sağkalım
İbrutinib ile tedavi edilen daha az hasta temsirolimusa karşı lenfoma semptomlarında klinik olarak anlamlı kötüleşme yaşamış (%27 karşısında %52) ve semptomların kötüleşmesine kadar geçen süre ibrutinib ile temsirolimus karşısında daha yavaş olmuştur (HR 0,27, p
<0,0001).
Şekil 1: MCL3001 Çalışmasına Ait Kaplan-Meier PFS (ITT Popülasyonu) Eğrisi
Progresyonsuz hayatta kalan hasta %
Imbruvica
Temsirolimus
Risk altında olan gönüllüler Imbruvica
Temsirolimus
Ay
Imbruvica Temsirolimus
KLL
KLL için daha önce tedavi almamış hastalar Tek ajan
Daha önce tedavi almamış 65 yaş ve üzeri KLL hastalarında IMBRUVICA'nın klorambusil ile karşılaştırıldığı randomize, çok merkezli, açık etiketli bir Faz 3 çalışması (PCYC-1115- CA) gerçekleştirilmiştir. 65-70 yaş arasındaki hastalarda fludarabin, siklofosfamid ve rituksimab ile birinci basamak kemoimmünoterapi kullanımına engel olan en az bir komorbidite olması koşulu konmuştur. Hastalar (n=269) hastalık progresyonu veya kabul edilemez toksisiteye kadar günde 420 mg IMBRUVICA veya her bir 28 günlük kürün 1. ve
15. günlerinde 0,5 mg/kg başlangıç dozunda klorambusil almak ve 0,8 mg/kg'lık doz artışları tolere edildiği sürece maksimum 12 kür için izin verilir şekilde 1:1 oranda kollara randomize edildiler. Hastalık progresyonunun doğrulanması ardından klorambusil grubundaki hastalar ibrutinib grubuna geçiş yapabilmiştir.
Medyan hasta yaşı 73 idi (aralık 65 ila 90); hastaların %63'ü erkek ve %91'i beyaz ırktandı. Hastaların %91'inin başlangıçtaki ECOG performans durumu 0 ya da 1 ve %9'unun ECOG performans durum 2'ydi. Çalışmaya 269 KLL hastası kaydedilmiştir. Başlangıçta, hastaların
%45'inde ileri klinik evre (Rai Evre III veya IV), %35'inde ≥ 5 cm'lik en az bir tümör,
%39'unda başlangıçta anemi, %23'ünde başlangıçta trombositopeni, %65'inde > 3500 mcg/L β2 mikroglobulin yüksekliği, %47'sinde < 60 ml/dak CrCL, %20'sinde del11q, %6'sında del 17p/tümör protein 53 (TP53) mutasyonu ve %44'ünde mutasyonsuz immünoglobulin ağır zincir değişken bölgesi (IGHV) mevcuttu.
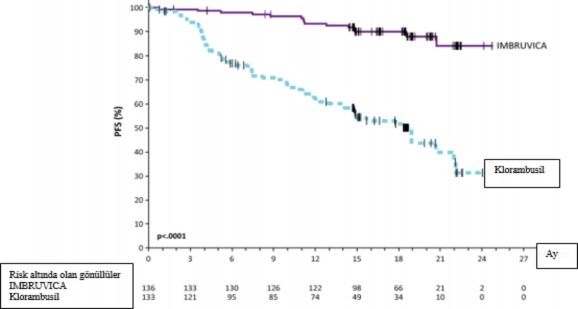
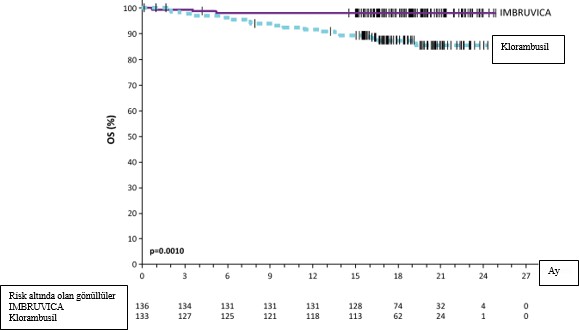
Uluslararası KLL Çalışma Grubu (IWCLL) kriterlerine göre Bağımsız Değerlendirme Kurulu (IRC) tarafından değerlendirilen progresyonsuz sağkalım (PFS), IMBRUVICA kolunda ölüm ya da progresyon riskinde %84 oranında istatistiksel olarak anlamlı bir azalma göstermiştir. PCYC-1115-CA çalışmasına ait etkililik sonuçları Tablo 4'te ve PFS ve OS için Kaplan- Meier eğrileri sırasıyla Şekil 2 ve 3'te gösterilmektedir.
ITT popülasyonunda klorambusil karşısında ibrutinib lehine istatistiksel olarak anlamlı bir sürekli trombosit veya hemoglobin düzelmesi gözlenmiştir. Başlangıçta sitopenileri olan hastalarda sürekli hematolojik düzelme aşağıdaki gibi olmuştur: ibrutinib ve klorambüsil için sırasıyla trombosit için %77,1'e %42,9, hemoglobin için %84,3'e %45,5'tir.
Tablo 4: PCYC-1115-CA Çalışmasına Ait Etkililik Sonuçları
Sonlanım noktası | IMBRUVICA N = 136 | Klorambüsil N = 133 |
PFS | ||
Olay sayısı (%) | 15 (11,0) | 64 (48,1) |
Medyan (%95 GA), ay | Ulaşılmadı | 18,9 (14,1, 22,0) |
HR (%95 GA) | 0,161 (0,091, 0,283) | |
ORR(CR + PR) | % 82,4 | % 35,3 |
P-değeri | <0,0001 | |
OS |
| |
Ölümlerin sayısı (%) | 3 (2,2) | 17 (12,8) |
HR (%95 GA) | 0,163 (0,048, 0,558) | |
GA = güven aralığı; HR = tehlike oranı; CR = tam yanıt; ORR = genel yanıt oranı; OS = genel sağkalım; PFS = progresyonsuz sağkalım; PR = kısmi yanıt
IRC tarafından değerlendirilenmedyan18,4aylıktakip.
Medyan OS'ye iki tedavi kolunda da ulaşılmamıştır.OSiçinp<0,005
Şekil 2: PCYC-1115-CA Çalışmasında Kaplan-Meier PFS Eğrisi (ITT Popülasyonu)
Şekil 3: PCYC-1115-CA Çalışmasında Kaplan-Meier OS Eğrisi (ITT Popülasyonu)
48 aylık takip
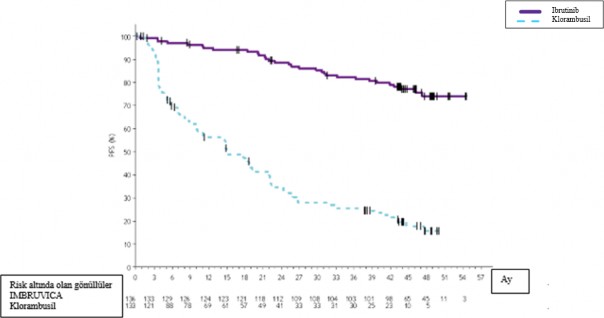
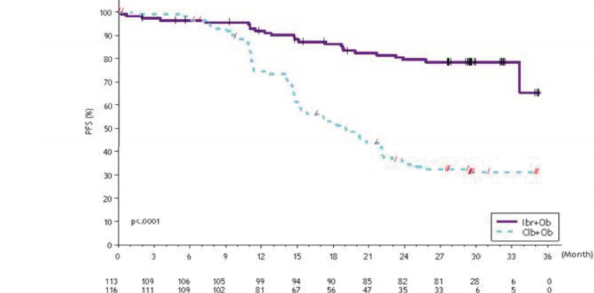
PCYC-1115-CA ve ona ait uzatma çalışmasında 48 aylık medyan takip süresi ile IMBRUVICA kolundaki hastalar için, araştırmacı değerlendirmesine göre ölüm veya progresyon riskinde %86 oranında bir azalma gözlenmiştir. Araştırmacı tarafından değerlendirilen medyan PFS'ye IMBRUVICA kolunda ulaşılmazken, klorambusil kolunda 15 ay [%95 GA (10,22, 19,35)] olarak bulunmuştur (HR=0,14 [%95 GA (0,09, 0,21)]).
olarak bulunmuştur. Güncellenmiş Kaplan-Meier PFS eğrisi Şekil 4'te gösterilmektedir.
Araştırmacı tarafından değerlendirilen ORR, IMBRUVICA kolunda %91,2 ve klorambusil kolunda %36,8 olmuştur. IWCLL kriterlerine göre CR oranı, IMBRUVICA kolunda %16,2 ve klorambusil kolunda %3 olmuştur. Uzun süreli takip sırasında, ilk başta klorambusil koluna randomize edilen toplam 73 hasta (%54,9) daha sonra çapraz geçiş tedavisi olarak ibrutinib almıştır. Kırk sekizinci aydaki Kaplan-Meier OS dönüm noktası tahmini IMBRUVICA kolunda %85,5 olmuştur.
PCYC-1115-CA çalışmasında ibrutinib ile görülen tedavi etkisi, del 17p/TP53 mutasyonu, del 11q ve/veya mutasyonsuz IGHV olan yüksek riskli hastalar genelinde tutarlılık göstermiştir.
Şekil 4: PCYC-1115-CA Çalışmasında 48 Aylık Takip ile Kaplan-Meier PFS Eğrisi (ITT Popülasyonu)
Kombinasyon tedavisi
IMBRUVICA'nın daha önce tedavi görmemiş KLL/SLL hastalarındaki güvenliliği ve etkililiği, obinutuzumabla kombinasyon halinde IMBRUVICA'nın obinutuzumabla kombinasyon halinde klorambusille karşılaştırıldığı randomize, çok merkezli, açık etiketli, Faz 3 çalışmasında (PCYC-1130-CA) daha ayrıntılı biçimde incelenmiştir. Çalışmaya 65 yaşında veya daha büyük ya da <65 yaşında olan ve mevcut hastalıklar olan, kreatinin klirensine göre böbrek işlevinde düşüş olan (<70 mL/dk.) veya del 17p/TP53 mutasyonu olan hastalar kaydedilmiştir. Hastalar (n=229) 6 döngü boyunca 28 günlük her bir döngünün 1. ve
15. günlerinde hastalık ilerlemesine veya kabul edilemez toksisiteye kadar günlük IMBRUVICA 420 mg'a ya da 0,5 mg/kg klorambusil dozuna 1:1 oranında randomize edilmiştir. Her iki kolda da hastalara birinci döngünün 1., 8. ve 15. gününde 1000 mg obinutuzumab verilmiş, daha sonra izleyen 5 döngünün birinci gününde tedavi uygulanmıştır (toplam 6 döngü, her biri 28 günlük). İlk obinutuzumab dozu 1. gün (100 mg) ve 2. gün (900 mg) arasında bölünmüştür.
Medyan yaş 71'dir (aralık, 40 ila 87) ve hastaların %64'ü erkek, %96'sı beyazdır. Tüm hastaların bazal ECOG performansstatüsü0(%48)ve1-2'dir (%52). Başlangıçta hastaların
dır
%44'ünde bazal anemi, %22'sinde bazal trombositopeni, %28'sinde CrCL <60 mL/dk var
ve medyan Yaşlılarda Kümülatif Hastalık Değerlendirme Ölçeği (CIRS-G) 4'tür (aralık, 0 ila 12). Başlangıçta, hastaların %65'inde yüksek risk faktörleriyle KLL/SLL görülmüştür (del17p/TP53 mutasyonu [%18], del11q [%15] veya mutasyona uğramamış IGHV [%54]).
İlerlemesiz sağkalım (PFS), IWCLL kriterlerine göre IRC tarafından incelenmiştir ve IMBRUVICA kolunda ölüm ve ilerleme riskinde istatistik açıdan anlamlı %77 oranında bir düşüş olduğuna işaret etmiştir. Çalışmadaki 31 aylık medyan izlem süresinde, IMBRUVICA
+ obinutuzumab kolunda medyan PFS'ye ulaşılmamıştır ve klorambusil + obinutuzumab kolunda 19 aydır. PCYC-1130-CA için etkililik sonuçları Tablo 5'te gösterilmektedir ve PFS için Kaplan-Meier eğrisi Şekil 5'te gösterilmektedir.
Tablo 5: PCYC-1130-CA Çalışmasındaki Etkililik Sonuçları
Bitiş noktası | IMBRUVICA + Obinutuzumab N=113 | Klorambusil + Obinutuzumab N=116 |
İlerlemesiz sağkalım |
|
|
Olay sayısı (%) | 24 (21,2) | 74 (63,8) |
Medyan (%95 GA), ay | Ulaşılmamıştır | 19 (15,1; 22,1) |
HR (%95 GA) | 0,23 (0,15; 0,37) | |
Toplam Yanıt Oranı | 88,5 | 73,3 |
CR | 19,5 | 7,8 |
PR | 69 | 65,5 |
GA=Güven Aralığı; HR = tehlike oranı; CR = tam yanıt; PR = kısmi yanıt
a IRC tarafından değerlendirilmiştir.
b IMBRUVICA + obinutuzumab kolunda tam yanıt veren ve tamamlanamamış kemik iliği iyileşmesi ile tam yanıt (CRi) olan 1 hasta dahil.
c PR = PR + nPR
Şekil 5: PCYC-1130-CA Çalışmasında PFS İçin Kaplan-Meier Eğrisi (ITT Popülasyonu)
İbrutinibin tedavi etkisi yüksekriskiKLL/SLLpopülasyonda tutarlıdır (del 17p/TP53
lık
PFS HR 0,15'tir [%95 GA (0,09; 0,27)]. Yüksek riskli KLL/SLL popülasyonu için 2 yıl
PFS oranı tahminleri IMBRUVICA + obinutuzumab ve klorambusil + obinutuzumab kollarında sırasıyla %78,8 [%95 GA (67,3; 86,7)] ve %15,5'tir [%95 GA (8,1; 25,2)].
Tablo 6: PFS Alt Grup Analizi (PCYC-1130-CA Çalışması)
| N | Tehlike Oranı | %95 GA |
Tüm hastalar | 229 | 0,231 | 0,145; 0,367 |
Yüksek risk (del17p/TP53/del11q/mutasyona uğramamış IGHV) | |||
Evet | 148 | 0,154 | 0,087; 0,27 |
Hayır | 81 | 0,521 | 0,221; 1,231 |
Del17p/TP53 | |||
Evet | 41 | 0,109 | 0,031; 0,38 |
Hayır | 188 | 0,275 | 0,166; 0,455 |
FISH | |||
Del17p | 32 | 0,141 | 0,039; 0,506 |
Del11q | 35 | 0,131 | 0,03; 0,573 |
Diğerleri | 162 | 0,302 | 0,176; 0,52 |
Mutasyona uğramamış IHGV | |||
Evet | 123 | 0,15 | 0,084; 0,269 |
Hayır | 91 | 0,3 | 0,12; 0,749 |
Yaş | |||
<65 | 46 | 0,293 | 0,122; 0,705 |
≥65 | 183 | 0,215 | 0,125; 0,372 |
Kitlesel hastalık | |||
<5 cm | 154 | 0,289 | 0,161; 0,521 |
≥5 cm | 74 | 0,184 | 0,085; 0,398 |
Rai evresi | |||
0/I/II | 110 | 0,221 | 0,115; 0,424 |
III/IV | 119 | 0,246 | 0,127; 0,477 |
CRF'ye göre ECOG | |||
0 | 110 | 0,226 | 0,11; 0,464 |
1-2 | 119 | 0,239 | 0,13; 0,438 |
Katmanlaştırılmamış analize göre tehlike oranı
IMBRUVICA + obinutuzumabla tedavi edilen hastaların %25'inde, klorambusil ve obinutuzumabla tedavi edilen hastaların %58'inde tüm derecelerde infüzyon ilişkili reaksiyon gözlemlenmiştir. IMBRUVICA + obinutuzumabla tedavi edilen hastaların %3'ünde, klorambusil ve obinutuzumabla tedavi edilen hastaların %9'unda Derece 3 veya daha ciddi infüzyon ilişkili reaksiyon gözlemlenmiştir.
IMBRUVICA'nın daha önce tedavi edilmemiş KLL veya SLL hastalarındaki güvenliliği ve etkililiği randomize, çok merkezli, açık etiketli bir Faz 3 çalışmasında (E1912), rituksimabla kombinasyon halinde IMBRUVICA (IR) ile standart fludarabin, siklofosfamid ve rituksimab (FCR) kemoimmünoterapisi karşılaştırılarak incelenmiştir. Çalışmaya daha önce tedavi edilmemiş ve 70 yaşında veya daha küçük KLL veya SLL hastaları kaydedilmiştir. Hastalar (n=529) 2:1 oranında IR veya FCR'ye atanmıştır. IMBRUVICA, hastalık ilerlemesi veya kabul edilemez toksisite olana kadar 420 mg/gün dozunda uygulanmıştır. Fludarabin 25 mg/m dozunda ve siklofosfamid 250 mg/m dozunda, her ikisi de 1.-6. Döngülerin 1., 2. ve
3. günlerinde uygulanmıştır.RituksimabIRkolundatoplam6 döngü boyunca, 2. döngüde,
![]()
birinci döngünün 2. gününde 325 mg/m dozunda, izleyen 5 döngünün 1. gününde 500 mg/m dozunda uygulanmıştır. Her bir döngü 28 gündür.
Medyan yaş 58'dir (aralık 28 ila 70) ve hastaların %67'si erkek, %90'ı beyazdır. Tüm hastaların bazal ECOG performans statüsü 0 veya 1 (%98) veya 2'dir (%2). Bazalda, hastaların %43'ünde Rai evresinin 3. veya 4. evrede olduğu görülmüştür ve hastaların
%59'unda yüksek risk faktörlü KLL/SLL görülmüştür (TP53 mutasyonu [%6], del11q [%22] veya mutasyonsuz IGHV [%53]).
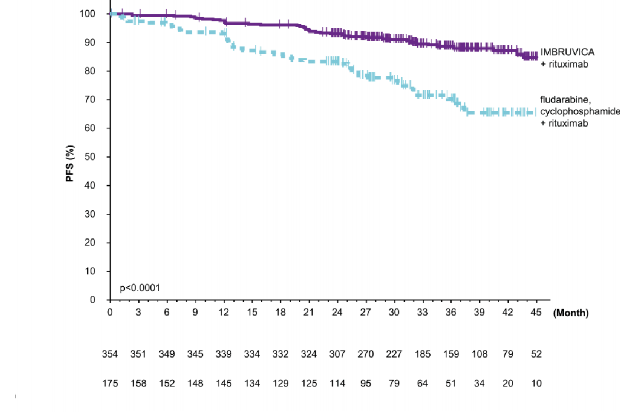
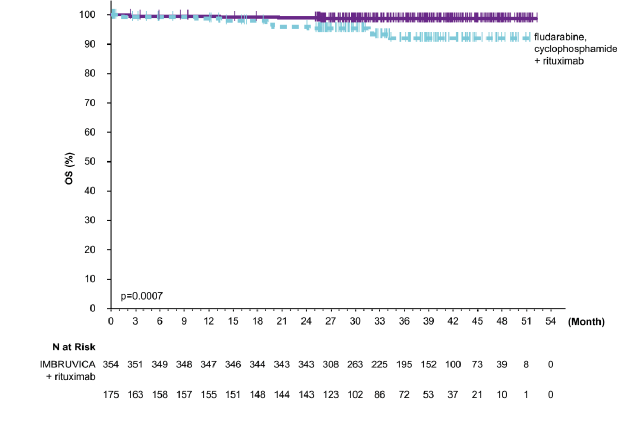
37 aylık medyan takip süresi olan E1912 çalışmasının etkililik sonuçları Tablo 7'de gösterilmektedir. PFS (IWCLL kriterlerine göre değerlendirilmiştir) ve OS için Kaplan-Meier eğrileri sırasıyla Şekil 6 ve Şekil 7'de gösterilmektedir.
Tablo 7: E1912 Çalışmasındaki Etkililik Sonuçları
Bitiş noktası | İbrutinib+ rituksimab (IR) N=354 | Fludarabin, Siklofosfamid ve Rituksimab (FCR) N=175 |
İlerlemesiz sağkalım | ||
Olay sayısı (%) | 41 (12) | 44 (25) |
Hastalık ilerlemesi | 39 | 38 |
Ölüm olayları | 2 | 6 |
Medyan (%95 GA), ay | NE (49,4; NE) | NE (47,1; NE) |
HR (%95 GA) | 0,34 (0,22; 0,52) | |
P-değeri | <0,0001 | |
Toplam sağkalım | ||
Ölüm sayısı (%) | 4 (1) | 10 (6) |
HR (%95 GA) | 0,17 (0,05; 0,54) | |
P-değeri | 0,0007 | |
Toplam Yanıt Oranı(%) | 96,9 | 85,7 |
a P değeri katmanlaştırılmamış log-sıra testine göredir.
b Araştırmacı değerlendirmeli.
HR = tehlike oranı; NE = değerlendirilemez
![]()
Şekil 6: E1912 Çalışmasında PFS'nin Kaplan-Meier Eğrisi (ITT Popülasyonu)
İbrutinibin tedavi etkisi yüksek riskli KLL/SLL popülasyonunda (TP53 mutasyonu, del11q veya mutasyonsuz IGHV) tutarlıdır; PFS HR değeri 0,23 [%95 GA (0,13; 0,40)], p <0,0001, Tablo 8'de gösterilmektedir. Yüksek riskli KLL/SLL popülasyonu için 3 yıllık PFS oranı tahminleri IR ve FCR kollarında sırasıyla %90,4 [%95 GA (85,4; 93,7)] ve %60,3'tür [%95
GA (46,2; 71,8)].
Tablo 8: PFS Alt Grup Analizi (E1912 Çalışması)
![]()
| N | Tehlike | %95 GA |
Tüm hastalar | 529 | 0,340 | 0,222; 0,522 |
Yüksek riskli (TP53/del11q/mutasyonsuz IGHV) | |||
Evet | 313 | 0,231 | 0,132; 0,404 |
Hayır | 216 | 0,568 | 0,292; 1,105 |
del11q | |||
Evet | 117 | 0,199 | 0,088; 0,453 |
Hayır | 410 | 0,433 | 0,260; 0,722 |
Mutasyonsuz IGHV | |||
Evet | 281 | 0,233 | 0,129; 0,421 |
Hayır | 112 | 0,741 | 0,276; 1,993 |
Kitlesel hastalık | |||
<5 cm | 316 | 0,393 | 0,217; 0,711 |
≥5 cm | 194 | 0,257 | 0,134; 0,494 |
Rai evresi | |||
0/I/II | 301 | 0,398 | 0,224; 0,708 |
III/IV | 0,148; 0,534 | ||
0 | 335 | 0,242 | 0,138; 0,422 |
1-2 | 194 | 0,551 | 0,271; 1,118 |
Tehlike oranı katmanlaştırılmamış analize dayanmaktadır.
Şekil 7: E1912 Çalışmasında OS'nin Kaplan-Meier Eğrisi (ITT Popülasyonu)
Sabit süreli kombinasyon tedavisi
Önceden tedavi edilmemiş KLL hastalarında IMBRUVICA'nın venetoklaks ile kombinasyon halinde sabit süreli tedavisinin güvenliliği ve etkililiği, randomize, açık etiketli bir faz 3 çalışmasında (CLL3011) değerlendirilmiştir. Çalışmaya, daha önce tedavi edilmemiş, CIRS skoru >6 veya CrCL ≥30 ila <70 mL/dak olan <65 yaş KLL hastaları ve 65 yaş ve üstü yetişkin hastalar dahil edilmiştir. Del 17p veya bilinen TP53 mutasyonları olan hastalar çalışma dışı bırakılmıştır. Hastalar (n=211), venetoklaks ile kombinasyon halinde IMBRUVICA veya obinutuzumab ile kombinasyon halinde klorambusil almak üzere 1:1 oranında randomize edilmiştir. IMBRUVICA + venetoklaks kolundaki hastalar, 3 kür boyunca tek ajan IMBRUVICA ve ardından 12 kür (5 haftalık doz titrasyon programı dahil) venetoklaks ile kombinasyon halinde IMBRUVICA almıştır. Her kür 28 gündür. IMBRUVICA günde 420 mg dozda uygulanmıştır. Venetoklaks, 1 hafta boyunca 20 mg ile başlanarak, ardından 1 hafta boyunca her bir 50 mg, 100 mg ve 200 mg doz seviyesinde, ardından önerilen günlük doz olan 400 mg olarak uygulanmıştır. Klorambusil + obinutuzumab koluna randomize edilen hastalar, 6 kür boyunca tedavi görmüştür. Obinutuzumab, 1. kür 1., 8. ve 15. günlerinde 1.000 mg dozunda uygulanmıştır. 2 ila 6.
kürlerde, 1. günde 1.000 mg obinutuzumab verilmiştir. Klorambusil, 1 ila 6. kürlerin 1. ve 15. günlerinde 0.5 mg/kg vücut ağırlığı dozunda uygulanmıştır. Sabit süreli rejimlerden herhangi birinin tamamlanmasının ardından IWCLL kriterlerine göre progrese olduğu tespit edilen hastalar, tek ajan IMBRUVICA ile tedavi edilebilir.
ta,
hastaların %18'i del 11q'lu KLL ve %52'si mutasyona uğramamış IGHV ile başvurmuştur. Tümör lizis sendromu riski için temel değerlendirmede, hastaların %25'inde yüksek tümör yükü vardır. 3 kür tek ajan IMBRUVICA öncü tedavisinden sonra, hastaların %2'sinde yüksek tümör yükü görülmüştür. Yüksek tümör yükü, herhangi bir lenf nodu ≥10 cm veya herhangi bir lenf nodu ≥5 cm ve mutlak lenfosit sayısı ≥25Ã10/L olarak tanımlanmıştır. 28 aylık medyan takip süresinde, IWCLL kriterlerine göre CLL3011 çalışması için IRC tarafından değerlendirilen etkililik sonuçları Tablo 9'da, PFS için Kaplan-Meier eğrisi Şekil 8'de ve minimal kalıntı hastalık oranları (MRD) negatifliği oranları Tablo 10'da sunulmaktadır.
Tablo 9: CLL3011 Çalışmasındaki Etkililik Sonuçları
Bitiş noktası | IMBRUVICA + Venetoklaks N=106 | Klorambusil + Obinutuzumab N=105 |
İlerlemesiz Sağkalım |
|
|
Olay sayısı (%) | 22 (20,8) | 67 (63,8) |
Medyan (%95 GA), ay | Ulaşılmamıştır (31,2, Ulaşılmamıştır) | 21 (16,6, 24,7) |
HR (%95 GA) | 0,22 (0,13, 0,36) | |
P-değeri | <0,0001 | |
Tam Yanıt Oranı (%) | 38,7 | 11,4 |
%95 GA | (29,4, 48) | (5,3, 17,5) |
P-değeri | <0,0001 | |
Toplam Yanıt Oranı (%) | 86,8 | 84,8 |
%95 GA | (80,3, 93,2) | (77,9, 91,6) |
CR = tam yanıt; CRi = tamamlanamamış kemik iliği iyileşmesi ile tam yanıt; HR = tehlike oranı; NE = ulaşılamamıştır; nPR = nodüler kısmi yanıt; PR = kısmi yanıt
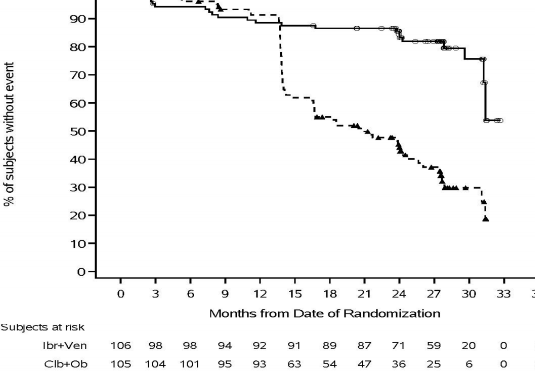
Şekil 8: CLL3011 Çalışması KLL Hastalarına ait Kaplan-Meier PFS (ITT popülasyonu) Eğrisi
IMBRUVICA + venetoklaksın tedavi etkisi, 0,23 PFS HR [%95 GA (0,13, 0,41)] ile yüksek riskli KLL popülasyonunda (TP53 mutasyonu, del 11q veya mutasyona uğramamış IGHV) ile tutarlıdır.
Genel sağkalım verileri henüz olgun değildir. 28 aylık medyan takipte, toplam 23 ölümle tedavi kolları arasında anlamlı fark yoktur: IMBRUVICA + venetoklaks kolunda 11 (%10,4) ve klorambusil + obinutuzumab kolunda 12 (%11,4) OS HR 1,048 [%95 GA (0,454, 2,419)].
6 aylık ek takibin ardından, IMBRUVICA + venetoklaks kolunda ve klorambusil + obinutuzumab kolunda sırasıyla 11 (%10,4) ve 16 (%15,2) ölüm rapor edilmiştir ve tahmini
OS HR 0,76'dır [%95 GA (0,352, 1,642].
Tablo 10: CLL3011 Çalışması MRD Negatiflik Oranları
| NGS Testi | Akış sitometrisi | ||
| IMBRUVICA + Venetoklaks N=106 | Klorambusil + Obinutuzumab N=105 | IMBRUVICA + Venetoklaks N=106 | Klorambusil + Obinutuzumab N=105 |
MRD Negatiflik oranı | ||||
Kemik iliği, n (%) | 59 (55,7) | 22 (21) | 72 (67,9) | 24 (22,9) |
%95 GA | (46,2, 65,1) | (13,2, 28,7) | (59, 76,8) | (14,8, 30,9) |
Periferik kan, n (%) | 63 (59,4) | 42 (40) | 85 (80,2) | 49 (46,7) |
%95 GA | (50,1, 68,8) | (30,6, 49,4) | (72,6, 87,8) | (37,1, 56,2) |
Tedavinin Tamamlanmasından Sonraki Üç Aydaki MRD Negatiflik Oranı | ||||
Kemik iliği, n (%) | 55 (51,9) | 18 (17,1) | 60 (56,6) | 17 (16,2) |
%95 GA | (42,4, 61,4) | (9,9, 24,4) | (47,2, 66) | (9,1, 23,2) |
Periferik kan, n (%) | 58 (54,7) | 41 (39) | 65 (61,3) | 43 (41) |
%95 GA | (45,2, 64,2) | (29,7, 48,4) | (52, 70,6) | (31,5, 50,4) |
P değerleri Cochran-Mantel-Haenszel ki-kare testinden alınmıştır. NGS ile kemik iliğinde MRD negatiflik oranı için P değeri birincil MRD analizidir.
Yeni nesil sıralama testi (clonoSEQ) kullanılarak 10-4 eşiğine dayalıdır
5.2. Farmakokinetik özellikler
Genel özellikler Emilim:
İbrutinib oral uygulama sonrasında 1 ila 2 saatlik medyan Tdeğeri ile hızla emilir. Aç koşullarda (n=8) mutlak biyoyararlanım %2,9'dur (%90 GA = 2,1 â 3,9) ve bir öğün ile birlikte kullanıldığında iki katına çıkar. İbrutinibin farmakokinetiği farklı B hücreli maligniteleri olan hastalarda anlamlı bir farklılık göstermez. İbrutinib maruziyeti 840 mg'a kadar olan dozlarda artar. Dozun 560 mg olarak uygulandığı hastalarda gözlenen kararlı durum EAA değeri (ortalama ± standart sapma) 953 ± 705 ng sa/mL'dir. İbrutinibin aç karnına alınması ile yüksek oranda yağ içeren bir kahvaltıdan 30 dakika önce, 30 dakika sonra (tok koşullar) ya da yüksek yağlı bir kahvaltıdan 2 saat sonrasına kıyasla maruziyetin yaklaşık
%60'ına (EAA) neden olmuştur.
İbrutinib pH'a bağlı çözünürlük sergiler ve daha yüksek pH değerinde daha düşük çözünürlüğe sahiptir. 5 gün süreyle günde bir kere 40 mg omeprazol aldıktan sonra aç karnına 560 mg'lık tek bir ibrutinib uygulanan sağlıklı gönüllülerde, geometrik ortalama oranları (%90 GA) EAAiçin %83 (%68-102), EAAiçin %92 (%78-110) ve Ciçin %38
(%26-53) olmuştur.
Dağılım:
İbrutinibin insan plazma proteinlerine in vitro geri dönüşümlü bağlanması %97,3 olup, 50 ila
1.000 ng/mL aralığında hiçbir konsantrasyon bağımlılığı yoktur. Kararlı durumdaki görünür dağılım hacmi (V/F) yaklaşık 10.000 L'dir.
Biyotransformasyon:
İbrutinib primer olarak CYP3A4 ile metabolize olur ve BTK'yı inhibe edici aktivitesi ibrutinibden yaklaşık 15 kat daha düşük olan bir dihidrodiol metaboliti oluşur. CYP2D6 ibrutinib metabolizmasında minimal bir rol oynar.
Bu nedenle, farklı CYP2D6 genotiplerine sahip hastalarda önlem alınması gerekli değildir. Eliminasyon:
Görünür klerens (CL/F) yaklaşık 1000 L/saat'tir. İbrutinibin yarılanma ömrü 4 ila 13 saattir. Sağlıklı deneklerde radyoaktif olarak etiketlenmiş tek doz oral [C]-ibrutinib uygulamasından sonra radyoaktivitenin yaklaşık %90'ı 168 saat içerisinde atılmış olup, bunun büyük bölümü (%80) feçeste ve %10'undan azı idrarda atılmıştır. Değişmemiş ibrutinib radyoaktif olarak etiketlenmiş boşaltım ürününün feçeste yaklaşık %1'ini oluşturur ve idrarda görülmez.
![]()
Doğrusallık/doğrusal olmayan durum:
İbrutinib maruziyeti doz ile orantılı olarak artar.
Hastalardaki karakteristik özellikler
Geriyatik popülasyon:
Popülasyon farmakokinetiği yaşın, dolaşımdan ibrutinib klerensini anlamlı düzeyde etkilemediğini göstermiştir.
Pediyatrik popülasyon:
Farmakokinetik veriler, nükseden veya refrakter matür B-hücreli non-Hodgkin lenfomalı çocuklarda, 12 yaş ve üzeri çocuklarda günlük 329 mg/m doz ve 3 yaş ila 12 yaş altı çocuklarda günlük 440 mg/m doz uygulanan ibrutinib maruziyetlerinin genellikle günlük 560 mg doz uygulanan yetişkin hastalarda gözlenen maruziyet aralığı içinde olduğunu göstermektedir.
Cinsiyet:
Popülasyon farmakokinetiği cinsiyetin, dolaşımdan ibrutinib klerensini anlamlı düzeyde etkilemediğini göstermiştir.
Irk:
Irkın ibrutinib farmakokinetiği üzerindeki potansiyel etkisini karşılaştırmak için yeterli bir veri yoktur.
Vücut ağırlığı:
Popülasyon farmakokinetiği verileri vücut ağırlığının (aralık: 41-146 kg; ortalama [standart sapma]: 83 [19 kg]) ibrutinib klerensi üzerinde ihmal edilebilir bir etkiye sahip olduğunu göstermiştir.
Böbrek yetmezliği:
İbrutinib minimal bir renal klerense sahiptir; metabolitlerin üriner yolla atılan miktarı dozun
<%10'udur. Bugüne kadar böbrek fonksiyon bozukluğu olan hastalarda spesifik çalışmalar yapılmamıştır. Ağır böbrek yetmezliği olan hastalara veya diyaliz hastalarına ait hiçbir veri mevcut değildir (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
İbrutinib karaciğerde metabolize olur. Kanserli olmayan hastalarda, açlık koşullarında 140 mg IMBRUVICA'nın verildiği bir karaciğer yetmezliği çalışması yürütülmüştür. Hafif (n=6, Child Pugh Sınıf A), orta (n=10, Child Pugh Sınıf B) ve şiddetli (n=8, Child Pugh Sınıf C) karaciğer yetmezliği olan hastalarda bozulmuş karaciğer fonksiyonu bireyler arasında önemli ölçüde değişmekte olup, ortalama olarak ibrutinib maruziyetinde (EAA) sırasıyla 2,7-, 8,2- ve 9,8-kat bir artış gözlenmiştir. Ayrıca ibrutinibin serbest fraksiyonu da yetmezliğin derecesi arttıkça yükselmiştir; bu çalışmada benzer özelliklere sahip sağlıklı kontrollerde plazmadaki
%3,3 oranına kıyasla hafif, orta ve şiddetli karaciğer yetmezliği olan gönüllülerde sırasıyla
%3, 3,8 ve 4,8 oranları görülmüştür. Bağlı olmayan ibrutinib maruziyetindeki (EAA) ilgili artışın hafif, orta ve şiddetli karaciğer yetmezliği olan gönüllülerde sırasıyla 4,1-, 9,8- ve 13-kat olduğu hesaplanmaktadır (bkz. Bölüm 4.2).
CYP substratları ile eş zamanlı kullanım:
In vitro çalışmalar ibrutinibin CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ve intestinal (ancak hepatik olmayan) CYP3A4'ün zayıf bir reversibl inhibitörü olduğunu ve CYP1A2,
CYP2B6, CYP2C8, CYP2C9,CYP2C19veCYP2D6'nınzam
ana bağlı klinik olarak anlamlı
![]()
inhibisyonunu sergilemediğini göstermiştir. İbrutinibin dihidrodiol metaboliti CYP2B6,
CYP2C8, CYP2C9 ve CYP2D6'nın zayıf bir inhibitörüdür. Dihidrodiol metaboliti in vitro ortamda en zayıf CYP450 izoenzim indükleyicidir. Ibrutinib'in hassas bir CYP3A4 substratı olması sebebiyle, kendi maruziyeti üzerinde klinik olarak ilişkili bir etkisi bulunmamaktadır.
Transport substratları/inhibitörleri ile eş zamanlı kullanım:
In vitro çalışmalar ibrutinibin ne P glikoproteinin ne de OCT2 hariç diğer majör taşıyıcıların bir substratı olmadığını göstermiştir. Dihidrodiol metaboliti ve diğer metabolitler P glikoprotein substratıdır. İbrutinib, P glikoproteinin ve BCRP'nin in vitro inhibitörüdür (bkz. Bölüm 4.5).
5.3. Klinik öncesi güvenlilik verileri
Aşağıdaki advers etkiler sıçanlar ve köpeklerde yapılan 13 haftalık çalışmalarda görülmüştür. İbrutinibin her iki türde de 30 mg/kg/gün'lük bir Yan Etki Gözlenmeyen Seviye (No Observed Adverse Effect Level; NOAEL) dozunda sıçanlarda ve köpeklerde gastrointestinal etkileri (yumuşak feçes/diyare ve/veya enflamasyon) ve lenfoid tükenmesini indüklediği saptanmıştır. 560 mg/gün klinik dozundaki ortalama maruziyete dayalı olarak, EAA oranları NOAEL'de erkek ve dişi sıçanlarda sırasıyla 2,6 ve 21 ile erkek ve dişi köpeklerde sırasıyla 0,4 ve 1,8 saptanmıştır. Gözlenen En Düşük Etki Seviyesi (Lowest Observed Effect Level; LOEL) (60 mg/kg/gün) marjinleri köpeklerde 3,6 (erkekler) ve 2,3 mislidir (dişi). Sıçanlarda, orta dereceli pankreatik asiner hücre atrofisi (advers kabul edilir) erkek sıçanlarda 100 mg/kg ve üzerindeki dozlarda (EAA maruziyet marjini: 2,6 kat) gözlenirken, 300 mg/kg/gün'e kadar dozlarda dişi sıçanlarda görülmemiştir (EAA maruziyet marjini: 21,3 kat). > 100 mg/kg/gün (EAA maruziyet marjini: 20,3 kat) verilen dişi sıçanlarda hafif düzeyde azalmış trabeküler ve kortikal kemik görülmüştür. Tüm gastrointestinal, lenfoid ve kemik bulguları 6 ila 13 haftalık süreçler sonunda iyileşmiştir. Pankreatik bulgular benzer geri dönüşüm süreçlerinde kısmen düzelmiştir.
Juvenil toksisite çalışmaları yapılmamıştır.
Karsinojenisite/genotoksisite
Transjenik farelerde (Tg.rasH2) 2000 mg/kg/gün'e kadar oral dozlarla yürütülen 6 aylık bir çalışmada, ibrutinib karsinojenisite göstermemiştir. Bu, insanlarda 560 mg/gün olarak uygulanan doz ile karşılaştırıldığında, EAA bakımından erkeklerde yaklaşık 23 kat, kadınlarda ise yaklaşık 37 kat ibrutinib maruziyetine karşılık gelmektedir.
İbrutinib bakterilerde, memeli hücrelerinde ya da farelerde test edildiğinde genotoksik özellikler sergilememiştir.
Üreme toksisitesi
İbrutinib gebe sıçanlara 80 mg/kg/gün dozunda verildiğinde, günde 560 mg doz uygulanan hastalardaki maruziyetin (EAA) yaklaşık 14 katı bir maruziyet marjini ile visseral malformasyonlar (kalp ve ana damarlar) ve iskeletsel değişimler ile artmış bir post- implantasyon kaybıyla ilişkilendirilmiştir. Hayvanlarda uygulanan ≥40 mg/kg/gün dozunda, ibrutinib (günde 560 mg doz uygulanan hastalara kıyasla, EAA oranı ≥5,6) azalmış fetus ağırlıklarına neden olmuştur. Sonuçta, fötal NOAEL 10 mg/kg/gün olarak belirlenmiştir (günde 560 mg dozuna kıyasla yaklaşık 1,3 katı EAA) (bkz. Bölüm 4.6).
![]()
KLL ve WM hastalarında maruziyetin (EAA) yaklaşık 2,8 katı) uygulanan tavşanlarda
malformasyonlara sebep olmuştur. Sonuçta, fötal NOAEL 5 mg/kg/gün olarak belirlenmiştir (günde 560 mg dozuna kıyasla yaklaşık 0,7 katı EAA) (bkz. Bölüm 4.6).
Fertilite
Erkek ya da dişi sıçanlarda test edilen maksimum doza kadar (100 mg/kg/gün â insana eşdeğer doz 16 mg/kg/gün) fertilite ya da üreme kapasitesine bir etki görülmemiştir.
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Satış Fiyatı | 41942.94 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 42074.23 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699593095580 |
| Etkin Madde | Ibrutinib |
| ATC Kodu | L01EL01 |
| Birim Miktar | 140 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |