IMFINZI 500 mg/10 ml infüzyonluk çözelti hazırlamak için konsantre (1 flakon) Kısa Ürün Bilgisi
{ Durvalumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
IMFINZITM 500 mg/10 mL infüzyonluk çözelti hazırlamak için konsantre Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her mL'si 50 mg durvalumab içerir.
10 mL'lik bir flakon 500 mg durvalumab içerir.
Durvalumab, rekombinant DNA teknolojisi ile memeli (Çin hamster over) hücrelerinde üretilen bir insan immünoglobulin (IgG1) monoklonal antikordur.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Konsantre infüzyon çözeltisi (steril konsantre).
Berrak ila opalesan, renksiz ila hafif sarı, gözle görülür partikül içermeyen çözelti. Çözeltinin pH düzeyi yaklaşık 6,0'dır, ozmolalitesi ise yaklaşık 400 mOsm/kg'dir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
IMFINZI PD-L1 düzeyi %1 ve üzeri olan, rezeke edilemeyen lokal ileri küçük hücreli dışı akciğer kanserinde (KHDAK), platin bazlı kemoradyoterapi sonrası progresyon görülmeyen yetişkin hastaların tedavisinde monoterapi olarak endikedir. Tedavi süresi fayda gören hastalarda 1 yıla kadar olup progresyon geliştiğinde kesilmelidir. Durvalumab kullanan hastalarda daha sonraki basamaklarda PD-1 ve PD-L1 antikoru kullanılamaz. EGFR, ALK ve ROS-1 mutasyonu bulunan hastalarda IMFINZI kullanılamaz.
Performans durumu 0-1 olan yaygın evre küçük hücreli akciğer kanseri (YE-KHAK) erişkin hastalarının birinci basamak tedavisinde 4 kür etoposid ve karboplatin ya da sisplatin ile kombinasyon ve ardından idame monoterapi olarak progresyona kadar IMFINZI endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, kanser tedavisinde deneyimli bir hekim tarafından başlatılmalı ve takip edilmelidir. Lokal olarak ilerlemiş KHDAK hastaları için PD-L1 testi
Lokal olarak ilerlemiş KHDAK hastaları, valide edilmiş bir testle doğrulanmış PD-L1 tümör
ekspresyonuna dayanarak tedavi açısından değerlendirilmelidir (bkz. bölüm 5.1).
Pozoloji/uygulama sıklığı ve süresi:
IMFINZITM monoterapisi için önerilen doz ve kemoterapi ile kombinasyon halindeki IMFINZI için önerilen doz Tablo 1'de sunulmaktadır. IMFINZI, 1 saat boyunca intravenöz infüzyonla uygulanır.
Tablo 1. Önerilen IMFINZI Dozu
Endikasyon | Önerilen IMFINZI Dozu | Tedavi Süresi |
Lokal Olarak İlerlemiş KHDAK | 2 haftada bir 10 mg/kg | Hastalık progresyonuna, kabul edilemez toksisiteye kadar veya maksimum 12 ay boyunca |
YE-KHAK | 4 kür boyunca her 3 haftada (21 gün) bir kemoterapi ile kombinasyon halinde 1500 mg
ardından her 4 haftada bir monoterapi olarak 1500 mg | Hastalık progresyonuna veya kabul edilemez toksisiteye kadar |
a Hastalık progresyonu doğrulanana kadar, hastalık progresyonuna ilişkin başlangıç kanıtı olan klinik açıdan stabil hastalar için tedaviye devam edilmesi önerilmektedir.
b Vücut ağırlığı 30 kg veya daha az olan hastalar, 4 kür boyunca her 3 haftada (21 gün) bir kemoterapi ile kombinasyon halinde IMFINZI 20 mg/kg'a eşdeğer ağırlığa dayalı doz ve ardından ağırlık 30 kg'ın üzerine çıkana kadar 4 haftada bir monoterapi olarak 20 mg/kg almalıdır.
c IMFINZI aynı gün kemoterapiden önce uygulanır.
d IMFINZI kemoterapi ile kombinasyon halinde uygulandığında, dozlama bilgileri için etoposid ve karboplatin ya da sisplatin ait Kullanma Talimatlarına bakın.
Dozun yükseltilmesi veya azaltılması önerilmemektedir. Hasta bazında güvenlilik ve tolerabilite esas alınarak dozlara ara verilmesi veya tedavinin kesilmesi gerekebilir.
İmmün aracılı advers reaksiyonların tedavisine ilişkin açıklamalar Tablo 2'de yer almaktadır (ayrıca bkz. Bölüm 4.4).
Tablo 2. IMFINZI için önerilen tedavi modifikasyonları ve tedavi önerileri
Advers reaksiyonlar |
Şiddeti | IMFINZI Tedavi Modifikasyonu | Aksi Belirtilmedikçe Kortikosteroid Tedavisi |
İmmün aracılı pnömonit/interstisyel akciğer hastalığı |
Derece 2 |
Dozlara ara verilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 3 veya 4 |
Tamamen kesilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. | |
İmmün aracılı hepatit | Derece 2 ile ALT veya AST >3-5 x NÜS ve/veya toplam bilirubin >1.5-3 x NÜS |
Dozlara ara verilir |
1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 3 ile AST veya ALT ≤8 x NÜS veya toplam bilirubin ≤5 x NÜS | |||
Derece 3 ile AST veya ALT >8 x NÜS veya toplam bilirubin >5 x NÜS |
Tamamen kesilir | ||
Başka bir neden olmadan eşzamanlı ALT veya AST >3 x NÜS ve toplam bilirubin >2 x NÜS | |||
İmmün aracılı kolit veya diyare |
Derece 2 veya 3 | Dozlara ara verilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 4 | Tamamen kesilir | ||
İmmün aracılı hipertiroidizm, tiroidit |
Derece 2-4 | Klinik olarak stabil olana kadar dozlara ara verilir |
Semptomatik tedavi (bkz. Bölüm 4.8) |
İmmün aracılı hipotiroidizm |
Derece 2-4 |
Değişiklik yok | Klinik gerekliliğe göre tiroid hormonu replasman tedavisi başlatılır. |
İmmün aracılı adrenal yetmezlik veya hipofizit/ hipopitüitarizm |
Derece 2-4 | Klinik olarak stabil olana kadar dozlara ara verilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır ve klinik gerekliliğe |
Advers reaksiyonlar |
Şiddeti | IMFINZI Tedavi Modifikasyonu | Aksi Belirtilmedikçe Kortikosteroid Tedavisi |
|
|
| göre hormon replasman tedavisi başlatılır. |
İmmün aracılı tip 1 diabetes mellitus |
Derece 2-4 |
Değişiklik yok | Klinik gerekliliğe göre insülin ile tedavi başlatılır. |
İmmün aracılı nefrit | Derece 2 ile serum kreatinin >1,5-3 x (NÜS veya başlangıç değeri) | Dozlara ara verilir |
1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 3 ile serum kreatinin >3x başlangıç değeri veya >3-6 x NÜS; Derece 4 ile serum kreatinin >6 x NÜS |
Tamamen kesilir | ||
İmmün aracılı döküntü veya dermatit (pemfigoid dahil) |
>1 hafta süren Derece 2 |
Dozlara ara verilir |
1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 3 | |||
Derece 4 | Tamamen kesilir | ||
İmmün aracılı miyokardit | Derece 2 | Dozlara ara verilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 3 veya 4, veya pozitif biyopsili herhangi bir Derece |
Tamamen kesilir | ||
İmmün aracılı Miyozit/polimiyozit | Derece 2 veya 3 | Dozlara ara verilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 4 | Tamamen kesilir | ||
İnfüzyon ile ilişkili reaksiyonlar |
Derece 1 veya 2 |
İnfüzyona ara verilir veya hızı yavaşlatılır | Sonraki infüzyon reaksiyonlarının profilaksisi için premedikasyon düşünülebilir. |
Derece 3 veya 4 | Tamamen kesilir |
| |
Enfeksiyon |
Derece 3 veya 4 | Klinik olarak stabil olana kadar dozlara ara verilir |
|
Advers reaksiyonlar |
Şiddeti | IMFINZI Tedavi Modifikasyonu | Aksi Belirtilmedikçe Kortikosteroid Tedavisi |
Miyastenia gravis | Derece 2 | Dozlara ara verilir |
1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Solunum veya otonomik yetmezlik belirtileri olan herhangi bir derece |
Tamamen kesilir | ||
Derece 3 veya 4 | |||
Diğer immün aracılı yan etkiler | Derece 3 | Dozlara ara verilir | 1 ila 2 mg/kg/gün prednizon veya eşdeğeri başlatılır, ardından doz azaltılır. |
Derece 4 |
Tamamen kesilir |
Advers Olaylar için Ortak Terminoloji Kriterleri, versiyon 4.03. ALT: alanin aminotransferaz; AST: aspartat aminotransferaz; NÜS: normalin üst sınırı. | |
Kortikosteroidlere rağmen 2 ila 3 günde iyileşme görülmezse, derhal ilave immünosüpresif tedaviye başlanır. İyileşme (Derece 0) durumunda, kortikosteroid doz azaltımına başlanmalı ve en az 1 ay devam edilmelidir. Sonrasında klinik karar doğrultusunda IMFINZI'ye devam edilebilir. | |
Eğer yan etki 30 gün içinde ≤ Derece 1'e ulaşacak şekilde düzelmezse veya solunum yetmezliği belirtileri varsa, IMFINZI'yi kalıcı olarak kullanmayı durdurunuz. |
İmmün aracılı advers reaksiyon şüphesinde etiyolojiyi doğrulamak ya da alternatif etiyolojileri dışlamak için yeterli değerlendirme gerçekleştirilmelidir. Advers reaksiyonun ciddiyetine bağlı olarak, IMFINZI'ye ara verilmeli ve kortikosteroidler uygulanmalıdır. Kötüleşme olması veya herhangi bir iyileşme görülmediği takdirde kortikosteroidlerin dozunu arttırmayı ve/veya ilave sistemik immünosupresanlar kullanmayı düşünün. Derece ≤1'e düzelme olduktan sonra, kortikosteroid dozunun azaltılmasına başlanmalıdır ve azaltım en az 1 ay sürmelidir. Advers reaksiyonlar düzelerek Derece ≤1'e gerilediği ve kortikosteroid dozu günde ≤10 mg prednizon veya eşdeğerine düşürüldüğü takdirde, ara verilmesini takip eden 12 hafta içinde IMFINZI tekrar başlatılabilir. Rekürren Derece 3 (şiddetli) immün aracılı advers reaksiyonlar ve replasman hormonları ile kontrol edilen endokrinopatiler hariç olmak üzere herhangi bir Derece 4 (yaşamı tehdit edici nitelikte) immün aracılı advers reaksiyonlar için IMFINZI kalıcı olarak kesilmelidir.
İmmün aracılı olmayan advers reaksiyonlar söz konusu olduğunda, Derece 2 ve 3 advers reaksiyonlar için Derece ≤1 veya başlangıç durumuna geri dönülene kadar IMFINZI'ye ara verin. Derece 4 advers reaksiyonlar söz konusu olduğunda (durdurma kararının eşlik eden klinik belirtilere/semptomlara ve klinik yargıya dayandırılması gerektiği Derece 4 laboratuvar anormallikleri hariç) IMFINZI kesilmelidir.
Uygulama şekli:
IMFINZITM intravenöz uygulama içindir. İntravenöz infüzyon çözeltisi halinde, 1 saat boyunca uygulanır.
Uygulama öncesinde bu tıbbi ürünün seyreltilmesi ile ilgili talimatlar için Bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Hafif ya da orta şiddetli böbrek yetersizliği olan hastalarda IMFINZI için önerilen herhangi bir doz ayarlanması mevcut değildir. Şiddetli böbrek yetersizliği olan hastalardan elde edilen veriler bu popülasyonla ilgili sonuçlar çıkarmak açısından için çok sınırlıdır (bkz. bölüm 5.2).
Karaciğer yetmezliği:
Orta seviyeli ila şiddetli karaciğer yetersizliği bulunan hastalardan elde edilmiş veriler sınırlıdır. Durvalumabın klirensinde hepatik süreçlerin katılımının küçük olması nedeniyle, maruziyet açısından herhangi bir fark beklenmediğinden, karaciğer yetersizliği olan hastalar için önerilen herhangi bir IMFINZI dozu ayarlaması bulunmamaktadır (bkz. bölüm 5.2).
Pediyatrik popülasyon:
IMFINZITM'nin güvenliliği ve etkililiği 18 yaşın altındaki ergenlerde ve çocuklarda belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon:
Yaşlı hastalar (≥65 yaş) için doz ayarlaması gerekli değildir (bkz. Bölüm 5.1). 75 yaş veya üzeri hastalar hakkındaki veriler sınırlıdır.
4.3. Kontrendikasyonlar
IMFINZITM, durvalumaba veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
İzlenebilirlik
Biyoteknolojik tıbbi ürünlerin izlenebilirliğini arttırmak için uygulanan ürünün ticari adı ve seri numarası açık şekilde kaydedilmelidir.
İmmün aracılı pnömonit
IMFINZITM alan hastalarda, sistemik kortikosteroidlerin kullanımını gerektiren ve net bir alternatif etiyolojinin olmaması ile tanımlanan immün aracılı pnömonit veya intersitisyel akciğer hastalığı görülmüştür.
Akciğerine radyasyon tedavisi uygulanan hastalarda radyasyon pnömoniti sık görülür ve pnömonit ile radyasyon pnömonitinin klinik prezentasyonu çok benzerdir. PACIFIC çalışmasında, çalışmanın başlamasından önceki 1 ila 42 gün içinde en az 2 kür eşzamanlı kemoradyoterapi ile uygulanan tedaviyi tamamlamış olan hastalarda pnömonit veya radyasyon pnömoniti IMFINZI ile tedavi uygulanan grupta 161 (%33,9) hastada, plasebo grubunda ise 58 (%24,8) hastada ortaya çıkmıştır ve bunların arasında Derece 3 (%3,4'e karşılık %3,0) ve Derece 5 (%1,1'e karşılık %1,7) olaylar da mevcuttur (bkz. bölüm 4.8).
Hastalar pnömonit veya radyasyon pnömonitinin belirti ve semptomları açısından izlenmelidir. Pnömonit şüphesi, radyografik görüntüleme ile doğrulanmalı, diğer enfeksiyöz ve hastalıkla ilişkili etiyolojiler dışlanmalı ve bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı hepatit
IMFINZITM alan hastalarda, sistemik kortikosteroidlerin kullanımını gerektiren ve net bir alternatif etiyolojinin olmaması ile tanımlanan immün aracılı hepatit görülmüştür (bkz. Bölüm 4.8). Hastalar, IMFINZITM ile tedavi öncesinde ve tedavi sırasında periyodik olarak ve klinik değerlendirmeye dayanarak belirtildiği şekilde anormal karaciğer testlerine karşı takip edilmelidir. İmmün aracılı hepatit Bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı kolit
IMFINZITM alan hastalarda, sistemik kortikosteroidlerin kullanımını gerektiren ve net bir alternatif etiyolojinin olmaması ile tanımlanan immün aracılı kolit veya diyare görülmüştür (bkz. Bölüm 4.8). Hastalar, kolit veya diyarenin bulgu ve belirtilerine karşı takip edilmeli ve Bölüm
4.2'de önerildiği şekilde yönetilmelidir. İmmün aracılı endokrinopatiler
İmmün aracılı hipotiroidizm, hipertiroidizm ve tiroidit
IMFINZI alan hastalarda immün aracılı hipotiroidizm, hipertiroidizm ve tiroidit ortaya çıkmıştır ve hipotiroidizm hipertiroidizmi izleyebilir (bkz. bölüm 4.8). Hastalar tedavi öncesinde ve tedavi sırasında periyodik olarak ve klinik değerlendirmeye dayanarak belirtildiği şekilde anormal tiroid fonksiyon testleri açısından izlenmelidir. İmmün aracılı hipotiroidizm, hipertiroidizm ve tiroidit bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı adrenal yetmezlik
IMFINZITM alan hastalarda immün aracılı adrenal yetmezlik görülmüştür (bkz. Bölüm 4.8). Hastalar, adrenal yetmezliğin klinik bulgu ve belirtileri açısından takip edilmelidir. Semptomatik adrenal yetmezlikte hastalar Bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı tip 1 diabetes mellitus
IMFINZITM alan hastalarda ilk olarak diyabetik ketoasidoz olarak ortaya çıkabilen ve erken teşhis edilmediği takdirde ölümcül olabilen immün aracılı tip 1 diabetes mellitus görülmüştür (bkz. Bölüm 4.8). Hastalar, tip 1 diabetes mellitusun klinik bulgu ve belirtileri açısından takip edilmelidir. Semptomatik tip 1 diabetes mellitus hastaları Bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı hipofizit/hipopitüitarizm
IMFINZI alan hastalarda immün aracılı hipofizit veya hipopitüitarizm ortaya çıkmıştır (bkz. Bölüm 4.8). Hastalar hipofizit veya hipopitüitarizmin klinik belirti ve semptomları açısından izlenmelidir. Semptomatik hipofizit veya hipopitüitarizm ortaya çıkması durumunda hastalar bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı nefrit
IMFINZITM alan hastalarda, sistemik kortikosteroidlerin kullanımını gerektiren ve net bir alternatif etiyolojinin olmaması ile tanımlanan immün aracılı nefrit görülmüştür (bkz. Bölüm
4.8). Hastalar, IMFINZITM ile tedavi öncesinde ve tedavi sırasında periyodik olarak anormal böbrek fonksiyon testlerine karşı takip edilmeli ve Bölüm 4.2'de önerildiği şekilde yönetilmelidir.
İmmün aracılı döküntü
IMFINZI alan hastalarda sistemik kortikosteroid kullanımı gerektiren ve net bir alternatif etiyolojisi olmayan immün aracılı döküntü veya dermatit (pemfigoid dahil) ortaya çıkmıştır (bkz. bölüm 4.8). PD-1 inhibitörleri ile tedavi uygulanan hastalarda Stevens-Johnson Sendromu veya toksik epidermal nekroliz olayları bildirilmiştir. Hastalar döküntü veya dermatit belirtileri ve semptomları açısından izlenmeli ve bölüm 4.2'de önerildiği şekilde yönetilmelidir.
Diğer immün aracılı advers reaksiyonlar
IMFINZI'nin etki mekanizması göz önüne alındığında, başka potansiyel immün aracılı advers reaksiyonlar ortaya çıkabilir. IMFINZI monoterapisi ile tedavi uygulanan hastalarda aşağıdaki immün aracılı advers reaksiyonlar gözlemlenmiştir: Miyastenia gravis, miyokardit, miyozit, polimiyozit, menenjit, ensefalit, Guillain-Barré sendromu, immün trombositopeni ve non-infektif sistit (bkz. Bölüm 4.8). Klinik çalışma programında yer alan hastalarda pankreatit olayları bildirilmiştir.
Hastalar belirtiler ve semptomlar açısından izlenmeli ve bölüm 4.2'de diğer immün aracılı advers reaksiyonlar için önerildiği şekilde yönetilmelidir.
İnfüzyon ile ilişkili reaksiyonlar
Hastalar infüzyonla ilişkili reaksiyonların belirti ve semptomları açısından izlenmelidir. IMFINZI alan hastalarda infüzyonla ilişkili şiddetli reaksiyonlar bildirilmiştir (bkz. bölüm 4.8). İnfüzyonla ilişkili reaksiyonlar bölüm 4.2'de önerildiği şekilde yönetilmelidir.
Klinik çalışmalara dahil edilmeyen hastalar
Şunların görüldüğü hastalar klinik çalışmalara dahil edilmemiştir: başlangıçta ECOG performans skorunun ≥2 olması; çalışmanın başlamasından önceki 2 yıl içerisinde aktif veya önceden belgelenmiş otoimmün hastalık; immün yetmezlik öyküsü; şiddetli immün aracılı advers reaksiyon öyküsü; sistemik kortikosteroidlerin fizyolojik dozu hariç (≤ 10 mg/gün prednizon veya eşdeğeri) sistemik immünosupresyon gerektiren tıbbi durumlar; kontrol edilemeyen eşzamanlı hastalıklar; aktif tüberküloz veya hepatit B veya C veya HIV enfeksiyonu veya IMFINZI'nin başlamasından önceki veya sonraki 30 gün içinde canlı zayıflatılmış aşı uygulanan hastalar. Veri mevcut olmadığında, durvalumab bu popülasyonlarda potansiyel yarar/riskin bireysel bazda dikkatle değerlendirilmesinin ardından, dikkatli bir şekilde kullanılmalıdır.
YE-KHAK'li hastalarda IMFINZI ile eşzamanlı profilaktik kraniyal radyasyonun (PCI) güvenliliği bilinmemektedir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Durvalumaba başlamadan önce, sistemik kortikosteroidlerin fizyolojik dozu (≤10 mg/gün prednizon veya eşdeğeri) hariç, sistemik kortikosteroidlerin veya immünosupresanların kullanılması, durvalumabın farmakodinamik aktivitesi ve etkililiği ile potansiyel etkileşimi nedeniyle önerilmemektedir. Bununla birlikte, immün aracılı advers reaksiyonların tedavi
edilmesi için durvalumaba başlandıktan sonra sistemik kortikosteroidler veya diğer immünosupresanlar kullanılabilir (bkz. bölüm 4.4).
Durvalumab ile hiçbir formal farmakokinetik (FK) ilaç-ilaç etkileşimi çalışması yapılmamıştır. Durvalumabın primer eliminasyon mekanizmaları hedef aracılı dağılım veya retiküloendotelyal sistem yoluyla protein katabolizması olduğundan, metabolik ilaç-ilaç etkileşimi beklenmemektedir. Durvalumab ve kemoterapi arasındaki FK ilaç-ilaç etkileşimi CASPIAN çalışmasında değerlendirilmiş olup, durvalumab ile eşzamanlı tedavinin, etoposid, karboplatin ya da sisplatinin FK'sini etkilemediğini göstermiştir. Bunun yanı sıra, popülasyon FK analizine dayanarak, eşzamanlı kemoterapi tedavisi durvalumabın FK'sini anlamlı şekilde etkilememiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Hafif ya da orta şiddetli böbrek yetersizliği olan hastalarda IMFINZI için önerilen herhangi bir doz ayarlanması mevcut değildir. Şiddetli böbrek yetersizliği olan hastalardan elde edilen veriler bu popülasyonla ilgili sonuçlar çıkarmak açısından için çok sınırlıdır (bkz. bölüm 5.2).
Karaciğer yetmezliği:
Orta seviyeli ila şiddetli karaciğer yetersizliği bulunan hastalardan elde edilmiş veriler sınırlıdır. Durvalumabın klirensinde hepatik süreçlerin katılımının küçük olması nedeniyle, maruziyet açısından herhangi bir fark beklenmediğinden, karaciğer yetersizliği olan hastalar için önerilen herhangi bir IMFINZI dozu ayarlaması bulunmamaktadır (bkz. bölüm 5.2).
Pediyatrik popülasyon:
IMFINZITM'nin güvenliliği ve etkililiği 18 yaşın altındaki ergenlerde ve çocuklarda belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon:
Yaşlı hastalar (≥65 yaş) için doz ayarlaması gerekli değildir (bkz. Bölüm 5.1 ve Bölüm 5.2). 75 yaş veya üzeri hastalar hakkındaki veriler sınırlıdır.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip olan kadınlar durvalumab ile tedavi sırasında ve son durvalumab dozunun ardından en az 3 ay etkili bir kontrasepsiyon kullanmalıdır.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalısmalar, gebelik /ve-veya/ embriyonal/fetal gelisim /ve-veya/ doğum /ve-veya/ doğum sonrası gelisim üzerindeki etkiler bakımından yetersizdir (bkz. kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. IMFINZITM gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Gebe kadınlarda durvalumab kullanımıyla ilgili veri yoktur. Etki mekanizmasına dayanarak durvalumab, gebeliğin sürdürülmesi üzerinde etki potansiyeline sahiptir ve bir fare allojenik gebelik modelinde PD-L1 sinyalinin bozulmasının fetal kayıpta bir artışla sonuçlandığı gösterilmiştir. Durvalumab ile yapılan hayvan çalışmaları üreme toksisitesi için bir gösterge değildir (bkz. Bölüm 5.3). İnsan IgG1'in plasenta bariyerini geçtiği bilinmektedir ve durvalumabın plasentadan geçtiği hayvan çalışmalarında doğrulanmıştır. Durvalumab, bir gebe kadına verildiğinde fetusa zarar verebilir ve gebelik sırasında ve tedavi uygulaması sırasında ve son dozun ardından en az 3 ay süresince etkili bir kontrasepsiyon kullanmayan kadınlarda önerilmez.
Laktasyon dönemi
Durvalumabın insan sütüyle atılıp atılmadığı bilinmemektedir. Sinomolgus maymunlarından elde edilen mevcut toksikolojik veriler, doğumdan sonra 28. Günde anne sütünde düşük durvalumab düzeyleri olduğunu ortaya koymuştur (bkz. Bölüm 5.3). İnsanlarda, antikorlar anne sütüne geçebilir, ancak emilim ve yenidoğana zarar verme potansiyeli bilinmemektedir. Bununla birlikte, emzirilen çocuk açısından potansiyel risk dışlanamaz. Çocuk için emzirmenin yararı ve kadın için tedavinin yararı göz önünde bulundurularak, emzirmenin kesilmesi ya da durvalumab tedavisinden kaçınılması hakkında bir karar verilmelidir.
Üreme yeteneği/Fertilite
Durvalumabın insanlarda veya hayvanlarda fertilite üzerindeki muhtemel etkileri hakkında bilgi bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Durvalumabın araç ve makine kullanımı üzerinde herhangi bir etkisi yoktur veya göz ardı edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Monoterapi olarak IMFINZI'nin güvenliliği, çok sayıda tümör tipinde 3006 hastadan toplanan verilere dayanmaktadır. IMFINZI her 2 haftada bir 10 mg/kg ya da her 4 haftada bir 20 mg/kg dozunda uygulanmıştır.
En sık görülen advers reaksiyonlar (>%10) öksürük/balgamlı öksürük (%21,5), diyare (%16,3), döküntü (%16,0), pireksi (%13,8), üst solunum yolu enfeksiyonları (%13,5), karın ağrısı (%12,7), prürit (%10,8) ve hipotiroidizm (%10,1) olmuştur.
Kemoterapi ile kombinasyon halinde verilen IMFINZI'nin güvenliliği, 265 KHAK hastasındaki verilere dayanmaktadır. IMFINZI her 3 haftada bir kemoterapi ile kombinasyon halinde ardından her 4 haftada bir monoterapi olarak 1500 mg dozunda uygulanmıştır. En sık görülen (>%20) advers reaksiyonlar nötropeni (%48,7), anemi (%38,5), bulantı (%33,6), yorgunluk (%32,1),
alopesi (%31,3), trombositopeni (%21,1) ve lökopeni (%20,0) olmuştur.
Advers reaksiyonların tablolaştırılmış özeti
Tablo 3'de, monoterapi güvenlilik veri kümesinde ve CASPIAN çalışmasında kemoterapi ile kombinasyon halinde IMFINZI ile tedavi edilen hastalardaki advers reaksiyonların insidansı listelenmiştir. Advers ilaç reaksiyonlar MedDRA sistem organ sınıfına göre listelenmektedir. Her bir sistem organ sınıfı içinde, advers ilaç reaksiyonları azalan sıklık sırasıyla verilmektedir. Her bir AİR için karşılık gelen frekans kategorisi şöyle tanımlanmaktadır: çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (mevcut verilerden hesaplanamıyor). Her bir sıklık grubu içinde, advers ilaç reaksiyonları azalan ciddilik sıralamasıyla verilmektedir.
Tablo 3. IMFINZI monoterapisi ve kemoterapi ile kombinasyon halinde IMFINZI ile tedavi edilen hastalardaki advers ilaç reaksiyonları
| IMFINZI Monoterapisi | Kemoterapi ile Kombine IMFINZI | ||||
| Herhangi bir Derece (%) | Derece 3-4 (%) | Herhangi bir Derece (%) | Derece 3-4 (%) | ||
Enfeksiyonlar ve enfestasyonlar | ||||||
Üst solunum yolu enfeksiyonları | Çok yaygın | 13,5 | 0,2 | Yaygın | 9,1 | 0,4 |
Pnömoni | Yaygın | 8,9 | 3,5 | Yaygın | 5,7 | 1,9 |
Oral kandidiyazis | Yaygın | 2,1 | 0 | Yaygın olmayan | 0,8 | 0 |
Dental ve oral yumuşak doku enfeksiyonları | Yaygın | 1,7 | < 0,1 | Yaygın | 1,1 | 0 |
Influenza | Yaygın | 1,6 | < 0,1 | Yaygın olmayan | 0,4 | 0 |
Kan ve lenf sistemi hastalıkları | ||||||
Nötropenie |
|
|
| Çok yaygın | 48,7 | 29,1 |
Anemi |
|
|
| Çok yaygın | 38,5 | 9,1 |
Trombositopenif |
|
|
| Çok yaygın | 21,1 | 6,8 |
Lökopenig |
|
|
| Çok yaygın | 20,0 | 7,9 |
Febril nötropeni |
|
|
| Yaygın | 6,4 | 5,3 |
Pansitopeni |
|
|
| Yaygın | 3,0 | 1,5 |
İmmün trombositopeni | Seyrek | <0,1 | <0,1 |
|
|
|
Endokrin hastalıkları |
|
| ||||
Hipotiroidizm | Çok yaygın | 10,1 | 0,2 | Yaygın | 9,4 | 0 |
Hipertiroidizm | Yaygın | 4,6 | 0 | Yaygın | 9,8 | 0 |
Tiroiditj | Yaygın olmayan | 0,8 | < 0,1 | Yaygın | 1,5 | 0 |
Adrenal yetmezlik | Yaygın olmayan | 0,6 | < 0,1 | Yaygın | 1,1 | 0 |
Tip 1 diabetes mellitus | Seyrek | < 0,1 | < 0,1 | Yaygın olmayan | 0,8 | 0,8 |
| IMFINZI Monoterapisi | Kemoterapi ile Kombine IMFINZI | ||||
| Herhangi bir Derece (%) | Derece 3-4 (%) | Herhangi bir Derece (%) | Derece 3-4 (%) | ||
Hipofizit/Hipopitüitarizm | Seyrek | < 0,1 | < 0,1 |
|
|
|
Diabetes insipidus | Seyrek | < 0,1 | < 0,1 |
|
|
|
Metabolizma ve beslenme hastalıkları | ||||||
İştahta azalma |
|
|
| Çok yaygın | 18,1 | 0,8 |
Sinir sistemi hastalıkları |
|
| ||||
Miyastenia gravis | Seyrek | < 0,1 |
|
|
|
|
Enfektif olmayan ensefalit | Bilinmiyor |
|
|
|
|
|
Menenjit | Seyrek | < 0,1 | < 0,1 |
|
|
|
Guillain-Barré sendromu | Bilinmiyor |
|
|
|
|
|
Kardiyak hastalıklar | ||||||
Miyokardit | Seyrek | < 0,1 | < 0,1 |
|
|
|
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | ||||||
Öksürük/Balgamlı Öksürük | Çok yaygın | 21,5 | 0,4 | Çok yaygın | 14,7 | 0,8 |
Pnömonit | Yaygın | 3,8 | 0,9 | Yaygın | 2,6 | 0,8 |
Disfoni | Yaygın | 3,1 | < 0,1 | Yaygın olmayan | 0,8 | 0 |
İnterstisyel akciğer hastalığı | Yaygın olmayan | 0,6 | 0,1 | Yaygın olmayan | 0,8 | 0 |
Gastrointestinal hastalıklar | ||||||
Diyare | Çok yaygın | 16,3 | 0,6 | Yaygın | 9,8 | 1,1 |
Abdominal ağrı | Çok yaygın | 12,7 | 1,8 | Yaygın | 8,7 | 0,4 |
Kolit | Yaygın olmayan | 0,9 | 0,3 | Yaygın olmayan | 0,8 | 0 |
Bulantı |
|
|
| Çok yaygın | 33,6 | 0,4 |
Konstipasyon |
|
|
| Çok yaygın | 16,6 | 0,8 |
Kusma |
|
|
| Çok yaygın | 14,7 | 0 |
Stomatit |
|
|
| Yaygın | 6,0 | 0,4 |
Hepatobilier hastalıklar | ||||||
Aspartat aminotransferazda artış veya Alanin aminotransferazda artış | Yaygın | 8,1 | 2,3 | Yaygın | 8,7 | 1,9 |
Hepatit | Yaygın olmayan | 0,8 | 0,4 | Yaygın | 1,9 | 1,1 |
Deri ve deri altı doku hastalıkları | ||||||
Döküntü | Çok yaygın | 16,0 | 0,6 | Yaygın | 9,4 | 0 |
Pruritus | Çok yaygın | 10,8 | < 0,1 | Yaygın | 7,5 | 0 |
Gece terlemesi | Yaygın | 1,6 | < 0,1 | Yaygın olmayan | 0,4 | 0 |
Dermatit | Yaygın olmayan | 0,7 | < 0,1 | Yaygın | 1,5 | 0 |
| IMFINZI Monoterapisi | Kemoterapi ile Kombine IMFINZI | ||||
| Herhangi bir Derece (%) | Derece 3-4 (%) | Herhangi bir Derece (%) | Derece 3-4 (%) | ||
Alopesi |
|
|
| Çok yaygın | 31,3 | 1,1 |
Pemfigoid | Seyrek | < 0,1 | 0 |
|
|
|
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | ||||||
Miyalji | Yaygın | 5,9 | < 0,1 | Yaygın | 3,4 | 0 |
Miyozit | Yaygın olmayan | 0,2 | < 0,1 |
|
|
|
Polimiyozit | Seyrek | < 0,1 | < 0,1 |
|
|
|
Böbrek ve idrar yolu hastalıkları | ||||||
Kan kreatininde artış | Yaygın | 3,5 | < 0,1 | Yaygın | 1,9 | 0 |
Disüri | Yaygın | 1,3 | 0 | Yaygın | 1,9 | 0 |
Nefrit | Yaygın olmayan | 0,3 | < 0,1 |
|
|
|
Non-infektif sistit | Seyrek | < 0,1 | 0 |
|
|
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | ||||||
Pireksi | Çok yaygın | 13,8 | 0,3 | Yaygın | 8,3 | 0 |
Periferik ödem | Yaygın | 9,7 | 0,3 | Yaygın | 6,4 | 0,8 |
Yorgunluk |
|
|
| Çok yaygın | 32,1 | 3,4 |
Yaralanma, zehirlenme ve prosedürel komplikasyonlar | ||||||
İnfüzyon ile ilişkili reaksiyon | Yaygın | 1,6 | 0,2 | Yaygın | 1,9 | 0,4 |
a larenjit, nazofarenjit, peritonsiller apse, farenjit, rinit, sinüzit, tonsillit, trakeobronşit ve üst solunum enfeksiyonunu içerir.
b akciğer enfeksiyonu, pneumocystis jirovecii pnömonisi, pnömoni, adenoviral pnömoni, bakteriyel pnömoni, sitomegaloviral pnömoni, haemophilus pnömonisi, pnömokokal pnömoni, streptokokal pnömoni, kandida pnömonisi ve legionella pnömonisini içerir.
c ölümle sonuçlanma dahil.
d gingivit, oral enfeksiyon, periodontit, dental pulpit, diş apsesi ve diş enfeksiyonunu içerir.
e nötropeni ve nötrofil sayısında düşüşü kapsar.
f trombositopeni ve trombosit sayısında düşüşü kapsar.
g lökopeni ve lökosit sayısında düşüşü kapsar.
h otoimmün hipotrioidizm, hipotiroidizmi kapsar.
i hiperthiroidizm ve Basedow hastalığını kapsar.
j otoimmün tiroidit, tiroidit, subakut tiroiditi kapsar.
k AstraZeneca destekli klinik çalışmalarda birleştirilen veri kümesi dışında bildirilen sıklık seyrek şeklinde olup, Derece > 2 olay bulunmamaktadır.
l otoimmün ensefalit ve ensefaliti kapsar.
m menenjit ve enfektif olmayan menenjiti kapsar.
n karın ağrısı, alt karın ağrısı, üst karın ağrısı ile böğür ağrısını kapsar.
o kolit, enterit, enterokolit ve proktiti kapsar.
p stomatitis ve mukoza enflamasyonunu kapsar.
q artan alanin aminotransferaz, artan aspartat aminotransferaz, artan hepatik enzim ve
artan transaminazları kapsar.
r hepatit, otoimmün hepatit, toksik hepatit, hepatosellüler hasar, akut hepatit, hepatotoksisite ve immün aracılı hepatiti kapsar.
s eritematöz döküntü, jeneralize döküntü, maküler döküntü, makülopapüler döküntü, papüler döküntü, pruritik döküntü, püstüler döküntü, eritem ve döküntüyü kapsar.
t jeneralize pruritus ve pruritusu kapsar.
u pemfigoid, bullöz dermatit ve pemfigusu kapsar. Tamamlanan ve devam eden çalışmalarda bildirilen sıklık yaygın olmayan şeklindedir.
v polimiyozit (ölümcül), birleştirilmiş veri kümesinin dışında devam eden destekli bir klinik çalışmada, IMFINZI ile tedavi edilen bir hastada gözlenmiştir: herhangi bir derecede seyrek, Derece 3 veya 4 veya 5'te seyrek.
w otoimmün nefrit, tübülointerstisyel nefrit, nefrit, glomerülonefrit ve membranöz glomerülonefriti kapsar.
x periferik ödem ve periferik şişliği kapsar.
z infüzyonla ilişkili reaksiyon ve dozlama günü ya da dozlamadan 1 gün sonra başlayan ürtikeri kapsar.
Seçili advers reaksiyonların tanımı
IMFINZI en yaygın olarak immün aracılı advers reaksiyonlarla ilişkilendirilmektedir. Ciddi reaksiyonlar da dahil olmak üzere bunların çoğu, uygun tıbbi tedavinin başlamasından veya IMFINZI'nin durdurulmasından sonra çözülmüştür. Aşağıdaki immün aracılı advers reaksiyonlara ilişkin veriler, PACIFIC çalışmasını ve durvalumabın onaylanmadığı endikasyonlarda farklı solid tümörleri bulunan hastalar üzerindeki çalışmaları da içeren 3006 hastayı kapsayan bir birleşik güvenlilik veri tabanını yansıtmaktadır. Bütün çalışmalarda IMFINZI, her 2 haftada bir 10 mg/kg, her 4 haftada bir 20 mg/kg veya her 3 ya da 4 haftada bir 1500 mg dozunda uygulanmıştır. Kemoterapi ile kombinasyon halinde verildiğinde IMFINZI için anlamlı advers reaksiyonların ayrıntıları, IMFINZI monoterapisine kıyasla klinik olarak önemli farklılıklar kaydedilmişse sunulmaktadır. Bu advers reaksiyonlara yönelik tedavi kılavuzları bölüm 4.4'te açıklanmıştır.
İmmün aracılı pnömonit
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında (n = 3006 çoklu tümör tipi), immün aracılı pnömonit 107 (%3,6) hastada ortaya çıkmıştır ve bunlara 23 (%0,8) hastadaki
Derece 3, 2 (< %0,1) hastadaki Derece 4 ve 6 hastadaki (%0,2) Derece 5 olay dahildir. Başlangıca kadar geçen medyan süre 57 gündü (aralık: 2-785 gün). 107 hastanın 64'ü yüksek doz kortikosteroid tedavisi görmüştür (günde en az 40 mg prednizon veya eşdeğeri) ve 2 hasta aynı zamanda infliksimab, 1 hasta da ayrıca siklosporin almıştır. IMFINZI 38 hastada durdurulmuştur. 58 hastada olaylar çözümlenmiştir.
İmmün aracılı pnömonit, PACIFIC çalışmasında çalışmanın başlangıcından önceki 1 ila 42 gün içinde eşzamanlı kemoradyoterapi ile uygulanan tedaviyi tamamlayan hastalarda (%10,7), birleşik güvenlilik veri tabanındaki diğer hastalara (%2,2) kıyasla daha sık şekilde ortaya çıkmıştır.
PACIFIC Çalışmasında, (IMFINZI kolunda n = 475, plasebo kolunda n = 234) immün aracılı pnömonit, IMFINZI uygulanan gruptaki 51 (%10,7) hastada ve plasebo grubunda yer alan 16
(%6,8) hastada ortaya çıkmıştır ve IMFINZI alan 8 (%1,7) hastada ve plasebo alan 6 (%2,6) hastada ortaya çıkan Derece 3 olaylar ile IMFINZI alan 4 (%0,8) hastada ve plasebo alan 3 (%1,3) hastada ortaya çıkan Derece 5 (ölümcül) olaylar buna dahildir. Başlangıca kadar geçen medyan süre IMFINZI uygulanan grupta 53 gün (aralık: 1-341 gün), plasebo grubunda ise 55,5 gün (aralık: 0-231 gün) olarak belirlenmiştir. IMFINZI uygulanan grupta 51 hastanın 44'ü sistemik kortikosteroid tedavisi görmüştür ve bunların 28'ine yüksek doz (günde en az 40 mg prednizon veya eşdeğeri) kortikosteroid tedavisi uygulanmış, 2 hasta ise aynı zamanda infliksimab almıştır. Plasebo grubunda 16 hastanın 11'i sistemik kortikosteroid tedavisi görmüştür ve bunların 9'una yüksek doz (günde en az 40 mg prednizon veya eşdeğeri) kortikosteroid tedavisi uygulanmıştır. IMFINZI uygulanan gruptaki 27 hastada, plasebo uygulanan grupta ise 6 hastada olay çözümlenmiştir.
İmmün aracılı hepatit
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı hepatit 36 (%1,2) hastada ortaya çıkmıştır ve bunlara 19 (%0,6) hastadaki Derece 3, 1 (<%0,1) hastadaki Derece 4 ve 2 (< %0,1) hastadaki Derece 5 (ölümcül) olay dahildir. Başlangıca kadar geçen medyan süre 67 gün (aralık: 7-333 gün) olarak belirlenmiştir. 36 hastanın 25'i yüksek doz kortikosteroid tedavisi görmüştür (günde en az 40 mg prednizon veya eşdeğeri). İki hasta da aynı zamanda mikofenolat tedavisi görmüştür. IMFINZI 7 hastada durdurulmuştur. 22 hastada olaylar çözümlenmiştir.
İmmün aracılı kolit
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı kolit veya diyare 52 (%1,7) hastada ortaya çıkmıştır ve bunlara 9 (%0,3) hastadaki Derece 3 ve 2 (< %0,1) hastadaki Derece 4 olay dahildir. Başlangıca kadar geçen medyan süre 73 gün (aralık: 1-394 gün) olarak belirlenmiştir. 52 hastanın 34'ü yüksek doz kortikosteroid tedavisi görmüştür (günde en az 40 mg prednizon veya eşdeğeri). Bir hasta aynı zamanda infliksimab, 1 hasta da aynı zamanda mikofenolat almıştır. IMFINZI 9 hastada durdurulmuştur. 39 hastada olaylar çözümlenmiştir.
İmmün aracılı endokrinopatiler
İmmün aracılı hipotiroidizm
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı hipotiroidizm 222 (%7,4) hastada ortaya çıkmıştır ve bunlara 4 (%0,1) hastadaki Derece 3 olay dahildir. Başlangıca kadar geçen medyan süre 85 gün (aralık: 1-562 gün) olarak belirlenmiştir. 222 hastanın 218'ine hormon replasman tedavisi uygulanmıştır ve beş hasta hipotiroidizm için yüksek doz kortikosteroid tedavisi (günde en az 40 mg prednizon veya eşdeğeri) ve takiben hormon replasmanı almıştır. Hastaların hiçbirinde IMFINZI immün aracılı hipotiroidizm nedeniyle durdurulmamıştır.
İmmün aracılı hipertiroidizm
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı hipertiroidizm 43 (%1,4) hastada ortaya çıkmıştır, Derece 3 veya 4 vaka gözlenmemiştir. Başlangıca kadar geçen medyan süre 43 gün (aralık: 1-196 gün) olarak belirlenmiştir. 43 hastanın 39'u ilaç tedavisi görmüştür (tiyamazol, karbimazol, propiltiyourasil, perklorat, kalsiyum kanal blokeri veya beta bloker), 11 hasta sistemik kortikosteroidler almıştır ve bu 11 hastanın 4'ü yüksek doz (günde en az 40 mg prednizon veya eşdeğeri) kortikosteroid tedavisi görmüştür. Bir hastada IMFINZI
immün aracılı hipertiroidizm nedeniyle durdurulmuştur. 35 hastada olay çözümlenmiştir. On sekiz hasta hipertiroidizmi takiben hipotiroidizm yaşamıştır.
İmmün aracılı tiroidit
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı tiroidit 11 (%0,4) hastada ortaya çıkmıştır ve bunlara 2 (<%0,1) hastadaki Derece 3 olay dahildir. Başlangıca kadar geçen medyan süre 41 gün (aralık: 14-106 gün) olarak belirlenmiştir. 11 hastanın 9'u hormon replasman tedavisi görmüş, 1 hastaya yüksek doz kortikosteroid (en az günde 40 mg prednizon veya eşdeğeri) ardından hormon replasmanı uygulanmıştır. Bir hastada IMFINZI immün aracılı tiroidit nedeniyle durdurulmuştur. İki hastada tiroidit ardından hipotiroidizm görülmüştür.
İmmün aracılı adrenal yetmezlik
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı adrenal yetersizlik 12 (%0,4) hastada ortaya çıkmıştır ve bunlara 3 (< %0,1) hastadaki Derece 3 olay dahildir. Başlangıca kadar geçen medyan süre 145,5 gün (aralık: 20-547 gün) olarak belirlenmiştir. 12 hastanın tümü sistemik kortikosteroid tedavisi görmüştür; 12 hastanın 4'üne yüksek doz (günde en az 40 mg prednizon veya eşdeğeri) kortikosteroid tedavisi uygulanmıştır. Hastaların hiçbirinde IMFINZI immün aracılı adrenal yetersizlik nedeniyle durdurulmamıştır. 3 hastada olay çözümlenmiştir.
İmmün aracılı Tip 1 diabetes mellitus
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı tip 1 diabetes mellitus 1 (<%0,1) hastada ortaya çıkmıştır (Derece 3). Olay ortaya çıkana kadar geçen süre 43 gün olmuştur. Hasta endokrin tedavisi almış ve IMFINZI immün aracılı tip 1 diabetes mellitus nedeniyle durdurulmuştur. Hastanın olayı çözümlenmiştir.
İmmün aracılı hipofizit/hipopitütiarizm
IMFINZI monoterapisi ile birleştirilmiş güvenlilik veri tabanında, immün aracılı hipofizit/hipopitüitarizm 2 (<%0,1) hastada (Derece 3) görülmüştür. Olaylar ortaya çıkana kadar geçen süre 44 gün ve 50 gün olmuştur. Her iki hasta yüksek doz kortikosteroid tedavisi (günde en az 40 mg prednizon veya eşdeğeri) almış ve bir hastada IMFINZI immün aracılı hipofizit/hipopituitarizm nedeniyle durdurulmuştur.
İmmün aracılı nefrit
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı nefrit 9 (%0,3) hastada ortaya çıkmıştır ve bunlara 2 (< %0,1) hastadaki Derece 3 olay dahildir. Başlangıca kadar geçen medyan süre 87 gün (aralık: 29-393 gün) olarak belirlenmiştir. Altı hasta (%0,2) yüksek doz kortikosteroid tedavisi görmüştür (günde en az 40 mg prednizon veya eşdeğeri) ve 1 hasta ayrıca mikofenolat almıştır. Beş hastada IMFINZI durdurulmuştur. 6 hastada olaylar çözümlenmiştir.
İmmün aracılı döküntü
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, immün aracılı döküntü veya dermatit (pemfigoid dahil) 45 (%1,5) hastada ortaya çıkmıştır ve bunlara 12 (%0,4) hastadaki Derece 3 olay dahildir. Başlangıca kadar geçen medyan süre 41 gün (aralık: 4-333 gün) olarak belirlenmiştir. 45 hastanın 20'si yüksek doz kortikosteroid tedavisi görmüştür (günde en az 40
mg prednizon veya eşdeğeri). IMFINZI 3 hastada durdurulmuştur. 31 hastada olaylar çözümlenmiştir.
İnfüzyon ile ilişkili reaksiyonlar
IMFINZI monoterapisine ilişkin birleşik güvenlilik veri tabanında, infüzyonla ilişkili reaksiyonlar 49 (%1,6) hastada ortaya çıkmıştır ve bunlara 5 (%0,2) hastadaki Derece 3 olay dahildir. Derece 4 ya da 5 olay yoktur.
Laboratuar Anomalileri
Durvalumab monoterapisi ile tedavi uygulanan hastalarda, başlangıçtan itibaren Derece 3 veya 4 laboratuvar anormalliği yaşayan hastaların oranı aşağıdaki gibidir: artan alanin aminotransferaz için %2,4; artan aspartat aminotransferaz için %3,6; artan kan kreatinini için %0,5; artan amilaz için %5,7 ve artan lipaz için %5,6. TSH'de başlangıçta ≤ NÜS'den herhangi bir derece> NÜS'ye kayma yaşayan hastaların oranı %18,8 ve TSH'de başlangıçta ≥ NAS olan herhangi bir derece
<NAS'ye kayma %18,1'dir.
Kemoterapi ile kombinasyon halinde durvalumab tedavisi gören hastalarda, başlangıçtan itibaren Derece 3 veya 4 laboratuar anomalisi gelişen hastaların oranı aşağıdaki gibiydir: artan alanin aminotransferaz için %4,9; artan aspartat aminotransferaz için %4,6; artan kan kreatinini için
%3,4; artan amilaz için %4,8 ve artan lipaz için %8,1. TSH'de başlangıçta ≤ NÜS'den herhangi bir derece> NÜS'e kayma yaşayan hastaların oranı %17,7 ve TSH'de başlangıçta ≥ NAS olan herhangi bir derece <NAS'ye kayma %31,3'tür.
İmmünojenisite
Monoterapi olarak IMFINZI'nin immünojenitesi, 2 haftada bir 10 mg/kg veya tek ajan olarak her
4 haftada bir 20 mg/kg IMFINZI ile tedavi uygulanan ve anti-ilaç antikor (ADA) varlığı açısından değerlendirilebilir olan 2280 hastadaki birleştirilmiş verilere dayanmaktadır. Altmış üç hastanın (%3,0) tedaviyle ortaya çıkan ADA testi pozitiftir. Durvalumaba yönelik nötralize edici antikorlar (nAb) hastaların %0,5'inde (12/2280) tespit edilmiştir. ADA'ların varlığı güvenlilik üzerinde klinik açıdan anlamlı etki ortaya çıkarmamıştır. ADA'nın etkililik üzerindeki etkisinin belirlenmesi için hasta sayısı yeterli değildir. Popülasyon farmakokinetiği analizine göre ADA açısından pozitif hastalarda hafifçe daha düşük maruziyet beklenmektedir, fakat FK maruziyetteki azalma tipik bir hastayla karşılaştırıldığında %30'un altındadır ve klinik açıdan anlamlı kabul edilmemektedir.
CASPIAN çalışmasında, her 3 haftada bir kemoterapi ile kombinasyon halindeki IMFINZI 1500 mg ile tedavi edilen ve ADA varlığı açısından değerlendirilebilen 201 hastadan 0 (%0) hastanın tedaviyle ortaya çıkan ADA testi pozitiftir. Tedaviyle ortaya çıkan ADA'nın, durvalumab FK, klinik güvenliliği ve etkililiği üzerindeki etkisi ölçülebilir değildir çünkü hiçbir hasta numunesi tedaviyle ortaya çıkan durvalumab ADA testinde pozitif sonuç vermemiştir.
Yaşlılar
Yaşlılar (≥ 65 yaş) ile daha genç hastalar arasında güvenlilik açısından genel olarak farklılık bildirilmemiştir. 75 yaş veya üzeri KHDAK ve YE-KHAK hastalarından elde edilmiş veriler sınırlıdır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Durvalumab ile doz aşımı konusunda herhangi bir bilgi yoktur. Doz aşımı durumunda, hastaların advers reaksiyon belirtileri veya semptomları açısından yakından izlenmesi ve derhal uygun semptomatik tedaviye başlanması önerilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar ATC kodu: L01XC28
Etki mekanizması
Programlanmış hücre ölümü ligand-1 (PD-L1) proteininin ekspresyonu, tümörlerin, immün sistem tarafından tespit edilmesinden ve eliminasyonundan kaçınmasına yardımcı olan adaptif bir immün yanıttır. PD-L1, inflamatuvar sinyallerce (örn., IFN-gamma) indüklenebilir ve hem tümör hücrelerinde hem de tümör mikro çevresinde tümör ile ilişkili immün hücrelerde eksprese olabilir. PD-L1, T hücre fonksiyonunu ve aktivasyonunu PD-1 ve CD80 (B7.1) ile etkileşim yoluyla bloke eder. PD-L1, reseptörlerine bağlanarak, sitotoksik T-hücre aktivitesini, proliferasyonunu ve sitokin üretimini azaltır.
Durvalumab, PD-L1'in PD-1 ve CD80 (B7.1) ile etkileşimini seçici bir şekilde bloke eden, tamamen insana ait, immünoglobulin G1 kappa (IgG1κ) monoklonal antikorudur. Durvalumab, antikora bağımlı hücre aracılı sitotoksisiteye (ADCC) neden olmaz. PD-L1/PD-1 ve PD- L1/CD80 etkileşimlerinin seçici blokajı anti-tümör immün yanıtlarını güçlendirir ve T-hücresi aktivasyonunu arttırır.
Klinik etkililik ve güvenlilik
![]()
KHDAK – PACIFIC Çalışması
IMFINZITM'nin etkililiği, lokal olarak ilerlemiş, rezeke edilemeyen 713 KHDAK hastası ile gerçekleştirilen randomize, çift kör, plasebo kontrollü, çok merkezli bir çalışma olan PACIFIC çalışmasında değerlendirilmiştir. Hastalar, çalışmaya başlamadan önceki 1 ila 42 gün içinde radyasyon tedavisi ile birlikte en az 2 kür definitif platin bazlı kemoterapiyi tamamlamıştır ve ECOG performans durumları 0 veya 1'dir. Hastaların %92'si toplam 54 ila 66 Gy radyasyon dozu almıştır. Kemoradyasyon sonrasında progrese olan hastalar, daha önce herhangi bir anti PD- 1 veya anti-PD-L1 antikoru maruziyeti olan hastalar, aktif veya çalışma başladıktan önceki 2 yıl içinde önceden belgelenmiş otoimmün bir hastalığı; immün yetmezlik öyküsü; şiddetli immün aracılı advers reaksiyonlar öyküsü; sistemik kortikosteroidlerin fizyolojik dozları hariç sistemik
immunosupresyon gerektiren tıbbi durumları; aktif tüberküloz veya hepatit B veya C veya HIV enfeksiyonu olan veya IMFINZITM tedavisi başlamadan önceki 30 gün içinde ve başladıktan sonraki 30 gün içinde canlı atenüe aşı olmuş olan hastalar çalışma dışı tutulmuştur. Hastalar, 12 aya kadar veya kabul edilemez toksisite ya da doğrulanan hastalık progresyonuna kadar 2 haftada bir intravenöz infüzyon yoluyla 10 mg/kg IMFINZITM (n=476) veya 10 mg/kg plasebo (n=237) almak üzere 2:1 oranında randomize edilmiştir. Randomizasyon cinsiyet, yaş (<65 yaşa karşın ≥ 65 yaş) ve sigara kullanma durumuna (sigara kullanana karşın sigara kullanmayan) göre tabakalandırılmıştır. 12. ayda hastalık kontrolü olan hastalara, hastalık progresyonu olduğunda yeniden tedavi edilme seçeneği verilmiştir. Tümör değerlendirmeleri ilk 12 ay 8 haftada bir ve sonrasında 12 haftada bir yapılmıştır.
Hastalar tümör PD-L1 ekspresyonu düzeyinden bağımsız şekilde çalışmaya dahil edilmiştir. Mümkün olması durumunda kemoradyoterapiden önce alınan arşiv amaçlı tümör dokusu numuneleri, VENTANA PD-L1 (SP263) IHC tayini kullanılarak tümör hücrelerinde (TC) PD-L1 ekspresyonu açısından retrospektif olarak test edilmiştir. Randomize edilen 713 hastanın %63'ü PD-L1 ekspresyonunu belirlemek için yeterli nitelik ve nicelikte doku numunesi sağlamıştır,
%37'si ise bilinmemektedir.
Demografik özelliklerin ve başlangıçtaki hastalık özelliklerinin çalışma kolları arasında iyi şekilde dengelenmiş olduğu görülmüştür. Genel çalışma popülasyonunun başlangıçtaki demografik özellikleri şu şekildedir: erkek (%70), ≥ 65 yaş (%45), ≥ 75 yaş (%8), Beyaz (%69),
Asyalı (%27), diğer (%4), sigara kullanmakta olan (%16), geçmişte sigara kullanmış olan (%75), hiç sigara kullanmamış olan (%9), ECOG Performans Durumu 0 (%49), ECOG Performans Durumu 1 (%51). Hastalık özelliklerinin şu şekilde olduğu belirlenmiştir: Evre IIIA (%53), Evre IIIB (%45), skuamöz (%46), skuamöz olmayan (%54) hidtolojik alt grupları. PD L1 ekspresyonu bilinen 451 hastanın %67'sinin TC ≥ %1 [PD-L1 TC %1-24 (%32), PD L1 TC ≥ %25 (%35)],
%33'ünün ise TC<%1 olduğu belirlenmiştir.
Çalışmanın iki primer sonlanma noktası, plaseboya kıyasla IMFINZI ile elde edilen progresyonsuz sağkalım (PFS) ve genel sağkalımdır (OS). Sekonder etkililik sonlanma noktası, randomizasyondan itibaren 12 aylık (PFS 12) ve 18 aylık (PFS 18) PFS'yi ve Randomizasyondan İkinci Progresyona Kadar Geçen Süreyi (PFS2) içermiştir. PFS, Körleştirilmiş Bağımsız Merkezi İnceleme (BICR) ile RECIST v1.1'e göre değerlendirilmiştir.
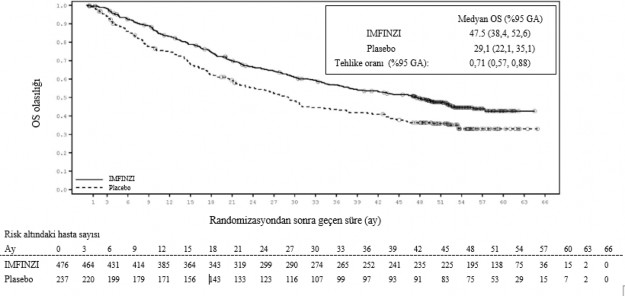
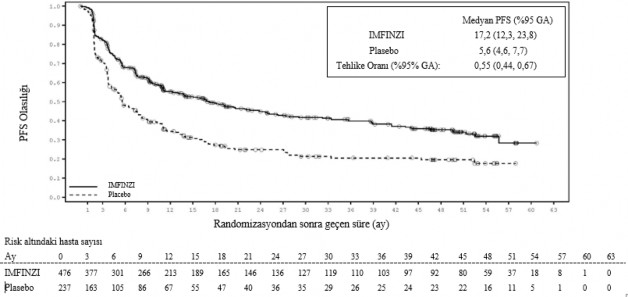
Çalışma IMFINZI ile tedavi uygulanan grupta PFS'de plasebo grubuyla karşılaştırıldığında istatistiksel olarak anlamlı bir iyileşme olduğunu göstermiştir [tehlike oranı (HR) = 0,52 (%95 GA: 0,42, 0,65), p <0,0001]. Çalışma IMFINZI ile tedavi uygulanan grupta OS'de plasebo grubuyla karşılaştırıldığında istatistiksel olarak anlamlı bir iyileşme olduğunu göstermiştir [HR = 0,68 (%95 GA: 0,53, 0,87), p <0,00251]. Bkz. Tablo 4 ve Şekil 1 ve 2.
Medyan 34,2 aylık takip ile 4-yıllık takip analizinde IMFINZI plaseboya kıyasla daha iyi OS ve PFS göstermeye devam etmiştir. Tablo 4 primer analiz ve takip analizinin OS ve PFS sonuçlarını özetlemektedir.
Tablo 4. PACIFIC çalışması için etkililik sonuçları
| Primer Analiz | 4-Yıllık Takip Analiz | ||
| IMFINZI (n = 476) | Plasebo (n = 237) | IMFINZI (n = 476) | Plasebo (n = 237) |
OS | ||||
Ölüm sayısı (%) | 183 (%38,4) | 116 (%48,9) | 247 (%51,9) | 149 (%62,9) |
Ortalama (ay) (%95 GA) | NR (34,7, NR) | 28,7 (22,9, NR) | 47,5 (38,4, 52,6) | 29,1 (22,1, 35,1) |
HR (%95 GA) | 0,68 (0,53, 0,87) | 0,71 (0,57, 0,88) | ||
2- yönlü p değeri | 0,00251 |
| ||
24. aydaki OS (%) (%95 GA) | %66,3 (%61,7, %70,4) | %55,6 (%48,9, %61,3) | %66,3 (%61,8, %70,4) | %55,3 (%48,6, %61,4) |
p-değeri | 0,005 |
| ||
48. aydaki OS (%) (%95 GA) |
|
| %49,6 (%44,9, %54,1) | %36,3 (%30,1, %42,6) |
PFS | ||||
Olay sayısı (%) | 214 (%45,0) | 157 (%66,2) | 266 (%55,9) | 174 (%73,4) |
Medyan PFS (ay) (%95 GA) | 16,8 (13,0, 18,1) | 5,6 (4,6, 7,8) | 17,2 (12,3, 23,8) | 5,6 (4,6, 7,7) |
HR (%95 GA) | 0,52 (0,42, 0,65) | 0,55 (0,44, 0,67) | ||
p-değeri | p < 0,0001 |
| ||
12. aydaki PFS (%) (%95 GA) | %55,9 (%51,0, %60,4) | %35,3 (%29,0, %41,7) | %55,3 (%50,5, %59,8) | %34,4 (%28,2, %40,7) |
18. aydaki PFS (%) (%95 GA) | %44,2 (%37,7, %50,5) | %27,0 (%19,9, %34,5) | %49,2 (%44,3, %53,) | %27,3 (%21,4, %33,5) |
48. aydaki PFS (%) (%95 GA) |
|
| %35,3 (%30,3, %40,4) | %19,5 (%14,1, %25,7) |
| Primer Analiz | 4-Yıllık Takip Analiz | ||
| IMFINZI (n = 476) | Plasebo (n = 237) | IMFINZI (n = 476) | Plasebo (n = 237) |
PFS2 | ||||
Medyan PFS2 (ay) (%95 GA) | 28,3 (25,1, 34,7) | 17,1 (14,5, 20,7) |
|
|
HR (%95 GA) | 0,58 (0,46, 0,73) |
| ||
p-değeri | p < 0,0001 |
| ||
a 13 Şubat 2017 tarihli veri kesme noktasında primer PFS analizi. 22 Mart 2018 tarihli veri kesme noktasında primer OS ve PFS2 analizi.
b 20 Mart 2020 tarihli veri kesme noktasına takip OS ve PFS analizi.
c PFS2 randomizasyondan ikinci progresyon tarihine (yerel standart klinik uygulama ile tanımlanan) veya ölüme dek geçen süre olarak tanımlanır.
NR: Ulaşılmadı
Şekil 1 ve 2 4-yıllık takip analizinden OS ve PFS için Kaplan-Meier eğrilerini gösterir.
Şekil 1. Kaplan-Meier OS eğrisi
Şekil 2. Kaplan-Meier PFS eğrisi
Plasebo alanlara kıyasla IMFINZI alan hastaların lehine PFS ve OS'de görülen iyileşmeler, etnik köken, yaş, cinsiyet, sigara kullanımı öyküsü, EGFR mutasyon durumu ve histolojiyi içeren tüm analiz edilen önceden tanımlanmış alt gruplarda tutarlı bir şekilde gözlenmiştir.
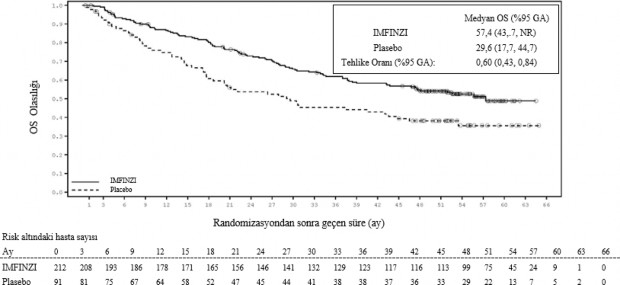
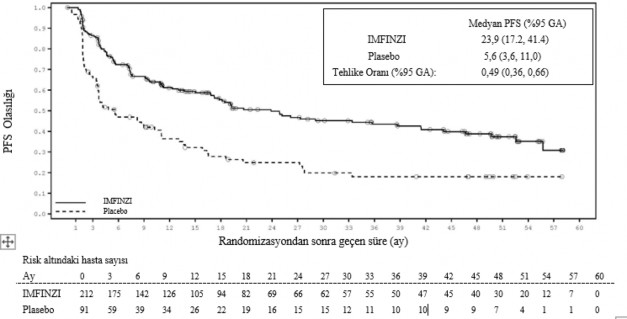
PD-L1 ekspresyonuna göre post-hoc alt grup analizi
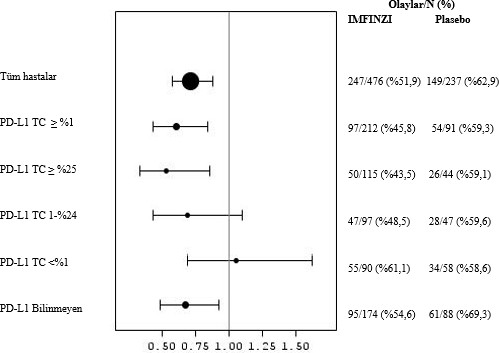
Tümör PD-L1 ekspresyonu (≥ %25, %1-24, ≥ %1, < %1) ve PD-L1 durumu belirlenemeyen (PD- L1 bilinmiyor) hastalar üzerinde etkililiği değerlendirmek üzere ek alt grup analizleri yapılmıştır. 4 yıllık takip analizi için PFS ve OS bulguları Şekil 3, 4, 5 ve 6'da özetlenmektedir.
Şekil 3. PD-L1 TC ≥ %1 için Kaplan-Meier OS eğrisi
Şekil 4. PD-L1 TC ≥ %1 için Kaplan-Meier PFS eğrisi
Şekil 5: PD-L1 Ekspresyonuna göre Forest OS grafiği
Şekil 6. PD-L1 Ekspresyonuna göre Forest PFS grafiği
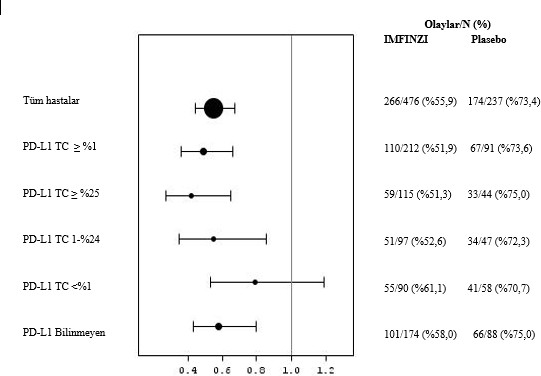
Genel olarak, PD-L1 TC ≥%1 alt grubunda durvalumabın güvenlilik profili, PD-L1 TC <%1 alt grubunda olduğu gibi, tedavi amaçlı popülasyonla tutarlılık sergilemiştir.
Hasta tarafından bildirilen sonuçlar
Hasta tarafından bildirilen semptomlar, fonksiyon ve sağlıkla ilişkili yaşam kalitesi (HRQoL), EORTC QLQ-C30 ve akciğer kanseri modülü (EORTC QLQ-LC13) kullanılarak toplanmıştır. LC13 ve C30 başlangıçta, ilk 8 hafta boyunca her 4 haftada bir, ardından tedavi periyodunun tamamlanmasına veya toksisite veya hastalık progresyonundan dolayı IMFINZI'nin kesilmesine kadar her 8 haftada bir değerlendirilmiştir. Uyumun IMFINZI ve plasebo tedavisi grupları arasında benzer olduğu görülmüştür (değerlendirilebilir tamamlanmış formlar toplamda %83'e karşılık %85,1).
Başlangıçta, IMFINZI ve plasebo grupları arasında hasta tarafından bildirilen semptomlarda, fonksiyonda ve HRQoL'de hiçbir fark gözlenmemiştir. 48. Haftaya kadar çalışma boyunca, IMFINZI ile plasebo grupları arasında semptomlar, işlevsellik ve HRQoL (10 puana eşit veya daha büyük bir fark ile değerlendirildiği üzere) açısından klinik olarak anlamlı bir fark ortaya çıkmamıştır.
KHAK – CASPIAN Çalışması
CASPIAN, etoposid ve karboplatin veya sisplatin ile kombinasyon halindeki tremelimumab ile veya tremelimumab olmadan IMFINZI'nin etkililiğini değerlendirmek üzere tasarlanmış bir çalışmadır. CASPIAN, WHO/ECOG performans durumu 0 veya 1, vücut ağırlığı> 30 kg olan ve KHAK için birinci basamak tedavi olarak platin bazlı bir kemoterapi rejimi almaya uygun, yaşam beklentisi ≥12 hafta olan, RECIST 1.1'e göre en az bir hedef lezyon ve yeterli organ ve kemik iliği fonksiyonuna sahip, tedavi görmemiş 805 YE-KHAK hastasında yapılan randomize, açık etiketli, çok merkezli bir çalışmadır. Asemptomatik ya da tedavi edilmiş beyin metastazları olan hastalar çalışmaya uygundur. Göğüs radyasyonu tedavisi öyküsü; aktif primer bağışıklık yetmezliği öyküsü; paraneoplastik sendrom (PNS) dahil olmak üzere otoimmün bozuklukları; aktif ya da önceden belgelenmiş otoimmün veya enflamatuar bozuklukları; tedavinin ilk dozundan önceki 14 gün içerisinde sistemik kortikosteroidlerin fizyolojik dozu dışında sistemik immünosupresanlar kullanan; aktif tüberküloz ya da hepatit B veya C ya da HIV enfeksiyonu bulunan ya da IMFINZI tedavisi başlamadan önceki 30 gün içinde ve başladıktan sonraki 30 gün içinde canlı atenüe aşı olmuş olan hastalar çalışmanın dışında bırakılmıştır.
Randomizasyon, 1. Kürdeki planlı platin bazlı (karboplatin ya da sisplatin) tedaviye göre tabakalandırılmıştır.
Hastalar 1:1:1 oranında aşağıdaki gibi randomize edilmiştir:
1. Kol: IMFINZI 1500 mg + tremelimumab 75 mg + etoposid ile karboplatin ya da sisplatin
2. Kol: IMFINZI 1500 mg + etoposid ile karboplatin ya da sisplatin
3. Kol: 4 ila 6 kür boyunca, 1. Günde karboplatin (EAA 5 veya 6 mg/mL/dak) veya
sisplatin (75-80 mg/m2) ve her 21 günlük siklusun 1., 2. ve 3. günlerinde intravenöz
etoposid (80-100 mg/m2).
Kol 1 ve 2'ye randomize edilen hastalar için, etoposid ile karboplatin ya da sisplatin, randomizasyondan sonra her 3 haftada bir şeklindeki programda 4 kür ile sınırlandırılmıştır. IMFINZI monoterapisi, hastalık progresyonuna ya da kabul edilemez toksisiteye kadar her 4 haftada bir devam etmiştir. Hastanın klinik olarak stabil olması ve araştırmacı tarafından belirlendiği gibi klinik fayda sağlaması durumunda IMFINZI monoterapisinin uygulanmasına hastalık progresyonundan sonra da izin verilmiştir.
3. kola randomize edilen hastaların toplam 6 kür etoposid ile karboplatin ya da sisplatin almalarına izin verilmiştir. Etoposid + platinin tamamlanmasından sonra, Profilaktik Kranyal Işınlama'ya (PCI) yalnızca 3. kolda araştırmacının takdirine göre izin verilmiştir.
Tümör değerlendirmeleri, randomizasyon tarihinden itibaren 6. ve 12. haftada ve ardından doğrulanan objektif hastalık progresyonuna kadar her 8 haftada bir gerçekleştirilmiştir. Sağkalım değerlendirmeleri, tedavinin sonlandırılmasından sonra her 2 ayda bir yapılmıştır.
Çalışmanın primer sonlanım noktaları, IMFINZI + etoposid + platin (Kol 2) karşısında tek başına etoposid + platin (Kol 3) ve IMFINZI + tremelimumab + etoposid + platin (Kol 1) karşısında tek başına etoposid + platinin (Kol 3) Genel Sağkalımıdır (OS). Kilit sekonder sonlanım noktası progresyonsuz sağkalımdır (PFS). Diğer sekonder sonlanım noktaları Objektif Yanıt Oranı (ORR), OS ve PFS değerlendirme noktaları ile Hasta Tarafından Bildirilen Sonuçlardır (PRO). PFS ve ORR, araştırmacı değerlendirmeleri kullanılarak RECIST v1.1'e göre değerlendirilmiştir.
Demografik bilgiler ve başlangıç hastalık özellikleri çalışmanın iki kolunda da (2. kolda 268 hasta ve 3. kolda 269 hasta) oldukça iyi dengelenmiştir. Genel çalışma popülasyonunun başlangıç demografik bilgileri şu şekildedir: erkek (%69,6); yaş ≥ 65 yaş (%39,6); medyan yaş 63 (aralık: 28 ila 82 yaş), beyaz (%83,8), Asyalı (%14,5), siyahi/Afro-Amerikan (%0,9), diğer (%0,6), Hispanik olmayanlar ya da Latin (%96,1), şimdi ya da eskiden sigara kullanan (%93,1), hiç sigara kullanmamış (%6,9), WHO/ECOG PS 0 (%35,2), WHO/ECOG PS 1 (%64,8), Evre IV
%90,3, sisplatin alan hastalar %24,6ve karboplatin alan hastalar % 74,1 idi ve 3. kolda hastaların
%56,8'i 6 kür etoposid + platin ve hastaların %7,8'i PCI almıştır.
Planlanmış bir ara (primer) analizde çalışma, tek başına etoposid + platine (Kol 3) kıyasla IMFINZI + etoposid + platin (Kol 2) ile OS'de istatistiksel olarak anlamlı bir iyileşme olduğunu göstermiştir [HR=0,73 (%95 GA: 0,591, 0,909), p=0,0047]. Anlamlılık açısından resmi olarak test edilmemiş olmasına rağmen, tek başına etoposid + platine kıyasla IMFINZI + etoposid + platin PFS'de de iyileşme göstermiştir [HR=0,78 (%95 GA: 0,645, 0,936)].
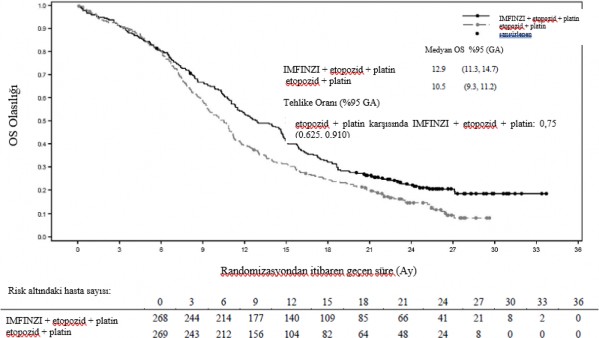
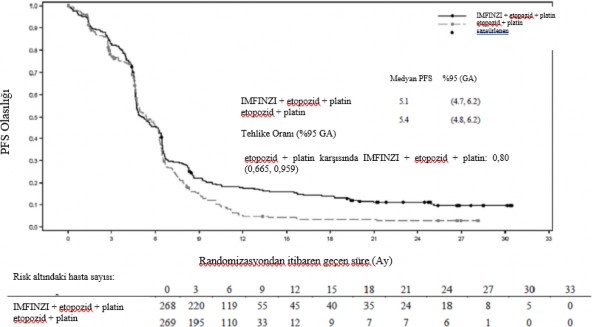
Planlı takip analizinde (medyan: 25,1 ay), IMFINZI + etoposid + platin (2. Kol) etoposid + platin (3. Kol) karşısında OS'de iyileşme devam etmiştir. Planlı takip analizinden elde edilen OS, PFS, ORR ve DoR sonuçları Tablo 5'te özetlenmiştir; OS ve PFS için Kaplan-Meier eğrileri Şekil 7 ve 8'de sunulmaktadır.
Tablo 5. CASPIAN Çalışması için Etkililik Sonuçları
| 2. Kol: IMFINZI + etoposid ile karboplatin ya da sisplatin (n=268) | 3. Kol: etoposid + karboplatin ya da sisplatin (n=269) |
OS | ||
Ölüm sayısı (%) | 210 (78,4) | 231 (85,9) |
Medyan OS (ay) | 12,9 | 10,5 |
(%95 GA) | (11,3, 14,7) | (9,3, 11,2) |
HR (%95 GA) | 0,75 (0,625, 0,910) | |
p-değeri | 0,0032 | |
18 ayda OS (%) | 32,0 | 24,8 |
(%95 GA) | (26,5, 37,7) | (19,7, 30,1) |
PFS |
| |
Olay sayısı (%) | 234 (87,3) | 236 (87,7) |
Medyan PFS (ay) | 5,1 | 5,4 |
(%95 GA) | (4,7, 6,2) | (4,8, 6,2) |
HR (%95 GA) | 0,80 (0,665, 0,959) | |
6 ayda PFS (%) | 45,4 | 45,8 |
(%95 GA) | (39,3, 51,3) | (39,5, 51,9) |
12 ayda PFS (%) | 17,9 | 5,3 |
(%95 GA) | (13,5, 22,8) | (2,9, 8,8) |
ORR n (%) | 182 (67,9) | 156 (58,0) |
(%95 GA) | (62,0, 73,5) | (51,8, 64,0) |
Tam Yanıt n (%) | 7 (2,6) | 2 (0,7) |
Kısmi Yanıt n (%) | 175 (65,3) | 154 (57,2) |
Medyan DoR (ay) | 5,1 | 5,1 |
(%95 GA) | (4,9, 5,3) | (4,8, 5,3) |
a 27 Ocak 2020 veri kesim tarihindeki takip OS, PFS, ORR ve DoR analizi
b Analiz, 1. kürdeki planlı platin tedavisine (karboplatin ya da sisplatin) göre ayarlanan katmanlandırılmış log-sıra testi kullanılarak ve ilişki sıra testleri yaklaşımı kullanılarak gerçekleştirilmiştir.
c Ara analizde (11 Mart 2019 veri kesim tarihi) OS p-değeri 0,0047 olup, gözlemlenen gerçek olay sayısında O'Brien Fleming türü sınırına sahip Lan-DeMets alfa harcama işlevine dayalı olarak % 4 genel 2 taraflı alfa için 0,0178 istatistiksel anlamlılık beyan sınırını karşılamıştır.
d Doğrulanan Objektif Yanıt.
e Post-hoc analiz.
Şekil 7. Ka plan-Meier OS eğrisi
plan-Meier OS eğrisi
Şekil 8. Kaplan-Meier PFS eğrisi
Alt grup analizi
Tek başına etoposid + platin alanlara kıyasla IMFINZI + etoposid + platin alan hastalar için OS'deki olumlu gelişmeler, demografik özellikler, coğrafi bölge, karboplatin veya sisplatin kullanımı ve hastalık özelliklerine göre önceden belirlenmiş alt gruplar arasında tutarlı bir şekilde gözlenmiştir.
5.2. Farmakokinetik özellikler
Durvalumab farmakokinetiği (FK) hem monoterapi hem de kemoterapi ile kombinasyon halindeki IMFINZI için değerlendirilmiştir.
Emilim:
IMFINZI' nin intravenöz yolla uygulandığı düşünülürse, IMFINZI' nin absorpsiyonuyla ilgili veri mevcut değildir.
Biyotransformasyon:
IMFINZI, IgG1 alt sınıfına dahil bir immünoglobülindir ve bu nedenle metabolize edilmez. Bunun yerine Imfinzi, endojen IgG moleküllerine benzer şekilde, retiküloendotelyal sistem tarafından peptit ve amino asit bileşenlerine katabolize edilmektedir ve nihai ürünler endojen aminoasit havuzuna alınmaktadır.
Dağılım:
1878 hastayı içeren bir popülasyon farmakokinetik analizine dayalı olarak iki haftada bir
≥10 mg/kg doz aralığında geometrik ortalama kararlı durum dağılım hacmi (V) 5,64 L'dir.
Eliminasyon:
Durvalumab klerensi (KL) zaman içinde azalarak 365. günde 8,6 mL/saat geometrik ortalama kararlı durum klerensi (KL) ile sonuçlanmış olup, KLss'deki düşüşün klinik olarak anlamlı olduğu değerlendirilmemiştir. Başlangıç KL değerine dayalı terminal yarılanma ömrü (t) yaklaşık 18 gündür. Durvalumabın tek bir ajan olarak ve kemoterapi ile kombinasyon halindeki farmakokinetiği arasında klinik olarak anlamlı bir fark bulunmamaktadır. Durvalumabın primer eliminasyon mekanizmaları hedef aracılı dağılım veya retiküloendotelyal sistem yoluyla protein katabolizmasıdır.
Doğrusallık/Doğrusal Olmayan Durum:
Durvalumabın farmakokinetiği solid tümörleri olan 2903 hastada iki, üç veya dört haftada bir monoterapi olarak intravenöz yoldan uygulanan 0,1 ila 20 mg/kg aralığındaki dozlarla çalışılmıştır. Farmakokinetik maruziyeti <3 mg/kg dozlarda doz orantısal değerin üzerinde (doğrusal olmayan farmakokinetik) ve ≥3 mg/kg dozlarda doz orantısal bir şekilde (doğrusal farmakokinetik) artmıştır. Kararlı duruma yaklaşık 16 haftada ulaşılmıştır.
Hastalardaki karakteristik özellikler
Diğer özel popülasyonlar:
Yaş (19 - 96 yaş), vücut ağırlığı (31 - 149 kg), cinsiyet, pozitif anti-ilaç antikor (ADA) durumu, albümin düzeyleri, LDH düzeyleri, kreatinin düzeyleri, çözünebilir PD-L1, tümör tipi, ırk veya
ECOG durumu durvalumabın farmakokinetiği üzerinde klinik olarak anlamlı bir etki ortaya çıkarmamıştır.
Böbrek yetmezliği:
Hafif (kreatinin klirensi (CrCL) 60 ila 89 mL/dak) ve orta dereceli (kreatinin klirensi (CrCL) 30 ila 59 mL/dak) böbrek yetersizliği, durvalumabın farmakokinetiği üzerinde klinik olarak anlamlı bir etki sergilememiştir. Şiddetli böbrek yetersizliğinin (CrCL 15 ila 29 mL/dak) durvalumabın farmakokinetiği üzerindeki etkisi bilinmemektedir.
Karaciğer yetmezliği:
Hafif karaciğer yetersizliği (bilirubin ≤ NÜS ve AST > NÜS veya bilirubin > 1,0 ila 1,5 × NÜS ve herhangi bir AST), durvalumabın farmakokinetiği üzerinde klinik olarak anlamlı bir etki sergilememiştir. Orta dereceli karaciğer yetersizliğinin (bilirubin > 1,5 ila 3 x NÜS ve herhangi bir AST) veya şiddetli karaciğer yetersizliğinin (bilirubin > 3,0 x NÜS ve herhangi bir AST) durvalumabın farmakokinetiği üzerindeki etkisi bilinmemektedir; bununla birlikte, IgG monoklonal antikorları primer olarak hepatik mekanizmalar yoluyla uzaklaştırılmadığından, karaciğer fonksiyonundaki bir değişikliğin durvalumab maruziyetini etkilemesi beklenmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Karsinojenisite ve mutajenisite
Durvalumabın karsinojenik ve genotoksik potansiyeli değerlendirilmemiştir.
Üreme toksikolojisi
Literatürde bildirildiği gibi, PD-1 / PD-L1 mekanizması, annenin fetüse karşı bağışıklık toleransını devam ettirerek gebeliğin korunmasında merkezi bir rol oynar ve fare allojenik gebelik modellerinde PD-L1 sinyalinin bozulmasının fetüs kaybında bir artışa yol açtığı gösterilmiştir. Hayvan üreme çalışmalarında, hamile cynomolgus maymunlarına gebeliğin doğrulanmasından başlanarak doğumdan kadar 10 mg/kg durvalumab klinik dozunda gözlemlenenden yaklaşık 18 kat daha yüksek maruziyet düzeylerinde (EAA'ya göre) durvalumab uygulamasının plasenta transferi ile ilişkili olduğu ancak maternal toksisite veya embriyofetal gelişim, gebelik sonucu veya postnatal gelişim üzerine etki göstermediği gözlenmiştir. Doğumdan sonraki 28. günde cynomolgous maymunun sütünde göz ardı edilebilir düzeyde durvalumab tespit edilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Histidin
Histidin hidroklorür monohidrat Trehaloz dihidrat
Polisorbat 80 Enjeksiyonluk su
6.2. Geçimsizlikler
Bu tıbbi ürün, Bölüm 6.6'da belirtilenler dışında başka tıbbi ürünler ile karıştırılmamalıdır. Ürünün seyreltilmesinde %0.9 Sodyum Klorür Enjeksiyon veya %5 Dekstroz Enjeksiyon kullanılmalıdır.
Geçimlilik çalışmaları polyolefin (PO) veya polivinil-klorür (PVC) infüzyon torbaları ile yapıldığından, infüzyonluk çözelti hazırlanırken sadece PO veya PVC infüzyon torbaları kullanılmalıdır.
6.3. Raf ömrü
Açılmamış flakon
2ºC - 8ºC arasında buzdolabında saklandığında 36 ay
Seyreltilmiş çözelti
Mikrobiyolojik açıdan bakıldığında, infüzyon için hazırlanan çözelti hemen kullanılmalıdır. Hemen kullanılmayacak olduğu takdirde, kullanım sırasındaki saklama süreleri ve kullanımdan önceki koşullar kullanıcının sorumluluğundadır ve seyreltme, kontrollü ve valide edilmiş aseptik koşullarda yapılmadıkça, normalde 2°C ila 8°C'de 24 saatten veya oda sıcaklığında (25°C'ye kadar) 12 saatten uzun olmayacaktır.
6.4. Saklamaya yönelik özel tedbirler
Açılmamış flakon
2ºC - 8ºC arasında buzdolabında saklayınız. Dondurmayınız.
Çalkalamayınız.
Işıktan korumak için orijinal ambalajında saklayınız.
Seyreltilen çözelti
İnfüzyonun hazırlanmasından sonraki saklama koşulları için Bölüm 6.3'e bakınız.
6.5. Ambalajın niteliği ve içeriği
Elastomerik tıpa ve gri alüminyum flip-off contalı 10 mL'lik Tip 1 cam flakon içindeki 10 mL konsantre, 500 mg durvalumab içerir. 1 flakonluk ambalaj büyüklüğü.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmelikâ€lerine uygun olarak imha edilmelidir.
Çözeltinin hazırlanması
IMFINZITM, tek dozluk bir flakonda sunulmaktadır ve herhangi bir koruyucu içermemektedir. Bu nedenle çözelti hazırlanıyorken aseptik teknik kullanılmalıdır.
Müstahzarı partikül madde ve renk bozukluğuna karşı görsel olarak inceleyiniz. IMFINZITM berrak ile opak arası, renksiz ila hafif sarı renkli çözeltidir. Eğer çözelti bulanıksa, renk bozukluğu varsa veya gözle görülür partiküller gözleniyorsa flakonu imha ediniz. Flakonu çalkalamayınız.
IMFINZI flakonundan (flakonlarından) gereken hacmi çekiniz ve 9 mg/mL (%0.9) enjeksiyonuk sodyum klorür solüsyonu veya 50 mg/mL (%5) enjeksiyonluk glukoz solüsyonu içeren bir intravenöz (IV) torbaya aktarınız. Hafifçe ters-düz ederek seyreltilmiş çözeltiyi karıştırınız. Seyreltilmiş çözeltinin nihai konsantrasyonu 1 mg/mL ila 15 mg/mL arasında olmalıdır. Çözeltiyi dondurmayınız veya çalkalamayınız.
Flakonda kalan kısım varsa bunu imha ediniz.
Uygulama
İnfüzyon çözeltisini steril, proteine düşük bağlanma özellikli 0,2 veya 0,22 mikron düz eksenli filtre içeren bir intravenöz hattan 1 saat boyunca intravenöz yoldan uygulayınız.
Aynı infüzyon hattından başka ilaçları birlikte uygulamayınız.
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 74425.28 TL [ 13 Oct 2025 ] |
| Önceki Satış Fiyatı | 74425.28 TL [ 6 Oct 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699786770904 |
| Etkin Madde | Durvalumab |
| İthal ( ref. ülke : Isvec ) ve Beşeri bir ilaçdır. |