İMİGRAN 10 Mg / Doz Nazal Sprey Kısa Ürün Bilgisi
{ Sumatriptan }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
İMİGRAN 10 mg / doz nazal sprey2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her 0.5 mİ içinde:
Sumatriptan (INN)...............................10 mg.
Diğer yardımcı maddeler için 6.1e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Nazal sprey
Berrak açık sarı ila koyu sarı sıvı
4.1. Terapötik endikasyonlar
4.2. Pozoloji ve uygulama şekli
Pozoloji/ uygulama sıklığı ve süresi:
Sumatriptan profılaktik olarak kullanılmamalıdır.
Sumatriptanın migren baş ağrısının başlamasından sonra mümkün olduğunca erken verilmesi tavsiye edilir, fakat atağın hangi safhasında verilirse verilsin eşit derecede etkilidir.
Yetişkinler (18 yaş ve üzeri)
Optimal sumatriptan nazal sprey dozu bir burun deliğinden uygulanmak üzere 20 mgdır. Hem migren atağının hem de sumatriptanın emiliminin hastalar arasında veya hastalann kendi içinde değişkenlik göstermesinden dolayı bazı hastalarda ve ataklarda 10 mg etkili olabilir. Eğer hasta ilk sumatriptan dozuna cevap vermezse, aynı atak için ikinci bir doz alınmamalıdır. Sumatriptan nazal sprey daha sonra gelen ataklar için alınabilir.
Eğer hasta ilk doza cevap verir, fakat belirtiler nüks ederse ilk dozu takiben 24 saat içinde ikinci doz verilebilir, ancak iki doz arasında en az 2 saatlik bir ara bırakılmalıdır.
Herhangi bir 24 saatlik süre içinde iki İMİGRAN 20 mg nazal spreyden daha fazlası kullanılmamalıdır.
Özel popülasyona ilişkin ek bilgiler: Adolesanlar (12-17 yaş arası):
Bu yaş grubunda migren tedavisinde deneyimi olan hekim tarafından tavsiye edilmelidir. Tavsiye edilen sumatriptan nazal sprey dozu bir burun deliğinden uygulanmak üzere 10 mgdır. Migren atağının ve sumatriptana maruz kalmanın hastalar arasında veya hastalann kendi içinde değişkenlik göstermesinden dolayı bazı hastalara 20 mglık doz gerekebilir.
Eğer hasta ilk sumatriptan dozuna cevap vermezse, aynı atak için ikinci bir doz alınmamalıdır. Sumatriptan daha sonra gelen ataklar için alınabilir.
Eğer hasta ilk doza cevap verir, fakat belirtiler nüks ederse ilk dozu takiben 24 saat içinde ikinci doz verilebilir, ancak iki doz arasında en az 2 saatlik bir ara bırakılmalıdır.
Herhangi bir 24 saatlik süre içinde iki sumatriptan 20 mg nazal spreyden daha fazlası kullanılmamalıdır.
Pediyatrik popülasyon (12 yaş altı) :
Sumatriptan nazal spreyin çocuklardaki güvenilirliği ve etkililiği henüz kanıtlanmamıştır. Geriyatrik popülasyon:
65 yaş üzeri hastalarda sumatriptan nazal spreyin kullanımı ile ilgili klinik deneyim bulunmamaktadır.
Böbrek yetmezliği
Sumatriptan, böbrek yetmezliği olan hastalarda araştırılmamıştır. Böbrek yetmezliği olan hastalara dikkatle uygulanmalıdır (bkz. Uyarılar ve Önlemler). Bununla birlikte, böbrek yetmezliği olan hastalann doz ayarlaması gerektirmesi olası değildir (bkz. Farmakokinetik).
Karaciğer yetmezliği
4.3. Kontrendikasyonlar
ve Farmakokinetik). Hafif ila orta şiddetli karaciğer yetmezliği olan hastalarda (Child-Pugh derece A veya B) dikkatle uygulanmalıdır (bkz. Uyarılar ve Önlemler).
Hemiplejik, baziler ve oftalmoplejik migren vakalarında.
Preparatın bileşenlerinden herhangi birine aşırı duyarlılığı olanlarda.
Sumatriptan, miyokard enfarktüsü geçirmiş hastalara veya iskemik kalp hastalığı olanlara, Prinzmetal angina/koroner vazospazm olanlara, periferal damar hastalığı veya iskemik kalp hastalığına uyan belirti ve işaretleri olan hastalara verilmemelidir.
Sumatriptan, serebrovasküler olay veya geçici iskemik atak hikayesi olan hastalara uygulanmamalıdır.
Kontrol altına alınmamış hipertansiyonu olan hastalarda sumatriptan kullanımı kontrendikedir.
Sumatriptan, şiddetli karaciğer bozukluğu olan hastalara uygulanmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Sumatriptan sadece açık olarak migren tanısı konulmuşsa kullanılmalıdır.
Diğer akut migren tedavilerinde olduğu gibi, önceden migren tanısı konmamış hastalarda ve atipik belirtileri olan migrenlilerde baş ağrısı tedavisine başlamadan önce diğer ciddi nörolojik durumların bertaraf edilmesi gerekir. Migrenlilerin belirli serebrovasküler olaylar (ör. CVA, TIA serebrovasküler olay, geçici iskemik atak) açısından yüksek risk altında olabilecekleri unutulmamalıdır.
4.8. İstenmeyen etkiler
). Eğer bu belirtiler iskemik kalp hastalığını düşündürürse uygun değerlendirme yapılmalıdır. Sumatriptan, tanısı konulmamış kalp hastalığı bulunma ihtimali olan postmenopozal kadın hastalara, 40 yaş üzeri erkek hastalara ve koroner arter hastalığı riski taşıyan hastalara, altta yatan kardiyovasküler bir hastalığı olup olmadığı incelenip değerlendirilmeden verilmemelidir. Ancak, bu değerlendirmeler kalp hastalığı olan her hastayı belirleyemeyebilir ve çok seyrek vakalarda altta yatan kardiyovasküler hastalık olmayan hastalarda ciddi kardiyak olaylar oluşabilir.
Hastaların az bir kısmında kan basıncında ve periferik damar direncinde geçici yükselmeler gözlendiğinden, sumatriptan kontrol altına alınmış hipertansiyon hastalarına dikkatle uygulanmalıdır.
Seyrek olarak, pazarlama sonrası raporlarda, selektif serotonin geri alım inhibitörleri (SSRI) ve sumatriptan kullanımını takiben serotonin sendromu (değişen mental durum, otonomik instabilite ve nöromüsküler anormallikler dahil) olan hastalar tanımlanmıştır. Serotonin sendromu, triptanlar ve serotonin noradrenalin geri alım inhibitörleri (SNRI) ile birlikte uygulandıktan sonra bildirilmiştir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Herhangi bir triptan/5-HTı agonistinin sumatriptan ile birlikte uygulanması tavsiye edilmemektedir.
Sumatriptan, böbrek veya karaciğer fonksiyon bozukluğu gibi ilacın emilimi, metabolizması veya atılımını önemli ölçüde etkileyen bir hastalığı olanlarda dikkatle uygulanmalıdır. Sumatriptan, nöbet öyküsü olanlarda veya nöbet eşiğini düşürebilen diğer risk faktörleri olan hastalarda dikkatle kullanılmalıdır.
Sülfonamidlere aşırı duyarlılığı olduğu bilinen hastalarda sumatriptan alimim takiben alerjik reaksiyon görülebilir. Alerjik reaksiyonlar deride aşırı duyarlılık reaksiyonlarından anaflaksiye kadar değişebilir. Çapraz duyarlılık kanıtı sınırlıdır, ancak bu hastalarda sumatriptan kullanılmadan önce dikkatli olunmalıdır.
Akut migren tedavisinde kullanılan ilaçların aşırı kullanımı, duyarlı hastalarda başağrısının alevlenmesi ile ilişkili bulunmuştur (aşırı ilaç kullanımına bağlı baş ağrısı). Bu tip durumlarda tedaviye son verilmesi gerekebilir.
Önerilen sumatriptan dozu aşılmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Propranolol, flunarizin, pizotifen veya alkol ile bir etkileşimi olduğu kanıtlanmamıştır.
Ergotamin ile uzun süreli vazospastik reaksiyonlar bildirilmiştir. Bu etkiler birbirine eklenebileceğinden eğer ergotamin içeren bir preparat alınmışsa sumatriptan ancak 24 saat sonra alınabilir. Tersine, sumatriptan alınmayı takiben herhangi bir ergotamin içeren preparat alınacaksa aradan en az 6 saat geçmelidir.
4.3. Kontrendikasyonlar
ı).
4.4. Özel kullanım uyarıları ve önlemleri
İMİGRAN ile St John bitkisi içeren bitkisel ürünlerin eşzamanlı kullanılması yan etki olasılığını artırabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Veri yoktur.
Pediyatrik popülasyon:
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi Cdir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü
(Kontrasepsiyon)Hayvanlar üzerinde yapılan çalışmalar, gebelik, embriyonal/fetal gelişim, doğum veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.
İMİGRAN gerekli olmadıkça çocuk doğurma potansiyeli olan kadınlarda kullanılmamalıdır.
Gebelik dönemi
Anneye sağlaması beklenen yaran ve fetüse olan olası riski dikkatlice değerlendirilmelidir. Çoklu prospektif gebelik bildirimlerinden elde edilen pazarlama sonrası veriler 1000in üzerinde sumatriptana maruz kalan kadının gebelik sonuçlarını göstermektedir. Kesin sonuç sunmak için yetersiz bilgi olmasına rağmen bulgular genel popülasyon ile karşılaştınldığında sumatriptana maruz kalan kadınlarda doğum kusurları sıklığında artış veya doğum kusurlannda tutarlı bir patem belirlenmemiştir.
Laktasyon dönemi
Sumatriptanın subkütan uygulanmasını takiben anne sütü ile atıldığı gösterilmiştir. Bebeğin tedaviden sonra 12 saat emzirilmeyerek sumatriptana maruz kalması azaltılabilir.
Üreme yeteneği/Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
Migren veya sumatriptan ile tedavi sonucu uyuşukluk olabilir.
4.8. İstenmeyen etkiler
Klinik çalışmalardan alınan veriler tahminidir. Karşılaştırma gruplarındaki genel oran dikkate alınmamıştır. Pazarlama-sonrası veriler gerçek sıklıktan çok raporlama oranına dayanmaktadır.
Rapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir:
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek (>1/10,000 ila <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Klinik çalışma verileri
Sinir sistemi hastalıkları
Yaygın: Baş dönmesi, uyuşukluk, parestezi ve hipoestezi dahil duyusal rahatsızlıklar.
Vasküler hastalıklar
Yaygın: Tedavinin hemen sonrasında kan basıncında geçici artışlar. Yüz kızarması.
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Sumatriptan nazal spreyi uyguladıktan sonra hafif, geçici iritasyon veya burun ya da boğazda yanma hissi veya burun kanaması bildirilmiştir.
Gastrointestinal hastalıklar
Yaygın: Kusma ve bulantı (sumatriptan ile ilişkisi açık değildir).
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Aşağıdaki belirti genellikle geçicidir. Yoğun olabilir, göğüs ve boğaz dahil olmak üzere vücudun herhangi bir bölümünü etkileyebilir.
Yaygın: Ağırlık hissi.
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Aşağıdaki belirtiler genellikle geçicidir. Yoğun olabilir, göğüs ve boğaz dahil vücudun herhangi bir bölümünü etkileyebilir.
Yaygın: Ağrı, sıcak veya soğuk, basınç veya daralma hissi.
Aşağıdaki belirtiler çoğunlukla hafif veya orta şiddetlidir ve geçicidir:
Yaygın: Halsizlik hissi, yorgunluk.
Araştırmalar
Çok seyrek: Karaciğer fonksiyon testlerinde minör bozukluklar
Pazarlama-sonrası veriler Bağışıklık sistemi hastalıkları
Çok seyrek: Deride aşırı duyarlılık reaksiyonlarından anaflaksiye kadar değişen aşırı duyarlılık reaksiyonları.
Sinir sistemi hastalıkları
Çok seyrek: Nöbetler. Bir kısmı önceden nöbet öyküsü olan veya nöbetlere yatkınlık yaratan durumları olan hastalarda görülmesine rağmen önceden yatkınlık yaratacak hiçbir durumu olmayan hastalarla ilgili nöbet raporları da vardır.
Tremor, distoni, nistagmus, skotom.
Göz hastalıkları
Çok seyrek: Işık parlaması, çift görme, görüşte azalma. Görüş kaybı (genellikle geçicidir). Ancak görsel bozukluklar migren atağı sırasında da oluşabilir.
Kardiyak hastalıklar
Çok seyrek: Bradikardi, taşikardi, çarpıntı, kardiyak aritmiler, geçici iskemik EKG değişiklikleri, koroner arter vazospazmı, anjina, miyokard enfarktüsü (bkz.
4.3. Kontrendikasyonlar
4.4. Özel kullanım uyarıları ve önlemleri
Vasküler hastalıklar
Yaygın: Geçici kan basıncı artışı
Çok seyrek: Hipotansiyon, Raynaud hastalığı.
Gastrointestinal hastalıklar
4.9. Doz aşımı ve tedavisi
Belirti ve işaretler
40 mga kadar intranazal olarak tek doz sumatriptan uygulandığında bahsedilen yan etkiler dışında başka bir yan etki görülmemiştir.
Klinik çalışmalarda gönüllüler intranazal yol ile günde 3 kez, 4 gün boyunca 20 mg sumatriptan aldığında herhangi anlamlı yan etki oluşmamıştır
Tedavi
Eğer aşırı doz oluşursa, hasta en az 10 saat kontrol altında tutulmalı ve gerekirse standart destekleyici tedavi uygulanmalıdır.
Hemodiyaliz veya peritonal diyalizin sumatriptan plazma konsantrasyonlan üzerine etkileri bilinmemektedir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif 5-HTı reseptör antagonisti ATC kodu: N02 C C01
Etki mekanizması
Sumatriptan selektif bir vasküler 5-hidroksi triptamin-1 (5HTıDve 5HTıB) reseptör agonisti olup, diğer 5HT reseptör (5HT2-5HT7) alt tipleri üzerine etkisi yoktur. Vasküler 5HTıD ve 5HTib reseptörleri başlıca kraniyel kan damarlarında bulunur ve vazokonstriksiyona aracılık eder.
Hayvanlarda sumatriptan selektif olarak karotis arteryel dolaşımı daraltır ancak serebral kan akımını değiştirmez. Karotis arteryal dolaşım, ekstrakraniyel ve meninksler gibi intrakraniyel dokulara kan sağlar ve bu damarlarda gevşeme ve/veya ödem oluşumunun insanda migrenin altta yatan mekanizması olduğu düşünülmektedir. Ek olarak, deneysel kanıtlar sumatriptanın trigeminal sinir aktivitesini inhibe ettiğini göstermektedir. Bu her iki aktivite sumatriptanın insanda antimigren etkisine eşlik eder.
Farmakodinamik etkileri
Klinik cevap 6 mglık subkutan enjeksiyonu takiben 10-15 dak., 20 mglık dozun intranazal uygulamasını takiben 15 dak. ve 100 mglık oral dozu veya 25 mglık rektal dozu takiben yaklaşık 30 dakika içinde başlar.
5.2. Farmakokinetik özellikler
Genel özellikler
Sumatriptanın farmakokinetiği migren ataklarından etkilenmez.
Emilim:
İntranazal uygulamayı takiben, sumatriptan hızla absorbe olur ve 1-1,5 saat sonra maksimum plazma konsantrasyonuna ulaşır. 20 mglık dozu takiben ortalama maksimum konsantrasyonu
12,9 ng/mldir. Ortalama intranazal biyoyararlanım, kısmen sistemik dolaşıma geçmeden önceki metabolizmadan ötürü subkutan uygulamaya göre %15.8dir
Dağılım:
Plazma proteinlerine bağlanma düşük olup (% 14-21), ortalama toplam dağılım hacmi 170 litredir.
Biyotrans formasyon:
Sumatriptanın en önemli metaboliti indol asetik asit analoğu olup, başlıca idrarla serbest asit ve glukuronid konjugatı şeklinde atılır. Bu metabolitin bilinen 5HTı veya 5HT2 aktivitesi yoktur. Minör metabolitleri saptanmamıştır.
Eliminasyon:
Eliminasyon yarılanma ömrü yaklaşık 2 saattir. Ortalama toplam plazma klerensi yaklaşık 1,160 ml/dakika ve ortalama renal plazma klerens yaklaşık 260 ml/dakikadır.
Renal olmayan klerens, total klerensin yaklaşık %80idir. Sumatriptan başlıca monoamin oksidaz Anın aracılık ettiği oksidatif metabolizma ile elimine edilir.
Hastalardaki karakteristik özellikler
Karaciğer hastaları:
Oral uygulamayı takiben hepatik bozukluğu olan hastalarda sistemik dolaşıma geçmeden önceki klerens düşer. Bu da sumatriptanın plazma düzeylerinin artışıyla sonuçlanır. Benzer artış intranazal uygulamayı takiben de beklenir.
Adölesan (12-17 yas arası):
Adölesan deneklerde (12-17 yaş) yapılan bir farmakokinetik çalışma, 20 mg intranazal dozu takiben ortalama eliminasyon yarılanma ömrünün yaklaşık 2 saat ve ortalama maksimum plazma konsantrasyonunun 13.9 ng/ml olduğunu göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Karsinojenez, mutajenez
In vitro sistemlerde ve hayvan çalışmalarında sumatriptanın genotoksik ve karsinojenik olmadığı görülmüştür.
Reprodüktif toksikoloji
Sıçanlar üzerinde yapılan bir fertilite çalışmasında, insana intranazal yolla verilen 20 mg sumatriptanı takiben oluşan plazma konsantrasyonunun yaklaşık 750 katı plazma düzeyleri ile sonuçlanan oral sumatriptan dozları inseminasyon başarısında azalma ile ilişkilidir.
Bu etki sıçanlar üzerinde yapılan ve insanlarda intranazal yolla verildiğinde ulaşılan maksimum plazma düzeyinin yaklaşık 500 katına ulaşılan subkütan çalışma sırasında oluşmaz.
Gebelik ve laktasyon
Sıçanlarda ve tavşanlarda teratojenik etki gözlenmemiştir ve sumatriptanın sıçanların post natal gelişimi üzerine etkisi yoktur.
Organeojenez sırasında gebe tavşanlara matemal toksisite oluşturmaya yetecek dozda sumatriptan uygulandığında bazen embriyoletaliteye neden olmuştur.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
6.2. Geçimsizlikler
Bilinen bir geçimsizliği yoktur.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
30 °Cnin altında oda sıcaklığında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.
Kullanıma hazırlama ve imha talimatları
Nazal sprey blister ambalajından sadece kullanımdan hemen önce çıkarılmalıdır.
Nazal sprey aşağıdaki parçaları içermektedir:
Uygulama ucu: Bu, burun deliği içine sokulan kısımdır. Sprey, en üstteki küçük delikten püskürür.

Tutma parçası: Bu, spreyi uygularken tuttuğunuz kısımdır.
Mavi piston: Pistona bastığınızda tüm doz bir seferde burun deliği içine püskürtülür. Piston sadece bir kez çalışır, bu nedenle uygulama ucunu burun deliği içine sokmadan önce pistona basmayınız, yoksa dozu kullanmadan harcamış olursunuz.

İlk olarak rahat bir pozisyona geçiniz. Yakınınızda oturacak yer varsa oturabilirsiniz.
Burnunuzu tıkalı hissediyorsanız veya soğuk algınlığınız varsa burnunuzu sümkürerek temizleyiniz.

Blister paketi açınız ve nazal spreyi dışarı çıkarınız.
Nazal spreyi parmaklarınız ve baş parmağınızla şekilde gösterildiği gibi dikkatlice tutunuz.
Mavi pistona henüz basmayınız.

Bir burun deliğinizi burnunuzun dışından parmağınızla sıkıca bastırarak kapatınız.
Ağzınızdan hafifçe dışarı nefes veriniz.
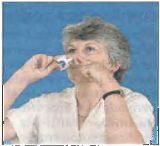
Nazal spreyin uygulama ucunu diğer burun deliğine rahat yapabildiğiniz kadar geriye sokunuz (yaklaşık lcm).
Şimdi başınızı şekilde gösterildiği gibi hafifçe geriye eğiniz ve ağzınızı kapatınız.
Burnunuzdan hafifçe nefes almaya başlayınız ve aynı zamanda mavi pistona baş parmağınızla sertçe basınız.
Piston biraz sert olabilir ve klik sesi duyulabilir.
Başınızı geriye eğik tutunuz ve 10-20 saniye ağzınızdan nefes alıp veriniz. DERİN NEFES ALMAYINIZ.
Bu işlemi yaparken spreyi dışarı çıkarabilir ve parmağınızı burnun diğer kısmından çekebilirsiniz.
Burnun içini ıslak hissedebilirsiniz ve spreyi kullandıktan sonra hafif bir tat alabilirsiniz. Bu normaldir ve kısa bir süre sonra geçer.
Bir kez kullandıktan sonra nazal spreyiniz artık boştur. Güvenli ve hijyenik bir şekilde imha edilmelidir.
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| SUMATRAN | 8699517090608 | |
| Diğer Eşdeğer İlaçlar |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | |
| Etkin Madde | Sumatriptan |
| İthal ve Beşeri bir ilaçdır. |