JARDIANCE 10 mg film kaplı tablet Kısa Ürün Bilgisi
{ Empagliflozin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
JARDIANCE 10 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet, 10 mg empagliflozin içerir.
Yardımcı maddeler
Her bir film kaplı tablette, 154,3 mg laktoz anhidre eşdeğer laktoz monohidrat (inek sütünden elde edilir) bulunur.
Yardımcı maddeler için Bölüm 6.1.'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Yuvarlak, açık sarı renkte, bikonveks, eğimli kenarlı film tablettir. Bir yüzünde âS10â ve diğer yüzünde Boehringer Ingelheim logosu basılıdır (tablet çapı: 9,1 mm).
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Tip-2 diyabetes mellitus
JARDIANCE, erişkinlerde, yeterli kontrol sağlanamayan Tip-2 diyabetes mellitus tedavisinde, diyet ve egzersizle birlikte;
İntolerans nedeniyle metformin kullanımının uygun bulunmadığı durumlarda monoterapi olarak
4.2. Pozoloji ve uygulama şekli
Tip-2 diyabetes mellitus
Diyabet tedavisinde, monoterapi şeklinde veya diğer ilaçlarla kombinasyonu şeklinde ekleme
tedavisi olarak önerilen başlangıç dozu, günde bir kez 10 mg empagliflozindir. Günde bir kez empagliflozin 10 mg dozu tolere eden, eGFR değerleri ≥60 mL/dk/1,73 m olan ve daha sıkı bir glisemik kontrole ihtiyaç duyan hastalarda, doz, günde bir kez 25 mg'a yükseltilebilir. Maksimum günlük doz 25 mg'dır (Bkz. Aşağıdaki bilgiler ve Bölüm 4.4).
Kalp yetersizliği
Önerilen doz günde bir kez 10 mg empagliflozindir.
Tüm endikasyonlar
Empagliflozin, bir sülfonilüre veya insülinle kombine şekilde kullanıldığında, hipoglisemi riskini azaltmak için sülfonilüre veya insülin dozunun düşürülmesi düşünülebilir (Bkz. Bölüm 4.5 ve Bölüm 4.8).
Eğer bir doz unutulursa, hasta hatırlar hatırlamaz alınmalıdır, ancak aynı gün içinde iki doz alınmamalıdır.
Uygulama şekli:
Tabletler yiyeceklerle birlikte veya yiyeceklerden ayrı olarak alınabilir. Bütün olarak su ile yutulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Tip-2 diyabetes mellitus hastalarında, empagliflozinin glisemik etkililiği renal fonksiyonlara bağlıdır. Standart tedaviye ek olarak kardiyovasküler riskin azaltılması için, eGFR 60 mL/dk/1,73 m'nin altında olan hastalarda günde bir kez 10 mg empagliflozin dozu kullanılmalıdır (Bkz. Tablo 1). Empagliflozinin glisemik düşürücü etkililiği, orta derecede böbrek yetmezliği olan hastalarda azaldığından ve ciddi böbrek yetmezliği olan hastalarda muhtemelen bulunmadığından, daha fazla glisemik kontrol gerekiyorsa, diğer anti- hiperglisemik ajanların eklenmesi düşünülmelidir. eGFR ve CrCl'ye göre doz ayarlama önerileri için Tablo 1'e bakınız.
Tablo 1: Doz ayarlama önerileri
Endikasyon | eGFR [mL/dakika/1,73 m²] veya CrCL [mL/dakika] | Toplam günlük doz |
Tip-2 diyabetes mellitus | ≥60 | 10 mg empagliflozin ile başlanır.
10 mg empagliflozini tolere eden ve ek glisemik kontrol gerektiren hastalarda, doz 25 mg empagliflozine artırılabilir. |
45 ila <60 | 10 mg empagliflozin ile başlanır Hali hazırda JARDIANCE kullanmakta olan hastalarda 10 mg empagliflozin ile devam edilir. |
| 30 ila <45 | 10 mg empagliflozin ile başlanır.
Halihazırda JARDIANCE kullanmakta olan hastalarda 10 mg empagliflozin ile devam edilir. |
| <30 | Empagliflozin önerilmemektedir. |
Kalp yetersizliği (Tip-2 diyabetes mellitus ile birlikte veya tek başına) | ≥20 | Önerilen günlük doz, 10 mg empagliflozindir. |
<20 | Empagliflozin önerilmez. |
Tip 2 diyabetes mellitusu olan veya olmayan hastalarda kalp yetersizliği tedavisi için, empagliflozin 10 mg başlatılabilir veya 20 mL/dk/1,73 m eGFR veya 20 mL/dk CrCl değerlerine kadar tedavi devam ettirilebilir.
Empagliflozin, son dönem böbrek hastalarında (ESRD) veya diyalizdeki hastalarda kullanılmamalıdır. Bu hastalarda kullanımı destekleyecek yeterli veri bulunmamaktadır (Bkz. Bölüm 4.4, 5.1 ve 5.2).
Karaciğer yetmezliği:
Hepatik yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli hepatik yetmezliği olan hastalarda empagliflozin maruziyeti artar. Şiddetli karaciğer yetmezliği olan hastalarda terapötik deneyim sınırlıdır, bu nedenle bu hastalarda kullanımı önerilmez (Bkz. Bölüm 5.2).
Pediyatrik popülasyon:
Empagliflozinin çocuklarda ve ergenlerde etkililiği ve güvenliliği belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon:
Yaş nedeniyle herhangi bir doz ayarlaması gerekli değildir. 75 yaş ve üzerindeki hastalarda hacim deplesyonu riskinin arttığı dikkate alınmalıdır (Bkz. Bölüm 4.4 ve 4.8).
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Ketoasidoz
Empagliflozin dahil, SGLT-2 inhibitörleri ile tedavi edilen diyabet hastalarında, hayati tehlike oluşturan ve fatal vakaları da içeren ketoasidoz vakaları seyrek olarak bildirilmiştir. Bazı hastalarda ketoasidoz, kan glikoz değerlerinde sadece orta düzeyde (14 mmol/L'nin (250 mg/dL) altında) bir yükselme şeklinde ortaya çıkan atipik bir tablo şeklinde görülmüştür. Ketoasidoz vakalarının ortaya çıkma olasılığının, daha yüksek empagliflozinin dozlarıyla artıp artmadığı bilinmemektedir.
Bulantı, kusma, anoreksi, abdominal ağrı, aşırı susama, nefes almakta güçlük, konfüzyon, olağandışı yorgunluk veya uyku hali gibi spesifik olmayan semptomların görülmesi halinde, ketoasidoz riski düşünülmelidir. Bu semptomlar ortaya çıkarsa, hasta, kan şekeri düzeyi ne olursa olsun, derhal ketoasidoz açısından değerlendirilmelidir.
Ketoasidoz şüphesi bulunan veya ketoasidoz tanısı konan hastalarda, empagliflozin tedavisi derhal sonlandırılmalıdır.
Majör cerrahi işlemler veya akut ciddi hastalıklar nedeniyle hastaneye yatırılmış hastalarda tedaviye ara verilmelidir. Bu hastalarda ketonların izlenmesi önerilmektedir. Kan keton düzeylerinin ölçülmesi idrar ölçümlerine tercih edilmelidir. Keton düzeyleri normale döndükten ve hastanın durumu stabilize edildikten sonra empagliflozin tedavisi yeniden başlatılabilir.
Empagliflozin tedavisine başlamadan önce, hastanın geçmişindeki ketoasidoza yatkınlık yaratan faktörler dikkate alınmalıdır.
Ketoasidoz riski daha yüksek olan hastalar arasında, beta hücre fonksiyonu rezervi düşük olan hastalar (Örneğin, C-peptid düzeyi düşük tip-2 diyabet hastaları veya erişkinlerde latent otoimmün diyabeti olanlar veya pankreatit öyküsü olan hastalar), besin alımının kısıtlanmasına veya şiddetli dehidratasyona neden olan durumlara sahip hastalar, insülin dozları azaltılmış hastalar ve akut hastalık, cerrahi veya alkol bağımlılığına bağlı olarak insülin gereksinimleri artmış hastalar bulunur. Bu hastalarda, SGLT-2 inhibitörleri dikkatli bir şekilde kullanılmalıdır.
Daha önce SGLT-2 inhibitör tedavisi uygulanırken ketoasidoz görülen hastalarda, başka bir tetikleyici faktör net olarak tanımlanıp çözümlenmedikçe, SGLT-2 inhibitör tedavisine yeniden başlanması önerilmez.
JARDIANCE, Tip 1 diyabet hastalarında kullanılmamalıdır. Klinik çalışmalardan elde edilen veriler, insülin tedavisine ek olarak 10 mg ve 25 mg empagliflozin ile tedavi edilen Tip I diyabet hastalarında, plaseboya göre DKA'nın ortaya çıkma sıklığının arttığını göstermiştir.
Renal yetmezlik
Tip 2 diabetes mellitus endikasyonu için, eGFR<60 mL/dk/1,73 m veya CrCl<60 mL/dk olan hastalarda günlük empagliflozin dozu 10 mg ile sınırlıdır (bkz. Bölüm 4.2). eGFR<30 mL/dk/1,73 m veya CrCl<30 mL/dk olduğunda empagliflozin önerilmemektedir.
Kalp yetersizliği endikasyonu için, eGFR<20 mL/dak/1,73 m değerleri olan hastalarda JARDIANCE önerilmemektedir.
Empagliflozin, son dönem böbrek yetmezliği hastalarında veya diyalizdeki hastalarda kullanılmamalıdır. Bu hastalarda kullanımı destekleyecek yeterli veri bulunmamaktadır (Bkz. Bölüm 4.2, 5.1 ve 5.2).
Renal fonksiyonların izlenmesi
Renal fonksiyonların aşağıdaki şekilde değerlendirilmesi önerilir:
Empagliflozin tedavisine başlamadan önce ve tedavi sırasında periyodik olarak, yani en az yılda bir kez (Bkz. Bölüm 4.2, 4.8, 5.1 ve 5.2).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakodinamik etkileşimler:
Diüretikler:
Empagliflozin, tiyazid ve loop diüretiklerin diüretik etkisine ek etki yapabilir ve dehidratasyon ve hipotansiyon riskini arttırabilir (Bkz. Bölüm 4.4).
İnsülin ve insülin salgılatıcılar:
İnsülin ve sülfonilüreler gibi insülin salgılatıcılar hipoglisemi riskini arttırabilir. Bu nedenle, hipoglisemi riskini azaltmak için, empagliflozin ile kombine olarak kullanıldığında insülin veya insülin salgılatıcıların daha düşük dozda kullanılması gerekebilir (Bkz. Bölüm 4.2, Bölüm 4.8).
Farmakokinetik etkileşimler:
Diğer ilaçların empagliflozin üzerindeki etkileri:
In vitro veriler, insanlarda empagliflozinin primer metabolizma yolunun, üridin 5´- difosfoglukuronoziltransferazlar olan UGT1A3, UGT1A8, UGT1A9 ve UGT2B7 aracılığı ile glukuronidasyon olduğunu düşündürmektedir. Empagliflozin bir insan uptake taşıyıcısı olan OAT3, OATP1B1 ve OATP1B3 substratıdır, ancak OAT1 ve OCT2'nin substratı değildir. Empagliflozin, P-glikoprotein (P-gp) ve meme kanseri direnç proteininin (BCRP) bir
substratıdır.
Empagliflozinin, UGT enzimleri ve OAT3'ün bir inhibitörü olan probenesid ile eş zamanlı uygulanması, empagliflozinin pik plazma konsantrasyonlarında (C) %26 oranında artışla ve konsantrasyon zaman eğrisi altında kalan alanda (EAA) %53 oranında yükselmeyle sonuçlanmıştır. Bu değişiklikler, klinik olarak anlamlı kabul edilmemiştir.
UGT indüksiyonunun (örneğin rifampisin veya fenitoin ile indüksiyon) empagliflozin üzerindeki etkisi çalışılmamıştır. Etkililikte muhtemel bir azalma riski nedeniyle, UGT enzimlerinin bilinen indükleyicileriyle eş zamanlı uygulanması önerilmez. Bu UGT enzimlerinin bir indükleyicisinin birlikte uygulanması gerekiyorsa, JARDIANCE'a yanıtı değerlendirmek için glisemik kontrolün izlenmesi uygundur.
Gemfibrozil (OAT3 ve OATP1B1/B3 taşıyıcılarının bir in vitro inhibitörü) ile yapılan bir etkileşim çalışması, eş zamanlı kullanımı takiben, empagliflozin Cdeğerinin %15 ve EAA değerinin %59 oranında arttığını göstermiştir. Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir.
Eş zamanlı rifampisin uygulanması ile OATP1B1/1B3 taşıyıcılarının inhibe edilmesi, empagliflozinin Cdeğerinde %75 ve EAA değerinde %35 oranında artışla sonuçlanmıştır. Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir.
Bir P-gp inhibitörü olan verapamil ile birlikte veya verapamil olmaksızın uygulanması halinde, empagliflozin maruziyeti benzerdir. Bu durum, P-gp inhibisyonunun empagliflozin üzerinde klinik olarak anlamlı bir etkisinin olmadığını göstermiştir.
Etkileşim çalışmaları, metformin, glimepirid, pioglitazon, sitagliptin, linagliptin, varfarin, verapamil, ramipril, simvastatin, torasemid ve hidroklorotiyazid ile eş zamanlı kullanımlarının, empagliflozinin farmakokinetiği üzerinde bir etkisinin olmadığını düşündürmektedir.
Empagliflozinin diğer ilaçlar üzerindeki etkileri:
Empagliflozin renal lityum atılımını artırabilir ve kan lityum seviyeleri düşebilir. Serum lityum konsantrasyonu, empagliflozin başlangıcından ve doz değişikliklerinden sonra daha sık izlenmelidir. Lityum serum konsantrasyonunu izlemek için lütfen hastayı lityum reçete eden doktora sevk ediniz.
In-vitro çalışmalara dayanarak, empagliflozin, CYP450 izoformlarını inhibe etmez, inaktive etmez veya indüklemez. Empagliflozin UGT1A1, UGT1A3, UGT1A8, UGT1A9 veya UGT2B7'yi inhibe etmez. Bu nedenle, majör CYP450 veya UGT izoformlarının empagliflozin ile ve bu enzimlerin substratları ile eş zamanlı uygulanması sonucunda ilaçâilaç etkileşmesi beklenmez.
Empagliflozin terapötik dozlarda P-gp'yi inhibe etmez. In-vitro çalışmalara dayanarak, empagliflozinin P-gp substratları ile etkileşmesi beklenmez. Bir P-gp substratı olan digoksinin empagliflozin ile eş zamanlı kullanılması, digoksinin Cdeğerinde %14 ve EAA değerinde
%6 oranında artışa yol açmıştır. Bu değişikliklerin klinik olarak anlamlı olmadığı düşünülmüştür.
Empagliflozin, in vitro koşullarda, klinik olarak anlamlı plazma konsantrasyonlarında, OAT3, OATP1B1 ve OATP1B3 gibi insan uptake taşıyıcılarını inhibe etmez ve bu uptake
taşıyıcılarının substratları ile ilaç-ilaç etkileşmesi beklenmez.
Sağlıklı gönüllülerde yürütülen etkileşim çalışmaları, empagliflozinin, metformin, glimepirid, pioglitazon, sitagliptin, linagliptin, simvastatin, varfarin, ramipril, digoksin, diüretikler ve oral kontraseptiflerin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığını düşündürmektedir.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyona ilişkin bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Veri mevcut değildir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon) JARDIANCE tedavisi sırasında uygun bir doğum kontrol yöntemi kullanılabilir. Bölüm 4.5'te açıklandığı gibi empagliflozinin, oral kontraseptiflerin farmakokinetiği üzerinde anlamlı bir klinik etkisi olmadığı düşünülmektedir.
Gebelik dönemi
JARDIANCE'ın gebe kadınlarda kullanımına ilişkin yeterli veri yoktur. Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya
/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir.
Hayvan çalışmaları empagliflozinin geç gestasyon döneminde çok sınırlı bir oranda plasentaya geçtiğini göstermektedir. Ancak bu çalışmalar, erken embriyonik gelişim dönemi açısından direkt veya indirekt zararlı bir etkiyi işaret etmemektedir. Bununla birlikte, hayvan çalışmaları, postnatal gelişim üzerinde advers etkiler göstermiştir (Bkz. Bölüm 5.3). Bir önlem olarak, gebelik döneminde JARDIANCE kullanımından kaçınılmalıdır.
İnsanlara yönelik potansiyel risk bilinmemektedir. JARDIANCE gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
İnsanlarda empagliflozinin süte geçişi ile ilgili bir veri bulunmamaktadır. Hayvan çalışmalarından elde edilen mevcut toksikolojik veriler, empagliflozinin süte geçtiğini göstermiştir. Yenidoğan/infant açısından bir risk göz ardı edilemez. JARDIANCE emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/ Fertilite
JARDIANCE için insan fertilitesi ile ilgili bir çalışma yürütülmemiştir. Hayvan çalışmaları, fertilite ile ilgili direkt veya indirekt zararlı bir etki göstermemiştir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
JARDIANCE'ın araç ve makine kullanımı üzerindeki etkisi düşüktür. Hastalar, araç ve makine kullanımı sırasında, özellikle JARDIANCE'ı bir sülfonilüre ve/veya insülin ile kombine olarak
alıyorlarsa, ortaya çıkabilecek hipoglisemiden kaçınmak için gerekli önlemleri almaları konusunda uyarılmalıdırlar.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Tip-2 diyabetes mellitus
Empagliflozinin güvenliliğini değerlendirmek üzere tip-2 diyabeti olan toplam 15.582 hasta klinik çalışmalara dahil edilmiştir. Bu hastalardan 10.004 kişi monoterapi olarak ya da metformin, bir sülfonilüre, pioglitazon, DPP-4 inhibitörleri veya insülin ile kombine şekilde empagliflozin almıştır.
18-24 hafta süreli, 3.534 hastanın dahil edildiği 6 plasebo kontrollü çalışmada, 1.183 hasta plasebo ile, 2.351 hasta ise empagliflozin ile tedavi edilmiştir. Empagliflozin ile tedavi edilen hastalardaki genel advers olay insidansı plasebo ile benzer bulunmuştur. En sık bildirilen advers reaksiyon, sülfonilüre veya insülin ile birlikte kullanıldığında, hipoglisemidir (âseçilmiş advers reaksiyonların açıklamasıâ bölümüne bakınız).
Kalp yetersizliği
EMPEROR çalışmalarına 10 mg empagliflozin veya plasebo ile tedavi edilen, düşük ejeksiyon fraksiyonlu (N=3.726) veya korunmuş ejeksiyon fraksiyonlu (N=5.985) kalp yetersizliği hastaları dahil edilmiştir. Hastaların yaklaşık yarısının tip 2 diyabet hastası olduğu saptanmıştır. EMPEROR-Reduced ve EMPEROR-Preserved çalışmalarının havuz analizinde en sık görülen advers reaksiyon hacim deplesyonu (empagliflozin 10 mg: %11,4, plasebo: %9,7) olmuştur.
Empagliflozinin genel güvenlilik profili genel olarak incelenen endikasyonlarda tutarlı olmuştur.
Advers reaksiyonların çizelgeli listesi
Plasebo kontrollü çalışmalarda empagliflozin alan hastalarda bildirilen ve sistem-organ sınıfına ve MedDRA tercih edilen terimlerine göre sınıflandırılan advers reaksiyonlar aşağıdaki tabloda sunulmuştur (Tablo 2).
Advers reaksiyonlar mutlak sıklık dikkate alınarak listelenmiştir. Sıklık dereceleri şu şekilde tanımlanır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila
<1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 2: Plasebo kontrollü çalışmalarda ve pazarlama sonrası deneyimde bildirilen advers reaksiyonların çizelgeli listesi (MedDRA)
Sistem organ sınıfı | Çok yaygın | Yaygın | Yaygın olmayan | Seyrek | Çok seyrek |
Enfeksiyonlar ve enfestasyonlar |
| Vajinal moniliazis, vulvovajinit, balanitis ve diğer genital enfeksiyonlar |
| Perineumda nekrotizan fasiit (Fournier gangreni)* |
|
| İdrar yolu enfeksiyonu (piyelonefrit ve ürosepsis dahil) |
| |||
Metabolizma ve beslenme hastalıkları | Hipoglisemi (sülfonilüre veya insülinle birlikte kullanıldığında) |
Susama hissi |
Diyabetik ketoasidoz* |
|
|
Vasküler hastalıklar | Hacim deplesyonu |
|
|
|
|
Gastrointestinal hastalıklar |
| Konstipasyon |
|
|
|
Deri ve deri altı doku hastalıkları |
| Pirürit (jeneralize) Döküntü | Ürtiker Anjiyoödem |
|
|
Böbrek ve idrar yolu hastalıkları |
| Ürinasyonda artış | Dizüri |
| Tübülointerstis yel nefrit |
Araştırmalar |
|
Serum lipidlerinde yükselme | Kan kreatinin düzeyinde yükselme/ Glomerüler filtrasyon hızında azalma |
|
|
|
| Hematokritte yükselme |
*Bölüm 4.4'e bakınız
Seçilmiş advers etkilerin açıklaması
Hipoglisemi
Hipoglisemi sıklığı, ilgili çalışmalardaki arka plan tedavisine bağlıdır ve empagliflozin ve plasebo için, monoterapi, metformine ekleme tedavisi, metformin ile birlikte veya birlikte olmayan pioglitazona ekleme tedavisi, linagliptin ve metformine ekleme tedavisi ve standart bakım tedavisine ekleme tedavisinde benzer bulunmuştur. Hipoglisemi sıklığı, daha önce ilaçla tedavi edilmemiş hastalarda, empagliflozinin metforminle kombinasyonu ile empagliflozin ve
metformin bileşenlerinden her birinin ayrı ayrı uygulanması karşılaştırıldığında da benzer bulunmuştur.
Metformin ve bir sülfonilüre tedavisine ekleme tedavisi (empagliflozin 10 mg: %16,1, empagliflozin 25 mg: %11,5, plasebo: %8,4), metformin ile birlikte veya birlikte olmayan ve bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %19,5, empagliflozin 25 mg: %28,4, plasebo: %20,6; 78 hafta süreli çalışma boyunca, empagliflozin 10 mg ve empagliflozin 25 mg: %36,1, plasebo: %35,3) ve metforminle birlikte veya birlikte olmayan MDI (çoklu doz enjeksiyon) insülin tedavisine ekleme tedavisi olarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %39,8, empagliflozin 25 mg: %41,3, plasebo: %37,2; 52 hafta süreli çalışma boyunca, empagliflozin
10 mg: %51,1, empagliflozin 25 mg: %57,7, plasebo: %58) sıklıklarda artış kaydedilmiştir.
EMPEROR kalp yetersizliği çalışmalarında, sülfonilüre ya da insüline ek olarak kullanıldığında benzer hipoglisemi sıklığı belirtilmiştir (empagliflozin 10 mg: %6,5, plasebo: %6,7).
Majör hipoglisemi (yardım gerektiren hipoglisemi)
Plasebo ile karşılaştırıldığında, monoterapi, metformin tedavisine ekleme tedavisi, metformin ve bir sülfonilüre tedavisine ekleme tedavisi ve metformin ile birlikte veya birlikte olmayan pioglitazon tedavisine ekleme tedavisi, linagliptin ve metfomin tedavisine ekleme tedavisi, standart bakım tedavisine ilave olarak ve daha önce ilaçla tedavi edilmemiş hastalarda, metformin ile empagliflozin kombinasyonu tedavisi, empagliflozin ve metformin bileşenlerinden her birinin ayrı ayrı uygulanmasıyla yapılan tedavi ile karşılaştırıldığında, majör hipoglisemide bir artış gözlenmemiştir. Metforminle birlikte olan veya birlikte olmayan ve bir sülfonilüre ile birlikte olan veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde, empagliflozin 10 mg: %0, empagliflozin 25 mg: %1,3, plasebo: %0; 78 hafta süreli çalışma
boyunca, empagliflozin 10 mg: %0, empagliflozin 25 mg: %1,3, plasebo: %0) ve metforminle birlikte veya birlikte olmayan MDI insüline ekleme tedavisi olarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %0,5, empagliflozin 25
mg: %0,5, plasebo: %0,5 ve 52 hafta süreli çalışma boyunca empagliflozin 10 mg: %1,6,
empagliflozin 25 mg: %0,5, plasebo: %1,6) sıklıkta artış kaydedilmiştir.
EMPEROR kalp yetersizliği çalışmalarında, diyabeti olan hastalar sülfonilüre veya insüline ek olarak empagliflozin ve plasebo (empagliflozin 10 mg: %2,2, plasebo: %1,9) ile tedavi edildiğinde benzer sıklıkta majör hipoglisemi gözlenmiştir.
Vajinal moniliazis, vulvovajinit, balanit ve diğer genital enfeksiyonlar
Vajinal moniliazis, vulvovajinit, balanit ve diğer genital enfeksiyonlar, empagliflozin (empagliflozin 10 mg: %4, empagliflozin 25 mg: %3,9) ile tedavi edilen hastalarda plaseboya (%1) göre daha sık bildirilmiştir. Bu enfeksiyonlar, plasebo ile karşılaştırıldığında, empagliflozin ile tedavi edilen kadınlarda daha sık bildirilmiştir. Sıklıktaki farklılıklar erkeklerde daha az belirgindir. Genital sistem enfeksiyonları hafif veya orta şiddettedir.
EMPEROR kalp yetersizliği çalışmalarında, plasebo uygulananlarla karşılaştırıldığında, empagliflozin tedavisi uygulananlarda bu enfeksiyonların sıklığı, diyabeti olmayan hastalara göre (empagliflozin 10 mg: %1,7, plasebo: %0,7) diyabeti olan hastalarda daha yüksektir (empagliflozin 10 mg: %2,3, plasebo: %0,8).
Ürinasyonda artış
Ürinasyonda artış (önceden tanımlanmış terimler olan pollaküri, poliüri ve noktüri dahil), plaseboya (%1,4) göre, empagliflozin (empagliflozin 10 mg: %3,5, empagliflozin 25 mg: %3,3) ile tedavi edilen hastalarda daha yüksek sıklıkta gözlenmiştir. Artmış ürinasyon genellikle hafif veya orta şiddettedir. Bildirilen noktüri sıklığı, empagliflozin ve plasebo için benzerdir (<%1).
EMPEROR kalp yetersizliği çalışmalarında, empagliflozin ve plasebo ile tedavi edilmiş hastalarda benzer sıklıklarda artmış idrara çıkma gözlenmiştir (empagliflozin 10 mg: %0,9, plasebo: %0,5).
İdrar yolu enfeksiyonu
Advers olay olarak bildirilen idrar yolu enfeksiyonunun genel sıklığı, empagliflozin 25 mg ve plasebo grubunda benzer (%7 ve %7,2) ve empagliflozin 10 mg grubunda daha yüksek bulunmuştur (%8,8). Plaseboya benzer şekilde, empagliflozin grubunda da idrar yolu enfeksiyonları, kronik veya tekrarlayan idrar yolu enfeksiyonu öyküsü bulunan hastalarda daha sık bildirilmiştir. İdrar yolu enfeksiyonlarının şiddeti (hafif, orta, şiddetli), empagliflozin ve plasebo grubundaki hastalarda benzer olmuştur. İdrar yolu enfeksiyonları kadınlarda, empagliflozin ile tedavi edilen grupta plaseboya göre daha sık bildirilirken, erkeklerde bir farklılık gözlenmemiştir.
Hacim deplesyonu
Hacim deplesyonunun (önceden tanımlanmış terimler olan kan basıncında (ambulatuvar) düşüş, sistolik kan basıncında düşüş, dehidratasyon, hipotansiyon, hipovolemi, ortostatik hipotansiyon ve senkop dahil) genel sıklığı, empagliflozin (empagliflozin 10 mg: %0,6, empagliflozin 25 mg: %0,4) ve plasebo (%0,3) ile tedavi edilen hastalar arasında benzer bulunmuştur. Hacim deplesyonu olaylarının sıklığı, empagliflozin 10mg (%2,3) veya 25 mg (%4,3) ile tedavi edilen 75 yaş ve üzerindeki hastalarda, plasebo (%2,1) ile tedavi edilenlere göre artmıştır.
Kan kreatinin düzeyinde yükselme/glomerüler filtrasyon hızında azalma
Kan kreatinin düzeyinde yükselme ve glomerüler filtrasyon hızında azalma olan hastaların genel sıklığı, empagliflozin ve plasebo ile tedavi edilen hastalar arasında benzer bulunmuştur (kan kreatininde yükselme: Empagliflozin 10 mg %0,6, empagliflozin 25 mg %0,1, plasebo
%0,5; glomerüler filtrasyon hızında azalma: Empagliflozin 10 mg %0,1, empagliflozin 25 mg
%0, plasebo %0,3).
Empagliflozin ile tedavi edilen hastalarda, kreatinin düzeyinde başlangıçtaki yükselmeler ve tahmin edilen glomerüler filtrasyon hızında başlangıçtaki azalmalar, tedavinin devamı sırasında genellikle geçici özellikte veya ilaç tedavisinin kesilmesinden sonra geri dönüşümlü olmuştur.
Bunlarla tutarlı olarak, EMPA-REG OUTCOME çalışmasında, empagliflozin ile tedavi edilen hastalarda başlangıçta eGFR düzeyinde bir düşüş (ortalama 3 mL/dk/1,73 m) yaşanmıştır. Sonrasında, devam eden tedavi sırasında eGFR korunmuştur. Tedavinin kesilmesinden sonra ortalama eGFR başlangıç düzeylerine dönmüştür, bu durum, bu böbrek fonksiyon değişikliklerinde akut hemodinamik değişikliklerin rol oynayabileceğini düşündürür.
Serum lipidlerinde artış
Plasebo karşısında empagliflozin 10 mg ve 25 mg için başlangıca göre ortalama yüzde artışlar sırasıyla şu şekildedir: total kolesterol, %3,5'e karşı %4,9 ve %5,7; HDL-kolesterol, %0,4'e karşı %3,3 ve %3,6; LDL-kolesterol, %7,5'e karşı %9,5 ve %10,0; trigliseritler, %10,5'e karşı
%9,2 ve %9,9.
Hematokrit artışı
Hematokritte başlangıca göre ortalama değişimler, plasebo için %0,1 karşısında empagliflozin 10 mg ve 25 mg için sırasıyla %3,4 ve %3,6 olmuştur. EMPA-REG OUTCOME çalışmasında, tedavi durdurulduktan sonra 30 günlük bir takip dönemini takiben hematokrit değerleri başlangıç değerlerine dönmüştür.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Semptomlar
Kontrollü klinik çalışmalarda, sağlıklı gönüllülerde empagliflozin 800 mg'a kadar tek doz uygulaması ve tip-2 diyabeti olan hastalarda günde 100 mg'a kadar çoklu doz uygulaması, herhangi bir toksisite göstermemiştir. Empagliflozin, idrarla glikoz atılımını arttırarak idrar hacminde artışa yol açmıştır. İdrar hacminde gözlenen artış, doza bağımlı değildir ve klinik olarak anlamlı bulunmamıştır. İnsanlarda 800 mg'ın üstündeki dozlarda bir deneyim yoktur.
Tedavi
Doz aşımı halinde, hastanın klinik durumuna uygun bir tedavi başlanmalıdır. Empagliflozinin hemodiyaliz ile uzaklaştırılması çalışılmamıştır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Sodyum-Glikoz Ko-Transporter 2 (SGLT2) İnhibitörleri ATC kodu: A10BK03
Etki mekanizması:
Empagliflozin, geri dönüşlü, oldukça potent (ICR1,3 nmol) ve selektif kompetetif bir sodyum- glikoz ko-transporter 2 (SGLT-2) inhibitörüdür. Empagliflozin, glikozun periferik dokulara taşınması için önemli olan diğer glikoz taşıyıcılarını inhibe etmez ve bağırsakta glikoz absorpsiyonundan sorumlu majör taşıyıcı olan SGLT-2 için SGLT-1'e göre 5000 kat daha seçicidir. SGLT-2 böbrekte oldukça fazla eksprese edilir, diğer dokulardaki ekspresyonu ise ya yoktur ya da çok düşüktür. Asıl taşıyıcı olarak, glikozun glomerüler filtrattan, dolaşıma geri emiliminden sorumludur. Tip-2 diyabeti ve hiperglisemisi olan hastalarda daha yüksek miktarda glikoz filtre edilir ve geri emilir.
Empagliflozin, tip 2 diyabet hastalarında renal glikoz geri emilimini azaltarak glisemik kontrolü
iyileştirir. Böbreklerden bu glikuretik mekanizma aracılığı ile uzaklaştırılan glikoz miktarı, kan glikoz konsantrasyonuna ve GFR'ye bağımlıdır. Tip-2 diyabeti ve hiperglisemisi olan hastalarda SGLT-2 inhibisyonu, idrarda aşırı glikoz atılımına yol açar. Ayrıca, empagliflozin kullanımına başlanması, sodyum atılımını arttırır ve bu durum da osmotik diürez ve intravasküler hacmin azalması ile sonuçlanır.
Tip-2 diyabeti olan hastalarda, empagliflozinin ilk dozundan hemen sonra idrarda glikoz atılımı artar ve 24 saat süreli doz aralığı boyunca devam eder. 4 haftalık tedavi döneminin sonunda, idrarda glikoz atılımda artış sağlanmıştır ve bu miktar, ortalama yaklaşık 78 g/gün olmuştur. Tip-2 diyabetli hastalarda idrarda glikoz atılımının artması, plazma glikoz düzeylerinin ani düşüşü ile sonuçlanmıştır.
Empagliflozin hem açlık hem de tokluk plazma glikoz düzeylerini iyileştirir. Empagliflozinin etki mekanizması beta hücrelerinin fonksiyonundan ve insülin yolağından bağımsızdır ve bu durum hipoglisemi riskinin düşük olmasına katkıda bulunur. Homeostaz Model Değerlendirmesi-β (HOMA- β) dahil, beta hücre fonskiyonunun yerini tutan göstergelerde de iyileşme kaydedilmiştir. Ayrıca, idrar glikoz atılımı, vücut yağ kaybı ve vücut ağırlığının azalması ile bağlantılı olarak kalori kaybını tetikler. Empagliflozin ile gözlenen glikozüri, diürez ile seyreder, bu da kan basıncının sürekli bir şekilde orta derecede düşüşüne katkıda bulunabilir.
Empagliflozin ayrıca sodyum geri emilimini azaltır ve distal tübüle ulaşan sodyum miktarını artırır. Bu durum, tübüloglomerüler geri beslemesinin artırılması ve intraglomerüler basıncın azaltılması, kalbin hem ön hem de ard yükünün düşürülmesi ve sempatik aktivitenin azaltılması ve düşük NT-proBNP değerleri ve kardiyak yeniden modelleme, dolum basınçları ve diyastolik fonksiyon üzerindeki faydalı etkilerle kanıtlandığı üzere sol ventrikül duvar stresinin azaltılması dahil ancak bunlarla sınırlı olmamak üzere birkaç fizyolojik işlevi etkileyebilir.
Klinik etkililik ve güvenlilik
Tip-2 diyabetes mellitus
Glisemik kontrolün iyileşmesi ve kardiyovasküler morbidite ve mortalitenin azalması, Tip 2 diyabet tedavisinin ayrılmaz bir parçasıdır.
12 çift kör, plasebo ve aktif kontrollü klinik çalışmada, Tip 2 diyabeti olan toplam 14.663 hastada glisemik etkililik ve kardiyovasküler sonuçlar değerlendirilmiştir. Bu çalışmalarda
9.295 hasta empagliflozin kullanmıştır (empagliflozin 10 mg: 4.165 hasta, empagliflozin 25 mg: 5.130 hasta). 5 çalışmanın süresi 24 haftadır. Bu çalışmaların uzatmalarında ve diğer çalışmalarda hastalar, 102 haftaya kadar sürelerle empagliflozin kullanmıştır.
Empagliflozinin monoterapi ve metformin, pioglitazon, bir sülfonilüre, DPP-4 inhibitörleri ve insülin ile kombine olarak kullanılması, HbA1c, açlık plazma glikozu (APG), vücut ağırlığı, sistolik ve diyastolik kan basıncında klinik olarak anlamlı iyileşmelere yol açmıştır. Empagliflozin 25 mg grubunda, empagliflozin 10 mg ve plasebo gruplarına göre, %7'den daha düşük HbA1c düzeyi hedefine ulaşan hasta oranı daha yüksektir ve daha az sayıda hasta glisemik kurtarma tedavisine ihtiyaç duymuştur. Başlangıç HbA1c düzeyinin daha yüksek olması HbA1c düzeyinde daha fazla düşüş ile ilişkili bulunmuştur. Ayrıca, standart bakım tedavisine ilave olarak uygulanan empagliflozin, Tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olanlarda kardiyovasküler mortaliteyi azaltmıştır.
Monoterapi
Empagliflozinin monoterapi olarak etkililiği ve güvenliliği, daha önce tedavi edilmemiş hastalarda, çift kör, plasebo kontrollü ve aktif kontrollü 24 hafta süreli bir çalışmada değerlendirilmiştir. Empagliflozin ile tedavi, plasebo ile karşılaştırıldığında, HbA1c düzeyinde istatistiksel olarak anlamlı (p<0,0001) bir düşüşe (Tablo 3) ve APG değerlerinde klinik olarak önemli bir azalmaya yol açmıştır.
Başlangıç HbA1c değeri ≥%8,5 olan hastaların (N=201) önceden belirlenmiş bir analizinde, HbA1c düzeyinde başlangıca göre azalma oranı, empagliflozin 10 mg için %-1,44, 25 mg için
%-1,43, sitagliptin için %-1,04'dür ve plasebo grubunda %0,01 oranında artış olmuştur.
Bu çalışmanın çift kör, plasebo kontrollü uzatmasında, HbA1c değerinde azalma, kilo kaybı ve kan basıncında düşüş 76 haftaya kadar devam etmiştir.
Tablo 3: 24 hafta süreli plasebo kontrollü empagliflozin monoterapisi çalışmasının etkililik sonuçları
| Plasebo | JARDIANCE | Sitagliptin | |
10 mg | 25 mg | 100 mg | ||
N | 228 | 224 | 224 | 223 |
HbA1c (%) | ||||
Başlangıç (ortalama) | 7,91 | 7,87 | 7,86 | 7,85 |
Başlangıca göre değişiklik | 0,08 | -0,66 | -0.78 | -0,66 |
Plaseboya göre farklılık |
| -0,74* | -0,85* | -0,73 |
(-0,88, -0,59) | ||||
(%97,5 GA) | (-0,9, -0,57) | (-1,01, -0,69) | ||
N | 208 | 204 | 202 | 200 |
Başlangıç HbA1c değeri ≥%7 olan hastalardan, HbA1c değeri <%7 hedefine ulaşan hastaların yüzdesi |
12 |
35,3 |
43,6 |
37,5 |
N | 228 | 224 | 224 | 223 |
Vücut ağırlığı (kg) | ||||
Başlangıç (ortalama) | 78,23 | 78,35 | 77,8 | 79,31 |
Başlangıca göre değişiklik | -0,33 | -2,26 | -2,48 | 0,18 |
Plaseboya göre farklılık |
| -1,93* | -2,15* | 0,52 |
(-0,04, 1) | ||||
(%97,5 GA) | (-2,48, -1,38) | (-2,7,-1,6) | ||
| ||||
N | 228 | 224 | 224 | 223 |
SBP (mmHg) | ||||
Başlangıç (ortalama) | 130,4 | 133 | 129,9 | 132,5 |
Başlangıca göre değişiklik | -0,3 | -2,9 | -3,7 | 0,5 |
Plaseboya göre farklılık
(%97,5 GA) |
| -2,6* (-5,2, -0) | -3,4* (-6,-0,9) | 0,8 (-1,4, 3,1) |
GA: Güven Aralığı SBP: Sistolik Kan Basıncı
*p-değeri<0,0001
Kombinasyon tedavisi
Metformin, sülfonilüre, pioglitazon tedavisine ekleme tedavisi olarak empagliflozin Metformin ve bir sülfonilüre veya metformin ile birlikte olan veya birlikte olmayan pioglitazon tedavisine ekleme tedavisi olarak empagliflozin kullanılması, HbA1c düzeylerinde ve vücut ağırlığında, plaseboya göre, istatistiksel olarak anlamlı (p<0,0001) azalmalarla sonuçlanmıştır (Tablo 4). Ayrıca, APG değerlerinde, sistolik ve diyastolik kan basıncında da, plaseboya göre, klinik olarak anlamlı azalmalar görülmüştür.
Bu çalışmaların çift kör, plasebo kontrollü uzatmalarında, HbA1c, vücut ağırlığı ve kan basıncındaki azalmalar 76. haftaya kadar devam etmiştir.
Tablo 4: 24 hafta süreli plasebo kontrollü çalışmaların etkililik sonuçları
Metformin tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 207 | 217 | 213 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,94 | 7,86 |
Başlangıca göre değişiklik | -0,13 | -0,7 | -0,77 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,57* (-0,72, -0,42) | -0,64* (-0,79, -0,48) |
N | 184 | 199 | 191 |
Başlangıç HbA1c değeri ≥%7 olan hastalarda, HbA1c değeri <%7 hedefine ulaşan hastaların yüzdesi |
12,5 |
37,7 |
38,7 |
N | 207 | 217 | 213 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 79,73 | 81,59 | 82,21 |
Başlangıca göre değişiklik | -0,45 | -2,08 | -2,46 |
Plaseboya göre farklılık (%97,5 GA) |
| -1,63* (-2,17, -1,08) |
-2,.01*(-2,56, -1,46) |
N | 207 | 217 | 213 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 128,6 | 129,6 | 130 |
Başlangıca göre değişiklik | -0,4 | -4,5 | -5,2 |
Plaseboya göre farklılık (%95 GA) |
| -4,1* (-6,2, -2,1) |
-4,.8* (-6,9, -2,7) |
Metformin ve bir sülfonilüre tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 225 | 225 | 216 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,15 | 8,07 | 8,1 |
Başlangıca göre değişiklik | -0,17 | -0,82 | -0,77 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,64* (-0,79, -0,49) | -0,59* (-0,74, -0,44) |
N | 216 | 209 | 202 |
Başlangıç HbA1c değeri ≥%7 olan hastalarda, HbA1c değeri <%7 hedefine ulaşan hastaların yüzdesi |
9,3 |
26,3 |
32,2 |
N | 225 | 225 | 216 |
Vücut ağırlığı(kg) | |||
Başlangıç (ortalama) | 76,23 | 77,08 | 77,5 |
Başlangıca göre değişiklik | -0,39 | -2,16 | -2,39 |
Plaseboya göre farklılık (%97,5 GA) |
| -1,76* (-2,25, -1,28) | -1,99* (-2,48, -1,5) |
N | 225 | 225 | 216 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 128,8 | 128,7 | 129,3 |
Başlangıca göre değişiklik | -1,4 | -4,1 | -3,5 |
Plaseboya göre farklılık (%95 GA) |
| -2,7 (-4,6, -0,8) | -2,1 (-4, -0,2) |
Pioglitazon +/- metformin tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 165 | 165 | 168 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,16 | 8,07 | 8,06 |
Başlangıca göre değişiklik | -0,11 | -0,59 | -0,72 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,48* (-0,69, -0,27) | -0,61* (-0,82, -0,4) |
N | 155 | 151 | 160 |
Başlangıç HbA1c değeri ≥%7 olan hastalarda, HbA1c değeri <%7 hedefine ulaşan hastaların yüzdesi |
7,7 |
24 |
30 |
N | 165 | 165 | 168 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 78,1 | 77,97 | 78,93 |
Başlangıca göre değişiklik | 0,34 | -1,62 | -1,47 |
Plaseboya göre farklılık (%97,5 GA) |
| -1,95* (-2,64, -1,27) | -1,81* (-2,49, -1,13) |
N | 165 | 165 | 168 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 125,7 | 126,5 | 126 |
Başlangıca göre değişiklik | 0,7 | -3,1 | -4 |
Plaseboya göre farklılık (%95 GA) |
| -3,9 (-6,23, -1,5) | -4,7 (-7,08, -2,37) |
GA: Güven Aralığı
* p-değeri <0,0001
Daha önce ilaç tedavisi almamış hastalarda metformin ile kombinasyon
Daha önce ilaç tedavisi almamış hastalarda empagliflozinin etkililiğini ve güvenliliğini değerlendirmek için 24 hafta süreli faktöriyel tasarımlı bir çalışma yürütülmüştür. Metformin ile kombine empagliflozin tedavisi (günde iki kez verilen 5 mg ve 500 mg; 5 mg ve 1000 mg; 12,5 mg ve 500 mg, 12,5 mg ve 1000 mg), HbA1c değerlerinde istatistiksel olarak anlamlı iyileşmeler sağlamış (Tablo 5) ve APG değerleri (bileşenlerin her biri ile tek tek karşılaştırıldığında) ve vücut ağırlığında (metforminle karşılaştırıldığında) daha fazla azalmaya neden olmuştur.
Tablo 5: Metformin ve empagliflozin kombinasyonunu her bir bileşen ile karşılaştıran 24. haftadaki etkililik sonuçları
| Empagliflozin 10 mg | Empagliflozin 25 mg | Metformin | |||||
| + Met 1000 mg | + Met 2000 mg | Met yok | + Met 1000 mg | + Met 2000 mg | Met yok | 1000 mg | 2000 mg |
N | 161 | 167 | 169 | 165 | 169 | 163 | 167 | 162 |
HbA1c (%) | ||||||||
Başlangıç (ortalama) | 8,68 | 8,65 | 8,62 | 8,84 | 8,66 | 8,86 | 8,69 | 8,55 |
Başlangıca Göre değişiklik | -1,98 | -2,07 | -1,35 | -1,93 | -2,08 | -1,36 | -1,18 | -1,75 |
Karşılaştırmaya karşı empa (%95 GA) | -0,63* (-0,86, -0,4) | -0,72* (-0,96, -0,49) |
| -0,57* (-0,81, -0,34) | -0,72* (-0,95, -0,48) |
|
|
|
Karşılaştırmaya karşı met (%95 GA) | -0,79* (-1,03, -0,56) | -0,33* (-0,56, -0,09) |
| -0,75* (-0,98, -0,51) | -0,33* (-0,56, -0,1) |
|
|
|
Met = Metformin; empa = Empagliflozin
* HbA1c için p ≤0,0062
Metformin ve linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda empagliflozin Metformin ve 5 mg linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda, gerek empagliflozin 10 mg, gerekse empagliflozin 25 mg ile uygulanan tedavi, plaseboyla karşılaştırıldığında, HbA1c düzeylerinde ve vücut ağırlığında istatistiksel olarak anlamlı (p<0,0001) düşüşle sonuçlanmıştır (Tablo 6). Ek olarak, APG, sistolik ve diyastolik kan basıncında da, plaseboya göre klinik olarak anlamlı düşüş sağlamıştır.
Tablo 6: Metformin ve linagliptin 5 mg tedavisi ile yeterli kontrol sağlanamayan hastalarda 24 hafta süreli plasebo kontrollü bir çalışmanın etkililik sonuçları
Metformin ve linagliptin 5 mg tedavisine ekleme tedavisi | |||
| Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 106 | 109 | 110 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,96 | 7,97 | 7,97 |
Başlangıca göre değişiklik | 0,14 | -0,65 | -0,56 |
Plaseboya göre farklılık (%95 GA) |
| -0,79* (-1,02, -0,55) | -0,7* (-0,93, -0,46) |
N | 100 | 100 | 107 |
Başlangıç HbA1c değeri ≥%7 olan hastalardan, HbA1c değeri <%7 hedefine ulaşan hastaların yüzdesi |
17 |
37 |
32,7 |
N | 106 | 109 | 110 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 82,3 | 88,4 | 84,4 |
Başlangıca göre değişiklik | -0,3 | -3,1 | -2,5 |
Plaseboya göre farklılık (%95 GA) |
| -2,8* (-3,5, -2,1) | -2,2* (-2,9,-1,5) |
N | 106 | 109 | 110 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 130,1 | 130,4 | 131 |
Başlangıca göre değişiklik | -1,7 | -3 | -4,3 |
Plaseboya göre farklılık (%95 GA) |
| -1,3 (-4,2, 1,7) | -2,6 (-5,5, 0,4) |
*p değeri <0,0001
Başlangıç HbA1c değeri %8,5 veya daha yüksek olan önceden belirlenmiş bir hasta alt grubunda, HbA1c değerinde 24. haftada başlangıca göre düşüş oranı, plaseboya göre, empagliflozin 10 mg ve empagliflozin 25 mg ile -%1,3 olmuştur (p<0,0001).
Metformine ekleme tedavisi olarak empagliflozin için 24 aylık veri - Glimepirid ile
karşılaştırma
Tek başına metformin ile yeterli glisemik kontrolün sağlanamadığı hastalarda, empagliflozin
25 mg'ın etkililik ve güvenliliğini glimepirid (günde 4 mg'a kadar) ile karşılaştıran bir çalışmada, günlük empagliflozin tedavisi, glimeprid ile karşılaştırıldığında, HbA1c değerinde daha üstün bir azalma (Tablo 7) ve APG değerinde klinik olarak anlamlı bir azalma ile sonuçlanmıştır. Günlük empagliflozin tedavisi, glimepirid ile karşılaştırıldığında, vücut ağırlığında, sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir azalma sağlamış ve istatistiksel olarak anlamlı oranda daha az hastada hipoglisemik olaylar ortaya çıkmıştır (empagliflozin için %2,5, glimepirid için %24,2, p<0,0001).
Tablo 7: Metformine ekleme tedavisi olarak empagliflozin ile glimepiridi karşılaştıran bir aktif kontrollü çalışmanın 104. haftada etkililik sonuçları
| Empagliflozin 25 mg | Glimepirid |
N | 765 | 780 |
HbA1c (%) | ||
Başlangıç (ortalama) | 7,92 | 7,92 |
Başlangıca göre değişiklik | -0,66 | -0,55 |
Glimepiride göre farklılık1 (%97,5 GA) | -0,11* (-0,2, -0,01) |
|
N | 690 | 715 |
Başlangıç HbA1c ≥%7 olan hastalardan, HbA1c <%7 hedefine ulaşan hastaların yüzdesi | 33,6 | 30,9 |
N | 765 | 780 |
Vücut ağırlığı(kg) | ||
Başlangıç (ortalama) | 82,52 | 83,03 |
Başlangıca göre değişiklik | -3,12 | 1,34 |
Glimepiride göre farklılık (%97,5 GA) | -4,46** (-4,87, -4,05) |
|
N | 765 | 780 |
SBP (mmHg) | ||
Başlangıç (ortalama) | 133,4 | 133,5 |
Başlangıca göre değişiklik | -3,1 | 2,5 |
Glimepiride göre farklılık (%97,5 GA) | -5,6** (-7,-4,2) |
|
GA: Güven Aralığı
* Daha aşağı olmadığını (non-inferiority) kanıtlamak için p-değeri<0,0001 ve üstünlük için p-değeri= 0,0153
** p-değeri<0,0001
İnsüline ekleme tedavisi
Çoklu günlük dozda insülin tedavisine ekleme tedavisi olarak empagliflozin
Metformin tedavisi ile birlikte olan veya olmayan çoklu günlük dozdaki insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozinin etkililiği ve güvenliliği, çift kör, plasebo kontrollü, 52 hafta süreli bir çalışmada değerlendirilmiştir. İlk 18 hafta ve son 12 hafta boyunca, insülin dozu sabit tutulmuş ancak 19-40. haftalar arasında açlık glikoz düzeyleri <100 mg/dL'ye [5,5 mmol/L] ve tokluk glikoz düzeyleri <140 mg/dL'ye [7,8 mmol/L] ulaşmak üzere ayarlanmıştır.
18. haftada empagliflozin, plaseboya göre, HbA1c düzeylerinde istatistiksel olarak anlamlı iyileşme sağlamıştır (Tablo 8).
52. haftada empagliflozin tedavisi, plaseboya göre, HbA1c düzeylerinde ve insülin kullanımında anlamlı bir azalma sağlamış ve APG değerinde düşüş ve kilo kaybı ile sonuçlanmıştır.
Tablo 8: Metformin ile birlikte veya birlikte olmayan çoklu günlük dozlardaki insüline ekleme tedavisi olarak kullanılan empagliflozin için yürütülen plasebo kontrollü bir çalışmada 18. ve
52. haftadaki etkililik sonuçları
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 188 | 186 | 189 |
18. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,33 | 8,39 | 8,29 |
Başlangıca göre değişiklik | -0,5 | -0,94 | -1,02 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,44* (-0,61, -0,27) | -0,52* (-0,69, -0,35) |
N | 115 | 119 | 118 |
52. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,25 | 8,4 | 8,37 |
Başlangıca göre değişiklik | -0,81 | -1,18 | -1,27 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,38*** (-0,62, -0,13) | -0,46* (-0,7, -0,22) |
N | 113 | 118 | 118 |
52. haftada başlangıç HbA1c ≥%7 olan hastalarda, HbA1c <%7 hedefine ulaşan hastaların yüzdesi |
26,5 |
39,8 |
45,8 |
N | 115 | 118 | 117 |
52. haftada insulin dozu (IU/gün) | |||
Başlangıç (ortalama) | 89,94 | 88,57 | 90,38 |
Başlangıca göre değişiklik | 10,16 | 1,33 | -1,06 |
Plaseboya göre farklılık (%97,5 GA) |
| -8,83 (-15,69, -1,97) | -11,22** (-18,09, -4,36) |
N | 115 | 119 | 118 |
52. haftada vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 96,34 | 96,47 | 95,37 |
Başlangıca göre değişiklik | 0,44 | -1,95 | -2,04 |
Plaseboya göre farklılık (%97,5 GA) |
| -2,39* (-3,54, -1,24) | -2,48* (-3,63, -1,33) |
GA: Güven Aralığı
* p-değeri <0,0001
** p-değeri= 0,0003
*** p-değeri= 0,0005
Bazal insülin tedavisine ekleme tedavisi olarak empagliflozin
Metformin ve/veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 78 hafta süreli bir çift kör, plasebo kontrollü çalışmada değerlendirilmiştir. İlk 18 haftada insülin dozu sabit tutulmuş, ancak sonraki 60 hafta süresince APG <110 mg/dL düzeylerini sağlamak üzere ayarlanmıştır.
18. haftada empagliflozin, HbA1c düzeylerini istatistiksel olarak anlamlı oranda iyileştirmiştir (Tablo 9).
78. haftada empagliflozin, plasebo ile karşılaştırıldığında, HbA1c değerinde ve insülin kullanımında istatistiksel olarak anlamlı bir azalma oluşturmuştur. Ayrıca empagliflozin, APG, vücut ağırlığı ve kan basıncında da düşüş sağlamıştır.
Tablo 9: Metformin veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozin için yürütülen bir plasebo kontrollü çalışmanın 18. ve 78. haftalardaki etkililik sonuçları
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 mg |
N | 125 | 132 | 117 |
18. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,1 | 8,26 | 8,34 |
Başlangıca göre değişiklik | -0,01 | -0,57 | -0,71 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,56* (-0,78, -0,33) | -0,7* (-0,93, -0,47) |
N | 112 | 127 | 110 |
78. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,09 | 8,27 | 8,29 |
Başlangıca göre değişiklik | -0,02 | -0,48 | -0,64 |
Plaseboya göre farklılık (%97,5 GA) |
| -0,46* (-0,73, -0,19) | -0,62* (-0,9, -0,34) |
N | 112 | 127 | 110 |
78. haftada bazal insülin dozu (IU/gün) |
|
|
|
Başlangıç (ortalama) | 47,84 | 45,13 | 48,43 |
Başlangıca göre değişiklik | 5,45 | -1,21 | -0,47 |
Plaseboya göre farklılık (%97,5 GA) |
| -6,66** (-11,56, -1,77) | -5,92** (-11, -0,85) |
GA: Güven Aralığı
* p-değeri <0,0001
** p-değeri <0,025
Renal yetmezliği olan hastalar, 52 hafta süreli plasebo kontrollü veriler
Renal yetmezliği olan hastalarda antidiyabetik tedaviye ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 52 hafta süreli, çift kör plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozin tedavisi, plasebo ile karşılaştırıldığında, 24. haftada, HbA1c düzeylerinde istatistiksel olarak anlamlı bir azalma (Tablo 10) ve APG değerlerinde klinik olarak anlamlı bir iyileşme ile sonuçlanmıştır. HbA1c, vücut ağırlığı ve kan basıncındaki iyileşmeler 52. haftaya kadar devam etmiştir.
Tablo 10: Renal bozukluğu olan tip-2 diyabet hastalarında plasebo kontrollü bir empagliflozin çalışmasında 24. hafta sonuçları
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 mg | Plasebo | Empagliflozin 25 mg |
eGFR ≥60 - <90 mL/dk/1,73 m² | eGFR ≥ 30 - <60 mL/dk/1,73 m² | ||||
N | 95 | 98 | 97 | 187 | 187 |
HbA1c (%) | |||||
Başlangıç (ortalama) | 8,09 | 8,02 | 7,96 | 8,04 | 8,03 |
Başlangıca göre değişiklik | 0,06 | -0,46 | -0,63 | 0,05 | -0,37 |
Plaseboya göre farklılık (%95 GA) |
| -0,52* (-0,72, -0,32) | -0,68* (-0,88, -0,49) |
| -0,42* (-0,56, -0,28) |
N | 89 | 94 | 91 | 178 | 175 |
Başlangıç HbA1c ≥%7 olan hastalarda, HbA1c <%7 hedefine ulaşan hastaların yüzdesi | 6,7 | 17 | 24,2 | 7,9 | 12 |
N | 95 | 98 | 97 | 187 | 187 |
Vücut ağırlığı (kg) | |||||
Başlangıç (ortalama) | 86 | 92,05 | 88,06 | 82,49 | 83,22 |
Başlangıca göre değişiklik | -0,33 | -1,76 | -2,33 | -0,08 | -0,98 |
Plaseboya göre farklılık (%95 GA) |
| -1,43 (-2,09, -0,77) | -2 (-2,66, -1,34) |
| -0,91 (-1,41, -0,41) |
N | 95 | 98 | 97 | 187 | 187 |
SBP (mmHg) | |||||
Başlangıç (ortalama) | 134,69 | 137,37 | 133,68 | 136,38 | 136,64 |
Başlangıca göre değişiklik | 0,65 | -2,92 | -4,47 | 0,4 | -3,88 |
Plaseboya göre farklılık |
| -3,57 | -5,12 |
| - 4,28 |
(%95 GA) |
| (-6,86, -0,29) | (-8,41, -1,82) |
| (-6,88, -1,68) |
GA: Güven Aralığı
* p <0,0001
Kardiyovasküler sonuçlar
Çift kör, plasebo kontrollü EMPA-REG OUTCOME çalışması, tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olan hastalarda, standart bakım tedavisine ek olarak uygulanan empagliflozin 10 mg ve empagliflozin 25 mg dozlarını alan hasta havuzu plasebo ile karşılaştırmıştır. Toplam 7.020 hasta tedavi edilmiş (empagliflozin 10 mg: 2.345, empagliflozin 25 mg: 2.342, plasebo: 2.333) ve medyan 3,1 yıl süreyle takip edilmiştir. Ortalama yaş 63, ortalama HbA1c %8,1'dir ve hastaların %71,5'i erkektir. Başlangıçta hastaların %74'ü metformin, %48'i insülin ve %43'ü bir sülfonilüre ile tedavi edilmiştir. Hastaların yaklaşık yarısının (%52,2) eGFR değeri 60-90 mL/dk/1,73 m, %17,8'nin 45-60 mL/dk/1,73 m ve
%7,7'sinin 30-45 mL/dk/1,73 m olarak tespit edilmiştir.
12. haftada HbA1c'de uyarlanmış ortalamadaki (SE) iyileşme, plasebo grubu için başlangıçtaki
%0,11 (0,02) değeri ile karşılaştırıldığında, empagliflozin 10 mg grubunda %0,65 (0,02) ve
empagliflozin 25 mg grubunda %0,71 (0,02) olarak gözlenmiştir. İlk 12 haftadan sonra glisemik kontrol, araştırmacı tedaviden bağımsız olarak optimize edilmiştir. Bu nedenle etki 94. haftada azaltılmış, HbA1c değerindeki uyarlanmış ortalama iyileşme, plasebo grubunda %0,08 (0,02), empagliflozin 10 mg grubunda %0,5 (0,02) ve empagliflozin 25 mg grubunda %0,55 (0,02) bulunmuştur.
Empagliflozin, primer kombine sonlanım noktası olan kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmenin önlenmesinde, plaseboya göre üstün bulunmuştur. Tedavi etkisi, kardiyovasküler ölümde anlamlı bir azalma ile sağlanmış, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede anlamlı bir değişiklik olmamıştır. Kardiyovasküler ölümdeki azalma, empagliflozin 10 mg ve empagliflozin 25 mg için karşılaştırılabilir bulunmuştur (Şekil 1) ve genel yaşam süresindeki iyileşme ile de doğrulanmıştır (Tablo 11). EMPA-REG OUTCOME çalışmasında empagliflozinin kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede bileşik primer sonlanım noktası üzerindeki etkisi, glisemik kontrolden veya renal fonksiyonundan (eGFR) büyük ölçüde bağımsız olmuştur ve genel olarak 30 mL/dakika/1,73m eGFR değerine kadar inen eGFR kategorileri arasında tutarlı olmuştur.
Kardiyovasküler mortaliteyi önlemedeki etkililiği, empagliflozin ile birlikte DPP-4 inhibitörü kullanan hastalarda veya siyah ırktan olanlarda tam olarak belirlenmemiştir, çünkü bu grupların EMPA-REG OUTCOME çalışmasındaki temsilleri sınırlıdır.
Tablo 11: Bileşik primer sonlanım noktası için tedavi etkisi, bileşenleri ve mortalite
| Plasebo | Empagliflozin |
N | 2.333 | 4.687 |
İlk KV ölüm, fatal olmayan MI veya fatal olmayan inme olayına kadar geçen süre N (%) | 282 (12,1) | 490 (10,5) |
Tehlike oranı, plaseboya karşı (%95,02 GA)* |
| 0,86 (0,74, 0,99) |
Üstünlük için p değeri |
| 0,0382 |
KV ölüm N (%) | 137 (5,9) | 172 (3,7) |
Tehlike oranı, plaseboya karşı (%95 GA) |
| 0,62 (0,49, 0,77) |
p değeri |
| <0,0001 |
Fatal olmayan MI N (%) | 121 (5,2) | 213 (4,5) |
Tehlike oranı, plaseboya karşı (%95 GA) |
| 0,87 (0,7, 1,09) |
p değeri |
| 0,2189 |
Fatal olmayan inme N (%) | 60 (2,6) | 150 (3,2) |
Tehlike oranı, plaseboya karşı (%95 GA) |
| 1,24 (0,92, 1,67) |
p değeri |
| 0,1638 |
Tüm nedenlere bağlı mortalite N (%) | 194 (8,3) | 269 (5,7) |
Tehlike oranı, plaseboya karşı (%95 GA) |
| 0,68 (0,57, 0,82) |
p değeri |
| <0,0001 |
KV olmayan mortalite N (%) | 57 (2,4) | 97 (2,1) |
Tehlike oranı, plaseboya karşı (%95 GA) |
| 0,84 (0,6, 1,16) |
KV: kardiyovasküler, MI: Miyokard enfarktüsü
* Çalışmadan elde edilen veriler bir ara analize dahil edildiğinden, anlamlılık için 0,0498'den düşük bir p değerine karşılık gelen bir iki yanlı %95,02 güven aralığı uygulanmıştır.
Şekil 1 - EMPA-REG OUTCOME çalışmasında kardiyovasküler ölüme kadar geçen zaman
Her bir empagliflozin dozuna karşılık plasebo
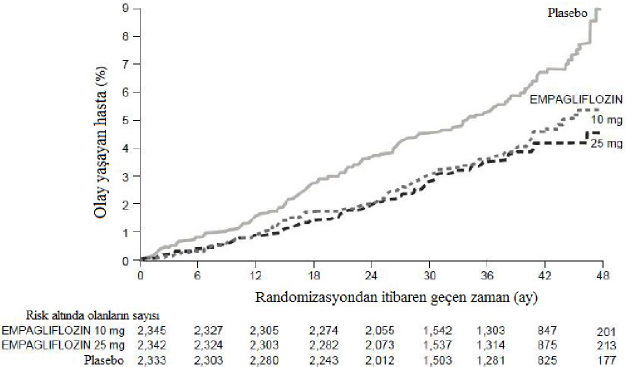
EMPAGLIFLOZIN 10 mg p=0,0016
HR (%95 GA)
0,55 (0,50, 0,85)
EMPAGLIFLOZIN 25 mg p=0,0001
HR (%95 GA)
0,59 (0,45, 0,77)
Hastaneye yatış gerektiren kalp yetersizliği
EMPA-REG OUTCOME çalışmasında, empagliflozin, plasebo ile karşılaştırıldığında, hastaneye yatış gerektiren kalp yetersizliği riskini düşürmüştür (empagliflozin %2,7, plasebo
%4,1; HR (Tehlike Oranı) 0,65, %95 GA = 0,5, 0,85).
Nefropati
EMPA-REG OUTCOME çalışmasında, ilk nefropati olayına kadar olan süre boyunca, empagliflozine (%12,7) kıyasla plasebo (18,8) için HR 0,61 (%95 GA 0,53, 0,7) olmuştur.
Ayrıca, empagliflozin (%49,7) plaseboya kıyasla (%28,8), başlangıçta makroalbuminürisi olan hastalarda, daha yüksek (HR 1,82, %95 GA 1,40, 2,37) sürekli normo- veya mikro-albüminüri oluşumu göstermiştir.
Açlık plazma glikozu
4 adet plasebo kontrollü çalışmada, empagliflozin monoterapisi veya metformin, pioglitazon veya metformin + bir sülfonilüre tedavisine ekleme tedavisi, APG değerinde başlangıca göre, plasebo (7,4 mg/dL [0,41 mmol/L]) ile karşılaştırıldığında, empagliflozin 10 mg için -20,5
mg/dL [-1,14 mmol/L], empagliflozin 25 mg için -23,2 mg/dL [-1,29 mmol/L] ortalama değişiklikle sonuçlanmıştır. Bu etki 24 haftadan sonra gözlenmiştir ve 76 hafta süresince devam etmiştir.
2 saatlik tokluk glikozu
Metformin veya metformin + bir sülfonilüre tedavisine ekleme olarak empagliflozin tedavisi,
24. haftada, 2 saatlik tokluk glikoz düzeylerinde (yemek tolerans testi) klinik olarak anlamlı bir düşüş sağlamıştır (metformine ekleme: plasebo +5,9 mg/dL, empagliflozin 10 mg: -46 mg/dL, empagliflozin 25 mg: -44,6 mg/dL, metformin + bir sülfonilüre tedavisine ekleme: plasebo -2,3 mg/dL, empagliflozin 10 mg: -35,7 mg/dL, empagliflozin 25 mg: -36,6 mg/dL).
Başlangıç HbA1c>%10 (yüksek) olan hastalar
3 Faz III çalışmasının önceden belirlenmiş havuz analizinde, şiddetli hiperglisemisi olan (N=184, ortalama başlangıç HbA1c %11,15) hastalarda, açık etiketli empagliflozin 25 mg tedavisi, 24. haftada, HbA1c değerinde, başlangıca göre %3,27 oranındaki klinik olarak anlamlı bir azalma ile sonuçlanmıştır. Bu çalışmalara plasebo veya empagliflozin 10 mg kolları dahil edilmemiştir.
Vücut ağırlığı
Plasebo-kontrollü dört çalışmanın önceden belirlenmiş havuzanalizinde, empagliflozin tedavisi, 24. haftada vücut ağırlığında azalma ile sonuçlanmış (plasebo için -0,24 kg, empagliflozin 10 mg için -2,04 kg ve empagliflozin 25 mg için -2,26 kg) ve 52. haftaya kadar (plasebo için -0,16 kg, empagliflozin 10 mg için -1,96 kg ve empagliflozin 25 mg için -2,25 kg) devam etmiştir.
Kan basıncı
Empagliflozinin etkililiği ve güvenliliği, çeşitli antidiyabetik tedavi alan ve en fazla 2 antihipertansif ilacı kullanan kan basıncı yüksek tip-2 diyabetli hastalarda 12 hafta süreyle yürütülen çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozinin günde bir kez uygulanması ile yapılan tedavi, HbA1c değerinde ve ambulatuvar kan basıncı izlenmesi ile tespit edilen 24 saatlik ortalama sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir iyileşme ile sonuçlanmıştır (Tablo 12). Empagliflozin tedavisi, otururken ölçülen SBP (Sistolik Kan Basıncı) ve DBP (Diyastolik Kan Basıncı)'de azalmalar sağlamıştır.
Tablo 12: Kan basıncı kontrol altında olmayan tip-2 diyabetli hastalarda, empagliflozinin plasebo kontrollü bir çalışmasında 12. haftadaki etkililik sonuçları
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 271 | 276 | 276 |
12. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,87 | 7,92 |
Başlangıca göre değişiklik | 0,03 | -0,59 | -0,62 |
Plaseboya göre farklılık (%95 GA) |
| -0,62* (-0,72, -0,52) | -0,65* (-0,75, -0,55) |
12. haftada 24 saatlik SBP | |||
Başlangıç (ortalama) | 131,72 | 131,34 | 131,18 |
Başlangıca göre değişiklik | 0,48 | -2,95 | -3,68 |
Plaseboya göre farklılık (%95 GA) |
| -3,44* (-4,78, -2,09) | -4,16* (-5,5, -2,83) |
12. haftada 24 saatlik DBP | |||
Başlangıç (ortalama) | 75,16 | 75,13 | 74,64 |
Başlangıca göre değişiklik | 0,32 | -1,04 | -1,4 |
Plaseboya göre farklılık (%95 GA) |
| -1,36** (-2,15, -0,56) | -1,72* (-2,51, -0,93) |
GA: Güven aralığı
* p-değeri <0,0001
** p-değer i<0,001
Plasebo kontrollü 4 çalışmanın önceden belirlenmiş havuz analizinde, empagliflozin tedavisi,
24. haftada, plasebo (-0,5 mmHg) ile karşılaştırıldığında, sistolik kan basıncında (empagliflozin 10 mg: -3,9 mmHg; empagliflozin 25 mg: -4,3 mmHg) ve diyastolik kan basıncında (plasebo:
-0,5 mmHg; empagliflozin 10 mg: -1,8 mmHg; empagliflozin 25 mg: -2 mmHg) azalma ile sonuçlanmış ve bu etki 52. haftaya kadar devam ettirilmiştir.
Kalp yetersizliği
Düşük ejeksiyon fraksiyonlu kalp yetersizliği hastalarında empagliflozin
![]()
Kalp yetersizliği bakım standardı tedavisine ek olarak günde bir kez 10 mg empagliflozinin etkililiğinin ve güvenliliğinin değerlendirilmesi amacıyla, kronik kalp yetersizliği (New York Kalp Derneği [NYHA] II-IV) ve düşük ejeksiyon fraksiyonlu (LVEF (Sol Venrikül Ejeksiyon Fraksiyonu) ≤%40) 3.730 hastada randomize, çift kör, plasebo kontrollü bir çalışma (EMPEROR-Reduced) yürütülmüştür. Primer sonlanım noktası, onaylanmış ilk kardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre olmuştur. Onaylanmış kalp yetersizliği nedeniyle hastanee yatışı (ilk ve rekürren) ve başlangıca göre eGFR(CKD-EPI)değişim eğimi, doğrulama testine dahil edilmiştir. Başlangıçta kalp yetersizliği tedavisi, ACE inhibitörlerini / anjiyotensin reseptör blokerlerini / anjiyotensin reseptör-neprilisin inhibitörünü (%88,3), beta blokerleri (%94,7), mineralokortikoid reseptör antagonistleri (%71,3) ve diüretikleri (%95) içermiştir.
Toplam 1.863 hasta 10 mg empagliflozine (plasebo: 1.867) randomize edilmiştir ve medyan 15,7 ay boyunca izlenmiştir. Çalışma popülasyonu, ortalama yaşı 66,8 yıl (aralık: 25-94 yıl) ile
%76,1 erkek hastalardan ve %23,9 kadın hastalardan oluşmuştur. Hastaların %26,8'i 75 yaş ve üzerinde olmuştur. Çalışma popülasyonunun %70,5'i Beyaz ırktan, %18'i Asyalı ve %6,9'u Siyah/Afrikalı Amerikalı olmuştur. Randomizasyonda hastaların %75,1'i NYHA sınıf II,
%24,4'ü sınıf III ve %0,5'i sınıf IV olarak kategorize edilmiştir. Ortalama LVEF %27,5 olmuştur. Başlangıçta, ortalama eGFR 62 mL/dk/1,73 m ve medyan üriner albümin / kreatinin oranı (UACR) 22 mg/g olmuştur. Hastaların yaklaşık yarısında (%51,7) eGFR ≥60 mL/dk/1,73 m değerleri, % 24,1'inde 45 - <60 mL/dk/1,73 m değerleri, %18,6'sında 30 - <45 mL/dk/1,73 m ve %5,3'ünde 20 - <30 mL/dk/1,73 m değerleri saptanmıştır.
Empagliflozin, plaseboya kıyasla kardiyovasküler ölüm veya kalp yetersizliği nedeniyle hastaneye yatıştan oluşan bileşik primer sonlanım noktasında risk azaltmada üstün olmuştur. Ek olarak, empagliflozin, kalp yetersizliği nedeniyle hastaneye yatış (ilk ve rekürren)riskini anlamlı ölçüde azaltmıştır ve eGFR düşüş oranını anlamlı ölçüde yavaşlatmıştır(Tablo 13; Şekil 2 ve 3).
Tablo 13: Bileşik primer sonlanım noktası, bileşenleri ve önceden belirlenmiş doğrulama testine dahil edilen iki önemli ikincil sonlanım noktası için tedavi etkisi
| Plasebo | Empagliflozin 10 mg |
N | 1.867 | 1.863 |
İlk KV ölüm veya HHF olayına kadar geçen süre, N (%) | 462 (24,7) | 361 (19,4) |
Plaseboya kıyasla tehlike oranı (%95,04 GA)* |
| 0,75 (0,65, 0,86) |
Üstünlük için pâdeğeri |
| <0,0001 |
KV Ölüm, N (%) | 202 (10,8) | 187 (10) |
Plaseboya kıyasla tehlike oranı (%95 GA) |
| 0,92 (0,75, 1,12) |
HHF (ilk olay), N (%)* | 342 (18,3) | 246 (13,2) |
Plaseboya kıyasla tehlike oranı (%95 GA) |
| 0,69 (0,59, 0,81) |
HHF (ilk ve rekürren), olayların N'si | 553 | 388 |
Plaseboya kıyasla tehlike oranı (%95,04 GA)* |
| 0,70 (0,58, 0,85) |
pâdeğeri |
| 0,0003 |
eGFR (CKD EPI)cr eğimi,** Düşüş oranı (mL/dk/1,73 m/yıl) | -2,28 | -0,55 |
Plaseboya kıyasla tedavi farkı (%95 GA) |
| 1,73 (1,10, 2,37) |
p-değeri |
| < 0,0001 |
KV = kardiyovasküler, HHF = kalp yetersizliği nedeniyle hastaneye yatış, eGFR = Tahmini glomerüler filtrasyon hızı, CKD EPI = Kronik böbrek hastalığı epidemiyoloji işbirliği denklemi
*CV ölüm ve HHF olayları, bağımsız bir klinik olay komitesi tarafından karara bağlanmıştır ve randomize set temel alınarak analiz edilmiştir.
**eGFR eğimi, tedavi edilen sete dayalı olarak analiz edilmiştir. Kesişim noktası plasebo için -0,95 mL/dk/1,73 m ve empagliflozin için -3,02 mL/dk/1,73 m'dir. Eğim, uzun süreli etkiyi temsil ederken; kesişim noktası, eGFR üzerindeki akut etkiyi temsil etmektedir.
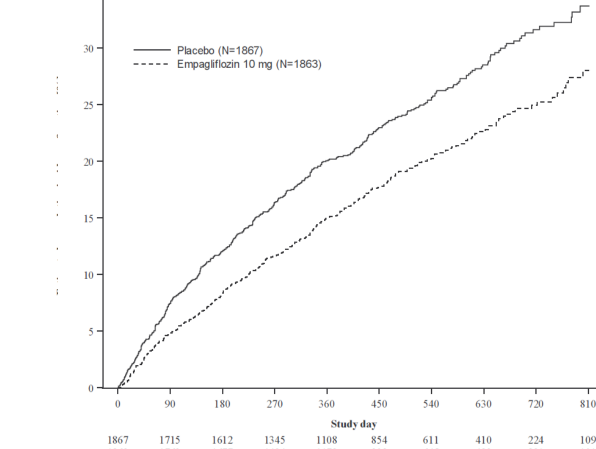
Tahmini kümülatif insidans fonksiyonu [%]
Şekil 2: Onaylanmış ilk kardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre
Bileşik primer sonlanım noktasının sonuçları; tip 2 diyabeti olan ve olmayan ve böbrek yetmezliği olan (20 mL/dk/1,73 m eGFR değerine kadar) ve olmayan hastalar dahil olmak üzere, önceden belirlenmiş alt gruplarda 1'in altında bir tehlike oranı (HR) ile genel olarak tutarlıdır.
Tedavi sırasında, empagliflozin grubunda zamanla eGFR düşüşü, plasebo grubuna kıyasla daha yavaş olmuştur (Şekil 3). 10 mg empagliflozin ile tedavi, eGFR düşüş oranını anlamlı ölçüde yavaşlatmış (Tablo 13) ve etki, önceden belirlenmiş tüm alt gruplarda tutarlı olmuştur. Empagliflozin ile tedavi edilen hastalar, eGFR'de başlangıçta düşüş yaşamıştır ve tedavinin sonlandırılmasından sonra başlangıca geri dönmüştür ve bu durum empagliflozinin eGFR üzerindeki etkilerinde akut hemodinamik değişikliklerin rol oynadığını desteklemektedir.
Ayarlanmış ortalama (SE)
Şekil 3: Zaman içinde eGFR'deki değişim *
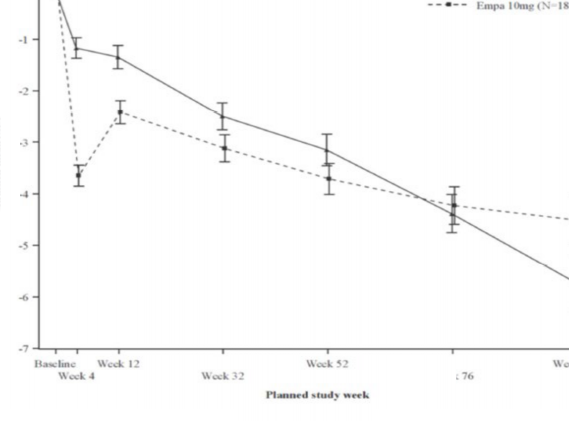
* Zaman içinde eGFR (CKD-EPI) (mL/dakika/1,73 m) MMRM sonuçları â tedavi edilen set.
Korunmuş ejeksiyon fraksiyonlu kalp yetersizliği olan hastalarda empagliflozin
Standart tedaviye ek olarak günde bir kez 10 mg empagliflozinin etkililiğinin ve güvenliliğinin değerlendirilmesi amacıyla, kronik kalp yetersizliği (NYHA II-IV) ve korunmuş ejeksiyon fraksiyonu (LVEF > %40) olan 5.988 hastada randomize, çift kör, plasebo kontrollü bir çalışma (EMPEROR-Preserved) yürütülmüştür. Primer sonlanım noktası, onaylanmış ilk kardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre olmuştur. Onaylanmış kalp yetersizliği nedeniyle hastaneye yatışın (ilk ve rekürren) yapılması ve eGFR(CKD-EPI)başlangıca göre değişim eğimi, doğrulama testine dahil edilmiştir. Başlangıç tedavisi, ACE inhibitörlerini/anjiyotensin reseptör blokerlerini/anjiyotensin reseptör- neprilisin inhibitörünü (%80,7), beta blokerleri (%86,3), mineralokortikoid reseptör antagonistleri (%37,5) ve diüretikleri (%86,2) içermiştir.
Toplam 2.997 hasta, 10 mg empagliflozin (plasebo: 2.991) için randomize edilmiştir ve medyan 26,2 ay boyunca izlenmiştir. Çalışma popülasyonu, ortalama yaşı 71,9 (aralık: 22-100 yıl) olan %55,3 erkek ve %44,7 kadından oluşmuştur. Hastaların %43'ü 75 yaş ve üzerindeydi. Çalışma popülasyonunun %75,9'u Beyaz, %13,8'i Asyalı ve %4,3'ü Siyah/Afrikalı Amerikalı ırkından oluşmuştur. Randomizasyonda, hastaların %81,5'i NYHA sınıf II, %18,1'i sınıf III ve %0,3'ü sınıf IV olarak kategorize edilmiştir. EMPEROR- Preserved çalışma popülasyonuna, LVEF'si <%50 (%33,1), LVEF'si %50 ila <%60 (%34,4) ve LVEF'si ≥%60 (%32,5) olan hastalar dahil edilmiştir. Başlangıçta, ortalama eGFR 60,6 mL/dk/1,73 m ve medyan üriner albümin/kreatinin oranı (UACR)
21 mg/g olmuştur. Hastaların yaklaşık yarısında (%50,1) eGFR ≥60 mL/dk/1,73 m değeri,
%26,1'inde 45 ila <60 mL/dk/1,73 m değerleri arasında, %18,6'sında 30 ila <45 mL/dk/1,73 m değerleri arasında ve %4,9'unda 20 ila <30 mL/dk/1,73 m değerleri arasındadır.
Empagliflozin, plaseboya kıyasla kardiyovasküler ölüm veya kalp yetersizliği nedeniyle hastaneye yatış bileşik primer sonlanım noktasında riski azaltmada üstün olmuştur. Ek olarak, empagliflozin, kalp yetersizliği nedeniylehastaneye yatışın (ilk ve rekürren) meydana gelmesi riskini anlamlı ölçüde azaltmıştır ve eGFR düşüş oranını anlamlı ölçüde yavaşlatmıştır (Tablo 14; şekil 4 ve 5).
Tablo 14: Bileşik primer sonlanım noktası, bileşenleri ve önceden belirlenmiş doğrulama testine dahil edilen iki önemli ikincil sonlanım noktası için tedavi etkisi
| Plasebo | Empagliflozin 10 mg |
N | 2.991 | 2.997 |
İlk KV ölüm veya HHF olayına kadar geçen süre, N (%) | 511 (17,1) | 415 (13,8) |
Plaseboya kıyasla tehlike oranı (%95 GA)* |
| 0,79 (0,69, 0,90) |
Üstünlük için p-değeri |
| 0,0003 |
KV Ölüm, N (%) | 244 (8,2) | 219 (7,3) |
Plaseboya kıyasla tehlike oranı (%95 GA) |
| 0,91 (0,76, 1,09) |
HHF (ilk olay), N (%) | 352 (11,8) | 259 (8,6) |
Plaseboya kıyasla tehlike oranı (%95 GA) |
| 0,71 (0,60, 0,83) |
HHF (ilk ve rekürren), N sayıda olay | 541 | 407 |
Plaseboya kıyasla tehlike oranı (%95 GA)* |
| 0,73 (0,61, 0,88) |
p-değeri |
| 0,0009 |
eGFR (CKD EPI)cr eğimi**, Düşüş oranı (mL/dk/1,73m/yıl) | -2,62 | -1,25 |
Plaseboya kıyasla tedavi farkı (%95 GA) |
| 1,36 (1,06, 1,66) |
p-değeri |
| < 0,0001 |
KV = kardiyovasküler, HHF = kalp yetersizliği nedeniyle hastaneye yatış, eGFR = Tahmini glomerüler filtrasyon hızı, CKD EPI = Kronik böbrek hastalığı epidemiyoloji işbirliği denklemi
*CV ölüm ve HHF olayları, bağımsız bir klinik olay komitesi tarafından karara bağlanmıştır ve randomize set temel alınarak analiz edilmiştir.
**eGFR eğimi, tedavi edilen sete dayalı olarak analiz edilmiştir. Kesişim noktası plasebo için -0,18 mL/dk/1,73 m ve empagliflozin için -3,02 mL/dk/1,73 m 'dir. Eğim, uzun süreli etkiyi temsil ederken; kesişim noktası, eGFR üzerindeki akut etkiyi temsil etmektedir.
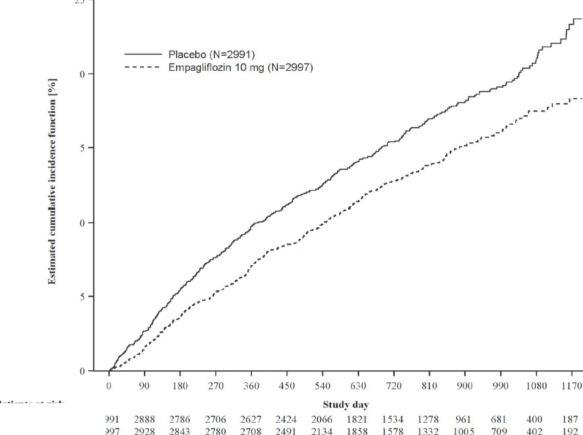
Risk taşıyan hastalar
Tahmini kümülatif insidans fonksiyonu [%]
Şekil 4 Onaylanmış ilk kardiyovasküler (KV) ölüm veya kalp yetersizliği nedeniyle hastane yatışına kadar geçen süre
Bileşik primer sonlanım noktasının sonuçları, örn., LVEF, diyabet durumu veya böbrek fonksiyonu (20 mL/dk/1,73 m'lik bir eGFR'ye kadar) olarak kategorize edilen önceden belirlenmiş alt grupların her biri arasında tutarlı çıkmıştır.
Tedavi sırasında zamanla eGFR düşüşü, empagliflozin grubunda plasebo grubuna kıyasla daha yavaş olmuştur (bkz. Şekil 5). 10 mg empagliflozin ile tedavi, eGFR düşüş oranını anlamlı ölçüde yavaşlatmıştır (Tablo 14) ve etki, önceden belirlenmiş tüm alt gruplarda tutarlı olmuştur. Empagliflozin ile tedavi edilen hastalar, eGFR'de başlangıçta düşüş yaşamıştır ve tedavinin sonlandırılmasından sonra başlangıca geri dönmüştür ve bu durum empagliflozinin eGFR üzerindeki akut etkilerinde hemodinamik değişikliklerin rol oynadığını desteklemektedir.
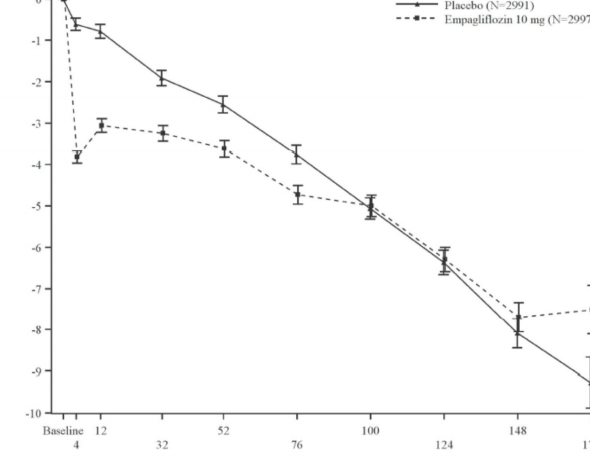
Planlanan çalışma haftası
Ayarlanmış ortalama (SE)
Şekil 5 Zaman içinde eGFR'deki değişim*
*Zaman içinde eGFR (CKD-EPI) (mL/dakika/1,73m) MMRM sonuçları â randomize set Pediyatrik popülasyon
Avrupa İlaç Ajansı (European Medicine Agency-EMA), JARDIANCE ile tip-2 diyabeti olan pediyatrik popülasyonun bir veya daha fazla alt grubunda yapılan çalışmaların sonuçlarını sunma zorunluluğunu ertelemiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2).
Avrupa İlaç Ajansı, kalp yetersizliği olan pediatrik popülasyonun tüm alt kümelerinde JARDIANCE ile yapılan çalışmaların sonuçlarını sunma yükümlülüğünden feragat etmiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Empagliflozinin farmakokinetiği, sağlıklı gönüllülerde ve tip-2 diyabetli hastalarda ayrıntılı olarak tanımlanmıştır. Oral uygulamadan sonra, empagliflozin, ortalama tmaks 1,5 saatte meydana gelen pik plazma konsantrasyonları ile hızlı bir şekilde emilir. Sonrasında, plazma konsantrasyonları hızlı bir dağılım fazı ile bifazik tarzda azalır ve terminal fazı göreceli olarak yavaştır. Kararlı durum ortalama plazma EAA ve Cdeğerleri, günde bir kez empagliflozin 10 mg için 1870 nmol.saat/L ve 259 nmol/L ve empagliflozin 25 mg için 4740 nmol.saat/L ve
687 nmol/L'dir. Empagliflozinin sistemik maruziyeti dozla orantılı şekilde artar. Empagliflozinin tek doz ve kararlı durum farmakokinetik parametreleri benzerdir, bu durum zamana göre lineer farmakokinetiği düşündürür. Sağlıklı gönüllülerle tip-2 diyabetli hastalar arasında empagliflozin farmakokinetiği açısından klinik olarak anlamlı bir farklılık yoktur.
Yüksek oranda yağlı ve yüksek kalorili bir yemekten sonra empagliflozin 25 mg alınması, hafif oranda daha düşük bir maruziyetle sonuçlanmıştır. Açlık koşulları ile karşılaştırıldığında, EAA yaklaşık %16 oranında ve Cyaklaşık %37 oranında azalmıştır. Yiyeceklerin empagliflozin farmakokinetiği üzerinde gözlenen etkileri, klinik olarak anlamlı kabul edilmez, empagliflozin yiyeceklerle birlikte veya ayrı olarak kullanılabilir.
Dağılım:
Görünür kararlı durum dağılım hacmi, popülasyon farmakokinetik analizlerine dayanarak, 73,8 L olarak tahmin edilmiştir. Sağlıklı gönüllülere oral [C]-empagliflozin çözeltisi uygulanmasını takiben kırmızı kan hücre parçalanması yaklaşık %37 ve plazma protein bağlanması %86 bulunmuştur.
Biyotransformasyon:
Empagliflozinin insan plazmasında majör bir metaboliti tespit edilmemiştir ve en belirgin metabolitleri 3 glukuronid konjugatıdır (2-,3- ve 6-O glukuronid). Her metabolitin sistemik maruziyeti, ilaca bağlı toplam materyalin %10'undan daha azdır. In vitro çalışmalar, empagliflozinin insanlardaki primer metabolizma yolunun, üridin 5'-difosfo-glukuronosil transferazlar UGT2B7, UGT1A3, UGT1A8 ve UGT1A9 aracılığı ile glukuronidasyon olduğunu düşündürmektedir.
Eliminasyon:
Popülasyon farmakokinetik analizlere dayanarak, empagliflozinin görünür terminal yarılanma ömrü 12,4 saat olarak tahmin edilmiştir, görünür oral klerensi 10,6 L/saattir. Empagliflozin oral klerensi açısından kişiler arası ve rezidüel değişkenlikler sırası ile %39,1 ve %35,8'dir. Günde bir kez verilen dozla, empagliflozinin kararlı durum plazma konsantrasyonlarına 5. dozla ulaşılmıştır. Yarı ömrü ile uyumlu olarak, kararlı durumda, plazma EAA açısından %22'ye kadar birikim gözlenmiştir. Oral [C]-empagliflozin çözeltisinin sağlıklı gönüllülere uygulanmasından sonra, ilaçla ilişkili radyoaktivitenin yaklaşık %96'sı, feçes (%41) veya idrarla (%54) atılmıştır. Feçeste geri kazanılan ilaçla ilişkili radyoaktivitenin büyük bir kısmı değişmemiş ana ilaç olmuştur ve idrarla atılan ilaçla ilişkili radyoaktivitenin yaklaşık yarısı değişmemiş ana ilaç olmuştur.
Hastalardaki karakteristik özellikler
Renal yetmezlik
Hafif, orta ve şiddetli renal bozukluğu olan hastalarda (eGFR<30 - <90 mL/dk/1,73 m) ve böbrek yetmezliği /son dönem böbrek yetmezliği (ESRD) olan hastalarda, renal fonksiyonları normal olan hastalarla karşılaştırıldığında, empagliflozinin EAA değerleri sırasıyla, yaklaşık olarak, %18, %20, %66 ve %48 oranında artmıştır. Empagliflozinin pik plazma düzeyleri, orta dereceli renal bozukluğu ve böbrek yetmezliği/ESRD hastaları ile renal fonksiyonları normal olan hastalar arasında benzerdir. Empagliflozinin pik plazma düzeyleri, hafif ve şiddetli renal bozukluğu olan hastalarda, renal fonksiyonları normal olan hastalara göre, kabaca %20 oranında daha yüksektir. Popülasyon farmakokinetik analizi, empagliflozinin görünür oral klerensinin, eGFR değerindeki azalma ile azaldığını, bunun da ilaç maruziyetinde yükselmeye neden olduğunu göstermiştir.
Hepatik yetmezlik
Child-Pugh sınıflandırmasına göre hafif, orta ve şiddetli hepatik bozukluğu olan hastalarda empagliflozinin EAA değeri, hepatik fonksiyonları normal olan hastalara göre, sırasıyla yaklaşık %23, %47 ve %75, Cdeğeri ise yaklaşık %4, %23 ve %48 artmıştır.
Vücut kitle indeksi
Popülasyon farmakokinetik analizlerine dayanarak, vücut kitle indeksinin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır. Bu analizde EAA değerinin, BMI 25 kg/m olanlara göre, BMI 30, 35, ve 45 kg/m olan kişilerde sırası ile %5,82, %10,4 ve
%17,3 daha düşük olduğu tahmin edilmiştir.
Cinsiyet
Popülasyon farmakokinetik analizlerine dayanarak, cinsiyetin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi yoktur.
Irk
Popülasyon farmakokinetik analizlerinde, EAA değerinin, BMI 25 kg/m olan Asyalılarda, aynı BMI değerine sahip Asyalı olmayanlarla karşılaştığında, %13,5 oranında daha yüksek olduğu tahmin edilmiştir.
Geriyatrik popülasyon
Popülasyon farmakokinetik analizlerine dayanarak, yaşın empagliflozinin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır.
Pediyatrik popülasyon
Bir pediyatrik Faz 1 çalışması, empagliflozinin (5 mg, 10 mg ve 25 mg) farmakokinetiğini ve farmakodinamiğini, Tip 2 diabetes mellitus hastası çocuklar ve ≥10 - <18 yaşlarındaki adolesanlarda araştırmıştır. Gözlenen farmakokinetik ve farmakodinamik yanıtlar, erişkin gönüllülerden elde edilen bilgilerle tutarlı bulunmuştur.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, genotoksisite, fertilite ve erken embriyonik gelişimle ilgili konvansiyonel çalışmalardaki klinik dışı veriler insanlar için özel bir tehlike ortaya koymamıştır.
Köpeklerde ve kemirgenlerde yapılan uzun dönem toksisite çalışmalarında, empagliflozinin klinik dozunun 10 katına eşit veya daha yüksek maruziyetlerinde toksisite belirtileri gözlenmiştir. Toksisitenin çoğu, vücut ağırlığı ve vücut yağında azalma, yiyecek tüketiminde artış, diyare, dehidratasyon, serum glikoz düzeyinde azalmayı da kapsayan idrarda glikoz kaybı ve elektrolit dengesizlikleri, protein metabolizmasındaki ve glikoneogenezdeki artışla görülen diğer serum proteinlerinde yükselme, poliüri ve glikozüri gibi idrar değişiklikleri ve böbreklerle bazı yumuşak ve vasküler dokuların mineralizasyonunu da içeren mikroskobik değişiklikler ile ilişkili sekonder farmakoloji ile uyumludur. Bazı türlerde, empagliflozinin 25 mg ile ilişkili olarak, empagliflozinin klinik EAA maruziyetinin yaklaşık 4 katında, böbrekler üzerindeki, abartılı farmakolojik etkilerin mikroskobik kanıtları gözlenmiştir. Bu kanıtlar arasında, tübüler dilatasyon ve tübüler ve pelvik mineralizasyon bulunur.
Empagliflozin genotoksik değildir.
2 yıl süreli bir karsinojenite çalışmasında empagliflozin, dişi sıçanlarda, maksimum klinik empagliflozin EAA maruziyetinin 72 kat fazlasına karşılık gelen, 700 mg/kg/gün düzeyindeki en yüksek doza kadar, tümör insidansını arttırmamıştır. Erkek sıçanlarda, en yüksek dozda, mezenterik lenf nodlarında, tedaviye bağlı benign vasküler proliferatif lezyonları (hemanjiyomlar) gözlenmiştir. Ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 26 katına karşılık gelen 300 mg/kg/gün dozda bu etki gözlenmemiştir. Sıçanlarda, 300 mg/kg/gün ve üzerindeki dozlarda, testislerde interstisyel hücre tümörleri daha yüksek insidansta gözlenmiş, empagliflozinin maksimum klinik maruziyetinin yaklaşık 18 katına karşılık gelen 100 mg/kg/gün dozda ise gözlenmemiştir. Her iki tümör de sıçanlarda yaygındır ve insanlarla ilişkili olması beklenmez.
Empagliflozin, dişi farelerde, maksimum klinik maruziyetinin yaklaşık 62 katına karşılık gelen 1000 mg/kg/gün doza kadar tümör insidansını arttırmamıştır. Erkek farelerde 1000 mg/kg/gün dozda renal tümörleri indüklemiştir, ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 11 katına karşılık gelen 300 mg/kg/gün dozda bu indükleme görülmemiştir. Bu tümörlerin etki mekanizması, erkek farelerin renal patolojiye doğal predispozisyonuna ve bir metabolik yolağa bağlı olup, insanlarda karşılığı yoktur. Erkek farelerdeki renal tümörler insanlarla ilişkili bulunmamıştır.
İnsanlarda, terapötik dozlardan sonraki maruziyetin yeterli derecedeki maruziyet miktarlarında, empagliflozinin fertilite veya erken embriyolojik gelişme üzerinde herhangi bir advers etkisi olmamıştır. Organogenez dönemi sırasında verilen empagliflozinin teratojen etkisi saptanmamıştır. Sadece maternal olarak toksik dozlarda verildiğinde empagliflozin, sıçanlarda kaburga kemiklerinde eğriliğe ve tavşanlarda embriyofetal kayıplarda artışa neden olmuştur.
Sıçanlarda yapılan pre- ve postnatal toksisite çalışmalarında, empagliflozine maksimum klinik maruziyetin yaklaşık 4 katındaki maternal maruziyetlerde, yavruların kilo alımında azalma gözlenmiştir. Empagliflozine maksimum klinik maruziyete eşdeğer bir sistemik maruziyette böyle bir etki gözlenmemiştir. Bu bulguların insanlarla ilişkisi belirsizdir.
Sıçanlarda yapılan bir juvenil toksisite çalışmasında, postnatal 21. günden postnatal 90. güne kadar empagliflozin uygulanması halinde, juvenil sıçanlarda sadece maksimum klinik doz olan 25 mg'ın yaklaşık 11 katına karşılık gelen 100 mg/kg/gün dozlarda advers olmayan, minimal- hafif dereceli renal tübüler ve pelvik dilatasyon görülmüştür. İlaçsız 13 haftalık bir dönem sonrasında bu bulgular ortadan kalkmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeği
Laktoz monohidrat (inek sütünden elde edilmiştir) Mikrokristalin selüloz
Hidroksipropil selüloz Kroskarmelloz sodyum Kolloidal anhidr silika Magnezyum stearat
Film kaplama
Hipromelloz
Titanyum dioksid (E171)
Talk
Makrogol (400)
Demir oksit, sarı (E 172)
6.2. Geçimsizlikler
Uygulanabilir değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC'nin altında oda sıcaklığında saklanır.
6.5. Ambalajın niteliği ve içeriği
PVC/aluminyum perfore birim doz blisterler.
Piyasaya 30 film tabletlik ambalaj büyüklükleri ile sunulur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâ ne uygun olarak imha edilmelidir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| EMPACROS | 8699514097846 | 581.24TL |
| EMPAFEL | 8699540030763 | 612.22TL |
| EMPALFO | 8680030190333 | 612.22TL |
| GLIFLOMED | 8680199007862 | 612.22TL |
| GLYZARDA | 8680080000415 | 612.22TL |
| Diğer Eşdeğer İlaçlar |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A16754 |
| Satış Fiyatı | 612.22 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 612.22 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693090119 |
| Etkin Madde | Empagliflozin |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |