JARDIANCE 25 mg film kaplı tablet Kısa Ürün Bilgisi
{ Empagliflozin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
JARDIANCE 25 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet, 25 mg empagliflozin içerir.
Yardımcı maddeler
Her bir film kaplı tablette, 107,4 mg laktoz anhidre eşdeğer laktoz monohidrat (inek sütünden elde edilir) bulunur.
Yardımcı maddeler için Bölüm 6.1.'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Oval, açık sarı renkte, bikonveks, eğimli kenarlı film tablettir. Bir yüzünde âS25â ve diğer yüzünde Boehringer Ingelheim logosu basılıdır (tablet uzunluğu:11,1 mm, tablet genişliği: 5,6 mm).
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
JARDIANCE, erişkinlerde, yeterli kontrol sağlanamayan Tip-2 diyabetes mellitus tedavisinde, diyet ve egzersizle birlikte;
İntolerans nedeniyle metformin kullanımının uygun bulunmadığı durumlarda monoterapi olarak
4.2. Pozoloji ve uygulama şekli
Diyabet tedavisinde, monoterapi şeklinde veya diğer ilaçlarla kombinasyonu şeklinde ekleme tedavisi olarak önerilen başlangıç dozu, günde bir kez 10 mg empagliflozindir. Günde bir kez empagliflozin 10 mg dozu tolere eden eGFR değerleri ≥60 mL/dk/1,73 m2 olan ve daha sıkı bir glisemik kontrole ihtiyaç duyan hastalarda, doz, günde bir kez 25 mg'a yükseltilebilir. Maksimum günlük doz 25 mg'dır (Bkz. Aşağıdaki bilgiler ve Bölüm 4.4).
Empagliflozin, bir sülfonilüre veya insülinle kombine şekilde kullanıldığında, hipoglisemi riskini azaltmak için sülfonilüre veya insülin dozunun düşürülmesi düşünülebilir (Bkz. Bölüm
4.5 ve Bölüm 4.8).
Uygulama şekli:
Tabletler yiyeceklerle birlikte veya yiyeceklerden ayrı olarak alınabilir. Bütün olarak su ile yutulmalıdır. Eğer bir doz atlanırsa hatırlar hatırlamaz alınmalıdır. Aynı gün içinde iki doz alınmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Tip-2 diyabetes mellitus hastalarında, empagliflozinin glisemik etkililiği renal fonksiyonlara bağlıdır. Standart tedaviye ek olarak kardiyovasküler riskin azaltılması için, eGFR 60 ml/dk/1,73 m2'nin altında olan hastalarda günde bir kez 10 mg empagliflozin dozu kullanılmalıdır (Bkz. Tablo 1). Empagliflozinin glisemik düşürücü etkililiği, orta derecede böbrek yetmezliği olan hastalarda azaldığı ve ciddi böbrek yetmezliği olan hastalarda muhtemelen bulunmadığı için, daha fazla glisemik kontrol gerekiyorsa, diğer anti- hiperglisemik ajanların eklenmesi düşünülmelidir. eGFR veya CrCl değerlerine göre doz ayarlama önerileri için Tablo 1'e bakınız.
Tablo1: Doz ayarlama önerileria
Endikasyon | eGFR [ml/dk/1,73 m²] veya CrCL [ml/dk] | Toplam günlük doz |
Tip 2 diyabetes mellitus | ≥60 | 10 mg empagliflozin ile başlanır
10 mg empagliflozini tolere eden ve ek glisemik kontrol gerektiren hastalarda, doz 25 mg empagliflozine artırılabilir. |
45 ila <60 | 10 mg empagliflozin ile başlanır
Halihazırda JARDIANCE kullanmakta olan hastalarda 10 mg empagliflozin ile devam edilir. | |
30 ila <45 | 10 mg empagliflozin ile başlanır.
Halihazırda JARDIANCE kullanmakta olan hastalarda 10 mg empagliflozin ile devam edilir. | |
<30 | Empagliflozin önerilmemektedir. |
a Bkz. Bölüm 4.4, 4.8, 5.1 ve 5.2
b Tip 2 diyabetes mellitus ve tanımlanmış kardiyovasküler hastalığı olanlarda
Empagliflozin, son dönem böbrek hastalarında (ESRD) veya diyalizdeki hastalarda kullanılmamalıdır. Bu hastalarda kullanımı destekleyecek yeterli veri bulunmamaktadır (Bkz. Bölüm 4.4, 5.1 ve 5.2).
Karaciğer yetmezliği:
Hepatik yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli hepatik yetmezliği olan hastalarda empagliflozin maruziyeti artar. Şiddetli karaciğer yetmezliği olan hastalarda terapötik deneyim sınırlıdır, bu nedenle bu hastalarda kullanımı önerilmez (Bkz. Bölüm 5.2).
Pediyatrik popülasyon:
Empagliflozinin çocuklarda ve ergenlerde etkililiği ve güvenliliği belirlenmemiştir. Veri bulunmamaktadır.
Geriyatrik popülasyon:
Yaş nedeniyle herhangi bir doz ayarlaması gerekli değildir. 75 yaş ve üzerindeki hastalarda hacim azalması riskinin arttığı dikkate alınmalıdır (Bkz. Bölüm 4.4 ve 4.8).
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Empagliflozin dahil, SGLT-2 inhibitörleri ile tedavi edilen diabetes mellitus hastalarında, hayati tehlike oluşturan ve fatal vakaları da içeren ketoasidoz vakaları seyrek olarak bildirilmiştir. Bazı hastalarda ketoasidoz, kan glikoz değerlerinde sadece orta düzeyde (14 mmol/L'nin (250 mg/dL) altında) bir yükselme şeklinde ortaya çıkan atipik bir tablo şeklinde görülmüştür. Ketoasidoz vakalarının ortaya çıkma olasılığının, daha yüksek empagliflozinin dozlarıyla artıp artmadığı bilinmemektedir.
Bulantı, kusma, anoreksi, abdominal ağrı, aşırı susama, nefes almakta güçlük, konfüzyon, olağandışı yorgunluk veya uyku hali gibi spesifik olmayan semptomların görülmesi halinde, ketoasidoz riski düşünülmelidir. Bu semptomlar ortaya çıkarsa, hasta, kan şekeri düzeyi ne olursa olsun, derhal ketoasidoz açısından değerlendirilmelidir.
Ketoasidoz şüphesi bulunan veya ketoasidoz tanısı konan hastalarda, empagliflozin tedavisi derhal sonlandırılmalıdır.
Majör cerrahi işlemler veya akut ciddi hastalıklar nedeniyle hastaneye yatırılmış hastalarda tedaviye ara verilmelidir. Bu hastalarda ketonların izlenmesi önerilmektedir. Kan keton düzeylerinin ölçülmesi idrar ölçümlerine tercih edilmelidir. Keton düzeyleri normale döndükten ve hastanın durumu stabilize edildikten sonra empagliflozin tedavisi yeniden başlatılabilir.
Empagliflozin tedavisine başlamadan önce, hastanın geçmişindeki ketoasidoza yatkınlık yaratan faktörler dikkate alınmalıdır.
Ketoasidoz riski daha yüksek olan hastalar arasında, beta hücre fonksiyonu rezervi düşük olan hastalar (Örneğin, C-peptid düzeyi düşük tip-2 diyabet hastaları veya erişkinlerde latent otoimmün diyabeti olanlar veya pankreatit öyküsü olan hastalar), besin alımının kısıtlanmasına veya şiddetli dehidratasyona neden olan durumlara sahip hastalar, insülin dozları azaltılmış hastalar ve akut hastalık, cerrahi veya alkol bağımlılığına bağlı olarak insülin gereksinimleri artmış hastalar bulunur. Bu hastalarda, SGLT-2 inhibitörleri dikkatli bir şekilde kullanılmalıdır.
Daha önce SGLT-2 inhibitör tedavisi uygulanırken ketoasidoz görülen hastalarda, başka bir tetikleyici faktör net olarak tanımlanıp çözümlenmedikçe, SGLT-2 inhibitör tedavisine yeniden başlanması önerilmez.
JARDIANCE, Tip 1 diyabet hastalarının tedavisi için kullanılmamalıdır. Klinik çalışmalardan elde edilen veriler, insülin tedavisine ek olarak 10 mg ve 25 mg empagliflozin ile tedavi edilen Tip I diyabet hastalarında, plaseboya göre DKA'nın ortaya çıkma sıklığının arttığını göstermiştir.
Renal yetmezlik
Tip 2 diabetes mellitus endikasyonu için, eGFR<60 mL/dk/1,73 m2 veya CrCl<60 mL/dk olan hastalarda günlük empagliflozin dozu 10 mg ile sınırlıdır (Bkz. Bölüm 4.2). eGFR<30 mL/dk/1,73 m2 veya CrCl<30 mL/dk olduğunda empagliflozin önerilmemektedir.
Empagliflozin, son dönem böbrek yetmezliği hastalarında veya diyalizdeki hastalarda kullanılmamalıdır. Bu hastalarda kullanımı destekleyecek yeterli veri bulunmamaktadır (Bkz. Bölüm 4.2, 5.1 ve 5.2).
Renal fonksiyonların aşağıdaki şekilde değerlendirilmesi önerilir:
Empagliflozin tedavisine başlamadan önce ve tedavi sırasında periyodik olarak, yani en az yılda bir kez (Bkz. Bölüm 4.2, 5.1 ve 5.2).
Renal fonksiyonlar üzerinde negatif etkisi olabilecek ilaçlarla eş zamanlı herhangi bir
tedaviye başlamadan önce.
Hacim azalması riski
SGLT-2 inhibitörlerinin etki mekanizmasına dayanarak, glikozüriye eşlik eden osmotik diürez, kan basıncında orta dereceli bir düşüşe yol açabilir (Bkz. Bölüm 5.1). Bu nedenle, bilinen kardiyovasküler hastalığı olan, geçmişinde hipotansiyon öyküsü olup antihipertansif tedavi gören hastalar veya 75 yaş ve üzerindeki hastalar gibi, empagliflozine bağlı kan basıncı düşmesinin risk oluşturabileceği hastalarda dikkatli olunmalıdır.
Empagliflozin tedavisi gören hastalarda, sıvı kaybına yol açan durumlar varsa (örneğin, gastrointestinal hastalıklar), hacim durumunun (örneğin, fiziksel muayene, kan basıncı ölçümleri, hematokrit dahil laboratuvar testleri) ve elektrolitlerin dikkatle izlenmesi gerekir. Sıvı kaybı düzeltilinceye kadar, empagliflozin tedavisinin geçici olarak durdurulması düşünülmelidir.
Yaşlı hastalar
Empagliflozinin idrarda glikoz atılımı üzerindeki etkileri osmotik diürez ile ilişkilidir, bu durum hidrasyon durumunu etkileyebilir. 75 yaş ve üzerindeki hastalar, hacim azalması açısından daha büyük risk altında olabilirler. Hacim azalması ile ilgili advers etkiler, plasebo ile karşılaştırıldığında, empagliflozin ile tedavi edilen bu grup hastalarda daha fazla bildirilmiştir (Bkz. Bölüm 4.8). Bu nedenle, sıvı azalmasına yol açabilecek ilaçlarla (örneğin, diüretikler, ACE inhibitörleri) birlikte kullanılması halinde, bu hastaların sıvı alımlarına özel bir dikkat gösterilmelidir.
Komplike idrar yolu enfeksiyonları
Empagliflozin ile tedavi edilen hastalarda, piyelonefrit ve ürosepsis içeren komplike idrar yolu enfeksiyonu vakaları raporlanmıştır (Bkz. Bölüm 4.8). Komplike idrar yolu enfeksiyonları olan hastalarda empagliflozin tedavisinin geçici olarak durdurulması düşünülmelidir.
Perineumda nekrotizan fasiit (Fournier gangreni)
SGLT2 inhibitörü kullanan diyabeti olan kadın ve erkek hastalarda, perineumda nekrotizan
fasiit (Fournier gangreni olarak da bilinir) vakaları bildirilmiştir. Bu durum, seyrek ama ciddi ve potansiyel olarak hayatı tehdit eden bir olaydır ve acil cerrahi girişim ve antibiyotik tedavisini gerektirir.
Hastalar, genital veya perineal bölgelerde ağrı, hassasiyet, eritem veya şişlik ile birlikte ateş veya kırıklık semptomlarından bazılarını birlikte hissetmeleri halinde doktora başvurmaları konusunda uyarılmalıdır. Ürogenital enfeksiyon veya perineal absenin, nekrotizan fasiitten önce ortaya çıkabileceği akılda tutulmalıdır. Eğer Fournier gangreninden şüphe edilirse, JARDIANCE tedavisi kesilmeli ve derhal tedavi (antibiyotikler ve cerrahi debridman dahil) başlanmalıdır.
Alt ekstremite amputasyonları
Başka bir SGLT2 inhibitörü ile devam eden uzun dönemli klinik çalışmalarda alt ekstremite amputasyon (başlıca, ayak parmağı) vakalarında artış gözlenmiştir. Bu durumun sınıf etkisi olup olmadığı bilinmemektedir. Tüm diyabet hastalarında olduğu gibi, hastalar rutin olarak koruyucu ayak bakımı üzerine konsülte edilmelidir.
Hepatik hasar
Klinik çalışmalarda empagliflozin ile hepatik hasar vakaları bildirilmiştir. Empagliflozin ile hepatik hasar arasında bir nedensellik ilişkisi tespit edilmemiştir.
Hematokrit yükselmesi
Empagliflozin tedavisi ile hematokritte yükselme gözlemlenmiştir (Bkz. Bölüm 4.8).
Kronik böbrek hastalığı
Albüminürinin eşlik ettiği veya etmediği kronik böbrek hastalığı (eGFR ≥30 mL/dk/1,73 m2) olan diyabet hastalarında diyabet tedavisi için empagliflozin ile deneyim mevcuttur. Albüminürisi olan hastalar empagliflozin tedavisinden daha fazla yarar görebilir.
İnfiltratif hastalık veya Takotsubo kardiyomiyopatisi
İnfiltratif hastalığı veya Takotsubo kardiyomiyopatisi olan hastalar özel olarak çalışılmamıştır. Bu nedenle, bu hastalarda etkinlik belirlenmemiştir.
İdrar laboratuvar değerlendirmeleri
Etki mekanizmasına bağlı olarak, JARDIANCE alan hastalarda idrarda glikoz testi pozitif çıkacaktır.
1,5-anhidroglusitol (1,5-AG) testi ile etkileşim
SGLT2 inhibitörleri alan hastalarda glisemik kontrolün değerlendirilmesinde, 1,5-AG ölçümlerinin güvenilir olmaması nedeniyle, glisemik kontrolün 1,5-AG testi ile izlenmesi önerilmez. Glisemik kontrolü izlemek için alternatif yöntemlerin kullanılması önerilir.
Laktoz
Tabletler laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glikoz- galaktoz malabsorbsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Sodyum
JARDIANCE her âdozâunda 1 mmol (23 mg)'dan daha az sodyum içerir; yani aslında âsodyum içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diüretikler:
Empagliflozin, tiyazid ve loop diüretiklerin diüretik etkisine ek etki yapabilir, böylece dehidratasyon ve hipotansiyon riskini arttırabilir (Bkz. Bölüm 4.4).
İnsülin ve insülin salgılatıcılar:
İnsülin ve sülfonilüreler gibi insülin salgılatıcılar hipoglisemi riskini arttırabilir. Bu nedenle, hipoglisemi riskini azaltmak için, empagliflozin ile kombine olarak kullanıldığında insülin veya insülin salgılatıcıların daha düşük dozda kullanılması gerekebilir (Bkz. Bölüm 4.2, Bölüm 4.8).
Farmakokinetik etkileşimler:
In vitro veriler, insanlarda empagliflozinin primer metabolizma yolunun, üridin 5´- difosfoglukuronoziltransferazlar olan UGT1A3, UGT1A8, UGT1A9 ve UGT2B7 aracılığı ile glukuronidasyon olduğunu düşündürmektedir. Empagliflozin bir insan uptake taşıyıcısı olan OAT3, OATP1B1 ve OATP1B3 substratıdır, ancak OAT1 ve OCT2'nin substratı değildir. Empagliflozin, P-glikoprotein (P-gp) ve meme kanseri direnç proteininin (BCRP) bir substratıdır.
Empagliflozinin, UGT enzimleri ve OAT3'ün bir inhibitörü olan probenesid ile eş zamanlı uygulanması, empagliflozinin pik plazma konsantrasyonlarında (C) % 26 oranında artışla ve konsantrasyon zaman eğrisi altında kalan alanda (EAA) % 53 oranında yükselmeyle sonuçlanmıştır. Bu değişiklikler, klinik olarak anlamlı kabul edilmemiştir.
UGT indüksiyonunun (örneğin rifampisin veya fenitoin ile indüksiyon) empagliflozin üzerindeki etkisi çalışılmamıştır. Etkililikte muhtemel bir azalma riski nedeniyle, UGT enzimlerinin bilinen indükleyicileriyle eş zamanlı uygulanması önerilmez. Bu UGT enzimlerinin bir indükleyicisinin birlikte uygulanması gerekiyorsa, JARDIANCE'a yanıtı değerlendirmek için glisemik kontrolün izlenmesi uygundur.
Gemfibrozil (OAT3 ve OATP1B1/B3 taşıyıcılarının bir in vitro inhibitörü) ile yapılan bir etkileşim çalışması, eş zamanlı kullanımı takiben, empagliflozin C değerinin % 15 ve EAA değerinin % 59 oranında arttığını göstermiştir. Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir.
Eş zamanlı rifampisin uygulanması ile OATP1B1/1B3 taşıyıcılarının inhibe edilmesi, empagliflozinin C değerinde % 75 ve EAA değerinde % 35 oranında artışla sonuçlanmıştır. Bu değişiklikler klinik olarak anlamlı kabul edilmemiştir.
Bir P-gp inhibitörü olan verapamil ile birlikte veya verapamil olmaksızın uygulanması halinde, empagliflozin maruziyeti benzerdir. Bu durum, P-gp inhibisyonunun empagliflozin üzerinde klinik olarak anlamlı bir etkisinin olmadığını göstermiştir.
Etkileşim çalışmaları, metformin, glimepirid, pioglitazon, sitagliptin, linagliptin, varfarin, verapamil, ramipril, simvastatin, torasemid ve hidroklorotiyazid ile eş zamanlı kullanımlarının, empagliflozinin farmakokinetiği üzerinde bir etkisinin olmadığını
düşündürmektedir.
Empagliflozinin diğer ilaçlar üzerindeki etkileri:
Empagliflozin renal lityum atılımını artırabilir ve kan lityum seviyesi düşebilir. Empagliflozin başlatıldıktan ve doz değişikliklerinden sonra serum lityum konsantrasyonu daha sık izlenmelidir. Lityum serum konsantrasyonunu izlemek için, hasta lityum reçete eden doktora sevk edilmelidir.
In-vitro çalışmalara dayanarak, empagliflozin, CYP450 izoformlarını inhibe etmez, inaktive etmez veya indüklemez. Empagliflozin UGT1A1, UGT1A3, UGT1A8, UGT1A9 veya UGT2B7'yi inhibe etmez. Bu nedenle, majör CYP450 veya UGT izoformlarının empagliflozin ile ve bu enzimlerin substratları ile eş zamanlı uygulanması sonucunda ilaçâilaç etkileşmesi beklenmez.
Empagliflozin terapötik dozlarda P-gp'yi inhibe etmez. In-vitro çalışmalara dayanarak, empagliflozinin P-gp substratları ile etkileşmesi beklenmez. Bir P-gp substratı olan digoksinin empagliflozin ile eş zamanlı kullanılması, digoksinin Cdeğerinde % 14 ve EAA değerinde
% 6 oranında artışa yol açmıştır. Bu değişikliklerin klinik olarak anlamlı olmadığı düşünülmüştür.
Empagliflozin, in vitro koşullarda, klinik olarak anlamlı plazma konsantrasyonlarında, OAT3, OATP1B1 ve OATP1B3 gibi insan uptake taşıyıcılarını inhibe etmez ve bu uptake taşıyıcılarının substratları ile ilaç-ilaç etkileşmesi beklenmez.
Sağlıklı gönüllülerde yürütülen etkileşim çalışmaları, empagliflozinin, metformin, glimepirid, pioglitazon, sitagliptin, linagliptin, simvastatin, varfarin, ramipril, digoksin, diüretikler ve oral kontraseptiflerin farmakokinetiği üzerinde klinik olarak anlamlı bir etkisi olmadığını düşündürmektedir.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyona ilişkin bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Veri mevcut değildir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon) JARDIANCE tedavisi sırasında uygun bir doğum kontrol yöntemi kullanılabilir. Bölüm 4.5'te açıklandığı gibi empagliflozinin, oral kontraseptiflerin farmakokinetiği üzerinde anlamlı bir klinik etkisi olmadığı düşünülmektedir.
Gebelik dönemi
JARDIANCE'ın gebe kadınlarda kullanımına ilişkin yeterli veri yoktur. Hayvanlar üzerinde yapılan çalışmalar, gebelik / ve-veya / embriyonal / fetal gelişim / ve-veya / doğum / ve-veya
/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir.
Hayvan çalışmaları empagliflozinin geç gestasyon döneminde çok sınırlı bir oranda plasentaya
geçtiğini göstermektedir. Ancak bu çalışmalar, erken embriyonik gelişim dönemi açısından direkt veya indirekt zararlı bir etkiyi işaret etmemektedir. Bununla birlikte, hayvan çalışmaları, postnatal gelişim üzerinde advers etkiler göstermiştir (Bkz. Bölüm 5.3). Bir önlem olarak, gebelik döneminde JARDIANCE kullanımından kaçınılmalıdır.
İnsanlara yönelik potansiyel risk bilinmemektedir. JARDIANCE gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
İnsanlarda empagliflozinin süte geçişi ile ilgili bir veri bulunmamaktadır. Hayvan çalışmalarından elde edilen mevcut toksikolojik veriler, empagliflozinin süte geçtiğini göstermiştir. Yenidoğan/infant açısından bir risk göz ardı edilemez. JARDIANCE emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/ Fertilite
JARDIANCE için insan fertilitesi ile ilgili bir çalışma yürütülmemiştir. Hayvan çalışmaları, fertilite ile ilgili direkt veya indirekt zararlı bir etki göstermemiştir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
JARDIANCE'ın araç ve makine kullanımı üzerindeki etkisi düşüktür. Hastalar, araç ve makine kullanımı sırasında, özellikle JARDIANCE'ı bir sülfonilüre ve/veya insülin ile birlikte alıyorlarsa, ortaya çıkabilecek hipoglisemiden kaçınmak için gerekli önlemleri almaları konusunda uyarılmalıdırlar.
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
Tip 2 diabetes mellitus
Empagliflozinin güvenliliğini değerlendirmek üzere tip-2 diyabeti olan toplam 15.582 hasta klinik çalışmalara dahil edilmiştir. Bu hastalardan 10.004 kişi monoterapi olarak veya metformin, bir sülfonilüre, pioglitazon, DPP-4 inhibitörleri veya insülin ile birlikte empagliflozin almıştır.
18-24 hafta süreli, 3.534 hastanın dahil edildiği 6 plasebo kontrollü çalışmada, 1.183 hasta plasebo ile, 2.351 hasta ise empagliflozin ile tedavi edilmiştir. Empagliflozin ile tedavi edilen hastalardaki genel advers olay insidansı plasebo ile benzer bulunmuştur. En sık bildirilen advers reaksiyon, sülfonilüre veya insülin ile birlikte kullanıldığında, hipoglisemidir (âseçilmiş advers reaksiyonların açıklamasıâ bölümüne bakınız).
![]()
Plasebo kontrollü çalışmalarda empagliflozin alan hastalarda bildirilen ve sistem-organ sınıfına ve MedDRA tercih edilen terimlerine göre sınıflandırılan advers reaksiyonlar aşağıdaki tabloda sunulmuştur (Tablo 2).
![]()
Advers reaksiyonlar mutlak sıklık dikkate alınarak listelenmiştir. Sıklık dereceleri şu şekilde tanımlanır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.,000 ila
![]()
![]()
![]()
<1/100); seyrek (≥1/10.,000 ila <1/1.,000); çok seyrek (<1/10.,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 2: Plasebo kontrollü çalışmalarda ve pazarlama sonrası deneyimde bildirilen advers reaksiyonların çizelgeli listesi (MedDRA)
Sistem organ sınıfı | Çok yaygın | Yaygın | Yaygın olmayan | Seyrek | Çok seyrek |
Enfeksiyonlar ve |
| Vajinal |
| Perineumda |
|
enfestasyonlar | moniliazis, | nekrotizan | |||
| vulvovajinit, | fasiit | |||
| balanitis ve diğer | (Fournier | |||
| genital | gangreni) | |||
| enfeksiyonlar | ||||
| İdrar yolu |
| |||
| enfeksiyonu |
| |||
| (piyelonefrit ve |
| |||
| ürosepsis dahil) |
| |||
Metabolizma ve | Hipoglisemi | Susama hissi | Diyabetik |
|
|
beslenme | (sülfonilüre |
| ketoasidoz* | ||
hastalıkları | veya insülinle |
|
| ||
| birlikte |
|
| ||
| kullanıldığında) |
|
| ||
Vasküler hastalıklar | Hacim azalması |
|
|
|
|
Gastrointestinal hastalıklar |
| Konstipasyon |
|
|
|
Deri ve deri altı doku hastalıkları |
| Pirürit (jeneralize) Döküntü | Ürtiker Anjiyoödem |
|
|
Böbrek ve idrar yolu hastalıkları |
| Ürinasyonda artış | Dizüri |
| Tübülointerstis yel nefrit |
Araştırmalar |
| Serum lipidlerinde yükselme | Kan kreatinin düzeyinde artış/ Glomerüler Filtrasyon hızında azalma Hematokrit değerinde yükselme |
|
|
*Bölüm 4.4'e bakınız
Seçilmiş advers etkilerin açıklaması
Hipoglisemi
Hipoglisemi sıklığı, ilgili çalışmalardaki geçmiş tedaviye bağlıdır ve empagliflozin ve plasebo için, monoterapi, metformine ekleme tedavisi, metformin ile birlikte veya birlikte olmayan pioglitazona ekleme tedavisi, linagliptin ve metformine ekleme tedavisi ve standart bakım tedavisine ekleme tedavisinde benzer bulunmuştur. Hipoglisemi sıklığı, daha önce ilaçla tedavi edilmemiş hastalarda, empagliflozinin metforminle kombinasyonu ile empagliflozin ve metformin bileşenlerinden her birinin ayrı ayrı uygulanması karşılaştırıldığında da benzer bulunmuştur.
Metformin ve bir sülfonilüre tedavisine ekleme tedavisi (empagliflozin 10 mg: % 16,1, empagliflozin 25 mg: % 11,5, plasebo: % 8,4), metformin ile birlikte veya birlikte olmayan ve bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: % 19,5, empagliflozin 25 mg: % 28,4, plasebo: % 20,6; 78 hafta süreli çalışma boyunca, empagliflozin 10 mg ve empagliflozin 25 mg: % 36,1, plasebo: % 35,3) ve metforminle birlikte veya birlikte olmayan MDI (çoklu doz enjeksiyon) insülin tedavisine ekleme tedavisi olarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: % 39,8, empagliflozin 25 mg: % 41,3, plasebo: % 37,2; 52 hafta süreli çalışma boyunca, empagliflozin 10 mg: % 51,1, empagliflozin 25 mg: % 57,7, plasebo: % 58) sıklıklarda artış kaydedilmiştir.
Plasebo ile karşılaştırıldığında, monoterapi, metformin tedavisine ekleme tedavisi, metformin ve bir sülfonilüre tedavisine ekleme tedavisi ve metformin ile birlikte veya birlikte olmayan pioglitazon tedavisine ekleme tedavisi, linagliptin ve metfomin tedavisine ekleme tedavisi, standart bakım tedavisine ilave olarak ve daha önce ilaçla tedavi edilmemiş hastalarda, metformin ile empagliflozin kombinasyonu tedavisi, empagliflozin ve metformin bileşenlerinden her birinin ayrı ayrı uygulanmasıyla yapılan tedavi ile karşılaştırıldığında, majör hipoglisemide bir artış gözlenmemiştir. Metforminle birlikte olan veya birlikte olmayan ve bir sülfonilüre ile birlikte olan veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde, empagliflozin 10 mg: % 0, empagliflozin 25 mg: % 1,3, plasebo: % 0; 78 hafta süreli çalışma
boyunca, empagliflozin 10 mg: % 0, empagliflozin 25 mg: % 1,3, plasebo: % 0) ve metforminle birlikte veya birlikte olmayan MDI insüline ekleme tedavisi olarak kullanıldığında (insülinin ayarlanamadığı ilk 18 haftalık tedavi döneminde empagliflozin 10 mg: %0,5, empagliflozin 25 mg: %0,5, plasebo: %0,5 ve 52 hafta süreli çalışma boyunca
empagliflozin 10 mg: % 1,6, empagliflozin 25 mg: % 0,5, plasebo: % 1,6) sıklıkta artış kaydedilmiştir.
Vajinal moniliazis, vulvovajinit, balanit ve diğer genital enfeksiyonlar, empagliflozin (empagliflozin 10 mg: % 4, empagliflozin 25 mg: % 3,9) ile tedavi edilen hastalarda plaseboya (% 1) göre daha sık bildirilmiştir. Bu enfeksiyonlar, plasebo ile karşılaştırıldığında, empagliflozin ile tedavi edilen kadınlarda daha sık bildirilmiştir. Sıklıktaki farklılıklar erkeklerde daha az belirgindir. Genital sistem enfeksiyonları hafif veya orta şiddettedir.
Ürinasyonda artış
Ürinasyonda artış (önceden tanımlanmış terimler olan pollaküri, poliüri ve noktüri dahil), plaseboya (% 1,4) göre, empagliflozin (empagliflozin 10 mg: % 3,5, empagliflozin 25 mg: %
3,3) ile tedavi edilen hastalarda daha yüksek sıklıkta gözlenmiştir. Artmış ürinasyon genellikle hafif veya orta şiddettedir. Bildirilen noktüri sıklığı, empagliflozin ve plasebo için benzerdir (<% 1).
İdrar yolu enfeksiyonu
Advers olay olarak bildirilen idrar yolu enfeksiyonunun genel sıklığı, empagliflozin 25 mg ve plasebo grubunda benzer (% 7 ve % 7,2) ve empagliflozin 10 mg grubunda daha yüksek bulunmuştur (% 8,8). Plaseboya benzer şekilde, empagliflozin grubunda da idrar yolu enfeksiyonları, kronik veya tekrarlayan idrar yolu enfeksiyonu öyküsü bulunan hastalarda daha sık bildirilmiştir. İdrar yolu enfeksiyonlarının şiddeti (hafif, orta, şiddetli), empagliflozin ve plasebo grubundaki hastalarda benzer olmuştur. İdrar yolu enfeksiyonları kadınlarda, empagliflozin ile tedavi edilen grupta plaseboya göre daha sık bildirilirken, erkeklerde bir farklılık gözlenmemiştir.
Hacim azalması
Hacim azalmasının (önceden tanımlanmış terimler olan kan basıncında (ambulatuvar) düşme, sistolik kan basıncında düşme, dehidratasyon, hipotansiyon, hipovolemi, ortostatik hipotansiyon ve senkop dahil) genel sıklığı, empagliflozin (empagliflozin 10 mg: % 0,6, empagliflozin 25 mg: % 0,4) ve plasebo (% 0,3) ile tedavi edilen hastalar arasında benzer bulunmuştur. Hacim azalması olaylarının sıklığı, empagliflozin 10 mg (% 2,3) veya 25 mg (% 4,3) ile tedavi edilen 75 yaş ve üzerindeki hastalarda, plasebo (% 2,1) ile tedavi edilenlere göre artmıştır.
Kan kreatinin düzeyinde yükselme/glomerüler filtrasyon hızında azalma
Kan kreatinin düzeyinde yükselme ve glomerüler filtrasyon hızında azalma olan hastaların genel sıklığı, empagliflozin ve plasebo ile tedavi edilen hastalar arasında benzer bulunmuştur (kan kreatininde yükselme: Empagliflozin 10 mg % 0,6, empagliflozin 25 mg % 0,1, plasebo
% 0,5; glomerüler filtrasyon hızında azalma: Empagliflozin 10 mg % 0,1, empagliflozin 25
mg % 0, plasebo % 0,3).
Empagliflozin ile tedavi edilen hastalarda, kreatinin düzeyinde başlangıçtaki yükselmeler ve tahmin edilen glomerüler filtrasyon hızında başlangıçtaki azalmalar, tedavinin devamı sırasında genellikle geçici özellikte veya ilaç tedavisinin kesilmesinden sonra geri dönüşlü olmuştur.
Bunlarla tutarlı olarak, EMPA-REG OUTCOME çalışmasında, empagliflozin ile tedavi edilen hastalarda başlangıçta eGFR düzeyinde bir düşüş (ortalama 3 mL/dk/1,73 m2 ) görülmüştür. Daha sonra, devam eden tedavi sırasında eGFR korunmuştur. Tedavinin kesilmesinden sonra ortalama eGFR başlangıç düzeylerine dönmüştür, bu durum, akut hemodinamik değişikliklerin bu böbrek fonksiyon değişikliklerinde rol oynayabileceğini düşündürür.
Serum lipidlerinde artış
Plasebo karşısında empagliflozin 10 mg ve 25 mg için başlangıca göre ortalama yüzde artışlar sırasıyla şu şekildedir: Total kolesterol, % 3,5'e karşı % 4,9 ve % 5,7; HDL-kolesterol, % 0,4'e karşı % 3,3 ve % 3,6; LDL-kolesterol, % 7,5'e karşı % 9,5 ve % 10,0; trigliseritler, % 10,5'e karşı % 9,2 ve % 9,9.
Hematokrit artışı
Hematokritte başlangıca göre ortalama değişimler, plasebo için % 0,1 karşısında empagliflozin
10 mg ve 25 mg için sırasıyla % 3,4 ve % 3,6 olmuştur. EMPA-REG OUTCOME
çalışmasında, tedavi kesildikten sonra 30 günlük bir izleme dönemini takiben hematokrit değerleri başlangıç değerlerine dönmüştür.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Semptomlar
Kontrollü klinik çalışmalarda, sağlıklı gönüllülerde empagliflozinin 800 mg'a kadar tek doz uygulaması ve tip-2 diyabeti olan hastalarda günde 100 mg'a kadar çoklu doz uygulaması, herhangi bir toksisiteye neden olmamıştır. Empagliflozin, idrarla glikoz atılımını arttırarak idrar hacminde artışa yol açmıştır. İdrar hacminde gözlenen artış, doza bağımlı değildir ve klinik olarak anlamlı bulunmamıştır. İnsanlarda 800 mg'ın üstündeki dozlarda bir deneyim yoktur.
Tedavi
Doz aşımı halinde, hastanın klinik durumuna uygun bir tedavi başlanmalıdır. Empagliflozinin hemodiyaliz ile uzaklaştırılması çalışılmamıştır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Sodyum-Glikoz Ko-Transporter 2 (SGLT2) İnhibitörleri ATC kodu: A10BK03
Etki mekanizması:
Empagliflozin, geri dönüşlü, oldukça potent (ICR1,3 nmol) ve seçici yarışmalı bir sodyum- glikoz ko-transporter 2 (SGLT-2) inhibitörüdür. Empagliflozin, glikozun periferik dokulara taşınması için önemli olan diğer glikoz taşıyıcılarını inhibe etmez ve bağırsakta glikoz absorpsiyonundan sorumlu majör taşıyıcı olan SGLT-2 için SGLT-1'e göre 5000 kat daha seçicidir. SGLT-2 böbrekte oldukça fazla eksprese edilir, diğer dokulardaki ekspresyonu ise ya yoktur ya da çok düşüktür. Asıl taşıyıcı olarak glikozun glomerüler filtrattan, dolaşıma reabsorbsiyonundan sorumludur. Tip-2 diyabeti ve hiperglisemisi olan hastalarda daha yüksek miktarda glikoz filtre edilir ve geri emilir.
Empagliflozin, tip 2 diyabet hastalarında renal glikoz geri emilimini azaltarak glisemik kontrolü iyileştirir. Böbreklerden bu gliküretik mekanizma aracılığı ile uzaklaştırılan glikoz miktarı, kan glikoz konsantrasyonuna ve GFR'ye bağımlıdır. Tip-2 diyabeti ve hiperglisemisi olan hastalarda SGLT-2 inhibisyonu, idrarda aşırı glikoz atılımına yol açar. Ayrıca, empagliflozin kullanımına başlanması, sodyum atılımını arttırır ve bu durum da osmotik diürez ve intravasküler hacmin azalması ile sonuçlanır.
Tip-2 diyabeti olan hastalarda, empagliflozinin ilk dozundan hemen sonra idrarda glikoz atılımı artar ve 24 saat süreli doz aralığı boyunca devam eder. 4 haftalık tedavi döneminin
sonunda, idrarda glikoz atılımda artış sağlanmıştır ve bu miktar, ortalama yaklaşık 78 g/gün olmuştur. Tip-2 diyabetli hastalarda idrarda glikoz atılımının artması, plazma glikoz düzeylerinin ani düşmesi ile sonuçlanmıştır.
Empagliflozin hem açlık hem de tokluk plazma glikoz düzeylerini iyileştirir. Empagliflozinin etki mekanizması beta hücrelerinin fonksiyonundan ve insülin yolağından bağımsızdır ve bu durum hipoglisemi riskinin düşük olmasına katkıda bulunur. Homeostaz Model Değerlendirmesi-ï¢ (HOMA-ï¢) dahil, beta hücre fonksiyonunun yerini tutan göstergelerde de iyileşme kaydedilmiştir. Ayrıca, idrar glikoz atılımı, vücut yağ kaybı ve vücut ağırlığının azalması ile bağlantılı olarak kalori kaybını tetikler. Empagliflozin ile gözlenen glikozüri, diürez ile seyreder, bu da kan basıncının sürekli bir şekilde orta derecede düşmesine katkıda bulunabilir.
Empagliflozin ayrıca sodyum geri emilimini azaltır ve distal tübüle ulaşan sodyum miktarını artırır. Bu durum: tübüloglomerüler geri beslemesinin artırılması ve intraglomerüler basıncın azaltılması, kalbin hem ön hem de ard yükünün düşürülmesi, sempatik aktivitenin azaltılması ve düşük NT-proBNP değerleri ve kardiyak yeniden modelleme , dolum basınçları ve diyastolik fonksiyon üzerindeki faydalı etkilerle kanıtlandığı üzere sol ventrikül duvar stresinin azaltılması dahil ancak bunlarla sınırlı olmamak üzere birkaç fizyolojik işlevi etkileyebilir.
Klinik etkililik ve güvenlilik Tip-2 diyabetes mellitus
Glisemik kontrolün iyileşmesi ve kardiyovasküler morbidite ve mortalitenin azalması, Tip 2 diyabet tedavisinin ayrılmaz bir parçasıdır.
12 çift kör, plasebo ve aktif kontrollü klinik çalışmada, Tip 2 diyabeti olan toplam 14.663 hastada glisemik etkililik ve kardiyovasküler sonuçlar değerlendirilmiştir. Bu çalışmalarda
9.295 hasta empagliflozin kullanmıştır (empagliflozin 10 mg: 4.165 hasta, empagliflozin 25 mg: 5.130 hasta). 5 çalışmanın süresi 24 haftadır. Bu çalışmaların uzatmalarında ve diğer çalışmalarda hastalar, 102 haftaya kadar sürelerle empagliflozin kullanmıştır.
Empagliflozinin monoterapi ve metformin, pioglitazon, bir sülfonilüre, DPP-4 inhibitörleri ve insülin ile kombine olarak kullanılması, HbA1c, açlık plazma glikozu (APG), vücut ağırlığı, sistolik ve diyastolik kan basıncında klinik olarak anlamlı iyileşmelere yol açmıştır. Empagliflozin 25 mg grubunda, empagliflozin 10 mg ve plasebo gruplarına göre, % 7'den daha düşük HbA1c düzeyi hedefine ulaşan hasta oranı daha yüksektir ve daha az sayıda hasta glisemik kurtarma tedavisine ihtiyaç duymuştur. Başlangıç HbA1c düzeyinin daha yüksek olması HbA1c düzeyinde daha fazla düşme ile ilişkili bulunmuştur. Ayrıca, standart bakım tedavisine ilave olarak uygulanan empagliflozin, Tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olanlarda kardiyovasküler mortaliteyi azaltmıştır.
Empagliflozinin monoterapi olarak etkililiği ve güvenliliği, daha önce tedavi edilmemiş hastalarda, çift kör, plasebo kontrollü ve aktif kontrollü 24 hafta süreli bir çalışmada değerlendirilmiştir. Empagliflozin ile tedavi, plasebo ile karşılaştırıldığında, HbA1c düzeyinde istatistiksel olarak anlamlı (p<0,0001) bir düşüşe (Tablo 3) ve APG değerlerinde klinik olarak önemli bir azalmaya yol açmıştır.
Başlangıç HbA1c değeri ≥% 8,5 olan hastaların (N=201) önceden tanımlanmış bir analizinde, HbA1c düzeyinde başlangıca göre azalma oranı, empagliflozin 10 mg için % -1,44, 25 mg için
% -1,43, sitagliptin için % -1,04'tür ve plasebo grubunda % 0,01 oranında artış olmuştur.
Bu çalışmanın çift kör, plasebo kontrollü uzatmasında, HbA1c değerinde azalma, kilo kaybı ve kan basıncında düşme 76 haftaya kadar devam etmiştir.
Tablo 3: 24 hafta süreli plasebo kontrollü empagliflozin monoterapisi çalışmasının etkililik sonuçlarıa
| Plasebo | JARDIANCE | Sitagliptin | |
10 mg | 25 mg | 100 mg | ||
N | 228 | 224 | 224 | 223 |
HbA1c (%) | ||||
Başlangıç (ortalama) | 7,91 | 7,87 | 7,86 | 7,85 |
Başlangıca göre değişiklik | 0,08 | -0,66 | -0.78 | -0,66 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,74* (-0,9, -0,57) | -0,85* (-1,01, -0,69) | -0,73 (-0,88, -0,59) |
N | 208 | 204 | 202 | 200 |
Başlangıç HbA1c değeri ≥% 7 olan hastalardan, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
12 |
35,3 |
43,6 |
37,5 |
N | 228 | 224 | 224 | 223 |
Vücut ağırlığı (kg) | ||||
Başlangıç (ortalama) | 78,23 | 78,35 | 77,8 | 79,31 |
Başlangıca göre değişiklik | -0,33 | -2,26 | -2,48 | 0,18 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,93* (-2,48, -1,38) | -2,15* (-2,7,-1,6) | 0,52 (-0,04, 1) |
N | 228 | 224 | 224 | 223 |
SBP (mmHg) | ||||
Başlangıç (ortalama) | 130,4 | 133 | 129,9 | 132,5 |
Başlangıca göre değişiklik | -0,3 | -2,9 | -3,7 | 0,5 |
Plaseboya göre farklılık (% 97,5 GA) |
| -2,6* (-5,2, -0) | -3,4* (-6, -0,9) | 0,8 (-1,4, 3,1) |
GA: Güven Aralığı SBP: Sistolik Kan Basıncı
*p-değeri<0,0001
Kombinasyon tedavisi
Metformin, sülfonilüre, pioglitazon tedavisine ekleme tedavisi olarak empagliflozin Metformin, metformin ve bir sülfonilüre veya metformin ile birlikte olan veya birlikte olmayan pioglitazon tedavisine ekleme tedavisi olarak empagliflozin kullanılması, HbA1c düzeylerinde ve vücut ağırlığında, plaseboya göre, istatistiksel olarak anlamlı (p<0,0001) azalmalarla sonuçlanmıştır (Tablo 4). Ayrıca, APG değerlerinde, sistolik ve diyastolik kan basıncında da, plaseboya göre, klinik olarak anlamlı azalmalar görülmüştür.
Bu çalışmaların çift kör, plasebo kontrollü uzatmalarında, HbA1c, vücut ağırlığı ve kan
basıncındaki azalmalar 76. haftaya kadar devam etmiştir.
Tablo 4: 24 hafta süreli plasebo kontrollü çalışmaların etkililik sonuçlarıa
Metformin tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 207 | 217 | 213 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,94 | 7,86 |
Başlangıca göre değişiklik | -0,13 | -0,7 | -0,77 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,57* (-0,72, -0,42) | -0,64* (-0,79, -0,48) |
N | 184 | 199 | 191 |
Başlangıç HbA1c değeri ≥% 7 olan hastalarda, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
12,5 |
37,7 |
38,7 |
N | 207 | 217 | 213 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 79,73 | 81,59 | 82,21 |
Başlangıca göre değişiklik | -0,45 | -2,08 | -2,46 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,63* (-2,17, -1,08) | -2,01* (-2,56, -1,46) |
N | 207 | 217 | 213 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 128,6 | 129,6 | 130 |
Başlangıca göre değişiklik | -0,4 | -4,5 | -5,2 |
Plaseboya göre farklılık (% 95 GA) |
| -4,1* (-6,2, -2,1) | -4,8* (-6,9, -2,7) |
Metformin ve bir sülfonilüre tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 225 | 225 | 216 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,15 | 8,07 | 8,1 |
Başlangıca göre değişiklik | -0,17 | -0,82 | -0,77 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,64* (-0,79, -0,49) | -0,59* (-0,74, -0,44) |
N | 216 | 209 | 202 |
Başlangıç HbA1c değeri ≥% 7 olan hastalarda, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
9,3 |
26,3 |
32,2 |
N | 225 | 225 | 216 |
Vücut ağırlığı(kg) | |||
Başlangıç (ortalama) | 76,23 | 77,08 | 77,5 |
Başlangıca göre değişiklik | -0,39 | -2,16 | -2,39 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,76* (-2,25, -1,28) | -1,99* (-2,48, -1,5) |
N | 225 | 225 | 216 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 128,8 | 128,7 | 129,3 |
Başlangıca göre değişiklik | -1,4 | -4,1 | -3,5 |
Plaseboya göre farklılık (% 95 GA) |
| -2,7 (-4,6, -0,8) | -2,1 (-4, -0,2) |
Pioglitazon +/- metformin tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 165 | 165 | 168 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,16 | 8,07 | 8,06 |
Başlangıca göre değişiklik | -0,11 | -0,59 | -0,72 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,48* (-0,69, -0,27) | -0,61* (-0,82, -0,4) |
N | 155 | 151 | 160 |
Başlangıç HbA1c değeri ≥% 7 olan hastalarda, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
7,7 |
24 |
30 |
N | 165 | 165 | 168 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 78,1 | 77,97 | 78,93 |
Başlangıca göre değişiklik | 0,34 | -1,62 | -1,47 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,95* (-2,64, -1,27) | -1,81* (-2,49, -1,13) |
N | 165 | 165 | 168 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 125,7 | 126,5 | 126 |
Başlangıca göre değişiklik | 0,7 | -3,1 | -4 |
Plaseboya göre farklılık (% 95 GA) |
| -3,9 (-6,23, -1,5) | -4,7 (-7,08, -2,37) |
GA: Güven Aralığı
* p-değeri <0,0001
Daha önce ilaç tedavisi almamış hastalarda metformin ile kombinasyon
Daha önce ilaç tedavisi almamış hastalarda empagliflozinin etkililiğini ve güvenliliğini değerlendirmek için 24 hafta süreli faktöriyel tasarımlı bir çalışma yürütülmüştür. Metformin ile kombine empagliflozin tedavisi (günde iki kez verilen 5 mg ve 500 mg; 5 mg ve 1000 mg; 12,5 mg ve 500 mg, 12,5 mg ve 1000 mg), HbA1c değerlerinde istatistiksel olarak anlamlı iyileşmeler sağlamış (Tablo 54) ve APG değerleri (bileşenlerin her biri ile tek tek karşılaştırıldığında) ve vücut ağırlığında (metforminle karşılaştırıldığında) daha fazla azalmaya neden olmuştur.
Tablo 5: Metformin ve empagliflozin kombinasyonunu her bir bileşen ile karşılaştıran 24. haftadaki etkililik sonuçlarıa
| Empagliflozin 10 mg | Empagliflozin 25 mg | Metformin | |||||
| + Met 1000 mgc | + Met 2000 mgc | Met yok | + Met 1000 mgc | + Met 2000 mgc | Met yok | 1000 mg | 2000 mg |
N | 161 | 167 | 169 | 165 | 169 | 163 | 167 | 162 |
HbA1c (%) | ||||||||
Başlangıç (ortalama) | 8,68 | 8,65 | 8,62 | 8,84 | 8,66 | 8,86 | 8,69 | 8,55 |
Başlangıca göre değişiklik | -1,98 | -2,07 | -1,35 | -1,93 | -2,08 | -1,36 | -1,18 | -1,75 |
Karşılaştırmaya karşı empa (% 95 GA) | -0,63* (-0,86, -0,4) | -0,72* (-0,96, -0,49) |
| -0,57* (-0,81, -0,34) | -0,72* (-0,95, -0,48) |
|
|
|
Karşılaştırmaya karşı met (% 95 GA) | -0,79* (-1,03, -0,56) | -0,33* (-0,56, -0,09) |
| -0,75* (-0,98, -0,51) | -0,33* (-0,56, -0,1) |
|
|
|
Met = Metformin; empa = Empagliflozin
* HbA1c için p ≤0,0062
Metformin ve linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda empagliflozin Metformin ve 5 mg linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda, gerek empagliflozin 10 mg, gerekse empagliflozin 25 mg ile uygulanan tedavi, plaseboyla karşılaştırıldığında, HbA1c düzeylerinde ve vücut ağırlığında istatistiksel olarak anlamlı (p<0,0001) azalmayla sonuçlanmıştır (Tablo 6). Ek olarak, APG, sistolik ve diyastolik kan basıncında da, plaseboya göre klinik olarak anlamlı düşüş sağlamıştır.
Tablo 6: Metformin ve linagliptin 5 mg tedavisi ile yeterli kontrol sağlanamayan hastalarda 24 hafta süreli plasebo kontrollü bir çalışmanın etkililik sonuçları
Metformin ve linagliptin 5 mg tedavisine ekleme tedavisi | |||
| Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 106 | 109 | 110 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,96 | 7,97 | 7,97 |
Başlangıca göre değişiklik | 0,14 | -0,65 | -0,56 |
Plaseboya göre farklılık (% 95 GA) |
| -0,79* (-1,02, -0,55) | -0,7* (-0,93, -0,46) |
N | 100 | 100 | 107 |
Başlangıç HbA1c değeri ≥% 7 olan hastalardan, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
17 |
37 |
32,7 |
N | 106 | 109 | 110 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 82,3 | 88,4 | 84,4 |
Başlangıca göre değişiklik | -0,3 | -3,1 | -2,5 |
Plaseboya göre farklılık (% 95 GA) |
| -2,8* (-3,5, -2,1) | -2,2* (-2,9, -1,5) |
N | 106 | 109 | 110 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 130,1 | 130,4 | 131 |
Başlangıca göre değişiklik | -1,7 | -3 | -4,3 |
Plaseboya göre farklılık (% 95 GA) |
| -1,3 (-4,2, 1,7) | -2,6 (-5,5, 0,4) |
*p değeri <0,0001
Başlangıç HbA1c değeri % 8,5 veya daha yüksek olan önceden belirlenmiş bir hasta alt grubunda, HbA1c değerinde 24. haftada başlangıca göre düşme oranı, plaseboya göre, empagliflozin 10 mg ve empagliflozin 25 mg ile -% 1,3 olmuştur (p<0,0001).
Metformine ekleme tedavisi olarak empagliflozin için 24 aylık veri - Glimepirid ile karşılaştırma
Tek başına metformin ile yeterli glisemik kontrolün sağlanamadığı hastalarda, empagliflozin 25 mg'ın etkililik ve güvenliliğini glimepirid (günde 4 mg'a kadar) ile karşılaştıran bir çalışmada, günlük empagliflozin tedavisi, glimeprid ile karşılaştırıldığında, HbA1c değerinde ortalamanın üzerinde bir azalma (Tablo 7) ve APG değerinde klinik olarak anlamlı bir azalma ile sonuçlanmıştır. Günlük empagliflozin tedavisi, glimepirid ile karşılaştırıldığında, vücut ağırlığında, sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir azalma sağlamış ve istatistiksel olarak anlamlı oranda daha az hastada hipoglisemik olaylar ortaya çıkmıştır (empagliflozin için % 2,5, glimepirid için % 24,2, p<0,0001).
Tablo 7: Metformine ekleme tedavisi olarak empagliflozin ile glimepiridi karşılaştıran bir aktif kontrollü çalışmanın 104. haftada etkililik sonuçlarıa
| Empagliflozin 25 mg | Glimepirid |
N | 765 | 780 |
HbA1c (%) | ||
Başlangıç (ortalama) | 7,92 | 7,92 |
Başlangıca göre değişiklik | -0,66 | -0,55 |
Glimepiride göre farklılık (% 97,5 GA) | -0,11* (-0,2, -0,01) |
|
N | 690 | 715 |
Başlangıç HbA1c ≥% 7 olan hastalardan, HbA1c <% 7 hedefine ulaşan hastaların yüzdesi | 33,6 | 30,9 |
N | 765 | 780 |
Vücut ağırlığı(kg) | ||
Başlangıç (ortalama) | 82,52 | 83,03 |
Başlangıca göre değişiklik | -3,12 | 1,34 |
Glimepiride göre farklılık (% 97,5 GA) | -4,46** (-4,87, -4,05) |
|
N | 765 | 780 |
SBP (mmHg) | ||
Başlangıç (ortalama) | 133,4 | 133,5 |
Başlangıca göre değişiklik | -3,1 | 2,5 |
Glimepiride göre farklılık (% 97,5 GA) | -5,6** (-7,-4,2) |
|
GA: Güven Aralığı
* Daha aşağı olmadığını (non-inferiority) kanıtlamak için p-değeri<0,0001 ve ortalamanın üzerinde için p-değeri= 0,0153
** p-değeri <0,0001
İnsüline ekleme tedavisi
Çoklu günlük dozda insülin tedavisine ekleme tedavisi olarak empagliflozin
Metformin tedavisi ile birlikte olan veya olmayan çoklu günlük dozdaki insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozinin etkililiği ve güvenliliği, çift kör, plasebo kontrollü, 52 hafta süreli bir çalışmada değerlendirilmiştir. İlk 18 hafta ve son 12 hafta boyunca, insülin dozu sabit tutulmuş ancak 19-40. haftalar arasında açlık glikoz düzeyleri
<100 mg/dL'ye [5,5 mmol/L] ve tokluk glikoz düzeyleri <140 mg/dL'ye [7,8 mmol/L] ulaşmak üzere ayarlanmıştır.
18. haftada empagliflozin, plaseboya göre, HbA1c düzeylerinde istatistiksel olarak anlamlı iyileşme sağlamıştır (Tablo 8).
52. haftada empagliflozin tedavisi, plaseboya göre, HbA1c düzeylerinde ve insülin kullanımında anlamlı bir azalma sağlamış ve APG değerinde düşme ve kilo kaybı ile sonuçlanmıştır.
Tablo 8: Metformin ile birlikte veya birlikte olmayan çoklu günlük dozlardaki insüline ekleme tedavisi olarak kullanılan empagliflozin için yürütülen plasebo kontrollü bir çalışmada 18. ve
52. haftadaki etkililik sonuçları
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 188 | 186 | 189 |
18. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,33 | 8,39 | 8,29 |
Başlangıca göre değişiklik | -0,5 | -0,94 | -1,02 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,44* (-0,61, -0,27) | -0,52* (-0,69, -0,35) |
N | 115 | 119 | 118 |
52. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,25 | 8,4 | 8,37 |
Başlangıca göre değişiklik | -0,81 | -1,18 | -1,27 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,38*** (-0,62, -0,13) | -0,46* (-0,7, -0,22) |
N | 113 | 118 | 118 |
52. haftada başlangıç HbA1c ≥% 7 olan hastalarda, HbA1c <% 7 hedefine ulaşan hastaların yüzdesi |
26,5 |
39,8 |
45,8 |
N | 115 | 118 | 117 |
52. haftada insulin dozu (İÜ/gün) | |||
Başlangıç (ortalama) | 89,94 | 88,57 | 90,38 |
Başlangıca göre değişiklik | 10,16 | 1,33 | -1,06 |
Plaseboya göre farklılık (% 97,5 GA) |
| -8,83# (-15,69, -1,97) | -11,22** (-18,09, -4,36) |
N | 115 | 119 | 118 |
52. haftada vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 96,34 | 96,47 | 95,37 |
Başlangıca göre değişiklik | 0,44 | -1,95 | -2,04 |
Plaseboya göre farklılık (% 97,5 GA) |
| -2,39* (-3,54, -1,24) | -2,48* (-3,63, -1,33) |
GA: Güven Aralığı
<140 mg/dl (7,8 mmol/l)) hedefine ulaşmak için insülin dozu ayarlamasına yönelik hedefe yönelik tedavi rejimi
* p-değeri <0,0001
** p-değeri= 0,0003
*** p-değeri= 0,0005
# p-değeri= 0,004
Bazal insülin tedavisine ekleme tedavisi olarak empagliflozin
Metformin ve/veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 78 hafta süreli bir çift kör, plasebo kontrollü çalışmada değerlendirilmiştir. İlk 18 haftada insülin dozu sabit tutulmuş, ancak sonraki 60 hafta süresince APG <110 mg/dL düzeylerini sağlamak üzere ayarlanmıştır.
18. haftada empagliflozin, HbA1c düzeylerini istatistiksel olarak anlamlı oranda iyileştirmiştir (Tablo 9).
78. haftada empagliflozin, plasebo ile karşılaştırıldığında, HbA1c değerinde ve insülin kullanımında istatistiksel olarak anlamlı bir azalma oluşturmuştur. Ayrıca empagliflozin, APG, vücut ağırlığı ve kan basıncında da düşüş sağlamıştır.
Tablo 9: Metformin veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozin için yürütülen bir plasebo kontrollü çalışmanın 18. ve 78. haftalardaki etkililik sonuçlarıa
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 mg |
N | 125 | 132 | 117 |
18. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,1 | 8,26 | 8,34 |
Başlangıca göre değişiklik | -0,01 | -0,57 | -0,71 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,56* (-0,78, -0,33) | -0,7* (-0,93, -0,47) |
N | 112 | 127 | 110 |
78. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,09 | 8,27 | 8,29 |
Başlangıca göre değişiklik | -0,02 | -0,48 | -0,64 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,46* (-0,73, -0,19) | -0,62* (-0,9, -0,34) |
N | 112 | 127 | 110 |
78. haftada bazal insülin dozu (İÜ/gün) |
|
|
|
Başlangıç (ortalama) | 47,84 | 45,13 | 48,43 |
Başlangıca göre değişiklik | 5,45 | -1,21 | -0,47 |
Plaseboya göre farklılık (% 97,5 GA) |
| -6,66** (-11,56, -1,77) | -5,92** (-11, -0,85) |
GA: Güven Aralığı
* p-değeri <0,0001
** p-değeri <0,025
Renal yetmezliği olan hastalar, 52 hafta süreli plasebo kontrollü veriler
Renal yetmezliği olan hastalarda antidiyabetik tedaviye ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 52 hafta süreli, çift kör plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozin tedavisi, plasebo ile karşılaştırıldığında, 24. haftada, HbA1c düzeylerinde istatistiksel olarak anlamlı bir azalma (Tablo 10) ve APG değerlerinde klinik olarak anlamlı bir iyileşme ile sonuçlanmıştır. HbA1c, vücut ağırlığı ve kan basıncındaki iyileşmeler 52. haftaya kadar devam etmiştir.
Tablo 10: Renal bozukluğu olan tip-2 diyabet hastalarında plasebo kontrollü bir empagliflozin çalışmasında 24. hafta sonuçlarıa
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 mg | Plasebo | Empagliflozin 25 mg |
eGFR ≥60 - <90 mL/dk/1,73 m² | eGFR ≥ 30 - <60 mL/dk/1,73 m² | ||||
N | 95 | 98 | 97 | 187 | 187 |
HbA1c (%) | |||||
Başlangıç (ortalama) | 8,09 | 8,02 | 7,96 | 8,04 | 8,03 |
Başlangıca göre değişiklik | 0,06 | -0,46 | -0,63 | 0,05 | -0,37 |
Plaseboya göre farklılık (% 95 GA) |
| -0,52* (-0,72, -0,32) | -0,68* (-0,88, -0,49) |
| -0,42* (-0,56, -0,28) |
N | 89 | 94 | 91 | 178 | 175 |
Başlangıç HbA1c ≥% 7 olan hastalarda, HbA1c <% 7 hedefine ulaşan hastaların yüzdesi | 6,7 | 17 | 24,2 | 7,9 | 12 |
N | 95 | 98 | 97 | 187 | 187 |
Vücut ağırlığı (kg) | |||||
Başlangıç (ortalama) | 86 | 92,05 | 88,06 | 82,49 | 83,22 |
Başlangıca göre değişiklik | -0,33 | -1,76 | -2,33 | -0,08 | -0,98 |
Plaseboya göre farklılık (% 95 GA) |
| -1,43 (-2,09, -0,77) | -2 (-2,66, -1,34) |
| -0,91 (-1,41, -0,41) |
N | 95 | 98 | 97 | 187 | 187 |
SBP (mmHg) | |||||
Başlangıç (ortalama) | 134,69 | 137,37 | 133,68 | 136,38 | 136,64 |
Başlangıca göre değişiklik | 0,65 | -2,92 | -4,47 | 0,4 | -3,88 |
Plaseboya göre farklılık (% 95 GA) |
| -3,57 (-6,86, -0,29) | -5,12 (-8,41, -1,82) |
| - 4,28 (-6,88, -1,68) |
GA: Güven Aralığı
* p <0,0001
Kardiyovasküler sonuçlar
Çift kör, plasebo kontrollü EMPA-REG OUTCOME çalışması, tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olan hastalarda, standart bakım tedavisine ek olarak uygulanan empagliflozin 10 mg ve empagliflozin 25 mg'ın havuzda toplanmış dozlarını plasebo ile karşılaştırmıştır. Toplam 7.020 hasta tedavi edilmiş (empagliflozin 10 mg: 2.345, empagliflozin 25 mg: 2.342, plasebo: 2.333) ve medyan 3,1 yıl süreyle takip edilmiştir. Ortalama yaş 63, ortalama HbA1c % 8,1'dir ve hastaların % 71,5'i erkektir. Başlangıçta hastaların % 74'ü metformin, % 48'i insülin ve % 43'ü bir sülfonilüre ile tedavi edilmiştir.
Hastaların yaklaşık yarısının (% 52,2) eGFR değeri 60-90 mL/dk/1,73 m2, % 17,8'nin 45-60 mL/dk/1,73 m2 ve % 7,7'sinin 30-45 mL/dk/1,73 m2 olarak belirlenmiştir.
12. haftada HbA1c'de uyarlanmış ortalamadaki (SE) iyileşme, plasebo grubu için başlangıçtaki % 0,11 (0,02) değeri ile karşılaştırıldığında, empagliflozin 10 mg grubunda % 0,65 (0,02) ve empagliflozin 25 mg grubunda % 0,71 (0,02) olarak gözlenmiştir. İlk 12 haftadan sonra glisemik kontrol, araştırmacı tedaviden bağımsız olarak optimize edilmiştir. Bu nedenle etki 94. haftada azaltılmış, HbA1c değerindeki uyarlanmış ortalama iyileşme, plasebo grubunda % 0,08 (0,02), empagliflozin 10 mg grubunda % 0,5 (0,02) ve empagliflozin 25 mg
grubunda % 0,55 (0,02) bulunmuştur.
Empagliflozin, birincil kombine sonlanım noktası olan kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmenin önlenmesinde , plaseboya göre üstün bulunmuştur. Tedavi etkisi, kardiyovasküler ölümde anlamlı bir azalma ile sağlanmış, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede anlamlı bir değişiklik olmamıştır. Kardiyovasküler ölümdeki azalma, empagliflozin 10 mg ve empagliflozin 25 mg için karşılaştırılabilir bulunmuştur (Şekil 1) ve genel yaşam süresindeki iyileşme ile de doğrulanmıştır (Tablo 11). EMPA-REG OUTCOME çalışmasında empagliflozinin kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede birincil birleşik sonlanım noktası üzerindeki etkisi, glisemik kontrolden veya renal fonksiyonundan (eGFR) büyük ölçüde bağımsız olmuştur ve genel olarak 30 ml/dakika/1,73m2 eGFR değerine kadar inen eGFR kategorileri arasında tutarlı olmuştur.
Kardiyovasküler mortaliteyi önlemedeki etkililiği, empagliflozin ile birlikte DPP-4 inhibitörü kullanan hastalarda veya siyah ırktan olanlarda tam olarak belirlenmemiştir, çünkü bu grupların EMPA-REG OUTCOME çalışmasındaki temsil edilme düzeyleri sınırlıdır.
Tablo 11: Birincil bileşik sonlanım noktası için tedavi etkisi, bileşenleri ve mortalitea
| Plasebo | Empagliflozin |
N | 2.333 | 4.687 |
İlk KV ölüm, fatal olmayan MI veya fatal olmayan inme olayına kadar geçen süre N (% ) | 282 (12,1) | 490 (10,5) |
Tehlike oranı, plaseboya karşı (% 95,.02 GA)* |
| 0,86 (0,74, 0,99) |
Üstünlük için p değeri |
| 0,0382 |
KV ölüm N (% ) | 137 (5,9) | 172 (3,7) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,62 (0,49, 0,77) |
p değeri |
| <0,0001 |
Fatal olmayan MI N (% ) | 121 (5,2) | 213 (4,5) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,87 (0,7, 1,09) |
p değeri |
| 0,2189 |
Fatal olmayan inme N (% ) | 60 (2,6) | 150 (3,2) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 1,24 (0,92, 1,67) |
p değeri |
| 0,1638 |
Tüm nedenlere bağlı mortalite N (% ) | 194 (8,3) | 269 (5,7) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,68 (0,57, 0,82) |
p değeri |
| <0,0001 |
KV olmayan mortalite N (% ) | 57 (2,4) | 97 (2,1) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,84 (0,6, 1,16) |
KV: Kardiyovasküler, MI: Miyokard enfarktüsü
* Çalışmadan elde edilen veriler bir ara analize dahil edildiği için, anlamlılık için 0,0498'den düşük bir p değerine karşılık gelen bir iki yanlı % 95,02 güven aralığı uygulanmıştır.
Şekil 1 - EMPA-REG OUTCOME çalışmasında kardiyovasküler ölüme kadar geçen
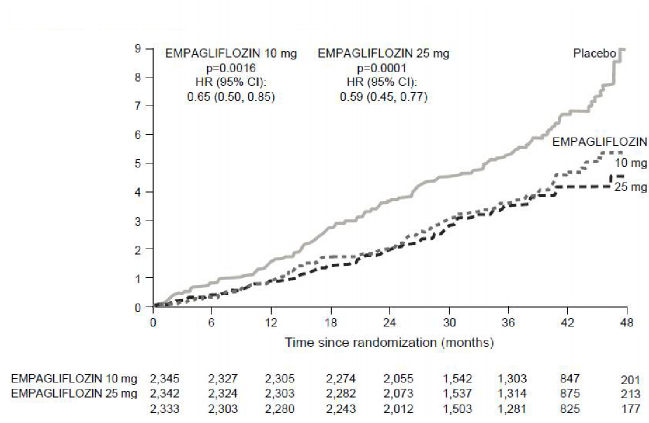
Her bir empagliflozin dozuna karşılık plasebo
Risk altında olanların sayısı
Plasebo
Randamizasyondan itibaren geçen zaman (ay)
EMPAGLIFLOZIN 10 mg EMPAGLIFLOZIN 25 mg
p=0,0016 p=0,0001
TO (% 95 GA) TO (% 95 GA)
0,55 (0,50, 0,85) 0,59 (0,45, 0,77)
Plasebo
Tıbbi durum yaşayan hasta (%)
zaman
Hastaneye yatış gerektiren kalp yetmezliği
EMPA-REG OUTCOME çalışmasında, empagliflozin plasebo ile karşılaştırıldığında, hastaneye yatış gerektiren kalp yetersizliği riskini düşürmüştür (empagliflozin % 2,7, plasebo
% 4,1; TO (Tehlike Oranı) 0,65, % 95 GA = 0,5, 0,85).
Nefropati
EMPA-REG OUTCOME çalışmasında, ilk nefropati olayına kadar olan süre boyunca, empagliflozine (% 12,7) kıyasla plasebo (18,8) için TO 0,61 (% 95 GA 0,53, 0,7) olmuştur.
Ayrıca, empagliflozin (% 49,7) plaseboya kıyasla (% 28,8), başlangıçta makroalbuminürisi olan hastalarda, daha yüksek (TO 1,82, % 95 GA 1,40, 2,37) sürekli normo- veya mikro- albüminüri oluşumu göstermiştir.
Açlık plazma glikozu
4 adet plasebo kontrollü çalışmada, empagliflozin monoterapisi veya metformin, pioglitazon veya metformin + bir sülfonilüre tedavisine ekleme tedavisi, APG değerinde başlangıca göre, plasebo (7,4 mg/dL [0,41 mmol/L]) ile karşılaştırıldığında, empagliflozin 10 mg için -20,5
mg/dL [-1,14 mmol/L], empagliflozin 25 mg için -23,2 mg/dL [-1,29 mmol/L] ortalama değişiklikle sonuçlanmıştır. Bu etki 24 haftadan sonra gözlenmiştir ve 76 hafta süresince
devam etmiştir.
2 saatlik tokluk glikozu
Metformin veya metformin + bir sülfonilüre tedavisine ekleme olarak empagliflozin tedavisi,
24. haftada, 2 saatlik tokluk glikoz düzeylerinde (yemek tolerans testi) klinik olarak anlamlı bir düşme sağlamıştır (metformine ekleme: Plasebo +5,9 mg/dL, empagliflozin 10 mg: -46 mg/dL, empagliflozin 25 mg: -44,6 mg/dL, metformin + bir sülfonilüre tedavisine ekleme: Plasebo -2,3 mg/dL, empagliflozin 10 mg: -35,7 mg/dL, empagliflozin 25 mg: -36,6 mg/dL).
Başlangıç HbA1c>% 10 (yüksek) olan hastalar
3 Faz III çalışmasının önceden tanımlanan havuzda toplanmış analizinde, şiddetli hiperglisemisi olan (N=184, ortalama başlangıç HbA1c % 11,15) hastalarda, açık etiketli empagliflozin 25 mg tedavisi, 24. haftada, HbA1c değerinde, başlangıca göre % 3,27 oranındaki klinik olarak anlamlı bir azalma ile sonuçlanmıştır. Bu çalışmalara plasebo veya empagliflozin 10 mg kolları dahil edilmemiştir.
Vücut ağırlığı
Plasebo-kontrollu dört çalışmanın önceden tanımlanmış, havuzda toplanmış analizinde, empagliflozin tedavisi, 24. haftada vücut ağırlığında azalma ile sonuçlanmış (plasebo için - 0,24 kg, empagliflozin 10 mg için -2,04 kg ve empagliflozin 25 mg için -2,26 kg) ve 52. haftaya kadar (plasebo için -0,16 kg, empagliflozin 10 mg için -1,96 kg ve empagliflozin 25 mg için - 2,25 kg) devam etmiştir.
Kan basıncı
Empagliflozinin etkililiği ve güvenliliği, çeşitli antidiyabetik tedavi alan ve en fazla 2 antihipertansif ilacı kullanan kan basıncı yüksek tip-2 diyabetli hastalarda 12 hafta süreyle yürütülen çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozinin günde bir kez uygulanması ile yapılan tedavi, HbA1c değerinde ve ambulatuvar kan basıncı izlenmesi ile tespit edilen 24 saatlik ortalama sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir iyileşme ile sonuçlanmıştır (Tablo 12). Empagliflozin tedavisi, otururken ölçülen SBP (Sistolik Kan Basıncı) ve DBP (Diyastolik Kan Basıncı)'de azalmalar sağlamıştır.
Tablo 12: Kan basıncı kontrol altında olmayan tip-2 diyabetli hastalarda, empagliflozinin plasebo kontrollü bir çalışmasında 12. haftadaki etkililik sonuçlarıa
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 271 | 276 | 276 |
12. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,87 | 7,92 |
Başlangıca göre değişiklik | 0,03 | -0,59 | -0,62 |
Plaseboya göre farklılık (% 95 GA) |
| -0,62* (-0,72, -0,52) | -0,65*
(-0.,75, -0,55) |
12. haftada 24 saatlik SBP | |||
Başlangıç (ortalama) | 131,72 | 131,34 | 131,18 |
Başlangıca göre değişiklik | 0,48 | -2,95 | -3,68 |
Plaseboya göre farklılık (% 95 GA) |
| -3,44* (-4,78, -2,09) | -4,16* (-5,5, -2,83) |
12. haftada 24 saatlik DBP | |||
Başlangıç (ortalama) | 75,16 | 75,13 | 74,64 |
Başlangıca göre değişiklik | 0,32 | -1,04 | -1,4 |
Plaseboya göre farklılık5 (% 95 GA) |
| -1,36** (-2,15, -0,56) | -1,72* (-2,51, -0,93) |
GA: Güven aralığı
* p-değeri <0,0001
** p-değeri <0,001
Plasebo kontrollü 4 çalışmanın önceden tanımlanmış havuzda toplanmış analizinde, empagliflozin tedavisi, 24. haftada, plasebo (-0,5 mmHg) ile karşılaştırıldığında, sistolik kan basıncında (empagliflozin 10 mg: -3,9 mmHg; empagliflozin 25 mg: -4,3 mmHg) ve diyastolik
kan basıncında (plasebo: -0,5 mmHg; empagliflozin 10 mg: -1,8 mmHg; empagliflozin 25 mg:
-2 mmHg) azalma ile sonuçlanmış ve bu etki 52. haftaya kadar devam ettirilmiştir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı (European Medicine Agency-EMA), JARDIANCE ile tip-2 diyabeti olan pediyatrik popülasyonun bir veya daha fazla alt grubunda yapılan çalışmaların sonuçlarını sunma zorunluluğunu ertelemiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2).
Avrupa İlaç Ajansı (European Medicine Agency-EMA), JARDIANCE ile kalp yetmezliği olan pediyatrik popülasyonun alt gruplarında yapılan çalışmaların sonuçlarını sunma zorunluluğunu ertelemiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Empagliflozinin farmakokinetiği, sağlıklı gönüllülerde ve tip-2 diyabetli hastalarda ayrıntılı olarak tanımlanmıştır. Oral uygulamadan sonra, empagliflozin, ortalama t1,5 saatte meydana gelen pik plazma konsantrasyonları ile hızlı bir şekilde emilir. Sonrasında, plazma konsantrasyonları hızlı bir dağılım fazı ile bifazik tarzda azalır ve terminal fazı göreceli olarak yavaştır. Kararlı durum ortalama plazma EAA ve Cdeğerleri, günde bir kez empagliflozin 10 mg için 1870 nmol.saat/L ve 259 nmol/L ve empagliflozin 25 mg için 4740 nmol.saat/L ve 687 nmol/L'dir. Empagliflozinin sistemik maruziyeti dozla orantılı şekilde artar. Empagliflozinin tek doz ve kararlı durum farmakokinetik parametreleri benzerdir, bu durum zamana göre lineer farmakokinetiği düşündürür. Sağlıklı gönüllülerle tip-2 diyabetli hastalar arasında empagliflozin farmakokinetiği açısından klinik olarak anlamlı bir farklılık yoktur.
Yüksek oranda yağlı ve yüksek kalorili bir yemekten sonra empagliflozin 25 mg alınması, hafif oranda daha düşük bir maruziyetle sonuçlanmıştır. Açlık koşulları ile karşılaştırıldığında, EAA yaklaşık % 16 oranında ve Cyaklaşık % 37 oranında azalmıştır. Yiyeceklerin empagliflozin farmakokinetiği üzerinde gözlenen etkileri, klinik olarak anlamlı kabul edilmez,
empagliflozin yiyeceklerle birlikte veya ayrı olarak kullanılabilir.
Dağılım:
Görünür kararlı durum dağılım hacmi, popülasyon farmakokinetik analizlerine dayanarak, 73,8 L olarak tahmin edilmiştir. Sağlıklı gönüllülere oral [14C]-empagliflozin çözeltisi uygulanmasını takiben kırmızı kan hücre parçalanması yaklaşık % 37 ve plazma protein bağlanması % 86 bulunmuştur.
Biyotransformasyon:
Empagliflozinin insan plazmasında majör bir metaboliti belirlenmemiştir ve en belirgin metabolitleri 3 glukuronid konjugatıdır (2-,3- ve 6-O glukuronid). Her metabolitin sistemik maruziyeti, ilaca bağlı toplam materyalin % 10'undan daha azdır. In vitro çalışmalar, empagliflozinin insanlardaki birincil metabolizma yolunun, üridin 5ï¢-difosfo-glukuronosil transferazlar UGT2B7, UGT1A3, UGT1A8 ve UGT1A9 aracılığı ile glukuronidasyon olduğunu düşündürmektedir.
Eliminasyon:
Popülasyon farmakokinetik analizlere dayanarak, empagliflozinin görünür terminal yarılanma ömrü 12,4 saat olarak tahmin edilmiştir, görünür oral klerensi 10,6 L/saattir. Empagliflozin oral klerensi açısından kişiler arası ve rezidüel değişkenlikler sırası ile % 39,1 ve % 35,8'dir. Günde bir kez verilen dozla, empagliflozinin kararlı durum plazma konsantrasyonlarına 5. dozla ulaşılmıştır. Yarı ömrü ile uyumlu olarak, kararlı durumda, plazma EAA açısından % 22'ye kadar birikim gözlenmiştir. Oral [14C]-empagliflozin çözeltisinin sağlıklı gönüllülere uygulanmasından sonra, ilaçla ilişkili radyoaktivitenin yaklaşık % 96'sı, feçes (% 41) veya idrarla (% 54) atılmıştır. Feçeste geri kazanılan ilaçla ilişkili radyoaktivitenin büyük bir kısmı değişmemiş ana ilaç olmuştur ve idrarla atılan ilaçla ilişkili radyoaktivitenin yaklaşık yarısı değişmemiş ana ilaç olmuştur.
Hastalardaki karakteristik özellikler
Renal yetmezlik
![]()
Hafif, orta ve şiddetli renal bozukluğu olan hastalarda (eGFR<30 - <90 mL/dk/1,.73 m2) ve böbrek yetmezliği /son dönem böbrek yetmezliği (ESRD) olan hastalarda, renal fonksiyonları normal olan hastalarla karşılaştırıldığında, empagliflozinin EAA değerleri sırasıyla, yaklaşık olarak, % 18, % 20, % 66 ve % 48 oranında artmıştır. Empagliflozinin pik plazma düzeyleri, orta dereceli renal bozukluğu ve böbrek yetmezliği/ESRD hastaları ile renal fonksiyonları normal olan hastalar arasında benzerdir. Empagliflozinin pik plazma düzeyleri, hafif ve şiddetli renal bozukluğu olan hastalarda, renal fonksiyonları normal olan hastalara göre, kabaca % 20 oranında daha yüksektir. Popülasyon farmakokinetik analizi, empagliflozinin görünür oral klerensinin, eGFR değerindeki azalma ile azaldığını, bunun da ilaç maruziyetinde yükselmeye neden olduğunu göstermiştir.
Hepatik yetmezlik
Child-Pugh sınıflandırmasına göre hafif, orta ve şiddetli hepatik bozukluğu olan hastalarda empagliflozinin EAA değeri, hepatik fonksiyonları normal olan hastalara göre, sırasıyla yaklaşık % 23, % 47 ve % 75, Cdeğeri ise yaklaşık % 4, % 23 ve % 48 artmıştır.
Vücut kitle indeksi
Popülasyon farmakokinetik analizlerine dayanarak, vücut kitle indeksinin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır. Bu analizde EAA
değerinin, BMI 25 kg/m2 olanlara göre, BMI 30, 35, ve 45 kg/m2 olan kişilerde sırası ile %
5,82, % 10,4 ve % 17,3 daha düşük olduğu tahmin edilmiştir.
Cinsiyet
Popülasyon farmakokinetik analizlerine dayanarak, cinsiyetin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi yoktur.
Irk
Popülasyon farmakokinetik analizlerinde, EAA değerinin, BMI 25 kg/m2 olan Asyalılarda, aynı BMI değerine sahip Asyalı olmayanlarla karşılaştığında, % 13,5 oranında daha yüksek olduğu tahmin edilmiştir.
Geriyatrik popülasyon
Popülasyon farmakokinetik analizlerine dayanarak, yaşın empagliflozinin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır.
Pediyatrik popülasyon
Bir pediyatrik Faz 1 çalışması, empagliflozinin (5 mg, 10 mg ve 25 mg) farmakokinetiğini ve farmakodinamiğini, Tip 2 diabetes mellitus hastası çocuklar ve ≥10 - <18 yaşlarındaki adolesanlarda araştırmıştır. Gözlenen farmakokinetik ve farmakodinamik yanıtlar, erişkin gönüllülerden elde edilen bilgilerle tutarlı bulunmuştur.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, genotoksisite, fertilite ve erken embriyonik gelişimle ilgili klasik
çalışmalardaki klinik dışı veriler insanlar için özel bir tehlike göstermemiştir.
Köpeklerde ve kemirgenlerde yapılan uzun dönem toksisite çalışmalarında, empagliflozinin klinik dozunun 10 katına eşit veya daha yüksek maruziyetlerinde toksisite belirtileri gözlenmiştir. Toksisitenin çoğu, vücut ağırlığı ve vücut yağ düzeyinde azalma, yiyecek tüketiminde artış, diyare, dehidratasyon, serum glikoz düzeyinde azalmayı da kapsayan idrarda glikoz kaybı ve elektrolit dengesizlikleri, protein metabolizmasındaki ve glikoneogenezdeki artışla görülen diğer serum proteinlerinde yükselme, poliüri ve glikozüri gibi idrar değişiklikleri ve böbreklerle bazı yumuşak ve vasküler dokuların mineralizasyonunu da içeren mikroskobik değişiklikler ile ilişkili ikincil farmakoloji ile uyumludur. Bazı türlerde, empagliflozinin 25 mg ile ilişkili olarak, empagliflozinin klinik EAA maruziyetinin yaklaşık
4 katında, böbrekler üzerindeki, abartılı farmakolojik etkilerin mikroskobik kanıtları gözlenmiştir. Bu kanıtlar arasında, tübüler dilatasyon ve tübüler ve pelvik mineralizasyon bulunur.
Empagliflozin genotoksik değildir.
2 yıl süreli bir karsinojenite çalışmasında empagliflozin, dişi sıçanlarda, maksimum klinik empagliflozin EAA maruziyetinin 72 kat fazlasına karşılık gelen, 700 mg/kg/gün düzeyindeki en yüksek doza kadar, tümör insidansını arttırmamıştır. Erkek sıçanlarda, en yüksek dozda, mezenterik lenf nodlarında, tedaviye bağlı benign vasküler proliferatif lezyonları (hemanjiyomlar) gözlenmiştir. Ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 26 katına karşılık gelen 300 mg/kg/gün dozda bu etki gözlenmemiştir. Sıçanlarda, 300 mg/kg/gün ve üzerindeki dozlarda, testislerde interstisyel hücre tümörleri daha yüksek insidansta gözlenmiş, empagliflozinin maksimum klinik maruziyetinin yaklaşık 18 katına
karşılık gelen 100 mg/kg/gün dozda ise gözlenmemiştir. Her iki tümör de sıçanlarda yaygındır ve insanlarla ilişkili olması beklenmez.
Empagliflozin, dişi farelerde, maksimum klinik maruziyetinin yaklaşık 62 katına karşılık gelen 1000 mg/kg/gün doza kadar tümör insidansını arttırmamıştır. Erkek farelerde 1000 mg/kg/gün dozda renal tümörleri indüklemiştir, ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 11 katına karşılık gelen 300 mg/kg/gün dozda bu indükleme görülmemiştir. Bu tümörlerin etki mekanizması, erkek farelerin renal patolojiye doğal predispozisyonuna ve bir metabolik yolağa bağlı olup, insanlarda karşılığı yoktur. Erkek farelerdeki renal tümörler insanlarla ilişkili bulunmamıştır.
İnsanlarda, terapötik dozlardan sonraki maruziyetin yeterli derecedeki maruziyet miktarlarında, empagliflozinin fertilite veya erken embriyolojik gelişme üzerinde herhangi bir advers etkisi olmamıştır. Organogenez dönemi sırasında verilen empagliflozinin teratojen etkisi saptanmamıştır. Sadece maternal olarak toksik dozlarda verildiğinde empagliflozin, sıçanlarda kaburga kemiklerinde eğriliğe ve tavşanlarda embriyofetal kayıplarda artışa neden olmuştur.
Sıçanlarda yapılan pre- ve postnatal toksisite çalışmalarında, empagliflozine maksimum klinik maruziyetin yaklaşık 4 katındaki maternal maruziyetlerde, yavruların kilo alımında azalma gözlenmiştir. Empagliflozine maksimum klinik maruziyete eşdeğer bir sistemik maruziyette böyle bir etki gözlenmemiştir. Bu bulguların insanlarla ilişkisi belirsizdir.
Sıçanlarda yapılan bir juvenil toksisite çalışmasında, postnatal 21. günden postnatal 90. güne kadar empagliflozin uygulanması halinde, juvenil sıçanlarda sadece maksimum klinik doz olan 25 mg'ın yaklaşık 11 katına karşılık gelen 100 mg/kg/gün dozlarda advers olmayan, minimal- hafif dereceli renal tübüler ve pelvik dilatasyon görülmüştür. İlaçsız 13 haftalık bir dönem sonrasında bu bulgular ortadan kalkmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (inek sütünden elde edilmiştir) Mikrokristalin selüloz
Hidroksipropil selüloz Kroskarmelloz sodyum Kolloidal anhidr silika Magnezyum stearat
Hipromelloz
Titanyum dioksid (E171) Talk
Makrogol (400)
Demir oksit, sarı (E 172)
6.2. Geçimsizlikler
Uygulanabilir değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC'nin altında oda sıcaklığında saklanır.
6.5. Ambalajın niteliği ve içeriği
PVC/aluminyum perfore birim doz blisterler.
Piyasaya 30 film tabletlik ambalaj büyüklükleri ile sunulur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâ ne uygun olarak imha edilmelidir.
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| EMPACROS | 8699514097846 | 581.24TL |
| EMPAFEL | 8699540030763 | 612.22TL |
| EMPALFO | 8680030190333 | 612.22TL |
| GLIFLOMED | 8680199007862 | 612.22TL |
| GLYZARDA | 8680080000415 | 612.22TL |
| Diğer Eşdeğer İlaçlar |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A16755 |
| Satış Fiyatı | 637.87 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 637.87 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693090126 |
| Etkin Madde | Empagliflozin |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |