JARDIANCE 25 mg film kaplı tablet Farmakolojik Özellikler
{ Empagliflozin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Sodyum-Glikoz Ko-Transporter 2 (SGLT2) İnhibitörleri ATC kodu: A10BK03
Etki mekanizması:
Empagliflozin, geri dönüşlü, oldukça potent (ICR1,3 nmol) ve seçici yarışmalı bir sodyum- glikoz ko-transporter 2 (SGLT-2) inhibitörüdür. Empagliflozin, glikozun periferik dokulara taşınması için önemli olan diğer glikoz taşıyıcılarını inhibe etmez ve bağırsakta glikoz absorpsiyonundan sorumlu majör taşıyıcı olan SGLT-2 için SGLT-1'e göre 5000 kat daha seçicidir. SGLT-2 böbrekte oldukça fazla eksprese edilir, diğer dokulardaki ekspresyonu ise ya yoktur ya da çok düşüktür. Asıl taşıyıcı olarak glikozun glomerüler filtrattan, dolaşıma reabsorbsiyonundan sorumludur. Tip-2 diyabeti ve hiperglisemisi olan hastalarda daha yüksek miktarda glikoz filtre edilir ve geri emilir.
Empagliflozin, tip 2 diyabet hastalarında renal glikoz geri emilimini azaltarak glisemik kontrolü iyileştirir. Böbreklerden bu gliküretik mekanizma aracılığı ile uzaklaştırılan glikoz miktarı, kan glikoz konsantrasyonuna ve GFR'ye bağımlıdır. Tip-2 diyabeti ve hiperglisemisi olan hastalarda SGLT-2 inhibisyonu, idrarda aşırı glikoz atılımına yol açar. Ayrıca, empagliflozin kullanımına başlanması, sodyum atılımını arttırır ve bu durum da osmotik diürez ve intravasküler hacmin azalması ile sonuçlanır.
Tip-2 diyabeti olan hastalarda, empagliflozinin ilk dozundan hemen sonra idrarda glikoz atılımı artar ve 24 saat süreli doz aralığı boyunca devam eder. 4 haftalık tedavi döneminin
sonunda, idrarda glikoz atılımda artış sağlanmıştır ve bu miktar, ortalama yaklaşık 78 g/gün olmuştur. Tip-2 diyabetli hastalarda idrarda glikoz atılımının artması, plazma glikoz düzeylerinin ani düşmesi ile sonuçlanmıştır.
Empagliflozin hem açlık hem de tokluk plazma glikoz düzeylerini iyileştirir. Empagliflozinin etki mekanizması beta hücrelerinin fonksiyonundan ve insülin yolağından bağımsızdır ve bu durum hipoglisemi riskinin düşük olmasına katkıda bulunur. Homeostaz Model Değerlendirmesi-ï¢ (HOMA-ï¢) dahil, beta hücre fonksiyonunun yerini tutan göstergelerde de iyileşme kaydedilmiştir. Ayrıca, idrar glikoz atılımı, vücut yağ kaybı ve vücut ağırlığının azalması ile bağlantılı olarak kalori kaybını tetikler. Empagliflozin ile gözlenen glikozüri, diürez ile seyreder, bu da kan basıncının sürekli bir şekilde orta derecede düşmesine katkıda bulunabilir.
Empagliflozin ayrıca sodyum geri emilimini azaltır ve distal tübüle ulaşan sodyum miktarını artırır. Bu durum: tübüloglomerüler geri beslemesinin artırılması ve intraglomerüler basıncın azaltılması, kalbin hem ön hem de ard yükünün düşürülmesi, sempatik aktivitenin azaltılması ve düşük NT-proBNP değerleri ve kardiyak yeniden modelleme , dolum basınçları ve diyastolik fonksiyon üzerindeki faydalı etkilerle kanıtlandığı üzere sol ventrikül duvar stresinin azaltılması dahil ancak bunlarla sınırlı olmamak üzere birkaç fizyolojik işlevi etkileyebilir.
Klinik etkililik ve güvenlilik Tip-2 diyabetes mellitus
Glisemik kontrolün iyileşmesi ve kardiyovasküler morbidite ve mortalitenin azalması, Tip 2 diyabet tedavisinin ayrılmaz bir parçasıdır.
12 çift kör, plasebo ve aktif kontrollü klinik çalışmada, Tip 2 diyabeti olan toplam 14.663 hastada glisemik etkililik ve kardiyovasküler sonuçlar değerlendirilmiştir. Bu çalışmalarda
9.295 hasta empagliflozin kullanmıştır (empagliflozin 10 mg: 4.165 hasta, empagliflozin 25 mg: 5.130 hasta). 5 çalışmanın süresi 24 haftadır. Bu çalışmaların uzatmalarında ve diğer çalışmalarda hastalar, 102 haftaya kadar sürelerle empagliflozin kullanmıştır.
Empagliflozinin monoterapi ve metformin, pioglitazon, bir sülfonilüre, DPP-4 inhibitörleri ve insülin ile kombine olarak kullanılması, HbA1c, açlık plazma glikozu (APG), vücut ağırlığı, sistolik ve diyastolik kan basıncında klinik olarak anlamlı iyileşmelere yol açmıştır. Empagliflozin 25 mg grubunda, empagliflozin 10 mg ve plasebo gruplarına göre, % 7'den daha düşük HbA1c düzeyi hedefine ulaşan hasta oranı daha yüksektir ve daha az sayıda hasta glisemik kurtarma tedavisine ihtiyaç duymuştur. Başlangıç HbA1c düzeyinin daha yüksek olması HbA1c düzeyinde daha fazla düşme ile ilişkili bulunmuştur. Ayrıca, standart bakım tedavisine ilave olarak uygulanan empagliflozin, Tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olanlarda kardiyovasküler mortaliteyi azaltmıştır.
Empagliflozinin monoterapi olarak etkililiği ve güvenliliği, daha önce tedavi edilmemiş hastalarda, çift kör, plasebo kontrollü ve aktif kontrollü 24 hafta süreli bir çalışmada değerlendirilmiştir. Empagliflozin ile tedavi, plasebo ile karşılaştırıldığında, HbA1c düzeyinde istatistiksel olarak anlamlı (p<0,0001) bir düşüşe (Tablo 3) ve APG değerlerinde klinik olarak önemli bir azalmaya yol açmıştır.
Başlangıç HbA1c değeri ≥% 8,5 olan hastaların (N=201) önceden tanımlanmış bir analizinde, HbA1c düzeyinde başlangıca göre azalma oranı, empagliflozin 10 mg için % -1,44, 25 mg için
% -1,43, sitagliptin için % -1,04'tür ve plasebo grubunda % 0,01 oranında artış olmuştur.
Bu çalışmanın çift kör, plasebo kontrollü uzatmasında, HbA1c değerinde azalma, kilo kaybı ve kan basıncında düşme 76 haftaya kadar devam etmiştir.
Tablo 3: 24 hafta süreli plasebo kontrollü empagliflozin monoterapisi çalışmasının etkililik sonuçlarıa
| Plasebo | JARDIANCE | Sitagliptin | |
10 mg | 25 mg | 100 mg | ||
N | 228 | 224 | 224 | 223 |
HbA1c (%) | ||||
Başlangıç (ortalama) | 7,91 | 7,87 | 7,86 | 7,85 |
Başlangıca göre değişiklik | 0,08 | -0,66 | -0.78 | -0,66 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,74* (-0,9, -0,57) | -0,85* (-1,01, -0,69) | -0,73 (-0,88, -0,59) |
N | 208 | 204 | 202 | 200 |
Başlangıç HbA1c değeri ≥% 7 olan hastalardan, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
12 |
35,3 |
43,6 |
37,5 |
N | 228 | 224 | 224 | 223 |
Vücut ağırlığı (kg) | ||||
Başlangıç (ortalama) | 78,23 | 78,35 | 77,8 | 79,31 |
Başlangıca göre değişiklik | -0,33 | -2,26 | -2,48 | 0,18 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,93* (-2,48, -1,38) | -2,15* (-2,7,-1,6) | 0,52 (-0,04, 1) |
N | 228 | 224 | 224 | 223 |
SBP (mmHg) | ||||
Başlangıç (ortalama) | 130,4 | 133 | 129,9 | 132,5 |
Başlangıca göre değişiklik | -0,3 | -2,9 | -3,7 | 0,5 |
Plaseboya göre farklılık (% 97,5 GA) |
| -2,6* (-5,2, -0) | -3,4* (-6, -0,9) | 0,8 (-1,4, 3,1) |
GA: Güven Aralığı SBP: Sistolik Kan Basıncı
*p-değeri<0,0001
Kombinasyon tedavisi
Metformin, sülfonilüre, pioglitazon tedavisine ekleme tedavisi olarak empagliflozin Metformin, metformin ve bir sülfonilüre veya metformin ile birlikte olan veya birlikte olmayan pioglitazon tedavisine ekleme tedavisi olarak empagliflozin kullanılması, HbA1c düzeylerinde ve vücut ağırlığında, plaseboya göre, istatistiksel olarak anlamlı (p<0,0001) azalmalarla sonuçlanmıştır (Tablo 4). Ayrıca, APG değerlerinde, sistolik ve diyastolik kan basıncında da, plaseboya göre, klinik olarak anlamlı azalmalar görülmüştür.
Bu çalışmaların çift kör, plasebo kontrollü uzatmalarında, HbA1c, vücut ağırlığı ve kan
basıncındaki azalmalar 76. haftaya kadar devam etmiştir.
Tablo 4: 24 hafta süreli plasebo kontrollü çalışmaların etkililik sonuçlarıa
Metformin tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 207 | 217 | 213 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,94 | 7,86 |
Başlangıca göre değişiklik | -0,13 | -0,7 | -0,77 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,57* (-0,72, -0,42) | -0,64* (-0,79, -0,48) |
N | 184 | 199 | 191 |
Başlangıç HbA1c değeri ≥% 7 olan hastalarda, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
12,5 |
37,7 |
38,7 |
N | 207 | 217 | 213 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 79,73 | 81,59 | 82,21 |
Başlangıca göre değişiklik | -0,45 | -2,08 | -2,46 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,63* (-2,17, -1,08) | -2,01* (-2,56, -1,46) |
N | 207 | 217 | 213 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 128,6 | 129,6 | 130 |
Başlangıca göre değişiklik | -0,4 | -4,5 | -5,2 |
Plaseboya göre farklılık (% 95 GA) |
| -4,1* (-6,2, -2,1) | -4,8* (-6,9, -2,7) |
Metformin ve bir sülfonilüre tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 225 | 225 | 216 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,15 | 8,07 | 8,1 |
Başlangıca göre değişiklik | -0,17 | -0,82 | -0,77 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,64* (-0,79, -0,49) | -0,59* (-0,74, -0,44) |
N | 216 | 209 | 202 |
Başlangıç HbA1c değeri ≥% 7 olan hastalarda, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
9,3 |
26,3 |
32,2 |
N | 225 | 225 | 216 |
Vücut ağırlığı(kg) | |||
Başlangıç (ortalama) | 76,23 | 77,08 | 77,5 |
Başlangıca göre değişiklik | -0,39 | -2,16 | -2,39 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,76* (-2,25, -1,28) | -1,99* (-2,48, -1,5) |
N | 225 | 225 | 216 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 128,8 | 128,7 | 129,3 |
Başlangıca göre değişiklik | -1,4 | -4,1 | -3,5 |
Plaseboya göre farklılık (% 95 GA) |
| -2,7 (-4,6, -0,8) | -2,1 (-4, -0,2) |
Pioglitazon +/- metformin tedavisine ekleme tedavisi | |||
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 165 | 165 | 168 |
HbA1c (%) | |||
Başlangıç (ortalama) | 8,16 | 8,07 | 8,06 |
Başlangıca göre değişiklik | -0,11 | -0,59 | -0,72 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,48* (-0,69, -0,27) | -0,61* (-0,82, -0,4) |
N | 155 | 151 | 160 |
Başlangıç HbA1c değeri ≥% 7 olan hastalarda, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
7,7 |
24 |
30 |
N | 165 | 165 | 168 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 78,1 | 77,97 | 78,93 |
Başlangıca göre değişiklik | 0,34 | -1,62 | -1,47 |
Plaseboya göre farklılık (% 97,5 GA) |
| -1,95* (-2,64, -1,27) | -1,81* (-2,49, -1,13) |
N | 165 | 165 | 168 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 125,7 | 126,5 | 126 |
Başlangıca göre değişiklik | 0,7 | -3,1 | -4 |
Plaseboya göre farklılık (% 95 GA) |
| -3,9 (-6,23, -1,5) | -4,7 (-7,08, -2,37) |
GA: Güven Aralığı
* p-değeri <0,0001
Daha önce ilaç tedavisi almamış hastalarda metformin ile kombinasyon
Daha önce ilaç tedavisi almamış hastalarda empagliflozinin etkililiğini ve güvenliliğini değerlendirmek için 24 hafta süreli faktöriyel tasarımlı bir çalışma yürütülmüştür. Metformin ile kombine empagliflozin tedavisi (günde iki kez verilen 5 mg ve 500 mg; 5 mg ve 1000 mg; 12,5 mg ve 500 mg, 12,5 mg ve 1000 mg), HbA1c değerlerinde istatistiksel olarak anlamlı iyileşmeler sağlamış (Tablo 54) ve APG değerleri (bileşenlerin her biri ile tek tek karşılaştırıldığında) ve vücut ağırlığında (metforminle karşılaştırıldığında) daha fazla azalmaya neden olmuştur.
Tablo 5: Metformin ve empagliflozin kombinasyonunu her bir bileşen ile karşılaştıran 24. haftadaki etkililik sonuçlarıa
| Empagliflozin 10 mg | Empagliflozin 25 mg | Metformin | |||||
| + Met 1000 mgc | + Met 2000 mgc | Met yok | + Met 1000 mgc | + Met 2000 mgc | Met yok | 1000 mg | 2000 mg |
N | 161 | 167 | 169 | 165 | 169 | 163 | 167 | 162 |
HbA1c (%) | ||||||||
Başlangıç (ortalama) | 8,68 | 8,65 | 8,62 | 8,84 | 8,66 | 8,86 | 8,69 | 8,55 |
Başlangıca göre değişiklik | -1,98 | -2,07 | -1,35 | -1,93 | -2,08 | -1,36 | -1,18 | -1,75 |
Karşılaştırmaya karşı empa (% 95 GA) | -0,63* (-0,86, -0,4) | -0,72* (-0,96, -0,49) |
| -0,57* (-0,81, -0,34) | -0,72* (-0,95, -0,48) |
|
|
|
Karşılaştırmaya karşı met (% 95 GA) | -0,79* (-1,03, -0,56) | -0,33* (-0,56, -0,09) |
| -0,75* (-0,98, -0,51) | -0,33* (-0,56, -0,1) |
|
|
|
Met = Metformin; empa = Empagliflozin
* HbA1c için p ≤0,0062
Metformin ve linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda empagliflozin Metformin ve 5 mg linagliptin tedavisi ile yeterli kontrol sağlanamayan hastalarda, gerek empagliflozin 10 mg, gerekse empagliflozin 25 mg ile uygulanan tedavi, plaseboyla karşılaştırıldığında, HbA1c düzeylerinde ve vücut ağırlığında istatistiksel olarak anlamlı (p<0,0001) azalmayla sonuçlanmıştır (Tablo 6). Ek olarak, APG, sistolik ve diyastolik kan basıncında da, plaseboya göre klinik olarak anlamlı düşüş sağlamıştır.
Tablo 6: Metformin ve linagliptin 5 mg tedavisi ile yeterli kontrol sağlanamayan hastalarda 24 hafta süreli plasebo kontrollü bir çalışmanın etkililik sonuçları
Metformin ve linagliptin 5 mg tedavisine ekleme tedavisi | |||
| Plasebo | Empagliflozin | |
10 mg | 25 mg | ||
N | 106 | 109 | 110 |
HbA1c (%) | |||
Başlangıç (ortalama) | 7,96 | 7,97 | 7,97 |
Başlangıca göre değişiklik | 0,14 | -0,65 | -0,56 |
Plaseboya göre farklılık (% 95 GA) |
| -0,79* (-1,02, -0,55) | -0,7* (-0,93, -0,46) |
N | 100 | 100 | 107 |
Başlangıç HbA1c değeri ≥% 7 olan hastalardan, HbA1c değeri <% 7 hedefine ulaşan hastaların yüzdesi |
17 |
37 |
32,7 |
N | 106 | 109 | 110 |
Vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 82,3 | 88,4 | 84,4 |
Başlangıca göre değişiklik | -0,3 | -3,1 | -2,5 |
Plaseboya göre farklılık (% 95 GA) |
| -2,8* (-3,5, -2,1) | -2,2* (-2,9, -1,5) |
N | 106 | 109 | 110 |
SBP (mmHg) | |||
Başlangıç (ortalama) | 130,1 | 130,4 | 131 |
Başlangıca göre değişiklik | -1,7 | -3 | -4,3 |
Plaseboya göre farklılık (% 95 GA) |
| -1,3 (-4,2, 1,7) | -2,6 (-5,5, 0,4) |
*p değeri <0,0001
Başlangıç HbA1c değeri % 8,5 veya daha yüksek olan önceden belirlenmiş bir hasta alt grubunda, HbA1c değerinde 24. haftada başlangıca göre düşme oranı, plaseboya göre, empagliflozin 10 mg ve empagliflozin 25 mg ile -% 1,3 olmuştur (p<0,0001).
Metformine ekleme tedavisi olarak empagliflozin için 24 aylık veri - Glimepirid ile karşılaştırma
Tek başına metformin ile yeterli glisemik kontrolün sağlanamadığı hastalarda, empagliflozin 25 mg'ın etkililik ve güvenliliğini glimepirid (günde 4 mg'a kadar) ile karşılaştıran bir çalışmada, günlük empagliflozin tedavisi, glimeprid ile karşılaştırıldığında, HbA1c değerinde ortalamanın üzerinde bir azalma (Tablo 7) ve APG değerinde klinik olarak anlamlı bir azalma ile sonuçlanmıştır. Günlük empagliflozin tedavisi, glimepirid ile karşılaştırıldığında, vücut ağırlığında, sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir azalma sağlamış ve istatistiksel olarak anlamlı oranda daha az hastada hipoglisemik olaylar ortaya çıkmıştır (empagliflozin için % 2,5, glimepirid için % 24,2, p<0,0001).
Tablo 7: Metformine ekleme tedavisi olarak empagliflozin ile glimepiridi karşılaştıran bir aktif kontrollü çalışmanın 104. haftada etkililik sonuçlarıa
| Empagliflozin 25 mg | Glimepirid |
N | 765 | 780 |
HbA1c (%) | ||
Başlangıç (ortalama) | 7,92 | 7,92 |
Başlangıca göre değişiklik | -0,66 | -0,55 |
Glimepiride göre farklılık (% 97,5 GA) | -0,11* (-0,2, -0,01) |
|
N | 690 | 715 |
Başlangıç HbA1c ≥% 7 olan hastalardan, HbA1c <% 7 hedefine ulaşan hastaların yüzdesi | 33,6 | 30,9 |
N | 765 | 780 |
Vücut ağırlığı(kg) | ||
Başlangıç (ortalama) | 82,52 | 83,03 |
Başlangıca göre değişiklik | -3,12 | 1,34 |
Glimepiride göre farklılık (% 97,5 GA) | -4,46** (-4,87, -4,05) |
|
N | 765 | 780 |
SBP (mmHg) | ||
Başlangıç (ortalama) | 133,4 | 133,5 |
Başlangıca göre değişiklik | -3,1 | 2,5 |
Glimepiride göre farklılık (% 97,5 GA) | -5,6** (-7,-4,2) |
|
GA: Güven Aralığı
* Daha aşağı olmadığını (non-inferiority) kanıtlamak için p-değeri<0,0001 ve ortalamanın üzerinde için p-değeri= 0,0153
** p-değeri <0,0001
İnsüline ekleme tedavisi
Çoklu günlük dozda insülin tedavisine ekleme tedavisi olarak empagliflozin
Metformin tedavisi ile birlikte olan veya olmayan çoklu günlük dozdaki insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozinin etkililiği ve güvenliliği, çift kör, plasebo kontrollü, 52 hafta süreli bir çalışmada değerlendirilmiştir. İlk 18 hafta ve son 12 hafta boyunca, insülin dozu sabit tutulmuş ancak 19-40. haftalar arasında açlık glikoz düzeyleri
<100 mg/dL'ye [5,5 mmol/L] ve tokluk glikoz düzeyleri <140 mg/dL'ye [7,8 mmol/L] ulaşmak üzere ayarlanmıştır.
18. haftada empagliflozin, plaseboya göre, HbA1c düzeylerinde istatistiksel olarak anlamlı iyileşme sağlamıştır (Tablo 8).
52. haftada empagliflozin tedavisi, plaseboya göre, HbA1c düzeylerinde ve insülin kullanımında anlamlı bir azalma sağlamış ve APG değerinde düşme ve kilo kaybı ile sonuçlanmıştır.
Tablo 8: Metformin ile birlikte veya birlikte olmayan çoklu günlük dozlardaki insüline ekleme tedavisi olarak kullanılan empagliflozin için yürütülen plasebo kontrollü bir çalışmada 18. ve
52. haftadaki etkililik sonuçları
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 188 | 186 | 189 |
18. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 8,33 | 8,39 | 8,29 |
Başlangıca göre değişiklik | -0,5 | -0,94 | -1,02 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,44* (-0,61, -0,27) | -0,52* (-0,69, -0,35) |
N | 115 | 119 | 118 |
52. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,25 | 8,4 | 8,37 |
Başlangıca göre değişiklik | -0,81 | -1,18 | -1,27 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,38*** (-0,62, -0,13) | -0,46* (-0,7, -0,22) |
N | 113 | 118 | 118 |
52. haftada başlangıç HbA1c ≥% 7 olan hastalarda, HbA1c <% 7 hedefine ulaşan hastaların yüzdesi |
26,5 |
39,8 |
45,8 |
N | 115 | 118 | 117 |
52. haftada insulin dozu (İÜ/gün) | |||
Başlangıç (ortalama) | 89,94 | 88,57 | 90,38 |
Başlangıca göre değişiklik | 10,16 | 1,33 | -1,06 |
Plaseboya göre farklılık (% 97,5 GA) |
| -8,83# (-15,69, -1,97) | -11,22** (-18,09, -4,36) |
N | 115 | 119 | 118 |
52. haftada vücut ağırlığı (kg) | |||
Başlangıç (ortalama) | 96,34 | 96,47 | 95,37 |
Başlangıca göre değişiklik | 0,44 | -1,95 | -2,04 |
Plaseboya göre farklılık (% 97,5 GA) |
| -2,39* (-3,54, -1,24) | -2,48* (-3,63, -1,33) |
GA: Güven Aralığı
<140 mg/dl (7,8 mmol/l)) hedefine ulaşmak için insülin dozu ayarlamasına yönelik hedefe yönelik tedavi rejimi
* p-değeri <0,0001
** p-değeri= 0,0003
*** p-değeri= 0,0005
# p-değeri= 0,004
Bazal insülin tedavisine ekleme tedavisi olarak empagliflozin
Metformin ve/veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 78 hafta süreli bir çift kör, plasebo kontrollü çalışmada değerlendirilmiştir. İlk 18 haftada insülin dozu sabit tutulmuş, ancak sonraki 60 hafta süresince APG <110 mg/dL düzeylerini sağlamak üzere ayarlanmıştır.
18. haftada empagliflozin, HbA1c düzeylerini istatistiksel olarak anlamlı oranda iyileştirmiştir (Tablo 9).
78. haftada empagliflozin, plasebo ile karşılaştırıldığında, HbA1c değerinde ve insülin kullanımında istatistiksel olarak anlamlı bir azalma oluşturmuştur. Ayrıca empagliflozin, APG, vücut ağırlığı ve kan basıncında da düşüş sağlamıştır.
Tablo 9: Metformin veya bir sülfonilüre ile birlikte veya birlikte olmayan bazal insülin tedavisine ekleme tedavisi olarak kullanılan empagliflozin için yürütülen bir plasebo kontrollü çalışmanın 18. ve 78. haftalardaki etkililik sonuçlarıa
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 mg |
N | 125 | 132 | 117 |
18. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,1 | 8,26 | 8,34 |
Başlangıca göre değişiklik | -0,01 | -0,57 | -0,71 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,56* (-0,78, -0,33) | -0,7* (-0,93, -0,47) |
N | 112 | 127 | 110 |
78. haftada HbA1c (%) |
|
|
|
Başlangıç (ortalama) | 8,09 | 8,27 | 8,29 |
Başlangıca göre değişiklik | -0,02 | -0,48 | -0,64 |
Plaseboya göre farklılık (% 97,5 GA) |
| -0,46* (-0,73, -0,19) | -0,62* (-0,9, -0,34) |
N | 112 | 127 | 110 |
78. haftada bazal insülin dozu (İÜ/gün) |
|
|
|
Başlangıç (ortalama) | 47,84 | 45,13 | 48,43 |
Başlangıca göre değişiklik | 5,45 | -1,21 | -0,47 |
Plaseboya göre farklılık (% 97,5 GA) |
| -6,66** (-11,56, -1,77) | -5,92** (-11, -0,85) |
GA: Güven Aralığı
* p-değeri <0,0001
** p-değeri <0,025
Renal yetmezliği olan hastalar, 52 hafta süreli plasebo kontrollü veriler
Renal yetmezliği olan hastalarda antidiyabetik tedaviye ekleme tedavisi olarak empagliflozinin etkililiği ve güvenliliği, 52 hafta süreli, çift kör plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozin tedavisi, plasebo ile karşılaştırıldığında, 24. haftada, HbA1c düzeylerinde istatistiksel olarak anlamlı bir azalma (Tablo 10) ve APG değerlerinde klinik olarak anlamlı bir iyileşme ile sonuçlanmıştır. HbA1c, vücut ağırlığı ve kan basıncındaki iyileşmeler 52. haftaya kadar devam etmiştir.
Tablo 10: Renal bozukluğu olan tip-2 diyabet hastalarında plasebo kontrollü bir empagliflozin çalışmasında 24. hafta sonuçlarıa
| Plasebo | Empagliflozin 10 mg | Empagliflozin 25 mg | Plasebo | Empagliflozin 25 mg |
eGFR ≥60 - <90 mL/dk/1,73 m² | eGFR ≥ 30 - <60 mL/dk/1,73 m² | ||||
N | 95 | 98 | 97 | 187 | 187 |
HbA1c (%) | |||||
Başlangıç (ortalama) | 8,09 | 8,02 | 7,96 | 8,04 | 8,03 |
Başlangıca göre değişiklik | 0,06 | -0,46 | -0,63 | 0,05 | -0,37 |
Plaseboya göre farklılık (% 95 GA) |
| -0,52* (-0,72, -0,32) | -0,68* (-0,88, -0,49) |
| -0,42* (-0,56, -0,28) |
N | 89 | 94 | 91 | 178 | 175 |
Başlangıç HbA1c ≥% 7 olan hastalarda, HbA1c <% 7 hedefine ulaşan hastaların yüzdesi | 6,7 | 17 | 24,2 | 7,9 | 12 |
N | 95 | 98 | 97 | 187 | 187 |
Vücut ağırlığı (kg) | |||||
Başlangıç (ortalama) | 86 | 92,05 | 88,06 | 82,49 | 83,22 |
Başlangıca göre değişiklik | -0,33 | -1,76 | -2,33 | -0,08 | -0,98 |
Plaseboya göre farklılık (% 95 GA) |
| -1,43 (-2,09, -0,77) | -2 (-2,66, -1,34) |
| -0,91 (-1,41, -0,41) |
N | 95 | 98 | 97 | 187 | 187 |
SBP (mmHg) | |||||
Başlangıç (ortalama) | 134,69 | 137,37 | 133,68 | 136,38 | 136,64 |
Başlangıca göre değişiklik | 0,65 | -2,92 | -4,47 | 0,4 | -3,88 |
Plaseboya göre farklılık (% 95 GA) |
| -3,57 (-6,86, -0,29) | -5,12 (-8,41, -1,82) |
| - 4,28 (-6,88, -1,68) |
GA: Güven Aralığı
* p <0,0001
Kardiyovasküler sonuçlar
Çift kör, plasebo kontrollü EMPA-REG OUTCOME çalışması, tip 2 diyabeti ve tanımlanmış kardiyovasküler hastalığı olan hastalarda, standart bakım tedavisine ek olarak uygulanan empagliflozin 10 mg ve empagliflozin 25 mg'ın havuzda toplanmış dozlarını plasebo ile karşılaştırmıştır. Toplam 7.020 hasta tedavi edilmiş (empagliflozin 10 mg: 2.345, empagliflozin 25 mg: 2.342, plasebo: 2.333) ve medyan 3,1 yıl süreyle takip edilmiştir. Ortalama yaş 63, ortalama HbA1c % 8,1'dir ve hastaların % 71,5'i erkektir. Başlangıçta hastaların % 74'ü metformin, % 48'i insülin ve % 43'ü bir sülfonilüre ile tedavi edilmiştir.
Hastaların yaklaşık yarısının (% 52,2) eGFR değeri 60-90 mL/dk/1,73 m2, % 17,8'nin 45-60 mL/dk/1,73 m2 ve % 7,7'sinin 30-45 mL/dk/1,73 m2 olarak belirlenmiştir.
12. haftada HbA1c'de uyarlanmış ortalamadaki (SE) iyileşme, plasebo grubu için başlangıçtaki % 0,11 (0,02) değeri ile karşılaştırıldığında, empagliflozin 10 mg grubunda % 0,65 (0,02) ve empagliflozin 25 mg grubunda % 0,71 (0,02) olarak gözlenmiştir. İlk 12 haftadan sonra glisemik kontrol, araştırmacı tedaviden bağımsız olarak optimize edilmiştir. Bu nedenle etki 94. haftada azaltılmış, HbA1c değerindeki uyarlanmış ortalama iyileşme, plasebo grubunda % 0,08 (0,02), empagliflozin 10 mg grubunda % 0,5 (0,02) ve empagliflozin 25 mg
grubunda % 0,55 (0,02) bulunmuştur.
Empagliflozin, birincil kombine sonlanım noktası olan kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmenin önlenmesinde , plaseboya göre üstün bulunmuştur. Tedavi etkisi, kardiyovasküler ölümde anlamlı bir azalma ile sağlanmış, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede anlamlı bir değişiklik olmamıştır. Kardiyovasküler ölümdeki azalma, empagliflozin 10 mg ve empagliflozin 25 mg için karşılaştırılabilir bulunmuştur (Şekil 1) ve genel yaşam süresindeki iyileşme ile de doğrulanmıştır (Tablo 11). EMPA-REG OUTCOME çalışmasında empagliflozinin kardiyovasküler ölüm, fatal olmayan miyokard enfarktüsü veya fatal olmayan inmede birincil birleşik sonlanım noktası üzerindeki etkisi, glisemik kontrolden veya renal fonksiyonundan (eGFR) büyük ölçüde bağımsız olmuştur ve genel olarak 30 ml/dakika/1,73m2 eGFR değerine kadar inen eGFR kategorileri arasında tutarlı olmuştur.
Kardiyovasküler mortaliteyi önlemedeki etkililiği, empagliflozin ile birlikte DPP-4 inhibitörü kullanan hastalarda veya siyah ırktan olanlarda tam olarak belirlenmemiştir, çünkü bu grupların EMPA-REG OUTCOME çalışmasındaki temsil edilme düzeyleri sınırlıdır.
Tablo 11: Birincil bileşik sonlanım noktası için tedavi etkisi, bileşenleri ve mortalitea
| Plasebo | Empagliflozin |
N | 2.333 | 4.687 |
İlk KV ölüm, fatal olmayan MI veya fatal olmayan inme olayına kadar geçen süre N (% ) | 282 (12,1) | 490 (10,5) |
Tehlike oranı, plaseboya karşı (% 95,.02 GA)* |
| 0,86 (0,74, 0,99) |
Üstünlük için p değeri |
| 0,0382 |
KV ölüm N (% ) | 137 (5,9) | 172 (3,7) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,62 (0,49, 0,77) |
p değeri |
| <0,0001 |
Fatal olmayan MI N (% ) | 121 (5,2) | 213 (4,5) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,87 (0,7, 1,09) |
p değeri |
| 0,2189 |
Fatal olmayan inme N (% ) | 60 (2,6) | 150 (3,2) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 1,24 (0,92, 1,67) |
p değeri |
| 0,1638 |
Tüm nedenlere bağlı mortalite N (% ) | 194 (8,3) | 269 (5,7) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,68 (0,57, 0,82) |
p değeri |
| <0,0001 |
KV olmayan mortalite N (% ) | 57 (2,4) | 97 (2,1) |
Tehlike oranı, plaseboya karşı (% 95 GA) |
| 0,84 (0,6, 1,16) |
KV: Kardiyovasküler, MI: Miyokard enfarktüsü
* Çalışmadan elde edilen veriler bir ara analize dahil edildiği için, anlamlılık için 0,0498'den düşük bir p değerine karşılık gelen bir iki yanlı % 95,02 güven aralığı uygulanmıştır.
Şekil 1 - EMPA-REG OUTCOME çalışmasında kardiyovasküler ölüme kadar geçen
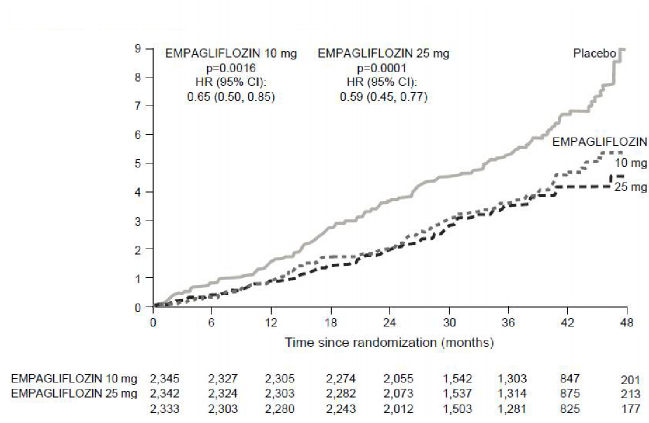
Her bir empagliflozin dozuna karşılık plasebo
Risk altında olanların sayısı
Plasebo
Randamizasyondan itibaren geçen zaman (ay)
EMPAGLIFLOZIN 10 mg EMPAGLIFLOZIN 25 mg
p=0,0016 p=0,0001
TO (% 95 GA) TO (% 95 GA)
0,55 (0,50, 0,85) 0,59 (0,45, 0,77)
Plasebo
Tıbbi durum yaşayan hasta (%)
zaman
Hastaneye yatış gerektiren kalp yetmezliği
EMPA-REG OUTCOME çalışmasında, empagliflozin plasebo ile karşılaştırıldığında, hastaneye yatış gerektiren kalp yetersizliği riskini düşürmüştür (empagliflozin % 2,7, plasebo
% 4,1; TO (Tehlike Oranı) 0,65, % 95 GA = 0,5, 0,85).
Nefropati
EMPA-REG OUTCOME çalışmasında, ilk nefropati olayına kadar olan süre boyunca, empagliflozine (% 12,7) kıyasla plasebo (18,8) için TO 0,61 (% 95 GA 0,53, 0,7) olmuştur.
Ayrıca, empagliflozin (% 49,7) plaseboya kıyasla (% 28,8), başlangıçta makroalbuminürisi olan hastalarda, daha yüksek (TO 1,82, % 95 GA 1,40, 2,37) sürekli normo- veya mikro- albüminüri oluşumu göstermiştir.
Açlık plazma glikozu
4 adet plasebo kontrollü çalışmada, empagliflozin monoterapisi veya metformin, pioglitazon veya metformin + bir sülfonilüre tedavisine ekleme tedavisi, APG değerinde başlangıca göre, plasebo (7,4 mg/dL [0,41 mmol/L]) ile karşılaştırıldığında, empagliflozin 10 mg için -20,5
mg/dL [-1,14 mmol/L], empagliflozin 25 mg için -23,2 mg/dL [-1,29 mmol/L] ortalama değişiklikle sonuçlanmıştır. Bu etki 24 haftadan sonra gözlenmiştir ve 76 hafta süresince
devam etmiştir.
2 saatlik tokluk glikozu
Metformin veya metformin + bir sülfonilüre tedavisine ekleme olarak empagliflozin tedavisi,
24. haftada, 2 saatlik tokluk glikoz düzeylerinde (yemek tolerans testi) klinik olarak anlamlı bir düşme sağlamıştır (metformine ekleme: Plasebo +5,9 mg/dL, empagliflozin 10 mg: -46 mg/dL, empagliflozin 25 mg: -44,6 mg/dL, metformin + bir sülfonilüre tedavisine ekleme: Plasebo -2,3 mg/dL, empagliflozin 10 mg: -35,7 mg/dL, empagliflozin 25 mg: -36,6 mg/dL).
Başlangıç HbA1c>% 10 (yüksek) olan hastalar
3 Faz III çalışmasının önceden tanımlanan havuzda toplanmış analizinde, şiddetli hiperglisemisi olan (N=184, ortalama başlangıç HbA1c % 11,15) hastalarda, açık etiketli empagliflozin 25 mg tedavisi, 24. haftada, HbA1c değerinde, başlangıca göre % 3,27 oranındaki klinik olarak anlamlı bir azalma ile sonuçlanmıştır. Bu çalışmalara plasebo veya empagliflozin 10 mg kolları dahil edilmemiştir.
Vücut ağırlığı
Plasebo-kontrollu dört çalışmanın önceden tanımlanmış, havuzda toplanmış analizinde, empagliflozin tedavisi, 24. haftada vücut ağırlığında azalma ile sonuçlanmış (plasebo için - 0,24 kg, empagliflozin 10 mg için -2,04 kg ve empagliflozin 25 mg için -2,26 kg) ve 52. haftaya kadar (plasebo için -0,16 kg, empagliflozin 10 mg için -1,96 kg ve empagliflozin 25 mg için - 2,25 kg) devam etmiştir.
Kan basıncı
Empagliflozinin etkililiği ve güvenliliği, çeşitli antidiyabetik tedavi alan ve en fazla 2 antihipertansif ilacı kullanan kan basıncı yüksek tip-2 diyabetli hastalarda 12 hafta süreyle yürütülen çift kör, plasebo kontrollü bir çalışmada değerlendirilmiştir. Empagliflozinin günde bir kez uygulanması ile yapılan tedavi, HbA1c değerinde ve ambulatuvar kan basıncı izlenmesi ile tespit edilen 24 saatlik ortalama sistolik ve diyastolik kan basıncında istatistiksel olarak anlamlı bir iyileşme ile sonuçlanmıştır (Tablo 12). Empagliflozin tedavisi, otururken ölçülen SBP (Sistolik Kan Basıncı) ve DBP (Diyastolik Kan Basıncı)'de azalmalar sağlamıştır.
Tablo 12: Kan basıncı kontrol altında olmayan tip-2 diyabetli hastalarda, empagliflozinin plasebo kontrollü bir çalışmasında 12. haftadaki etkililik sonuçlarıa
| Plasebo | JARDIANCE | |
10 mg | 25 mg | ||
N | 271 | 276 | 276 |
12. haftada HbA1c (%) | |||
Başlangıç (ortalama) | 7,9 | 7,87 | 7,92 |
Başlangıca göre değişiklik | 0,03 | -0,59 | -0,62 |
Plaseboya göre farklılık (% 95 GA) |
| -0,62* (-0,72, -0,52) | -0,65*
(-0.,75, -0,55) |
12. haftada 24 saatlik SBP | |||
Başlangıç (ortalama) | 131,72 | 131,34 | 131,18 |
Başlangıca göre değişiklik | 0,48 | -2,95 | -3,68 |
Plaseboya göre farklılık (% 95 GA) |
| -3,44* (-4,78, -2,09) | -4,16* (-5,5, -2,83) |
12. haftada 24 saatlik DBP | |||
Başlangıç (ortalama) | 75,16 | 75,13 | 74,64 |
Başlangıca göre değişiklik | 0,32 | -1,04 | -1,4 |
Plaseboya göre farklılık5 (% 95 GA) |
| -1,36** (-2,15, -0,56) | -1,72* (-2,51, -0,93) |
GA: Güven aralığı
* p-değeri <0,0001
** p-değeri <0,001
Plasebo kontrollü 4 çalışmanın önceden tanımlanmış havuzda toplanmış analizinde, empagliflozin tedavisi, 24. haftada, plasebo (-0,5 mmHg) ile karşılaştırıldığında, sistolik kan basıncında (empagliflozin 10 mg: -3,9 mmHg; empagliflozin 25 mg: -4,3 mmHg) ve diyastolik
kan basıncında (plasebo: -0,5 mmHg; empagliflozin 10 mg: -1,8 mmHg; empagliflozin 25 mg:
-2 mmHg) azalma ile sonuçlanmış ve bu etki 52. haftaya kadar devam ettirilmiştir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı (European Medicine Agency-EMA), JARDIANCE ile tip-2 diyabeti olan pediyatrik popülasyonun bir veya daha fazla alt grubunda yapılan çalışmaların sonuçlarını sunma zorunluluğunu ertelemiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2).
Avrupa İlaç Ajansı (European Medicine Agency-EMA), JARDIANCE ile kalp yetmezliği olan pediyatrik popülasyonun alt gruplarında yapılan çalışmaların sonuçlarını sunma zorunluluğunu ertelemiştir (pediyatrik kullanım ile ilgili bilgiler için bkz. Bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Empagliflozinin farmakokinetiği, sağlıklı gönüllülerde ve tip-2 diyabetli hastalarda ayrıntılı olarak tanımlanmıştır. Oral uygulamadan sonra, empagliflozin, ortalama t1,5 saatte meydana gelen pik plazma konsantrasyonları ile hızlı bir şekilde emilir. Sonrasında, plazma konsantrasyonları hızlı bir dağılım fazı ile bifazik tarzda azalır ve terminal fazı göreceli olarak yavaştır. Kararlı durum ortalama plazma EAA ve Cdeğerleri, günde bir kez empagliflozin 10 mg için 1870 nmol.saat/L ve 259 nmol/L ve empagliflozin 25 mg için 4740 nmol.saat/L ve 687 nmol/L'dir. Empagliflozinin sistemik maruziyeti dozla orantılı şekilde artar. Empagliflozinin tek doz ve kararlı durum farmakokinetik parametreleri benzerdir, bu durum zamana göre lineer farmakokinetiği düşündürür. Sağlıklı gönüllülerle tip-2 diyabetli hastalar arasında empagliflozin farmakokinetiği açısından klinik olarak anlamlı bir farklılık yoktur.
Yüksek oranda yağlı ve yüksek kalorili bir yemekten sonra empagliflozin 25 mg alınması, hafif oranda daha düşük bir maruziyetle sonuçlanmıştır. Açlık koşulları ile karşılaştırıldığında, EAA yaklaşık % 16 oranında ve Cyaklaşık % 37 oranında azalmıştır. Yiyeceklerin empagliflozin farmakokinetiği üzerinde gözlenen etkileri, klinik olarak anlamlı kabul edilmez,
empagliflozin yiyeceklerle birlikte veya ayrı olarak kullanılabilir.
Dağılım:
Görünür kararlı durum dağılım hacmi, popülasyon farmakokinetik analizlerine dayanarak, 73,8 L olarak tahmin edilmiştir. Sağlıklı gönüllülere oral [14C]-empagliflozin çözeltisi uygulanmasını takiben kırmızı kan hücre parçalanması yaklaşık % 37 ve plazma protein bağlanması % 86 bulunmuştur.
Biyotransformasyon:
Empagliflozinin insan plazmasında majör bir metaboliti belirlenmemiştir ve en belirgin metabolitleri 3 glukuronid konjugatıdır (2-,3- ve 6-O glukuronid). Her metabolitin sistemik maruziyeti, ilaca bağlı toplam materyalin % 10'undan daha azdır. In vitro çalışmalar, empagliflozinin insanlardaki birincil metabolizma yolunun, üridin 5ï¢-difosfo-glukuronosil transferazlar UGT2B7, UGT1A3, UGT1A8 ve UGT1A9 aracılığı ile glukuronidasyon olduğunu düşündürmektedir.
Eliminasyon:
Popülasyon farmakokinetik analizlere dayanarak, empagliflozinin görünür terminal yarılanma ömrü 12,4 saat olarak tahmin edilmiştir, görünür oral klerensi 10,6 L/saattir. Empagliflozin oral klerensi açısından kişiler arası ve rezidüel değişkenlikler sırası ile % 39,1 ve % 35,8'dir. Günde bir kez verilen dozla, empagliflozinin kararlı durum plazma konsantrasyonlarına 5. dozla ulaşılmıştır. Yarı ömrü ile uyumlu olarak, kararlı durumda, plazma EAA açısından % 22'ye kadar birikim gözlenmiştir. Oral [14C]-empagliflozin çözeltisinin sağlıklı gönüllülere uygulanmasından sonra, ilaçla ilişkili radyoaktivitenin yaklaşık % 96'sı, feçes (% 41) veya idrarla (% 54) atılmıştır. Feçeste geri kazanılan ilaçla ilişkili radyoaktivitenin büyük bir kısmı değişmemiş ana ilaç olmuştur ve idrarla atılan ilaçla ilişkili radyoaktivitenin yaklaşık yarısı değişmemiş ana ilaç olmuştur.
Hastalardaki karakteristik özellikler
Renal yetmezlik
![]()
Hafif, orta ve şiddetli renal bozukluğu olan hastalarda (eGFR<30 - <90 mL/dk/1,.73 m2) ve böbrek yetmezliği /son dönem böbrek yetmezliği (ESRD) olan hastalarda, renal fonksiyonları normal olan hastalarla karşılaştırıldığında, empagliflozinin EAA değerleri sırasıyla, yaklaşık olarak, % 18, % 20, % 66 ve % 48 oranında artmıştır. Empagliflozinin pik plazma düzeyleri, orta dereceli renal bozukluğu ve böbrek yetmezliği/ESRD hastaları ile renal fonksiyonları normal olan hastalar arasında benzerdir. Empagliflozinin pik plazma düzeyleri, hafif ve şiddetli renal bozukluğu olan hastalarda, renal fonksiyonları normal olan hastalara göre, kabaca % 20 oranında daha yüksektir. Popülasyon farmakokinetik analizi, empagliflozinin görünür oral klerensinin, eGFR değerindeki azalma ile azaldığını, bunun da ilaç maruziyetinde yükselmeye neden olduğunu göstermiştir.
Hepatik yetmezlik
Child-Pugh sınıflandırmasına göre hafif, orta ve şiddetli hepatik bozukluğu olan hastalarda empagliflozinin EAA değeri, hepatik fonksiyonları normal olan hastalara göre, sırasıyla yaklaşık % 23, % 47 ve % 75, Cdeğeri ise yaklaşık % 4, % 23 ve % 48 artmıştır.
Vücut kitle indeksi
Popülasyon farmakokinetik analizlerine dayanarak, vücut kitle indeksinin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır. Bu analizde EAA
değerinin, BMI 25 kg/m2 olanlara göre, BMI 30, 35, ve 45 kg/m2 olan kişilerde sırası ile %
5,82, % 10,4 ve % 17,3 daha düşük olduğu tahmin edilmiştir.
Cinsiyet
Popülasyon farmakokinetik analizlerine dayanarak, cinsiyetin empagliflozin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi yoktur.
Irk
Popülasyon farmakokinetik analizlerinde, EAA değerinin, BMI 25 kg/m2 olan Asyalılarda, aynı BMI değerine sahip Asyalı olmayanlarla karşılaştığında, % 13,5 oranında daha yüksek olduğu tahmin edilmiştir.
Geriyatrik popülasyon
Popülasyon farmakokinetik analizlerine dayanarak, yaşın empagliflozinin farmakokinetiği üzerine klinik olarak anlamlı bir etkisi olmamıştır.
Pediyatrik popülasyon
Bir pediyatrik Faz 1 çalışması, empagliflozinin (5 mg, 10 mg ve 25 mg) farmakokinetiğini ve farmakodinamiğini, Tip 2 diabetes mellitus hastası çocuklar ve ≥10 - <18 yaşlarındaki adolesanlarda araştırmıştır. Gözlenen farmakokinetik ve farmakodinamik yanıtlar, erişkin gönüllülerden elde edilen bilgilerle tutarlı bulunmuştur.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, genotoksisite, fertilite ve erken embriyonik gelişimle ilgili klasik
çalışmalardaki klinik dışı veriler insanlar için özel bir tehlike göstermemiştir.
Köpeklerde ve kemirgenlerde yapılan uzun dönem toksisite çalışmalarında, empagliflozinin klinik dozunun 10 katına eşit veya daha yüksek maruziyetlerinde toksisite belirtileri gözlenmiştir. Toksisitenin çoğu, vücut ağırlığı ve vücut yağ düzeyinde azalma, yiyecek tüketiminde artış, diyare, dehidratasyon, serum glikoz düzeyinde azalmayı da kapsayan idrarda glikoz kaybı ve elektrolit dengesizlikleri, protein metabolizmasındaki ve glikoneogenezdeki artışla görülen diğer serum proteinlerinde yükselme, poliüri ve glikozüri gibi idrar değişiklikleri ve böbreklerle bazı yumuşak ve vasküler dokuların mineralizasyonunu da içeren mikroskobik değişiklikler ile ilişkili ikincil farmakoloji ile uyumludur. Bazı türlerde, empagliflozinin 25 mg ile ilişkili olarak, empagliflozinin klinik EAA maruziyetinin yaklaşık
4 katında, böbrekler üzerindeki, abartılı farmakolojik etkilerin mikroskobik kanıtları gözlenmiştir. Bu kanıtlar arasında, tübüler dilatasyon ve tübüler ve pelvik mineralizasyon bulunur.
Empagliflozin genotoksik değildir.
2 yıl süreli bir karsinojenite çalışmasında empagliflozin, dişi sıçanlarda, maksimum klinik empagliflozin EAA maruziyetinin 72 kat fazlasına karşılık gelen, 700 mg/kg/gün düzeyindeki en yüksek doza kadar, tümör insidansını arttırmamıştır. Erkek sıçanlarda, en yüksek dozda, mezenterik lenf nodlarında, tedaviye bağlı benign vasküler proliferatif lezyonları (hemanjiyomlar) gözlenmiştir. Ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 26 katına karşılık gelen 300 mg/kg/gün dozda bu etki gözlenmemiştir. Sıçanlarda, 300 mg/kg/gün ve üzerindeki dozlarda, testislerde interstisyel hücre tümörleri daha yüksek insidansta gözlenmiş, empagliflozinin maksimum klinik maruziyetinin yaklaşık 18 katına
karşılık gelen 100 mg/kg/gün dozda ise gözlenmemiştir. Her iki tümör de sıçanlarda yaygındır ve insanlarla ilişkili olması beklenmez.
Empagliflozin, dişi farelerde, maksimum klinik maruziyetinin yaklaşık 62 katına karşılık gelen 1000 mg/kg/gün doza kadar tümör insidansını arttırmamıştır. Erkek farelerde 1000 mg/kg/gün dozda renal tümörleri indüklemiştir, ancak empagliflozinin maksimum klinik maruziyetinin yaklaşık 11 katına karşılık gelen 300 mg/kg/gün dozda bu indükleme görülmemiştir. Bu tümörlerin etki mekanizması, erkek farelerin renal patolojiye doğal predispozisyonuna ve bir metabolik yolağa bağlı olup, insanlarda karşılığı yoktur. Erkek farelerdeki renal tümörler insanlarla ilişkili bulunmamıştır.
İnsanlarda, terapötik dozlardan sonraki maruziyetin yeterli derecedeki maruziyet miktarlarında, empagliflozinin fertilite veya erken embriyolojik gelişme üzerinde herhangi bir advers etkisi olmamıştır. Organogenez dönemi sırasında verilen empagliflozinin teratojen etkisi saptanmamıştır. Sadece maternal olarak toksik dozlarda verildiğinde empagliflozin, sıçanlarda kaburga kemiklerinde eğriliğe ve tavşanlarda embriyofetal kayıplarda artışa neden olmuştur.
Sıçanlarda yapılan pre- ve postnatal toksisite çalışmalarında, empagliflozine maksimum klinik maruziyetin yaklaşık 4 katındaki maternal maruziyetlerde, yavruların kilo alımında azalma gözlenmiştir. Empagliflozine maksimum klinik maruziyete eşdeğer bir sistemik maruziyette böyle bir etki gözlenmemiştir. Bu bulguların insanlarla ilişkisi belirsizdir.
Sıçanlarda yapılan bir juvenil toksisite çalışmasında, postnatal 21. günden postnatal 90. güne kadar empagliflozin uygulanması halinde, juvenil sıçanlarda sadece maksimum klinik doz olan 25 mg'ın yaklaşık 11 katına karşılık gelen 100 mg/kg/gün dozlarda advers olmayan, minimal- hafif dereceli renal tübüler ve pelvik dilatasyon görülmüştür. İlaçsız 13 haftalık bir dönem sonrasında bu bulgular ortadan kalkmıştır.
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Boehringer Ingelheim İlaç Tic. A.Ş.
| Geri Ödeme Kodu | A16755 |
| Satış Fiyatı | 637.87 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 637.87 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699693090126 |
| Etkin Madde | Empagliflozin |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |