JEMVY 20 mg/0.4 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör (1 enjektör) Farmakolojik Özellikler
{ Ofatumumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Seçici immünosupresanlar ATC kodu: L04AA52Etki mekanizması
Ofatumumab tamamen insan bir anti-CD20 monoklonal antikorudur (IgG1). CD20 molekülü pre- B'den olgun B lenfositi aşamasına B lenfositlerinde ekspresyonu yapılan bir transmembran
fosfoproteindir. CD20 molekülü ayrıca aktive T hücrelerinin küçük bir fraksiyonunda eksprese
edilir.
Ofatumumabın CD20'ye bağlanması, başlıca kompleman aracılı sitotoksisite (CDC) ve daha düşük boyutta antikora bağımlı hücre aracılı sitotoksisite (ADCC) aracılığıyla CD20+ B hücrelerinin lizisini indükler. Ofatumumabın aynı zamanda hem yüksek hem de düşük CD20 ekspresyonu yapan hücrelerde hücre lizisini indüklediği gösterilmiştir. CD20-ekspresyonu yapan T hücreleri aynı zamanda ofatumumab ile azaltılır.
Farmakodinamik etkiler
B-hücresi azalması
4 haftada bir 20 mg ofatumumabın kullanıldığı RMS klinik çalışmalarında, 1, 7 ve 14. günlerde 20 mg'lık bir başlangıç doz rejiminden sonra uygulama, tedavinin başlamasından iki hafta sonra gibi kısa bir süre içinde B hücrelerinin NAS'nin (40 hücre/µl olarak tanımlanır) altına hızlı ve sürekli bir şekilde azalmasıyla sonuçlanmıştır. 4. haftada başlayan idame fazı başlatılmadan önce, hastaların %94'ünde <10 hücre/µl toplam B hücresi seviyelerine ulaşılmış olup bu değer
12. haftada hastaların %98'ine yükselmiş ve 120 haftaya kadar sürdürülmüştür (yani çalışma tedavisi sırasında).
B-hücresi seviyesinin normale dönmesi
RMS Faz III klinik çalışmalarından veriler, B-hücresinin LLN veya başlangıç değerine düzelmesine, tedavinin bırakılmasından sonra 24,6 haftalık bir medyan süreyi göstermektedir. PK- B hücresi modelleme ve B-hücresi azalması için simülasyon bu verileri desteklemekte ve B- hücresinde LLN'ye düzelmek için tedavi sonrası 23 haftalık bir medyan süreyi öngörmektedir.
İmmünojenisite
RMS faz III çalışmalarında, tedaviye bağlı anti-ilaç antikorlarının (ADA'lar) genel insidansı ofatumumab ile tedavi edilen hastalarda %0,2 (914'ten 2'si) olmuş ve tedaviyi güçlendiren veya nötralize eden ADA'sı olan hiçbir hasta tanımlanmamıştır. Ofatumumab ile ilişkili ADA insidansı düşük olduğundan, pozitif ADA titrelerinin PK, güvenlilik profili veya B-hücresi kinetiği üzerindeki etkisi değerlendirilemez.
Klinik etkililik ve güvenlilik
JEMVY'nin etkililiği ve güvenliliği, 18 ila 55 yaşında, taramada 0 ile 5.5 arasında Genişletilmiş Özürlülük Durumu Ölçeği (EDSS) skorunda özürlülük durumuna sahip ve önceki yıl sırasında en az bir kanıtlanmış relaps ya da önceki iki yıl sırasında iki relaps veya önceki yıl sırasında pozitif gadolinyum (Gd)-tutan MRG taramasına sahip relapsla seyreden MS'li (RMS) hastalarda yürütülen birebir aynı tasarıma sahip iki randomize, çift kör, aktif kontrollü faz III pivotal çalışmada (Çalışma 1 [ASCLEPIOS I] ve Çalışma 2 [ASCLEPIOS II]) değerlendirilmiştir. Gerek yeni tanı konmuş hastalar gerekse mevcut tedavilerinden geçiş yapan hastalar kaydedilmiştir.
İki çalışmada RSM'li sırasıyla 927 ve 955 hasta 1:1 oranında ilk 14 günde haftada 20 mg'lık üç dozluk (1, 7 ve 14. günlerde) başlangıç dozundan sonra 4. haftadan itibaren her 4 haftada bir ofatumumab 20 mg subkutan enjeksiyonları veya günde bir kez oral teriflunomid 14 mg kapsülleri almaya randomize edilmiştir. Hastalar aynı zamanda körlüğü sağlamak üzere diğer tedavi koluna
tekabül eden eş plasebo almıştır (çift plasebo tasarımı).
Bireysel hastalar için tedavi süresi, çalışma sonu kriterlerinin ne zaman sağlandığına bağlı olarak değişkendir. Her iki çalışmada, medyan tedavi süresi 85 hafta olup, teriflunomid grubundaki hastaların %23,2'sine karşı ofatumumab grubundaki hastaların %33,0'ı 96 haftadan uzun süre tedavi görmüştür.
Demografikler ve başlangıç özellikleri tedavi kolları ve her iki çalışma arasında iyi dengelenmiştir (bkz. Tablo 2). Ortalama yaş 38 olup, ortalama hastalık süresi ilk semptomun başlangıcından itibaren 8,2 yıldır ve ortalama EDSS skoru 2,9'dur; hastaların %40'ı daha önce bir hastalığı modifiye edici tedavi (DMT) ile tedavi görmezken, %40'ı başlangıç MRG taramalarında gadolinyum (Gd)-tutan T1 lezyonları göstermiştir.
Her iki çalışmanın birincil etkililik sonlanım noktası EDSS temelinde doğrulanmış relapsların yıllık oranıdır (ARR). Kritik ikincil etkililik sonlanım noktaları başlangıç EDSS skoru sırasıyla 0, 1 ila 5 veya ≥5,5 olan hastalarda EDSS skorunda ≥1,5, ≥1 veya ≥0,5 artış olarak tanımlanan EDSS'de maluliyet kötüleşmesine kadar geçen süreyi (3. ay ve 6. ayda doğrulanmış) içermiştir. İlave kritik sonlanım noktaları MRG taraması başına Gd-tutan T1 lezyonları sayısını ve yıllık yeni veya genişleyen T2 lezyonları sayısını içermiştir. Özürlülükle ilişkili kritik ikincil sonlanım noktaları çalışma protokollerinde tanımlandığı üzere ASCLEPIOS Çalışma 1 ve Çalışma 2 çalışmalarından birleştirilmiş verilerin meta-analizinde değerlendirilmiştir.
Tablo 2 Demografikler ve başlangıç özellikleri
Özellikler | Çalışma 1 (ASCLEPIOS I) | Çalışma 2 (ASCLEPIOS II) | ||
| Ofatumumab (N=465) | Teriflunomid (N=462) | Ofatumumab (N=481) | Teriflunomid (N=474) |
Yaş (ortalama ± standart sapma; yıl) | 39±9 | 38±9 | 38±9 | 38±9 |
Cinsiyet (kadın; %) | 68,4 | 68,6 | 66,3 | 67,3 |
Tanıdan beri MS süresi (ortalama/medyan; yıl) | 5,77/3,94 | 5,64/3,49 | 5,59/3,15 | 5,48/3,10 |
Daha önce DMT'lerle tedavi edilmiş (%) | 58,9 | 60,6 | 59,5 | 61,8 |
Son 12 aydaki relaps sayısı | 1,2 | 1,3 | 1,3 | 1,3 |
EDSS skoru (ortalama/medyan) | 2,97/3,00 | 2,94/3,00 | 2,90/3,00 | 2,86/2,50 |
Ortalama toplam T2 lezyon hacmi (cm) | 13,2 | 13,1 | 14,3 | 12,0 |
Gd+ T1 lezyonları olan hastalar (%) | 37,4 | 36,6 | 43,9 | 38,6 |
Gd+ T1 lezyonların sayısı (ortalama) | 1,7 | 1,2 | 1,6 | 1,5 |
Her iki çalışma için etkililik bulguları Tablo 3, Şekil 1'de özetlenmektedir.
Her iki Faz III çalışmada, teriflunomide kıyasla ofatumumab yıllık relaps oranında sırasıyla %50,5
ve %58,5'lik anlamlı bir azalma göstermiştir.
Birleştirilmiş verilerde önceden belirtilmiş meta-analiz teriflunomide kıyasla ofatumumabın 3-
aylık doğrulanmış özürlülük progresyonu (CDP) riskini %34,4 ve 6-aylık CDP'yi %32,5 oranında anlamlı olarak azalttığını göstermiştir (bkz. Şekil 1).
Teriflunomide kıyasla ofatumumab Gd-tutan T1 lezyonlarını %95,9 ve yeni veya genişleyen T2 lezyonlarının oranını %83,5 oranında anlamlı olarak azaltmıştır (değerler birleştirilmiş çalışmalar için ortalama azalmaları temsil etmektedir).
İki faz III çalışmada, cinsiyet, yaş, vücut ağırlığı, önceki steroid olmayan MS tedavisi ve başlangıçtaki özürlülük ve hastalık aktivitesi ile tanımlanan keşifsel alt gruplarda teriflunomide kıyasla ofatumumabın kritik etkililik bulguları üzerinde benzer bir etkisi gözlenmiştir.
Tablo 3 RMS'de yürütülen faz III çalışmalardan kritik bulguların genel özeti
Sonlanım Noktaları | Çalışma 1 (ASCLEPIOS I) | Çalışma 2 (ASCLEPIOS II) | ||
Ofatumumab 20 mg (N=465) | Teriflunomid 14 mg (N=462) | Ofatumumab 20 mg (N=481) | Teriflunomid 14 mg (N=474) | |
Ayrı ayrı çalışmalar temelinde sonlanım noktaları | ||||
Yıllık relaps oranı (ARR) (birincil sonlanım noktası) | 0,11 | 0,22 | 0,10 | 0,25 |
Oran azalması | %50,5 (p<0,001) | %58,5 (p<0,001) | ||
MRG taraması başına T1 Gd-tutan lezyonların ortalama sayısı | 0,0115 | 0,4523 | 0,0317 | 0,5141 |
Nispi azalma | %97,5 (p<0,001) | %93,8 (p<0,001) | ||
Yılda yeni veya genişleyen T2 lezyonların sayısı | 0,72 | 4,00 | 0,64 | 4,15 |
Nispi azalma | %81,9 (p<0,001) | %84,5 (p<0,001) | ||
Önceden belirtilmiş meta-analizler temelinde sonlanım noktaları | ||||
3 aylık doğrulanmış özürlülüğe sahip hastaların oranı Risk azalması | %15,0 teriflunomide karşı %10,9 ofatumumab
%34,4 (p=0,002) | |||
6 aylık doğrulanmış özürlülüğe sahip hastaların oranı Risk azalması | %12,0 teriflunomide karşı %8,1 ofatumumab
%32,5 (p=0,012) | |||
Şekil 1 Tedaviye göre ilk 3-aylık CDP'ye kadar geçen süre (ASCLEPIOS Çalışma 1 ve Çalışma
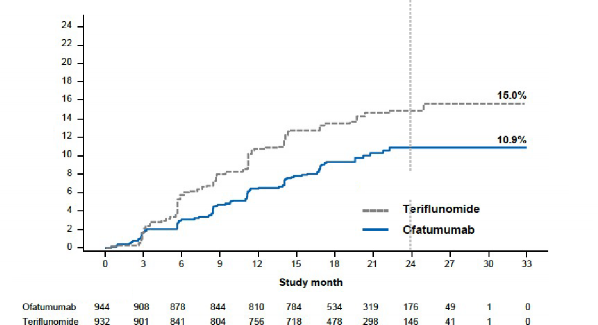
Risk azalması: %34,4, p=0,002
(N=932) (N=944)
2 birlikte, tam analiz seti)
Faz III çalışmalarda, advers olaylar (AE'ler) (%84,2'ye karşı %83,6) ve bırakmaya yol açan AE'lerin (%5,2'ye karşı %5,7) görüldüğü hastaların oranı ofatumumab ve teriflunomid gruplarında benzerdir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
20 mg'lık aylık subkutan doz kararlı durumda 483 µg*s/ml'lik ortalama EEA ve 1,43 µg/ml'lik ortalama C'a yol açar.
Subkutan uygulama sonrasında, ofatumumabın diğer terapötik monoklonal antikorlara benzer şekilde başlıca lenfatik sistem aracılığıyla emildiğine inanılmaktadır.
Dağılım:
Kararlı durumda dağılım hacminin 20 mg dozda tekrarlanan subkutan ofatumumab uygulamasının ardından 5,42 litre olduğu hesaplanmıştır.
Biyotransformasyon:
Ofatumumab beklenen metabolik yolağın yaygın proteolitik enzimler tarafından küçük peptidlere ve amino asitlere parçalanma olduğu bir proteindir.
Eliminasyon:
Ofatumumab iki yolla atılır: B hücrelerine bağlanma ile ilişkili hedef aracılı yol ve spesifik olmayan endositozun ardından diğer IgG molekülleri ile olduğu gibi intraselüler katabolizmanın aracılık ettiği hedeften bağımsız yol. Başlangıçta bulunan B hücreleri tedavinin başında ofatumumab hedef aracılı klirensinin daha büyük bir bileşeni ile sonuçlanır. Ofatumumab ile doz uygulama B hücrelerinin potens azalmasına yol açar ki bu da azalmış genel klirens ile sonuçlanır.
Kararlı durumda yarılanma ömrü 20 mg dozda tekrarlanan subkutan ofatumumab uygulamasının ardından yaklaşık 16 gün olarak hesaplanmıştır.
Doğrusallık/doğrusal olmayan durum:
Ofatumumab zaman içerisinde azalan klirensi nedeniyle doğrusal olmayan bir farmakokinetiğe
sahiptir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Böbrek yetmezliği olan hastalarda ofatumumabla özel çalışmalar yürütülmemiştir.
Hafif böbrek yetmezliği olan hastalar klinik çalışmalara dahil edilmiştir. Orta şiddette ve şiddetli böbrek yetmezliği olan hastalarda deneyim bulunmamaktadır. Bununla birlikte, ofatumumab idrarla atılmadığından, böbrek yetmezliği olan hastalarda doz modifikasyonunun gerekmesi beklenmemektedir.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda ofatumumabla özel çalışmalar yürütülmemiştir.
Ofatumumab gibi monoklonal antikorların hepatik metabolizması ihmal edilebilir olduğundan, karaciğer yetmezliğinin farmakokinetiğini etkilemesi beklenmemektedir. Bu nedenle karaciğer yetmezliği olan hastalarda doz modifikasyonu gerekmesi beklenmemektedir.
Cinsiyet:
Cinsiyet çapraz çalışma popülasyonu analizinde ofatumumab merkezi dağılım hacmi üzerinde orta düzeyde (%12) bir etki göstermiş olup, kadın hastalarda daha yüksek C ve EEA değerleri gözlenmiştir (bu analizde hastaların %48'i erkek ve %52'si kadındır); bu etkiler klinik açıdan ilgili kabul edilmez ve dozda ayarlama önerilmemektedir.
Vücut ağırlığı:
Çapraz çalışma popülasyon analizinin sonuçlarına dayalı olarak, vücut ağırlığı, RMS gönüllülerinde ofatumumaba maruziyetin ortak değişkeni (Cve AUC) olarak tanımlanmıştır.
Ancak vücut ağırlığı, klinik çalışmalarda değerlendirilen güvenlilik ve etkililik ölçütlerini etkilememiştir; bu nedenle doz ayarlaması gerekli değildir.
Pediatrik popülasyon:
18 yaşın altındaki pediatrik hastalarda ofatumumabın farmakokinetiğini araştırmak için hiçbir çalışma yapılmamıştır.
Geriyatrik popülasyon:
Kısıtlı klinik deneyimden dolayı 55 yaş üzerindeki hastalarda ofatumumaba özel farmakokinetik çalışmalar yoktur (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler güvenlilik farmakolojisi sonlanım noktaları dahil tekrarlanan doz toksisitesine ilişkin geleneksel çalışmalar temelinde insanlar için özel bir tehlike ortaya koymamıştır.
Ofatumumab ile karsinojenisite veya mutajenisite çalışmaları yürütülmemiştir. Bir antikor olarak ofatumumabın DNA ile doğrudan etkileşim göstermesi beklenmemektedir.
Maymunlarda yürütülen embriyo-fetal gelişim (EFD) ve geliştirilmiş pre/post-natal gelişim (ePPND) çalışmaları, gestasyon sırasında intravenöz olarak verilen ofatumumaba maruziyetin maternal toksisite, teratojenisite ve embriyo-fetal ve pre/post-natal gelişim üzerinde advers etkilere neden olmadığını göstermiştir.
Bu çalışmalarda, ofatumumab fetüslerin ve bebeklerin kanında tespit edilmiş olup, plasental transferi ve doğum sonrası ofatumumaba devam eden fetal maruziyeti (monoklonal antikorun uzun yarılanma ömrü) doğrulamaktadır. Gestasyon sırasında ofatumumaba maruziyet maternal hayvanlarda ve fetüslerinde ve bebeklerinde beklenen CD20+ B-hücreleri azalmasının yanında fetüslerde azalmış dalak ağırlığına (histolojik korelat yokluğunda) ve yüksek dozlarda bebeklerde keyhole limpey hemosiyanine (KLH) azalmış humoral immün yanıta yol açmıştır. Bütün bu değişiklikler doğum sonrası 6 aylık periyot sırasında geri dönüşüm göstermiştir. Bebeklerde, terapötik dozdan 160 kat daha yüksek dozlarda (EEA temelinde) erken doğum sonrası mortalite gözlenmiş olup, muhtemelen immün düzenlenmeye bağlı potansiyel enfeksiyonlardan kaynaklanmıştır. ePPND çalışmasının bebeklerinde ofatumumabın farmakolojik aktivitesi ile ilişkili NOAEL, NOAEL'de maternal maruziyet aylık 20 mg'lık terapötik dozda insan maruziyeti ile kıyaslandığında en az 22 katlık EEA bazlı bir güvenlilik sınırına yol açmaktadır.
Özel bir maymun fertilite çalışmasında erkek ve dişi fertilite sonlanım noktaları etkilenmemiştir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 38861.39 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 38861.39 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699074950483 |
| Etkin Madde | Ofatumumab |
| İthal ( ref. ülke : Malezya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |