KALETRA 200 mg/50 mg 120 film tablet {Abbott} Farmakolojik Özellikler
{ Lopinavir + Ritonavir }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: sistemik kullanım için antiviral ATC kodu: J05AE06
Mikrobiyoloji
Etki mekanizması: Lopinavir HIV-1 ve HIV-2 proteazların bir inhibitörü olup, gag-pol poliproteinin klivajını engelleyerek olgunlaşmamış, enfeksiyöz olmayan virüs üretimine yol açar.
İn vitro antiviral aktivite: Lopinavirin laboratuardaki ve klinikteki HIV suşlarına karşı in vitro antiviral aktivitesi, sırasıyla, akut olarak enfekte edilmiş lenfoblastik hücre dizilerinde ve periferik kan lenfositlerinde değerlendirilmiştir. İnsan serumunun yokluğunda, lopinavirin beş farklı HIV-1 laboratuar suşuna karşı ortalama %50 etkili konsantrasyonu (EC50) 10 ila 27 nm (0.006 - 0.017 mcg/ml, 1 mcg/ml, 1.6 microMa eşdeğerdir) ve birkaç HIV-1 klinik izolatına karşı (n, 6ya eşdeğerdir) 4 ila 11 nm (0.003 - 0.007 mcg/ml) aralığında değişmektedir. Yüzde 50 insan serumu varlığında lopinavirin bu beş laboratuar suşuna karşı ortalama EC50si, 7-11 katlık bir azalmayı göstererek 65 ila 289 nM (0.04 - 0.18) mcg/ml aralığında değişmektedir. Lopinavir ve diğer proteaz inhibitörlerinin ya da ters transkriptaz inhibitörlerinin ilaç kombinasyonu aktivite çalışmaları henüz tamamlanmamıştır.
Direnç
Lopinavire karşı duyarlılığı azalmış olan HIV-1 izolatları in vitro olarak seçilmiştir.
Ritonavirin varlığı, lopinavire dirençli virüslerin in-vitro olarak seçilmesini etkilemediği gözükmektedir.
Çapraz direnç
Klinik öncesi çalışmalar
Proteaz inhibitörleri arasında değişen derecelerde çapraz direnç gözlemlenmiştir. Daha evvel tek bir proteaz inhibitörü ile tedavi edilen hastalardan alınan klinik izolatlara karşı lopinavirin in-vitro aktivitesinin olduğu saptanmıştır. Nelfinavire (n = 13) ve sakuinavire (n = 4), 4 katından daha fazla azalmış duyarlılık gösteren izolatlar, lopinavire karşı 4 kattan daha az duyarlılık göstermiştir. İndinavire (n = 16) ve ritonavire (n = 3), 4 katından daha fazla azalmış duyarlılık gösteren izolatlar, lopinavire karşı sırasıyla ortalama 5.7 ve 8.3 katlık bir azalmış duyarlılık göstermiştir. Daha evvel iki ya da daha fazla proteaz inhibitörü ile tedavi edilen hastalardan alınan izolatlar, klinik kısımda tarif edildiği üzere (bkz. Klinik çalışmalar: Önceden proteaz inhibitör tedavisi almış hastalarda KALETRA®nın antiviral aktivitesi) lopinavire karşı duyarlılıkta daha fazla azalma görülmüştür.
Lopinavir/ritonavir tedavisi esnasında çapraz direnç
Lopinavir/ritonavir tedavisi esnasında seçilen virüslerde çapraz dirence ilişkin çok az bilgi bulunmaktadır.
Daha önce bir veya daha fazla proteaz inhibitörüyle tedavi edilmiş olan 4 hastanın Lopinavir/ritonavir tedavisi sırasında fenotipik lopinavir direnci gelişmiş olan izolatları ya çapraz-dirençli kalmış ya da ritonavir, indinavir ve nelfinavire çapraz direnç geliştirmişlerdir. Bütün rebound virüsler ya tümüyle duyarlı olarak kalmış ya da amprenavire karşı orta derecede azalmış duyarlılık gelişmiştir (lopinavire 99 kat direnç ile eşzamanlı olarak 8.5 kata kadar). Daha önce sakinavir tedavisi uygulanmamış iki bireyden elde edilen rebound izolatlar sakinavire karşı tümüyle duyarlı kalmıştır.
Lopinavir/ritonavire dayalı bir kombinasyon rejimi başlatılan antiretroviral deneyimi olan hastalarda azalmış virolojik yanıtın genotipik ilişkisi
Lopinavir/ritonavire virolojik yanıt, başlangıç noktasındaki proteazlardaki şu üç ya da daha fazla amino asit substitüsyonunun varlığı ile lopinavir/ritonavire virolojik yanıtın etkilendiği gösterilmiştir: L10F/I/R/V, K20M/N/R, L24I, L33F, M36I, 147V, G48V, I54L/T/V, V82A/F/S/T ve I84V. Tablo 1, Çalışma 888, 765 ve 957de başlangıç noktasındaki yukarıdaki proteaz inhibitörüne direnç mutasyonlarının sayısına göre 48 haftalık virolojik yanıtı (HIV RNA < 400 kopya/ml) gösterir (aşağıya bakınız).
Tablo 1
Başlangıç noktasına göre Lopinavir/ritonavir Duyarlılığı ve Lopinavir/ritonavireazalmış yanıt ile ilişkilendirilen Proteaz Substitüsyonlarının sayısında göre 48. haftada Virolojik Yanıt (HIV RNA < 400 kopya /ml) 1
Başlangıç noktasındaki proteaz inhibitörü mutasyonlarının sayısı1 | Çalışma 888 (Tek proteaz inhibitörü deneyimli, NNRTI kullanmamış)2 n = 130 | Çalışma 765 (Tek proteaz inhibitörü deneyimli, NNRTI kullanmamış) 3 n = 56 | Çalışma 957 (çoklu proteaz inhibitörü deneyimli, NNRTI kullanmamış) 4 n = 50 |
0 - 2 | 76/103 (74%) | 34/45 (76%) | 19/20 (95%) |
3 - 5 | 13/26 (50%) | 8/11 (73%) | 18/26 (69%) |
6 ya da daha fazla | 0/1 (0%) | - | 1/4 (25%) |
1 Analizde yer alan substitüsyonlar: L10F/I/R/V, K20M/N/R, L24I, | L33F, M36I, I47V, | ||
G48V, I54L/T/V, V82A/C/F/S/T ve I84V.
2 43% indinavir, 42% nelfinavir, 10% ritonavir, 15% sakinavir.
3 41% indinavir, 38% nelfinavir, 4% ritonavir, 16% sakinavir.
4 86% indinavir, 54% nelfinavir, 80% ritonavir, 70% sakinavir.
Klinik çalışmalar
Önceden proteaz inhibitör tedavisi almış hastalarda KALETRA®nın antiviral aktivitesi:
Lopinavire karşı in vitro duyarlılık azalmasının klinik anlamı, başlangıçtaki viral genotipe ve fenotipe göre Kaletra tedavisine virolojik yanıt değerlendirilerek, daha önce nelfinavir, indinavir, sakinavir ve ritonavirden (Çalışma M98-957) seçilen en az 2 proteaz inhibitörüyle tedaviye rağmen NNRTI kullanmamış ve HIV RNA > 1000 kopya/ml sahip 56 hastada incelenmiştir. Bu çalışmada hastalar başlangıç olarak efavirenz ve nükleozid ters transkriptaz inhibitörleri ile kombinasyon halinde lopinavir/ritonavirin iki dozundan birini almak için randomize edildi. Lopinavirin başlangıç noktasındaki 56 viral izolata karşı EC50 değeri, yabanıl tipteki HIVe karşı EC50 değerine göre 0.5 ila 96 kat daha yüksektir. Bu başlangıç noktasındaki izolatların %56sı (31/56), lopinavire karşı 4 kat daha fazla azalmış duyarlılık göstermiştir. 31 izolatın lopinavir duyarlılığında 27.9 katlık bir ortalama azalma bulunmakta idi.
KALETRA®, efavirenz ve nükleozid ters transkriptaz inhibitörleriyle ile 48 haftalık tedaviden sonra, lopinavire karşı < 10-kat, 10 ila 40-kat arası ve > 40-kat duyarlılık azalması olan hastaların sırasıyla %93 (25/27), %73 (11/15) ve %25inde (2/8) plazma HIV RNAnın < 400 kopya/ml olduğu gözlemlenmiştir. Lopinavir duyarlılığı rekombinant fenotipik teknolojisi kullanılarak virolojik olarak test edilmiştir. Genotip de ayrıca virolojik olarak yapılmıştır. Plazma HIV RNA < 50 kopya/ml, sırasıyla yukarıdaki hasta gruplarının %81 (22/27), %60 (9/15) ve %25 (2/8)inde gözlemlenmiştir
Şu an lopinavir/ritonavir tedavisi gören hastalardaki izolatlarda, lopinavirle ilişkili mutasyon örnekleri aydınlatmak için yeterli veri bulunmamaktadır. Spesifik mutasyon örnekleri ve virolojik yanıt oranları arasındaki ilişkiyi değerlendirmek için daha fazla çalışma gerekmektedir.
Klinik farmakodinamik veriler Erişkinlerdeki Kullanımı:
Önceden antiretroviral tedavi almayan hastalar
Çalışma M98-863: lopinavir/ritonavir günde 2 kez + stavudin + lamivudin ile nelfinavir (günde 3 kez) + stavudin
M98-863 çalışması, daha önce antiretroviral almamış olan 653 hastada nelfinavir (günde üç defa 750 mg) artı stavudin + lamivudinin ile lopinavir/ritonavir (günde iki defa 400/100 mg) artı stavudin + lamivudin tedavisi ile karşılaştırıldığı devam etmekte olan randomize, çift kör, çok merkezli bir çalışmadır. Yaş ortalaması 38 olan (aralık 19 ila 84 arası) hastaların %57si beyaz ırka mensup ve %80i erkek idi. Ortalama başlangıç noktasındaki CD4 hücresi sayısı 259 hücre/mm3 (aralık: 2 - 949 hücre/mm3) ve ortalama başlangıç noktasındaki plazma HIV-1 RNA 4.9 log10 kopya/ml (aralık: 2.6 - 6.8 log10 kopya/ml) idi.
Çalışma M97-765: Günde 2 kez lopinavir/ritonavir + nevirapin + NRTI
M97-765 çalışması, iki doz düzeyinde (400/100 mg ve 400/200 mg, ikisi de günde iki defa) lopinavir/ritonavir artı nevirapin (günde iki defa 200 mg) ve iki nükleosid ters transkriptaz inhibitörünü, daha evvelden tek proteaz inhibitörü deneyimi olan ve daha önce nükleosid olmayan ters transkriptaz inhibitörü kullanmamış olan 70 hastada değerlendiren randomize, kör, çok merkezli devam etmekte olan bir çalışmadır. Yaş ortalaması 40 olan (aralık 22 ila 66 arası) hastaların %73i beyaz ırka mensup ve %90sı erkek idi. Ortalamabaşlangıç noktasındaki CD4 hücre sayısı 372 hücre/mm3 (aralık 72 - 807 hücre/mm3) ve ortalama başlangıç noktasındaki plazma HIV-1 RNA 4.0 log10 kopya/ml (aralık 2.9 -5.8 log10 kopya/ml) olmuştur.
Çalışma 765te tedavinin 144 haftası boyunca, HIV RNA < 400 (< 50) kopya/ml olan hastaların oranı %54 (%50) [n=70] ve CD4 hücre sayısında buna karşılık gelen ortalama artış 212 hücre/mm3 olmuştur. 27 hasta (%39) çalışmayı bırakmış olup advers olaylar nedeniyle bırakan 9 hasta (%13) ve 2 ölüm (%3) buna dahildir.
Pediyatrik Kullanım
Çalışma M98-940
Çalışma M98-940, 80 mg/ml lopinavir ve 20 mg/ml ritonvir içeren lopinavir/ritonavir oral solüsyonunun farmakokinetik profilini, tolerabilitesini, güvenliliğini ve etkinliğini daha önce antiretroviral kullanmamış (%44) ve antiretroviral deneyimli (%56) 100 pediyatrik hastada değerlendiren açık etiketli, çok merkezli bir çalışmadır. Bütün hastalar daha önce non-nükleozid ters transkriptaz inhibitörü kullanmamış olan hastalardır. Hastalar m2 başına 230 mg lopinavir/57.5 mg ritonavir dozu ya da m2 başına 300 mg lopinavir/75 mg ritonavir dozu alacak şekilde randomize edilmişlerdir. Daha önce kullanmamış hastalara ayrıca nükleosid ters transkriptaz inhibitörleri verilmiştir. Deneyimli hastalar nevirapin artı en fazla iki nükleozid ters transkriptaz inhibitörü almışlardır.
5.2. Farmakokinetik özellikler
Genel özellikler
Ritonavir ile birlikte verilen lopinavirin farmakokinetik özellikleri sağlıklı yetişkin gönüllülerde ve HIV ile enfekte hastalarda değerlendirilmiştir: iki grup arasında önemli farklar gözlenmemiştir. Lopinavir esasen tümüyle CYP3A tarafından metabolize edilir. Ritonavir, lopinavir metabolizmasını inhibe ederek lopinavirin plazma düzeylerini arttırır. Çalışmalarda lopinavir/ritonavirin günde iki defa 400/100 mg dozunda kullanımı HIV ile enfekte hastalarda ritonavirden 15-20 kat daha yüksek olan ortalama kararlı durum lopinavir plazma konsantrasyonları elde edilmiştir. Ritonavirin plazma düzeyleri, günde iki defa 600 mg ritonavir dozundan sonra elde edilen düzeylerden %7 daha azdır. Lopinavirin in vitro antiviral EC50 değeri, ritonavirinkinden yaklaşık 10 kat daha düşüktür. Bu nedenle, KALETRA®nın antiviral aktivitesi lopinavire bağlıdır.
Şekil 1, HIV-enfekteli yetişkin hastalarda (n = 19) yapılan bir farmakokinetik çalışmadaki yemeklerle birlikte üç hafta boyunca günde iki defa 400/100 mg lopinavir/ritonavir uygulaması sonrası lopinavirin ve ritonavirin ortalama kararlı durum plazma konsantrasyonlarını gösterir.
Absorpsiyon: HIV-pozitif hastalardaki bir farmakokinetik çalışmada, 3 hafta süreyle yemeklerle birlikte günde iki defa 400/100 mg KALETRA® ile çoklu dozlama, uygulamadan ortalama 4 saat sonra gelişen 9.8 ± 3.7 mcg/mllik bir ortalama ± SD lopinavir doruk plazma konsantrasyonu (Cmax) meydana getirir. Sabah dozundan önceki ortalama kararlı durum vadi konsantrasyonu 7.1 ± 2.9 mcg/ml ve 12 saatlik bir doz aralığı boyunca lopinavir EAAsı ortalama 92.6 ± 36.7 ^g^saat/ml olmuştur. Ritonavirle birlikte formüle edilen lopinavirin insanlardaki mutlak biyoyararlanımı belirlenmiş değildir.
Dağılım: Kararlı durumda, lopinavir plazma proteinlerine yaklaşık %98-99 oranında bağlanır. Lopinavir, alfa-1-asit glikoprotein (AAG) ve albümine bağlanır ama AAG için daha yüksek bir afiniteye sahiptir. Kararlı durumda lopinavirin proteine bağlanması, günde iki defa 400/100 mg KALETRA® dozundan sonra gözlemlenen konsantrasyon aralığı boyunca sabit kalmakta olup sağlıklı gönüllülerde ve HIV-pozitif hastalarda benzer düzeydedir.
Metabolizma: İnsan karaciğer mikrozomlarıyla yapılan in vitro deneyler, lopinavirin başlıca oksidatif metabolizmaya tabi olduğunu göstermiştir. Lopinavir yaygın olarak karaciğer sitokrom P450 sistemince neredeyse tümüyle CYP3A izoenzimi tarafından metabolize edilir. Ritonavir güçlü bir CYP3A inhibitörü olup lopinavir metabolizmasını inhibe ederek lopinavirin plazma düzeylerini artırmaktadır. İnsanlarda yapılan bir 14C-lopinavir çalışması, tek doz 400/100 mg KALETRA® dozundan sonra plazmadaki radyoaktivitenin %89unun ana ilaca bağlı olduğunu göstermiştir. İnsanda lopinavirin en az 13 oksidatif metaboliti saptanmıştır. 4-okso ve 4-hidroksimetabolit epimerik çifti antiviral aktiviteye sahip majör metabolitlerdir ama bunlar toplam plazma radyoaktivitesinin yalnızca küçük miktarlarını oluşturmaktadır. Ritonavirin metabolik enzimleri indükleyerek kendi metabolizmasını ve benzer biçimde lopinavir metabolizmasını indüklediği gösterilmiştir. Çoğul doz sırasında doz öncesi lopinavir konsantrasyonları, zamanla düşerek yaklaşık 10 - 16 gün sonra stabilize olmaktadır.
Şekil 1
*HIV-enfekteli Yetişkin Deneklere ait %95 Güven aralıklarına (CV) sahip Ortalama kararlı durum plazma konsantrasyonları (N=19)
H
n
o
y
s astr
n o
a
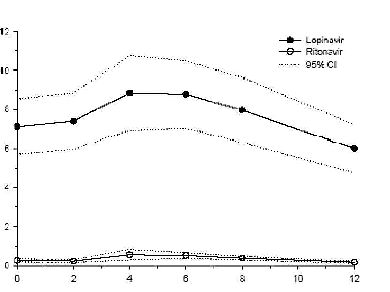
Zaman (saat)
Eliminasyon: 400/100 mg 14C-lopinavir/ritonavir dozunu takiben, uygulanan 14C-lopinavir dozunun sırasıyla yaklaşık %10.4 ± %2.3 ve %82.6 ± %2.5i, 8 gün sonra idrar ve dışkıda bulunmaktadır. Değişmemiş lopinavir idrar ve dışkıda, verilen dozun sırasıyla %2.2 ve %19.8i oranında bulunmaktadır. Çoklu dozlardan sonra lopinavir dozunun %3ten azı değişmeden idrarla atılmaktadır. Lopinavirin görünen oral klerensi (CL/F) 5.98 ± 5.75 L/saat (ortalama ± Standart sapma, N=19) olmuştur.
Günde bir kez doz uygulaması
Günde bir kez lopinavir/ritonavir uygulamasının farmakokinetiği özellikleri HIV-enfekte daha önce antiretroviral tedavi görmemiş hastalarda değerlendirilmiştir. Lopinavir/ritonavir 800/200 mg, günde bir kez doz rejiminin bir parçası olarak emtrisitabin 200 mg ve tenofovir DF 300 mg ile kombinasyon halinde uygulandı. 800/200 mg lopinavir/ritonavirin günde bir kez olarak 4 hafta boyunca yemeklerle birlikte çoklu doz uygulaması (n = 24), uygulamadan yaklaşık 6 saat sonra gelişen 11.8 ± 3.7 ^g/mllik bir ortalama ± standart sapma lopinavir doruk plazma konsantrasyonu (Cmaks) oluşturur. Lopinavirin ortalama kararlı durum vadi konsantrasyonu sabah dozundan önce lopinavirin ortalama kararlı durum vadi konsantrasyonu 3.2 ± 2.1 |ig/ml ve bir doz aralığı içerisinde minimum konsantrasyonu 1.7 ± 1.6 ^g/mldir. 24 saatlik bir doz aralığı boyunca lopinavir EAAsı ortalama 154.1 ± 61.4 ^g*h/ml. olmuştur.
Elektrokardiyogram üzerine etkisi:
QTcF aralığı 39 sağlıklı yetişkinde randomize, plasebo ve aktif (moksifloksasin 400 mg QD) kontrollü çapraz çalışmada, Gün 3de 12 saatin üzerinde 10 ölçüm ile değerlendirilmiştir. Plasebodan gelen QTcFdeki en yüksek ortalama farklılıklar (%95 üst güven sınırı) günde iki kez 400/100 mg ve supraterapötik olarak günde iki kez 800/200 mg LPV/r için sırasıyla 3.6 (6.3) ve 13.1 (15.8) idi.Bu iki doz rejimi Gün 3de aşağı yukarı tavsiye edilen QD ile birlikte gözlenenden veya kararlı durumda günde iki defa LPV/rden 1.5 ve 3 kat fazla açığa çıkma ile sonuçlandı. Hiç bir denek temel seviyeden > 60 msaniyenin QTcFsinde artış veya QTcF aralığında 500 msaniyelik potansiyel klinik olarak uygun eşik değerinin üstüne çıkma durumunu tecrübe etmemiştir.
PR aralığının hafif uzaması aynı çalışmada Gün 3de lopinavir/ritonavir alan deneklerde tespit edilmiştir. En yüksek PR aralığı 286 msaniye olup herhangi ikincil veya üçüncül derecede kalp bloğu gözlenmemiştir. (bakınız bölüm 4.4)
Hastalardaki Karakteristik Özellikler
Pediyatrik hastalar: Günde iki defa 300/75 mg/m2 ve 230/57.5 mg/m2 lopinavir/ritonavir dozlarının farmakokinetiği, yaşları altı ay ile 12 yaş arasında değişen toplam 53 pediyatrik hastada yapılan çalışmalarda incelenmiştir. Nevirapinsiz günde iki defa 230/57.5 mg/m2 rejimi ve nevirapinle günde iki defa 300/75 mg/m2 rejimi, günde iki defa 400/100 mg, (nevirapinsiz) yetişkin hasta rejimindekine benzer lopinavir plazma konsantrasyonları sağlamıştır. Günde bir kez lopinavir/ritonavir uygulaması pediyatrik hastalarda değerlendirilmemiştir.
Günde iki defa 230/57.5 mg/m2 lopinavirle ortalama kararlı durum EAA, Cmax ve Cmin değerleri nevirapin olmadan lopinavir/ritonavirden sonra (n=12) sırasıyla 72.6 ± 31.1mcg*saat/ml, 8.2 ± 2.9 ve 3.4 ± 2.1 mcg/ml ve günde iki defa 300/75 mg/m2 ile (nevirapinle beraber) (n=12) 85.8 ± 36.9 mcg*saat/ml, 10.0 ± 3.3 ve 3.6 ± 3.5 mcg/ml olmuştur. Nevirapin rejimi, günde iki kez 7 mg/kg (6 ay ila 8 yaş arası için) ya da günde iki kez 4 mg/kgdır (8 yaşın üzeri için).
Altı aydan küçük pediyatrik hastalarda KALETRA®nın güvenliliği ve farmakokinetik profilleri kanıtlanmamıştır. Bir klinik çalışma esnasında altı ay ile 12 yaş arası HIV-enfekteli hastalarda görülen advers olay profili yetişkin hastalarınkine benzer idi. Klinik çalışmalarda KALETRA®nın pediyatrik hastalardaki antiviral aktivitesinin değerlendirmesi devam etmektedir. Günde bir kez KALETRA® uygulaması pediyatrik hastalarda değerlendirilmemiştir.
Böbrek yetmezliği: Lopinavirin farmakokinetiği, böbrek yetmezliği olan hastalarda araştırılmamıştır; ancak, lopinavirin böbrek klerensi ihmal edilebilir olduğundan, böbrek yetmezliği olan hastalarda toplam vücut klerensinde bir azalma olması beklenmemektedir.
Karaciğer yetmezliği: Lopinavir çoğunlukla karaciğerde metabolize edilir ve atılır. Hafif veya orta dereceli karaciğer yetmezliği olan HIV ve HCV ile kombine enfeksiyonlu hastalarda, günde iki defa lopinavir/ritonavir 400/100 mg ile yapılan çoğul dozlu bir çalışmasında, normal karaciğer fonksiyonuna sahip HIV enfeksiyonlu hastalara kıyasla lopinavirin EAAsında %30luk bir artış ve Cmaksında %20lik azalma olmuştur. Buna ek olarak, lopinavirin plazma proteinlerine bağlanması, kontrol grubuna kıyasla hafif ila orta düzeyde karaciğer yetmezliği olanlarda daha azdır (sırasıyla 99.09 e karşı. 99.31%) (bkz. 4.5.).
Cinsiyet, Yaş, Irk,
5.3. Klinik öncesi güvenlilik verileri
Akut, Subakut ve Kronik Toksisite
Kemirgenlerde ve köpeklerdeki yinelenen dozlu toksisite çalışmaları, majör hedef organların karaciğer, böbrek, tiroid, dalak ve dolaşımdaki eritrositler olduğunu göstermiştir. Hepatik değişimler fokal dejenerasyonla birlikte hücre şişmesidir. Bu değişimlere yol açan maruziyet, insandaki klinik maruziyet ile karşılaştırılırken hayvanlardaki dozajlar önerilen klinik dozun 6 katından fazladır. İnsanda önerilen dozun en az iki katını alan farelerde hafif renal tübüler dejenerasyon görülürken sıçanlarda ve köpeklerde böbrekler etkilenmemiştir. Sıçanlarda serum tiroksinindeki azalma, tiroid bezlerinde foliküler hücre hipertrofisi ile sonuçlanan bir TSH salınımı artışına yol açmıştır. Bu değişimler etkin maddenin kesilmesiyle geri dönüşlü olup farelerde ve köpeklerde görülmemiştir. Sıçanlarda Coombs-negatif anizositoz ve poikilositoz gözlenmiş ama farelerde ve köpeklerde gözlenmemiştir. Histiyositoz ile birlikte dalak büyümesi sıçanlarda görülmüş ama diğer türlerde görülmemiştir. Serum kolesterolü kemirgenlerde yükselmiş ama köpeklerde yükselmemi ştir. Trigliseridler yalnızca farelerde yükselmiştir.
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Abbott Laboratuvarları İthalat İhracat Tic. Ltd. Şti.
| Geri Ödeme Kodu | A10816 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699548093692 |
| Etkin Madde | Lopinavir + Ritonavir |
| İthal ( ref. ülke : Ingiltere ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |