KEYTRUDA 100 mg/4 ml (25 mg/ml) infüzyonluk çözelti Farmakolojik Özellikler
{ Pembrolizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar, PD-1/PD-L1 (Programlanmış hücre ölümü proteini-1/ölüm ligandı-1) inhibitörleri
ATC kodu: L01FF02
Etki mekanizması
KEYTRUDA programlı hücre ölümü-1 (PD-1) reseptörüne bağlanan ve PD-1 ile ligandları olan PD-L1 ve PD-L2 arasındaki etkileşimi bloke eden bir insanlaştırılmış (humanize) monoklonal antikordur. PD-1 reseptörü, T hücre aracılı immün yanıtların kontrolünde rol oynadığı gösterilmiş olan T hücre aktivitesinin bir negatif düzenleyicisidir. KEYTRUDA PD- 1'in, antijen sunan hücrelerde eksprese edilen ve tümör veya tümör mikroçevresindeki diğer hücrelerde de eksprese edilebilen PD-L1 ve PD-L2'e bağlanmasını bloke ederek T hücre yanıtlarını güçlendirir (anti-tümör yanıtlar dahil).
Klinik etkililik ve güvenlilik
Melonama veya önceden tedavi edilmiş KHDAK'nin klinik çalışmalarında 2 haftada bir 10 mg/kg ve 3 haftada bir 10 mg/kg, 3 haftada bir 2 mg/kg pembrolizumab dozları incelenmiştir. Pembrolizumabın etkililik ve güvenliliği için doz/maruz kalım ilişkilerinin modellemesine ve simülasyonuna dayanarak, monoterapi şeklinde uygulanan 3 haftada bir 200 mg, 3 haftada bir 2 mg/kg ve 6 haftada bir 400 mg dozları arasında etkililik veya güvenlilik bakımından klinik olarak anlamlı hiçbir fark yoktur (bkz. Bölüm 4.2).
Melanoma
KEYNOTE-006: Daha önce ipilimumab ile tedavi edilmemiş melanomalı hastalardaki kontrollü çalışma
Daha önce hiç ipilimumab ile tedavi edilmemiş ileri evre melanomalı hastaların tedavisinde pembrolizumabın güvenliliği ve etkililiği çok merkezli, kontrollü, Faz III KEYNOTE-006 çalışmasında araştırılmıştır. Hastalar 2 haftada bir (n=279) veya 3 haftada bir (n=277) pembrolizumab 10 mg/kg ya da 3 haftada bir 3 mg/kg ipilimumab (n=278) almak üzere randomize edilmiştir (1:1:1). BRAF V600E mutant melanomalı hastaların daha önceden BRAF inhibitör tedavisi almış olmaları şartı aranmamıştır.
hastaların hastalık progresyonu doğrulanıncaya kadar tedaviye devam etmelerine izin
verilmiştir. Tümör durumunun değerlendirmesi 12. haftada, ardından 48. haftaya kadar 6
haftada bir ve daha sonra 12 haftada bir yapılmıştır.
834 hastadan %60'ı erkektir, %44'ü 65 yaş ve üzeridir (medyan yaş: 62 [aralık: 18-89]) ve
%98'i beyazdır. %65'inde M1c evresi ve %9'unda beyin metastazları öyküsü mevcuttur.
%66'sı daha önce hiç tedavi almamış ve %34'ü en az bir tedavi almıştır. %31'inde ECOG PS 1, %69'unda ECOG PS 0'dı ve %32'sinde LDH yüksektir. BRAF mutasyonları 302 (%36) hastada bildirilmiştir. BRAF mutasyonlu tümörleri olan hastalardan 139'u (%46) önceden bir BRAF inhibitörüyle tedavi edilmiştir.
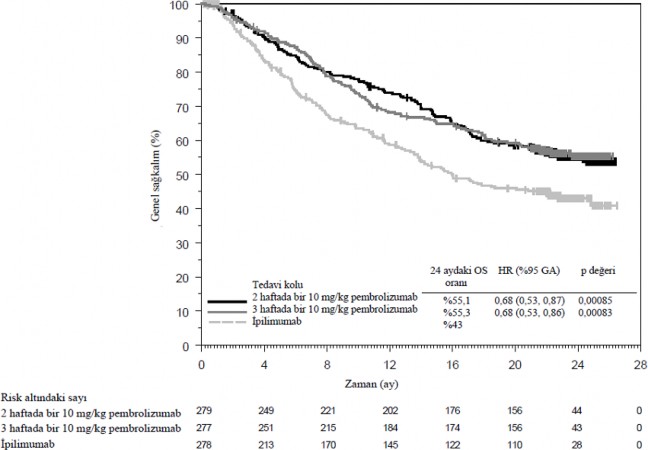
Birincil etkililik sonuç ölçütleri RECIST versiyon 1.1 kullanılarak Entegre Radyoloji ve Onkoloji İncelemesi [IRO] gözden geçirmesiyle değerlendirilen progresyonsuz sağkalım (PFS) ve genel sağkalımdır (OS). İkincil etkililik sonuç ölçütleri genel yanıt oranı (ORR) ve yanıt süresidir. Tablo 3 daha önce ipilimumab tedavisi almamış hastaların minimum 21 aylık takip sonrası gerçekleştirilen final analiz sonucunda ana etkililik ölçümlerini özetlemektedir. Final analizde OS ve PFS için Kaplan-Meier eğrileri Şekil 1 ve 2'de gösterilmektedir.
Tablo 3: KEYNOTE-006 etkililik sonuçları
Sonlanım noktası | 3 haftada bir 10 mg/kg Pembrolizumab n=277 | 2 haftada bir 10 mg/kg Pembrolizumab n=279 | 3 haftada bir 3 mg/kg İpilimumab n=278 |
OS |
|
|
|
Olay yaşayan hastaların sayısı (%) | 119 (%43) | 122 (%44) | 142 (%51) |
Tehlike oranı* (%95 GA) | 0,68 (0,53, 0,86) | 0,68 (0,53, 0,87) | --- |
p-değeri†| < 0,001 | < 0,001 | --- |
Medyan (ay) (%95 GA) | Ulaşılmadı (24, NA) | Ulaşılmadı (22, NA) | 16 (14, 22) |
PFS |
|
|
|
Olay yaşayan hastaların sayısı (%) | 183 (%66) | 181 (%65) | 202 (%73) |
Tehlike oranı* (%95 GA) | 0,61 (0,5, 0,75) | 0,61 (0,5, 0,75) | --- |
p-değeri †| < 0,001 | < 0,001 | --- |
Medyan (ay) (%95 GA) | 4,1 (2,9, 7,2) | 5,6 (3,4, 8,2) | 2,8 (2,8, 2,9) |
En iyi genel yanıt |
|
|
|
ORR % (%95 GA) | %36 (30, 42) | %37 (31, 43) | %13 (10, 18) |
Tam yanıt | %13 | %12 | %5 |
Kısmi yanıt | %23 | %25 | %8 |
Yanıt süresi |
|
|
|
Medyan, aylar (aralık) | Ulaşılmadı (2, 22,8+) | Ulaşılmadı (1,8, 22,8+) | Ulaşılmadı (1,1+, 23,8+) |
18. ayda yanıtın devam ettiği hasta %'si | %68 | %71 | %70 |
*Tehlike oranı (pembrolizumabın ipilimumab ile karşılaştırması) sınıflandırılmış Cox orantılı
tehlike modeline dayanır.
†Sınıflandırılmış Log-rank testine dayanır.
‡ En iyi genel yanıtı doğrulanmış tam veya kısmi yanıt olan hastalara dayanır.
Şekil 1: KEYNOTE-006'da tedavi koluna göre genel sağkalım için Kaplan-Meier eğrisi (tedavi amaçlı popülasyon)
Şekil 2: KEYNOTE-006'da tedavi koluna göre progresyonsuz sağkalım için Kaplan- Meier eğrisi (tedavi amaçlı popülasyon)
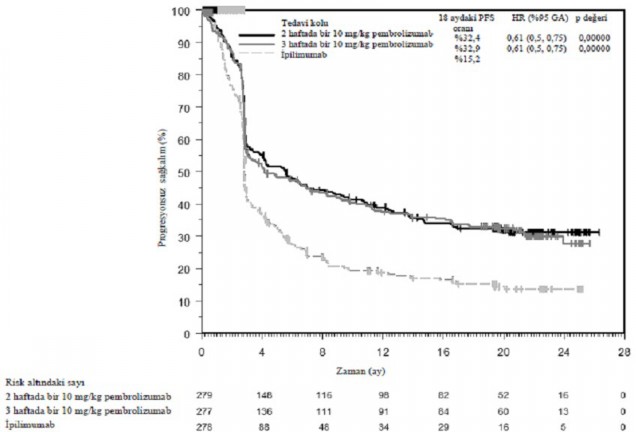
KEYNOTE-002: Önceden ipilimumab ile tedavi edilen melanomalı hastalarda yürütülen kontrollü çalışma
Daha önce ipilimumab ile ve eğer hasta BRAF V600 mutasyonu yönünden pozitif ise bir BRAF veya MEK inhibitörüyle tedavi edilen ileri evre melanomalı hastaların tedavisinde pembrolizumabın güvenliliği ve etkililiği çok merkezli, kontrollü bir çalışmada (KEYNOTE- 002) araştırılmıştır. Hastalar 3 haftada bir 2 mg/kg (n=180) veya 10 mg/kg pembrolizumab (n=181) ya da kemoterapi (n=179; dakarbazin, temozolomid, karboplatin, paklitaksel veya karboplatin+paklitaksel) almak üzere randomize edilmiştir (1:1:1). Otoimmün hastalığı olan veya immünosupresif tedavi alan hastalar çalışmadan dışlanmıştır; diğer dışlama kriterleri, kortikosteroid tedavisi gerektiren herhangi bir derece 4 toksisite veya 12 haftadan daha uzun süre kortikosteroid tedavisi gerektiren (günde 10 mg'dan fazla prednizon ya da eşdeğeri) derece 3 toksisite şeklinde tanımlanan, ipilimumab tedavisiyle ilişkili şiddetli veya yaşamı tehdit eden immün sistem ilişkili advers reaksiyon öyküsü; önceki ipilimumab tedavisinden sonra devam eden ≥ derece 2 advers reaksiyonlar; diğer monoklonal antikorlara geçmişte şiddetli aşırı duyarlılık; pnömonit veya interstisyel akciğer hastalığı öyküsü; HIV, hepatit B veya hepatit C enfeksiyonu ve ECOG Performans Durumu ≥ 2'yi içermiştir.
Hastalar kabul edilemez toksisiteye veya hastalık progresyonuna kadar pembrolizumab ile tedavi edilmiştir. Başlangıçta hastalık progresyonu bulguları olan klinik yönden stabil hastaların hastalık progresyonudoğrulanıncayakadartedaviye devam etmelerine izin
haftada bir ve daha sonra 12 haftada bir yapılmıştır. Kemoterapi alan ve ilk planlanmış
hastalık değerlendirmesinden sonra bağımsız inceleme tarafından doğrulanmış hastalık progresyonu yaşayan hastaların çift-kör koşullarda pembrolizumab tedavisine geçerek 3 haftada bir 2 mg/kg veya 10 mg/kg pembrolizumab almaları mümkün olmuştur.
540 hastadan %61'i erkek, %43'ü 65 yaş ve üzeri (medyan yaş 62'dir [aralık: 15-89]) ve
%98'i beyazdır. %82'sinde M1c evresi mevcuttur. %73'üne ileri evre melanoma için daha önce en az iki sistemik tedavi ve %32'sine üç veya daha fazla sistemik tedavi uygulanmıştır. Hastaların %45'inde ECOG PS 1'dir, %40'ında LDH yüksekliği ve %23'ünde bir BRAF mutasyonlu tümör mevcuttur.
Birincil etkililik sonuç ölçütleri progresyonsuz sağkalım (PFS; Solid Tümörlerde Yanıt Değerlendirme Kriterleri [RECIST 1.1] kullanılarak Entegre Radyoloji ve Onkoloji İncelemesi [IRO]) ile değerlendirilmiştir) ve genel sağkalımdır (OS). İkincil etkililik ölçütleri genel yanıt oranı (ORR) ve yanıt süresidir. Tablo 4 daha önce ipilimumab ile tedavi edilmiş hastalarda final analizde ana etkililik ölçütlerini özetlemektedir; Şekil 3'de ise PFS için Kaplan-Meier eğrisi gösterilmektedir. Her iki pembrolizumab kolu PFS açısından kemoterapiden üstündü ve pembrolizumab dozları arasında hiçbir fark yoktu. Diğer tedaviye (pembrolizumab) geçişin potansiyel olarak karıştırıcı etkileri için düzeltme yapılmayan final OS analizinde pembrolizumab ile kemoterapi arasında istatistiksel olarak anlamlı fark yoktu. Kemoterapi koluna randomize edilen hastalardan %55'i diğer kola geçmiş ve ardından pembrolizumab tedavisi almıştır.
Tablo 4: KEYNOTE-002 etkililik sonuçları
Sonlanım noktası | 3 haftada bir 2 mg/kg Pembrolizumab n=180 | 3 haftada bir 10 mg/kg Pembrolizumab n=181 | Kemoterapi n=179 |
PFS |
|
|
|
Olay yaşayan hastaların sayısı (%) | 150 (%83) | 144 (%80) | 172 (%96) |
Tehlike oranı* (%95 GA) | 0,58 (0,46, 0,73) | 0,47 (0,37, 0,6 | --- |
p-değeri †| < 0,001 | < 0,001 | --- |
Medyan (ay) (%95 GA) | 2,9 (2,8, 3,8) | 3 (2,8, 5,2) | 2,8 (2,6, 2,8) |
OS |
|
|
|
Olay yaşayan hastaların sayısı (%) | 123 (%68) | 117 (%65) | 128 (%72) |
Tehlike oranı* (%95 GA) | 0,86 (0,67, 1,1) | 0,74 (0,57, 0,96) | --- |
p-değeri †| 0,1173 | 0,0106 | --- |
Medyan (ay) (%95 GA) | 13,4 (11, 16,4) | 14,7 (11,3, 19,5) | 11 (8,9, 13,8) |
En iyi genel yanıt |
|
|
|
ORR % (%95 GA) | %22 (16, 29) | %28 (21, 35) | %5 (2, 9) |
Tam yanıt | %3 | %7 | %0 |
Kısmi yanıt | %19 | %20 | %5 |
Yanıt süresi |
|
|
|
Medyan (ay) (aralık) | 22,8(1,4+, 25,3+) | Ulaşılmadı (1,1+, 28,3+) | 6,8 (2,8, 11,3) |
12 ayda devam eden, % | %73 | %79 | %0 |
* Tehlike oranı (pembrolizumabın kemoterapiyle karşılaştırması) sınıflandırılmış Cox orantılı
tehlike modeline dayanır.
†Sınıflandırılmış Log-rank testine dayanır.
‡ Çoklu ayarlama sonrası istatiksel olarak anlamlı değildir.
Şekil 3: KEYNOTE-002'de tedavi koluna göre progresyonsuz sağkalım için Kaplan-
Meier eğrisi (tedavi amaçlı popülasyon)
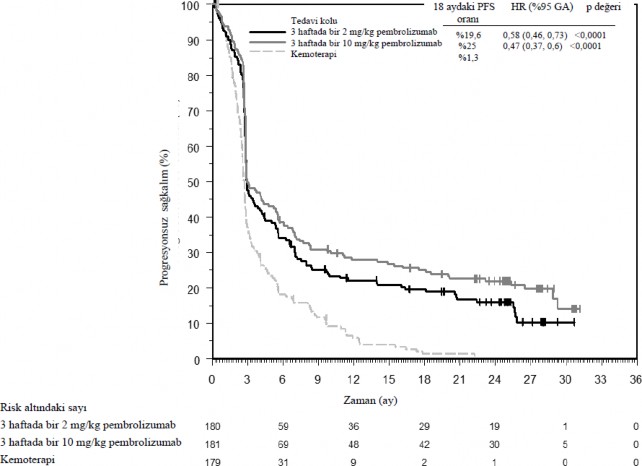
KEYNOTE-001: Daha önce ipilimumab almamış ve önceden ipilimumab ile tedavi edilen melanomalı hastalarda açık etiketli çalışma
İlerlemiş melanomalı hastalarda pembrolizumabın güvenliliği ve etkililiği kontrollü olmayan, açık etiketli KEYNOTE-001 çalışmasında araştırılmıştır. Etkililik, tanımlanan iki kohorttaki 276 hastada değerlendirilmiştir; bu kohortlardan biri daha önce ipilimumab ile tedavi edilen (ve eğer hasta BRAF V600 mutasyonu yönünden pozitif ise bir BRAF veya MEK inhibitörüyle tedavi edilen) hastaları, diğeri ise hiç ipilimumab tedavisi almamış hastalardan oluşmuştur. Hastalar 3 haftada bir 2 mg/kg veya 3 haftada bir 10 mg/kg dozunda pembrolizumab almak üzere randomize edilmiştir. Hastalar kabul edilemez toksisiteye veya hastalık progresyonuna kadar pembrolizumab ile tedavi edilmiştir. Başlangıçta hastalık progresyonu bulguları olan klinik yönden stabil hastaların hastalık progresyonu doğrulanıncaya kadar tedaviye devam etmelerine izin verilmiştir. Hariç bırakma kriterleri KEYNOTE-002 ile benzerdir.
Daha önce ipilimumab ile tedavi edilmiş ve 2 mg/kg pembrolizumab alan 89 hastadan %53'ü erkek, %33'ü 65 yaş ve üzeriydivemedyanyaş59'dur(aralık: 18-88). İki hasta dışında tüm
Hastaların %70'ine ileri evre melanom için daha önce en az iki sistemik tedavi ve %35'ine üç veya daha fazla sistemik tedavi uygulanmıştır. BRAF mutasyonları çalışma popülasyonunun
%13'ünde bildirilmiştir. BRAF mutasyonlu tümörleri olan tüm hastalar daha önce bir BRAF inhibitörüyle tedavi edilmiştir.
Daha önce ipilimumab ile tedavi edilmemiş ve 2 mg/kg pembrolizumab alan 51 hastadan
%63'ü erkektir, %35'i 65 yaş ve üzeridir ve medyan yaş 60'dır (aralık: 35-80). Bir hasta dışında tüm hastalar beyazdır. %63'ünde M1c evresi ve %2'sinde beyin metastazları öyküsü mevcuttur. %45'i ileri evre melanom için daha önce hiç tedavi almamıştır. BRAF mutasyonları 20 (%39) hastada bildirilmiştir. BRAF mutasyonlu tümörleri olan hastalardan 10'u (%50) daha önce bir BRAF inhibitörüyle tedavi edilmiştir.
Birincil etkililik sonuç ölçütü RECIST 1.1 kullanılarak bağımsız gözden geçirmeyle değerlendirilen ORR'dir. İkincil etkililik sonuç ölçütleri hastalık kontrol oranı (DCR; tam yanıt, kısmi yanıt ve stabil hastalığı içerir), yanıt süresi, PFS ve OS'dir. Tümör yanıtı 12 hafta aralıklarla değerlendirilmiştir. Tablo 5 tavsiye edilen dozda pembrolizumab alan, daha önce ipilimumab tedavisi almış veya almamış hastaların en az 30 aylık takibine dayanarak ana etkililik ölçümlerini özetlemektedir.
Tablo 5: KEYNOTE-001 etkililik sonuçları
Sonlanım noktası | Daha önce ipilimumab ile tedavi edilmiş hastalarda 3 haftada bir 2 mg/kg Pembrolizumab n=89 | Daha önce ipilimumab ile tedavi edilmemiş hastalarda 3 haftada bir 2 mg/kg Pembrolizumab n=51 |
En iyi genel yanıt*, IRO'ya göre †|
|
|
ORR % (%95 GA) | %26 (17, 36) | %35 (22, 50) |
Tam yanıt | %7 | %12 |
Kısmi yanıt | 19 | %24 |
Hastalık Kontrol Oranı, % | %48 | %49 |
Yanıt süresi |
|
|
Medyan (ay) (aralık) | 30,5 (2,8+, 30,6+) | 27,4 (1,6+, 31,8+) |
24. ayda devam eden, % | %75 | %71 |
PFS |
|
|
Medyan (ay) (%95 GA) | 4,9 (2,8, 8,3) | 4,7 (2,8, 13,8) |
12. ayda PFS oranı | %34 | %38 |
OS |
|
|
Medyan (ay) (%95 GA) | 18,9 (11, mevcut değil) | 28 (14, mevcut değil) |
24. ayda OS oranı | %44 | %56 |
* Bağımsız radyolojiye göre başlangıçta ölçülebilir hastalığı olmayan hastaları içerir.
†IRO = RECIST 1.1'in kullanıldığı Entegre Radyoloji ve Onkoloji Değerlendirmesi
‡ Stabil hastalık veya daha iyisini içeren en iyi yanıta dayanır.
§ Yanıtın ilk kaydedildiği tarihten itibaren, bağımsız gözden geçirmeyle doğrulanan bir yanıtı olan hastaları esas alır; n=23 daha önce ipilimumab ile tedavi edilen hastalarda; n=18 daha önce ipilimumab ile tedavi edilmemiş hastalarda.
¶ Kaplan-Meier hesaplamasına dayanır.
Daha önce ipilimumab ile tedavi edilmiş (n=84) ve önceden ipilimumab ile tedavi edilmemiş (n=52) olup 3 haftada bir 10 mg/kg pembrolizumab alan hastalardaki sonuçlar 3 haftada bir 2 mg/kg pembrolizumab alan hastalardaki sonuçlarla benzerdir.
Alt popülasyon analizleri
Melanoma'da BRAF mutasyonu durumu
Tablo 6'da özetlendiği üzere, KEYNOTE-002'de BRAF vahşi tipi (n=414; %77) hastalarda veya önceden BRAF tedavisi almış BRAF mutasyonlu hastalarda (n=126; %23) final analizin bir parçası olarak bir alt grup analizi yapılmıştır.
Tablo 6: KEYNOTE-002'de BRAF mutasyonlu hastalarda etkililik sonuçları
| BRAF vahşi tipi | BRAF tedavisi almış BRAF mutasyonlu hastalar | ||
Sonlanım noktası | 3 haftada bir 2 mg/kg Pembrolizumab (n=136) | Kemoterapi (n=137) | 3 haftada bir 2 mg/kg Pembrolizumab (n=44) | Kemoterapi (n=42) |
PFS Tehlike oranı* (%95 GA) | 0,5 (0,39, 0,66) | .... | 0,79 (0,5, 1,25) | .... |
OS Tehlike oranı* (%95 GA) | 0,78 (0,58, 1,04) | ... | 1,07 (0,64, 1,78) | ... |
ORR | %26 | %6 | %9 | %0 |
* Tehlike oranı (pembrolizumabın kemoterapi ile karşılaştırması) sınıflandırılmış Cox orantılı tehlike modeline dayanır
Tablo 7'de özetlendiği üzere, KEYNOTE-006'da BRAF yabani tipi olan hastalarda (n=525;
%63), daha önce BRAF tedavisi almamış BRAF mutasyonlu hastalarda (n=163; %20) ve daha önce BRAF tedavisi almış BRAF mutasyonlu hastalarda (n=139; %17) final analizin bir parçası olarak bir alt grup analizi yapılmıştır.
| BRAF yabani tipi | BRAF tedavisi almamış BRAF mutasyonlu hastalar | BRAF tedavisi almış BRAF mutasyonlu hastalar | |||
Sonlanım | Her 2 | İpilimumab | Her 2 veya | İpilimumab | Her 2 veya | İpilimumab |
noktası | veya 3 | (n=170) | 3 haftada | (n=55) | 3 haftada | (n=52) |
| haftada |
| bir 10 |
| bir 10 |
|
| bir 10 |
| mg/kg |
| mg/kg |
|
| mg/kg |
| Pembroliz |
| Pembroliz |
|
| Pembrol |
| umab |
| umab |
|
| izumab |
| (havuzlan |
| (havuzlan |
|
| (havuzla |
| mış) |
| mış) |
|
| nmış) |
|
|
|
|
|
PFS | 0,61 | .... | 0,52 | .... | 0,76 (0,51, | .... |
Tehlike | (0,49, |
| (0,35, |
| 1,14) |
|
oranı* | 0,76) |
| 0,78) |
|
|
|
(%95 |
|
|
|
|
|
|
GA) |
|
|
|
|
|
|
OS Tehlike oranı* (%95 | 0,68 (0,52, 0,88)
| ...
| 0,7 (0,4, 1,22)
| ...
| 0,66 (0,41, 1,04)
s://www.turkiye.gov | ...
|
ORR | %38 | %14 | %41 | %15 | %24 | %10 |
Tablo 7: KEYNOTE-006'da BRAF mutasyonlu hastalarda etkililik sonuçları
* Tehlike oranı (pembrolizumabın kemoterapi ile karşılaştırması) sınıflandırılmış Cox orantılı tehlike modeline dayanır
Melanoma'da PD-L1 durumu
KEYNOTE-002'de PD-L1 pozitif olan hastaları (tümör ve tümör ilişkili immün hücrelerin ≥
%1'inde PD-L1 ekspresyonu) PD-L1 negatif hastalarla karşılaştıran final analizin parçası olarak bir alt grup analizi yapılmıştır. PD-L1 ekspresyonu 22C3 anti-PD-L1 antikoruyla geriye dönük olarak immünohistokimya yöntemiyle analiz edilmiştir. PD-L1 ekspresyonu yönünden değerlendirilebilir nitelikte olan hastalardan (%79), %69'u (n=294) PD-L1 pozitif ve %31'i (n=134) PD-L1 negatiftir. PD-L1 ekspresyonuna göre etkililik sonuçları Tablo 8'de özetlenmektedir.
Tablo 8: KEYNOTE-002'de PD-L1 ekspresyonuna göre etkililik sonuçları
Sonlanım noktası | 3 haftada bir 2 mg/kg Pembrolizumab | Kemoterapi | 3 haftada bir 2 mg/kg Pembrolizumab | Kemoterapi |
| PD-L1 pozitif | PD-L1 negatif | ||
PFS Tehlike oranı* (%95 GA) | 0,55 (0,4, 0,76) | .... | 0,81 (0,5, 1,31) | .... |
OS Tehlike oranı* (%95 GA) | 0,9 (0,63, 1,28) | ... | 1,18 (0,7, 1,99) | ... |
ORR | %25 | %4 | %10 | %8 |
* Tehlike oranı (pembrolizumabın kemoterapi ile karşılaştırması) sınıflandırılmış Cox orantılı tehlike modeline dayanır
KEYNOTE-006'da PD-L1 pozitif hastaları (n=671; %80) PD-L1 negatif hastalarla (n=150;
%18) karşılaştıran final analizin parçası olarak bir alt grup analizi yapılmıştır. PD-L1 ekspresyonu yönünden değerlendirilebilir nitelikte olan hastalardan (%98), %82'si PD-L1 pozitif ve %18'i PD-L1 negatiftir. PD-L1 ekspresyonuyla etkililik sonuçları Tablo 9'da özetlenmektedir.
Sonlanım noktası | Her 2 veya 3 haftada bir 10 mg/kg Pembrolizumab (havuzlanmış) | İpilimumab | Her 2 veya 3 haftada bir 10 mg/kg Pembrolizumab (havuzlanmış) | İpilimumab |
| PD-L1 pozitif | PD-L1 negatif | ||
PFS Tehlike oranı* (%95 GA) | 0,53 (0,44, 0,65) | .... | 0,87 (0,58, 1,3) | .... |
OS Tehlike oranı* (%95 GA) | 0,63 (0,5, 0,8) | ... | 0,76 (0,48, 1,19) | ... |
ORR | %40 | %13 | ||
Tablo 9: KEYNOTE-006'da PD-L1 ekspresyonuna göre etkililik sonuçları
Oküler melanom
KEYNOTE-001 çalışmasına dahil edilen oküler melanomlu 20 hastada hiç objektif yanıt bildirilmemiştir; 6 hastada stabil hastalık bildirilmiştir.
KHDAK
KEYNOTE-024: Daha önce tedavi görmemiş hastalarda KHDAK'nin kontrollü çalışması Önceden tedavi uygulanmamış metastatik KHDAK'nin tedavisinde pembrolizumabın güvenliliği ve etkililiği çok merkezli, kontrollü KEYNOTE-024 çalışmasında araştırılmıştır. Hastalar PD-L1 IHC 22C3 pharmDx Kiti ile belirlenen PD-L1 ekspresyonu ≥ %50 tümör oran skoruna (TPS) sahipti. Hastalar 3 haftada bir 200 mg pembrolizumab (n=154) veya araştırmacının seçtiği platin içeren kemoterapi (n=151; pemetreksed+karboplatin, pemetreksed+sisplatin, gemsitabin+sisplatin, gemsitabin+karboplatin veya paklitaksel+karboplatin dahil) almak üzere randomize edilmiştir (1:1). Skuamöz olmayan hastalar pemetreksed idame tedavisini alabileceklerdi. Hastalar kabul edilemez toksisite veya hastalık progresyonuna kadar pembrolizumab ile tedavi edilmiştir. Hastanın klinik yönden stabil olması ve araştırmacının hastanın klinik fayda gördüğünü düşünmesi halinde tedaviye hastalık progresyonundan sonra devam edilebilmiştir. Hastalık progresyonu olmayan hastalar 24 aya kadar tedavi edilebilecekti. Çalışmaya EGFR veya ALK genomik tümör mutasyonları olan hastalar, son 2 yılda sistemik tedavi gerektiren bir otoimmün hastalığı olan hastalar, immünosupresyon gerektiren bir tıbbi durumu olan hastalar ve son 26 haftada göğüs bölgesine 30 Gy'den fazla radyasyon alan hastalar dahil edilmemiştir. Tümör durumu değerlendirmesi 9 haftada bir yapılmıştır. Kemoterapi alan ve bağımsız olarak doğrulanan hastalık progresyonu yaşayan hastaların diğer kola geçerek pembrolizumab almaları mümkündü.
KEYNOTE-024 çalışmasındaki 305 hastanın başlangıç karakteristikleri şöyleydi: medyan yaş 65 (%54'ü 65 yaş ve üzeri); %61'i erkek; %82'si beyaz, %15'i Asyalı; ECOG performans durumu %35 ve %65'inde sırasıyla 0 ve 1. Hastalık karakteristikleri skuamöz (%18) ve skuamöz olmayan (%82); M1 (%99) ve beyin metastazlarını (%9) içermiştir.
Birincil etkililik sonuç ölçütü RECIST 1.1 kullanılarak körlenmiş bağımsız merkezi gözden geçirmeyle (BICR) değerlendirilen PFS'ydi. İkincil etkililik sonuç ölçütleri OS ve ORR'ydi (RECIST 1.1 kullanılarak BICR ile değerlendirilmiştir). Tablo 10 tüm ITT popülasyonunda ana etkililik ölçütlerini özetlemektedir. PFS ve ORR sonuçları medyan 11 aylık takip süresini içeren bir ara analizden bildirilmektedir. OS sonuçları medyan 25 aylık takip süresini içeren son analizden bildirilmektedir.
Tablo 10: KEYNOTE-024'ün Etkililik Sonuçları
Sonlanım Noktası | Pembrolizumab
3 haftada bir 200 mg n=154 | Kemoterapi n=151 |
PFS |
|
|
Olay yaşayan hastaların sayısı (%) | 73 (%47) | 116 (%77) |
Tehlike oranı* (%95 GA) | 0,5 (0,37, 0,68) | |
p-değeri | <0,001 | |
Medyan (ay) (%95 GA) | 10,3 (6,7, NA) | 6 (4,2, 6,2) |
OS |
|
|
Olay yaşayan hastaların sayısı (%) | 73 (%47) | 96 (%64) |
Tehlike oranı* (%95 GA) | 0,63 (0,47, 0,86) | |
p-değeri | 0,002 | |
Medyan (ay) (%95 GA) | 30 (18,3, NA) | 14,2 (9,8, 19) |
Objektif Yanıt Oranı |
|
|
ORR % (%95 GA) | %45 (37, 53) | %28 (21, 36) |
Tam yanıt, % | %4 | %1 |
Kısmi yanıt, % | %41 | %27 |
Yanıt süresi |
|
|
Medyan (ay) (aralık) | Ulaşılmadı (1,9+, 14,5+) | 6.3 (2,1+, 12,6+) |
Yanıt süresi > 6 ay olan hastaların %'si | %88 | %59 |
* Tehlike oranı (pembrolizumabın kemoterapi ile karşılaştırması) sınıflandırılmış Cox orantılı tehlike modeline dayanır
†Sınıflandırılmış Log-rank testine dayanır
‡ En iyi genel yanıtı doğrulanmış tam veya kısmi yanıt olan hastalara dayanır
§ Kaplan-Meier tahminlerine dayanır; 6 ay veya daha uzun süren yanıtlara sahip olan 43 hastayı içerir
¶ Kaplan-Meier tahminlerine dayanır; 6 ay veya daha uzun süren yanıtlara sahip olan 16 hastayı içerir
NA = mevcut değil
Şekil 4: KEYNOTE-024'de tedavi koluna göre progresyonsuz sağkalımın Kaplan-Meier eğrisi (Tedavi Amaçlı Popülasyon)
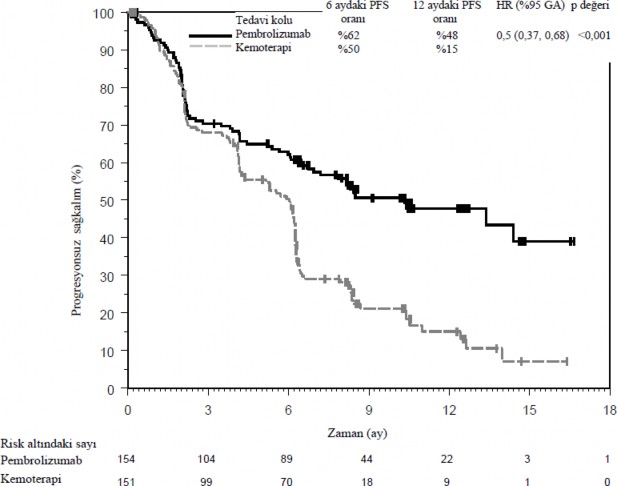
Şekil 5: KEYNOTE-024'de tedavi koluna göre genel sağkalımın Kaplan-Meier eğrisi (Tedavi Amaçlı Popülasyon)
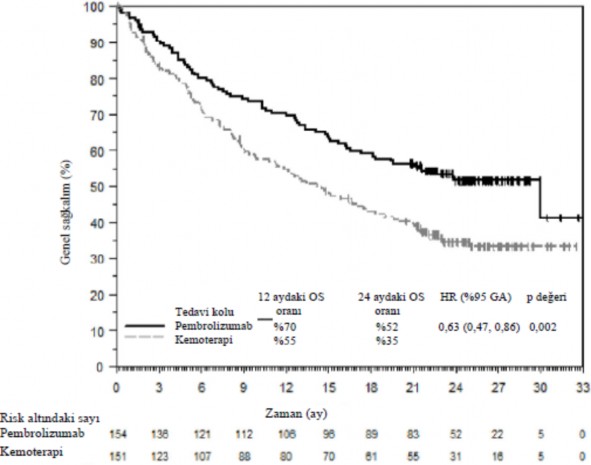
Bir alt grup analizinde, hiç sigara kullanmamış az sayıda hastada kemoterapiye göre pembrolizumabın daha düşük sağkalım yararı gözlemlenmiştir; bununla birlikte, hasta sayısının azlığından dolayı bu verilerden kesin sonuçlara varılamaz.
KEYNOTE-042: Daha önce tedavi görmemiş KHDAK hastaları üzerinde kontrollü çalışma
Pembrolizumabın güvenliliği ve etkililiği, daha önce tedavi edilmemiş lokal ileri veya metastatik KHDAK'nin tedavisine yönelik çok merkezli, kontrollü bir çalışma olan KEYNOTE-042'de de araştırılmıştır. Çalışma tasarımı, hastaların PD-L1 IHC 22C3 pharmDxTM Kitine göre >%1 TPS ile PD-L1 ekspresyonuna sahip olması dışında KEYNOTE-024'ünkine benzerdi. Hastalar, her 3 haftada bir 200 mg pembrolizumab (n=637) veya araştırmacının tercih ettiği platin içeren kemoterapi (n=637; pemetreksed+karboplatin veya paklitaksel+karboplatin dahil) almak üzere randomize edildi (1:1). Skuamöz olmayan KHDAK'li hastalar pemetrexed bakım alabilir.). Tümör durumunun değerlendirilmesi, ilk 45 hafta boyunca her 9 haftada bir ve daha sonra her 12 haftada bir yapıldı.
KEYNOTE-042'deki 1.274 hastanın 599'unda (%47) PD-L1 IHC 22C3 pharmDxTM Kitine göre TPS ≥ %50 olan PD-L1 eksprese eden tümörler vardı. Bu 599 hastanın temel özellikleri şunları içeriyordu: medyan yaş 63 (65 yaş ve üzeri %45); %69 erkek; %63 Beyaz ve %32
Asyalı; %17 Hispanik veyaLatin;veECOGperformansdurumu sırasıyla %31 ve %69'da 0
Birincil etkililik sonuç ölçüsü OS idi. İkincil etkililik sonuç ölçütleri, PFS ve ORR idi (BICR tarafından RECIST 1.1 kullanılarak değerlendirildiği gibi). Çalışma, kemoterapiye kıyasla pembrolizumab monoterapisine randomize edilmiş tümörleri PD-L1 TPS ≥ %1 eksprese eden hastalarda (son analizde HR 0,82; %95 CI 0,71, 0,93) ve tümörleri PD eksprese eden hastalarda OS'de istatistiksel olarak anlamlı bir iyileşme göstermiştir. PD-L1 TPS ≥ %50, kemoterapiye kıyasla pembrolizumab monoterapisine randomize edilmiştir. Tablo 11, 15.4 aylık medyan takipte gerçekleştirilen son analizde TPS > %50 popülasyonu için temel etkililik ölçümlerini özetlemektedir. Son analize dayalı olarak TPS ≥ %50 popülasyonu için OS için Kaplan-Meier eğrisi Şekil 6'da gösterilmektedir.
Tablo 11: KEYNOTE-042'de etkililik sonuçları (PD-L1 TPS > %50)
Sonlanım Noktası | Pembrolizumab
3 haftada bir 200 mg
n=299 | Kemoterapi n=300 |
OS |
|
|
Olay yaşayan hastaların sayısı (%) | 180 (%60) | 220 (%73) |
Tehlike oranı* (%95 GA) | 0,7 (0,58, 0,86) | |
p-değeri | 0,0003 | |
Medyan (ay) (%95 GA) | 20 (15,9 24,2) | 12,2 (10,4 14,6) |
PFS |
|
|
Olay yaşayan hastaların sayısı (%) | 238(%80) | 250 (%83) |
Tehlike oranı* (%95 GA) | 0,84 (0,7, 1,01) | |
Medyan (ay) (%95 GA) | 6,5 (5,9 8,5) | 6,4 (6,2, 7,2) |
Objektif Yanıt Oranı |
|
|
ORR % (%95 GA) | %39 (34, 45) | %32 (27, 38) |
Tam yanıt | %1 | %0,3 |
Kısmi yanıt | %38 | %32 |
Yanıt süresi |
|
|
Medyan (ay) (aralık) | 22 (2,1+, 36,5+) | 10,8 (1,8+, 30,4+) |
Yanıt süresi > 18ay olan hastaların %'si | %57 | %34 |
* Tehlike oranı (pembrolizumabın kemoterapi ile karşılaştırması) sınıflandırılmış Cox orantılı tehlike modeline dayanır
†Sınıflandırılmış Log-rank testine dayanır
‡ En iyi genel yanıtı doğrulanmış tam veya kısmi yanıt olan hastalara dayanır
Şekil 6: KEYNOTE-042'de tedavi koluna göre genel sağkalım için Kaplan-Meier eğrisi (PD-L1 ekspresyonu TPS ≥ %50 olan hastalar, popülasyonu tedavi etme amaçlı)
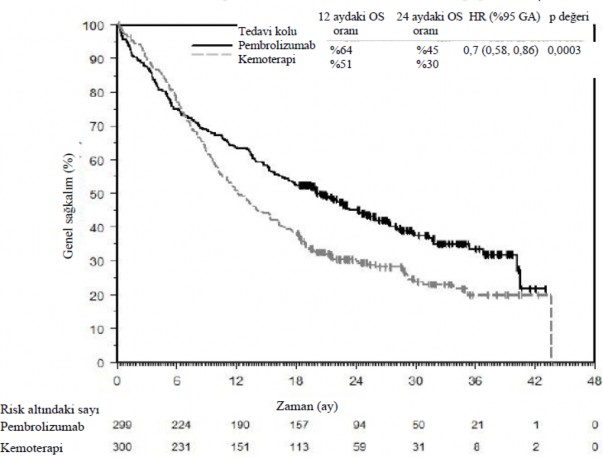
Post-hoc keşif amaçlı bir alt grup analizinin sonuçları, hiç sigara içmemiş hastalarda hem ilk 4 ay boyunca hem de tüm tedavi süresi boyunca kemoterapiye kıyasla pembrolizumabın sağkalım yararında azalma yönünde bir eğilim göstermiştir. Ancak, bu alt grup analizinin keşifsel doğası nedeniyle, kesin sonuçlara varılamaz.
KEYNOTE-189: Daha önce tedavi almamış skuamöz olmayan KHDAK hastalarında kombine tedaviyi inceleyen kontrollü çalışma
Pemetreksed ve platin kemoterapisiyle kombine uygulanan pembrolizumabın etkililiği KEYNOTE-189 adlı çok merkezli, randomize, aktif-kontrollü, çift-kör bir çalışmada araştırılmıştır. Ana uygunluk kriterleri metastatik skuamöz olmayan KHDAK, metastatik KHDAK için daha önce hiçbir sistemik tedavi almamış olmak ve EGFR veya ALK genomik tümör mutasyonlarının olmamasıydı. Tedaviden önceki 2 yılda sistemik tedavi gerektiren bir otoimmün hastalığı olan hastalar, immünosupresyon gerektiren bir tıbbi durumu olan hastalar ve son 26 haftada göğüs bölgesine 30 Gy'den fazla radyasyon alan hastalar çalışmaya dahil edilmemiştir. Hastalar aşağıdaki rejimlerden birini almak üzere randomize edilmiştir (2:1):
5.2. Farmakokinetik özellikler
Genel özelliklerPembrolizumabın farmakokinetik özellikleri 2 haftada bir 1-10 mg/kg arasında, 3 haftada bir 2 - 10 mg/kg arasında değişen dozlar veya 3 haftada bir 200 mg alan metastatik veya rezeke edilemeyen melanoma, KHDAK veya karsinomlu 2.993 hastada çalışılmıştır.
Emilim:
Pembrolizumab intravenöz yolla uygulanır ve dolayısıyla hemen tam biyoyararlanıma ulaşır.
Dağılım:
Sınırlı ekstravasküler dağılımla uyumlu olarak, kararlı durumda pembrolizumabın dağılım hacmi küçüktür (yaklaşık 6,0 L; varyasyon katsayısı (CV): %20). Bir antikordan bekleneceği gibi, pembrolizumab plazma proteinlerine spesifik biçimde bağlanmaz.
Biyotransformasyon:
Pembrolizumab spesifik olmayan yollarla katabolize edilir, metabolizma pembrolizumabın klirensine katkıda bulunmaz.
Eliminasyon:
Pembrolizumabın klirensi ilk doza kıyasla (252 mL/gün [CV%: %37]) kararlı durumda maksimal değişikliğe ulaştıktan sonra yaklaşık %23 oranında daha düşüktür (geometrik ortalama, 195 mL/gün [CV%: %40]), zaman içinde klirenste gözlenen bu azalma klinik yönden anlamlı kabul edilmemektedir. Terminal yarı ömrün geometrik ortalama değeri (CV%) kararlı durumda 22 gündür (%32).
Doğrusallık/Doğrusal Olmayan Durum:
Zirve konsantrasyon (C) veya zamana karşı plazma konsantrasyonu eğrisinin altında kalan alan (EAA) ile ifade edilen pembrolizumabın maruz kalımı etkililik açısından doz aralığında dozla orantılı şekilde artmıştır. 3 haftada bir uygulama rejimiyle tekrarlı dozlamadan sonra 16. haftada pembrolizumabın kararlı durum konsantrasyonlarına ulaşılmış ve sistemik birikim 2,1 kat olmuştur. Kararlı durumda medyan vadi konsantrasyonlar (C), 3 haftada bir 2 mg/kg dozunda yaklaşık 22 mcg/mL ve 3 haftada bir 200 mg dozunda yaklaşık 29 mcg/mL bulunmuştur. 3 hafta boyunca kararlı durum konsantrasyonuna karşı zaman eğrisi altındaki medyan alan, 3 haftada bir 2 mg/kg dozunda 794 mcg gün/mL ve 3 haftada bir 200 mg dozunda 1,053 mcg gün/mL bulunmuştur.
cHL ve diğer tümör tipleri arasında medyan C'ta kayda değer bir fark saptanmamıştır. cHL ve diğer tümör tiplerindeki mevcut güvenlilik verilerine dayanarak, bu farklılıklar klinik olarak anlamlı bulunmamıştır.
Özel Popülasyonlar
Çeşitli eş değişkenlerin pembrolizumabın farmakokinetikleri üzerindeki etkileri popülasyon farmakokinetik analizlerinde değerlendirilmiştir. Bu faktörler pembrolizumabın klirensi üzerinde klinik yönden önemli hiçbir etkiye yol açmamıştır; yaş (aralık: 15-94 yaş), cinsiyet, ırk, hafif veya orta derecede böbrek yetmezliği, hafif veya orta derecede karaciğer yetmezliği ve tümör yükü. Vücut ağırlığı ve klirens arasındaki ilişki, maruziyetin yeterli ve benzer kontrolünü sağlamak için sabit dozu veya vücut ağırlığına dayalı dozlamayı desteklemektedir. Pediyatrik hastalarda (> 3 ila 17 yaş) her 3 haftada bir 2 mg / kg ağırlığa dayalı dozaj ile pembrolizumab maruziyeti, aynı dozdaki yetişkinlerinkine benzerdir.
Böbrek Yetmezliği:
Böbrek yetmezliğinin pembrolizumabın klirensine etkisi, hafif veya orta derecede böbrek yetmezliği olan hastaların böbrek fonksiyonu normal olan hastalarla karşılaştırıldığı popülasyon farmakokinetik analizlerinde değerlendirilmiştir. Hafif veya orta derecede böbrek yetmezliği olan hastalarla böbrek fonksiyonu normal olan hastalar arasında pembrolizumabın klirensi bakımından klinik yönden önemli farklar saptanmamıştır. Pembrolizumab şiddetli böbrek yetmezliği olan hastalarda çalışılmamıştır.
Karaciğer Yetmezliği:
Karaciğer yetmezliğinin pembrolizumabın klirensine etkisi, hafif ve orta derecede karaciğer yetmezliği (A.B.D. Ulusal Kanser Enstitüsü'nün karaciğer fonksiyon bozukluğu kriterleri kullanılarak tanımlanmıştır) olan hastalar karaciğer fonksiyonu normal olan hastalarla karşılaştırılarak popülasyon farmakokinetik analizlerinde değerlendirilmiştir. Hafif veya orta derecede karaciğer yetmezliği olan hastalarla karaciğer fonksiyonu normal olan hastalar arasında pembrolizumabın klirensi bakımından klinik yönden önemli farklar saptanmamıştır. Pembrolizumab şiddetli karaciğer yetmezliği olan hastalarda çalışılmamıştır (bkz. Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Merck İlaç Ecza ve Kimya Ticaret AŞ
| Satış Fiyatı | |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699636080160 |
| Etkin Madde | Pembrolizumab |
| ATC Kodu | L01XC18 |
| Birim Miktar | 25 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |