KOLROS 20 mg 28 film kaplı tablet Kısa Ürün Bilgisi
{ Rosuvastatin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
KOLROS 20 mg film tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir tablet; 20 mg rosuvastatine eşdeğer miktarda 20,8 mg rosuvastatin kalsiyum içerir.
Yardımcı maddeler
Laktoz monohidrat (sığır sütü kaynaklı) 120 mg Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film tablet
Pembe renkli, film kaplı, oval, bikonveks tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Hiperkolesteroleminin tedavisi
Diyet ve diğer farmakolojik olmayan tedavilere (örn. egzersiz, kilo verme) cevabın yetersiz olduğu durumlarda, diyete ilave olarak, primer hiperkolesterolemili (heterozigot ailesel hiperkolesterolemi dahil Tip IIa) veya karma dislipidemili (Tip IIb) yetişkinler, adölesanlar ve 10 yaş ve üstü çocuklarda kullanılır.
Diyet ve diğer lipid düşürücü tedavilere (örneğin; LDL aferezi) ilave olarak ya da bu tür tedavilerin uygun olmadığı durumlarda homozigot ailesel hiperkolesterolemili yetişkinler, adölesanlar ve 6 yaş ve üstü çocuklarda kullanılır.
Kardiyovasküler olaylardan korunma
Diğer risk faktörlerinin düzeltilmesine ilave olarak, ilk kardiyovasküler olay (bkz. Bölüm 5.1) riskinin yüksek olduğu düşünülen hastalarda majör kardiyovasküler olaylardan korunmada kullanılır.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiKOLROS ile tedaviye başlamadan önce hastaya tedavi süresince de devam etmesi gereken standart kolesterol düşürücü diyet uygulanır. KOLROS dozu, mevcut kılavuzlar esas alınarak, tedavinin amacına ve hastanın yanıtına göre ayarlanmalıdır.
Hiperkolesteroleminin tedavisi
Statine yeni başlayanlarda ve başka bir HMG KoA redüktaz inhibitöründen rosuvastatin tedavisine geçilen hastalarda tavsiye edilen başlangıç dozu oral olarak günde tek doz 5 veya 10
mg'dır. Başlangıç dozu seçiminde hastaların bireysel kolesterol düzeyleri, advers reaksiyonlar için olası riskin yanısıra ilerideki kardiyovasküler risk dikkate alınmalıdır (aşağıya bakınız). Gerekirse 4 hafta sonra doz bir sonraki doz seviyesine ayarlanabilir (bkz. Bölüm 5.1). Daha düşük dozlara kıyasla 40 mg doz ile advers etkilerin bildirilme sıklığında artış nedeniyle (bkz. Bölüm 4.8), dozun, maksimum doz olan 40 mg'a çıkarılması sadece, 20 mg doz ile yeterli yanıt alınamayan, kardiyovasküler hastalık riski yüksek olan ağır hiperkolesterolemili hastalarda (özellikle ailesel hiperkolesterolemili hastalar) düşünülmelidir. Bu hastalar düzenli olarak izlenmelidir. (bkz. Bölüm 4.4). 40 mg dozun, uzman (kardiyolog veya endokrinolog) gözetiminde kullanılmaya başlanması önerilmektedir.
Kardiyovasküler Olayların Önlenmesi
Kardiyovasküler olay riskini azaltma çalışmasında kullanılan doz günde 20 mg'dır (bkz. Bölüm 5.1)
Uygulama şekli :
KOLROS, günün herhangi bir saatinde, aç veya tok karnına alınabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği :
Hafif ve orta derecede böbrek yetmezliği olanlarda doz ayarlamasına gerek yoktur.
Orta derecede böbrek yetmezliği olan hastalarda (kreatinin klirensi <60 mL/dk) başlangıç dozu olarak 5 mg önerilir. Orta derecede böbrek yetmezliği olan hastalarda, 40 mg'lık doz kontrendikedir. Ağır böbrek yetmezliği olan hastalarda KOLROS'un tüm dozları kontrendikedir (bkz. Bölüm 4.3, 5.2).
Karaciğer yetmezliği :
Child-Pugh puanı 7 ve altındaki hastalarda rosuvastatinin sistemik maruziyetinde bir artış olmamıştır. Ancak, Child-Pugh puanı 8 ve 9 olanlarda sistemik maruziyette artış gözlenmiştir (bkz. Bölüm 5.2). Bu hastaların böbrek fonksiyonları değerlendirilmelidir (bkz. Bölüm 4.4). Child-Pugh puanı 9'dan daha fazla olan hastalarla ilgili deneyim yoktur. KOLROS, aktif karaciğer hastalığı olanlarda kontrendikedir (bkz. Bölüm 4.3).
Pediyatrik popülasyon:
Pediyatrik popülasyonda kullanım sadece uzman hekimler tarafından yürütülmelidir. Çocuklar ve ergenler; 6 ila 17 yaş arasında olanlar (Tanner Evre <II-V):
Heterozigot ailesel hiperkolesterolemi
Heterozigot ailesel hiperkolesterolemili çocuklar ve ergenlerde normal başlangıç dozu günde 5 mg'dır.
Heterozigot ailesel hiperkolesterolemili 6 ila 9 yaş arasındaki çocuklarda normal doz aralığı günde bir kez 5-10 mg'dır. Bu popülasyonda 10 mg'dan daha yüksek dozlar için güvenlilik ve etkililik çalışılmamıştır.
4.3. Kontrendikasyonlar
KOLROS, aşağıdaki durumlarda kontrendikedir:
Rosuvastatin ya da ilacın içerdiği herhangi bir maddeye karşı aşırı duyarlılığı olanlarda,
4.4. Özel kullanım uyarıları ve önlemleri
Renal etkiler
Rosuvastatinin yüksek dozları ile özellikle 40 mg ile tedavi edilen hastalarda, daldırma testi (dipstick testing) ile tespit edilen, genellikle tübüler kaynaklı ve birçok vakada geçici ve aralıklarla görülen proteinüri gözlenmiştir. Proteinüri akut ya da ilerleyen renal hastalığın belirtisi değildir (bkz. Bölüm 4.8). Pazarlama sonrası kullanımda ciddi renal olayların raporlanma oranı 40 mg'lık dozda daha fazladır. KOLROS'un 40 mg dozu ile tedavi edilen hastaların rutin takibi sırasında böbrek fonksiyonlarının değerlendirilmesi gerekir.
İskelet kası üzerine etkileri
Rosuvastatin ile tedavi edilen hastalarda, tüm dozlarla ve özellikle 20 mg'ın üzerindeki
dozlarda miyalji, miyopati ve nadiren rabdomiyoliz gibi iskelet kası üzerine etkiler bildirilmiştir. HMG-KoA redüktaz inhibitörleri ile ezetimibin birlikte kullanımı sonucu çok nadir rabdomiyoliz vakası bildirilmiştir. Buna karşılık farmakodinamik bir etkileşim göz ardı edilemez ( bkz. Bölüm 4.5) ve birlikte kullanımları sırasında dikkatli olunmalıdır. Diğer HMG- KoA redüktaz inhibitörlerinde olduğu gibi, pazarlama sonrası kullanımda raporlanan Rosuvastatin ile ilişkili rabdomiyoliz oranı, 40 mg'lık dozda daha fazladır.
Kreatinin kinaz ölçümü
Kreatinin kinaz (CK), sonucun yanlış yorumlanmasına neden olabilecek ağır egzersizden sonra ya da kreatinin kinaz artışına neden olabilecek bir durumun varlığında ölçülmemelidir. Kreatinin kinazın başlangıç değerleri belirgin ölçüde yüksek ise (>5xULN) bunu doğrulamak için 5-7 gün içinde tekrar test yapılmalıdır. Tekrarlanan test, başlangıç değerlerinin CK> 5xULN olduğunu doğrular ise tedaviye başlanmamalıdır.
Tedaviden önce
Diğer HMG-KoA redüktaz inhibitörlerinde olduğu gibi, KOLROS, miyopati/rabdomiyolize karşı hastayı duyarlı hale getirebilecek faktörlerin bulunduğu hastalarda dikkatli kullanılmalıdır. Bu faktörler:
Böbrek yetmezliği
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Rosuvastatin ile birlikte kullanılan tıbbi ürünlerin rosuvastatin üzerindeki etkileri
Taşıyıcı protein inhibitörleri: Rosuvastatin, hepatik alım taşıyıcısı OATP1B1 ve hepatik eflüks taşıyıcısı BCRP dahil belli taşıyıcı proteinlerin substratıdır. KOLROS'un bu taşıyıcı proteinlerin inhibitörleri olan tıbbi ürünlerle eş zamanlı olarak kullanılması rosuvastatin plazma konsantrasyonunda ve miyopati riskinde artışa neden olabilir (bkz. Bölüm 4.2, 4.4 , 4.5 ve Tablo1).
Siklosporin:
Rosuvastatin ve siklosporin birlikte kullanıldığında,rosuvastatinin eğri altı alan (EAA) değerleri, sağlıklı gönüllülere göre 7 kat daha yüksek bulunmuştur (bkz. Tablo 1). KOLROS eş zamanlı olarak siklosporin kullanan hastalarda kontrendikedir (bkz. Bölüm 4.3). Eş zamanlı uygulamada siklosporinin plazma konsantrasyonunda bir değişikliğe neden olmamıştır.
Proteaz inhibitörleri:
Esas mekanizması tam olarak bilinmemekle beraber, eşzamanlı proteaz inhibitörlerinin kullanımı, maruz kalınan rosuvastatin miktarını önemli ölçüde artırabilir (bkz. Tablo 1). Örneğin, bir farmakokinetik çalışmada, 10 mg rosuvastatinin ve iki proteaz inhibitörünün (300 mg atazanavir/100 mg ritonavir) kombinasyonu olan bir ilacın sağlıklı gönüllülerde birlikte kullanılması, rosuvastatine ait EAA ve Cdeğerinde sırasıyla yaklaşık olarak 3 kat ve 7 kat artışla sonuçlanmıştır. KOLROS ve bazı proteaz inhibitörü kombinasyonlarının birlikte kullanılması, KOLROS dozunda, rosuvastatin maruziyetinde beklenen artışa dayalı dikkatli ayarlamalar yapıldıktan sonra değerlendirilebilir (bkz. Bölüm 4.2,4.4,4.5 Tablo 1). Atazanavir/ritonavir veya lopinavir/ ritonavir kombinasyonu kullananlarda rosuvastatinin günlük kullanımı 10 mg ile sınırlandırılmalıdır.
Gemfibrozil ve diğer lipid düşürücü ilaçlar:
Rosuvastatinin ve gemfibrozilin birlikte kullanılması, rosuvastatinin maksimum plazma konsantrasyonu (C) ve EAA değerlerinin 2 kat artması ile sonuçlanmıştır (bkz. Bölüm 4.4).
Özel etkileşim çalışmalarından elde edilen verilere göre, fenofibrat ile farmakokinetik yönden bir etkileşim beklenmez, ancak farmakodinamik etkileşim olabilir. Gemfibrozil, fenofibrat, diğer fibratlar ve niasinin (nikotinik asit) lipid düşürücü dozları (1 g/gün veya daha yüksek dozlar), HMG-KoA redüktaz inhibitörleri ile birlikte kullanıldığında miyopati riskini artırırlar, bunun nedeni, muhtemelen bu ilaçların tek başına kullanıldığında da miyopatiye neden olmalarıdır. KOLROS'un 40 mg dozunun bir fibrat ile (gemfibrozil ve fenofibrat gibi) birlikte kullanılması kontrendikedir (bkz. Bölüm 4.3 ve 4.4). Bu tip hastalarda 5 mg dozla başlanmalıdır.
Ezetimib:
Hiperkolesterolemik hastalarda 10 mg rosuvastatin ve 10 mg ezetimib kullanıldığında rosuvastatinin EAA değeri 1.2 kat artmıştır (Tablo 1). Rosuvastatin ve ezetimib arasında advers etki açısından farmakodinamik bir etkileşim vardır (bkz. Bölüm 4.4).
Antiasidler:
Rosuvastatinin , alüminyum ve magnezyum hidroksit içeren bir antasid süspansiyon ile aynı anda kullanılması, rosuvastatinin plazma konsantrasyonunu yaklaşık % 50 azaltmıştır. Ancak, antasid, Rosuvastatin verilmesinden 2 saat sonra verildiğinde bu etki azalmaktadır. Bu etkileşim ile ilgili klinik çalışma yoktur.
Eritromisin:
Rosuvastatin ve eritromisinin birlikte kullanılması, rosuvastatinin EAA(0-t) değerinde % 20, Cdeğerinde ise % 30 azalmasına neden olmuştur. Bu etkileşim, eritromisinin barsak motilitesini artırmasına bağlı olabilir.
Sitokrom P450 enzimleri:
İn vitro ve in vivo çalışmaların sonuçları, rosuvastatinin sitokrom P450 izoenzimleri üzerine inhibitör ya da indükleyici bir etkisinin olmadığını göstermektedir. Ayrıca, rosuvastatin, bu izoenzimler için zayıf bir substrattır. Bu nedenle, sitokrom P450 enzimleri ile metabolizmaya bağlı ilaç etkileşimi beklenmez. Rosuvastatinin, flukonazol (CYP2C9 ve CYP3A4 inhibitörü) ya da ketokonazol (CYP2A6 ve CYP3A4 inhibitörü) ile klinik açıdan bir etkileşimi gözlenmemiştir.
Rosuvastatin dozunda ayarlama gerektiren etkileşimler (ayrıca bkz. Tablo 1):
KOLROS'un, rosuvastatine maruziyeti artırdığı bilinen diğer tıbbi ürünler ile birlikte kullanılması gerektiğinde, KOLROS dozları ayarlanmalıdır. Maruziyette (EAA) beklenen artış yaklaşık 2 kat veya daha fazlaysa tedaviye günde tek doz 5 mg KOLROS ile başlanmalıdır. KOLROS için günlük maksimum doz, beklenen rosuvastatin maruziyeti, etkileşim görülen tıbbi ürünler kullanılmadığında günde 40 mg KOLROS dozu maruziyetini aşmayacak şekilde ayarlanmalıdır; örneğin gemfibrozil ile 20 mg'lık KOLROS dozu (1,9 kat artış) ve ritonavir/atazanavir kombinasyonu ile 10 mg'lık KOLROS dozu (3,1 kat artış).
Eğer tıbbi ürünün rosuvastatin EAA 2 katından az yükselttiği gözlemlenirse, başlangıç dozu azaltılmak zorunda değildir ancak KOLROS dozu 20 mg'ı geçecek şekilde yükseltilirse dikkatli olunmalıdır.
Tablo 1: Yayımlanmış klinik çalışmalara göre rosuvastatin ile birlikte kullanılan tıbbi ürünlerin rosuvastatin maruziyeti üzerindeki etkileri (EAA; azalan alan büyüklüğüne göre) Rosuvastatin EAA değerinde 2 katı veya 2 katından fazla artış
Etkileşim görülen ilaç için doz rejimi | Rosuvastatin doz rejimi | Rosuvastatin EAA değerindeki değişiklik* |
Sofosbuvir/velpatasvir/voksilaprevir (400 mg-100 mg-100 mg) + Voksilaprevir (100 mg) 15 gün boyunca günde bir defa |
10 mg, tek doz | 7,4 kat â |
Siklosporin 75 mg BID ila 200 mg BID, 6 ay | 10 mg OD, 10 gün | 7,1 kat â |
Darolutamid 600 mg BID, 5 gün | 5 mg, tek doz | 5,2 kat â |
Etkileşim görülen ilaç için doz rejimi | Rosuvastatin doz rejimi | Rosuvastatin EAA değerindeki değişiklik* |
Regorafenib 160 mg, OD, 14 gün | 5 mg, tek doz | 3,8 kat â |
Atazanavir 300 mg/ritonavir 100 mg OD, 8 gün | 10 mg, tek doz | 3,1 kat â |
Velpatasvir 100 mg OD | 10 mg, tek doz | 2,7 kat â |
Ombitasvir 25 mg/paritaprevir 150 mg/ Ritonavir 100 mg OD/ dasabuvir 400 mg BID, 14 gün | 5 mg, tek doz | 2,6 kat â |
Grazoprevir 200 mg/elbasvir 50 mg OD, 11 gün | 10 mg, tek doz | 2,3 kat â |
Glecaprevir 400 mg/pibrentasvir 120 mg OD, 7 gün | 5 mg OD, 7 gün | 2,2 kat â |
Simeprevir 150 mg OD, 7 gün | 10 mg, tek doz | 2,8 kat â |
Lopinavir 400 mg/ritonavir 100 mg BID, 17 gün | 20 mg OD, 7 gün | 2,1 kat â |
Klopidogrel 300 mg yükleme, takiben 24 saatte, 75 mg | 20 mg, tek doz | 2 kat â |
Gemfibrozil 600 mg BID, 7 gün | 80 mg, tek doz | 1,9 kat â |
Rosuvastatin EAA değerinde 2 katından az artış |
|
|
Etkileşim görülen ilaç için doz rejimi | Rosuvastatin doz rejimi | Rosuvastatin EAA değerindeki değişiklik* |
Eltrombopag 75 mg OD, 5 gün | 10 mg, tek doz | 1,6 kat â |
Darunavir 600 mg/ritonavir 100 mg BID, 7 gün | 10 mg OD, 7 gün | 1,5 kat â |
Tipranavir 500 mg/ritonavir 200 mg BID, 11 gün | 10 mg, tek doz | 1,4 kat â |
Dronedaron 400 mg BID | Mevcut değildir | 1,4 kat â |
İtrakonazol 200 mg OD, 5 gün | 10 mg, tek doz | 1,4 kat â** |
Ezetimib 10 mg OD, 14 gün | 10 mg, OD, 14 gün | 1,2 kat â** |
Rosuvastatin EAA değerinde düşüş |
|
|
Etkileşim görülen ilaç için doz rejimi | Rosuvastatin doz rejimi | Rosuvastatin EAA değerindeki değişiklik* |
Eritromisin 500 mg QID, 7 gün | 80 mg, tek doz | % 20 ï¯ |
Baikalin 50 mg TID, 14 gün | 20 mg, tek doz | % 47 ï¯ |
* x-kat değişiklik olarak sunulan veriler, eş zamanlı uygulama ve rosuvastatinin tek başına kullanılması arasındaki basit bir oranı temsil eder. % değişiklik olarak sunulan veriler, tek başına rosuvastatine kıyasla % farklılığı temsil eder.
Artış âââ, azalma âââ ile ifade edilmiştir.
** Farklı rosuvastatin dozlarında çeşitli etkileşim çalışmaları yürütülmüştür, tabloda en anlamlı oran gösterilmiştir.
EAA = Eğri altındaki alan; OD = günde bir kez; BID = günde iki kez; TID = günde üç kez; QID
= günde dört kez.
Aşağıdaki tıbbi ürünün/kombinasyonlarının, rosuvastatin ile eşzamanlı uygulanmasının EAA oranı üzerinde klinik olarak belirgin bir etkisi yoktur:
Aleglitazar 0,3 mg 7 gün dozlama; Fenofibrat 67 mg 7 gün günde üç kez dozlama; Flukonazol 200 mg 11 gün günde bir kez dozlama; Fosamprenavir 700 mg/ritonavir 100 mg 8 gün günde iki kez dozlama; Ketokonazol 200 mg 7 gün günde iki kez dozlama; Rifampin 450 mg 7 gün günde bir kez dozlama; Silimarin 140 mg 5 gün günde üç kez dozlama.
Rosuvastatinin birlikte kullanıldığı tıbbi ürünler üzerindeki etkisi K vitamini antagonistleri:
Diğer HMG-KoA redüktaz inhibitörlerinde olduğu gibi, K vitamini antagonistleri (örneğin varfarin veya bir diğer kumarin antikoagülanı) kullanan hastalarda KOLROS tedavisine
başlandığında veya KOLROS dozu yükseltilirken INR (Uluslararası Normalize Oran / International Normalised Ratio) düzeyi yükselebilir. Tedavinin kesilmesi veya dozun azaltılması INR düzeyini düşürür. Bu durumlarda, INR'nin izlenmesi önerilir.
Oral kontraseptifler / Hormon Replasman Tedavisi (HRT):
Rosuvastatin ve oral kontraseptiflerin birlikte kullanılması, etinil östradiol ve norgestrelin eğri altında kalan alanında, sırasıyla % 26 ve % 34 oranında yükselmeye neden olmuştur. Oral kontraseptif dozları belirlenirken, bu durum dikkate alınmalıdır. Rosuvastatin ve hormon replasman tedavisinin birlikte uygulandığı hastalara ilişkin farmakokinetik veri yoktur bu nedenle benzer bir etki dışlanamaz. Ancak bu kombinasyon, klinik çalışmalarda, kadınlarda yaygın olarak kullanılmış ve iyi tolere edilmiştir.
Diğer ilaçlar:
Digoksin: Özel etkileşim çalışmalarından elde edilen verilere göre digoksin ile klinik etki ile bağlantılı bir etkileşim beklenmez.
Fusidik Asit: Rosuvastatin ve fusidik asit ile etkileşim çalışması yapılmamıştır. Rabdomiyoliz dahil miyopati riski, sistemik fusidik asit ve statinlerin eşzamanlı kullanımı ile artabilir. Bu etkileşimin mekanizması (ister farmakodinamik, ister farmakokinetik olsun ya da her ikisi) henüz bilinmemektedir. Bu kombinasyonu alan hastalarda rabdomiyoliz (bazı ölümler dahil) rapor edilmiştir.
Sistemik fusidik asit ile tedavi gerekiyorsa, fusidik asit tedavisi süresince KOLROS tedavisi kesilmelidir. Ayrıca bkz. Bölüm 4.4.
Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:
Etkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir. Pediyatrik popülasyona ilişkin etkileşimlerin kapsamı bilinmemektedir.
4.6. Gebelik ve laktasyon
döneminde ve doğurganlık çağında olup uygun doğum kontrol yöntemi uygulamayan kadınlarda.Gebelik kategorisi X
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) KOLROS kullanan, gebe kalma potansiyeli olan kadınlar, uygun bir doğum kontrol yöntemi kullanmalıdır. Eğer hasta bu ilacı kullandığı sırada gebe kalırsa tedavi acilen sonlandırılmalıdır.
Gebelik dönemi
KOLROS gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir.
KOLROS gebelik döneminde kontrendikedir. (bkz. Bölüm 4.3). Kolesterol ve kolesterol biyosentezine ait diğer maddeler fetüs gelişimi için gerekli olduğundan, HMG-KoA redüktaz enziminin inhibisyonuna bağlı ortaya çıkabilecek riskler, KOLROS tedavisinin gebelik döneminde sağlayacağı yararın önüne geçer. Hayvan çalışmalarında, üreme toksisitesine yönelik bilgiler sınırlıdır (bkz. Bölüm 5.3).
Laktasyon dönemi
KOLROS laktasyon döneminde kontrendikedir.
Rosuvastatin, sıçanların sütüne geçmektedir. İnsanlarda anne sütüne geçip geçmediği konusunda bilgi yoktur (bkz. Bölüm 4.3).
Üreme yeteneği/Fertilite
Hayvan çalışmalarında, üreme toksisitesine yönelik bilgiler sınırlıdır (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
KOLROS'un araç ve makine kullanmaya etkisini belirlemek üzere çalışma yapılmamıştır. Ancak, KOLROS'un farmakodinamik etkilerine dayanarak araç ve makine kullanma yeteneğini etkilemesi beklenmez. Araç ve makine kullanırken, tedavi sırasında sersemlik görülebileceği akılda tutulmalıdır.
4.8. İstenmeyen etkiler
İstenmeyen etkiler genellikle hafif ve geçicidir. Kontrollü klinik çalışmalarda, Rosuvastatin ile tedavi edilen hastaların % 4'ten daha az bir kısmı istenmeyen etkiler nedeni ile çalışmadan çıkarılmıştır.
İstenmeyen etkilerin görülme sıklığı aşağıdaki gibi derecelendirilmiştir:
Yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (⥠1/1.000 ila < 1/100); seyrek (⥠1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Seyrek: Trombositopeni
Bağışıklık sistemi hastalıkları
Seyrek: Anjiyoödem dahil hipersensitivite reaksiyonları
Endokrin hastalıkları
Yaygın: Diabetes mellitus
Psikiyatrik hastalıklar
Bilinmiyor: Depresyon
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı, sersemlik
Çok seyrek: Polinöropati, hafıza kaybı
Bilinmiyor: Periferal nöropati, uyku bozuklukları (uykusuzluk ve kabus görme dahil)
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Bilinmiyor: Öksürük, dispne
Gastrointestinal hastalıklar Yaygın: Kabızlık, bulantı, karın ağrısı Seyrek: Pankreatit
Bilinmiyor: Diyare
Hepato-bilier hastalıklar
Seyrek: Hepatik transaminazlarda artış Çok seyrek: Sarılık, hepatit
Deri ve deri altı doku hastalıkları:
Yaygın olmayan: Pirürit döküntü, ürtiker
Bilinmiyor: Stevens-Johnson sendromu, eozinofili ve sistemik semptomların eşlik ettiği ilaç etkileşimi (DRESS)
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları:
Yaygın: Miyalji
Seyrek: Miyopati (miyozit dahil), rabdomiyoliz, lupus benzeri sendrom, kas yırtılması Çok seyrek: Artralji
Bilinmiyor: Bazen ruptür komplikasyonlu tendon bozuklukları, immun aracılı nekrotizan miyopati
Böbrek ve idrar yolu hastalıkları
Çok seyrek: Hematüri
Üreme sistemi ve meme hastalıkları
Çok seyrek: Jinekomasti
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Asteni Bilinmiyor: Ödem
Diğer HMG-KoA redüktaz inhibitörlerinde olduğu gibi, dozun artırılması ile yan etki sıklığı artar.
Renal etkiler
Rosuvastatin ile tedavi edilen hastalarda, genellikle tübüler kaynaklı ve daldırma testi ile belirlenen proteinüri gözlenmiştir. Rosuvastatin 10 mg ve 20 mg ile tedaviden bir süre sonra idrar protein düzeyinde sıfır veya eser miktardan ++ veya daha yüksek seviyelere geçiş < % 1, 40 mg ile yaklaşık % 3 olmuştur. 20 mg doz ile sıfır veya eser miktardan + düzeye geçişte küçük bir artış gözlenmiştir. Vakaların çoğunda, tedaviye devam edildiğinde, proteinüri kendiliğinden azalır veya kaybolur. Klinik çalışmalardan ve bugüne kadar olan pazarlama sonrası elde edilen verilerin incelenmesi sonucunda, proteinüri ile akut ya da ilerleyen renal hastalık arasında nedensel bir ilişki tanımlanmamıştır.
KOLROS ile tedavi edilen hastalarda hematüri gözlenmiştir ve klinik çalışma verileri hematüri oluşumunun düşük olduğunu göstermektedir.
İskelet kasına etkileri
KOLROS ile tedavi edilen hastalarda, tüm dozlarla ve özellikle 20 mg'ın üzerindeki dozlarda miyalji, miyopati (miyozit dahil) ve nadiren, akut böbrek yetmezliği ile veya değil, rabdomiyoliz gibi iskelet kası üzerine etkiler bildirilmiştir.
Rosuvastatin kullanan hastalarda doza bağlı olarak CK düzeylerinde artış gözlenmiştir; bu durum vakaların çoğunda hafif, semptomsuz ve geçici olmuştur. Eğer CK düzeyleri yükselirse (> 5x ULN), tedavi kesilmelidir (bkz. Bölüm 4.4).
Karaciğer üzerine etkileri
Diğer HMG-KoA redüktaz inhibitörlerinde olduğu gibi, rosuvastatin kullanan hastaların az bir kısmında doza bağlı olarak transaminaz düzeylerinde artış gözlenmiştir. Bu durum, vakaların çoğunda, hafif, semptomsuz ve geçici olmuştur.
Bazı statinler ile aşağıdaki yan etkiler raporlanmıştır:
Seksüel disfonksiyon
4.9. Doz aşımı ve tedavisi
Doz aşımının spesifik bir tedavisi yoktur. Doz aşımı durumunda semptomatik tedavi uygulanmalı, gerekli destekleyici önlemler alınmalıdır. Karaciğer fonksiyon testleri ve CK düzeyleri izlenmelidir. Hemodiyaliz etkili değildir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: HMG-KoA redüktaz inhibitörleri ATC kodu: C10AA07
Etki mekanizması:
Rosuvastatin, 3-hidroksi-3-metilglutaril koenzim A'nın kolesterol prekürsörü olan mevalonata
dönüşmesini sağlayan hız-kısıtlayıcı enzim olan HMG-KoA redüktazın, selektif ve kompetitif bir inhibitörüdür. Rosuvastatinin temel olarak etki gösterdiği yer, kolesterolün düşürülmesinde hedef organ olan karaciğerdir.
Rosuvastatin, hücre yüzeyindeki hepatik LDL reseptörlerinin sayısını artırarak LDL'nin karaciğere girişi ve katabolizmasını artırır ve VLDL'nin hepatik sentezini inhibe ederek VLDL ve LDL partiküllerinin sayısını azaltır.
Farmakodinamik etkiler
Rosuvastatin, yükselmiş LDL-kolesterol, total kolesterol ve trigliseritleri düşürür, HDL- kolesterolü yükseltir. Rosuvastatin ayrıca, ApoB, nonHDL-K, VLDL-K, VLDL TG'leri düşürür, ApoA-I'i yükseltir (bkz. Tablo 2). Rosuvastatin, LD-LK/HDL-K, total kolesterol/HDL-K, nonHDL-K/HDL-K, ve ApoB/ApoA-I oranlarını da düşürür.
Tablo 2: Primer hiperkolesterolemi (tip IIa ve IIb) hastalarının doz-yanıt verileri (başlangıç değerlerinden ortalama % değişiklik)
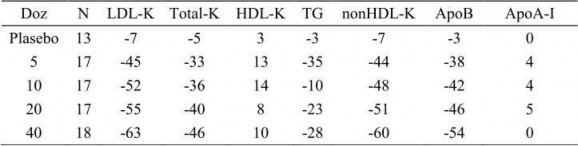
KOLROS ile tedaviye başlandıktan sonra bir hafta içinde terapötik yanıt alınmaya başlanır, genellikle 2 hafta içinde maksimum terapötik yanıtın % 90'ına ulaşılır. Tam etki genellikle 4 haftada görülür ve devam eder.
Klinik etkililik ve güvenlilik:
KOLROS, ırk, cinsiyet veya yaştan bağımsız olarak hipertrigliseridemili veya hipertrigliseridemisi olmayan hiperkolesterolemili yetişkinlerde ve diyabet hastaları veya ailesel hiperkolesterolemili hastalar gibi özel hasta gruplarında etkilidir.
Faz III çalışmalarından elde edilen havuzlanmış veriler, Rosuvastatinin tip IIa ve tip IIb hiperkolesterolemi (ortalama taban LDL-K yaklaşık 185 mg/dL (4,8 mmol/L) hastalarının büyük bir kısmında, European Atherosclerosis Society-Avrupa Ateroskleroz Derneği - (EAS;1998) kılavuzu tedavi hedeflerine ulaşmada etkili olduğunu göstermiştir; Rosuvastatin 10 mg ile tedavi edilen hastaların yaklaşık % 80'inde EAS'nin hedeflediği LDL-K düzeylerine (<116 mg/dL (<3 mmol/L)) ulaşılmıştır.
Heterozigot ailesel hiperkolesterolemili hastaları içeren geniş bir çalışmada, 435 hastaya zorunlu doz titrasyonu yapılarak 20-80 mg Rosuvastatin verilmiştir. Rosuvastatinin tüm dozları lipid parametreleri üzerinde ve tedavi hedefine ulaşmada yararlı etki göstermiştir. Dozun 40 mg'a titre edilmesini (12 haftalık tedavi) takiben, LDL-K % 53 oranında düşmüştür. Hastaların
% 33'ünde EAS kılavuzunda belirlenen LDL-K düzeylerine (<116 mg/dL (<3 mmol/L)) ulaşılmıştır.
Zorunlu titrasyon yapılan açık etiketli bir çalışmada, homozigot ailesel hiperkolesterolemili 42 hastanın, 20-40 mg Rosuvastatine verdiği yanıtlar değerlendirilmiştir. Toplam hasta grubunda, LDL-K, ortalama % 22 oranında düşmüştür.
Sınırlı sayıda hasta üzerinde yapılan klinik araştırmalarda, Rosuvastatinin fenofibrat ile birlikte kullanıldığında trigliseritlerin düşürülmesinde, niasin ile birlikte kullanıldığında ise HDLK'nin yükseltilmesinde aditif etkisinin olduğu gösterilmiştir (bkz. Bölüm 4.4).
METEOR adı verilen çok merkezli, çift-kör, plasebo kontrollü bir klinik çalışmada, ortalama LDK-K değeri 154,5 mg/dL (4 mmol/L) olan subklinik aterosklerozlu (Karotis intima media kalınlığına (KIMK) göre belirlenen) ve koroner arter hastalığı açısından düşük riske sahip (10 yıllık Framingham riski < %10), yaşları 45-70 arasında olan 984 hasta, günde tek doz rosuvastatin 40 mg veya plasebo ile 2 yıl boyunca tedavi edilmek üzere randomize edilmişlerdir. Rosuvastatin maksimum KIMK artış oranını plaseboya kıyasla anlamlı ölçüde yavaşlatmaktadır. Rosuvastatin ile tedavi edilen hastalar ve plasebo verilen hastalar arasında, 12 karotid arter bölgesine ait maksimum KIMK değerindeki değişiklik oranındaki fark -0,0145 mm/yıl'dır (% 95 güven aralığı -0,0196, -0,0093; p<0,0001). Plasebo ile görülen +0,0313 mm/yıl'lık (% 1,12/yıl (p<0,0001) ilerlemeye kıyasla rosuvastatin ile başlangıca göre kaydedilen değişim â 0,0014 mm/yıl'dır (%-0,12/yıl (anlamlı olmayan). KIMK düşüşü ve kardiyovasküler olaylar riskinde azalma arasında direkt bir korelasyon olduğu henüz gösterilmemiştir. METEOR çalışmasında çalışılan popülasyon düşük koroner kalp hastalığı riskine sahiptir ve rosuvastatin 40 mg hedef popülasyonunu temsil etmemektedir. 40 mg'lık doz sadece yüksek kardiyovasküler risk taşıyan ciddi hiperkolesterolemili hastalarda reçete edilmelidir (bkz. Bölüm 4.2).
Primer Korunmada Statinlerin Kullanımının Doğrulanması: Rosuvastatini Değerlendiren Bir Girişim Çalışmasında (JUPITER), rosuvastatinin majör aterosklerotik kardiyovasküler hastalık olaylarının ortaya çıkması üzerindeki etkisi 17.802 erkekte (≥50 yaş) ve kadında (â¥60 yaş) değerlendirilmiştir.
Çalışmanın katılımcıları günde bir kez plasebo (n=8.901) veya 20 mg rosuvastatin (n=8.901) gruplarına rastgele ayrılmış ve ortalama 2 yıllık bir süre boyunca takip edilmiştir.
Rosuvastatin grubunda, plasebo grubuna kıyasla LDL-kolesterol konsantrasyonu %45 (p<0,001) azalmıştır.
Başlangıçtaki Framingham risk skoru >% 20 olan yüksek riskli kişilerden oluşan (1.558 kişi) bir alt grubun post-hoc analizinde, rosuvastatin tedavisiyle plaseboya kıyasla kardiyovasküler ölüm, inme ve miyokard infarktüsün bileşik sonlanım noktasında anlamlı bir azalma gözlenmiştir (p=0,028). Olay oranındaki mutlak risk azalması 1000 hasta yılı başına 8,8'dir. Bu yüksek risk grubunda toplam mortalite değişmemiştir (p=0,193). Başlangıçtaki SKOR riski
â¥% 5 olan (65 yaş üzeri hastaların dahil edilmesini sağlayacak şekilde ekstrapolasyon uygulanmıştır) yüksek riskli hastalardan oluşan bir alt grubun (toplam 9.302 kişi) post-hoc analizinde, rosuvastatin tedavisinde plaseboya kıyasla kardiyovasküler ölüm, inme ve miyokard infarktüsün bileşik sonlanım noktasında anlamlı bir azalma gözlenmiştir (p=0,0003). Olay oranındaki mutlak risk azalması 1.000 hasta yılı başına 5,1'dir. Bu yüksek risk grubunda toplam mortalite değişmemiştir (p=0,076).
JUPITER çalışmasında, rosuvastatin kullanan hastaların % 6,6'sı, plasebo kullanan hastaların ise % 6,2'si advers olay nedeniyle çalışma ilacını bırakmıştır. Tedavinin kesilmesine neden olan en yaygın advers olaylar şunlardır: miyalji (% 0,3 rosuvastatin, % 0,2 plasebo), karın ağrısı
(% 0,03 rosuvastatin, % 0,02 plasebo) ve döküntü (%0,02 rosuvastatin, %0,03 plasebo). Plaseboya eşit veya plasebodan yüksek oranda görülen en yaygın advers olaylar şunlardır: idrar yolu enfeksiyonu (% 8,7 rosuvastatin, % 8,6 plasebo), nazofarenjit (% 7,6 rosuvastatin, %7,2 plasebo), sırt ağrısı (% 7,6 rosuvastatin, % 6,9 plasebo) ve miyaljidir (% 7,6 rosuvastatin, % 6,6 plasebo).
Pediyatrik popülasyon:
12 haftalık çift kör, randomize, çok merkezli, plasebo-kontrollü, bir çalışmayı (n= 176, 97 erkek ve 79 kadın) takiben 40 haftalık (n=173, 96 erkek ve 77 kadın), açık etiketli, rosuvastatin doz- titrasyon fazı ile devam edildiğinde, 10-17 yaş arası heterozigot ailesel hiperkolesterolemili hastalarda (Tanner evre II-V, kızlarda ilk adetten en az 1 yıl sonra) 12 hafta boyunca günde 1 doz 5, 10 veya 20 mg rosuvastatin veya plasebo uygulanmış ve daha sonra hepsi 40 hafta süresince günde 1 doz rosuvastatin almıştır. Çalışma başlangıcında, hastaların yaklaşık %30'u 10-13 yaş arasındadır ve sırasıyla % 17'si, % 18'i, % 40'ı ve % 25'i Tanner II, III, IV ve V.evredeydi.
Plasebo için % 0,7 olan değerle karşılaştırıldığında, 5, 10 ve 20 mg rosuvastatin ile LDL-K'de sırasıyla % 38,3, % 44,6 ve % 50 azalma meydana gelmiştir.
40 haftalık, açık etiketli, hedefe doğru titrasyon yapıldığı dönemin sonunda, günde bir kere maksimum 20 mg'a kadar yapılan doz uygulaması ile 173 hastanın 70'inde (% 40,5) değerin 108 mg/dL (2,8 mmol/L)'nin altındaki LDL-K hedefine ulaşılmıştır.
52 haftalık çalışma tedavisinden sonra büyüme, ağırlık, VKİ veya cinsel olgunlaşmada herhangi bir etki saptanmamıştır (bkz. Bölüm 4.4). Bu çalışma (n=176) seyrek advers ilaç olaylarının karşılaştırılması için uygun değildir.
Rosuvastatin 2 yıllık, açık etiketli, hedefe doğru titrasyon yapılan, yaşları 6 ila 17 arasında olan (88 erkek ve 110 kız çocuğu, Tanner evre <II-V) , heterozigot ailesel hiperkolesterolemili 198 çocukta da çalışılmıştır. Tüm hastalarda başlangıç dozu günde bir kez 5 mg rosuvastatin idi. Yaşları 6 ila 9 olan hastalar (n=64) günde bir kez 10 mg'lık maksimum doza titre edildi ve yaşları 10 ila 17 arasında olan hastalar (n=134) günde bir kez 20 mg'lık maksimum doza titre edildiler.
Rosuvastatin ile tedavinin 24 ayından sonra, 6 ila <10, 10 ila <14 ve 14 ila <18 yaş gruplarında LDL-K'da başlangıç değerine göre LS ortalama yüzde azalması, sırasıyla -% 43 (Başlangıç: 236 mg/dL (6,1 mmol/L), 24. Ay: 133 mg/dL (3,4 mmol/L)), -% 45 (Başlangıç: 234 mg/dL (6,2 mmol/L), 24. Ay: 124 mg/dL(3,2 mmol/L)) ve -% 35'di (Başlangıç: 241 mg/dL (6,2 mmol/L),
24. Ay: 153 mg/dL (4 mmol/L)).
Rosuvastatin 5 mg, 10 mg ve 20 mg aşağıdaki sekonder lipid ve lipoprotein değişkenleri için de başlangıca göre istatistiki olarak anlamlı değişiklikler sağlamıştır: HDL-K, TK, non-HDL- K, LDL-K/HDL-K, TC/HDL-K, TG/HDL-K, non HDL K/HDL-K, ApoB, ApoB/ApoA-1. Bu
değişikliklerin her biri iyileşen lipid cevapları ile bağıntılıdır ve 2 yıl boyunca kalıcı olmuştur.
Tedavinin 24 ayından sonra büyüme, ağırlık, VKİ veya cinsel olgunlaşmada herhangi bir etki saptanmamıştır (bkz. Bölüm 4.4)
Rosuvastatin randomize, çift kör, plasebo kontrollü, çok merkezli, çaprazlamalı bir çalışmada günde bir defa uygulanan 20 mg'nin plasebo ile karşılaştırılmasıyla homozigot ailesel
hiperkolesterolemi görülen 14 çocuk ve ergende (6 ila 17 yaş arası) araştırılmıştır. Çalışmada hastalara 10 mg rosuvastatinin uygulandığı 4 haftalık bir aktif diyet giriş fazı, öncesinde veya sonrasında 6 haftalık plasebo uygulamasıyla 6 hafta 20 mg rosuvastatinin uygulandığı bir çaprazlama fazı ve tüm hastaların 20 mg rosuvastatin aldığı 12 haftalık bir idame fazı yer almıştır. Çalışmaya girdikleri sırada ezetimib veya aferez tedavisi görmekte olan hastalar tüm çalışma boyunca bu tedavilerine devam etmiştir.
20 mg rosuvastatinle uygulanan 6 haftalık tedaviyi takiben LDL-K'da plaseboya kıyasla istatistiksel açıdan anlamlı (p=0,005) bir azalma (% 22,3, 85,4 mg/dL veya 2,2 mmol/L) gözlenmiştir. Total-K (% 20,1, p=0,003), nonHDL kolesterol (% 22,9, p=0,003) ve ApoB'de (% 17,1, p=0,024) istatistiksel açıdan anlamlı azalmalar gözlenmiştir. 20 mg rosuvastatinle uygulanan 6 haftalık tedaviyi takiben TG, LDL-K/HDL-K, Total-K/HDL-K, nonHDL kolesterol/HDL-K ve ApoB/ApoA-1'de de plaseboya kıyasla azalmalar görülmüştür. Plaseboyla yapılan 6 haftalık uygulamanın ardından 20 mg rosuvastatinle uygulanan 6 haftalık tedavi ile LDL-K'da gözlenen azalma 12 haftalık devam eden tedavi sırasında korunmuştur. Bir hastada, yukarı titrasyondan sonra 40 mg ile 6 haftalık tedavinin ardından LDL-K (%8,0), Total-K (% 6,7) ve non-HDL-K'de (% 7,4) daha fazla azalma oldu.
Bu hastaların 9'unda 90 haftaya kadar 20 mg rosuvastatin ile uzatılmış açık etiketli tedavi sırasında, LDL-K düşüşü -% 12,1 ila -% 21,3 aralığında korunmuştur.
Açık etiketli zorunlu titrasyon çalışmasına katılmış olan homozigot ailesel hiperkolesterolemi görülen ve değerlendirilebilir durumda olan 7 çocuk ve ergende (8 ila 17 yaş arası) (yukarıya bakınız) 20 mg rosuvastatinle uygulanan 6 haftalık tedaviyi takiben LDL-K (% 21), Total-K (% 19,2) ve nonHDL kolesterolde (% 21) başlangıca göre gözlenen azalma yüzdesinin homozigot ailesel hiperkolesterolemi görülen çocuk ve ergenler üzerinde gerçekleştirilmiş olan yukarıda bahsedilen çalışmada gözlenenle tutarlı olduğu görülmüştür.
Avrupa İlaç Ajansı, homozigot ailesel hiperkolesteroleminin, primer kombine (karma) dislipideminin ve kardiyovasküler olayların tedavisi ile pediyatrik popülasyonun tüm alt kümelerinde rosuvastatin ile yapılan çalışmaların sonuçlarının sunulması zorunluluğunu kaldırmıştır (pediyatrik kullanım ile ilgili bilgiler için Bölüm 4.2'ye bakınız).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Oral uygulamadan yaklaşık 5 saat sonra doruk plazma konsantrasyonuna ulaşılır. Mutlak biyoyararlanımı yaklaşık % 20'dir.
Dağılım:
Rosuvastatin, kolesterol sentezi ve LDL-K klirensinin temel olarak yer aldığı karaciğere büyük oranda geçer. Rosuvastatinin dağılım hacmi yaklaşık 134 L'dir. Rosuvastatin, temel olarak albümin olmak üzere plazma proteinlerine % 90 oranında bağlanır.
Biyotransformasyon:
Rosuvastatinin metabolizması sınırlıdır (yaklaşık % 10). İnsan hepatositleri kullanılarak yapılan in vitro metabolizma çalışmaları, rosuvastatinin, sitokrom P450'ye bağlı metabolizma için zayıf
bir substrat olduğunu göstermektedir. Temel olarak yer alan izoenzim CYP2C9 olup, 2C19, 3A4 ve 2D6'nın daha az yeri vardır. Belirlenen temel metabolitler, N-desmetil ve lakton metabolitleridir. N-desmetil metaboliti, rosuvastatinden % 50 oranında daha az aktif iken lakton formu klinik olarak inaktiftir. HMG-KoA redüktaz inhibitör aktivitenin % 90'ından fazlası rosuvastatin tarafından gerçekleştirilir.
Eliminasyon:
Rosuvastatinin yaklaşık % 90'ı değişmemiş ilaç olarak feçes ile (absorbe edilmiş ve edilmemiş maddeden oluşur), geri kalanı idrar ile atılır. Yaklaşık % 5'i idrarla değişmemiş olarak atılır. Plazma eliminasyon yarı ömrü yaklaşık 19 saattir. Eliminasyon yarı ömrü, yüksek dozlar ile artmaz. Ortalama geometrik plazma klirensi yaklaşık 50 litre/saattir (varyasyon katsayısı
% 21,7). Diğer HMG-KoA redüktaz inhibitörlerinde olduğu gibi, rosuvastatinin karaciğer tarafından alımı membran taşıyıcısı OATP-C ile olur. Bu taşıyıcı, rosuvastatinin karaciğerden eliminasyonunda önemli bir yer tutar.
Doğrusallık:
Rosuvastatinin sistemik yararlanımı doz ile orantılı olarak artar. Günlük çoklu dozlardan sonra farmakokinetik parametrelerde değişiklik yoktur.
Hastalardaki karakteristik özellikler
Yaş ve cinsiyet:
Yaş ve cinsiyetin rosuvastatinin farmakokinetiği üzerine klinik açıdan yetişkinlerde bir etkisi yoktur. Rosuvastatinin heterozigot ailesel hiperkolesterolemili çocuklar ve ergenlerdeki farmakokinetiği, dislipidemi olan yetişkin gönüllülerdekine benzerdir (bakınız aşağıdaki âpediyatrik popülasyonâ).
Irk:
Farmakokinetik çalışmalar, Asya kökenli (Japon, Çinli, Filipinli, Vietnamlı ve Koreli) hastaların ortalama EAA ve Cdeğerlerinin, beyaz ırktan olanlarla kıyaslandığında yaklaşık 2 kat yükseldiğini göstermiştir; Hint kökenli Asyalılarda ortalama EAA ve Cmaks yaklaşık 1.3 kat artış gösterir. Popülasyon farmakokinetik analizinde, beyaz ırktan olanlar ve siyahi gruplar arasında klinik açıdan anlamlı farmakokinetik değişiklik ortaya çıkmamıştır.
Böbrek yetmezliği:
Çeşitli derecelerde böbrek yetmezliği olan hastalarla yapılan bir çalışmada, hafif ve orta derecede böbrek yetmezliğinin, rosuvastatin ya da N-desmetil metabolitinin plazma konsantrasyonları üzerine etkisi olmadığı görülmüştür. Ancak, ağır böbrek yetmezliği olan hastalarda (KrKl <30 mL/dak) rosuvastatin plazma konsantrasyonu sağlıklı gönüllülere göre 3 kat, N-desmetil metabolitinin plazma konsantrasyonu ise 9 kat artmıştır. Hemodiyalize giren hastalarda rosuvastatinin sabit durum plazma konsantrasyonu, sağlıklı gönüllülere göre yaklaşık
% 50 daha fazladır.
Karaciğer yetmezliği:
Çeşitli derecelerde karaciğer yetmezliği olan hastalarla yapılan bir çalışmada, Child-Pugh puanı 7 ve altında olan hastalarda rosuvastatinin sistemik maruziyetinin arttığına ilişkin bir kanıt yoktur. Ancak Child-Pugh puanı 8 ve 9 olan 2 hastada rosuvastatinin sistemik maruziyetinin Child-Pugh puanları daha düşük olan hastalara göre en az 2 kat arttığı gözlenmiştir. Child-Pugh puanları 9'dan fazla olan hastalarla ilgili deneyim yoktur.
Genetik polimorfizmler:
Rosuvastatin dahil, HMG-KoA redüktaz inhibitörlerinin dağılımı OATP1B1 ve BCRP taşıyıcı proteinleri aracılığıyladır. SLCO1B1 (OATP1B1) ve/veya ABCG2 (BCRP) genetik polimorfizmleri görülen hastalarda, rosuvastatin maruziyetinde artış riski vardır. Ayrı ayrı SLCO1B1 c.521CC ve ABCG2 c.421AA polimorfizmleri, SLCO1B1 c.521TT veya ABCG2c.421CC genotiplerine kıyasla daha yüksek rosuvastatin maruziyeti (EAA) ile ilişkilidir. Bu spesifik genotip klinik pratikte belirlenmemiştir, ancak bu tip polimorfizmlere sahip olduğu bilinen hastalar için daha düşük KOLROS dozları önerilir.
Pediyatrik popülasyon:
Heterozigot ailesel hiperkolesterolemili 10 - 17 veya 6-17 yaş aralığındaki (toplam 214 hasta) pediyatrik hastada, rosuvastatin (tablet olarak uygulanan) ile yapılan iki farmakokinetik çalışma, pediyatrik hastalarda rosuvastatin maruziyetinin yetişkin hastalarla karşılaştırılabilir ya da daha az olduğunu göstermiştir. Rosuvastatin maruziyeti 2 yılı aşan bir sürede doz ve zamana göre tahmin edilebilirdi.
5.3. Klinik öncesi güvenlilik verileri
Güvenliliğe ilişkin farmakolojik çalışmalar, tekrarlanan doz toksisitesi, genotoksisite, karsinojenik potansiyel ile ilgili konvansiyonel çalışmalar, insanlar üzerinde özel bir zararlı etkisinin olmadığını göstermiştir. hERG geni üzerine etkileri spesifik testlerle değerlendirilmemiştir. Klinik çalışmalarda gözlenmeyen, ancak hayvanlarda klinik maruziyet seviyesine benzer maruziyet seviyelerinde gözlenen advers reaksiyonlar şunlardır: Fare ve sıçanlarla yapılan tekrarlanan doz toksisite çalışmalarında rosuvastatinin farmakolojik etkisine bağlı olarak histopatolojik karaciğer değişimleri gözlenmiştir. Bu değişimler, köpeklerle yapılan çalışmalarda safra kesesi üzerine etkilerle birlikte daha az önemli seviyede gözlenmiştir; maymunlarla yapılan çalışmalarda gözlenmemiştir. Ayrıca, maymunlarda ve daha yüksek dozlarda köpeklerde testiküler toksisite gözlenmiştir. Üreme üzerine toksisitesi sıçanlarda, terapötik maruziyet düzeyinin birkaç katı yüksek olan maternal olarak toksik dozlarda, yavruların büyüklüğü ve ağırlıklarının azalması ve yavru hayvanın sağ kalımının azalması ile kanıtlanmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (sığır sütü kaynaklı) Mikrokristalin selüloz
Kroskarmelloz sodyum Kolloidal silikon dioksit Magnezyum stearat Hipromelloz 2910/5 Makrogol 6000 Titanyum dioksit (E171) Talk
Demir oksit, kırmızı (E172)
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25 ºC altındaki oda sıcaklığında saklanmalıdır. Nemden korumak için orijinal ambalajı içinde tutulur.
6.5. Ambalajın niteliği ve içeriği
Blister ambalaj: Al/Al
28 ve 84 tabletlik blister ambalajlarda Tüm ambalajlar pazarlanmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| COLNAR | 8699536091440 | |
| COUPET | 8699262090731 | |
| CRELIX | 8699578095468 | |
| CRESTOR | 8699786090194 | |
| KOLROS | 8699502093300 | |
| Diğer Eşdeğer İlaçlar |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Geri Ödeme Kodu | A12634 |
| Satış Fiyatı | 186.33 TL [ 22 Sep 2023 ] |
| Önceki Satış Fiyatı | 186.33 TL [ 15 Sep 2023 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699502093348 |
| Etkin Madde | Rosuvastatin |
| Yerli ve Beşeri bir ilaçdır. |