KYPROLIS 60 mg IV enjeksiyonluk çözelti için toz içeren flakon (1 flakon) Farmakolojik Özellikler
{ Karfilzomib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar/Proteazom inhibitörü ATC kodu: L01XG02
Etki mekanizması
Karfilzomib 26S proteazomunun içerisindeki proteolitik çekirdek partikül olan 20S proteazomunun N-terminal treonin-içeren aktif yerlerine geri dönüşsüz olarak bağlanan tetrapeptit yapısındaki bir epoksiketon proteazom inhibitörüdür. Karfilzomib solid ve hematolojik tümör hücreleri üzerinde in vitro antiproliferatif ve proapoptotik aktivitelere sahiptir. Hayvanlarda, karfilzomib kan ve dokulardaki proteazom aktivitesini inhibe etmiş ve multipl miyelom, hematolojik ve solid tümör modellerinde tümörün büyümesini geciktirmiştir.
Farmakodinamik etkiler
İntravenöz karfilzomib uygulanması, kanda ilk dozdan 1 saat sonra ölçüldüğünde, proteazom kimotripsin-benzeri (chymotrypsin like (CT-L)) aktivitesinin süpresyonuyla sonuçlanmıştır. Lenalidomid ve deksametazon ile veya tek başına ≥ 15 mg/m2 düzeyinde karfilzomib dozları proteazomun CT-L aktivitesinin ≥ %80 inhibisyonunu indüklemiştir. Buna ek olarak, tek ajan olarak intravenöz yoldan 20 mg/m2 karfilzomib, proteazomun düşük moleküler kütleli polipeptid 2 (low molecular mass polypeptide 2 (LMP2)) ve multikatalitik endopeptidaz kompleksi benzeri 1 (multicatalytic endopeptidase complex-like 1 (MECL1)) alt birimlerinin sırasıyla %26 ila %32 ve %41 ila %49 ortalama inhibisyonuyla sonuçlanmıştır. Proteazom inhibisyonu, dozlamanın her haftasında, karfilzomibin ilk dozunu takiben ≥ 48 saat süreyle devam etmiştir.
Daha yüksek 56 mg/m2 dozunda CT-L alt birimlerinde 15 ila 20 mg/m2 dozuna kıyasla daha yüksek inhibisyon (≥%90) görülmesinin yanı sıra diğer proteazom alt birimlerinde (LMP7, MECL1 ve LMP2) de daha yüksek inhibisyon saptanmıştır. 56 mg/m2 dozunda LMP7, MECL1
ve LMP2 alt birimlerinde 15 ila 20 mg/m2 dozuna kıyasla inhibisyonda sırasıyla %8, %23 ve
%34 artış gözlemlenmiştir. Karfilzomib ile benzer proteazom inhibisyonu, test edildiği 2 doz
seviyesinde (20 ve 36 mg/m2) 2 ila 10 dakikalık ve 30 dakikalık infüzyonlar ile elde edilmiştir. Klinik etkililik ve güvenlilik
Relaps veya refrakter multipl miyelom için lenalidomid ve deksametazon ile kombinasyon halinde
ASPIRE
ASPIRE, 1 ila 3 seri tedavi (burada tedavi serisi, relaps veya progresif hastalık gibi etkililik eksikliği nedeniyle kesintiye uğramamış olan planlanmış bir tedavi kürüdür [sıralı indüksiyon, transplantasyon, konsolidasyon ve/veya idame dahildir]) almış olan relaps veya refrakter multipl miyelom hastalarında KYPROLİS®'in lenalidomid ve deksametazon (KRd) ile kombinasyonunu tek başına lenalidomid ve deksametazon (Rd) ile karşılaştırarak değerlendiren randomize, açık etiketli, çok merkezli çalışmadır. Aşağıdaki hastalar çalışmaya alınmamıştır: en son rejimde bortezomibe refrakter, en son rejimde lenalidomid ve deksametazona refrakter, önceki hiçbir rejime yanıt vermemiş olan, kreatinin klerensi
< 50 ml/dak, ALT/AST > 3,5 à ULN ve bilirubin > 2 à ULN; New York Kalp Derneği sınıf III ila IV konjestif kalp yetmezliği veya son 4 ay içinde miyokard enfarktüsü geçiren hastalar. KRd kolunda KYPROLİS® başlangıç dozu olarak 20 mg/m2 düzeyinde değerlendirilmiş, bu düzey 1. döngünün 8. gününde ve sonrasında 27 mg/m2'ye yükseltilmiştir. KYPROLİS®
1. döngüden 12. döngüye kadar her 28 günlük döngünün 1, 2, 8, 9, 15 ve 16. günlerinde 10 dakikalık infüzyon olarak uygulanmıştır. KYPROLİS®, 13. döngüden 18. döngüye kadar her 28 günlük döngünün 1, 2, 15 ve 16. günlerinde dozlanmıştır. Deksametazon 40 mg her
döngünün 1, 8, 15 ve 22. gününde oral veya intravenöz yoldan uygulanmıştır. Lenalidomid, her 28 günlük döngünün 1 ila 21. günlerinde 25 mg oral yoldan verilmiştir. Rd tedavi kolunda lenalidomid ve deksametazon rejimi KRd tedavi kolu ile aynıdır. KYPROLİS®, hastalık progresyonu veya kabul edilemez toksisite nedeniyle erken kesilene kadar en fazla 18 döngü uygulanmıştır. Lenalidomid ve deksametazon uygulamasına hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam edilmiştir. Her iki kol için tromboprofilaksi ve bir proton pompa inhibitörünün eşzamanlı kullanımı ve KRd kolu için antiviral profilaksi gerekli görülmüştür.
ASPIRE çalışmasında 792 hasta KRd veya Rd koluna 1:1 oranında randomize edilmiştir. Demografik bilgiler ve başlangıç özellikleri iki grup arasında iyi bir dengededir (bkz. Tablo 11). Hastaların sadece %53'ünde genetik mutasyon için test yapılmıştır; KRd kolundaki hastaların %12'sinde ve Rd kolundaki hastaların %13'ünde yüksek riskli bir genetik mutasyon saptanmıştır.
Tablo 11: ASPIRE çalışmasında demografik bilgiler ve başlangıç özellikleri
Özellikler | KRd (N = 396) | Rd (N = 396) |
Yaş, medyan yıl (min, maks) | 64 (38; 87) | 65 (31; 91) |
Yaş ≥ 75, n (%) | 43 (11) | 53 (13) |
Erkekler, n (%) | 215 (54) | 232 (59) |
Irk, n (%) | ||
Beyaz | 377 (95) | 377 (95) |
Siyah | 12 (3) | 11 (3) |
Diğer veya bildirilmemiş | 7 (2) | 8 (2) |
Özellikler | KRd (N = 396) | Rd (N = 396) |
Önceki rejim sayısı, n (%) | ||
1 | 184 (46) | 157 (40) |
2 | 120 (30) | 139 (35) |
3 | 92 (23) | 100 (25) |
Önceki nakil, n (%) | 217 (55) | 229 (58) |
ECOG performans durumu, n (%) | ||
0 | 165 (42) | 175 (44) |
1 | 191 (48) | 186 (47) |
2 | 40 (10) | 35 (9) |
Çalışma başlangıcında ISS evresi, n (%) | ||
I | 167 (42) | 154 (39) |
II | 148 (37) | 153 (39) |
III | 73 (18) | 82 (21) |
Bilinmiyor | 8 (2) | 7 (2) |
Kreatinin Klerensi, ml/dak, medyan (min, maks) | 79 (39; 212) | 79 (30; 208) |
30 ila < 50, n (%) | 19 (5) | 32 (8) |
50 ila < 80, n (%) | 185 (47) | 170 (43) |
Son tedaviye refrakter, n (%) | 110 (28) | 119 (30) |
Herhangi bir zamanda aşağıdakilere refrakter, n (%): | ||
Bortezomib | 60 (15) | 58 (15) |
Lenalidomid | 29 (7) | 28 (7) |
Bortezomib + immünomodülatör ajan | 24 (6) | 27 (7) |
ECOG = Doğu Kooperatif Onkoloji Grubu (Eastern Cooperative Oncology Group); ISS = Uluslararası Evreleme Sistemi; KRd = KYPROLİS, lenalidomid ve deksametazon; Rd = lenalidomid ve deksametazon
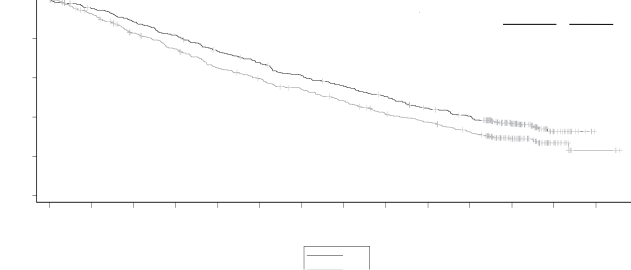
Bağımsız İnceleme Komitesi (Independent Review Committee (IRC)) tarafından Standart Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group (IMWG))/Avrupa Kan ve Kemik İliği Nakli (European Blood and Marrow Transplantation (EBMT)) yanıt kriterleri kullanılarak belirlendiğine göre KRd kolundaki hastalar Rd kolundakilere göre daha iyi PFS sergilemiştir (HR = 0,69, 2 yanlı P-değeri = 0,0001 ile).
Medyan PFS süresi KRd kolunda 26,3 ay, Rd kolunda ise 17,6 ay olmuştur (bkz. Tablo 12 ve Şekil 1).
KRd kolunda 246 ölümün ve Rd kolunda 267 ölümün ardından önceden planlanmış bir genel sağkalım (OS) analizi gerçekleştirilmiştir. Medyan takip süresi yaklaşık 67 ay olmuştur. KRd kolundaki hastalarda, Rd kolundaki hastalara kıyasla OS'de istatistiksel açıdan anlamlı bir avantaj gözlenmiştir (bkz. Tablo 12 ve Şekil 2).
Tablo 12: ASPIRE çalışmasında etkililik sonuçları
| Kombinasyon tedavisi | |
KRd (N = 396) | Rd (N = 396) | |
PFS | ||
Medyan, ay (%95 CI) | 26,3 (23,3; 30,5) | 17,6 (15,0; 20,6) |
HR (%95 CI) | 0,69 (0,57; 0,83) | |
P-değeri (2 yanlı) | 0,0001 | |
Genel Sağkalım | ||
Medyan, Ay (%95 CI) | 48,3 (42,4; 52,8) | 40,4 (33,6; 44,4) |
HR (%95 CI) | 0,79 (0,67; 0, 95) | |
P değeri (2 yanlı) | 0,0091 | |
| Kombinasyon tedavisi | |
KRd (N = 396) | Rd (N = 396) | |
Genel yanıt | ||
Yanıt alınan hasta sayısı (N) | 345 | 264 |
ORR (%) (%95 CI) | 87 (83; 90) | 67 (62; 71) |
P-değeri (2 yanlı) | < 0,0001 | |
Yanıt kategorisi, n (%) | ||
sCR | 56 (14) | 17 (4) |
CR | 70 (18) | 20 (5) |
VGPR | 151 (38) | 123 (31) |
PR | 68 (17) | 104 (26) |
CI = güven aralığı; CR = tam yanıt; HR = Risk oranı; KRd = KYPROLİS, lenalidomid ve deksametazon; ORR = genel yanıt oranı; PFS = progresyonsuz sağkalım; PR = kısmi yanıt; Rd = lenalidomid ve deksametazon; sCR = kesin tam yanıt; VGPR = çok iyi kısmi yanıt
Medyan yanıt süresi (DOR), KRd kolunda yanıt elde eden 345 hasta için 28,6 ay (%95 CI: 24,9; 31,3) ve Rd kolunda yanıt elde eden 264 hasta için 21,2 ay (%95 CI: 16,7; 25,8) olmuştur. Yanıta kadar geçen medyan süre, KRd kolunda 1 ay (aralık: 1 ila 14 ay) ve Rd kolunda da 1 ay (aralık 1 ila 16 ay) olmuştur.

Şekil 1: ASPIRE Çalışmasında Progresyonsuz Sağkalımın Kaplan-Meier Eğrisi
| ||
| ||

|
|
CI = güven aralığı; EBMT = Avrupa Kan ve Kemik İliği Nakli (European Blood and Marrow Transplantation); IMWG = Uluslararası Miyelom Çalışma Grubu (International Myeloma Working Group);
HR = risk oranı; KRd = KYPROLİS, lenalidomid ve deksametazon kolu; PFS = Progresyonsuz Sağkalım;
Rd = lenalidomid ve deksametazon kolu
Not: Yanıt ve PH (progresif hastalık) sonuçları standart objektif IMWG/EBMT yanıt kriterleri kullanılarak tayin edilmiştir.
![]()
Şekil 2: ASPIRE Çalışmasında Genel Sağkalımın Kaplan-Meier Eğrisi
| ||
CI = güven aralığı; HR = risk oranı; KRd = KYPROLİS, lenalidomid ve deksametazon; OS = genel
sağkalım; Rd = lenalidomid ve deksametazon kolu
Relaps veya refrakter multipl miyelom için deksametazon ile kombinasyon
Deksametazon ile kombinasyon halindeki KYPROLİS®'in etkililiği, iki açık etiketli, randomize çalışmada (ENDEAVOR ve ARROW) değerlendirilmiştir
ENDEAVOR
ENDEAVOR, 1 ila 3 basamak tedavi almış olan relaps veya refrakter multipl miyelom hastalarında KYPROLİS® ve deksametazona (Kd) karşı bortezomib ve deksametazonu (Vd) karşılaştırarak değerlendiren randomize, açık etiketli, çok merkezli bir çalışmadır. Toplam 929 hasta kaydedilmiş ve randomize edilmiştir (464 hasta Kd koluna; 465 hasta Vd koluna). Randomizasyon önceki proteazom inhibitörü tedavisi (var veya yok), önceki tedavi basamakları (1'e karşılık 2 veya 3), güncel Uluslararası Evreleme Sistemi evresi (1'e karşılık 2 veya 3) ve planlanan bortezomib uygulama yoluna göre tabakalandırılmıştır. Önceki rejimlerde yanıtları PR'den daha az; kreatinin klerensi < 15 ml/dak; hepatik transaminazları
≥ 3 à ULN; sol ventrikül ejeksiyon fraksiyonu < %40 veya başka önemli bir kalp sorunu olan hastalar çalışmaya alınmamıştır. Bu çalışmada KYPROLİS® başlangıç dozu olarak 20 mg/m2 ile başlayıp, 1. döngünün 8. gününde ve sonrasında 56 mg/m2'ye yükseltilmesi değerlendirilmiştir. KYPROLİS® her 28 günlük döngünün 1, 2, 8, 9, 15 ve 16. gününde 30 dakikalık infüzyon olarak haftada iki kez uygulanmıştır. Deksametazon 20 mg her döngünün 1, 2, 8, 9, 15, 16, 22 ve 23. günlerinde oral veya intravenöz yoldan uygulanmıştır.
Vd kolunda bortezomib 21 günlük döngünün 1, 4, 8 ve 11. günlerinde 1,3 mg/m2 dozda
intravenöz veya subkutan yoldan dozlanmış, deksametazon 20 mg her döngünün 1, 2, 4, 5, 8, 9, 11 ve 12. günlerinde oral veya intravenöz yoldan uygulanmıştır. Eşzamanlı olarak tromboprofilaksi uygulanması isteğe bağlı olmuş, ve bir antiviral ajan ve proton pompa inhibitörü ile profilaksi ise gerekli görülmüştür. Vd kolundaki 465 hastanın 381'i subkutan yoldan bortezomib almıştır. Hastalık progresyonuna veya kabul edilemez toksisiteye kadar tedaviye devam edilmiştir.
Demografik bilgiler ve başlangıç özellikleri Tablo 13'te özetlenmektedir.
Tablo 13: ENDEAVOR çalışmasında demografik bilgiler ve başlangıç özellikleri
Özellik | Kd (N = 464) | Vd (N = 465) |
Yaş, yıl | ||
Medyan (min, maks) | 65 (35; 89) | 65 (30; 88) |
< 65, n (%) | 223 (48) | 210 (45) |
65â74, n (%) | 164 (35) | 189 (41) |
≥ 75, n (%) | 77 (17) | 66 (14) |
Cinsiyet, n (%) | ||
Kadın | 224 (48) | 236 (51) |
Erkek | 240 (52) | 229 (49) |
Irk, n (%) | ||
Beyaz | 353 (76) | 361 (78) |
Siyah | 7 (2) | 9 (2) |
Asyalı | 56 (12) | 57 (12) |
Diğer veya bildirilmemiş | 48 (10) | 38 (8) |
ECOG performans durumu, n (%) | ||
0 | 221 (48) | 232 (50) |
1 | 210 (45) | 203 (44) |
2 | 33 (7) | 30 (6) |
Kreatinin klerensi (ml/dak) | ||
Medyan (min, maks) | 73 (14; 185) | 72 (12; 208) |
< 30, n (%) | 28 (6) | 28 (6) |
30 â < 50, n (%) | 57 (12) | 71 (15) |
50 â < 80, n (%) | 186 (40) | 177 (38) |
≥ 80, n (%) | 193 (42) | 189 (41) |
FISH, n (%) | ||
Yüksek risk | 97 (21) | 113 (24) |
Standart risk | 284 (61) | 291 (63) |
Bilinmeyen risk | 83 (18) | 61 (13) |
Çalışma başlangıcında ISS evresi, n (%) | ||
ISS I | 219 (47) | 212 (46) |
ISS II | 138 (30) | 153 (33) |
ISS III | 107 (23) | 100 (22) |
Önceki rejim sayısı, n (%) | ||
1 | 232 (50) | 231 (50) |
2 | 158 (34) | 144 (31) |
3 | 74 (16) | 88 (19) |
4 | 0 (0) | 2 (0,4) |
Önceki tedaviler, n (%) | 464 (100) | 465 (100) |
Bortezomib | 250 (54) | 252 (54) |
Multipl miyelom için nakil | 266 (57) | 272 (59) |
Talidomid | 212 (46) | 249 (54) |
Lenalidomid | 177 (38) | 178 (38) |
Bortezomib + immünomodülatör ajan | 159 (34) | 168 (36) |
Önceki son tedaviye refrakter, n (%) | 184 (40) | 189 (41) |
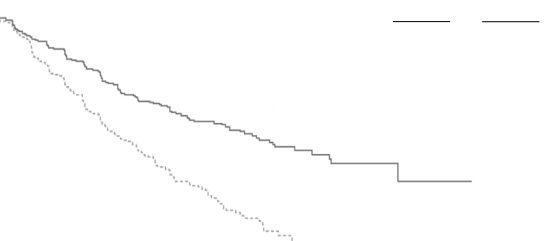
KYPROLİS® etkililiği, IMWG yanıt kriterleri kullanılarak IRC tarafından belirlenen PFS'ye göre değerlendirilmiştir. Çalışmada Kd kolunda 18,7 ay ve Vd kolunda 9,4 ay medyan PFS görülmüştür (bkz. Şekil 3 ve Tablo 14).
Şekil 3: ENDEAVOR Çalışmasında Progresyonsuz Sağkalımın Kaplan-Meier Eğrisi
| ||
![]()
|
|
![]()
CI = güven aralığı; HR = risk oranı; Kd = KYPROLİS ve deksametazon; PFS = progresyonsuz sağkalım;
Vd = bortezomib ve deksametazon
Diğer sonlanım noktaları OS ve genel yanıt oranını (ORR) içermektedir.
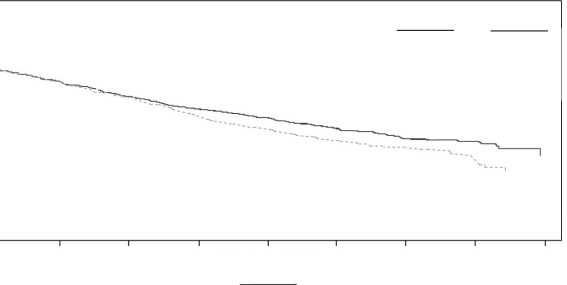
Kd kolunda 189 ölümün ve Vd kolunda 209 ölümün ardından önceden planlanmış bir OS analizi gerçekleştirilmiştir. Medyan takip süresi yaklaşık 37 ay olmuştur. Kd kolundaki hastalarda, Vd kolundaki hastalarla karşılaştırıldığında anlamlı düzeyde daha uzun OS gözlenmiştir (HR = 0,79; %95 CI: 0,65; 0,96; P değeri = 0,01). Sonuçlar Tablo 14 ve Şekil 4'te sunulmaktadır.
Tablo 14: ENDEAVOR'da önemli sonuçların özeti (tedavisi amaçlanan popülasyon)
| Kd (N = 464) | Vd (N = 465) |
PFS | ||
Olay sayısı (%) | 171 (37) | 243 (52) |
Medyan, ay (%95 CI) | 18,7 (15,6; NE) | 9,4 (8,4; 10,4) |
HR (Kd/Vd) (%95 CI) | 0,53 (0,44; 0,65) | |
P-değeri (1 yanlı) | < 0,0001 | |
Genel Sağkalım | ||
Ölüm sayısı (%) | 189 (41) | 209 (45) |
Medyan , Ay (%95 CI) | 47,6 (42,5; NE) | 40,0 (32,6; 42.3) |
HR (Kd/Vd) (%95 CI) | 0,79 (0,65; 0,96) | |
P-değeri (1 yanlı) | 0,01 | |
| Kd (N = 464) | Vd (N = 465) |
Genel yanıt | ||
Yanıt verenler N | 357 | 291 |
ORR (%) (%95 CI) | 77 (73; 81) | 63 (58; 67) |
P-değeri (1 yanlı) | < 0,0001 | |
Yanıt kategorisi, n (%) | ||
sCR | 8 (2) | 9 (2) |
CR | 50 (11) | 20 (4) |
VGPR | 194 (42) | 104 (22) |
PR | 105 (23) | 158 (34) |
CI = güven aralığı; CR = tam yanıt; HR = risk oranı; Kd = KYPROLİS ve deksametazon; ORR = genel yanıt oranı; PFS = progresyonsuz sağkalım; PR = kısmi yanıt; NE = hesaplanabilir değildir; sCR = kesin tam yanıt; Vd = bortezomib ve deksametazon; VGPR = çok iyi kısmi yanıt;
Şekil 4: ENDEAVOR Çalışmasında Kaplan-Meier Genel Sağkalım Grafiği
| ||
| ||
![]()
CI = güven aralığı; HR = risk oranı; Kd = KYPROLİS ve deksametazon; OS = genel sağkalım;
Vd = bortezomib ve deksametazon
PR veya daha iyi bir yanıt elde edilen gönüllülerde medyan DOR, Kd kolunda 21,3 ay (%95 CI: 21,3, tahmin edilemez) ve Vd kolunda 10,4 ay (%95 CI: 9,3; 13,8) olmuştur. Yanıta kadar geçen medyan süre her iki kolda 1 ay (aralık: < 1 ila 8 ay) olmuştur.
ARROW
ARROW, daha önce 2 ila 3 basamak tedavi görmüş olan relaps, refrakter multipl miyelom hastalarında haftada bir defa uygulanan KYPROLİS® ve deksametazon (Kd) (20/70 mg/m2) ile
haftada iki defa uygulanan Kd'nin (20/27 mg/m2) karşılaştırıldığı randomize, açık etiketli, çok merkezli ve üstünlük gösterilmesi hedeflenen bir çalışmadır. Daha önceki basamaklardan en az birine PR'nin altında yanıt vermiş olup; kreatinin klirensi < 30 mL/dak olan; hepatik transaminazları ≥ 3 à ULN olan; sol ventriküler ejeksiyon fraksiyonu < %40 olan veya başka anlamlı kardiyak durumları olan hastalar tedaviye alınmamıştır. Toplam 478 hasta kaydedilmiş ve randomize edilmiştir (20/70 mg/m2 kolunda 240; 20/27 mg/m2 kolunda 238). Randomizasyon, güncel Evrelendirme Sistemi evresine (evre 1 veya evre 2 ya da 3), bortezomib tedavisine dirençli durumuna (evet veya hayır) ve yaşa (< 65 veya ≥ 65 yaş) göre basamaklandırılmıştır. Çalışmanın 1. Kolunda 1. Döngünün 8. Gününden itibaren 70 mg/m2'ye yükseltilen 20 mg/m2'lik başlangıç dozunda KYPROLİS® değerlendirilmiştir.
1. Kolda KYPROLİS® haftada bir defa, 28 günlük döngülerin her birinin 1, 8 ve 15. günlerinde
30 dakikalık infüzyon şeklinde uygulanmıştır. Çalışmanın 2. Kolunda 1. Döngünün
8. Gününden itibaren 27 mg/m2'ye yükseltilen 20 mg/m2'lik başlangıç dozunda KYPROLİS® değerlendirilmiştir. 2. Kolda KYPROLİS® haftada iki defa, 28 günlük döngülerin her birinin 1, 2, 8, 9, 15 ve 16. günlerinde 10 dakikalık infüzyon şeklinde uygulanmıştır. Her iki rejimde
de tüm döngülerin 1, 8, 15. Günlerinde ve yalnızca 1 ila 9. Döngünün 22. Gününde oral yolla 40 mg deksametazon uygulanmıştır. Eşzamanlı tromboprofilaksi uygulaması isteğe bağlı bırakılmıştır, bir antiviral ajanla profilaksi önerilmiştir ve bir proton pompası inhibitorü ile profilaksi zorunlu kılınmıştır. Hastalık progresyonu veya kabul edilemez toksisite ortaya çıkana kadar tedaviye devam edilmiştir.
Demografik özellikler ve başlangıç özellikleri Tablo 15'te özetlenmektedir.
Tablo 15: ARROW Çalışmasındaki Demografik Özellikler ve Başlangıç Özellikleri
Özellikler | Haftada bir defa 20/70 mg/m Kd (N = 240) | Haftada iki defa 20/27 mg/m Kd (N = 238) |
Yaş, Yıl | ||
Medyan (min, maks) | 66 (39; 85) | 66 (35; 83) |
< 65, n (%) | 104 (43) | 104 (44) |
65â74, n (%) | 90 (38) | 102 (43) |
≥ 75, n (%) | 46 (19) | 32 (13) |
Cinsiyet, n (%) | ||
Kadın | 108 (45) | 110 (46) |
Erkek | 132 (55) | 128 (54) |
Irk, n (%) | ||
Beyaz | 200 (83) | 202 (85) |
Siyah | 3 (1) | 2 (1) |
Asyalı | 30 (13) | 15 (6) |
Diğer veya Bildirilmemiş | 7 (3) | 19 (8) |
ECOG Performans Durumu, n (%) | ||
0 | 118 (49) | 118 (50) |
1 | 121 (50) | 120 (50) |
2 | 1 (0,4) | 0 (0) |
Kreatinin Klirensi (mL/dak) | ||
Medyan (min, maks) | 70,80 (28;212) | 73,20 (29;181) |
< 30, n (%) | 2 (1) | 1 (0,4) |
30 â < 50, n (%) | 48 (20) | 34 (14) |
50 â < 80, n (%) | 91 (38) | 111 (47) |
≥ 80, n (%) | 99 (41) | 91 (38) |
Özellikler | Haftada bir defa 20/70 mg/m Kd (N = 240) | Haftada iki defa 20/27 mg/m Kd (N = 238) |
FISH, n (%) | ||
Yüksek risk | 34 (14) | 47 (20) |
Standart risk | 47 (20) | 53 (22) |
Bilinmeyen risk | 159 (66) | 138 (58) |
Çalışmanın Başlangıcındaki ISS Evresi, n (%) | ||
ISS I | 94 (39) | 99 (42) |
ISS II | 80 (33) | 81 (34) |
ISS III | 63 (26) | 54 (23) |
Önceki Rejimlerin Sayısı | ||
2 | 116 (48) | 125 (53) |
3 | 124 (52) | 112 (47) |
>3 | 0 (0) | 1 (0,4) |
Önceki Tedaviler, n (%) | ||
Bortezomib | 236 (98) | 237 (100) |
Transplantasyon | 146 (61) | 157 (66) |
Talidomid | 119 (50) | 119 (50) |
Lenalidomid | 207 (86) | 194 (82) |
ECOG = Doğu Kooperatif Onkoloji Grubu; FISH = Fluoresans in situ hibridizasyon; ISS = Uluslararası Evreleme Sistemi; Kd = KYPROLİS ve deksametazon
KYPROLİS®'in etkililiği IMWG yanıt kriterleri kullanılarak PFS'ye göre değerlendirilmiştir. Etkililik sonuçları Tablo 16 ve Şekil 5'te sunulmaktadır.
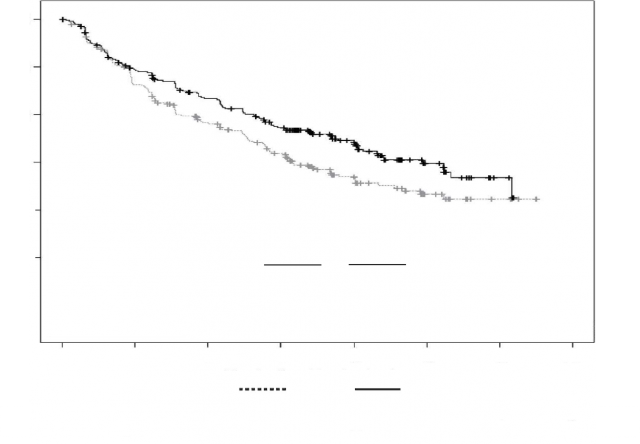
Şekil 5: ARROW Çalışmasında Progresyonsuz Sağkalıma İlişkin Kaplan-Meier Grafiği
| ||
| ||
|
|
CI = güven aralığı; HR = risk oranı; Kd = KYPROLİS ve deksametazon; PFS = progresyonsuz sağkalım
Tablo 16: ARROW Çalışmasındaki Kilit Bulguların Özeti (Tedavi Niyetli Popülasyon)
| Haftada bir defa 20/70 mg/m Kd (N = 240) | Haftada iki defa 20/27 mg/m Kd (N = 238) |
PFS | ||
Olay sayısı, n (%) | 126 (52,5) | 148 (62,2) |
Medyan, Ay (%95 CI) | 11,2 (8,6; 13,0) | 7,6 (5,8; 9,2) |
HR (%95 CI) | 0,69 (0,54; 0,88) | |
P değeri (1 yanlı) | 0,0014 | |
Genel Yanıt | ||
Yanıt verenlerin sayısı | 151 | 97 |
ORR (%) (%95 CI) | 62,9 (56,5; 69,0) | 40,8 (34,5; 47,3) |
P değeri (1 yanlı) | < 0,0001 | |
Yanıt Kategorisi, n (%) | ||
sCR | 4 (1,7) | 0 (0,0) |
CR | 13 (5,4) | 4 (1,7) |
VGPR | 65 (27,1) | 28 (11,8) |
PR | 69 (28,8) | 65 (27,3) |
CI = güven aralığı; CR = tam yanıt; HR = risk oranı; Kd = KYPROLİS ve deksametazon; ORR = genel yanıt oranı; PFS = progresyonsuz sağkalım; VGPR = çok iyi kısmi yanıt; PR = kısmi yanıt; sCR = kesin tam yanıt
PR veya daha iyi bir yanıt elde edilen gönüllülerde medyan DOR, 20/70 mg/m2 Kd kolunda 15 ay (%95 CI: 12,2, hesaplanabilir değildir), 20/27 mg/m2 Kd kolunda ise 13,8 ay (%95 CI:
9,5, hesaplanabilir değildir) olmuştur. Yanıt ortaya çıkana kadar geçen medyan süre 20/70 mg/m2 Kd kolunda 1,1 ay, 20/27 mg/m2 Kd kolunda ise 1,9 ay olmuştur.
KYPROLİS® tek başına deksametazon ile kombinasyon halinde haftada iki defa 20/27 mg/m2
şeklindeki uygulama için onaylı değildir.
Relaps veya Refrakter Multipl Miyelom için İntravenöz Daratumumab ve Deksametazon ile Kombinasyon Halinde
KYPROLİS®'in daratumumab ve deksametazon (DKd) ile kombinasyon halindeki etkililiği, iki açık etiketli klinik çalışmada (CANDOR ve EQUULEUS) değerlendirilmiştir.
CANDOR
CANDOR, daha önce 1 ila 3 basamak tedavi almış olan relaps veya refrakter multipl miyelom hastalarında haftada iki defa uygulanan KYPROLİS® 20/56 mg/m2'nin intravenöz daratumumab ve deksametazon (DKd) ile kombinasyonuna kıyasla haftada iki defa uygulanan KYPROLİS® 20/56 mg/m2 ve deksametazonu (Kd) değerlendiren randomize, açık etiketli, çok merkezli bir çalışmadır. Aşağıdaki hastalar çalışmaya alınmamıştır: son 2 yıl içinde bilinen orta ila şiddetli derecede inatçı astımı olan, FEV1'i öngörülen normalin %50'sinden az olan ve bilinen kronik obstrüktif akciğer hastalığı (COPD) bulunan veya aktif konjestif kalp yetmezliği olan hastalar. Randomizasyon taramasında ISS (evre 1 veya 2'ye karşılık evre 3), önceki proteazom inhibitörü maruziyeti (var veya yok), önceki tedavi basamağı sayısı (1'e karşılık 2 veya daha fazla) ya da önceki küme farklılaşma antijeni 38 (CD38) antikor tedavisine (var veya yok) göre sınıflandırma yapılmıştır.
KYPROLİS® 1. Döngünün 1 ve 2. Günlerinde 20 mg/m2'lik; 1. Döngünün 8, 9, 15 ve
16. Günlerinde ve ardından her 28 günlük döngünün 1, 2, 8, 9, 15 ve 16. Günlerinde
56 mg/m2'lik dozlar halinde intravenöz yoldan 30 dakika uygulanmıştır. 1, 2, 8, 9, 15 ve
16. Günlerde oral veya intravenöz yoldan deksametazon 20 mg ve ardından her 28 günlük
döngünün 22. Gününde oral veya intravenöz yoldan 40 mg uygulanmıştır. DKd kolunda,
1. Döngünün 1 ve 2. Günlerinde intravenöz yoldan 8 mg/kg daratumumab uygulanmıştır.
Ardından 1. Döngünün 8, 15 ve 22. Günlerinde; 2. Döngünün 1, 8, 15 ve 22. Günlerinde; 3 ila
6. Döngülerin 1 ve 15. Günlerinde ve kalan döngüler için veya hastalık progresyonuna kadar
1. Günde intravenöz yoldan 16 mg/kg daratumumab uygulanmıştır. 20 mg'a düşürülmüş deksametazon dozunu alan 75 yaş üzeri hastalar için 20 mg'lık dozun tamamı, daratumumabın uygulandığı günlerde daratumumab pre-infüzyon ilacı olarak verilmiştir. Her iki çalışma kolunda KYPROLİS® uygulandığında ise deksametazon dozajı günlere bölünmüştür. Hastalık progresyonuna veya kabul edilemez toksisiteye kadar her iki kolda tedaviye devam edilmiştir.
Toplam 466 hasta randomize edilmiştir (312 hasta DKd koluna ve 154 hasta Kd koluna). Demografik bilgiler ve başlangıç özellikleri Tablo 17'de özetlenmektedir.
Tablo 17: CANDOR Çalışmasında Demografik Bilgiler ve Başlangıç Özellikleri
Özellikler | DKd (N = 312) | Kd (N = 154) |
Randomizasyonda yaş (yıl) | ||
Medyan (min, maks) | 64 (29; 84) | 65 (29; 84) |
Özellikler | DKd (N = 312) | Kd (N = 154) |
Yaş grubu â n (%) | ||
18 â 64 yaş | 163 (52) | 77 (50) |
65 â 74 yaş | 121 (39) | 55 (36) |
75 yaş ve üzeri | 28 (9) | 22 (14) |
Cinsiyet â n (%) | ||
Erkek | 177 (57) | 91 (59) |
Kadın | 135 (43) | 63 (41) |
Irk â n (%) | ||
Asyalı | 46 (15) | 20 (13) |
Siyah veya Afro-Amerikan | 7 (2,2) | 2 (1,3) |
Beyaz | 243 (78) | 123 (80) |
Diğer | 16 (5) | 9 (6) |
Coğrafi bölge â n (%) | ||
Kuzey Amerika | 21 (7) | 12 (8) |
Avrupa | 207 (66) | 103 (67) |
Asya Pasifik | 84 (27) | 39 (25) |
ECOG performans durumu â n (%) | ||
0 veya 1 | 295 (95) | 147 (95) |
2 | 15 (4,8) | 7 (4,5) |
Eksik | 2 (0,6) | 0 (0,0) |
FISH ile belirlendiği şekilde risk grubu â n (%) | ||
Yüksek risk | 48 (15) | 26 (17) |
Standart risk | 104 (33) | 52 (34) |
Bilinmiyor | 160 (51) | 76 (49) |
Taramada I x RS uyarınca ISS evresi â n (%) | ||
I veya II | 252 (81) | 127 (82) |
III | 60 (19) | 27 (17) |
Önceki rejim sayısı â n (%) | ||
1 | 144 (46) | 70 (45) |
2 | 99 (32) | 46 (30) |
3 | 69 (22) | 37 (24) |
Önceki Tedaviler | ||
Lenalidomid | 123 (39) | 74 (48) |
Lenalidomide refrakter | 99 (32) | 55 (36) |
Bortezomib | 287 (92) | 134 (87) |
Önceki CD38 antikor tedavisi â n (%) | 1 (0,3) | 0 (0,0) |
Önceki kök hücre nakli (ASCT) â n (%) | 195 (62) | 75 (49) |
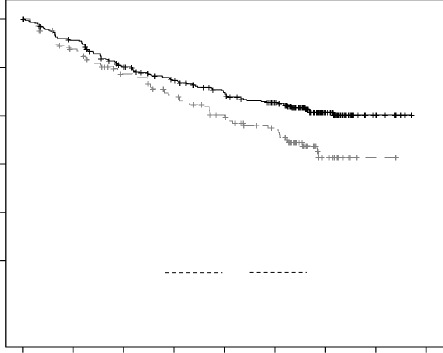
Etkililik, IMWG yanıt kriterleri kullanılarak IRC'nin PFS değerlendirmesine göre değerlendirmiştir. Etkililik sonuçları Tablo 18 ve Şekil 6'da sunulmaktadır. DKd kolunda medyan yanıt süresine ulaşılmamıştır ve medyan yanıt süresi Kd kolunda 16,6 ay (13,9; NE) olmuştur. Yanıta kadar geçen medyan (min, maks) süre, DKd kolu için 1,0 (1; 14) ay ve Kd kolu için 1,0 (1; 10) ay olmuştur.
Şekil 6: CANDOR Çalışmasında Progresyonsuz Sağkalıma İlişkin Kaplan-Meier Grafiği
| ||
| ||
|
|
Tablo 18: CANDOR Çalışmasında Önemli Sonuçların Özeti (Tedavi Amaçlı Popülasyon)
| DKd (N = 312) | Kd (N = 154) |
PFS | ||
Olay sayısı (%) | 110 (%35) | 68 (%44) |
Medyan, Ay (%95 CI) | NE (NE, NE) | 15,8 (12,1; NE) |
HR (%95 CI) | 0,63 (0,46; 0,85) | |
P-değeri (1 yanlı) | 0,0014 | |
Genel Yanıt | ||
Yanıt Verenlerin Sayısı | 263 | 115 |
ORR (%) (%95 CI) | %84 (%80; %88) | %75 (%67; %81) |
P-değeri (1 yanlı) | 0,0040 | |
CR | 89 (%28) | 16 (%10) |
VGPR | 127 (%41) | 59 (%38) |
PR | 47 (%15) | 40 (%26) |
12. ayda MRD [-] CR oranı, n (%) (%95 CI) | 39 (%12) (%9; %17) | 2 (%1,3) (%0,2; %4,6) |
P-değeri (1 yanlı) | < 0,0001 | |
MRD [-] CR | 43 (%14) | 5 (%3,2) |
EQUULEUS
EQUULEUS, daha önce 1 ila 3 basamak tedavi almış olan relaps veya refrakter multipl miyelom hastalarında KYPROLİS®'in intravenöz daratumumab ve deksametazon ile kombinasyonunu değerlendiren açık etiketli, çok kohortlu bir çalışmadır. Aşağıdaki hastalar çalışmaya alınmamıştır: son 2 yıl içinde bilinen orta ila şiddetli inatçı astımı olan, FEV1'i öngörülen normalin %50'sinden az olan ve bilinen kronik obstrüktif akciğer hastalığı (COPD) bulunan veya aktif konjestif kalp yetmezliği (New York Kalp Derneği Sınıf III-IV olarak tanımlanır) olan hastalar.
KYPROLİS® haftada bir defa 1. Döngünün 1. Gününde 20 mg/m2'lik doz halinde intravenöz yoldan 30 dakika uygulanmış ve doz 1. Döngünün 8 ve 15. Günlerinde ve her 28 günlük
döngünün 1, 8 ve 15. Günlerinde 70 mg/m2'ye çıkarılmıştır. On hastaya 1. Döngünün
Gününde intravenöz yoldan 16 mg/kg daratumumab ve kalan hastalara 1. Döngünün 1 ve
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
30 dakikalık infüzyon şeklinde uygulanan 20 mg/m2 ile 70 mg/m2 arasındaki dozlarda karfilzomib multipl miyelom hastalarında maksimum plazma konsantrasyonlarında (C) ve sonsuza giden zaman içinde eğri altında kalan alanda (AUC) doza bağımlı artış göstermiştir. Aynı zamanda relaps, refrakter multipl miyelom hastalarında 2 ila 10 dakikalık infüzyon şeklinde 20 mg/m ve 56 mg/m arası karfilzomible de Cve AUCdeğerlerinde doza bağımlı bir artış gözlenmiştir. 30 dakikalık bir infüzyon, aynı dozda 2 ila 10 dakikalık bir infüzyonla gözlenene benzer bir AUCfakat 2 ila 3 kat daha düşük bir Cortaya çıkarmıştır. Haftada bir 30 dakikalık infüzyon halinde 70 mg/m2 veya haftada iki defa 2 ila 10 dakikalık infüzyon halinde 15 ve 20 mg/m2 karfilzomibin tekrarlanan şekilde uygulanmasını takiben karfilzomib birikimine işaret eden kanıt ortaya çıkmamıştır.
Tablo 26'de farklı doz rejimleri için birinci döngüde hesaplanan ortalama günlük eğri altındaki alan (AUC), kararlı durumdaki ortalama günlük eğri altındaki alan (AUC) ve birinci döngüdeki en yüksek dozda ortaya çıkan C(C) listelenmektedir.
Tablo 26: Farklı Doz Rejimleri için Karfilzomib Maruziyeti Parametreleri
Hesaplanan Parametreler (%CV) | 2 ila 10 dakikalık infüzyonla haftada iki defa 20/27 mg/m | 30 dakikalık infüzyonla haftada iki defa 20/56 mg/m | 30 dakikalık infüzyonla haftada bir defa 20/70 mg/m |
AUC(ngâ¢sa/mL) | 95 (40) | 170 (35) | 114 (36) |
AUC(ngâ¢sa/mL) | 111 (34) | 228 (28) | 150 (35) |
C(ng/mL) | 1282 (17) | 1166 (29) | 1595 (36) |
CV: Coefficient of variation
Dağılım:
Ortalama kararlı-durum dağılım hacmi 20 mg/m2 karfilzomib dozunda 28 L olmuştur. Karfilzomib %97 oranında insan plazma proteinlerine bağlanır ve 0,4 - 4 mikromolar aralığı içindeki konsantrasyonlarda in vitro ortalama %97âdir.
Biyotransformasyon:
Karfilzomib peptidaz klivajı ile hızlı, şekilde metabolize olur ve epoksit hidrolizi metabolizmanın temel yolağıdır. Sitokrom P450-aracılıklı mekanizmalar genel karfilzomib metabolizmasına minör bir katkıda bulunur.
Eliminasyon:
Karfilzomibin yarı ömrü 1. Döngünün 1. Gününde ≥ 15 mg/m2'lik intravenöz dozları takiben
≤ 1 saattir. 30 dakikalık infüzyon veya 2 ila 10 dakikalık infüzyon şeklinde uygulandığında yarı ömrün benzer olduğu görülmüştür. Sistemik klirens, 151 ile 263 L/saat arasında değişmiştir.
Uygulanan karfilzomib dozunun yaklaşık %25'i 24 saat içinde idrarda metabolit olarak atılmıştır. Ana bileşiğin idrar ve dışkıyla atılımı önemsiz miktardadır (toplam dozun %0,3'ü).
Doğrusallık/Doğrusal olmayan durum:
Veri bulunmamaktadır.
Hastalardaki karakteristik özellikler
Spesifik popülasyonlar:
Yaş (35-89 yaş), cinsiyet, ırk veya etnisite (%80 Beyaz, %11 Siyah, %6 Asyalı, %3 Latin) ve hafif ila şiddetli böbrek yetmezliği (kreatinin klirensi 15-89 mL/dak) karfilzomibin farmakokinetiği üzerinde klinik açıdan anlamlı etki ortaya çıkarmamıştır.
Karaciğer yetmezliği
Hafif (total bilirubin 1 ila 1,5 Ã ULN ve herhangi bir AST veya total bilirubin ≤ ULN ve AST
> ULN) ve orta derece (total bilirubin > 1,5 ila 3 Ã ULN ve herhangi bir AST) karaciğer yetmezliği olan hastalarda, karfilzomibin AUC değeri karaciğer fonksiyonu normal olan hastalara göre yaklaşık %50 oranında artmıştır. Şiddetli karaciğer yetmezliği (total bilirubin > 3 Ã ULN ve herhangi bir AST) olan hastalarda karfilzomibin farmakokinetiği değerlendirilmemiştir.
Böbrek yetmezliği
Hemodiyaliz uygulanan SEBH hastalarında karfilzomibin AUC değeri böbrek fonksiyonu normal olan hastalara göre %33 oranında daha yüksek gözlenmiştir. KYPROLİS® konsantrasyonlarının hemodiyaliz klirensi araştırılmamış olduğundan, ilaç hemodiyaliz prosedüründen sonra uygulanmalıdır.
İlaç etkileşim çalışmaları
Klinik çalışmalar
Karfilzomibin hassas CYP3A substratı üzerine etkisi
Midazolamın (hassas bir CYP3A substratı) farmakokinetiği karfilzomib uygulamasından etkilenmemiştir.
In vitro çalışmalar
Karfilzomibin CYP450 enzimi üzerine etkisi
Karfilzomib direkt ve zamana bağımlı CYP3A inhibisyonu sergilemiştir fakat in vitro
CYP1A2 ve CYP3A4'ü indüklememiştir.
Taşıyıcıların karfilzomib üzerine etkisi
Karfilzomib in vitro bir P-glikoprotein (P-gp) substratıdır.
Karfilzomibin taşıyıcılar üzerine etkisi
Karfilzomib in vitro P-gp'yi inhibe eder. Bununla birlikte, KYPROLİS®'in intravenöz yoldan uygulandığı ve yaygın biçimde metabolize edildiği göz önüne alındığında, KYPROLİS®'in farmakokinetiğinin P-gp inhibitörlerinden veya indüktörlerinden etkilenmesi olası gözükmemektedir.
5.3. Klinik öncesi güvenlilik verileri
Gebelik
Gebe sıçanlar ve tavşanlara organogenez döneminde intravenöz yoldan uygulanan karfilzomib sıçanlarda 2 mg/kg/gün ve tavşanlarda 0,8 mg/kg/gün dozlarına kadar teratojenik olmamıştır. Karfilzomib test edilen herhangi bir dozda teratojenik olmamıştır. Tavşanlarda,
≥ 0,4 mg/kg/gün dozunda pre-implantasyon kaybında bir artış ve erken rezorpsiyonlarda ve post-implantasyon kayıplarında artış ve maternal toksik doz olan 0,8 mg/kg/gün dozunda fetal ağırlıkta bir azalma olmuştur. Tavşanlarda 0,4 ve 0,8 mg/kg/gün dozları VYAâya dayalı olarak insanlarda önerilen doz olan 27 mg/m2 dozunun sırasıyla, ortalama %20 ve %40'ına karşılık gelmektedir.
Karsinogenez, mutagenez, fertilitede bozulma Karfilzomib ile karsinojenisite çalışmaları yapılmamıştır.
Karfilzomib periferik kan lenfositlerinde in vitro kromozomal sapma testinde klastojenik olmuştur. Karfilzomib in vitro bakteriyel ters mutasyon (Ames) testinde mutajenik değildir ve in vivo fare kemik iliği mikronükleus tayininde klastojenik olmamıştır.
Karfilzomib ile fertilite çalışmaları yapılmamıştır. Üreme dokuları üzerinde 28 günlük yinelenen doz sıçan ve maymun toksisite çalışmalarında veya 6 aylık rat ve 9 aylık maymun kronik toksisite çalışmalarında etkiler saptanmamıştır.
Hayvan toksikolojisi ve/veya farmakolojisi
Kardiyovasküler toksisite: Tek bolus intravenöz doz olarak 3 mg/kg karfilzomib uygulanan maymunlarda (VYA'ya göre insanlarda önerilen doz olan 27 mg/m2 dozunun ortalama 1,3 katına karşılık gelmektedir) hipotansiyon, kalp hızında artış ve troponin-T serum düzeylerinde artış görülmüştür.
Kronik uygulama: Klinik olarak kullanılanlara benzer doz programı ile sıçanlarda karfilzomibin ≥ 2 mg/kg/dozunda ve maymunlarda 2 mg/kg/dozunda yinelenen bolus intravenöz uygulaması, kardiyovasküler (kalp yetmezliği, kardiyak fibroz, perikardiyal sıvı toplanması, kardiyak hemoraji/dejenerasyon), gastrointestinal (nekroz/hemoraji), renal (glomerülonefropati, tübüler nekroz, disfonksiyon) ve pulmoner (hemoraji/inflamasyon) sistemlerdeki toksisitelere bağlı mortalitelerle sonuçlanmıştır. Sıçanlardaki 2 mg/kg/dozu, VYAâya göre insanlarda önerilen doz olan 27 mg/m2 dozunun ortalama yarısı kadardır. Maymunlardaki 2 mg/kg/dozu, VYAâya göre insanlarda önerilen doza yaklaşık olarak eşdeğerdir.
Uygulamadan önce partikül madde veya renk değişimine karşı çıplak gözle inceleyin. Hazırlanmış ürün berrak, renksiz bir çözelti olmalı ve herhangi bir renk değişikliği veya partikül madde gözlenirse uygulanmamalıdır.
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Amgen İlaç Tic. Ltd. Şti
| Geri Ödeme Kodu | A16943 |
| Satış Fiyatı | 24563.04 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 24563.04 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699862270014 |
| Etkin Madde | Karfilzomib |
| ATC Kodu | L01XG02 |
| Birim Miktar | 60 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Hollanda ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |