LASTET 25 mg 40 kapsül Kısa Ürün Bilgisi
{ Etoposid }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
LASTET® 25 mg kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her bir kapsülde
Etkin madde: Etoposid 25 mg
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Yumuşak kapsül
Renksiz-açık sarı renkte berrak ve viskoz sıvı içeren soluk turuncu yumuşak kapsüller.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik Endikasyonlar
LASTET, küçük hücreli akciğer kanseri, küçük hücreli dışı akciğer kanseri, germ hücre tümörü, över kanseri, meme kanseri, Hodgkin lenfoma, Hodgkin dışı lenfoma, sarkomlar ve mide kanserinde endikedir.
4.2. Pozoloji ve Uygulama Şekli Pozoloji / uygulama sıklığı ve süresi:
Yetişkinler
2
LASTET, art arda beş gün boyunca günde 100 - 200 mg/m vücut alanı dozajıyla kullanılır. Bu tedavi siklüsünün tekrarlanabilmesi için en az 21 günlük bir zaman aralığının geçmesi gerekir.
Genellikle bir tedavi siklusu, kemik iliği değerlerinin eski normal seviyelerine geri döndüğü kan tahlilleriyle (hematolojik kontroller) teyit edildikten sonra tekrarlanmalıdır.
Polikemoterapi kapsamında uygulanacak kesin dozaj, oral etoposid uygulaması içeren ve ilgili hastalığın tedavisinde etkisi kanıtlanmış olan tedavi protokolleri temelinde belirlenir.
Hatırlatma:
Kanıtlanmış tedavi protokollerinde intravenöz uygulanması gereken etoposidin yerine, LASTET yumuşak kapsüller kullanılmamalıdır. Bunun nedeni İki dozaj formu arasındaki biyoyararlanım farkıdır.
Tedavi süresi veya tedavi aralıkları, endikasyona, kemoterapi için uygulanan tedavi planına, hastaların durumuna ve kan sayımı değerlerinin toparlanma hızına göre tayin edilir.
Özellikle kronik, oral tedavide kan sayımı değerlerinin haftalık kontrollerle izlenmesi tavsiye edilir.
Tümörün tedaviye cevap vermediği, hastalığın ilerlediği ve/veya tolere edilemeyecek dereceye ulaşan yan etkilerin ortaya çıktığı hastalarda LASTET tedavisi kesilmelidir.
Uygulama şekli:
Oral olarak uygulanır.
Tedavi, sadece tümör tedavisinde deneyimli doktorlar tarafından ve bir klinikte veya bir klinikle işbirliği içinde uygulanmalıdır. İlacın kullanma talimatlarına sıkı sıkıya uyulmalıdır.
LASTET kapsüller, yemek öğünleri sırasında veya öğünlerden sonra yeterince suyla (tercihen bir bardak su örneğin; 200 mİ) çiğnemeden yutulmalıdır.
Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:
Böbrek ve/veya karaciğer yetmezliği olan hastalarda dikkatle kullanılmalıdır.
Pediyatrik popülasyon:
Çocuklarda güvenliği ve etkinliği bilinmemektedir.
Geriyatrik popülasyon:
4.3. Kontrendikasyonlar
Etoposide, podofılotoksine, podofilotoksin türevlerine veya ilacın diğer bileşenlerinden herhangi birine karşı bilinen hipersensitivitesi (aşırı duyarlılığı) olan ve ağır karaciğer ve/veya böbrek yetmezliğiniz olan hastalarda kullanılmamalıdır.
Miyelosüpresyon, LASTETin doz sınırlayıcı bir yan etkisidir. Bundan dolayı, ilaç, fayda risk oranı karşılaştırması haklı göstermediği müddetçe, daha önce uygulanan ilaç tedavisinden veya radyoterapiden kaynaklanan ağır miyelosüpresyonlu hastalarda kullanılmamalıdır. Önceden miyelosüpresyon olan hastaların etoposid ile tedavi edildiği durumlarda özel dikkat gösterilmelidir. İlaç uygulaması, kemik iliğinin yenilenmesi için uygun aralıklarda yapılmalıdır. Bununla birlikte kan hücrelerinin (granülositler, eritrositler ve trombositler) dikkatli bir şekilde izlenmesi gerekir.
Lökopeni ve/veya trombopeni durumunda, LASTET tedavisi, kan sayım değerleri normale döndükten sonra (lökositler>4000/mikrolitre, trombositler> 100.000 mikrolitre) sürdürülmelidir.
LASTET, akut enfeksiyonlu hastalara reçete edilmemelidir.
Karaciğer veya böbrek işlev bozukluğu olan hastalar, sadece bu işlev bozukluğunun altta yatan hastalıkla bağlantılı olduğu durumlarda LASTET ile tedavi edilmelidir. Karaciğer ve böbrek işlevi bozuklukları etoposid eliminasyonunu olumsuz etkileyebileceğinden dolayı, hastanın böbrek ve karaciğer işlevleri, temel kan kimyası değerleri (serum bilirubin ve kreatinin) yardımıyla kontrol edilmelidir. İşlev bozukluğu tespit edilmesi durumunda, örneğin doz düşürme veya tedaviyi kesme gibi uygun önlemler alınmalıdır.
Serum albümin seviyesi düşük olan hastalarda, etoposide bağlı toksisite riski artabilir.
Tedaviye başlamadan önce nörolojik işlevler muayene edilmelidir. LASTET tedavisi uygulamak için, periferal sinir sistemi işlevlerinin normal olması şarttır.
4.4. Özel kullanım uyarıları ve önlemleri
Tedavi süresince ilaç geçimliliğini izlemeye ve toksik belirtiler gösteren hastaların korunmasına ve bakımına yönelik uygun cihazlar ve teknik şartlar mevcut olmalıdır.
Tedaviye başlamadan önce, tedavi sırasında ve her bir tedavi küründen önce kan sayım değerleri (lökositler, trombositler ve hemoglobin), karaciğer ve böbrek işlevleri kontrol edilmeli ve nörolojik işlevler tetkik edilmelidir.
Lökosit sayısının 2000/mm, mutlak nötrofıl granülosit sayısının 500/mmve trombosit sayısının 50.000/mm seviyesinin altına düşmesi halinde tedaviye ara verilmeli ve dolaşımdaki kan hücrelerinin seviyeleri tekrar kabul edilebilir değerlere (trombositler>100.000/mm, lökositler>4000/mm) yükselmeden tedaviye yeniden başlanmamalıdır. Etoposidin monoterapi olarak veya kombinasyon içinde kullanılmasına bağlı olarak, dolaşımdaki kan hücrelerinin seviyeleri genellikle 21 gün içinde normal değerlere geri döner.
Miyelosüpresif ve antineoplastik etkili diğer ilaçlarla birlikte uygulanan kombinasyon tedavisinde etoposid dozu düşürülmelidir.
Etoposid, yüksek dozlarda uygulanan diğer ilaçlarla birlikte önerilen dozun üzerindeki dozlarda uygulandığında kardiyotoksisite meydana gelebilir.
Üşüme ve titreme nöbetleri, ateş, taşikardi, bronkospazm, dispne ve kan basıncı düşüşü olaylarını içeren olası anafılaktoid reaksiyonlarda, tedavi derhal kesilmeli ve hastaya, sempatomimetik, kortikosteorid, antİhistaminik ilaçlar veya plazma ikame edici çözeltiler verilmelidir.
Ortaya çıkması muhtemel ağır enfeksiyon ve/veya kanama epizotlarıyla hızlı ve etkin bir şekilde mücadele etmek için uygun şartlar oluşturulmalıdır. Etoposid tedavisine başlanmadan önce var olan enfeksiyonlar tedavi edilmelidir.
Hastalann % 30-40ında mide bulantısı ve kusma meydana gelir. İstenmeyen bu etkileri kontrol etmede antiemetiklerden yararlanılabilir.
Etoposid genetik yapıya hasar verebilir (bakınız Bölüm 4.6 ve 5.3). Bundan dolayı, erkekler, tedavi sırasında ve tedavi sonrası 6 aylık dönem içinde çocuk sahibi olmamalıdır. İrreversibl infertilite olasılığı mevcuttur.
Etoposid ile birlikte diğer antineoplastik ilaçlarla tedavi gören hastalarda prelösemik fazla birlikte ya da prelösemik faz olmaksızın seyrek olarak akut löseminin ortaya çıktığı rapor edilmiştir.
İkincil löseminin gelişimiyle ilgili ne kümülatif risk ne de eğilim faktörleri bilinmektedir. Etoposidin tedavi şemalarında kullanılabilecek dozları ve kümülatif dozları tavsiye edilmiştir ancak kesin olarak belirlenmemiştir.
Epipodofİlotoksinler uygulanan bazı ikincil lösemili hastalarda 1 lq23 kromozomunda anormallik gözlemlenmiştir. Bu anormallik epipodofılotoksinleri içermeyen kemoterapi rejimleriyle tedavi edildikten sonra gelişen ikincil lösemide ve de novo (daha önce görülmeyen) oluşan lösemide görülmüştür. Diğer karakteristik ise epipodofılotoksin tedavisi almış ikincil lösemi hastalarında görülen kısa süreli bir latent dönemden sonra yaklaşık ortalama 32 ayda gelişen lösemi ile ilişkilidir.
Etoposidin diğer kemoterapi ilaçlarıyla birlikte kullanılması sonrası tümör lizis sendromunun ortaya çıktığı (bazen ölümcül olabilen) vakalar bildirilmiştir. Tümör lizis sendromunun erken belirtilerini fark etmek için, hastanın yakından izlenmesi gerekir. Bu durum özellikle, tedaviye duyarlı büyük hacimli tümörler ve böbrek yetmezliği gibi risk faktörleri olan hastalar için geçerlidir. Olası komplikasyon oluşumu nedeniyle bu hastalarda uygun tedbir tedavileri alınmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
LASTET, kuvvetli miyelosüpresif etkiye sahip bir ilaçtır; bu nedenle, benzer etkili başka ilaçlarla (örneğin: siklofosfamid, BCNU (karmustin), CCNU (lomustin), 5-FU (5-florourasil), vinblastin, adriamisin, sisplatin vs.) birlikte uygulanan kombinasyon tedavisinde veya eşzamanlı radyoterapide ilacın bu etkisi artabilir.
Etoposid, kumarinin (varfarin) proteine bağlanmasını engelleyebilir ve böylece onun antikoagülan etkisini şiddetlendirebilir (münferit vaka raporları).
Antrasiklinler (epirubisin, adriamisin vs.) ile etoposid arasında, deneylerle doğrulanmış çapraz dirençler gözlemlenmiştir.
LASTETin plazma proteinlerine in vitro bağlanma oranı % 97dir. Fenilbütazon, sodyum salisilat ve asetilsalisilik asit etoposidin plazma proteinlerine bağlanmasını engelleyebilir ve dolayısıyla bazı durumlarda etoposidin etkisini ve yan etkisini şiddetlendirebilir.
LASTETin diğer bir antitümor ajan veya radyoterapi ile birlikte uygulanması kemik iliği depresyonu gibi yan etkileri şiddetlendirebilir. Oral etoposidin yüksek doz siklosporin ile birlikte uygulanması (2000 ng/ml üstündeki konsantrasyonlara varan) etoposidin dağılımının (AUC) % 80 oranında artmasına sebep olur. Etoposidin toplam vücut klerensi, tek başına etoposid uygulanarak yapılan tedavilerle karşılaştırıldığında % 38 oranında azalmaktadır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi Ddir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü(Kontrasepsiyon)
LASTET genetik yapıya zarar verebilir. Çocuk doğurma potansiyeli bulunan kadınlar hamile kalmaktan kaçınmalıdırlar.
LASTET ile tedavi edilen erkeklerin tedavi sırasında ve tedavi sonrası 6 aylık dönem içinde çocuk sahibi olmamaları ve LASTET tedavisinden sonra irreversibl infertilite olasılığından dolayı, tedaviye başlamadan önce spermlerini sperm bankasında saklama uygulaması hakkında uzman bir kuruma danışmaları önerilmektedir.
Gebelik dönemi
LASTET ile gebe kadınlarda yapılmış yeterli ve kontrollü çalışma bulunmamaktadır. LASTET genetik yapıya zarar verebilir ve embriyo gelişimini olumsuz etkileyebilir. LASTET hamilelik sırasında kullanılmamalıdır. Hamile hastalarda ilacın tedavi için endikasyonu hayati önemdeyse, anne kamındaki çocuğun maruz kalacağı riskler hakkında tıbbi konsültasyon yapılmalıdır.
Tedavi sırasında hasta hamile kalacak olursa, genetik konsültasyona başvurulmalıdır.
Laktasyon dönemi
LASTET ile tedavi sırasında emzirme durdurulmalıdır.
Üreme yeteneği/ Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
Rapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir.
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygm olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın: Ağır enfeksiyonlar
(Kist ve polipler dahil olmak üzere) iyi huylu ve kötü huylu neoplazmlar
Yaygın olmayan: Akut lösemi (özellikle başka antineoplastik etkili ilaçlarla kombine edilerek uygulanan etoposid tedavisinin geç sonucu olarak).
Monositik tümörlü hastalarda etoposid tedavisinden sonra sekonder lösemi riski yaklaşık % ldir. Bu löseminin karakteristik özellikleri; görece kısa latans süresi (ortalama 35 ay), monositik veya miyelomonositer FAB alt-tipi, vakaların yaklaşık % 50sinde 1 lq23de kromozom anormallikleri ve kemoterapiye iyi cevap vermesidir. Sekonder lösemi riski toplam kümülatif doz artışıyla (Etoposid > 2 g/m) birlikte artar.
Çok seyrek: Tümör lizis sendromu (bazen ölümcül olabilen)
Kan ve lenf sistemi hastalıkları
Çok yaygın: En önemli ve doz sınırlayıcı yan etki, reversibl kemik iliği süpresyonudur. Bunun şiddeti doza bağlıdır ve Ölümcül olabilir.
Hastaların % 60 - 91inde lökosit sayısı azalması (yaklaşık olarak 21 sonra ortaya çıkar), % 7-17sinde şiddetli lökosit sayısı azalması (1000/mikrolitreden az), % 28 - 4 T inde trombosit sayısı azalması ve % 4 - 20sinde şiddetli trombosit sayısı azalması (50000/mikrolitreden az) gözlemlenmiştir. En düşük lökosit değerlerine 7-14 gün sonra ve en düşük trombosit sayımı değerlerine 9-16 gün sonra ulaşılmıştır.
Hastaların yaklaşık % 40ında hemoglobin düşüşü gözlemlenmiştir.
20 gün sonra kan sayımı değerleri genel olarak tekrar normale dönmüştür. Etoposidin kemik iliği üzerindeki etkisi kümülatif değildir.
Ağır kemik iliği süpresyonu beraberinde enfeksiyonlara veya kanamalara yol açabilir.
Bağışıklık sistemi hastalıkları
Yaygın: Uygun tedavi önlemlerinin (adrenalin, antihistaminikler, glukokortikoidler) alınmasını gerektiren üşüme ve titreme nöbetleri, ateş, taşikardi, bronkospazm, dispne ve kan basıncı düşüşü olayları hastaların % 0,7 - % 2sinde gözlemlenmiştir.
Ayrıca nöbet tarzında cilt kızarıklığı (eritem), yüz ve dil ödemi, öksürük, terleme, siyanoz, laringospazm, kramp nöbetleri ve kan basıncı artışı olaylarını içeren anafılaktoid reaksiyonlar da gözlemlenmiştir.
Çok seyrek: İnfüzyon uygulamasında solunumun infıizyon kesildikten sonra spontane olarak yeniden düzene girdiği apne vakaları. Bronkospazmla bağlantılı ani ölümcül reaksiyonlar rapor edilmiştir.
Sinir sistemi hastalıkları
Yaygın: Santral sinir sistemi yan etkileri (bitkinlik, uyuklama), periferal sinir sistemi yan etkileri.
Yaygın olmayan: Kramp nöbetleri ve konfuzyon, hiperkinezi, akinezi, somnolans, baş dönmesi, yorgunluk, ağızda tat kalması, geçici kortikal körlük ve optik nevrit de dahil merkezi sinir sistemi etkileri.
Seyrek: Periferik nöropati
Bilinmiyor: Ekstrem i tel erde uyuşma ve baş ağrısı
Göz hastalıkları
Bilinmiyor: Geçici kortikal körlük, optik nörit
Kardiyak hastalıklar
Çok seyrek: Kalp ritim bozuklukları, miyokard enfarktüsü (ancak etoposid ile bağlantısı ispatlanamamıştır).
Seyrek: Hipotansiyon, hipertansiyon Bilinmiyor: Aritmi, taşikardi
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Yaygm olmayan: İnterstisyel pnömoni, pnömoni ve pulmoner fıbroz.
Bilinmiyor: Apne
Gastrointestinal hastalıklar
Çok yaygın: % 31 - 43 sıklıkla mide bulantısı ve kusma meydana gelir ve genel olarak antiemetik tedaviyle kontrol edilebilir (bakınız Bölüm 4.4). % 1 - 13 sıklıkla diyare, % 10 - 13 sıklıkla iştahsızlık gözlemlenmiştir.
Yaygın: Hastaların % 1 - 6sında ağız mukozası enflamasyonu görülebilir; bunun için ağız hijyenine özen gösterilmelidir. Mukozit ve özofajit meydana gelebilir. Tat alma hissi bozulabilir. Yaygın olmayan: Yutma zorluğu (disfaji), karın ağrısı, obstipasyon.
Hepato-bilier hastalıklar
Yaygın: Karaciğer işlev bozuklukları % 0-3 sıklıkla gözlemlenmiştir. Yüksek dozlarda LASTET, bilirubin, SGOT ve alkalik fosfatazın serum değerlerinde artışa neden olabilir.
Seyrek: y-GTP, LDH seviyelerinde yükselme
Deri ve derialtı doku hastalıkları
Çok yaygın: % 66ya kadar varan sıklıkta saç dökülmesi meydana gelir ve bazı durumlarda saç tamamen dökülür, fakat tedaviden sonra saç yeniden çıkar.
Yaygın olmayan;Döküntü, ürtiker, cilt renginde bozulma (pigmentasyon) ve kaşıntı.
Çok seyrek: Radyoterapi ve müteakip etoposid tedavisinden sonra, bir hastanın ışın uygulanan bölgesinde enflamatuvar ve kaşıntılı cilt kızarması meydana gelmiştir. Bunun yanında,
Stevens-Johnson sendromu ve toksik epidermal nekrolİz (ölümcül bir vaka) bildirilmiştir; ancak bunların etoposidle bağlantısı kanıtlanamamıştır.
Böbrek ve idrar hastalıkları
Seyrek: İdrarda protein
Bilinmiyor: BUN ve kreatinin seviyelerinde artış
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Seyrek: Yüzde sıcak basması, ödem, total serum protein seviyelerinde azalma Bilinmiyor: Geçici metabolik asidoz, halsizlik, intermitten kas krampları ve ateş, sodyum, potasyum, klor, kalsiyum gibi elektrolitlerde anormallikler, şuur bulanıklığı, yorgunluk, tat değişikliği.
Araştırmalar
4.9. Doz aşımı ve tedavisi
Doz aşımı, 1 ila 2 hafta içinde şiddetli miyelosüpresyona neden olabilir.
Doz aşımı için spesifik bir antidot yoktur. Kemik iliğine korumaya yönelik etkili maddeler bilinmemektedir. Kemik iliği nakli etkili bir önlem olabilir. Semptomatik tedavi, kan transfüzyonunu ve enfeksiyonların önlenmesini ve tedavi edilmesini içermelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: Sitostatikler/podofilotoksin türevi ATC Kodu: L01CB01
Etki mekanizması
5.2. Farmakokinetik özellikler
Genel Özellikler:
Emilim:
LASTET yumuşak kapsüller yutulduktan sonra, etoposidin mutlak biyoyararlanımı % 50 ± 25dir. İlaç alımından 1-2 saat sonra maksimum plazma seviyelerine ulaşılır.
Oral kullanımdan sonra C ^ ve AUC değerleri, normalde, intravenöz uygulama sonrası ulaşılan
değerlerin yarısına ulaşır ve aynı bireyde ve bireyler-arasında büyük değişkenlik gösterir. Absorpsiyonun doza bağlı olduğu kanıtlanamamıştır.
Dağılım:
İnsan serumunda proteine bağlanma oranının % 94-97 olduğu tespit edilen Etoposidin dokulara hızlı dağıldığı, ancak serebrospinal sıvıya geçmediği bulunmuştur.
t 1-2 saat ve t 5-11 saat olmak üzere, plazma seviyeleri bifazik bir seyir izler. Günde 200 mg veya 2 x 200 mg oral uygulama ardından plazmada birikim gözlemlenmemiştir.
Bivotransformasvon:
Etoposidin ilk geçiş etkisiyle ilgili hiçbir bulgu yoktur. Örneğin, etoposid kapsül ile non-renal klerensinin mutlak oral biyoyararlanımı arasında bir ilişki yoktur. Oral kapsül uygulamasından sonra etoposid metabolizma ve atılımında başka hiçbir farklılık bulgularına rastlanmamıştır.
Eliminasyon:
İlacın başlıca atılım yolu böbrektir; dozun % 40-60sı 48-72 saat içinde değişmemiş ilaç formunda İdrarla atılır. Böbrek yetmezliği olan hastalarda ilacın eliminasyon süresi uzayabilir. Klerensin 20 mg/dakika veya altında olduğu hastalara standart dozun % 75i verilmelidir.
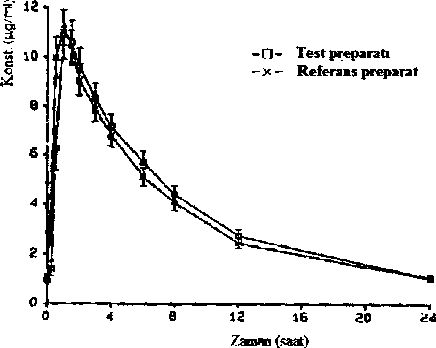
Bivovararlanım
Bir konsantrasyon-zaman diyagramında ortalama plazma seviyesinin referans preparata kıyasla izlediği seyir
1993 yılında 34 denekte yapılan bir biyoyararlanım çalışması referans preparata kıyasla şu sonuçları vermiştir:
Test preparatı | Referans preparat | |
Maksimum plazma konsantrasyonu (C ): ng/ml ma* | 12,40 ±0,90 | 11,79 ±0,77 |
Maksimum plazma konsantrasyonuna ulaşma zamanı (t ): saat ma* | 1,35 ±0,11 | 0,93 ± 0,06 |
Konsantrasyon-zaman eğrisinin altındaki alan (AUC): ^ıg/ml ~h | 92,89 ±7,41 | 88,89 ± 6,34 |
5.3. Klinik Öncesi güvenlilik verileri
Mutaienite
İn-vitro ve in-vivo deneylerde etoposidin gen ve kromozom mutasyonuna yol açtığına dair pozitif sonuçlar elde edilmiştir. Bu sonuçlar, ilacın insanlarda mutajenik bir etkiye sahip olduğu şüphesini haklı kılmaktadır.
Karsinojenite:
Karsinojenite için hayvan deneyleri yapılmamıştır. DNA hasarı ve ispatlanan genotoksİsitesinden dolayı, etoposidin kanserojen potansiyel taşıdığı varsayılmalıdır.
Üreme farmakoloiisi/teratoienite
Etoposid hayvan deneylerinde embriyotoksik ve teratojen etki göstermiştir. İlaç, anne hayvanlardaki ağırlık artışını doza bağlı bir şekilde progresif olarak inhibe etmiştir. Sıçanlara ve farelere etoposid verildikten sonra testis atrofisi ve spermiyogenez bozuklukları görülmüştür.
İmmünoloji
Etoposid hayvan deneylerinde immünosüpresif etki göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
6.2. Geçimsizlikler
Bugüne kadar bilinen bir geçimsizlik yoktur.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
6.5. Ambalajın niteliği ve içeriği
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ETOPOSID | 8699205760158 | |
| ETOPOSIDE-AMPHAR | 8699694770010 | |
| ETOPOSIDE-TEVA | 8699638760244 | |
| ETOSID | 8699828760061 | 369.42TL |
| FYTOSID | 8699830770034 | |
| Diğer Eşdeğer İlaçlar |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Onko Koçsel İlaç San. Tic. A.ş
| Satış Fiyatı | 1006.61 TL [ 22 Sep 2023 ] |
| Önceki Satış Fiyatı | 1006.61 TL [ 15 Sep 2023 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699650151228 |
| Etkin Madde | Etoposid |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |