LASTET 50 mg 20 kapsül Farmakolojik Özellikler
{ Etoposid }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: Sitostatikler/podofılotoksin türevi ATC Kodu: L01CB01
Etki mekanizması
5.2. Farmakokinetik özellikler
Genel Özellikler:
Emilim:
LASTET yumuşak kapsüller yutulduktan sonra, etoposidin mutlak biyoyararlanımı % 50 ± 25dir. İlaç alımından 1-2 saat sonra maksimum plazma seviyelerine ulaşılır.
Oral kullanımdan sonra C ve AUC değerleri, normalde, intravenöz uygulama sonrası ulaşılan
mnks
değerlerin yarısına ulaşır ve aynı bireyde ve bireyler-arasında büyük değişkenlik gösterir. Absorpsiyonun doza bağlı olduğu kanıtlanamamıştır.
Dağılım:
İnsan serumunda proteine bağlanma oranının % 94-97 olduğu tespit edilen Etoposidin dokulara hızlı dağıldığı, ancak serebrospinal sıvıya geçmediği bulunmuştur.
t 1-2 saat ve t 5-11 saat olmak üzere, plazma seviyeleri bifazik bir seyir izler. Günde 200 mg veya 2 x 200 mg oral uygulama ardından plazmada birikim gözlemlenmemiştir.
Bivotransformasvon:
Etoposidin ilk geçiş etkisiyle ilgili hiçbir bulgu yoktur. Örneğin, etoposid kapsül ile non-renal klerensinin mutlak oral biyoyararlanımı arasında bir ilişki yoktur. Oral kapsül uygulamasından sonra etoposid metabolizma ve atılımında başka hiçbir farklılık bulgularına rastlanmamıştır.
Eliminasyon:
İlacın başlıca atılım yolu böbrektir; dozun % 40-60sı 48-72 saat içinde değişmemiş ilaç formunda idrarla atılır. Böbrek yetmezliği olan hastalarda ilacın eliminasyon süresi uzayabilir. Klerensin 20 mg/dakika veya altında olduğu hastalara standart dozun % 75i verilmelidir.
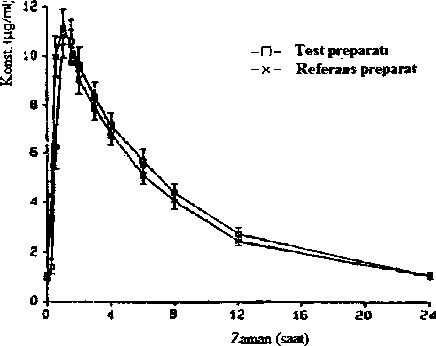
Bivovararlamm
Bir konsantrasyon-zaman diyagramında ortalama plazma seviyesinin referans preparata kıyasla izlediği seyir
1993 yılında 34 denekte yapılan bir b i yo yarar 1 anım çalışması referans preparata kıyasla şu sonuçlan vermiştir:
Test preparatı | Referans preparat | |||||||||||||||||||||||||||||||||||||||
Maksimum plazma konsantrasyonu (C ): jng/ml m&\ | 12,40 ±0,90 | 11,79 ±0,77 | ||||||||||||||||||||||||||||||||||||||
Maksimum plazma konsantrasyonuna ulaşma zamanı (t ): saat ma\ | 1,35 ±0,11 | 0,93 ± 0,06 | ||||||||||||||||||||||||||||||||||||||
Konsantrasyon-zaman eğrisinin altındaki alan (AUC): fig/ml ~h | 92,89 ±7,41 | 5.3. Klinik öncesi güvenlilik verileriMutaienite İn-vitro ve in-vivo deneylerde etoposidin gen ve kromozom mutasyonuna yol açtığına dair pozitif sonuçlar elde edilmiştir. Bu sonuçlar, ilacın insanlarda mutajenik bir etkiye sahip olduğu şüphesini haklı kılmaktadır. Karsinojenite: Karsinojenite için hayvan deneyleri yapılmamıştır. DNA hasarı ve ispatlanan genotoksisitesinden dolayı, etoposidin kanserojen potansiyel taşıdığı varsayılmalıdır. Üreme farmakoloiisi/teratoienite Etoposid hayvan deneylerinde embriyotoksik ve teratojen etki göstermiştir. İlaç, anne hayvanlardaki ağırlık artışını doza bağlı bir şekilde progresif olarak inhibe etmiştir. Sıçanlara ve farelere etoposid verildikten sonra testis atrofisi ve spermiyogenez bozukluklan görülmüştür. İmmünoloji Etoposid hayvan deneylerinde immünosüpresif etki göstermiştir.
İLAÇ GENEL BİLGİLERİ
Onko Koçsel İlaç San. Tic. A.ş
|
| Geri Ödeme Kodu | A04572 |
| Satış Fiyatı | 3064.66 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 3064.66 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699650151211 |
| Etkin Madde | Etoposid |
| ATC Kodu | L01CB01 |
| Birim Miktar | 50 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 20 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Alkaloidler ve Diğer Doğal İlaçlar (64 ilaç) > Etoposid |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |

