LATAFREE % 0.005 tek dozluk göz damlası. çözelti Kısa Ürün Bilgisi
{ Latanoprost }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
LATAFREE %0.005 tek dozluk göz damlası, çözelti Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
0,2 mL çözelti içeren 0,4 mL'lik tek dozluk flakon 0,01 mg latanoprost içerir.
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Tek dozluk göz damlası, çözelti Beyaz, beyazımsı bulanık çözelti
Diğer elinizle flakonu baş aşağı, gözünüzün üstünde dik olarak tutunuz. Yavaşça sıkarak bir damla damlatınız. Damlalığın ucunu eliniz veya gözünüze değdirmemeye dikkat ediniz.

4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
LATAFREE, açık açılı glokom ve oküler hipertansiyonu olan yaşlılar dahil yetişkin hastalarda artmış intraoküler basıncı düşürmede endikedir.
LATAFREE, pediyatrik glokomda ve göz içi basıncı yükselmiş pediyatrik hastalardaki göz içi basıncını düşürmede endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/Uygulama sıklığı ve süresi:Erişkinler için önerilen tedavi şekli günde bir kez, hasta göz(ler)e bir damla damlatılmasıdır. Optimal etki LATAFREE akşamları uygulandığında elde edilir.
Pediyatrik hastalarda önerilen doz erişkinlerle aynı olup, günde 1 kez hasta göz(ler)e bir damla damlatılmalıdır (Bkz. Bölüm 5.1). Eğer bir doz atlanırsa tedavi bir sonraki dozun zamanında uygulanmasıyla devam ettirilir.
Uygulama şekli:
Oküler kullanım.
Tüm göz damlalarında olduğu gibi, olası sistemik absorpsiyonu azaltmak için, gözyaşı kesesinin bir dakika süreyle mediyal kantustan bastırılması (punktal oklüzyon) önerilir. Bu işlem, her bir damla damlatıldıktan hemen sonra uygulanmalıdır.
Göz damlasının damlatılmasından önce kontakt lensler çıkartılmalıdır; ilaç damlatıldıktan en az 15 dakika sonra lensler yeniden takılabilir (Bkz. Bölüm 4.4).
LATAFREE, intraoküler basıncı düşürmek için diğer sınıflardaki topikal oftalmik ilaçlarla birlikte kullanılabilir. Birden fazla topikal oftalmik ilaç kullanılıyorsa, ilaçlar en az beş dakika arayla uygulanmalıdır.
Günde bir defadan daha sık yapılan uygulamaların ilacın intraoküler basıncı düşürücü etkisini azalttığı görüldüğünden, LATAFREE'nin önerilen günlük tatbik sayısı günde 1 defadan fazla olmamalıdır.
Tek dozluk kap, her iki gözü de tedavi etmeye yeterli miktarda göz damlası içerir.
Uygulamadan önce ellerinizi yıkayınız.
Aşağıda belirtildiği şekilde gözünüze uygulayınız:
Bir adet tek dozluk flakonu yerinden ayırınız, ucundan kırınız ve üzerini gösterildiği gibi çeviriniz.
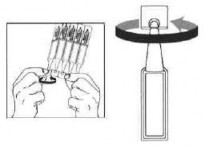
Damlattıktan sonra gözünüzün iç ucuna parmak ucunuz ile 1-2 dakika bastırınız. Bu, ilacın gözyaşı kanallarından buruna akmasını önler.

4.3. Kontrendikasyonlar
Latanoprost veya ilacın bileşimindeki maddelerden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
LATAFREE iris içindeki kahverengi pigmenti artırarak göz rengini yavaş yavaş değiştirebilir. Tedavi başlatılmadan önce hastalar gözlerinin renginde kalıcı bir değişiklik olabileceği konusunda bilgilendirilmelidir. Tek taraflı tedavide kalıcı heterokromi oluşabilir.
Bu etki özellikle mavi-kahverengi, gri-kahverengi, yeşil-kahverengi veya sarı-kahverengi gibi karma renkli irisleri olanlarda daha çok görülür. İki yıl boyunca yapılmış çalışmalarda hastalardan gözleri homojen olarak mavi olanlarda renk değişikliği gözlenmezken, göz rengi homojen gri, yeşil veya kahverengi olanlarda renk değişikliği nadiren görülmüştür. Latanoprost ile yapılan çalışmalarda iris rengindeki değişimin başlangıcı genellikle tedavinin ilk 8 ayı içinde, nadiren de ikinci veya üçüncü yılı içinde görülür; tedavinin dördüncü yılından sonra ise değişim görülmemiştir. İris pigmentasyonunun progresyon hızı zamanla azalır ve beş yıl süreyle stabil kalır. Artan pigmentasyonun etkisi beş yıldan sonraki dönemde değerlendirilmemiştir. Açık etiketli, 5 yıllık bir latanoprost güvenlilik çalışmasında hastaların
%33'ünde iris pigmentasyonu gelişmiştir (Bkz. Bölüm 4.8). Olguların çoğunluğunda iristeki renk değişimi hafif olup, çoğu zaman klinik olarak gözlenmemiştir. Karma renkli irisleri olan hastalardaki insidans %7 ile %85 arasında değişirken, en yüksek insidans sarı-kahverengi irislerde görülmüştür.
Bu etki melanosit sayısının artmasından ziyade iristeki stromal melanositlerin melanin içeriğinin artmasına bağlıdır. Tipik olarak, pupilin etrafındaki kahverengi pigmentasyon etkilenen gözde merkezden perifere doğru olur fakat iris veya irisin bir kısmı daha kahverengimsi görünebilir. Tedavi kesildikten sonra renk değişikliği ilerlememektedir. Yapılan klinik çalışmalarda, söz konusu renk değişikliği herhangi bir semptom ile ilişkilendirilememiştir.
Tedavi, iristeki ben ya da benekleri etkilemez. Klinik çalışmalarda, ön kamaranın trabeküler ağında ya da başka bir yerinde pigment birikimine rastlanmamıştır. Beş sene süreyle iris pigmentasyonunu değerlendirmek için yapılan klinik çalışmada, iris pigmentasyonundaki artış herhangi bir negatif klinik sekele yol açmamıştır ve iris pigmentasyonu oluşursa LATAFREE kullanmaya devam edilebilir. Ancak, irisin pigmentasyonu hakkında daha uzun süreli deneyimler elde edilmedikçe, hastalar düzenli olarak kontrol edilmeli ve iris pigmentasyonunda artış olduğunda klinik durum değerlendirilerek gerekirse tedavi kesilmelidir.
Dar açılı glokom, psödofakik hastalarda açık açılı glokom ve pigmenter glokomda latanoprost ile ilgili deneyim sınırlıdır. Enflamatuar ve neovasküler glokom, enflamatuar oküler koşullar veya konjenital glokom için latanoprost ile ilgili bir deneyim yoktur. Latanoprostun göz bebeği üzerinde etkisi yoktur ya da çok az bir etkisi vardır; ancak, kapalı açılı glokomun akut atakları konusunda deneyim bulunmamaktadır. Bu nedenle, daha fazla deneyim edinilene kadar, latanoprostun bu koşullarda dikkatle kullanılması önerilmektedir.
Latanoprostun katarakt ameliyatının peri-operatif döneminde kullanımıyla ilgili çalışma verileri sınırlıdır. LATAFREE bu hastalarda dikkatle kullanılmalıdır.
Latanoprost, herpetik keratit öyküsü olan hastalarda dikkatli şekilde kullanılmalıdır ve aktif herpes simpleks keratiti olgularında ve özellikle prostaglandin analogları ile ilişkili yineleyen herpetik keratit öyküsü olan hastalarda kullanılmamalıdır.
Esas olarak afakik hastalarda, posterior lens kapsülünde veya ön kamara lenslerinde yırtığı olan psödofakik hastalarda veya kistoid maküler ödem (diyabetik retinopati ve retinal ven oklüzyonu gibi) için risk faktörü olduğu bilinen hastalarda maküler ödem görülmüştür (Bkz. Bölüm 4.8). Afakik hastalarda, posterior lens kapsülünde veya ön kamara lenslerinde yırtığı olan psödofakik hastalarda veya kistoid maküler ödem için risk faktörü olduğu bilinen hastalarda LATAFREE dikkatle kullanılmalıdır.
İrit/üveit için predispozan risk faktörlerine sahip olduğu bilinen hastalarda LATAFREE dikkatle kullanılmalıdır.
Astımı olan hastalarda deneyim sınırlıdır, ancak pazarlama sonrası deneyimde bazı astım ve/veya dispne alevlenmesi olguları rapor edilmiştir. Bu nedenle, yeterli deneyim edinilinceye kadar astım hastaları dikkatle tedavi edilmelidir (Bkz. Bölüm 4.8).
Raporların çoğunda Japon hastalarda olmak üzere, periorbital cilt rengi değişikliği gözlenmiştir. Bugüne kadarki deneyimler periorbital cilt rengi değişikliğinin kalıcı olmadığını göstermektedir ve bazı olgularda latanoprost tedavisi devam ettiği sırada normale dönmüştür.
LATAFREE, tedavi edilen gözde ve çevresindeki kirpiklerde ve ayva tüylerinde yavaş yavaş değişikliklere neden olabilir; bu değişiklikler uzunluk, kalınlık, pigmentasyon ve kirpik veya
ayva tüylerinin sayısında artış olması, kirpiklerin yanlış yönde büyümesidir. Kirpik değişiklikleri tedavi kesildikten sonra geri dönüşümlüdür.
Pediyatrik popülasyon
1 yaşından küçük yaş grubuna ilişkin etkililik ve güvenlilik verileri 4 hasta ile sınırlıdır (Bkz. Bölüm 5.1). Erken doğan (36 haftalık gestasyonel yaştan önce) infantlara ilişkin veri bulunmamaktadır.
0 ila 3 yaş arası çocuklarda başlıca görülen PKG (Primer Konjenital Glokom) tedavisinde, cerrahi (ör. trabekülotomi/goniotomi) halen birinci basamak tedavidir.
Çocuklarda uzun süreli güvenlilik henüz belirlenmemiştir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
LATAFREE ile spesifik ilaç etkileşimi bilgisi bulunmamaktadır.
Kombine kullanımı ile ilgili klinik çalışmalar tam kesinlik kazanmamış olsa da, 3 aylık bir çalışmada, latanoprostun göz içi basıncını düşürücü etkisinin, beta-adrenerjik antagonistler (timolol), adrenerjik agonistler (dipivalil, epinefrin), karbonik anhidraz inhibitörleri (asetazolamid) ve en azından kısmi olarak da kolinerjik agonistlerle (pilokarpin) aditif olduğu gösterilmiştir.
İki prostaglandin analoğunun birlikte oftalmik uygulanmasını takiben intraoküler basınçta çelişkili yükselmeler olduğuna dair raporlar mevcuttur. Dolayısıyla, iki veya daha fazla prostaglandinin, prostaglandin analoğunun veya prostaglandin türevlerinin kullanımı önerilmez.
Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği:
Mevcut veri yoktur.
Pediyatrik popülasyon:
Etkileşim çalışmaları yalnızca yetişkinlerde gerçekleştirilmiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Gebeliğin seyri bakımından, doğmamış bebek veya yenidoğan açısından potansiyel tehlikeli farmakolojik etkileri bulunması nedeniyle çocuk doğurma potansiyeli bulunan kadınlar etkili bir doğum kontrolü uygulamalıdır.
Gebelik dönemi
Latanoprostun gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Bu tıbbi ürünün insanlarda gebelik sırasında kullanım açısından güvenliliği belirlenmemiştir. Bu nedenle, LATAFREE gebelik sırasında kullanılmamalıdır. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Laktasyon dönemi
LATAFREE'nin aktif maddesi ve metabolitleri anne sütüne geçebilir. Bu nedenle LATAFREE emziren annelerde kullanılmamalıdır ve emzirme durdurulmalıdır.
Üreme yeteneği/Fertilite
Latanoprost ile yapılan hayvan çalışmalarında, erkek ya da dişi fertilitesi üzerinde herhangi bir olumsuz etki görülmemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
LATAFREE'nin araç ve makine kullanımı üzerine etkisi oldukça azdır. Diğer göz preparatlarında olduğu gibi, göze damlatılması geçici görme bulanıklıklarına yol açabilir. Bu durum geçinceye kadar, hastalar araç ve makine kullanmamalıdır.
4.8. İstenmeyen etkiler
​Güvenlilik profilinin özeti
Advers reaksiyonların çoğunluğu oküler sistemle ilgilidir. Açık etiketli, 5 yıllık bir latanoprost güvenlilik çalışmasında hastaların %33'ünde iris pigmentasyonu gelişmiştir (Bkz. Bölüm 4.4). Diğer oküler advers reaksiyonlar genellikle geçicidir ve dozun uygulanması sırasında meydana gelir.
4.9. Doz aşımı ve tedavisi
Latanoprost aşırı dozda verildiğinde, göz iritasyonu ve konjunktiva hiperemisi dışında göze ait herhangi bir yan etki oluşturmamaktadır. Latanaprostun aşırı dozda alımı söz konusu olduğunda tedavi semptomatik olmalıdır.
LATAFREE'nin yanlışlıkla ağızdan alınması durumunda, aşağıdaki bilgiler faydalı olabilmektedir:
Tek dozluk kaplar 10 mcg latanoprost içerir. Bunun %90'dan fazlası karaciğerden ilk geçişte metabolize olur. Sağlıklı gönüllülere intravenöz olarak verilen 3 mcg/kg latanoprost herhangi bir belirti oluşturmamıştır, ancak 5,5-10 mcg/kg'lık dozlar, bulantı, karın ağrısı, baş dönmesi, yorgunluk, sıcak basmaları ve terlemeye neden olmuştur. Maymunlarda, 500 mikrogram/kg'a kadar olan dozlarda intravenöz latanoprost infüzyonu yapıldığında kardiyovasküler sistem üzerinde önemli etkiler olmamıştır.
Maymunlara intravenöz yolla latanoprost uygulanması geçici bronkokonstriksiyon ile ilişkilendirilmiştir. Orta dereceli bronşiyal astımı olan hastalarda latanoprostun klinik kullanım dozunun 7 katı verildiğinde bile, solunum sistemi, kalp atışı veya kan basıncı üzerine belirgin etkisi olmamıştır.
Kontaminasyondan korunmak için uygulamadan sonra çözelti artsa bile kullanılmış flakonu atınız.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Oftalmolojikler, antiglokom preparatları ve miyotikler; prostaglandin analoğu
ATC kodu: S01EE01
Etki mekanizması:
Bir prostaglandin Fanaloğu olan latanoprost, aköz hümörün dışarıya akışını artırarak göz içi basıncını azaltan selektif bir prostanoid FP reseptör agonistidir. İnsanlarda intraoküler basıncın azalması, uygulandıktan yaklaşık 3-4 saat sonra başlar ve maksimum etkiye 8-12 saat sonra ulaşır. Basınç azalması en az 24 saat süreyle sağlanır.
Hayvanlarda ve insanlarda yapılan çalışmalar basınç düşürücü etkinin ana mekanizmaların uveoskleral dışa akımın artması ve aköz hümörün dışa akımını kolaylaştırıcı faktörlerin etkisini artırdığı da (dışa akım direncinin azalması) gözlenmiştir.
Farmakodinamik etki:
Önemli çalışmalar latanoprost monoterapisinin etkili olduğunu göstermiştir. Kombine kullanımı ile ilgili klinik çalışmalar da yapılmıştır. 3 aylık bir çalışma latanoprostun beta- adrenerjik antagonistleriyle (timolol) kombinasyonunun etkili olduğunu göstermiştir. Kısa
süreli çalışmalar (1 veya 2 hafta), latanoprostun adrenerjik agonistler (dipivalil, epinefrin), oral karbonik anhidraz inhibitörleri (asetazolamid) ile kombinasyonunun aditif, kolinerjik agonistlerle (pilokarpin) ise kısmen aditif etkileri olduğunu düşündürmektedir.
Klinik çalışmalar, latanoprostun aköz hümörun üretiminde herhangi bir etkisinin olmadığını göstermiştir. Latanoprostun kan-aköz bariyeri üzerine de herhangi bir etkisi söz konusu değildir.
Latanoprost, maymunlarda klinik dozda kullanıldığında intraoküler kan dolaşımı üzerinde hiçbir etki oluşmaz ya da etkileri önemsizdir. Topikal uygulama sırasında az ya da orta derecede bir konjunktival veya episkleral hiperemi ortaya çıkabilmektedir.
Ekstrakapsüler lens ekstraksiyonu geçirmiş maymunların gözlerine uygulanan latanoprost ile kronik tedavi, floresein anjiyografisi ile yapılan belirlemeye göre retinal kan damarlarını etkilememiştir.
Psödofakik hastalarda uygulanan kısa süreli latanoprost tedavisi sonucunda arka segmente herhangi bir fluoresein sızması söz konusu olmamıştır.
Klinik dozlarda latanoprost, kardiyovasküler veya solunum sistemi üzerinde belirgin herhangi bir farmakolojik etki yaratmamıştır.
Klinik etkililik ve güvenlilik:
404 oküler hipertansiyon ve glokomatöz hastalarında, prezervatif içeren % 0.005 latanoprost referans ürün ile prezervatif içermeyen latanoprost ile 3 aylık, karşılaştırmalı araştırmacı maskeli çalışma değerlendirilmiştir. Primer etkinlik değişimi, başlangıç ile 84. gün arası intraoküler basınçtaki değişimdir.
84. günde, intraoküler basınç düşmesi -%36 yani -8,6 mm Hg idi. Latanoprost tarafından uyarılmıştır. Bu prezervatif içeren % 0,005 latanoprost referans ürün ile benzerdir.
Hasta göz (mL TT popülasyon) |
| Latanoprost | Referans ürün |
Temel | n Ortalama+SD | 189 24,1±1,8 | 164 24 ±1,7 |
84. gün | n Ortalama+SD | 185 15,4±2,3 | 162 15±2 |
Ortalama değişiklik (0-84) | n Ortalama+SD [%95 Cl] | 185 -8,6±2,6 [-9; -8,3] | 162 -9±2,4 [-9,4;-8,7] |
İstatiksel analiz | E (SE) [%95 Cl] | 0,417±0,215 [-0.006; 0.840] | |
Bu 3 aylık deneme latanoprost ve latanoprost referans ürünlerinin istenmeyen etkilerini sırasıyla şöyle göstermiştir: irritasyon/yanma/batma damlatma üzerine değil (84. günde, latanoprost için % 6,8 ve latanoprost referans ürün için % 12,9) ve konjunktival hiperemi (84. günde, latanoprost için % 21,4 ve latanoprost referans ürün için % 29,1). Sistematik yan etkilerle ilgili, 2 tedavi grubu arasında majör farklılık elde edilmez.
Pediyatrik popülasyon
≤18 yaşındaki pediyatrik hastalarda latanaprostun etkililiği, oküler hipertansiyon ve pediyatrik glokom tanısı konulan 107 hastada timolol ile latanoprostun karşılaştırıldığı 12 haftalık çift maskeli bir klinik çalışmada gösterilmiştir. Yenidoğanların gestasyonel yaşının en az 36 hafta olması şart koşulmuştur.
Hastalara günde bir kez %0,005 latanoprost ya da günde iki kez %0,5 timolol (veya 3 yaşından küçük katılımcılar için isteğe bağlı olarak %0,25) verilmiştir. Birincil etkinlik sonlanım noktası, başlangıçtan çalışmanın 12. haftasına kadar göz içi basıncında (GİB) meydana gelen ortalama azalmadır. Latanoprost ve timolol gruplarında ortalama GİB azalmaları benzer olmuştur. İncelenen tüm yaş gruplarında (0 ila <3 yaş, 3 ila <12 yaş ve 12 ila 18 yaş), 12. haftada latanoprost grubundaki ortalama GİB azalması, timolol grubundakine benzer olmuştur. Buna karşın 0 ila <3 yaş grubunda etkinlik verileri, latanoprost için yalnızca 13 hastaya dayanmaktadır ve klinik pediyatrik çalışmadaki 0 ila <1 yaş grubunu temsil eden 4 hastada önemli bir etkinlik gösterilmemiştir. Erken (36 haftalık gestasyonel yaştan önce) doğan bebeklere ilişkin veri bulunmamaktadır.
PKG alt grubundaki katılımcılarda GİB azalmaları, latanoprost grubu ile timolol grubu arasında benzer olmuştur. PKG olmayan (ör. juvenil açık açılı glokom, afakik glokom) alt grup, PKG alt grubu ile benzer sonuçlar göstermiştir.
GİB üzerindeki etki, yetişkinlerde olduğu gibi, tedavinin ilk bir haftasından sonra gözlenmiştir ve 12 haftalık çalışma dönemi boyunca korunmuştur.
Aktif tedavi grubuna ve başlangıç tanısına göre 12. haftada GİB azalması (mmHg) | ||||
| Latanaprost N=53 | Timolol N=54 | ||
Başlangıç ortalaması (SH) 12. hafta, başlangıç ortalamasına göre değişim*(SH) | 27,3 (0,75) -7,18 (0,81) | 27,8 (0,84) -5,72 (0,81) | ||
Timolole karşı p-değeri | 0,2056 | |||
| PKG N=28 | PKG olmayan N=25 | PKG N=26 | PKG olmayan N=28 |
Başlangıç ortalaması (SH) 12. hafta, başlangıç ortalamasına göre değişim* (SH) | 26,5 (0,72) 5,9 (0,98) | 28,2 (1,37) 8,66 (1,25) | 26,3 (0,95) -5,34 (1,02) | 29,1 (1,33) -6,02 (1,18) |
Timolole karşo p-değeri | 0,6957 | 0,1317 |
|
|
SH: standart hata. * Uyarlanmış tahmini kovaryans (ANCOVA) modelin bir analizini temel almaktadır. | ||||
5.2. Farmakokinetik özellikler
Genel özelliklerLatanoprost kendiliğinden inaktif olan isopropil ester bir ön ilaçtır ama latanoprost asitinin hidrolizinden sonra biyolojik olarak aktif hale geçer.
Emilim:
Kimyasal yapısı bir izopropilester olan latanaprost bir ön ilaçtır, bu hali ile etkili değildir, ancak hidroliz sonucu asit formuna dönüşen latanaprost biyolojik olarak aktif hale geçer. Ön ilaç latanoprost, korneadan kolayca absorbe edilir ve aköz hümöre geçen ilacın tamamı, korneayı geçerken hidrolize olur. İnsanlarda yapılan çalışmalar, ilacın topikal olarak uygulanmasından 2 saat sonra, aköz hümörde maksimum konsantrasyonuna eriştiğini göstermektedir.
Dağılım:
İnsanlarda dağılım hacmi 0,16±0,02 L/kg'dır. Lokal uygulamadan sonra latanoprostun asit formu aköz hümörde ilk dört saatte ve plazmada ise sadece birinci saatte ölçülebilir. Maymunlarda topikal uygulama sonrasında latanoprost esasen ön segment, konjunktiva ve göz kapaklarına dağılmaktadır. İlacın yalnızca çok küçük bir miktarı arka segmente ulaşmaktadır.
3 aylık rasgele seçilen bir pilot çalışmada 30 hipertansiyon veya glokomatöz olan hastalarda, latanoprost plazma seviyeleri ölçülmüştür ve damlatmadan 30 dakika sonra hemen hemen tüm hastalarda değerler LOQ (40 pg/ml)'nun altına düşmüştür.
Biyotransformasyon:
Bir izopropil ester pro-ilacı olan latanoprost, korneada esterazlar tarafından biyolojik olarak aktif aside hidrolize edilir. Pratik olarak, latanoprostun aktif hali olan asit formunun göz içinde herhangi bir metabolizması söz konusu değildir. Asıl metabolizma karaciğerde oluşur. Latanoprostun sistemik dolaşıma ulaşan aktif asidi, esasen karaciğer tarafından yağ asidi β- oksidasyonu aracılığıyla 1, 2- dinor ve 1, 2, 3, 4-tetranor metabolitlerine metabolize edilir. Hayvan çalışmalarında, biyolojik aktivitesi çok az olan veya hiç olmayan bu metabolitlerin başlıca idrarla atıldığı gösterilmiştir.
Eliminasyon:
Hem intravenöz hem de topikal uygulama sonrasında, latanoprostun asit formunun insan plazmasından eliminasyonu hızlıdır (t½=17 dak). Sistemik klerensi yaklaşık 7 mL/dak/kg'dır. Hepatik β-oksidasyonu takiben, metabolitler başlıca böbrekler yoluyla elimine edilir. Topikal ve intravenöz dozdan sonra, uygulanan dozun sırasıyla %88 ve %98'i idrarda bulunur.
Pediyatrik popülasyon
Oküler hipertansiyonu ve glokomu olan 22 yetişkin ve 25 pediyatrik (doğumdan <18 yaşa kadar) hastada, plazma latanoprost asidi konsantrasyonlarına ilişkin açık etiketli bir farmakokinetik çalışma yapılmıştır. Tüm yaş gruplarına, en az 2 hafta boyunca her iki göze günde birer damla şeklinde %0,005 latanoprost uygulanmıştır. Latanoprost asidinin sistemik maruziyeti, yetişkinlerle karşılaştırıldığında 3 ila <12 yaşlarındaki hastalarda yaklaşık 2 kat ve
<3 yaşındaki çocuklarda 6 kat yüksek bulunmuştur ancak sistemik advers etkilere ilişkin geniş güvenlilik sınırı korunmuştur (Bkz. Bölüm 4.9). Pik plazma konsantrasyonuna ulaşmak için geçen medyan (ortanca) süre, tüm yaş gruplarında doz uygulamasından sonra 5 dakika
olmuştur. Medyan plazma eliminasyon yarılanma ömrü (<20 dakika), pediyatrik ve yetişkin hastalarda benzer şekilde, kısa olmuştur ve kararlı durum koşullarında latanoprost asidinin sistemik dolaşımda birikimine yol açmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Sistemik/Oküler etkiler:
Latanoprostun sistemik olduğu kadar gözle ilgili olabilecek toksik etkileri bazı hayvan türlerinde araştırılmıştır. Genel olarak, latanoprostun güvenlilik aralığı göze uygulanan klinik doz ile en az 1.000 katı dozunda uygulandığında görülen sistemik toksisite dozu aralığında olup, iyi tolere edilebilen bir maddedir. Anestezi almamış olan maymunlara intravenöz olarak verilen, klinik uygulamaların yaklaşık 100 misli doz/kg gibi yüksek doz latanoprost, büyük bir olasılıkla kısa süreli bronkokonstriksiyona bağlı olarak ortaya çıkan solunum hızı artışına neden olmuştur. Latanoprost 500 mikrogram/kg'a varan dozlarda maymunlara intravenöz infüzyon yolu ile uygulanmış ve kardiovasküler sistem üzerine major etkileri olmamıştır. Hayvan çalışmalarında, latanoprostun duyarlılaştırma özelliği bulunduğu bildirilmemiştir.
Tavşan veya maymunlarda 100 mcg/göz/gün olarak verilen dozlarda (klinik doz yaklaşık 1,5 mikrogram/göz/gün'dür) gözde her hangi bir toksik etki görülmemiştir. Maymunlarda klinik dozda kullanıldığında, latanoprostun intraoküler kan dolaşımına etkisi yoktur veya ihmal edilebilir düzeydedir.
Kronik oküler toksisite çalışmalarında, 6 mcg/göz/gün olarak verilen latanoprostun palpebral fisürde artışa neden olabileceği bildirilmiştir. Bu etki geri dönüşümlü olup, klinik dozun üzerinde uygulanan dozlarda meydana gelmiştir. Ancak bu etki insanlarda gözlenmemiştir.
Artan pigmentasyon mekanizmasının, herhangi bir proliferatif değişiklik gözlenmeksizin, irisin melanositlerindeki melanin üretiminin stimülasyonu olduğu görülmektedir. İris rengindeki değişim kalıcı olabilir.
Karsinojenez:
Fare ve sıçanlarda yapılan karsinojenite çalışmaları sonuçları negatiftir.
Mutajenez:
Latanoprost, bakterilerdeki ters mutasyon testlerinde, fare lenfomasında gen mutasyonunda ve fare mikronukleus testinde negatif sonuç vermiştir. İn vitro olarak, insan lenfositlerinde kromozom değişiklikleri gözlenmiştir. Benzer etkiler, doğal olarak meydana gelen bir
prostaglandin olan prostaglandin File de gözlenmiştir; bu nedenle söz konusu etkinin bu sınıf maddelerin bir etkisi olarak kabul edilmektedir.
İlave olarak sıçanlarla yapılan genetik mutasyon ile ilgili in vitro/in vivo çalışmalar, DNA sentezini etkilememiş ve latanoprostun mutajenik potansiyelinin olmadığını ortaya koymuştur.
Fertilite:
Latanoprost ile yapılan hayvan çalışmalarında, erkek ya da dişi fertilitesi üzerinde herhangi bir olumsuz etkisi görülmemiştir. Latanoprost ile sıçanlarda yapılan embriyotoksisite çalışmalarında intravenöz olarak verilen dozlarda (5, 50 ve 250 mikrogram/kg/gün) herhangi bir embriyotoksik etkiye rastlanmamıştır. Bununla birlikte, latanoprost tavşanlarda 5 mikrogram/kg/gün (klinik dozun yaklaşık 100 katı) ve daha yüksek dozlarda uygulandığında embriyoletal etkileri başlatmıştır.
Latanoprost, insanlarda kullanılan dozunun yaklaşık 100 katı oranında tavşanlara intravenöz yolla verildiğinde, geç rezorpsiyon ve düşük insidansında artış ve fetus ağırlığında düşüş ile karakterize embriyofetal toksisite belirtilerinin artışına neden olabilmektedir.
Teratojenez:
Teratojenik potansiyele sahip olduğu görülmemiştir.
Oküler toksisite:
Latanoprost göz damlasının, hayvanlarda 28 gün boyunca günde 2 kez oküler uygulaması herhangi bir lokal ya da sistematik toksik etki göstermemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Makrogol gliserol hidroksi stearat 40 Sorbitol (E 420)Karbomer 974P PEG 4000
Disodyum edetat Sodyum hidroksit Enjeksiyonluk su
6.2. Geçimsizlikler
In vitro olarak yapılan çalışmalar, tiomersal içeren göz damlalarının latanoprost ile karıştırılması sonucu çökeltiler oluşabileceğini göstermiştir. Bu tür göz damlaları latanoprost ile birlikte kullanıldığında, damlaların en az 5 dakika aralıklarla uygulanması gerekir.
6.3. Raf ömrü
24 ay
Folyo açıldıktan sonra 7 gün içinde, tek dozluk flakonlar kullanılabilir.
Tek dozluk flakon ilk açıldıktan sonra hemen kullanılmalıdır, kullanılmayan kısım atılmalıdır.
6.4. Saklamaya yönelik özel tedbirler
25ËšC altındaki oda sıcaklığında saklayınız. Her kullanımdan sonra kalan kısım atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
6 adet koruyucu folyo içinde 5'er adet 0,2 mL çözelti içeren 0,4 mL'lik flakonlar şeklinde kullanıma sunulmaktadır. Her kutuda 30 adet flakon bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| LATAFREE | 8699844612122 | 165.65TL |
| LATAPOL | 8699514610212 | 143.50TL |
| LATASOPT | 8680199610147 | 828.88TL |
| LATROST | 8699525618269 | |
| OFTAGEN | 8699514610113 | |
| Diğer Eşdeğer İlaçlar |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
Vem İlaç Sanayi Ve Ticaret Ltd. Şti
| Satış Fiyatı | 165.65 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 165.65 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699844612122 |
| Etkin Madde | Latanoprost |
| ATC Kodu | S01EE01 |
| Birim Miktar | 0.05 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Duyu Organları > Göz Tansiyonu İlaçları (Glokom) ve Miyotikler > Latanoprost |
| Yerli ve Beşeri bir ilaçdır. |