LEVEMIR PENFILL 100U/ml 5X3ml kartuş içinde enj. çöz. Farmakolojik Özellikler
{ Insulin Detemir }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diyabette kullanılan ilaçlar. Enjeksiyon için insülin ve analogları, uzun etkili.
ATC kodu: A10AE05.
Etki mekanizması ve farmakodinamik etkiler
LEVEMIR® Penfill®, çözünür, bazal insülin olarak kullanılan, uzun etkili bir insülin analogudur.
LEVEMIR® Penfill®'in kan şekerini düşürücü etkisi, insülinin kas ve yağ hücrelerindeki reseptörlere bağlanarak glukozun hücre içine girişini kolaylaştırmasına ve eş zamanlı olarak karaciğerden glukoz açığa çıkmasını da inhibe etmesine bağlıdır.
Tablo 1'de, total ve maksimum farmakodinamik etki için bireyin kendi içindeki varyasyon katsayısında (CV) görüldüğü üzere, LEVEMIR® Penfill®'in etki profili, NPH (Nötral Protamin Hagedorn) insülin ile kıyaslandığında istatistiksel olarak anlamlı derecede daha az değişken ve daha öngörülebilirdir.
Tablo 1. LEVEMIRPenfillve NPH insülinin zaman etki profilinin bireylerin kendi içindeki değişkenliği
Farmakodinamik son nokta | LEVEMIR Penfill CV (%) | NPH İnsülin CV (%) |
EAA* | 27 | 68 |
GİH** | 23 | 46 |
*Eğri Altındaki Alan (EAA) **Glukoz İnfüzyon Hızı (GİH) LEVEMIR® Penfill® ile yapılan bütün karşılaştırmalarda p-değeri <0,001
LEVEMIR® Penfill®'in uzamış etkisi enjeksiyon bölgesinde insülin detemir moleküllerinin güçlü birlikteliği ve yağ asidi yan zinciri ile albumine bağlanması sonucu oluşur. İnsülin detemir, NPH insülin ile kıyaslandığında periferik hedef dokularda çok daha yavaş dağılır.
Bu kombine etki uzatma mekanizmaları, insülin detemirin NPH insüline kıyasla daha tekrarlanabilir absorpsiyonunu ve etki profilini sağlar.
|
| ||||
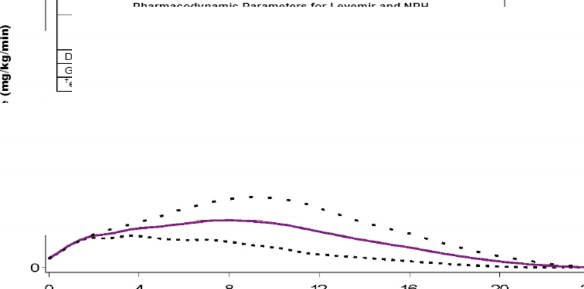
Glukoz infüzyon hızı (
İnsülin enjeksiyonundan itibaren geçen süre (saat) LEVEMIR ........ .0,2 U/kg _â_0,3 U/kg 0,4 U/kg
Şekil 1. Tip 1 diyabetli hastalarda LEVEMIRPenfill'in aktivite profili
Etki süresi günde bir veya iki enjeksiyonla sağlanan doza bağlı olarak 24 saattir. Eğer günde iki kez uygulanırsa, 2-3 doz uygulamasından sonra kararlı durum oluşur. 0,2-0,4 ünite/kg (U/kg) aralığındaki dozlar için, LEVEMIR® Penfill®'in maksimum etkisinin %50'sinden fazlası doz uygulamasından sonra 3-4 saatten yaklaşık 14 saate kadar görülür.
Farmakodinamik cevapta doz orantısallığı (maksimum etki, etki süresi, toplam etki) deri altı uygulama sonrası gözlenmiştir.
Uzun süreli klinik çalışmalarda NPH'a kıyasla LEVEMIR® Penfill® ile tedavi sırasında günden güne daha az değişkenlik gösteren APG (Açlık Plazma Glukozu) gösterilmiştir.
Oral antidiyabetik ilaçlarla birlikte kullanılan bazal insülin ile tedavi edilmiş Tip 2 diyabetli hastalardaki çalışmalar, LEVEMIR Penfill ile glisemik kontrolün (HbA), NPH insülin ve insülin glarjin ile kıyaslanabilir ve daha az kilo artışı ile ilişkili olduğunu göstermiştir, bakınız aşağıdaki Tablo 2. İnsülin glarjin ile karşılaştırılan çalışmada, LEVEMIR® Penfill®'in günde bir veya iki kez uygulanmasına izin verilirken, insülin glarjininin günde bir kez uygulanmasına izin verilmiştir. LEVEMIR® Penfill® tedavisi alan hastaların %55'i, 52 haftalık çalışmayı günde iki kezlik rejim ile tamamlamıştır.
Tablo 2. İnsülin tedavisinden sonra vücut ağırlığında değişiklik
Çalışma süresi | LEVEMIR Penfill günde bir defa | LEVEMIR Penfill günde iki defa | NPH insülin | İnsülin glarjin |
20 hafta | +0,7 kg |
| +1,6 kg |
|
26 hafta |
| +1,2 kg | +2,8 kg |
|
52 hafta | +2,3 kg | +3,7 kg |
| +4,0 kg |
LEVEMIR® Penfill® ile oral antidiyabetik ilaçların kombine tedavisini araştıran çalışmalarda, NPH insülinle karşılaştırıldığında LEVEMIR® Penfill® tedavisi %61-65 daha az minör noktürnal hipoglisemi riskiyle sonuçlanmıştır.
Oral antidiyabetik ilaçlarla hedefe ulaşamayan tip 2 diyabetlilerde, açık etiketli bir randomize çalışma yürütülmüştür. Çalışma liraglutid+metformin kullanılan 12 haftalık bir hazırlık dönemi ile başlamış, hastaların %61'i HbA<%7'ye bu dönemde ulaşmışlardır. Hedefe ulaşamayan %39'luk hasta grubu 52 hafta boyunca tedavilerine ek olarak günde bir LEVEMIR® Penfill® veya liraglutid+metformin alacak şekilde randomize oldular. Tedaviye LEVEMIR Penfill eklenmesi 52 hafta sonunda HbA'de %7,6'dan %7,1'e ek bir azalma sağlamıştır. Hiç major hipoglisemik atak olmamıştır. Majör hipoglisemik atak, hastanın kendisini tedavi edemediği ve glukagon veya i.v glukoz ihtiyacı duyulan atak olarak belirlenmiştir. Bakınız Tablo 3.
Tablo 3. Klinik çalışma verileri â Liraglutid+metformin tedavisine LEVEMIRPenfilleklenmesi
| Çalışma haftası | LEVEMIR Penfill + liraglutid + metformin'e randomize olanlar
n=160 | liraglutid + metformin'e randomize olanlar
n=149 | P-değeri |
Başlangıca göre ortalama HbAdeğişimi (%) | 0-26. hafta | -0,51 | 0,02 | <0,0001 |
0-52. hafta | -0,50 | 0,01 | <0,0001 | |
HbA< %7 hedefine ulaşan hasta sayısı (%) | 0-26. hafta | 43,1 | 16,8 | <0,0001 |
0-52. hafta | 51,9 | 21,5 | <0,0001 | |
Başlangıca göre vücut ağırlığındaki değişim (kg) | 0-26. hafta | -0,16 | -0,95 | 0,0283 |
0-52. hafta | -0,05 | -1,02 | 0,0416 | |
Minör hipoglisemik ataklar (her hasta yılı için) | 0-26. hafta | 0,286 | 0,029 | 0,0037 |
0-52. hafta | 0,228 | 0,034 | 0,0011 |
Tek başına veya metformin ile birlikte, bazal insülin tedavisi ile kontrol altına alınamayan Tip 2 diyabet hastalarında, tedaviye liraglutid (1,8 mg) veya plasebo eklenmesinin etkililik ve güvenliliğinin araştırılması amacıyla 26 haftalık, çift kör randomize bir klinik çalışma yürütülmüştür. Hipoglisemi riskini en aza indirmek amacıyla başlangıçtaki HbA1c değerleri
≤ %8,0 olan hastalarda insülin dozu %20 oranında düşürülmüştür. Daha sonra hastaların, pre- randomizasyon dozundan daha yüksek olmamak şartıyla insülin dozunu titre etmelerine izin verilmiştir. Hastaların (metformin kullananların %97,3'ü) %33'ü (nê147) için bazal insülin ürünü LEVEMIR® Penfill®'dir. Bu hastalarda, liraglutid eklenmesi, plasebo ile karşılaştırıldığında, HbA1c (%6,93'e karşılık %8,24), açlık plazma glukozu (7,20 mmol/1'ye karşılık 8,13 mmol/1) ve vücut ağırlığında daha büyük bir düşüş (-0,43 kg'a karşılık -3,47 kg) ile sonuçlanmıştır. Başlangıç değerleri bu parametreler için her iki grupta da benzerdir. Minör hipoglisemik atakların gözlenme oranı benzerdir ve ciddi hipoglisemik ataklar her iki grupta da gözlenmemiştir.
Bazal/bolus insülin tedavisi alan tip 1 diyabetli hastalardaki uzun dönemli çalışmalarda, LEVEMIR® Penfill® açlık plazma glukozunu, NPH insüline göre daha iyi düzenlemiştir. LEVEMIR Penfill ile glisemik kontrol (HbA) NPH insülin ile kıyaslanabilirdir; ayrıca noktürnal hipoglisemi riski daha düşüktür ve kilo alımı ile ilişkili değildir.
Bazal bolus insülin tedavisi kullanılan klinik çalışmalarda, LEVEMIR® Penfill® ve NPH insülin ile hipoglisemi görülme oranları benzerdir. Tip 1 diyabetli hastalarda yapılan noktürnal hipoglisemi analizleri, NPH insüline göre belirgin olarak daha düşük minör noktürnal hipoglisemi (hastanın kendini tedavi edebildiği ve 2,8 mmol/l'den düşük kapiler kan glukozu ya da 3,1 mmol/l plazma glukozu ile de gösterilen) riski göstermiştir; tip 2 diyabette ise bir fark görülmemiştir.
LEVEMIR® Penfill®'in kullanımı ile antikor gelişimi gözlenmiştir. Ancak bu durum glisemik kontrolü etkiliyor gibi gözükmemektedir.
Gebelik
Prospektif, girişimsel olmayan bir ruhsatlandırma sonrası güvenlik çalışmasında, LEVEMIR® FlexPen®'e (n = 727, 680 canlı doğan bebek) veya diğer bazal insülinlere (n = 730, 668 canlı doğan bebek) maruz kalan tip 1 veya tip 2 diyabetli gebe kadınlar gebelik sonuçları açısından izlendi.
Malformasyon sonlanım noktasının bileşenleri açısından LEVEMIR® FlexPen® ile diğer bazal insülinler arasında istatistiksel olarak anlamlı bir fark gözlenmemiştir (majör konjenital malformasyonlar, majör konjenital malformasyonlar veya minör konjenital malformasyonlar nedeniyle indüklenen düşük). Çalışmadan elde edilen sonuçlar, LEVEMIR® FlexPen®'in diğer bazal insülinlerle karşılaştırıldığında önceden diyabeti olan kadınlarda olumsuz gebelik sonuçları için aşırı risk ile ilişkili olmadığını gösterdi.
LEVEMIR® Penfill®, açık-etiketli, randomize kontrollü bir klinik çalışmada çalışılmış, tip 1 diyabetli gebe kadınlarda (n=310) bazal-bolus tedavi rejimi ile bazal insülin olarak LEVEMIR® Penfill® (n=152) veya NPH insülini (n=158), NovoRapid® ile kombine kullanmışlardır.
Gebeliğin 36. haftasında ölçülen HbAdeğerlerine göre LEVEMIR Penfill, NPH insülinden daha etkisiz değildir ve gebelik boyunca ortalama HbAdüşüşü benzerdir.
Pediyatrik popülasyon
LEVEMIR® Penfill®'in etkililik ve güvenliliği adolesan ve çocuklarda yapılan üç randomize kontrollü klinik çalışmada 12 aya kadar izlenmiştir (toplamda n=1045); bu çalışmalar 1-5 yaş arası toplam 167 çocuk içermekteydi. Bütün çalışmalarda bazal-bolus tedavi olarak verildiğinde LEVEMIR Penfill ile sağlanan glisemik kontrolün (HbA), %0,4 eş-değerlik sınırı kullanıldığında, NPH insülin ve insülin degludec ile karşılaştırılabilir olduğu gösterilmiştir. LEVEMIR® Penfill® ile insülin degludec âin karşılaştırıldığı klinik çalışmada, ketozun eşlik ettiği hiperglisemik atakların oranı LEVEMIR® Penfill® için belirgin olarak daha yüksek bulunmuştur. Ataklar, hasta başına â maruz kalma yılı olarak sırasıyla 1,09 ve 0,68 şeklindedir. NPH insüline oranla LEVEMIR® Penfill® kullananlarda daha az kilo alımı (SS skoru, kilo cinsiyet ve yaş için düzeltilmiştir) gözlenmiştir.
LEVEMIR® Penfill® ile uzun dönemli tedavi sonra antikor oluşumunu değerlendirmek amacıyla, 2 yaş üstündeki çocukları içeren çalışma ek olarak 12 ay daha (toplam 24 aylık tedavi verisi) uzatılmıştır. İnsülin antikorlarında ilk yıldaki artış sonrası, ikinci yılda insülin antikorları çalışma öncesi seviyelerin hafifçe üstünde olacak şekilde azalmıştır. Sonuçlar antikor gelişiminin glisemik kontrol ve LEVEMIR® Penfill® dozu üzerinde negatif etkisinin olmadığını göstermektedir.
Tip 2 diyabetli adolesan hastalar için etkililik ve güvenlilik verileri, çocuklar, adolesanlar, tip 1 diyabetli yetişkin hastalar ve tip 2 diyabetli yetişkin hastalar için elde edilen verilerden tahmin edilmektedir. Sonuçlar LEVEMIR® Penfill®'in tip 2 diyabetli adolesan hastalarda kullanılmasını desteklemektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Maksimum serum konsantrasyonuna uygulama sonrası 6 ila 8 saatte ulaşılır. Günde iki defa uygulandığında, kararlı serum konsantrasyonlarına 2-3 doz uygulamasından sonra ulaşılır. LEVEMIR® Penfill® emiliminde bireyin kendi içindeki değişkenliği diğer bazal insülin preparatlarından daha azdır. Deri altına uygulandığında insülin detemirin mutlak biyoyararlanımı yaklaşık olarak %60'tır.
Dağılım:
LEVEMIR® Penfill®'in dağılım hacmi (yaklaşık 0,1 l/kg) yüksek fraksiyonlarda insülin detemirin kanda dolaştığını gösterir.
İn vitro ve in vivo protein bağlama çalışma sonuçları insülin detemir ile yağ asitleri veya diğer protein bağlayan ilaçlar arasında klinik olarak belirgin bir etkileşim olmadığını göstermektedir.
Biyotransformasyon:
İnsülin detemirin bozunması insan insülinine benzer; oluşan tüm metabolitleri inaktiftir.
Eliminasyon:
Deri altı uygulama sonrası terminal yarılanma ömrü, deri altı dokudan absorpsiyon hızı ile belirlenir. Terminal yarılanma ömrü doza bağlı olarak 5 ila 7 saat arasındadır.
Doğrusallık:
Terapötik doz aralığında deri altı uygulama sonrasında, serum konsantrasyonlarında (maksimum konsantrasyon, emilim miktarı) doz orantısallığı gözlenmiştir.
Farmakokinetik/Farmakodinamik ilişkiler:
Tip 2 diyabetli hastalara kararlı durumda tek doz LEVEMIR® Penfill® 0,5 ünite/kg ile 1,8 mg liraglutid uygulandığında, liraglutid ve LEVEMIR® Penfill® arasında farmakokinetik veya farmakodinamik etkileşimler gözlenmemiştir.
Hastalardaki karakteristik özellikler
Yaşlılar (≥65 yaş):
Yaşlı ve genç hastalar arasında LEVEMIR® Penfill®'in farmakokinetik özelliklerinde klinik olarak belirgin bir farklılık bulunmamıştır.
Böbrek ve karaciğer yetmezliği:
Böbrek veya karaciğer yetmezliği olan hastalar ile sağlıklı bireyler arasında LEVEMIR® Penfill® 'in farmakokinetik özelliklerinde klinik olarak belirgin bir farklılık bulunmamıştır. Bu popülasyonlarda, LEVEMIR® Penfill®'in farmakokinetiği kapsamlı olarak çalışılmadığından, plazma glukozunun yakın takibi önerilmektedir.
Cinsiyet:
Cinsiyetler arasında LEVEMIR® Penfill®'in farmakokinetik özelliklerinde klinik olarak belirgin bir farklılık bulunmamıştır.
Pediyatrik popülasyon:
LEVEMIR® Penfill®'in farmakokinetik özellikleri küçük çocuklarda (1-5 yaş), çocuklarda (6-12 yaş) ve adolesanlarda (13-17 yaş) araştırılmıştır ve tip 1 diyabetik erişkinler ile karşılaştırılmıştır. Küçük çocuklar, çocuklar, adolesanlar ve yetişkinler arasında farmakokinetik özelliklerde klinik olarak belirgin bir farklılık bulunmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi, tekrarlayan doz toksisitesi, genotoksisite ve üreme ve gelişme toksisitesi üzerine yapılan konvansiyonel çalışmalardan elde edilen klinik olmayan veriler insanlar için özel bir tehlike göstermemiştir. Reseptör afinitesi verileri ve in vitro mitojenisite testleri, insan insülini ile karşılaştırıldığında artmış bir mitojenik potansiyele dair herhangi bir kanıt göstermemiştir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
İLAÇ GENEL BİLGİLERİ
Novo Nordisk Sağlık Ürünleri Tic. Ltd. Şti.
| Geri Ödeme Kodu | A04597 |
| Satış Fiyatı | 808.04 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 808.04 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699676950782 |
| Etkin Madde | Insulin Detemir |
| ATC Kodu | A10AE05 |
| Birim Miktar | 100 |
| Birim Cinsi | U |
| Ambalaj Miktarı | 5X3 |
| Sindirim Sistemi ve Metabolizma > İnsülinler ve Analogları > İnsülin Detemir |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |