LORVIQUA 100 mg film kaplı tablet (30 tablet) Farmakolojik Özellikler
{ Lorlatinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik İlaçlar, Protein kinaz inhibitörleri, anaplastik lenfoma kinaz (ALK) inhibitörleri.
ATC kodu: L01ED05
Etki mekanizması
Lorlatinib ALK ve c-ros onkogen (ROS1) tirozin kinazların adenozin trifosfat (ATP) ile yarışan seçici inhibitörüdür.
Preklinik çalışmalarda rekombinant enzim ve hücre temelli deneylerde lorlatinib mutasyona uğramamış ALK ve klinik olarak ilgili mutant ALK kinazların katalitik etkinliğini inhibe etmiştir. Lorlatinib L1196M, G1269A, G1202R ve I1171T ALK mutasyonları dahil ALK varyantı 1 (v1) ile füzyon yapan ekinoderm mikrotübül ile ilişkili protein benzeri 4 (EML4) eksprese eden tümör ksenografları taşıyan farede tümöre karşı belirgin etkinlik göstermiştir. Bu ALK mutantlarından ikisinin (G1202R ve I1171T) alektinibe, brigatinibe, seritinibe ve krizotinibe karşı direnç sağladığı bilinmektedir. Lorlatinib kan-beyin bariyerini geçmiştir. Lorlatinib ortotopik EML4-ALK ya da EML4-ALK beyin tümör implantlarında taşıyan farede etkinlik göstermiştir.
Klinik etkililik
Daha Önce Tedavi Almamış ALK-Pozitif İlerlemiş KHDAK (CROWN Çalışması)
Daha önce metastatik hastalığa yönelik olarak sistemik tedavi almamış ALK-pozitif KHDAK hastalarının tedavisinde lorlatinibin etkililiği açık-etiketli, randomize, aktif-kontrollü, çok- merkezli B7461006 çalışmasında (CROWN çalışması) gösterilmiştir. Bu çalışmada hastaların Doğu Kooperatif Onkoloji Grubu (ECOG) performans statüsünün 0-2 olması, VENTANA ALK (D5F3) CDx testi ile belirlendiği üzere ALK-pozitif KHDAK olması gerekmekteydi. Leptomeningeal metastazlar dahil tedavi edilmiş ya da edilmemiş MSS metastazları bulunan nörolojik açıdan stabil hastaların çalışmaya katılması uygundu. Hastaların randomizasyondan önceki 2 hafta içinde stereotaktik veya kısmi beyin ışınlaması dahil ışın tedavisini; randomizasyondan önceki 4 hafta içinde ise tam beyin ışınlaması tedavisini bitirmiş olmaları gerekmekteydi.
Hastalar günde bir kez oral yoldan 100 mg lorlatinib veya günde iki kez oral yoldan 250 mg krizotinib alacak şekilde 1:1 oranında randomize edilmiştir. Randomizasyon etnik kökene (Asyalı veya Asyalı-olmayan) ve başlangıçta MSS metastazları varlığı ya da yokluğuna göre katmanlandırılmıştır. Her iki tedavi grubunda tedaviye hastalıkta progresyon veya kabul edilmeyen toksisite görülünceye devam edilmiştir. En önemli etkililik sonuç ölçütü Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) versiyon 1.1'e (v1.1) göre Körlenmiş Bağımsız Merkezi İnceleme (BICR) tarafından belirlendiği üzere progresyonsuz sağkalımdı (PFS). Ek etkililik sonuç ölçütleri, genel sağkalım (OS), araştırmacı değerlendirmesine göre PFS, PFS2 ve genel yanıt oranı (ORR), yanıt süresi (DOR) ve intrakraniyal progresyona kadar geçen süre (IC TTP) dahil olmak üzere BICR tarafından belirlenen tümör değerlendirmesiyle ilgili verilerdir. Başlangıçta MSS metastazları olan hastalarda ek sonuç ölçütleri, BICR tarafından belirlenen intrakraniyal genel yanıt oranı (IC-ORR) ve intrakraniyal yanıt süresi (IC- DOR) idi.
Toplam 296 hasta lorlatinib (n=149) veya krizotinib (n=147) alacak şekilde randomize edilmiştir. Genel çalışma popülasyonunun demografik özellikleri şu şekildeydi: medyan yaş 59 (aralık: 26 ila 90 yaş arası), ≥65 yaş (%35), %59 kadın, %49 beyaz, %44 Asyalı ve %0,3 siyah. Hastaların büyük bir çoğunluğunda adenokarsinom vardı (%95) ve hiç sigara içmemişlerdi (%59). BICR nöroradyologlarının belirlediği MSS metastazları hastaların %26'sında (n=78) görüldü: bunlardan 30 hastada ölçülebilir MSS lezyonları vardı.
CROWN çalışmasından elde edilen sonuçlar Tablo 3'te özetlenmektedir. Veri kesim
noktasında OS ve PFS2 verileri olgunlaşmış durumda değildi.
Tablo 3 CROWN Çalışmasında Etkililik Sonuçları
Etkililik Parametresi | Lorlatinib N=149 | Krizotinib N=147 |
Medyan takip süresi, ay (%95 GA) | 18 (16 - 20) | 15 (13 - 18) |
BICR'ye göre progresyonsuz sağkalım | ||
Olay görülen hasta sayısı, n (%) | 41 (%28) | 86 (%59) |
Progresif hastalık, n (%) | 32 (%22) | 82 (%56) |
Ölüm, n (%) | 9 (%6) | 4 (%3) |
Medyan, ay (%95 GA) | NE (NE, NE) | 9 (8 - 11) |
Tehlike oranı (%95 GA) | 0,28 (0,19 - 0,41) | |
p-değeri | <0,0001 | |
Genel sağkalım |
| |
Olay görülen hasta sayısı, n (%) | 23 (%15) | 28 (%19) |
Medyan, ay (%95 GA) | NE (NE, NE) | NE (NE, NE) |
Tehlike oranı (%95 GA) | 0,72 (0,41 - 1,25) | |
INV'ye göre progresyonsuz sağkalım | ||
Olay görülen hasta sayısı, n (%) | 40 (%27) | 104 (%71) |
Progresif hastalık, n (%) | 34 (%23) | 99 (%67) |
Ölüm, n (%) | 6 (%4) | 5 (%3) |
Medyan, ay (%95 GA) | NE (NE, NE) | 9 (7 - 11) |
Tehlike oranı (%95 GA) | 0,21 (0,14 - 0,31) | |
p-değeri | < 0,0001 | |
BICR'ye göre genel yanıt | ||
Genel yanıt oranı, n (%) | 113 (%76) | 85 (%58) |
(%95 GA) | 68 â 83 | 49 - 66 |
İntrakraniyal progresyona kadar geçen zaman | ||
Medyan, ay (%95 GA) | NE (NE, NE) | 16,6 (11 - NE) |
Tehlike oranı (%95 GA) | 0,07 (0,03 - 0,17) | |
Yanıt süresi | ||
Yanıt verenlerin sayısı | 113 | 85 |
Medyan, ay (%95 GA) | NE (NE, NE) | 11 (9 - 13) |
Başlangıçta ölçülebilir MSS lezyonları olan hastalarda intrakraniyal genel yanıt | N=17 | N=13 |
İntrakraniyal yanıt oranı, n (%) | 14 (%82) | 3 (%23) |
(%95 GA)c | (57 - 96) | (5 - 54) |
Tam yanıt oranı | %71 | %8 |
Yanıt süresi |
|
|
Yanıt verenlerin sayısı | 14 | 3 |
Medyan, ay (%95 GA) | NE (NE - NE) | 10 (9 - 11) |
Başlangıçta ölçülebilir veya ölçülemeyen MSS lezyonları olan hastalarda intrakraniyal genel yanıt |
N=38 |
N=40 |
İntrakraniyal yanıt oranı, n (%) | 25 (%66) | 8 (%20) |
(%95 GA) | (49 - 80) | (9 - 36) |
Tam yanıt oranı | %61 | %15 |
Yanıt süresi |
|
|
Yanıt verenlerin sayısı | 25 | 8 |
Medyan, ay (%95 GA) | NE (NE - NE) | 9 (6 - 11) |
Kısaltmalar: BICR=Kör Bağımsız Merkez İncelemesi; GA=güven aralığı; MSS=merkezi sinir sistemi; INV= araştırmacı değerlendirmesi; N=hasta sayısı; NE=tahmin edilemeyen.
Şekil 1: CROWN Çalışması'nda BICR'ye Göre Progresyonsuz Sağkalıma Ait Kaplan- Meier Grafiği
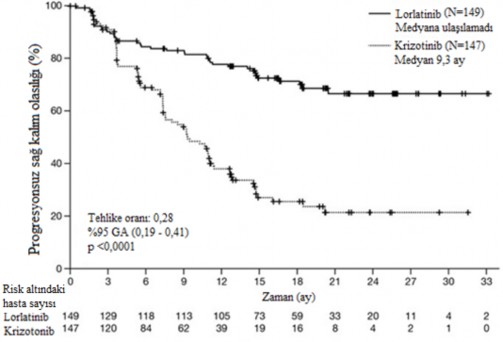
Kısaltmalar: GA=güven aralığı; N=hasta sayısı.
Lorlatinib tedavisinden sağlanan fayda, başlangıçta MSS metastazı olan (n=38, HR=0,2, %95 GA: 0,1-0,43) ve MSS metastazı olmayan hastalar (n=111, HR=0,32, %95 GA: 0,2-0,49) dahil olmak üzere, başlangıçtaki hasta ve hastalık özelliklerinin alt grupları arasında karşılaştırılabilir olmuştur.
Daha önce bir ALK kinaz inhibitörü ile tedavi edilmiş ALK-Pozitif İlerlemiş KHDAK
ALK- pozitif ileri evre KHDAK'nin tedavisinde en az bir ikinci nesil ALK TKİ ile tedaviden sonra lorlatinib kullanımı tek kollu, çok merkezli faz 1/2 çalışma olan Çalışma A'da araştırılmıştır. Toplam 139 ALK pozitif ileri evre KHDAK hastası en az bir ikinci nesil ALK TKİ ile tedaviden sonra çalışmanın Faz 2 bölümüne kaydedilmiştir. Hastalar kesintisiz olarak oral yolla günde bir kez 100 mg dozunda lorlatinib kullanmıştır.
Çalışmanın Faz 2 kısmında birincil etkililik sonlanım noktası Bağımsız Merkezi İnceleme (ICR) ile solid tümörlerde modifiye RECIST v 1.1'e göre değerlendirilen intrakranyal (İK)- ORR dahil objektif yanıt oranıdır. İkincil sonlanım noktaları kapsamında DOR, İK-DOR, tümör yanıtına kadar geçen süre (TTR) ve PFS vardır.
En az bir ikinci nesil ALK TKİ ile tedavi almış olan 139 ALK-pozitif ileri evre KHDAK hastasının demografik özellikleri aşağıda yer almaktadır: %56 kadın, %48 beyaz, %38 Asyalı, medyan yaş 53 yaş (aralık 29-83 yaş) olup hastaların %16'sı 65 yaş ve üstüdür. ECOG performans durumu başlangıçta hastaların %96'sında 0 ya da 1 bulunmuştur. Hastaların
%67'sinde başlangıçta beyin metastazları vardır. 139 hastanın %20'si daha önce krizotinib dışında bir ALK TKİ kullanmışken %47'si daha önce 2 ALK TKİ, %33'ü ise 3 ya da daha fazla ALK TKİ almıştır.
A Çalışmasının başlıca etkililik sonuçları Tablo 4 ve 5'te yer almaktadır.
Tablo 4. A Çalışmasında önceki tedaviye göre genel etkililik sonuçları
Etkililik parametresi | Daha önce kemoterapi ile ya da tek başına bir ALK TKİáµ (N=28) | Daha önce kemoterapi ile ya da tek başına iki ya da daha fazla ALK TKİ (N=111) |
Objektif yanıt oranıáµ (%95 GA) Tam yanıt, n Kısmi yanıt, n | %42,9 (24,5 - 62,8) 1 11 | %39,6 (30,5 - 49,4) 2 42 |
Yanıtın süresi Medyan, ay (%95 GA) |
5,6 (4,2 - NR) |
9,9 (5,7 - 24,4) |
Progresyonsuz sağkalım Medyan, ay (%95 GA) |
5,5 (2,9 - 8,2) |
6,9 5,4 - 9,5 |
Kısaltmalar: ALK= anaplastik lenfoma kinaz; GA=güven aralığı; ICR=Bağımsız Merkezi İnceleme; N/n=hasta sayısı; NR= erişilmedi; TKI= tirozin kinaz inhibitör.
áµ Alektinib, brigatinib ya da seritinib. áµ ICR'ye göre
Tablo 5. A Çalışmasında önceki tedaviye göre intrakranyal* etkililik sonuçları
Etkililik parametresi | Daha önce kemoterapi ile ya da tek başına bir ALK TKİáµ (N=9) | Daha önce kemoterapi ile ya da tek başına iki ya da daha fazla ALK TKİ (N=48) |
Objektif yanıt oranıáµ (%95 GA) Tam yanıt, n Kısmi yanıt, n | %66,7 (29,9 - 92,5) 2 4 | %52,1 (37,2 â 66,7) 10 15 |
İntrakranyal yanıtın süresi Medyan, ay (%95 GA) |
NR (4,1 - NR) |
12,4 (6- NR) |
Kısaltmalar: ALK= anaplastik lenfoma kinaz; GA=güven aralığı; ICR=Bağımsız Merkezi İnceleme; N/n=hasta sayısı; NR= erişilmedi; TKI= tirozin kinaz inhibitör.
*Başlangıçta en az bir ölçülebilir beyin metastazı olan hastalarda. áµ Alektinib, brigatinib ya da seritinib.
áµ ICR'ye göre
139 hastadan oluşan genel etkililik popülasyonunda ICR'ye göre 56 hastada doğrulanmış objektif yanıt alınmış, medyan TTR 1,4 ay (aralık: 1,2 - 16,6 ay) olmuştur. ORR Asyalı popülasyonda %49,1 (%95 GA: 35,1 - 63,2) ve Asyalı olmayan popülasyonda %31,5 (%95 GA: 21,1 - 43,4) olmuştur. Doğrulanmış objektif İK tümör yanıtı olan ve ICR'ye göre başlangıçta en az bir ölçülebilir beyin metastazı olan 31 hastada medyan İK-TTR 1,4 ay (aralık= 1,2 - 16,2 ay) olmuştur. İK-ORR Asyalı popülasyonda %54,5 (%95 GA: 32,2 - 75,6) ve Asyalı olmayan popülasyonda %46,4 (%95 GA: 27,5 - 66,1) olmuştur.
5.2. Farmakokinetik özellikler
Emilim
Lorlatinibin pik plazma konsantrasyonlarına hızla erişilmekte olup 100 miligramlık tek dozu takiben medyan T1,2 saat ve günde bir kez 100 g dozunda birden fazla kez verildiğinde ise 2 saat bulunmuştur.
İntravenöz uygulama ile karşılaştırıldığında lorlatinib tabletlerin oral yolla verilmesinden sonra ortalama mutlak biyo-yararlılığı %80,8 (%90 GA: 75,7- 86,2) olmuştur.
Lorlatinibin yüksek yağ ve yüksek kalori içeren bir yemekle birlikte verilmesi aç karnına verilmesine göre kan seviyelerini %5 arttırmıştır.
Lorlatinib tok ya da aç karnına verilebilir.
Kanser hastalarında günde bir kez 100 mg dozda uygulandığında; geometrik ortalama (% varyasyon katsayısı [CV]) pik plazma konsantrasyonu 577 (42) ng/ml ve EAA5,650 (39) ngÎsaat/ml bulunmuştur. Geometrik ortalama (% CV) oral klirens 17,7 (39) l/saat bulunmuştur.
Dağılım
Lorlatinib insan plazma proteinlerine in vitro %66 oranında bağlanmakta olup albümine ya da
α-asit glikoproteine orta derecede bağlanmaktadır.
Biyotransformasyon
İnsanlarda lorlatinib birincil metabolik yolaklar olarak oksidasyona ve glukuronidasyona uğramaktadır. İn vitro veriler lorlatinibin birincil olarak CYP3A4 ve UGT1A4 tarafından metabolize edildiğini ve CYP2C8, CYP2C19, CYP3A5 ve UGT1A3'ün minör katkıda bulunduğunu göstermektedir.
Plazmada lorlatinibin amid ve aromatik bağlarının oksidatif ayrışmasından kaynaklanan bir
benzoik asit metaboliti majör metabolit olarak belirlenmiş olup dolaşımdaki radyoaktivitenin
%21'inden sorumludur. Oksidatif ayrışma ile oluşan metabolit farmakolojik olarak inaktiftir.
Eliminasyon
Tek bir 100 miligramlık dozdan sonra lorlatinibin plazma yarı ömrü 23,6 saattir. Otoindüksiyonun tamamlanmasını takiben kararlı durumdaki tahmini lorlatinib efektif plazma yarı ömrü 14,83 saattir. 100 miligramlık radyoaktif etiketli lorlatinib dozun oral yolla verilmesini takiben radyoaktivitenin ortalama %47,7'si idrardan, %40,9'u feçesten ve genelde ortalama %88,6'sı geri kazanılmıştır.
Değişmemiş lorlatinib insan plazmasında ve feçeste belirlenen majör bileşendir ve toplam radyoaktivitenin sırasıyla %44'ü ve %9,1'ini oluşturmaktadır. Lorlatinibin %1'inden azı idrarda değişmemiş olarak saptanmıştır.
Ayrıca lorlatinib insan pregnan-X-reseptörü (PXR) ve insan yapısal androstan reseptörü (CAR) aracılığıyla bir indükleyicidir.
Doğrusallık/Doğrusal Olmayan durum
Tek dozda maruz kalınan lorlatinib seviyesi (EAAve C) 10 mg ile 200 mg doz aralığında doza bağlı olarak artmıştır. 10 mg ile 200 mg doz aralığı dışında az miktarda veri mevcuttur; bununla birlikte tek dozdan sonra EAAve Ciçin doğrusallıktan sapma olmamıştır.
Günde bir kez doz birden fazla kez verildiğinde lorlatinib Cdozla orantılı olarak artmıştır ve EAAgünde 10 mg ile 200 mg doz aralığı dışında dozlarda hafifçe daha az orantılı olarak artmıştır.
Aynı şekilde kararlı durumda maruz kalınan plazma lorlatinib seviyeleri tek doz farmakokinetiği için beklenenden daha düşüktür ve bu da net zamana bağlı oto-indüksiyon etkisini göstermektedir.
Hastalardaki Karakteristik Özellikler
Karaciğer yetmezliği
Lorlatinibin karaciğerde metabolize edilmesi nedeniyle karaciğer yetmezliği lorlatinibin plazma konsantrasyonlarını yükseltme olasılığını arttırmaktadır. Yapılan klinik çalışmalar AST ya da ALT seviyelerinin normalin üst seviyesinin 2,5 katından fazla olduğu ya da artış altta yatan kansere bağlıysa normalin üst seviyesinin 5 katından fazla olduğu ya da total bilirübin seviyesinin normalin üst seviyesinin 1,5 katından fazla olduğu hastaları dışlamıştır. Popülasyon farmakokinetik analizleri maruz kalınan lorlatinib maruziyetinin hafif karaciğer yetmezliği olan hastalarda klinik olarak anlamlı ölçüde değişmediğini göstermiştir (n = 50). Hafif karaciğer yetmezliği olan hastalar için doz ayarlamaları önerilmemektedir. Orta ya da ağır karaciğer yetmezliği olan hastalar hakkında bilgi yoktur.
Böbrek yetmezliği
Verilen dozun %1'inden azı idrarda değişmemiş lorlatinib olarak saptanmaktadır. Popülasyon farmakokinetik lorlatinib kararlı durum plazma maruziyet seviyesinin ve Cdeğerinin kötüleşen bazal böbrek fonksiyonu ile hafif arttığını göstermiştir. Bir böbrek yetmezliği çalışmasına dayanarak, hafif veya orta şiddetteki böbrek yetmezliği olan hastalar için başlangıç dozunda ayarlama yapılması önerilmemektedir [Böbrek Hastalığı Çalışmasında Diyet Modifikasyonu'na (MDRD) göre türetilen eGFR; eGFR (mL/dak/1,73 m) Ã ölçülen vücut yüzey alanı/1,73 ≥ 30 mL/dk]. Bu çalışmada, lorlatinib EAA, ağır böbrek yetmezliği olan hastalarda (mutlak eGFR < 30 mL/dk), böbrek fonksiyonu normal olan gönüllülere (mutlak eGFR ≥ 90 mL/dak) kıyasla %41 artmıştır. Ağır böbrek yetmezliği olan hastalarda lorlatinib dozunun azaltılması önerilir, örneğin günde bir kez 75 mg oral başlangıç dozu (bkz. Bölüm 4.2). Renal diyaliz hastaları için bilgi mevcut değildir.
Yaş, cinsiyet, ırk, vücut ağırlığı ve fenotip
İleri evre KHDAK olan ve sağlıklı gönüllülerde yapılan popülasyon farmakokinetik analizleri CYP3A5 ve CYP2C19 için yaşın, cinsiyetin, ırkın, vücut ağırlığının ve fenotipin klinik olarak anlamlı etkileri olmadığını göstermiştir.
Kardiyak elektrofizyoloji
A Çalışmasında 2 hastanın (%0,7) mutlak Fridericia düzeltme QTc (QTcF) değerleri> 500 milisaniye olmuş ve 5 hastada (%1,8) QTcF değişikliği başlangıca göre> 60 milisaniye olmuştur.
Ayrıca, tek bir oral doz lorlatinibin (50 mg, 75 mg ve 100 mg) günde bir kez 200 mg itrakonazol ile ve tek başına etkisi 16 sağlıklı gönüllüde 2 yönlü çapraz bir çalışmada değerlendirilmiştir. Bu çalışmada gözlenen ortalama lorlatinib konsantrasyonlarında ortalama QTc değerlerinde artış gözlenmemiştir.
A Çalışmasında önerilen 100 miligramlık dozda lorlatinib alan ve bir EKG incelemesi bulunan 295 hastadan QTc aralığının> 470 milisaniye olan hastaların dışlandığı bir popülasyonda lorlatinib değerlendirilmiştir. Çalışma popülasyonunda PR aralığında başlangıca göre maksimum ortalama değişiklik 16,4 milisaniye (2 yönlü %90 üst GA 19,4 milisaniye) (Bkz.
Bölümler 4.2, 4.4 ve 4.8) olmuştur. Bu hastalardan yedisinde başlangıç PR> 200 milisaniyedir. PR aralığının <200 milisaniye olduğu 284 hastanın %14'ünde lorlatinib başlandıktan sonra PR aralığında uzama ≥ 200 milisaniye olmuştur. PR aralığındaki uzama konsantrasyona bağımlı bir şekilde oluşmuştur. Hastaların %1'inde atriyoventriküler blok oluşmuştur.
PR uzaması gelişen hastalarda doz değişikliği gerekebilir (Bkz Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Tekrarlayan doz toksisitesi
Önerilen pozolojide insanda maruz kalınan klinik seviyelere eşdeğer dozda gözlenen başlıca toksisiteler çeşitli dokularda inflamasyon (sıçanlarda deri ve servikste, köpeklerde akciğerde, trakea, deride, lenf bezlerinde ve/veya mandibuler kemik dahil ağız boşluğunda; beraberinde beyaz kan hücreleri, fibrinojen ve/veya globülin seviyesinde artış ve albümin seviyesinde azalmalar) ve pankreas (beraberinde amilaz ve lipaz seviyelerinde artış), hepatobiliyer sistem (beraberinde karaciğer enzimlerinde artışlar), erkek üreme sistemi, kardiyovasküler sistem, böbrekler ve gastrointestinal sistem, periferik sinirler ve MSS (bilişsel fonksiyonda bozulma) değişiklikleri olmuştur. Hayvanlarda akut dozlama sonrası (Cdeğerine göre tek doz 100 mg ile insanda klinik olarak maruz kalınan seviyenin yaklaşık 2,6 katı) kan basıncında ve kalp atım hızında ve QRS kompleksinde ve PR aralığında değişiklikler de gözlenmiştir. Karaciğer safra kanalı hiperplazisi dışında tüm hedef organ bulguları tamamıyla geri dönüşlüdür.
Genotoksisite
Lorlatinib in vitro ve in vivo olarak mutajenik değildir ancak anöjenik olup EAA'ya göre 100 mg ile insan klinik olarak maruz kalınan seviyenin yaklaşık 16,5 katı ile anöjenisite üzerinde herhangi bir seviyede etki gözlenmemiştir.
Karsinojenisite
Lorlatinib ile Karsinojenisite çalışmaları yapılmamıştır. Üreme toksisitesi
Sıçanda ve köpekte seminifer tübüler dejenerasyon ve/veya testis atrofisi ve epididim değişiklikleri (inflamasyon ve/veya vaküolleşme) gözlenmiştir. Önerilen pozolojide insanda maruz kalınan seviyelere eşdeğer dozda köpeklerde prostatta minimal-hafif glandüler atrofi gözlenmiştir. Erkek üreme organlarında etkiler kısmen ya da tamamen geri dönüşlüdür.
Sıçanlarda ve tavşanlarda yapılan embriyofetal toksisite çalışmalarında embriyo ölümü ve düşük fetüs ağırlığı ve malformasyonlar gözlenmiştir. Fetüsteki morfolojik anormallikler arasında kol ve bacaklarda rotasyon, parmak sayısında artış, gastroşizis, böbrek malformasyonu, kubbe kafa, yüksek damak ve beyin ventriküllerinde genişleme vardır. EAA'ya göre hayvanlarda embriyofetal etkilerin geliştiği en düşük dozlarla maruz kalınan seviye 100 mg dozu ile insanda klinik olarak maruz kalınan seviyeye eşdeğerdir.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir.
Şizofrenlik
Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu
sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler
hakkında bilgi verecektir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 99999.58 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 99999.58 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308092045 |
| Etkin Madde | Lorlatinib |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |