LORVIQUA 25 mg film kaplı tablet (30 tablet) Kısa Ürün Bilgisi
{ Lorlatinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
LORVİQUA 25 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Lorlatinib 25 mg
Yardımcı maddeler
Laktoz monohidrat (sığır kaynaklı) 1,58 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film Kaplı Tablet.
Bir yüzünde âPfizerâ, diğer yüzünde â25â ve âLLNâ baskılı yuvarlak sarımsı kahverengi hızlı salımlı film kaplı tablet
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
LORVİQUA, monoterapi olarak daha önce bir ALK (anaplastik lenfoma kinaz) inhibitörü ile tedavi edilmemiş veya bir veya daha fazla ALK tirozin kinaz inhibitörü (TKI) ile tedavi edilmiş ALK pozitif, metastatik küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkinlerin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
PozolojiLorlatinib tedavisi, antikanser tıbbi ürünlerin kullanımında deneyimli bir doktor tarafından başlatılmalı ve gözetim altında tutulmalıdır.
Yarar sağladığı gösterilen tek hasta grubu olduğundan, ALK pozitif KHDAK'nin saptanması lorlatinib tedavisinde hasta seçimi için gereklidir. ALK pozitif KHDAK değerlendirmesi, yeterliliği kanıtlanmış laboratuvarlar tarafından belirli teknoloji kullanılarak yapılmalıdır. Uygun olmayan test performansı, güvenilir olmayan test sonuçlarına yol açabilir.
Önerilen doz oral yoldan günde bir defa 100 mg'dir.
Uygulama sıklığı ve süresi:
Hastalık ilerleyene veya kabul edilemez toksisite meydana gelene kadar lorlatinib ile tedaviye
devam edilmelidir.
Geciken ya da unutulan dozlar
Bir dozun unutulması halinde bir sonraki doza 4 saatten az bir zaman kalmadığı sürece unutulan doz hatırlanır hatırlanmaz alınmalıdır. Bir sonraki doza 4 saatten daha az süre kalmışsa unutulan tablet atlanmalıdır. Unutulan dozu tamamlamak için 2 doz aynı anda alınmamalıdır.
Dozaj Modifikasyonları
Bireysel güvenlilik ve toleransa bağlı olarak dozun azaltılması veya kesilmesi gerekebilir.
Lorlatinib doz azaltma seviyeleri aşağıda özetlenmiştir:
İlk doz azaltma: Oral yoldan günde bir defa LORVİQUA 75 mg
İkinci doz azaltma: Oral yoldan günde bir defa LORVİQUA 50 mg
Oral yoldan günde bir defa 50 mg'lik dozu tolere edemeyen hastalarda LORVİQUA'nın kullanımına kalıcı olarak son verilmelidir.
Toksisiteler ve atriyoventriküler (AV) blok gelişen hastalar için önerilen dozaj değişiklikleri Tablo 1'de verilmiştir.
Tablo 1. Advers Reaksiyonlar için Önerilen LORVİQUA Dozaj Modifikasyonları
Advers Reaksiyon | Lorlatinib dozajı |
Hiperkolesterolemi veya hipertrigliseridemi | |
Hafif hiperkolesterolemi (kolesterol ULN ile 300 mg/dL veya ULN ile 7.75 mmol/L arasında)
VEYA
Orta derecede hiperkolesterolemi (kolesterol 301 ile 400 mg/dL veya 7,76 ile 10,34 mmol/L arasında) VEYA Hafif hipertrigliseridemi (trigliserit 150 ve 300 mg/dL veya 1,71 ve 3,42 mmol/L arasında) VEYA Orta derecede hipertrigliseridemi (trigliserit 301 ile 500 mg/dL veya 3,43 ile 5,7 mmol/L arasında) | İlgili reçeteleme bilgilerine göre lipid düşürücü tedaviye başlayın veya lipid düşürücü tedaviyi modifiye edin / ayarlayın; lorlatinibe aynı dozda devam edin. |
Şiddetli hiperkolesterolemi (kolesterol 401 ile 500 mg/dL veya 10,35 ile 12,92 mmol/L arasında) VEYA Şiddetli hipertrigliseridemi | Lipid düşürücü tedaviye başlayın. Halihazırda lipid düşürücü tedavi uygulanıyorsa, ilgili reçete bilgilerine göre bu tedavinin dozunu arttırın veya yeni bir lipid düşürücü tedaviye geçin. Ara vermeden lorlatinibe aynı dozda devam edin. |
(trigliserit 501 and 1,000 mg/dL or 5,71 ve 11,4 mmol/L arasında) |
|
Hayatı tehdit eden hiperkolesterolemi (kolesterol 500 mg/dL'nin veya 12,92 mmol/L'nin üzerinde)
VEYA
Hayatı tehdit eden hipertrigliseridemi (trigliserit 1,000 mg/dL'nin veya 11,4 mmol/L'nin üzerinde) | İlgili reçeteleme bilgilerine göre lipid düşürücü tedaviye başlayın veya bu tedavinin dozunu arttırın ya da yeni bir lipid düşürücü tedaviye geçiş yapın. Hiperkolesterolemi ve/veya hipertrigliseridemi orta veya hafif dereceye iyileşene kadar lorlatinibe ara verin.
İlgili reçeteleme bilgilerine göre lipid düşürücü tedaviyi maksimuma çıkarırken aynı lorlatinib dozu ile devam edin.
Şiddetli hiperkolesterolemi ve/veya hipertrigliseridemi, ilgili reçete bilgilerine göre en yüksek lipid düşürücü tedavisine rağmen tekrarlarsa, lorlatinib dozunu bir seviye azaltın. |
Merkezi Sinir Sistemi (MSS) etkileri (bilişsel, ruh hali, zihinsel durum veya konuşmadaki psikotik etkileri ve değişiklikleri içerir) | |
Derece 2: Orta VEYA Derece 3: Ciddi | Toksisite Derece 1'e eşit veya daha düşük olana kadar doza ara verin. Ardından bir seviye azaltılmış dozda lorlatinibe devam edin. |
Derece 4: Yaşamı tehdit eden | Kalıcı olarak lorlatinib kullanımına son verin. |
Lipaz/Amilaz artışı | |
Derece 3: Şiddetli VEYA Derece 4: Yaşamı tehdit eden/Acil müdahale gerektiren |
Lipaz veya amilaz başlangıç seviyesine dönünceye kadar lorlatinibe ara verin. Ardından bir seviye azaltılmış dozda lorlatinibe devam edin. |
İnterstisyel Akciğer Hastalığı (ILD)/Akciğer İltihabı | |
Derece 1: Hafif VEYA Derece 2: Orta | Semptomlar başlangıç seviyesine dönünceye kadar lorlatinibe ara verin ve kortikosteroidlere başlamayı düşünün. Ardından bir seviye azaltılmış dozda lorlatinibe devam edin.
6 haftalık lorlatinib kesilmesi ve steroid tedavisinden sonra ILD/ akciğer iltihabı tekrarlarsa ya da iyileşmezse lorlatinibi kalıcı olarak bırakın. |
Derece 3: Şiddetli VEYA Derece 4: Yaşamı tehdit eden/Acil müdahale gerektiren |
Kalıcı olarak lorlatinib kullanımına son verin. |
PR aralığı uzaması/Atrioventriküler (AV) Blok | |
Birinci derecede AV bloğu: Asemptomatik | Lorlatinibe ara vermeden aynı dozda devam edin. Eş zamanlı tıbbi ürünlerin etkilerini göz önünde bulundurun. PR aralığını uzatabilecek elektrolit dengesizliğini değerlendirin ve düzenleyin. AV bloğu ile potansiyel olarak ilişkili olan EKG/semptomları yakından izleyin. |
Birinci derecede AV bloğu: Semptomatik | Lorlatinibe ara verin. Eş zamanlı tıbbi ürünlerin etkilerini göz önünde bulundurun. PR aralığını uzatabilecek elektrolit dengesizliğini değerlendirin ve düzenleyin. AV bloğu ile potansiyel olarak ilişkili olan EKG/semptomları yakından izleyin. Semptomlar düzelirse, bir seviye azaltılmış dozda lorlatinibe devam edin. |
İkinci derecede AV bloğu: Asemptomatik | Lorlatinibe ara verin. Eş zamanlı tıbbi ürünlerin etkilerini göz önünde bulundurun. PR aralığını uzatabilecek elektrolit dengesizliğini değerlendirin ve düzenleyin. AV bloğu ile potansiyel olarak ilişkili EKG/semptomları yakından izleyin. Sonraki EKG'de ikinci derecede AV bloğu görülmezse, bir seviye azaltılmış dozda lorlatinibe devam edin. |
İkinci derecede AV bloğu: Semptomatik | Lorlatinibe ara verin. Eş zamanlı tıbbi ürünlerin etkilerini göz önünde bulundurun. PR aralığını uzatabilecek elektrolit dengesizliğini değerlendirin ve düzenleyin. Kardiyak gözlem ve takibe başvurun. Semptomatik AV bloğu devam ederse kalp pili takılmasını değerlendirin. Semptomlar ve ikinci derecede AV bloğu düzelirse veya hastalar asemptomatik birinci derece AV bloğuna geri dönerse, bir seviye azaltılmış dozda lorlatinibe devam edin. |
Tam AV bloğu | Lorlatinibe ara verin. Eş zamanlı tıbbi ürünlerin etkilerini göz önünde bulundurun. PR aralığını uzatabilecek elektrolit dengesizliğini değerlendirin ve düzenleyin. Kardiyak gözlem ve takibe başvurun. AV bloğu ile ilişkili şiddetli semptomlar için kalp pili takılması gerekebilir. AV bloğu çözülmezse, kalıcı bir kalp pili takılması düşünülebilir.
Kalp pili takılmışsa, lorlatinibe tam dozda devam edin. Kalp pili takılmamışsa, yalnızca semptomlar düzeldiğinde ve PR aralığı 200 ms'den az olduğunda bir seviye azaltılmış dozda lorlatinibe devam edin. |
Hipertansiyon | |
Derece 3 (160 mmHg'ye eşit veya daha yüksek SKB ya da 100 mmHg'ye eşit veya daha yüksek DKB; tıbbi müdahale gerektiren; birden fazla antihipertansif ilaç veya daha önce kullanılandan daha yoğun tedavi gerektiren) | Derece 1 veya daha düşük hipertansiyon (SKB 140 mmHg'den düşük ve DKB 90 mmHg'den düşük) gözlenene kadar lorlatinibe ara verin ve ardından aynı dozda devam edin.
Derece 3 hipertansiyon tekrarlarsa, derece 1 veya daha düşük seviyeye iyileşinceye kadar lorlatinibe ara verin ve azaltılmış bir dozda devam edin. Optimal tıbbi tedavi ile yeterli hipertansiyon kontrolü sağlanamazsa, lorlatinib kalıcı olarak kesilmelidir. |
Derece 4 (Yaşamı tehdit eden sonuçları olan, acil müdahale gerektiren) | Derece 1 veya daha düşük seviyeye gelinceye kadar lorlatinibe ara verin ve azaltılmış bir dozda devam edin ya da lorlatinibi kalıcı olarak kesin.
Derece 4 hipertansiyon tekrar ederse, lorlatinib kalıcı olarak kesilmelidir. |
Hiperglisemi | |
Derece 3 VEYA Derece 4 (Optimal anti hiperglisemik tedaviye rağmen 250 mg/dL'den yüksek kalıcı hiperglisemi) | Hiperglisemi yeterince kontrol edilinceye kadar lorlatinibe ara verin, ardından bir seviye azaltılmış dozda lorlatinibe devam edin.
Optimal tıbbi tedavi ile yeterli hiperglisemik kontrol sağlanamazsa, lorlatinib kalıcı olarak kesilmelidir. |
Diğer advers reaksiyonlar |
|
Derece 1: Hafif VEYA Derece 2: Orta |
Klinik duruma göre doz modifikasyonu yapmamayı ve dozu bir seviye azaltmayı değerlendirin. |
Derece 3 veya daha yüksek: Şiddetli | Semptomlar Derece 2'ye veya başlangıçtakine eşit ya da daha düşük oluncaya kadar lorlatinibe ara verin. Ardından bir seviye azaltılmış dozda lorlatinibe devam edin. |
Kısaltmalar: MSS: merkezi sinir sistemi; CTCAE Advers Olaylar için Genel Terminoloji Kriterleri; DKB: diastolik kan basıncı; EKG: elektrokardiyogram; HMG CoA: 3-hidroksi-3- metilglutaril koenzim A; NCL: Ulusal Kanser Enstitüsü; SKB: sistolik kan basıncı; ULN: normalin üst sınırı.
Güçlü sitokrom P-450 (CYP) 3A4/5 inhibitörleri
Lorlatinibin güçlü CYP 3A4/5 inhibitörü olan tıbbi ürünler ve greyfurt suyu ürünleri ile eş zamanlı kullanımı, lorlatinib plazma konsantrasyonunu arttırabilir. CYP 3A4/5'i inhibe etme potansiyeli daha düşük olan alternatif bir eş zamanlı tıbbi ürün düşünülmelidir (bkz. Bölüm 4.5). Güçlü bir CYP 3A4/5 inhibitörü birlikte uygulanmak zorundaysa, günde bir kez 100 mg olan başlangıç lorlatinib dozu, günde bir kez 75 mg'a düşürülmelidir (bkz. Bölüm 4.5 ve 5.2). Güçlü bir CYP 3A4/5 inhibitörünün eş zamanlı kullanımı kesilirse, güçlü CYP3A4/5 inhibitörünün 3 ile 5 yarılanma ömrü kadar bir arınma döneminden sonra, güçlü CYP 3A4/5 inhibitörüne başlamadan önce kullanılan dozda lorlatinibe devam edilmelidir.
Uygulama şekli:
LORVİQUA oral kullanım içindir.
Hastalara dozlarını yaklaşık olarak günün aynı saatinde yiyeceklerle veya aç almaları önerilmelidir (Bkz. Bölüm 5.2). Tabletler bütün olarak yutulmalıdır (tabletler yutulmadan önce çiğnenmemeli, kırılmamalı veya bölünmemelidir). Kırılmış, çatlamış veya başka şekilde zarar görmüş tabletler alınmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Karaciğer Yetmezliği:
Hafif karaciğer yetmezliği olan hastalar için doz ayarlaması önerilmez. Orta veya şiddetli karaciğer yetmezliği olan hastalar için bir bilgi mevcut değildir. Bu nedenle orta veya şiddetli karaciğer yetmezliği olan hastalarda lorlatinib kullanımı önerilmez (bkz. Bölüm 5.2).
Böbrek Yetmezliği:
Böbrek fonksiyonu normal olan ve hafif veya orta derecede böbrek yetmezliği [mutlak tahmini glomerüler filtrasyon hızı (eGFR): ≥ 30 mL/dk] olan hastalarda doz ayarlaması yapılması gerekli değildir. Şiddetli böbrek yetmezliği olan hastalarda (mutlak eGFR < 30 mL/dk), azaltılmış lorlatinib dozu, örneğin günde bir kez oral alınan 75 mg'lık başlangıç dozu, önerilir (bkz. Bölüm 5.2). Renal diyaliz hastaları için bilgi mevcut değildir.
Pediyatrik popülasyon:
Lorlatinibin 18 yaş altı pediatrik hastalarda güvenliliği ve etkililiği belirlenmemiştir. Veri mevcut değildir.
Geriyatrik popülasyon:
Bu popülasyona ilişkin verilerin sınırlı olması nedeniyle 65 yaş ve üzeri hastalar için doz önerisi yapılamamaktadır (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Lorlatinibe veya 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olanlarda kontrendikedir.
LORVİQUA ile güçlü CYP3A4/5 indükleyicilerinin eş zamanlı kullanımı kontrendikedir (Bkz.
Bölüm 4.4 ve 4.5).
4.4. Özel kullanım uyarıları ve önlemleri
Hiperlipidemi
Lorlatinib kullanımı serum kolesterol ve trigliserid artışları ile ilişkili bulunmuştur (bkz. Bölüm 4.8). Serum kolesterol ve trigliserid seviyelerinde ağır artış oluşmasına kadar geçen medyan süre sırasıyla 104 gün (aralık: 29- 518 gün) ve 120 gündür (aralık: 15-780 gün). Serum kolesterol ve trigliserid seviyeleri lorlatinib başlanmadan önce ve başlandıktan 2, 4 ve 8. haftalarda ve ardından düzenli olarak izlenmelidir. Eğer endike ise lipid düşürücü bir ilaca başlanmalı ya da kullanılmakta olan ilacın dozu arttırılmalıdır (Bkz. Bölüm 4.2).
Merkezi Sinir Sistemi Etkileri
Lorlatinib kullanan hastalarda psikotik etkiler ve bilişsel fonksiyon, duygudurum, zihinsel durum veya konuşma değişiklikleri dahil merkezi sinir sistemi (MSS) etkileri gözlenmiştir (Bkz. Bölüm 4.8). MSS etkileri gelişen hastalar için doz değişikliği ya da lorlatinib tedavisinin bırakılması gerekebilir (Bkz. Bölüm 4.2).
Atriyoventriküler blok
Lorlatinib ikinci derece ya da üçüncü derece AV bloğu (pacemaker takılı olmadığı sürece) olan ya da PR aralığının >220 milisaniye olduğu herhangi bir AV bloğu olan hastaların dışlandığı bir hasta popülasyonunda incelenmiştir. Lorlatinib alan hastalarda PR aralığında uzama ve AV blok bildirilmiştir (Bkz. Bölüm 5.2). Özellikle klinik önemi olan kalp olaylarının oluşmasına zemin sağlayan hastalıkları olan hastalarda olmak üzere lorlatinib başlamadan önce ve ardından ayda bir elektrokardiyografi (EKG) takibi yapılmalıdır. AV blok gelişen hastalarda doz değişiklikleri gerekebilir (Bkz. Bölüm 4.2).
Sol ventrikül ejeksiyon fraksiyonunda düşme
Lorlatinib alan ve başlangıçta ve en az bir takip sol ventrikül ejeksiyon fraksiyonu (LVEF) değerlendirmesi olan hastalarda sol ventrikül ejeksiyon fraksiyonunda düşme bildirilmiştir. Mevcut klinik çalışma verilerine göre kalbin kasılma kapasitesindeki değişiklikler üzerindeki etki ve lorlatinib arasında bir neden ilişkisi belirlemek olanaksızdır. Kardiyak risk faktörleri olan ve LVEF seviyesini etkileyebilecek hastalıkları olan hastalarda başlangıçta ve tedavi sırasında LVEF değerlendirmesi dahil olmak üzere kalp açısından takip yapılması düşünülmelidir. Tedavi sırasında kardiyak belirti ve semptomları gelişen hastalarda LVEF değerlendirmesi dahil olmak üzere kalp açısından takip yapılması düşünülmelidir.
Lipaz ve amilaz artışı
Lorlatinib alan hastalarda lipaz ve/veya amilaz artışları oluşmuştur (Bkz. Bölüm 4.8). Serum lipaz ve amilaz seviyelerinde artış oluşmasına kadar geçen medyan süre sırasıyla 141 gün (aralık: 1- 1091 gün) ve 138 gündür (aralık: 1-1112 gün). Lorlatinib alan hastalarda eş zamanlı hipertrigliseridemi ve/veya olası intrensek bir mekanizma nedeniyle pankreatit riski dikkate alınmalıdır. Hastalar lorlatinib başlanmadan önce ve klinik olarak endike ise başlandıktan sonra düzenli olarak lipaz ve amilaz açısından takip edilmelidir (Bkz. Bölüm 4.2).
İnterstisyel akciğer hastalığı/Pnömonit
Lorlatinib ile ILD/pnömonit ile uyumlu ağır ya da yaşamı tehdit eden pulmoner advers reaksiyonlar oluşmuştur (Bkz. Bölüm 4.8). Solunum semptomlarında ILD/pnömonit düşündüren (örneğin dispne, öksürük ve ateş) kötüleşme olan tüm hastalar derhal ILD/pnömonit açısından değerlendirilmelidir. Tablonun şiddetine göre lorlatinibe ara verilmeli ya da kesin olarak bırakılmalıdır (Bkz. Bölüm 4.2).
Hipertansiyon
Lorlatinib alan hastalarda hipertansiyon bildirilmiştir (bkz. Bölüm 4.8). Lorlatinib tedavisine başlamadan önce kan basıncı kontrol edilmelidir. Lorlatinib tedavisi başlangıcından 2 hafta sonra ve devamında en az ayda bir kez kan basıncı izlenmelidir. Tablonun şiddetine göre lorlatinibe ara verilmeli ve azaltılmış bir dozda yeniden başlanmalı ya da kalıcı olarak bırakılmalıdır (Bkz. Bölüm 4.2).
Hiperglisemi
Lorlatinib alan hastalarda hiperglisemi meydana gelmiştir (bkz. Bölüm 4.8). Lorlatinib tedavisine başlamadan önce açlık serum glukozu ölçülmeli ve sonrasında ulusal kılavuzlara göre periyodik olarak izlenmelidir. Tablonun şiddetine göre lorlatinibe ara verilmeli ve azaltılmış bir dozda yeniden başlanmalı ya da kalıcı olarak bırakılmalıdır (Bkz. Bölüm 4.2).
İlaç etkileşimleri
Sağlıklı gönüllülerde yapılan bir çalışmada lorlatinib ile eş zamanlı olarak güçlü bir CYP3A4/5 indükleyicisi olan rifampin kullanımı total bilirübin ve alkalin fosfataz artışı olmaksızın alanin aminotransferaz (ALT) ve aspartat aminotransferaz (AST) artışları ile ilişkili bulunmuştur (Bkz. Bölüm 4.5). Eş zamanlı olarak güçlü bir CYP3A4/5 indükleyicisi kullanımı kontrendikedir (Bkz. Bölümler 4.3 ve 4.5).
Lorlatinib ile orta derece CYP3A4/5 indükleyicisi modafinil kombinasyonu alan sağlıklı gönüllülerde karaciğer fonksiyon testlerinde klinik olarak anlamlı değişiklikler görülmemiştir (Bkz. Bölüm 4.5).
Lorlatinib eş zamanlı olarak verildiğinde alfentanil, siklosporin, dihidroergotamin, ergotamin, fentanil, hormonal kontraseptifler, pimozid, kinidin, sirolimus ve takrolimus dahil ancak bunlarla kısıtlı olmamak üzere terapötik indeksi dar CYP3A4/5 substratlarının konsantrasyonlarını düşürebileceğinden bu ilaçların lorlatinib ile eş zamanlı verilmesinden kaçınmalıdır (Bkz. Bölüm 4.5).
Üreme ve gebelik
Lorlatinib ile tedavi sırasında ve son dozdan sonra en az 14 hafta boyunca gebe kalma olasılığı olan kadın partneri bulunan erkek hastalar kondom kullanımını içeren etkili bir gebelikten korunma yöntemi ve partneri gebe olan erkek hastalar kondom kullanmalıdır (Bkz. Bölüm 4.6). Erkek üreme fonksiyonu lorlatinib tedavisi sırasında olumsuz etkilenebilir (Bkz. Bölüm 5.3). Erkekler tedaviden önce üreme fonksiyonunun etkili bir şekilde korunması konusunda bir doktora danışmalıdır. Gebe kalma olasılığı olan kadınlara lorlatinib kullanırken gebe kalmaktan kaçınmaları söylenmelidir. Lorlatinib hormonal kontraseptifleri etkisizleştirebileceğinden lorlatinib tedavisi sırasında kadın hastalar için hormonal olmayan yüksek etkili bir kontraseptif gerekir (Bkz. Bölümler 4.5 ve 4.6). Eğer hormonal bir gebelikten korunma yönteminin kullanılması kaçınılmazsa bu durumda hormonal yöntemle birlikte kondom kullanılmalıdır. Etkili gebelikten korunma tedaviyi tamamladıktan sonra en az 35 gün sürdürülmelidir (Bkz. Bölüm 4.6). Lorlatinibin kadın üreme fonksiyonunu etkileyip etkilemediği bilinmemektedir.
Laktoz intoleransı
Bu tıbbi ürün laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Sodyum
Bu tıbbi ürün her âdozâunda (25 mg veya 100 mg tablette) 1 mmol (23 mg)'dan daha az sodyum ihtiva eder. Düşük sodyum diyeti uygulayan hastalar, bu ürünün aslında âsodyum içermediğiâ konusunda bilgilendirilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakokinetik etkileşimleri
İn vitro veriler lorlatinibin başlıca CYP3A4 ve üridin difosfat-glukunosiltransferaz (UGT) 1A4 ile metabolize edildiğini göstermektedir. CYP2C8, CYP2C19, CYP3A5 ve UGT1A3 minör katkıda bulunmaktadır.
İlaçların lorlatinib üzerindeki etkisi
CYP3A4/5 indükleyicileri
Güçlü bir CYP3A4/5 indükleyici olan rifampin sağlıklı gönüllülere 12 gün boyunca günde bir kez oral yolla 600 mg dozunda verildiğinde tek bir 100 mg oral lorlatinib dozunun ortalama eğri altındaki alanını (EAA) %85 ve Cdeğerini %76 azaltmıştır; AST ve ALT artışları da gözlenmiştir. Lorlatinibin güçlü CYP3A4/5 indükleyicileri (örneğin rifampisin, karbamazepin, enzalutamid, mitotan, fenitoin ve sarı kantaron otu) ile eş zamanlı verilmesi lorlatinibin plazma konsantrasyonlarını azaltabilir. Lorlatinibin güçlü CYP3A4/5 indükleyicileri ile kullanımı kontrendikedir (Bkz. Bölümler 4.3 ve 4.4). Sağlıklı gönüllülerde tek bir 100 mg oral lorlatinib dozu ile orta derecede CYP3A4/5 indükleyici olan modafinil (19 gün boyunca günde bir kez 400 mg) kombinasyonunun uygulanmasından sonra karaciğer fonksiyon testi sonuçlarında klinik olarak anlamlı bir değişiklik görülmemiştir. Modafinilin eş zamanlı kullanımı, lorlatinibin farmakokinetiği üzerinde klinik olarak anlamlı bir etkiye sahip olmamıştır.
CYP3A4/5 inhibitörleri
Güçlü bir CYP3A4/5 inhibitörü olan itrakonazol sağlıklı gönüllülere 5 gün boyunca 200 mg
oral günde tek doz verildiğinde tek bir 100 mg oral lorlatinib dozunun ortalama EAAdeğerini
%42 ve tek bir 100 mg oral lorlatinib dozunun Cdeğerini %24 azaltmıştır. Güçlü CYP3A4/5 inhibitörleri (örneğin boseprevir, kobisistat, itrakonazol, ketakonazol, posakonazol, troleandomisin, vorikonazol, ritonavir, ritonavir ile kombine paritaprevir ve ombitasvir ve/veya dasabuvir ve elvitegravir, indinavir, lopinavir ya da tipranavir ile kombine ritonavir) lorlatinibin plazma konsantrasyonlarını arttırabilir. Greyfurt ürünleri de lorlatinibin plazma konsantrasyonlarını arttırabilir ve kaçınılmalıdır. CYP3A4/5 inhibisyonu yapma olasılığı daha düşük olan alternatif bir ilacın eş zamanlı verilmesi düşünülmelidir. Eğer güçlü bir CYP3A4/5 inhibitörünün eş zamanlı olarak verilmesi zorunlu ise lorlatinib dozunun azaltılması önerilir (Bkz. Bölüm 4.2).
Lorlatinibin diğer ilaçlar üzerindeki etkisi
CYP3A4/5 substratları
İn vitro çalışmalar lorlatinibin CYP3A4/5'nin zamana bağımlı bir inhibitörü ve bunun yanı sıra indükleyicisi olduğunu göstermiştir. Lorlatinib 15 gün boyunca günde tek 150 mg dozunda oral yolla verildiğinde tek bir 2mg midazolam (duyarlı bir CYP3A substratı) dozunun EAAdeğerini ve Cdeğerini sırasıyla %61'e ve %50'ye kadar azaltmıştır; dolayısıyla, lorlatinib orta güçte CYP3A indükleyicisidir. Bu nedenle lorlatinib eş zamanlı olarak verildiğinde alfentanil, siklosporin, dihidroergotamin, ergotamin, fentanil, hormonal kontraseptifler, pimozid, kinidin, sirolimus ve takrolimus dahil ancak bunlarla kısıtlı olmamak üzere terapötik indeksi dar CYP3A4/5 substratlarının konsantrasyonlarını düşürebileceğinden bu ilaçların lorlatinib ile eş zamanlı verilmesinden kaçınmalıdır (bkz. Bölüm 4.4).
CYP2B6 substratı
Lorlatinib 15 gün boyunca günde tek 100 mg dozunda oral yolla verildiğinde tek bir oral 100 mg bupropion (CYP2B6 ve CYP3A4 substratı kombinasyonu) dozunun EAAdeğerini ve Cdeğerini sırasıyla %49,5'e ve %53'e kadar azaltmıştır. Dolayısıyla, lorlatinib zayıf bir CYP2B6 indükleyicisidir ve lorlatinib başlıca CYP2B6 ile metabolize edilen ilaçlarla kombine kullanıldığında doz ayarlaması gerekmez.
CYP2C9 substratı
Lorlatinib 15 gün boyunca günde tek 100 mg dozunda oral yolla verildiğinde tek bir oral 500 mg tolbutamid (duyarlı bir CYP2C9 substratı) dozunun EAAdeğerini ve Cdeğerini sırasıyla %43'e ve %15'e kadar azaltmıştır. Dolayısıyla, lorlatinib zayıf bir CYP2C9 indükleyicisidir ve lorlatinib başlıca CYP2C9 ile metabolize edilen ilaçlarla kombine kullanıldığında doz ayarlaması gerekmez.
Bununla birlikte CYP2C9 ile metabolize edilen dar terapötik indekse sahip ilaçlarla (örneğin kumarin antikoagülanlar) eş zamanlı tedavi durumunda hastalar takip edilmelidir.
UGT substratları
Lorlatinib 15 gün boyunca günde tek 100 mg dozunda oral yolla verildiğinde tek bir oral 500 mg asetaminofen (bir UGT, SULT ve CYP1A2, 2A6, 2D6 ve 3A4 substratı) dozunun EAAdeğerini ve Cdeğerini sırasıyla %45'e ve %28'e kadar azaltmıştır. Dolayısıyla, lorlatinib zayıf bir UGT indükleyicisidir ve lorlatinib başlıca UGT ile metabolize edilen ilaçlarla kombine kullanıldığında doz ayarlaması gerekmez. Bununla birlikte UGT ile metabolize edilen dar terapötik indekse sahip ilaçlarla eş zamanlı tedavi durumunda hastalar takip edilmelidir.
P-glikoprotein substratları
Lorlatinib 15 gün boyunca günde tek 100 mg dozunda oral yolla verildiğinde tek bir oral 60 mg feksofenadin [duyarlı bir P-glikoprotein (P-gp) substratı] dozunun EAAdeğerini ve Cdeğerini sırasıyla %67'ye ve %63'e kadar azaltmıştır. Dolayısıyla, lorlatinib orta güçte bir P- gp indükleyicisidir. P-gp substratı olan ve dar terapötik indekse sahip ilaçlar (örneğin digoksin, dabigatran eteksilat) bu substratlarının plazma konsantrasyonlarını düşürme olasılığı nedeniyle lorlatinib ile kombine kullanılırken dikkatli olunmalıdır.
Diğer CYP enzimlerinin in vitro inhibisyon ve indüksiyon çalışmaları
İn vitro olarak lorlatinibin CYP1A2 indüksiyonu yoluyla ilaç-ilaç etkileşimlerine neden olma olasılığı düşüktür.
P-gp dışındaki ilaç taşıyıcıları ile in vitro çalışmalar
İn vitro çalışmalar lorlatinibin klinik konsantrasyonlarda BCRP (gastrointestinal sistem), OATP1B1, OATP1B3, OCT1, MATE1 ve OAT3 substratlarının plazma seviyelerinde klinik olarak anlamlı değişikliklere yol açma olasılığı olduğunu göstermiştir. BCRP, OATP1B1, OATP1B3, OCT1, MATE1 ve OAT3 substratlarının plazma seviyelerinde klinik olarak anlamlı değişikliklere yol açma olasılığı dışlanamayacağından lorlatinib bu substratlarla kullanılırken dikkatli olunmalıdır.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Gebe kalma potansiyeli olan kadınlara lorlatinib kullanırken gebe kalmaktan kaçınmaları söylenmelidir. Lorlatinib hormonal kontraseptifleri etkisizleştirebileceğinden lorlatinib tedavisi sırasında kadın hastaların yüksek etkili hormonal olmayan bir gebelikten korunma yöntemi kullanmaları gerekir (Bkz. Bölümler 4.4 ve 4.5). Eğer hormonal kontraseptif kullanılması zorunlu ise hormonal yöntemle birlikte kondom kullanılmalıdır. Tedavi tamamlandıktan en az 35 gün sonrasına kadar etkili bir gebelikten korunma yöntemi kullanılmaya devam edilmelidir.
Gebe kalma potansiyeli olan kadın partnerleri olan erkek hastalar lorlatinib tedavisi sırasında ve son dozdan en az 14 hafta sonrasına kadar kondomu da içeren etkili gebelikten korunma yöntemleri kullanmalı ve partnerleri gebe olan erkek hastalar kondom kullanmalıdır.
Gebelik dönemi
Lorlatinibin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalarda embriyo-fetal toksisite gösterilmiştir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Lorlatinib gebe bir kadına verildiğinde fetüse zarar verebilir. Lorlatinibin gebelik sırasında ve gebe kalma potansiyeli olup gebelikten korunma yöntemi kullanmayan kadınlarda kullanılması önerilmez.
Laktasyon dönemi
Lorlatinibin ve metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir. Yeni doğanlarda ve süt çocuklarında risk dışlanamaz.
Lorlatinib emzirme sırasında kullanılmamalıdır. Lorlatinib tedavisi sırasında ve son dozdan 7 gün sonrasına kadar emzirmeye ara verilmelidir.
Üreme yeteneği/Fertilite
Preklinik güvenlilik bulgularına göre lorlatinib tedavisi sırasında erkek üreme fonksiyonu olumsuz etkilenebilir (Bkz. Bölüm 5.3). Kadın üreme fonksiyonunun etkilenip etkilenmediği bilinmemektedir. Tedaviye başlamadan önce erkekler üreme fonksiyonunun korunması açısından doktora danışmalıdır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Lorlatinibin araç ve makine kullanımı üzerine orta düzeyde etkisi bulunmaktadır. Hastalar santral sinir sistemi etkileri yaşayabileceğinden, araç veya makine kullanılırken dikkatli olunmalıdır (Bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profili özeti
En sık bildirilen advers reaksiyonlar hiperkolesterolemi (%81,1), hipertrigliseridemi (%67,2), ödem (%55,7), periferik nöropati (%43,7), kilo artışı (%30,9), bilişsel etkiler (%27,7), fatigue
(%27,3), artralji (%23,5), ishal (%22,9) ve duygudurum etkileri (%21) olmuştur.
Lorlatinib alan hastaların %7,4'ünde ciddi yan etkiler bildirilmiştir. En sık görülen ciddi advers reaksiyonlar, bilişsel etkiler ve pnömonidir.
Lorlatinib alan hastaların %20'sinde advers reaksiyonlara bağlı olarak doz azaltılmıştır. Dozun azaltılmasına en sık neden olan advers reaksiyonlar ödem ve periferik nöropatidir. Lorlatinib alan hastaların %3,2'si gelişen advers reaksiyonlara bağlı olarak tedaviyi bırakmıştır. Tedavinin kesin olarak bırakılmasına en sık neden olan advers reaksiyonlar bilişsel etkiler, periferik nöropati, pnömoni ve psikotik etkilerdir.
Advers reaksiyonların tablo listesi
Tablo 2 Çalışma A'da (N=327) ve CROWN çalışmasında (N=149) ileri evre KHDAK nedeniyle günde bir kez 100 mg lorlatinib ile tedavi edilen 476 erişkin hastada oluşan advers reaksiyonları sunmaktadır.
Advers reaksiyonlar sistem organ sınıfına uygun olarak listelenmiştir. Advers reaksiyonlar her sistem organ sınıfı altında aşağıdaki düzen kullanılarak, en sık görülen reaksiyonlar en başta olmak üzere görülme sıklığına göre sıralanmıştır: çok yaygın (≥1/10); yaygın (≥1/100 ila 1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000). Her bir sıklık gruplandırması içinde istenmeyen etkiler azalan tıbbi ciddiyet sırasına göre verilmiştir.
Tablo 2.Advers reaksiyonlar
Sistem organ sınıfı | Advers reaksiyon | Sıklık | Tüm dereceler % | Derece 3-4 % |
Kan ve lenf sistemi hastalıkları | Anemi | Çok yaygın | 18,5 | 4,2 |
Metabolizma ve beslenme hastalıkları | Hiperkolesterolemiáµ | Çok yaygın | 81,1 | 18,3 |
Hipertrigliseridemiáµ | Çok yaygın | 67,2 | 19,3 | |
Hiperglisemi | Yaygın | 9,2 | 3,2 | |
Psikiyatrik hastalıklar | Duygudurum üzerindeki etkilerᶠ| Çok yaygın | 21 | 1,5 |
Psikotik etkileráµ | Yaygın | 6,5 | 0,4 | |
Zihinsel durum değişiklikleri | Yaygın | 2 | 1,7 | |
Sinir sistemi hastalıkları | Bilişsel etkileráµ | Çok yaygın | 27,7 | 2,9 |
Periferik nöropatiᶠ| Çok yaygın | 43,7 | 2,7 | |
Baş ağrısı | Çok yaygın | 17,9 | 0,6 | |
Konuşma üzerinde etkilerᶢ | Yaygın | 8,2 | 0,6 | |
Göz hastalıkları | Görme bozukluklarıÊ° | Çok yaygın | 17,2 | 0,2 |
Vasküler hastalıkları | Hipertansiyon | Çok yaygın | 13 | 6,1 |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | Pnömonitᶦ | Yaygın | 1,9 | 0,6 |
Gastrointestinal hastalıkları | İshal | Çok yaygın | 22,9 | 1,5 |
Bulantı | Çok yaygın | 17,6 | 0,6 | |
Kabızlık | Çok yaygın | 17,4 | 0,2 | |
Deri ve deri altı doku hastalıkları | Döküntüʲ | Çok yaygın | 13,7 | 0,2 |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Artalji | Çok yaygın | 23,5 | 0,8 |
Miyaljiáµ | Çok yaygın | 19,3 | 0,2 | |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | ÖdemË¡ | Çok yaygın | 55,7 | 2,7 |
Fatigueáµ | Çok yaygın | 27,3 | 1,3 | |
Araştırmalar | Kilo artışı | Çok yaygın | 30,9 | 10,1 |
Lipaz artışı | Çok yaygın | 12,4 | 6,9 | |
Amilaz artışı | Çok yaygın | 11,3 | 2,7 | |
Elektrokardiyogram PR uzaması | Yaygın olmayan | 0,8 | 0 |
Aynı tıbbi kavram ya da durumu temsil eden advers reaksiyonlar birlikte gruplandırılmıştır ve yukarıdaki tabloda tek bir advers reaksiyon olarak bildirilmiştir. Çalışmalarda halen bildirilen ve ilgili advers reaksiyona katkıda bulunan terimler aşağıdaki listede belirtildiği şekilde parantez içinde belirtilmiştir.
áµ Hiperkolesterolemi (kan kolesterol seviyesinde artış, hiperkolesterolemi dahil). áµ Hipertrigliseridemi (kan trigliseridlerinde artış, hipertrigliseridemi dahil).
ᶠDuygudurum etkileri (duygulanım bozukluğu, duygusal değişkenlik, saldırganlık, ajitasyon, öfke, anksiyete, Tip I bipolar bozukluk, depresif duygudurum, depresyon, depresif semptom, öforik duygudurum, sinirlilik, mani, duygudurum değişikliği, duygudurum dalgalanmaları, panik atak, kişilik değişikliği, stres dahil).
áµ Psikotik etkiler (işitsel halüsinasyonlar, halüsinasyon, görsel halüsinasyonlar dahil).
áµ Bilişsel etkiler (SOC sinir sistemi bozuklukları olaylarını kapsar: amnezi, bilişsel bozukluk, demans, dikkat bozukluğu, hafıza bozukluğu, mental bozukluk; ve aynı zamanda SOC psikiyatrik bozukluk olaylarını da kapsar: dikkat bozukluğu, hiperaktivite bozukluğu, konfüzyon durumu, deliryum, yönelim bozukluğu, okuma bozukluğu). Bu etkiler içinde SOC sinir sistemi bozuklukları terimleri SOC psikiyatrik bozukluk terimlerinde daha sık olarak bildirilmiştir.
ᶠPeriferik nöropati (yanma duygusu, disestezi, karıncalanma, yürüyüş bozukluğu, hipoestezi, motor işlev bozukluğu, kas güçsüzlüğü, nöralji, nöropati, periferik nörotoksisite, parestezi, periferik motor nöropati, periferik duysal nöropati, peroneal sinir felci, duysal bozukluk dahil). ᶢ Konuşma etkileri (dizartri, yavaş konuşma, konuşma bozukluğu).
Ê° Görme bozukluğu (çift görme, ışıktan rahatsız olma, ışık çakmaları, bulanık görme, görme keskinliğinin azalması, görme kaybı, uçuşan cisimler görme).
Í¥ Pnömonit (interstisyel akciğer hastalığı, akciğer opasitesi, pnömonit dahil).
ʲ Döküntü (akneiform dermatit, makülopapüler döküntü, kaşıntılı döküntü, döküntü dahil). áµ Miyalji (kas iskelet ağrısı, kas ağrısı dahil).
Ë¡ Ödem (genel ödem, periferik ödem, periferik şişlik, şişlik dahil). áµ Fatigue (asteni, bitkinlik dahil).
Seçili advers reaksiyonların tanımı
Hiperkolesterolemi/ hipertrigliseridemi
Serum kolesterol ya da trigliserid seviyelerinde artış advers reaksiyonları hastaların sırasıyla
%81,1'inde ve %67,2'sinde bildirilmiştir. Bunlardan hafif ya da orta şiddette hiperkolesterolemi ya da hipertrigliseridemi advers reaksiyonları hastaların sırasıyla
%62,8'inde ve %47,9'unda gelişmiştir (Bkz Bölüm 4.4). Hem hiperkolesterolemi hem de hipertrigliseridemi için başlangıca kadar geçen medyan süre 15 gün olmuştur (hiperkolesterolemi aralığı: 1- 784 gün; hipertrigliseridemi aralığı: 1-796 gün). Hiperkolesteroleminin ve hipertrigliserideminin medyan süresi sırasıyla 451 ve 427 gün olmuştur.
Merkezi sinir sistemi etkileri
Başlıca MSS advers reaksiyonları bilişsel etkiler (%27,7), duygudurum etkileri (%21) , konuşma etkileri (%8,2) ve psikotik etkiler (%6,5) olup genellikle hafif, geçici olmuş ve dozun geç verilmesi ya da doz azaltılması ile spontan olarak düzelmiştir (Bkz. Bölümler 4.2 ve 4.4). Herhangi bir derecedeki en sık bilişsel etki bellek bozukluğudur (%11,3) ve en sık Derece 3 ya da 4 reaksiyonlar konfüzyon durumu ve bilişsel bozukluktur (sırasıyla %1,7 ve %0,8). Herhangi bir derecedeki en sık duygudurum etkisi anksiyete (%6,5) ve en sık görülen Derece 3 ve 4 reaksiyonları sinirlilik ve depresyondur (sırasıyla %0,8 ve %0,4). Konuşma üzerinde tüm derecelerde en sık etki dizartri (%4) olurken Derece 3 ve 4 reaksiyonlar dizartri, yavaş konuşma ve konuşma bozukluğudur (her biri %0,2). Tüm derecelerde en sık psikotik etki halüsinasyon (%3,7) olurken Derece 3 ve 4 reaksiyonlar halüsinasyon, işitsel halüsinasyon ve görsel halüsinasyondur (her biri %0,3). Bilişsel, duygudurum, konuşma ve psikotik etkilerinin ortaya çıkmasına kadar geçen medyan süre sırasıyla 109, 43, 49 ve 23 gündür. Bilişsel, duygudurum ve konuşma etkilerinin medyan süresi sırasıyla 223, 143, 147 ve 74 gündür.
Hipertansiyon
Çalışma A ve CROWN çalışmasında (B7461006) hastaların %13'ünde hipertansiyon yan etkisi bildirilmiştir. Bu hastaların %6,9'unda hafif veya orta dereceli hipertansiyon advers reaksiyonu meydana gelmiştir (bkz. Bölüm 4.4). Hipertansiyon başlangıcına kadar geçen medyan süre 208 gündür (aralık: 1 ile 1028 gün). Hipertansiyon medyan süresi 219 gündür.
Hiperglisemi
Çalışma A ve CROWN çalışmasında (B7461006) hastaların %9,2'sinde hiperglisemi yan etkisi bildirilmiştir. Bu hastaların %6,1'inde hafif veya orta derecede hiperglisemi advers reaksiyonu meydana gelmiştir (bkz. Bölüm 4.4). Hiperglisemi başlangıcına kadar geçen medyan süre 145 gündür (aralık: 1 ile 1058 gün). Hiperglisemi medyan süresi 113 gündür.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Tıbbi ürünle doz aşımının tedavisi genel destekleyici önlemleri içermektedir. PR intervalinin doz-bağımlı etkisi olduğundan, EKG izlenmesi önerilmektedir. Lorlatinibin antidotu bulunmamaktadır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik İlaçlar, Protein kinaz inhibitörleri, anaplastik lenfoma
kinaz (ALK) inhibitörü. ATC kodu: L01ED05
Etki mekanizması
Lorlatinib ALK ve c-ros onkogen (ROS1) tirozin kinazların adenozin trifosfat (ATP) ile yarışan seçici inhibitörüdür.
Preklinik çalışmalarda rekombinant enzim ve hücre temelli deneylerde lorlatinib mutasyona uğramamış ALK ve klinik olarak ilgili mutant ALK kinazların katalitik etkinliğini inhibe etmiştir. Lorlatinib L1196M, G1269A, G1202R ve I1171T ALK mutasyonları dahil ALK varyantı 1 (v1) ile füzyon yapan ekinoderm mikrotübül ile ilişkili protein benzeri 4 (EML4) eksprese eden tümör ksenografları taşıyan farede tümöre karşı belirgin etkinlik göstermiştir. Bu ALK mutantlarından ikisinin (G1202R ve I1171T) alektinibe, brigatinibe, seritinibe ve krizotinibe karşı direnç sağladığı bilinmektedir. Lorlatinib kan-beyin bariyerini geçmiştir. Lorlatinib ortotopik EML4-ALK ya da EML4-ALK beyin tümör implantlarında taşıyan farede etkinlik göstermiştir.
Klinik etkililik
Daha Önce Tedavi Almamış ALK-Pozitif İlerlemiş KHDAK (CROWN Çalışması)
Daha önce metastatik hastalığa yönelik olarak sistemik tedavi almamış ALK-pozitif KHDAK hastalarının tedavisinde lorlatinibin etkililiği açık-etiketli, randomize, aktif-kontrollü, çok- merkezli B7461006 çalışmasında (CROWN çalışması) gösterilmiştir. Bu çalışmada hastaların Doğu Kooperatif Onkoloji Grubu (ECOG) performans statüsünün 0-2 olması, VENTANA ALK (D5F3) CDx testi ile belirlendiği üzere ALK-pozitif KHDAK olması gerekmekteydi. Leptomeningeal metastazlar dahil tedavi edilmiş ya da edilmemiş MSS metastazları bulunan nörolojik açıdan stabil hastaların çalışmaya katılması uygundu. Hastaların randomizasyondan önceki 2 hafta içinde stereotaktik veya kısmi beyin ışınlaması dahil ışın tedavisini; randomizasyondan önceki 4 hafta içinde ise tam beyin ışınlaması tedavisini bitirmiş olmaları gerekmekteydi.
Hastalar günde bir kez oral yoldan 100 mg lorlatinib veya günde iki kez oral yoldan 250 mg krizotinib alacak şekilde 1:1 oranında randomize edilmiştir. Randomizasyon etnik kökene (Asyalı veya Asyalı-olmayan) ve başlangıçta MSS metastazları varlığı ya da yokluğuna göre katmanlandırılmıştır. Her iki tedavi grubunda tedaviye hastalıkta progresyon veya kabul edilmeyen toksisite görülünceye devam edilmiştir. En önemli etkililik sonuç ölçütü Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) versiyon 1.1'e (v1.1) göre Körlenmiş Bağımsız Merkezi İnceleme (BICR) tarafından belirlendiği üzere progresyonsuz sağkalımdı (PFS). Ek etkililik sonuç ölçütleri, genel sağkalım (OS), araştırmacı değerlendirmesine göre PFS, PFS2 ve genel yanıt oranı (ORR), yanıt süresi (DOR) ve intrakraniyal progresyona kadar geçen süre (IC TTP) dahil olmak üzere BICR tarafından belirlenen tümör değerlendirmesiyle ilgili verilerdir. Başlangıçta MSS metastazları olan hastalarda ek sonuç ölçütleri, BICR tarafından belirlenen intrakraniyal genel yanıt oranı (IC-ORR) ve intrakraniyal yanıt süresi (IC- DOR) idi.
Toplam 296 hasta lorlatinib (n=149) veya krizotinib (n=147) alacak şekilde randomize edilmiştir. Genel çalışma popülasyonunun demografik özellikleri şu şekildeydi: medyan yaş 59 (aralık: 26 ila 90 yaş arası), ≥65 yaş (%35), %59 kadın, %49 beyaz, %44 Asyalı ve %0,3 siyah. Hastaların büyük bir çoğunluğunda adenokarsinom vardı (%95) ve hiç sigara içmemişlerdi (%59). BICR nöroradyologlarının belirlediği MSS metastazları hastaların %26'sında (n=78) görüldü: bunlardan 30 hastada ölçülebilir MSS lezyonları vardı.
CROWN çalışmasından elde edilen sonuçlar Tablo 3'te özetlenmektedir. Veri kesim
noktasında OS ve PFS2 verileri olgunlaşmış durumda değildi.
Tablo 3 CROWN Çalışmasında Etkililik Sonuçları
Etkililik Parametresi | Lorlatinib N=149 | Krizotinib N=147 |
Medyan takip süresi, ay (%95 GA) | 18 (16 - 20) | 15 (13 - 18) |
BICR'ye göre progresyonsuz sağkalım | ||
Olay görülen hasta sayısı, n (%) | 41 (%28) | 86 (%59) |
Progresif hastalık, n (%) | 32 (%22) | 82 (%56) |
Ölüm, n (%) | 9 (%6) | 4 (%3) |
Medyan, ay (%95 GA) | NE (NE, NE) | 9 (8 - 11) |
Tehlike oranı (%95 GA) | 0,28 (0,19 - 0,41) | |
p-değeri | <0,0001 | |
Genel sağkalım |
| |
Olay görülen hasta sayısı, n (%) | 23 (%15) | 28 (%19) |
Medyan, ay (%95 GA) | NE (NE, NE) | NE (NE, NE) |
Tehlike oranı (%95 GA) | 0,72 (0,41 - 1,25) | |
INV'ye göre progresyonsuz sağkalım | ||
Olay görülen hasta sayısı, n (%) | 40 (%27) | 104 (%71) |
Progresif hastalık, n (%) | 34 (%23) | 99 (%67) |
Ölüm, n (%) | 6 (%4) | 5 (%3) |
Medyan, ay (%95 GA) | NE (NE, NE) | 9 (7 - 11) |
Tehlike oranı (%95 GA) | 0,21 (0,14 - 0,31) | |
p-değeri | < 0,0001 | |
BICR'ye göre genel yanıt | ||
Genel yanıt oranı, n (%) | 113 (%76) | 85 (%58) |
(%95 GA) | 68 â 83 | 49 - 66 |
İntrakraniyal progresyona kadar geçen zaman | ||
Medyan, ay (%95 GA) | NE (NE, NE) | 16,6 (11 - NE) |
Tehlike oranı (%95 GA) | 0,07 (0,03 - 0,17) | |
Yanıt süresi | ||
Yanıt verenlerin sayısı | 113 | 85 |
Medyan, ay (%95 GA) | NE (NE, NE) | 11 (9 - 13) |
Başlangıçta ölçülebilir MSS lezyonları olan hastalarda intrakraniyal genel yanıt | N=17 | N=13 |
İntrakraniyal yanıt oranı, n (%) | 14 (%82) | 3 (%23) |
(%95 GA)c | (57 - 96) | (5 - 54) |
Tam yanıt oranı | %71 | %8 |
Yanıt süresi |
|
|
Yanıt verenlerin sayısı | 14 | 3 |
Medyan, ay (%95 GA)a | NE (NE - NE) | 10 (9 - 11) |
Başlangıçta ölçülebilir veya ölçülemeyen MSS lezyonları olan hastalarda intrakraniyal genel yanıt | N=38 | N=40 |
İntrakraniyal yanıt oranı, n (%) | 25 (%66) | 8 (%20) |
(%95 GA)c | (49 - 80) | (9 - 36) |
Tam yanıt oranı | %61 | %15 |
Yanıt süresi |
|
|
Yanıt verenlerin sayısı | 25 | 8 |
Medyan, ay (%95 GA)a | NE (NE - NE) | 9 (6 - 11) |
Kısaltmalar: BICR=Kör Bağımsız Merkez İncelemesi; GA=güven aralığı; MSS=merkezi sinir sistemi; INV= araştırmacı değerlendirmesi; N=hasta sayısı; NE=tahmin edilemeyen.
![]()
Şekil 1: CROWN Çalışması'nda BICR'ye Göre Progresyonsuz Sağkalıma Ait Kaplan- Meier Grafiği
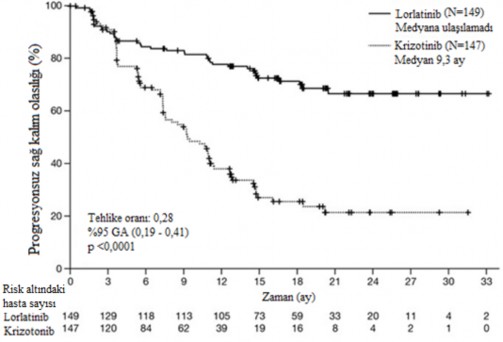
Kısaltmalar: GA=güven aralığı; N=hasta sayısı.
Lorlatinib tedavisinden sağlanan fayda, başlangıçta MSS metastazı olan (n=38, HR=0,2, %95 GA: 0,1-0,43) ve MSS metastazı olmayan hastalar (n=111, HR=0,32, %95 GA: 0,2-0,49) dahil olmak üzere, başlangıçtaki hasta ve hastalık özelliklerinin alt grupları arasında karşılaştırılabilir olmuştur.
Daha önce bir ALK kinaz inhibitörü ile tedavi edilmiş ALK-Pozitif İlerlemiş KHDAK
ALK- pozitif ileri evre KHDAK'nin tedavisinde en az bir ikinci nesil ALK TKİ ile tedaviden sonra lorlatinib kullanımı tek kollu, çok merkezli faz 1/2 çalışma olan Çalışma A'da araştırılmıştır. Toplam 139 ALK pozitif ileri evre KHDAK hastası en az bir ikinci nesil ALK TKİ ile tedaviden sonra çalışmanın Faz 2 bölümüne kaydedilmiştir. Hastalar kesintisiz olarak oral yolla günde bir kez 100 mg dozunda lorlatinib kullanmıştır.
Çalışmanın Faz 2 kısmında birincil etkililik sonlanım noktası Bağımsız Merkezi İnceleme (ICR) ile solid tümörlerde modifiye RECIST v1.1'e göre değerlendirilen intrakranyal (İK)- ORR dahil objektif yanıt oranıdır. İkincil sonlanım noktaları kapsamında DOR, İK-DOR, tümör yanıtına kadar geçen süre (TTR) ve PFS vardır.
En az bir ikinci nesil ALK TKİ ile tedavi almış olan 139 ALK-pozitif ileri evre KHDAK hastasının demografik özellikleri aşağıda yer almaktadır: %56 kadın, %48 beyaz, %38 Asyalı, medyan yaş 53 yaş (aralık 29-83 yaş) olup hastaların %16'sı 65 yaş ve üstüdür. ECOG performans durumu başlangıçta hastaların %96'sında 0 ya da 1 bulunmuştur. Hastaların
%67'sinde başlangıçta beyin metastazları vardır. 139 hastanın %20'si daha önce krizotinib dışında bir ALK TKİ kullanmışken %47'si daha önce 2 ALK TKİ, %33'ü ise 3 ya da daha fazla ALK TKİ almıştır.
A Çalışmasının başlıca etkililik sonuçları Tablo 4 ve 5'te yer almaktadır.
Tablo 4. A Çalışmasında önceki tedaviye göre genel etkililik sonuçları
Etkililik parametresi | Daha önce kemoterapi ile ya da tek başına bir ALK TKİáµ (N=28) | Daha önce kemoterapi ile ya da tek başına iki ya da daha fazla ALK TKİ (N=111) |
Objektif yanıt oranıáµ (%95 GA) Tam yanıt, n Kısmi yanıt, n | %42,9 (24,5 - 62,8) 1 11 | %39,6 (30,5 - 49,4) 2 42 |
Yanıtın süresi Medyan, ay (%95 GA) |
5,6 (4,2 - NR) |
9,9 (5,7 - 24,4) |
Progresyonsuz sağkalım Medyan, ay (%95 GA) |
5,5 (2,9 - 8,2) |
6,9 5,4 - 9,5 |
Kısaltmalar: ALK= anaplastik lenfoma kinaz; GA=güven aralığı; ICR=Bağımsız Merkezi İnceleme; N/n=hasta sayısı; NR= erişilmedi; TKI= tirozin kinaz inhibitör.
áµ Alektinib, brigatinib ya da seritinib. áµ ICR'ye göre
Tablo 5. A Çalışmasında önceki tedaviye göre intrakranyal* etkililik sonuçları
Etkililik parametresi | Daha önce kemoterapi ile ya da tek başına bir ALK TKİáµ (N=9) | Daha önce kemoterapi ile ya da tek başına iki ya da daha fazla ALK TKİ (N=48) |
Objektif yanıt oranıáµ (%95 GA) Tam yanıt, n Kısmi yanıt, n | %66,7 (29,9 - 92,5) 2 4 | %52,1 (37,2 â 66,7) 10 15 |
İntrakranyal yanıtın süresi Medyan, ay (%95 GA) |
NR (4,1- NR) |
12,4 (6 - NR) |
Kısaltmalar: ALK= anaplastik lenfoma kinaz; GA=güven aralığı; ICR=Bağımsız Merkezi İnceleme; N/n=hasta sayısı; NR= erişilmedi; TKI= tirozin kinaz inhibitör.
*Başlangıçta en az bir ölçülebilir beyin metastazı olan hastalarda. áµ Alektinib, brigatinib ya da seritinib.
áµ ICR'ye göre
139 hastadan oluşan genel etkililik popülasyonunda ICR'ye göre 56 hastada doğrulanmış objektif yanıt alınmış, medyan TTR 1,4 ay (aralık: 1,2 - 16,6 ay) olmuştur. ORR Asyalı popülasyonda %49,1 (%95 GA: 35,1 - 63,2) ve Asyalı olmayan popülasyonda %31,5 (%95 GA: 21,1 - 43,4) olmuştur. Doğrulanmış objektif İK tümör yanıtı olan ve ICR'ye göre başlangıçta en az bir ölçülebilir beyin metastazı olan 31 hastada medyan İK-TTR 1,4 ay (aralık= 1,2 - 16,2 ay) olmuştur. İK-ORR Asyalı popülasyonda %54,5 (%95 GA: 32,2- 75,6) ve Asyalı olmayan
popülasyonda %46,4 (%95 GA: 27,5 - 66,1) olmuştur.
5.2. Farmakokinetik özellikler
Emilim
Lorlatinibin pik plazma konsantrasyonlarına hızla erişilmekte olup 100 miligramlık tek dozu takiben medyan T1,2 saat ve günde bir kez 100 g dozunda birden fazla kez verildiğinde ise 2 saat bulunmuştur.
İntravenöz uygulama ile karşılaştırıldığında lorlatinib tabletlerin oral yolla verilmesinden sonra ortalama mutlak biyo-yararlılığı %80,8 (%90 GA: 75,7 - 86,2) olmuştur.
Lorlatinibin yüksek yağ ve yüksek kalori içeren bir yemekle birlikte verilmesi aç karnına verilmesine göre kan seviyelerini %5 arttırmıştır.
Lorlatinib tok ya da aç karnına verilebilir.
Kanser hastalarında günde bir kez 100 mg dozda uygulandığında; geometrik ortalama (% varyasyon katsayısı [CV]) pik plazma konsantrasyonu 577 (42) ng/ml ve EAA5,650 (39) ngÎsaat/ml bulunmuştur. Geometrik ortalama (% CV) oral klirens 17,7 (39) l/saat bulunmuştur.
Dağılım
Lorlatinib insan plazma proteinlerine in vitro %66 oranında bağlanmakta olup albümine ya da α-asit glikoproteine orta derecede bağlanmaktadır.
Biyotransformasyon
İnsanlarda lorlatinib birincil metabolik yolaklar olarak oksidasyona ve glukuronidasyona uğramaktadır. İn vitro veriler lorlatinibin birincil olarak CYP3A4 ve UGT1A4 tarafından metabolize edildiğini ve CYP2C8, CYP2C19, CYP3A5 ve UGT1A3'ün minör katkıda bulunduğunu göstermektedir.
Plazmada lorlatinibin amid ve aromatik bağlarının oksidatif ayrışmasından kaynaklanan bir
benzoik asit metaboliti majör metabolit olarak belirlenmiş olup dolaşımdaki radyoaktivitenin
%21'inden sorumludur. Oksidatif ayrışma ile oluşan metabolit farmakolojik olarak inaktiftir.
Eliminasyon
Tek bir 100 miligramlık dozdan sonra lorlatinibin plazma yarı ömrü 23,6 saattir. Otoindüksiyonun tamamlanmasını takiben kararlı durumdaki tahmini lorlatinib efektif plazma yarı ömrü 14,83 saattir. 100 miligramlık radyoaktif etiketli lorlatinib dozun oral yolla verilmesini takiben radyoaktivitenin ortalama %47,7'si idrardan, %40,9'u feçesten ve genelde ortalama %88,6'sı geri kazanılmıştır.
Değişmemiş lorlatinib insan plazmasında ve feçeste belirlenen majör bileşendir ve toplam radyoaktivitenin sırasıyla %44'ü ve %9,1'ini oluşturmaktadır. Lorlatinibin %1'inden azı idrarda değişmemiş olarak saptanmıştır.
Ayrıca lorlatinib insan pregnan-X-reseptörü (PXR) ve insan yapısal androstan reseptörü (CAR) aracılığıyla bir indükleyicidir.
Doğrusallık/Doğrusal Olmayan durum
Tek dozda maruz kalınan lorlatinib seviyesi (EAAve C) 10 mg ile 200 mg doz aralığında doza bağlı olarak artmıştır. 10 mg ile 200 mg doz aralığı dışında az miktarda veri mevcuttur; bununla birlikte tek dozdan sonra EAAve Ciçin doğrusallıktan sapma olmamıştır.
Günde bir kez doz birden fazla kez verildiğinde lorlatinib Cdozla orantılı olarak artmıştır ve EAAgünde10 mg ile 200 mg doz aralığı dışında dozlarda hafifçe daha az orantılı olarak artmıştır.
Aynı şekilde kararlı durumda maruz kalınan plazma lorlatinib seviyeleri tek doz farmakokinetiği için beklenenden daha düşüktür ve bu da net zamana bağlı otoindüksiyon etkisini göstermektedir.
Hastalardaki Karakteristik Özellikler
Karaciğer yetmezliği
Lorlatinibin karaciğerde metabolize edilmesi nedeniyle karaciğer yetmezliği lorlatinibin plazma konsantrasyonlarını yükseltme olasılığını arttırmaktadır. Yapılan klinik çalışmalar AST ya da ALT seviyelerinin normalin üst seviyesinin 2,5 katından fazla olduğu ya da artış altta yatan kansere bağlıysa normalin üst seviyesinin 5 katından fazla olduğu ya da total bilirübin seviyesinin normalin üst seviyesinin 1,5 katından fazla olduğu hastaları dışlamıştır. Popülasyon farmakokinetik analizleri maruz kalınan lorlatinib maruziyetinin hafif karaciğer yetmezliği olan hastalarda klinik olarak anlamlı ölçüde değişmediğini göstermiştir (n = 50). Hafif karaciğer yetmezliği olan hastalar için doz ayarlamaları önerilmemektedir. Orta ya da ağır karaciğer yetmezliği olan hastalar hakkında bilgi yoktur.
Böbrek yetmezliği
Verilen dozun %1'inden azı idrarda değişmemiş lorlatinib olarak saptanmaktadır. Popülasyon farmakokinetik analizleri lorlatinib kararlı durum plazma maruziyet seviyesinin ve Cdeğerinin kötüleşen bazal böbrek fonksiyonu ile hafif arttığını göstermiştir. Bir böbrek yetmezliği çalışmasına dayanarak, hafif veya orta şiddetteki böbrek yetmezliği olan hastalar için başlangıç dozunda ayarlama yapılması önerilmemektedir [Böbrek Hastalığı Çalışmasında Diyet Modifikasyonu'na (MDRD) göre türetilen eGFR; eGFR (mL/dak/1,73 m) Ã ölçülen vücut yüzey alanı/1,73 ≥ 30 mL/dk]. Bu çalışmada, lorlatinib EAA, ağır böbrek yetmezliği olan hastalarda (mutlak eGFR < 30 mL/dk), böbrek fonksiyonu normal olan gönüllülere (mutlak eGFR ≥ 90 mL/dak) kıyasla %41 artmıştır. Ağır böbrek yetmezliği olan hastalarda lorlatinib dozunun azaltılması önerilir, örneğin günde bir kez 75 mg oral başlangıç dozu (bkz. Bölüm 4.2). Renal diyaliz hastaları için bilgi mevcut değildir.
Yaş, cinsiyet, ırk, vücut ağırlığı ve fenotip
İleri evre KHDAK olan ve sağlıklı gönüllülerde yapılan popülasyon farmakokinetik analizleri CYP3A5 ve CYP2C19 için yaşın, cinsiyetin, ırkın, vücut ağırlığının ve fenotipin klinik olarak anlamlı etkileri olmadığını göstermiştir.
Kardiyak elektrofizyoloji
A Çalışmasında 2 hastanın (%0,7) mutlak Fridericia düzeltme QTc (QTcF) değerleri> 500 milisaniye olmuş ve 5 hastada (%1,8) QTcF değişikliği başlangıca göre> 60 milisaniye olmuştur.
Ayrıca, tek bir oral doz lorlatinibin (50 mg, 75 mg ve 100 mg) günde bir kez 200 mg itrakonazol ile ve tek başına etkisi 16 sağlıklı gönüllüde 2 yönlü çapraz bir çalışmada değerlendirilmiştir. Bu çalışmada gözlenen ortalama lorlatinib konsantrasyonlarında ortalama QTc değerlerinde artış gözlenmemiştir.
A Çalışmasında önerilen 100 miligramlık dozda lorlatinib alan ve bir EKG incelemesi bulunan 295 hastadan QTc aralığının> 470 milisaniye olan hastaların dışlandığı bir popülasyonda lorlatinib değerlendirilmiştir. Çalışma popülasyonunda PR aralığında başlangıca göre maksimum ortalama değişiklik 16,4 milisaniye (2 yönlü %90 üst GA 19,4 milisaniye) (Bkz.
Bölümler 4.2, 4.4 ve 4.8) olmuştur. Bu hastalardan yedisinde başlangıç PR> 200 milisaniyedir. PR aralığının <200 milisaniye olduğu 284 hastanın %14'ünde lorlatinib başlandıktan sonra PR aralığında uzama ≥ 200 milisaniye olmuştur. PR aralığındaki uzama konsantrasyona bağımlı bir şekilde oluşmuştur. Hastaların %1'inde atriyoventriküler blok oluşmuştur.
PR uzaması gelişen hastalarda doz değişikliği gerekebilir (Bkz Bölüm 4.2).
5.3. Klinik öncesi güvenlilik verileri
Tekrarlayan doz toksisitesi
Önerilen pozolojide insanda maruz kalınan klinik seviyelere eşdeğer dozda gözlenen başlıca toksisiteler çeşitli dokularda inflamasyon (sıçanlarda deri ve servikste, köpeklerde akciğerde, trakea, deride, lenf bezlerinde ve/veya mandibuler kemik dahil ağız boşluğunda; beraberinde beyaz kan hücreleri, fibrinojen ve/veya globülin seviyesinde artış ve albümin seviyesinde azalmalar) ve pankreas (beraberinde amilaz ve lipaz seviyelerinde artış), hepatobiliyer sistem (beraberinde karaciğer enzimlerinde artışlar), erkek üreme sistemi, kardiyovasküler sistem, böbrekler ve gastrointestinal sistem, periferik sinirler ve MSS (bilişsel fonksiyonda bozulma) değişiklikleri olmuştur. Hayvanlarda akut dozlama sonrası (Cdeğerine göre tek doz 100
mg ile insanda klinik olarak maruz kalınan seviyenin yaklaşık 2,6 katı) kan basıncında ve kalp atım hızında ve QRS kompleksinde ve PR aralığında değişiklikler de gözlenmiştir. Karaciğer safra kanalı hiperplazisi dışında tüm hedef organ bulguları tamamıyla geri dönüşlüdür.
Genotoksisite
Lorlatinib in vitro ve in vivo olarak mutajenik değildir ancak anöjenik olup EAA'ya göre 100 mg ile insan klinik olarak maruz kalınan seviyenin yaklaşık 16,5 katı ile anöjenisite üzerinde herhangi bir seviyede etki gözlenmemiştir.
Karsinojenisite
Lorlatinib ile Karsinojenisite çalışmaları yapılmamıştır. Üreme toksisitesi
Sıçanda ve köpekte seminifer tübüler dejenerasyon ve/veya testis atrofisi ve epididim değişiklikleri (inflamasyon ve/veya vaküolleşme) gözlenmiştir. Önerilen pozolojide insanda maruz kalınan seviyelere eşdeğer dozda köpeklerde prostatta minimal-hafif glandüler atrofi gözlenmiştir. Erkek üreme organlarında etkiler kısmen ya da tamamen geri dönüşlüdür.
Sıçanlarda ve tavşanlarda yapılan embriyofetal toksisite çalışmalarında embriyo ölümü ve düşük fetüs ağırlığı ve malformasyonlar gözlenmiştir. Fetüsteki morfolojik anormallikler arasında kol ve bacaklarda rotasyon, parmak sayısında artış, gastroşizis, böbrek malformasyonu, kubbe kafa, yüksek damak ve beyin ventriküllerinde genişleme vardır. EAA'ya göre hayvanlarda embriyofetal etkilerin geliştiği en düşük dozlarla maruz kalınan seviye 100 mg dozu ile insanda klinik olarak maruz kalınan seviyeye eşdeğerdir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Çekirdek tablet:
Mikrokristalin Selüloz
Dibazik Kalsiyum Fosfat, Susuz Sodyum Nişasta Glikolat Magnezyum stearat
Film kaplama
HPMC 2910/Hipromelloz
Laktoz Monohidrat (sığır kaynaklı) Macrogol 4000/PEG 3350 Triasetin
Titanyum Dioksit
Ferrozoferrik Oksit/Siyah Demir Oksit Demir Oksit Kırmızı
6.2. Geçimsizlikler
Geçerli değil
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
10 film kaplı tablet içeren alüminyum folyo arka kaplama materyali olan OPA/Al/PVC folyo
blister
Ambalaj büyüklükleri:
25 mg: 30, 60, 100, 120 film kaplı tablet: Her biri 10 tablet içeren sırasıyla 3, 6, 10, 12 blister
içeren kutular
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel gereklilikler bulunmamaktadır.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliği' ve âAmbalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 30398.57 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 30398.57 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308092007 |
| Etkin Madde | Lorlatinib |
| ATC Kodu | L01ED05 |
| Birim Miktar | 25 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |