LYNPARZA 100 mg film kaplı tablet (56 tablet) Kısa Ürün Bilgisi
{ Olaparib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
LYNPARZATM 100 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Olaparib 100 mg
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Bir yüzünde âOP100â baskısı bulunan, diğer yüzü düz, sarı ila koyu sarı renkli, oval, bikonveks tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
LYNPARZA aşağıdakiler için endikedir:
Over kanseri Monoterapi olarak;
ilerlemiş (FIGO evre III ve IV) BRCA1/2-mutasyonlu (germ hattı ve/veya somatik) yüksek dereceli epitelyal over, fallop tüpü veya primer peritoneal kanser görülen ve birinci basamak platin bazlı kemoterapinin tamamlanmasını takiben tam ya da kısmi yanıt alınan yetişkin hastalara uygulanan idame tedavisinde,
daha önce platin içeren kemoterapi sonrası relaps gelişen platin duyarlı (Platin duyarlılığı son tedavi dozundan en az 6 ay ve üzerinde relaps gelişen hastalardır.) BRCA mutasyonu (BRCA1/2 mutasyonu, akreditasyon almış bir laboratuvarda çalışılmış olmalıdır.) pozitif olan yüksek dereceli epitelyal over tümörü, fallop tüpü veya primer peritoneal kanserli hastaların platin içeren ikinci basamak tedavisi sonrası idame tedavisinde endikedir.
Bevasizumabla kombinasyon halinde
ilerlemiş (FIGO evre III ve IV) yüksek dereceli seröz epitelyal over kanseri, fallop tüpü kanseri veya primer peritoneal kanser görülen ve birinci basamak platin bazlı kemoterapi ve bevasizumab kombinasyon tedavisinin tamamlanmasını takiben yanıt veren (tam veya kısmi) ve ECOG Performans durumu 0-1 olan yetişkin hastalara bevasizumabla kombinasyon halinde uygulanan idame tedavisinde progresyona kadar veya en fazla 24 ay süreyleendikedir.
Meme kanseri
LYNPARZA, germline BRCA 1 veya 2 mutasyonu olan triple negatif yüksek riskli (Neoadjuvan tedavi sonrası patolojik rezidüel hastalığı olanlar veya primer cerrahisini olmuş ve patolojik olarak tümör çapı 2 cm üstünde yada lenf nodu pozitif olan adjuvan tedavisini almış hastalar) erken evre meme kanserinde lokal tedaviler ve antrasiklin ve/veya taksan içeren adjuvan/neoadjuvan kemoterapi tamamlandıktan sonra monoterapi halinde maksimum 1 yıl süreyle endikedir.
LYNPARZA, germ hattı BRCA1 veya 2 mutasyonlarına sahip olan, HER2 negatif metastatik meme kanseri olan yetişkin hastalarının tedavisinde monoterapi olarak endikedir. Hastalar, bu tedavi için uygun olmaları durumunda, daha önce (neo)adjuvan veya metastatik ortamda bir antrasiklin ve bir taksan ile tedavi görmüş olmalı ve (neo) adjuvan platin temelli bir tedavi almışlarsa son tedaviden itibaren 12 ay geçmiş olmalıdır (bkz. bölüm 5.1).
Hormon reseptörü (HR) pozitif meme kanseri görülen hastalar aynı zamanda önceki endokrin tedavisi sırasında veya sonrasında progresyon göstermiş olmalıdır veya endokrin tedavisi için uygun olmadıkları yönünde değerlendirme yapılmış olmalıdır.
Pankreas adenokarsinomu
LYNPARZA, birinci basamak platin bazlı kemoterapiyi en az 16 hafta kullanıp hastalığı progresyon göstermeyen, germ hattı BRCA1/2-mutasyonlu, metastatik pankreas adenokarsinomlu, ECOG Performans durumu 0-1 olan yetişkin hastalarının idame tedavisinde monoterapi olarak endikedir.
Prostat kanseri
LYNPARZA, metastatik kastrasyona dirençli prostat kanserinde önceki enzalutamid veya abireteron tedavisine progresyon göstermiş ve BRCA1,2 veya ATM mutasyonu olan yetişkin hastaların tedavisinde monoterapi olarak endikedir.
4.2. Pozoloji ve uygulama şekli
LYNPARZA ile tedavi, anti-kanser tıbbi ürünlerin kullanımında deneyimli bir hekim tarafından başlatılmalı ve takip edilmelidir.
Hasta Seçimi
BRCA mutasyonlu ileri over kanserinin birinci basamak idame tedavisi:
Yüksek dereceli epitelyal over kanseri (EOK), fallop tüpü kanseri (FTK) veya primer peritoneal kanserin (PPK) birinci basamak idame tedavisi için LYNPARZA tedavisi başlatılmadan önce hastaların meme kanserine duyarlılık genleri (BRCA) 1 veya 2'de patojen veya olası patojen germ hattı ve/veya somatik mutasyonlara sahip olduğu valide edilmiş bir test kullanılarak doğrulanmalıdır.
Platine duyarlı relaps yapmış over kanserinin idame tedavisi:
Platin bazlı tedaviye tam veya kısmi yanıt veren hastalarda, relaps yapmış EOK, FTK veya PPK'nin idame tedavisinde monoterapi olarak LYNPARZA kullanılmasından önce hastaların
meme kanserine duyarlılık genleri (BRCA) 1 veya 2'de patojen veya olası patojen germ hattı ve/veya somatik mutasyonlara sahip olduğu valide edilmiş bir test kullanılarak doğrulanmalıdır.
Bevasizumab ile kombinasyon halinde over kanserinin birinci basamak idame tedavisi:
Bevasizumabla birlikte birinci basamak platin bazlı kemoterapinin tamamlanmasını takiben yanıt veren (tam veya kısmi) hastalarda EOK, FTK veya PPK'nin birinci basamak tedavisinde bevasizumabla kombinasyon halinde LYNPARZA için meme kanserine duyarlılık genleri (BRCA1/2 ) testi yapılmasına gerek yoktur.
Germline BRCA-mutasyonlu yüksek riskli erken meme kanserinin adjuvan tedavisi
Triple negatif, yüksek riskli erken meme kanserinin adjuvan tedavisi için Lynparza başlanmadan önce hastalarda geçerli bir test ile zararlı veya zararlı olduğundan şüphe edilen gBRCA1/2 mutasyonu doğrulanmalıdır (bkz. Bölüm 5.1).
gBRCA1/2-mutasyonlu HER2-negatif metastatik meme kanseri:
Germline meme kanseri duyarlılık genleri (gBRCA1/2) mutasyona uğramış insan epidermal büyüme faktörü reseptörü 2 (HER2)-negatif metastatik meme kanseri için, LYNPARZA tedavisine başlanmadan önce hastalarda zararlı veya şüpheli zararlı bir gBRCA1/2 mutasyonu doğrulanmalıdır. gBRCA1/2 mutasyon durumu, onaylanmış bir test yöntemi kullanılarak deneyimli bir laboratuvar tarafından belirlenmelidir. Meme kanserinde tümör BRCA1/2 testlerinin klinik doğrulamasını gösteren veriler şu anda mevcut değildir.
BRCA mutasyonlu metastatik pankreas adenokarsinomunun birinci basamak idame tedavisi:
Germ hattı gBRCA1/2 mutasyonlu metastatik pankreas adenokarsinomunun birinci basamak tedavisi için LYNPARZA tedavisi başlatılmadan önce hastaların patojenik veya olası patojenik bulunan gBRCA1/2 mutasyonuna sahip olduğu doğrulamalıdır. gBRCA1/2 mutasyonu durumu deneyimli bir laboratuvar tarafından valide edilmiş bir test yöntemi kullanılarak belirlenmelidir.
BRCA1/2 ya da ATM genlerinde mutasyona uğramış metastatik kastrasyona dirençli prostat kanseri:
BRCA1,2 ya da ATM genlerinde mutasyonlu metastatik kastrasyona dirençli prostat kanserinde (mCRPC) LYNPARZA tedavisine başlanmadan önce hastaların homolog rekombinasyon onarım geni mutasyonu doğrulanmalıdır (bir doku örneğinden alınan tümör DNA'sı veya bir plazma örneğinden alınmış ctDNA veya kan ya da başka bir tümör dışı örnekten elde edilmiş germ hattı DNA'sı kullanılarak). HRR genetik durumu, deneyimli bir laboratuvar tarafından valide edilmiş bir test yöntemi kullanılarak belirlenmelidir.
![]()
Eğer uygulanabilir ise BRCA1/2 veya ATM genlerindeki mutasyonlar açısından test uygulanan hastalara yönelik genetik danışmanlık yerel düzenlemelere uygun şekilde verilmelidir.
Pozoloji/uygulama sıklığı ve süresi:
LYNPARZA, 100 mg ve 150 mg'lık tabletler halinde mevcuttur.
LYNPARZA'nın önerilen dozu, 600 mg'lık toplam günlük doza karşılık gelecek şekilde günde iki kez alınan 300 mg'dır (iki adet 150 mg tablet). 100 mg tablet, dozun azaltılması için kullanılmalıdır.
LYNPARZA monoterapi:
Platin bazlı kemoterapiye (tam veya kısmi) yanıt veren platine duyarlı nükseden (PSR) yüksek dereceli epitelyal over, fallop tüpü veya primer periton kanseri olan hastalar, platin içeren rejimin son dozu tamamlandıktan en geç 8 hafta sonra LYNPARZA ile tedaviye başlamalıdır.
Bevasizumabla kombinasyon halinde LYNPARZA
Bevasizumabla birlikte uygulanan birinci basamak platin bazlı tedavinin tamamlanmasını takiben yüksek dereceli epitelyal over kanserine, fallop tüpü kanserine veya primer peritoneal kansere yönelik birinci basamak idame tedavisinde LYNPARZA ile bevasizumab kombinasyonu uygulanırken hastalar bevasizumabla kombinasyon halinde LYNPARZA tedavisine son kemoterapi dozlarının tamamlanmasından en az 3 hafta ve en fazla 9 hafta sonra başlamalıdır. LYNPARZA bevasizumab ile kombinasyon halinde kullanılacak olduğunda önerilen dozaj bilgisi için bevasizumaba ilişkin ürün bilgisine başvurun (bkz. bölüm 5.1).
Endokrin tedavi ile kombinasyonda LYNPARZA
Önerilen pozoloji için endokrin tedavi kombinasyonu bileşenlerinin (aromataz inhibitörü/anti- östrojen ajan ve/veya LHRH) ürün bilgisine başvurun.
gBRCA1/2 mutasyonlu metastatik pankreas adenokarsinomu görülen hastalar LYNPARZA tedavisine birinci basamak platin bazlı kemoterapilerinin son dozunun tamamlanmasından en geç 8 hafta sonra başlamalıdır.
Tedavi süresi
BRCA mutasyonlu ilerlemiş over kanserinin birinci basamak idame tedavisi:
Tedavi marker yüksekliği ve/veya radyolojik hastalık progresyonu veya kabul edilemez toksisite gelişene kadar verilebilir. Maksimum tedavi süresi 2 yıldır.
BRCA mutasyonlu platine duyarlı relaps yapmış over kanserinin idame tedavisi:
BRCA mutasyonlu platine duyarlı relaps yapmış yüksek dereceli epitelyal over, fallop tüpü veya primer peritoneal kanser görülen hastalarda tedavinin altta yatan hastalığın progresyonuna veya kabul edilemez toksisiteye kadar sürdürülmesi önerilmektedir.
BRCA mutasyonlu metastatik pankreas adenokarsinomunun birinci basamak idame tedavisi: Altta yatan hastalığın progresyonuna veya kabul edilemez toksisiteye kadar tedaviye devam edilmesi önerilmektedir.
BRCA1/2 veya ATM -geni mutasyonlu metastatik kastrasyona dirençli prostat kanseri:
Altta yatan hastalığın progresyonuna veya kabul edilemez toksisiteye kadar tedaviye devam edilmesi önerilmektedir. Cerrahi kastrasyon uygulanmış olmayan hastalarda tedavi sırasında lüteinizan hormon salgılatıcı hormon (LHRH) analogu kullanılarak ilaçla kastrasyona devam edilmelidir.
İlerlemiş over kanserinin bevasizumab ile kombinasyon halinde birinci basamak idame tedavisi:
Hastalar radyolojik hastalık progresyonu, kabul edilemez toksisite veya 2 yıl tedaviden sonra radyolojik hastalık kanıtı yoksa 2 yıla kadar tedaviye devam edebilir. Tedaviyi uygulayan doktorun görüşüne göre devam eden LYNPARZA tedavisinden ilave yarar elde edebilecek olan ve 2. yılda hastalık kanıtı sergileyen hastalara 2 yıldan daha uzun süre tedavi uygulanabilir. LYNPARZA bevasizumab ile kombinasyon halinde kullanılacak olduğunda önerilen tedavi süresi için bevasizumaba ilişkin ürün bilgisine başvurun (bkz. bölüm 5.1).
Over kanseri hastalarında ilk veya sonraki relapsı takiben LYNPARZA ile tekrar idame tedavisi uygulanması konusunda herhangi bir etkililik veya güvenlilik verisi yoktur (bkz. bölüm 5.1).
Germline BRCA-mutasyonlu, yüksek riskli meme kanserinin adjuvan tedavisi
Hastaların 1 yıla veya hastalık nüksüne veya kabul edilemez toksisite gelişimine dek, hangisi önce gerçekleşirse, tedavi edilmesi önerilir.
gBRCA1/2-mutasyonlu HER2-negatif metastatik meme kanseri:
Altta yatan hastalık veya kabul edilemez toksisitenin ilerlemesine kadar tedaviye devam edilmesi önerilir.
Dozun unutulması
Eğer hastalar bir LYNPARZA dozunu almayı unuturlarsa, bir sonraki normal dozu planlı saatinde almalıdır.
Advers reaksiyonlar için doz ayarlamaları
Bulantı, kusma, diyare ve anemi gibi advers reaksiyonların yönetimi için tedaviye ara verilebilir ve dozun azaltılması düşünülebilir (bkz. Bölüm 4.8).
Önerilen doz azaltımı günde iki kez 250 mg'dır (bir adet 150 mg tablet ve bir adet 100 mg tablet; 500 mg'lık toplam günlük doza eşdeğer).
Eğer dozun daha fazla azaltılması gerekirse, günde iki kez 200 mg'a (iki adet 100 mg tablet; 400 mg'lık toplam günlük doza eşdeğer) azaltılması önerilir.
CYP3A inhibitörleri ile eşzamanlı uygulama için doz ayarlamaları
LYNPARZA'nın güçlü veya orta derecede güçlü CYP3A inhibitörleri ile eşzamanlı uygulanması önerilmemektedir ve alternatif ilaçlar düşünülmelidir. Eğer güçlü bir CYP3A inhibitörü ile eşzamanlı kullanılması gerekiyorsa, LYNPARZA dozunun günde iki kez 100 mg'a (bir adet 100 mg tablet; 200 mg'lık toplam günlük doza eşdeğer) azaltılması önerilir. Eğer orta derece güçlü bir CYP3A inhibitörü ile eşzamanlı kullanılması gerekiyorsa, LYNPARZA dozunun günde iki kez 150 mg'a (bir adet 150 mg tablet; 300 mg'lık toplam günlük doza eşdeğer) azaltılması önerilir (bkz. Bölüm 4.4 ve Bölüm 4.5).
Uygulama şekli:
LYNPARZA oral kullanım içindir.
LYNPARZA tabletler bütün halde yutulmalı ve çiğnenmemeli, ezilmemeli, çözülmemeli ve bölünmemelidir. LYNPARZA tabletler aç veya tok karnına alınabilir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
LYNPARZA'nın önerilen dozu günde iki kez 200 mg'dır (iki adet 100 mg tablet; 400 mg'lık toplam günlük doza eşdeğer) (bkz. Bölüm 5.2).
LYNPARZA, hafif derecede böbrek yetmezliği (kreatinin klirensi 51 ila 80 mL/dk) olan hastalara herhangi bir doz ayarlaması yapılmadan uygulanabilir.
LYNPARZA'nın ağır derecede böbrek yetmezliği ya da son evre böbrek hastalığı (kreatinin klirensi ≤30 mL/dk) olan hastalarda kullanımı, bu hastalardaki güvenlilik ve etkililik çalışılmamış olduğundan önerilmemektedir. LYNPARZA ağır derecede böbrek yetmezliği olan hastalarda ancak beklenen yarar, muhtemel risklere ağır bastığı takdirde kullanılabilir ve hasta böbrek fonksiyonları ve advers olaylar açısından dikkatle izlenmelidir.
Karaciğer yetmezliği:
LYNPARZA, hafif ve orta derecede karaciğer yetmezliği (Child-Pugh A veya B Sınıfı) olan hastalara herhangi bir doz ayarlaması yapılmadan uygulanabilir (bkz. Bölüm 5.2). LYNPARZA'nın ağır derecede karaciğer yetmezliği (Child-Pugh C Sınıfı olan hastalarda kullanılması, bu hastalardaki güvenliliği ve etkililiği çalışılmamış olduğundan önerilmemektedir.
Pediyatrik popülasyon:
LYNPARZA'nın çocuklarda ve adolesanlarda güvenliliği ve etkililiği belirlenmemiştir. Veri mevcut değildir.
Geriyatrik popülasyon:
Yaşlılar için başlangıç dozunda herhangi bir ayarlama gerekmemektedir.
Diğer:
Beyaz ırka mensup olmayan hastalar:
Beyaz ırka mensup olmayan hastalarda sınırlı klinik veri mevcuttur. Bununla birlikte etnik kökene dayalı herhangi bir doz ayarlaması gerekmemektedir (bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
Olaparibe veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılıkta ya da,
Tedavi sırasında ve son doz alındıktan sonra 1 ay boyunca emzirmede (bkz. Bölüm 4.6).
4.4. Özel kullanım uyarıları ve önlemleri
Hematolojik toksisite
LYNPARZA ile tedavi edilen hastalarda, genellikle hafif veya orta şiddetli (CTCAE derece 1 veya 2) anemi, nötropeni, trombositopeni ve lenfopeninin klinik tanılarını ve/veya laboratuvar bulgularını içeren hematolojik toksisite bildirilmiştir. Önceki anti-kanser tedavisinin neden olduğu hematolojik toksisiteleri düzelene kadar (hemoglobin, trombosit ve nötrofil düzeyleri
≤ CTCAE derece 1 olmalıdır) hastaların LYNPARZA ile tedaviye başlamamaları gerekir. Tedavi sırasında herhangi bir parametredeki klinik olarak anlamlı değişikliklerin izlenebilmesi için tedavi öncesi (başlangıç) tam kan sayımı, bunu takiben tedavinin ilk 12 ayı süresince aylık takip ve ardından periyodik takip önerilir (bkz. Bölüm 4.8).
LYNPARZA uygulamasına ara verildikten 4 hafta sonra kan parametreleri halen klinik olarak anormal seyrediyorsa, kemik iliği analizi ve/veya kan sitogenetik analizi önerilir.
Miyelodisplastik Sendrom/Akut Miyeloid Lösemi (MDS/AML)
LYNPARZA monoterapisi ile yapılan klinik çalışmalarda tedavi edilen hastalarda, uzun süreli sağkalım takibi de dahil olmak üzere, miyelodisplastik sendrom/akut miyeloid löseminin (MDS/AML) genel insidansı < %1,5 olup bu insidans, önceden en az iki basamak platin kemoterapi almış ve 5 yıl boyunca takip edilmiş BRCAm platin duyarlı nüks etmiş yumurtalık kanseri hastalarında daha yüksektir (bkz. bölüm 4.8). Olayların çoğu ölümle sonuçlanmıştır. MDS/AML gelişen hastalarda olaparib ile tedavi süresi <6 ay ile >4 yıl arasında değişmiştir.
MDS/AML'den şüpheleniliyorsa, hasta kemik iliği analizi ve sitogenetik için kan numunesi alınması dahil olmak üzere ileri araştırmalar için bir hematoloğa sevk edilmelidir. Uzun süreli hematolojik toksisite araştırmasının ardından MDS/AML doğrulanırsa, LYNPARZA kesilmeli ve hasta uygun şekilde tedavi edilmelidir.
Venöz Tromboembolik Olaylar
LYNPARZA ile tedavi edilen hastalarda ağırlıklı olarak pulmoner emboli olayları olmak üzere venöz tromboembolik olaylar meydana gelmiştir ve tutarlı bir klinik paterni yoktur. Diğer onaylanmış endikasyonlarla karşılaştırıldığında, aynı zamanda androjen deprivasyon tedavisi alan metastatik kastrasyona dirençli prostat kanseri olan hastalarda daha yüksek bir insidans gözlenmiştir (bkz. bölüm 4.8). Hastalar venöz tromboz ve pulmoner emboli klinik belirtileri ve semptomları açısından izlenmeli ve tıbbi açıdan uygun şekilde tedavi edilmelidir. Daha önce VTE öyküsü olan hastalar daha fazla risk altında olabilir ve uygun şekilde izlenmelidir.
Pnömonit
Ölümle sonuçlanan olayları da içeren pnömonit, klinik çalışmalarda LYNPARZA ile tedavi edilen hastaların <%1,0'ında bildirilmiştir. Pnömonit bildirimlerinde tutarlı bir patern yoktur ve bir dizi yatkınlık oluşturucu faktör (akciğer kanseri ve/veya akciğerlere metastazlar, altta yatan pulmoner hastalık, sigara öyküsü ve/veya önceden kemoterapi ve radyoterapi almış olmak) değerlendirmeyi güçleştirmiştir. LYNPARZA klinik çalışmalarda (güvenlik havuzundan değerlendirilen) diğer tedaviler ile kombinasyon halinde kullanıldığında, ölümcül sonuçları olan olaylar görülmüştür. Hastalarda dispne, öksürük ve ateş gibi yeni veya kötüleşen respiratuvar semptomlar gelişirse ya da anormal göğüs radyolojik bulgusu gözlenirse, LYNPARZA tedavisine ara verilmeli ve derhal inceleme başlatılmalıdır. Eğer pnömonit doğrulanırsa, LYNPARZA tedavisi kesilmeli ve hastalar uygun şekilde tedavi edilmelidir.
Embriyofetal toksisite
Etki mekanizmasına (PARP inhibisyonu) dayanılarak, LYNPARZA, gebe kadınlara uygulandığında fetal zarara neden olabilir. Sıçanlar üzerinde yürütülen klinik dışı çalışmalar olaparibin embriyofetal sağkalım üzerinde advers etkiler gösterdiğini ve günde iki kez 300 mg olarak önerilen insan dozunda beklenenlerin altındaki maruziyetlerde majör fetal malformasyonları tetiklediğini göstermiştir.
Gebelik/Kontrasepsiyon
Lynparza gebelik sırasında kullanılmamalıdır. Çocuk doğurma potansiyeli olan kadınlar, Lynparza tedavisine başlamadan önce, tedavi sırasında ve son Lynparza dozunu aldıktan sonra 1 ay boyunca iki adet güvenilir kontrasepsiyon yöntemi kullanmalıdır. İki adet yüksek etkili ve tamamlayıcı kontrasepsiyon yöntemi önerilmektedir. Erkek hastalar ve çocuk doğurma potansiyeli olan kadın partnerleri, tedavi sırasında ve son Lynparza dozunu aldıktan sonra 3 ay boyunca güvenilir bir kontrasepsiyon yöntemi kullanmalıdır (bkz. Bölüm 4.6).
Etkileşimler
LYNPARZA'nın güçlü veya orta derecede güçlü CYP3A inhibitörleri ile eşzamanlı uygulanması önerilmemektedir (bkz. Bölüm 4.5). Eğer güçlü veya orta derecede güçlü bir CYP3A inhibitörü ile eşzamanlı uygulanması gerekiyorsa, LYNPARZA dozu azaltılmalıdır (bkz. Bölüm 4.2 ve Bölüm 4.5).
LYNPARZA'nın güçlü veya orta derecede güçlü CYP3A indükleyicileri ile eşzamanlı uygulanması önerilmemektedir. Eğer halihazırda LYNPARZA almakta olan bir hastanın, güçlü veya orta derecede güçlü bir CYP3A indükleyicisi ile tedavi edilmesi gerekiyorsa, hekim, LYNPARZA'nın etkisinin önemli ölçüde azalacağını bilmelidir (bkz. Bölüm 4.5).
Bu tıbbi ürün her tablette 1 mmol'den (23 mg) daha az sodyum içerir, dolayısıyla esasında âsodyum içermediğiâ kabul edilebilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakodinamik etkileşimler
DNA'ya zarar veren ilaçlar da dahil olmak üzere diğer anti-kanser ilaçları ile kombinasyon halinde olaparibin incelendiği klinik çalışmalar, miyelosupresif toksisitenin arttığına ve süresinin uzadığına işaret etmektedir. Önerilen LYNPARZA monoterapi dozu, miyelosupresif anti-kanser tıbbi ürünleri ile kombinasyon için uygun değildir.
Olaparibin aşılar veya immunosupresan ilaçlar ile kombinasyonu çalışılmamıştır. Bu nedenle, eğer bu ilaçlar LYNPARZA ile eşzamanlı kullanılıyorsa, dikkatli olunmalı ve hastalar yakından takip edilmelidir.
Farmakokinetik etkileşimler
Diğer ilaçların olaparib üzerindeki etkisi
CYP3A4/5'ler, ağırlıklı olarak olaparibin metabolik klirensinden sorumlu olan izoenzimlerdir.
kullanılacaksa günde iki kez 150 mg'a (300 mg'lık toplam günlük doza eşdeğer) azaltılması önerilir (bkz. Bölüm 4.2 ve Bölüm 4.4). Ayrıca, LYNPARZA tedavisi sırasında, bir CYP3A inhibitörü olduğundan greyfurt suyunun tüketilmemesi önerilir.
Bilinen bir CYP3A indükleyicisi olan rifampisinin etkisini değerlendirmek için yürütülen bir klinik çalışmada, olaparib ile eşzamanlı uygulama durumunda ortalama olaparib Cdeğerinin %71 (%90 GA: %76-67) ve ortalama EAA değerinin %87 (%90 GA: %89-84) azaldığı gösterilmiştir. Bu nedenle, bu enzimin bilinen güçlü indükleyicilerinin (örn., fenitoin, rifampisin, rifapentin, karbamazepin, nevirapin, fenobarbital ve sarı kantaron) LYNPARZA ile kullanılması önerilmemektedir; çünkü LYNPARZA'nın etkililiğinin önemli ölçüde azalma ihtimali bulunmaktadır. Orta ila güçlü indükleyicilerin (örn., efavirenz, rifabutin) olaparib maruziyeti üzerindeki etkilerinin boyutu belirlenmemiştir, dolayısıyla LYNPARZA'nın bu ilaçlarla birlikte uygulanması önerilmemektedir (bkz. Bölüm 4.4).
Olaparibin diğer ilaçlar üzerindeki etkileri
Olaparib in vitro olarak CYP3A4'ü inhibe eder ve in vivo olarak hafif CYP3A inhibitörü olduğu tahmin edilmektedir. Bu nedenle, duyarlı CYP3A substratları veya dar terapötik indekse sahip substratlar (örn., simvastatin, sisaprid, siklosporin, ergot alkaloidleri, fentanil, pimozid, sirolimus, takrolimus ve ketiapin) LYNPARZA ile kombine edildiğinde dikkatli olunmalıdır. Dar terapötik indekse sahip CYP3A substratları ile eşzamanlı olarak LYNPARZA kullanan hastaların uygun klinik izlemi önerilmektedir.
CYP1A2, 2B6 ve 3A4'ün indüklenmesi in vitro olarak gösterilmiştir, klinik olarak anlamlı boyutta indüklenmesi en muhtemel olan CYP2B6'dır. Olaparibin CYP2C9, CYP2C19 ve P- gp'yi indükleme potansiyeli de göz ardı edilemez. Bu nedenle, birlikte uygulandığında olaparib, bu metabolik enzimlerin substratlarına maruziyeti ve taşıyıcı proteinleri azaltabilir. Bazı hormonal kontraseptiflerin etkililiği, olaparib ile birlikte uygulandığında azalabilir (ayrıca bkz. Bölüm 4.4 ve 4.6).
In vitro olarak, olaparib, eflüks taşıyıcısı P-gp'yi (IC50 = 76µM) inhibe eder, bu nedenle, olaparib'in P-gp substratları (örn., Simvastatin, pravastatin, dabigatran, digoksin ve kolşisin) ile klinik olarak anlamlı ilaç etkileşimlerine neden olabileceği göz ardı edilemez. Eş zamanlı olarak bu tip tıbbi ürünleri alan hastalar için uygun klinik izlem önerilmektedir.
İn vitro olarak, olaparibin BCRP, OATP1B1, OCT1, OCT2, OAT3, MATE1 ve MATE2K'nin bir inhibitörü olduğu gösterilmiştir. Olaparibin BCRP (örn. metotreksat, rosuvastatin), OATP1B1 (örn. bosentan, glibenklamid, repaglinid, statinler ve valsartan), OCT1 (örn. metformin), OCT2 (örn. serum kreatinin), OAT3 (örn. furosemid ve metotreksat), MATE1 (örn. metformin) ve MATE2K (örn. metformin) substratlarına maruziyeti arttırabileceği göz ardı edilemez. Olaparib, özellikle bir statin ile kombinasyon halinde verildiğinde dikkatli olunmalıdır.
Anastrozol, letrozol ve tamoksifen ile kombinasyon
Olaparib ile anastrozol, letrozol veya tamoksifen kombinasyonunu değerlendirmek için klinik bir çalışma yapılmıştır. Anastrozol veya letrozol ile anlamlı etkileşim gözlenmezken, tamoksifen olaparibe maruziyeti % 27 oranında azaltmıştır. Bu etkinin klinik anlamlılığı bilinmemektedir. Olaparib, tamoksifenin farmakokinetiğini etkilemez.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik Kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınların, LYNPARZA tedavisi gördükleri süre boyunca gebe kalmamaları ve tedaviye başladıklarında gebe olmamaları gerekir. Tedavi öncesinde çocuk doğurma potansiyeli olan tüm kadınlara hamilelik testi yapılmalı ve tedavi süresince düzenli olarak testin yapılması göz önünde bulundurulmalıdır.
Çocuk doğurma potansiyeli olan kadınlar, Lynparza tedavisine başlamadan önce, tedavi sırasında ve son Lynparza dozunu aldıktan sonra 1 ay boyunca, seçilen kontrasepsiyon yöntemi cinsel perhiz olmadıkça, iki adet güvenilir kontrasepsiyon yöntemi kullanmalıdır (bkz. Bölüm 4.4). İki adet yüksek etkili ve tamamlayıcı kontrasepsiyon yöntemi önerilmektedir.
Olaparibin enzim indüksiyonu yoluyla CYP2C9 substratlarına maruziyeti azaltabileceği göz ardı edilemeyeceğinden, olaparib ile birlikte uygulandığında bazı hormonal kontraseptiflerin etkinliği azalabilir. Bu nedenle, tedavi sırasında ek bir hormonal olmayan kontraseptif yöntem uygulanması düşünülmelidir (bkz. bölüm 4.5). Hormona bağlı kanseri olan kadınlar için iki adet hormonal olmayan kontraseptif yöntem düşünülmelidir.
Erkeklerde kontrasepsiyon
Olaparib veya metabolitlerinin seminal sıvıya geçip geçmediği bilinmemektedir. Erkek hastalar tedavi sırasında ve son Lynparza dozunu almalarını takip eden 3 ay süresince hamile veya çocuk doğurma potansiyeline sahip olan bir kadınla girilen cinsel ilişki sırasında prezervatif kullanmalıdır. Aynı zamanda erkek hastaların kadın partnerleri de çocuk doğurma potansiyeline sahip olmaları durumunda yüksek düzeyde etkili bir doğum kontrol yöntemi uygulamalıdır (bkz. bölüm 4.4). Erkek hastalar tedavi sırasında ve son Lynparza dozunu almalarını takip eden 3 ay süresince sperm bağışı yapmamalıdır.
Gebelik dönemi
Olaparibin gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. Hayvanlar ile gerçekleştirilen çalışmalarda, sıçanlar üzerinde, insanlarda kullanılan terapötik dozlardan daha düşük maternal sistemik maruziyetlerde, ciddi teratojenik etkiler ve embriyofetal sağkalım üzerindeki etkileri içeren üreme toksisitesi gösterilmiştir (bkz. Bölüm 5.3). Olaparibin gebe kadınlarda kullanımına ilişkin veri bulunmamaktadır; ancak olaparibin etki mekanizmasına dayanılarak, LYNPARZA gebelik döneminde ve çocuk doğurma potansiyeli olup tedavi süresince ve LYNPARZA'nın son dozunu aldıktan sonra bir ay süreyle güvenilir bir doğum kontrol yöntemi uygulamayan kadınlarda kullanılmamalıdır (Doğum kontrolü ve gebelik testi hakkında daha fazla bilgi için yukarıdaki âÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)â bölümüne bakınız).
Laktasyon dönemi
Olaparibin süt ile atıldığına ilişkin hayvan çalışması bulunmamaktadır. Olaparibin veya metabolitlerinin insan sütü ile atılıp atılmadığı bilinmemektedir. Ürünün farmakolojik özelliği göz önünde bulundurulduğunda, emzirme süresince ve son doz alındıktan sonra bir ay boyunca LYNPARZA kontrendikedir (bkz. Bölüm 4.3).
Üreme yeteneği/Fertilite
Fertilite hakkında klinik veri bulunmamaktadır. Hayvanlar üzerinde gerçekleştirilen çalışmalarda konsepsiyon üzerinde bir etki gözlenmemiştir; ancak embriyofetal sağkalım üzerinde advers etkiler söz konusudur (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
LYNPARZA'nın araç ve makine kullanma becerisi üzerinde orta derecede bir etkisi bulunmaktadır. LYNPARZA ile tedavi sırasında asteni, yorgunluk veya sersemlik hali bildirilmiştir. Bu semptomları yaşayan hastalar araç veya makine kullanırken dikkatli olmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
LYNPARZA monoterapisi genellikle hafif veya orta derece şiddetli olan (CTCAE derece 1 veya 2) ve genellikle tedavinin kesilmesini gerektirmeyen advers reaksiyonlar ile ilişkilendirilmiştir. Tüm klinik çalışmalarda LYNPARZA monoterapisi (≥%10) alan hastalarda en sık gözlenen advers reaksiyonlar; bulantı, bitkinlik, anemi, kusma, diyare, iştah azalması, baş ağrısı, disguzi, öksürük, nötropeni, dispne, baş dönmesi, dispepsi, lökopeni ve trombositopeni olmuştur.
Hastaların %2'sinde ortaya çıkan derece ≥3 advers reaksiyonlar anemi (%15), nötropeni (%5), bitkinlik/asteni (%4), lökopeni (%3) ve trombositopeni (%2) olmuştur.
Monoterapide doza ara verilmesine ve/veya azaltılmasına en yaygın şekilde neden olan advers reaksiyonlar anemi (%16), kusma (%6), bulantı (%7), bitkinlik/asteni (%6) ile nötropeni (%6) olmuştur. İlacın kalıcı şekilde bırakılmasına en yaygın şekilde neden olan advers reaksiyonlar anemi (%1,7), trombositopeni (%0,7), bitkinlik/asteni (%0,8),bulantı (%0,9), nötropeni (%0.6) ve kusma (%0.5) olmuştur.
Lynparza, bevasizumab ile kombinasyon halinde kullanıldığında, güvenlilik profili genellikle tedaviler tek başına uygulandığındaki ile uyumludur.
Advers olaylar, bevasizumab ile birlikte kullanıldığında hastaların %57sinde doza ara verilmesine ve/veya azaltılmasına yol açmış ve hastaların %20'sinde olaparib/bevasizumab ve
%6'sında plasebo/bevasizumab ile tedavinin kalıcı olarak kesilmesine yol açmıştır. Doza ara verilmesine ve/veya azaltılmasına en sık neden olan advers reaksiyonlar anemi (%22), bulantı (%10) ve yorgunluk/asteni (%5) olmuştur. İlacın kalıcı olarak kesilmesine en sık neden olan advers reaksiyonlar anemi (%3,6), bulantı (%3,4) ve yorgunluk/asteni (%1,5) olmuştur.
Advers olaylar, abirateron ile birlikte kullanıldığında hastaların %46,9'unda olaparib dozunun kesilmesine veya azaltılmasına ve hastaların sırasıyla %16,2 ve %8,1'inde olaparib/abirateron ve plasebo/abirateron tedavisinin kesilmesine neden olmuştur. Dozun kesilmesine ve/veya azaltılmasına en yaygın şekilde neden olan advers reaksiyonlar anemi (%15,6), bulantı (%3), bitkinlik/asteni (%2,6) ve nötropeni (%2,1) şeklindeydi. Kalıcı olarak kesilmesine neden olan en yaygın advers reaksiyon anemi (%4,1) idi.
![]()
Advers reaksiyonların listesi
Güvenlilik profili, klinik çalışmalardaterapötikendikasyondaönerilen dozda solid tümörlerle
LYNPARZA monoterapisi ile tedavi edilen 4098 hastaya ait veri havuzuna dayanmaktadır.
Hasta maruziyetinin bilindiği LYNPARZA monoterapisi alan hastaların incelendiği klinik çalışmalarda aşağıdaki advers reaksiyonlar tanımlanmıştır. Advers ilaç reaksiyonları MedDRA Sistem Organ Sınıfına (SOC) ve ardından MedDRA tercih edilen terime göre listelenmektedir. Her bir SOC içinde terimler azalan sıklığa ve sonrasında azalan ciddiyet derecesine göre düzenlenmiştir. Sıklıklar şu şekilde tanımlanmaktadır: Çok yaygın (≥1/10); yaygın (≥1/100 ila
<1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10,000 ila <1/1.000); çok seyrek (<1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1.LYNPARZA için bildirilen advers reaksiyonların listesi
| Advers reaksiyonlar | |
MedDRA Sistem Organ Sınıfı | Tüm CTCAE derecelerinin sıklığı | CTCAE derece ≥3 sıklığı |
Benign, malign ve | Yaygın olmayan | Yaygın olmayan |
tanımlanmamış (kist | Miyelodisplastik sendrom/ Akut | Miyelodisplastik sendrom/ Akut |
ve polipler dahil) | miyeloid lösemi | miyeloid lösemi |
neoplaziler |
|
|
Kan ve lenfatik | Çok yaygın | Çok yaygın |
sistem hastalıkları | Anemi, Nötropeni, Lökopeni | Anemi |
| Yaygın | Yaygın |
| Lenfopeni Trombositopeni, | Nötropeni, Trombositopeni, Lökopeni |
|
| Lenfopeni |
İmmün sistem hastalıkları | Yaygın olmayan Aşırı duyarlılık, | Nadir Aşırı duyarlılık |
| Nadir Anjiyoödem |
|
Metabolizma ve beslenme bozuklukları | Çok yaygın İştahsızlık | Yaygın olmayan İştahsızlık |
Sinir sistemi hastalıkları | Çok yaygın Baş dönmesi, Baş ağrısı, Tat alma duyusunda değişiklik | Yaygın olmayan Baş dönmesi, Baş ağrısı |
Solunum, göğüs | Çok yaygın | Yaygın |
bozuklukları ve | Öksürük, Dispne | Dispne |
mediastinal |
| Yaygın olmayan |
hastalıklar |
| Öksürük |
Gastrointestinal | Çok yaygın | Yaygın |
hastalıklar | Kusma, Diyare, Bulantı, Dispepsi | Kusma, Bulantı |
| Yaygın | Yaygın olmayan |
| Stomatit, Üst abdominal ağrı | Stomatit, Diyare |
|
| Nadir |
|
| Dispepsi, Üst abdominal ağrı |
Deri ve deri altı dokusu bozuklukları | Yaygın Döküntü | Yaygın olmayan Döküntü |
| Yaygın olmayan Dermatit Nadir Eritema nodozum |
Nadir Dermatit |
Genel bozukluklar ve uygulama yerine ilişkin hastalıklar | Çok yaygın Yorgunluk (asteni dahil) | Yaygın Yorgunluk (asteni dahil) |
Tetkikler | Yaygın Kan kreatinin düzeyinde artış
Yaygın olmayan Ortalama hücre hacminde artış | Nadir Kan kreatinin düzeyinde artış |
Araştırmalar | Yaygın Kanda kreatinin artışı Yaygın olmayan Ortalama hücre hacmi artışı | Seyrek Kanda kreatinin artışı |
Vasküler bozukluklar | Yaygın Venöz tromboembolizm | Yaygın Venöz tromboembolizm |
a MDS/AML akut miyeloid lösemi, miyelodisplastik sendrom ve miyeloid löseminin Tercih Edilen Terimlerini (PT) kapsar.
Anemi, anemi, makrositik anemi, eritropeni, hematokrit azalması, hemoglobin azalması, normokromik anemi, normokromik normositik anemi, normositik anemi ve kırmızı kan hücresi sayımında azalma tercih edilen terimlerini (PT'lerini) içerir; Nötropeni, agranülositoz, ateşli nötropeni, granülosit sayısında azalma, granülositopeni, idiyopatik nötropeni, nötropeni, nötropenik enfeksiyon, nötropenik sepsis ve nötrofil sayısında azalma PT'lerini içerir; Trombositopeni, trombosit sayısında azalma, trombosit üretiminde azalma, plateletkrit azalması ve trombositopeni PT'lerini içerir; Lökopeni, lökopeni ve beyaz kan hücresi sayımında azalma PT'lerini içerir; Lenfopeni, B-lenfosit sayısında azalma, lenfosit sayısında azalma, lenfopeni ve T-lenfosit sayısında azalma PT'lerini içerir; Öksürük, öksürük ve balgamlı öksürük PT'lerini içerir; Aşırı duyarlılık, ilaç aşırı duyarlılığı ve aşırı duyarlılık PT'lerini içerir; Dispne, dispne ve eforla dispne PT'lerini içerir; Stomatit, aftöz ülser, ağız ülseri ve stomatit PT'lerini içerir; Döküntü, eksfolyatif döküntü, yaygın eritem, döküntü, eritematöz döküntü, yaygın döküntü, maküler döküntü, makülo-papüler döküntü, papüler döküntü ve kaşıntılı döküntü PT'lerini içerir; Dermatit, dermatit, alerjik dermatit ve eksfolyatif dermatit PT'lerini içerir.
* Pazarlama sonrası ortamda gözlemlendiği gibi
Seçili advers reaksiyonların tanımı
Hematolojik toksisite
Anemi ve diğer hematolojik toksisiteler genellikle düşük dereceli (CTCAE derece 1 veya 2) idi, ancak CTCAE derece 3 ve daha yüksek olaylar bildirilmiştir. Anemi ve diğer hematolojik toksisiteler genellikle düşük dereceli (CTCAE derece 1 veya 2) idi, ancak CTCAE derece 3 ve daha yüksek olaylar bildirilmiştir. Aneminin ilk başlangıcına kadar geçen medyan süre yaklaşık 4 hafta idi (CTCAE derece ≥ 3 olaylar için yaklaşık 7 hafta). Anemi, doz kesintileri ve dozun azaltılması ile (bölüm 4.2'ye bakınız) ve uygun olduğu durumlarda kan transfüzyonu ile kontrol altına alınmıştır. Tablet formülasyonuyla gerçekleştirilen klinik çalışmalarda anemi advers reaksiyonlarının insidansı %35,2 olmuştur (CTCAE derece ≥3 %14,8), anemi nedeniyle doza ara verme, doz azaltma ve kesme insidansları ise sırasıyla %16,4, %11,1 ve %2,1 olmuştur; olaparib ile tedavi edilen hastaların%15,6'sıbirveyadahafazla kan transfüzyonuna ihtiyaç
duymuştur. Olaparib ve hemoglobin düşüşleri arasında bir maruziyet-yanıt ilişkisi kanıtlanmıştır. Lynparza ile yapılan klinik çalışmalarda, hemoglobinde başlangıca göre CTCAE derece ≥2 kaymaların (azalmalar) insidansı %21, mutlak nötrofillerde bu oran %17, trombositlerde %5, lenfositlerde %26 ve lökositlerde %19 (hepsi yaklaşık %) idi.
Başlangıçta düşük veya normal olan ortalama eritrosit hacminin ULN'nin üzerine çıktığı vakaların insidansı yaklaşık %51'di. Tedavi kesildikten sonra seviyelerin normale döndüğü ve bu durumun herhangi bir klinik sonuç doğurmadığı görülmüştür.
Tedavi sırasında herhangi bir parametrede klinik açıdan anlama sahip olan ve doza ara verilmesini, dozun azaltılmasını ve/veya ilave tedavi uygulanmasını gerektirebilecek değişiklik ortaya çıkıp çıkmadığının takip edilmesi için başlangıçta test yapılması ve tedavinin ilk 12 ayı boyunca her ay ve sonrasında periyodik olarak tam kan sayımı takibi yapılması önerilir (bkz. bölüm 4.2 ve 4.4).
Miyelodisplastik sendrom/Akut miyeloid lösemi
MDS/AML, monoterapi klinik çalışmalarında tüm endikasyonlarda (%0,8) terapötik dozda yaygın olmayan şekilde meydana gelen ciddi advers reaksiyonlardır. İnsidans, uzun süreli güvenlilik takibi sırasında bildirilen olaylar dahil %0,5 olmuştur (klinik çalışmalarda en az bir doz oral olaparibe maruz kalan 17923hastalık genel güvenlilik popülasyonuna göre hesaplanmış olan oran). Tüm hastalar, daha önce platin bazlı ajanlarla kemoterapi almış olup MDS/AML gelişimi için potansiyel katkıda bulunan faktörlere sahipti. Birçoğu ayrıca DNA'ya zarar veren başka ajanlar ve radyoterapi almıştı. Raporların çoğunluğu germ hattı meme kanseri duyarlılığı geni 1 veya 2 (gBRCA1/2) mutasyonunun taşıyıcıları ile ilgiliydi. MDS/AML olgularının insidansı gBRCA1m ve gBRCA2m hastaları arasında benzerdi (sırasıyla %1,6 ve
%1,2). Hastaların bazılarında kanser veya kemik iliği displazisi öyküsü vardı.
Önceden en az iki basamak platin kemoterapi görmüş ve hastalık progresyonuna kadar çalışma tedavisi almış (SOLO2 Çalışması, hastaların %45'i ≥ 2 yıl olaparib tedavisi almıştır) BRCAm platin duyarlı nüks etmiş yumurtalık kanserli hastalarda MDS/AML insidansı, 5 yıllık takipte olaparib alan hastalarda %8 ve plasebo alan hastalarda %4 olmuştur. Olaparib kolunda, 16 MDS/AML olgusundan 9'u, sağkalım takibi sırasında olaparibin kesilmesinden sonra meydana gelmiştir. MDS/AML insidansı, olaparib kolunda uzatılmış genel sağkalım ve geç başlangıçlı MDS/AML bağlamında gözlenmiştir. MDS/AML riski, olaparib idame tedavisi 2 yıllık bir süre boyunca bir basamak platin kemoterapisinden sonra verildiğinde birinci basamakta 5 yıllık takipte <%1,5 olarak kalmaktadır (SOLO1 Çalışması'nda %1,2 ve PAOLA-1 Çalışması'nda
%0,7). Risk azaltma ve yönetimi için bölüm 4.4'e bakın.
Venöz Tromboembolik Olaylar
mCRPC için birinci basamak tedavi olarak olaparib artı abirateron alan erkeklerde (PROpel çalışması), venöz tromboembolik olayların insidansı, olaparib artı abirateron kolunda %8 ve plasebo artı abirateron kolunda %3,3'tü. Bu çalışmada başlangıca kadar geçen medyan süre 170 gündü (aralık: 12 ila 906 gün). Hastaların büyük çoğunluğu olaydan kurtulmuş ve standart tıbbi tedavi ile olaparibe devam edebilmiştir.
Önemli kardiyovasküler hastalığı olan hastalar çalışma dışı bırakılmıştır. Kardiyovasküler hariç bırakma kriterleri için lütfen abirateron ürün bilgilerine bakınız (bölüm 4.4).
Diğer laboratuvar bulguları
LYNPARZA ile yapılan klinik çalışmalarda, kandaki kreatinin seviyesinde başlangıca göre ortaya çıkan CTCAE derece ≥2 kaymaların (artışlar) insidansı yaklaşık %11'di. Çift kör plasebo kontrollü çalışmadan elde edilen veriler, başlangıca kıyasla %23'e varan medyan artış ortaya koymuştur ve bu artış zaman içinde tutarlılık sergilemiş, tedavi durdurulduktan sonra ise belirgin bir klinik sekel bırakmadan başlangıç değerine geri dönmüştür. Başlangıç noktasında hastaların %90'ının kreatinin değerleri CTCAE derece 0 olup, başlangıçta CTCAE derece 1 olanların oranının ise %10 olduğu görülmüştür.
Gastrointestinal toksisiteler
Bulantı genellikle çok erken dönemde bildirilmiş olup, ilk başlama zamanı hastaların çoğunluğunda LYNPARZA tedavisinin ilk bir ayı içerisindedir. Kusma da erken dönemde bildirilmiş olup, ilk başlama zamanı hastaların çoğunluğunda LYNPARZA tedavisinin ilk iki ayı içerisindedir. Gerek bulantı gerekse kusmanın hastaların çoğunluğunda aralıklı olduğu ve dozlara ara verme, dozun azaltılması ve/veya antiemetik tedavi ile kontrol edilebildiği bildirilmiştir. Antiemetik profilaksi gerekmemektedir.
Birinci basamak over kanseri idame tedavisinde, hastalar bulantı olayları (olaparible %77, plaseboyla%38), kusma (olaparible %40, plaseboyla %15), ishal (olaparible %34, plaseboyla
%25) ve dispepsi (olaparible %17, plaseboyla %12) yaşamıştır. Bulantı olayları olaparible tedavi uygulanan hastaların %2,3'ünde (CTCAE Derece 2) ve plasebo ile tedavi uygulanan hastaların %0,8'inde (CTCAE Derece 1) ilacın kesilmesine neden olmuştur; olaparible tedavi uygulanan hastaların %0,8'i ve %0,4'ü, sırasıyla düşük dereceli (CTCAE Derece 2) kusma ve dispepsi nedeniyle tedaviyi bırakmıştır.
Olaparib veya plasebo ile tedavi edilen hiçbir hasta, ishal nedeniyle tedaviyi bırakmamıştır. Plasebo ile tedavi edilen hiçbir hasta, kusma veya dispepsi nedeniyle tedaviyi bırakmamıştır. Bulantı olayları, olaparible tedavi edilen hastaların %14'ünde ve %4'ünde sırasıyla doza ara verilmesine ve dozun azaltılmasına neden olmuştur. Kusma olayları olaparible tedavi uygulanan hastaların %10'unda tedavinin duraklatılmasına neden olmuştur; olaparible tedavi uygulanan hiçbir hasta dozun azalmasına neden olan bir kusma olayı yaşamamıştır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Pediatrik hastalarda çalışma gerçekleştirilmemiştir.
Geriyatrik popülasyon:
Yaşlılarda (≥ 75 yaş) sınırlı klinik veri mevcuttur.
Diğer:
Beyaz ırka mensup olmayan hastalar:
Beyaz ırka mensup olmayan hastalarda sınırlı klinik veri mevcuttur.
Şüpheli advers reaksiyonların raporlanması
Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Olaparible doz aşımı konusundaki deneyim sınırlıdır. İki günden fazla 900 mg'ye varan dozda olaparib tablet alan az sayıda hastada hiçbir beklenmeyen advers reaksiyon bildirilmemiştir. Doz aşımı belirtileri saptanmamıştır ve LYNPARZA doz aşımı durumunda özel bir tedavi yoktur. Doz aşımı söz konusu olduğunda, hekimler genel destekleyici önlemleri takip etmeli ve hastayı semptomatik tedavi etmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastikler ve immunomodulatör ajanlar,antinoeplastik ajanlar,
Poli (ADP-riboz) polimeraz(PARP) inhibitörleri
ATC kodu: L01XK01
Etki mekanizması ve Farmakodinamik etkiler:
Olaparib, insan poli (ADP-riboz) polimeraz enzimlerinin (PARP-1, PARP-2 ve PARP-3) potent bir inhibitörüdür ve ister tek başına tedavi olarak ister mevcut kemoterapiler ile kombinasyon halinde in vitro koşullarda seçili tümör hücre dizilerinin büyümesini ve in vivo ortamda tümör büyümesini inhibe ettiği gösterilmiştir.
PARP, DNA tek sarmal kırılmalarının etkin onarımı için gereklidir ve PARP kaynaklı onarımın önemli bir özelliği için kromatin modifikasyonu sonrasında PARP'nin kendi kendini modifiye etmesi ve DNA'dan ayrılarak baz eksizyon tamiri (BER) enzimlerinin erişimini kolaylaştırması gerekir. Olaparib, DNA bağlantılı PARP'ın aktif bölgesine bağlandığında PARP'ın ayrılmasını önler ve DNA'ya hapsederek onarımı bloke eder. Replike olan hücrelerde bu durum ayrıca replikasyon çatalı, PARP-DNA eklentileri ile karşılaştığında DNA çift sarmal kırılmaları (DSB'ler) oluşumuna da yol açar. Normal hücrelerde homolog rekombinasyon onarım (HRR) yolağı, bu DNA çift sarmal kırılmalarını onarmada etkilidir. BRCA1 veya 2 gibi HRR fonksiyonel bileşenleri olmayan kanserlerde DNA DSB'ler doğru veya etkili şekilde tamir edilemez. Bunun yerine genomik instabilitede artışa yol açan klasik homolog olmayan uç birleşmesi (NHEJ) mekanizması gibi, alternatif ve hataya eğilimli mekanizmalar aktive edilir. Birkaç replikasyon turunun ardından genomik instabilite desteklenebilir olmayan düzeylere ulaşabilir ve kanser hücreleri normal hücrelere kıyasla halihazırda daha yüksek bir DNA hasarı yüküne sahip olduğundan, bu durum kanser hücresinin ölümü ile sonuçlanabilir. Neden olan bozukluk ve etkinlik tam olarak açıklanmamış olmakla birlikte, BRCA1 veya BRCA2 mutasyonlarının yokluğunda HRR mekanizması başka mekanizmalar tarafından bozulabilir. Tam fonksiyonel HRR mekanizmasının mevcut olmayışı overkanserlerinde ve diğer kanserlerde platin duyarlılığının kilit roldeki belirleyicilerinden biridir.
BRCA1/2-eksikliği bulunan in vivo modellerde platin tedavisinden sonra verilen olaparib, tek başına platin tedavisine kıyasla tümör progresyonunda bir gecikme ve genel sağkalımda bir artış ortaya çıkarmıştır ve bunlar olaparib idame tedavisi periyodu ile korelasyon göstermiştir.
NHA'lar ile kombine anti-tümör etkisi
Prostat kanseri modellerinde yapılan klinik öncesi çalışmalarda, PARP inhibitörleri ve yeni nesil hormonal ajanlar birlikte uygulandığında birleşik bir anti-tümör etkisi bildirilmiştir. PARP, androjen reseptörü (AR) sinyalinin pozitif ortak regülasyonunda yer alır; bu, PARP/AR sinyali birlikte inhibe edildiğinde artan AR hedef gen supresyonuna yol açar. Diğer klinik öncesi çalışmalarda, NHA'larla yapılan tedavinin bazı HRR genlerinin transkripsiyonunu inhibe ettiği dolayısıyla HRR eksikliğini indüklediği ve genetik olmayan mekanizmalar yoluyla PARP inhibitörlerine karşı duyarlılığın arttığı bildirilmiştir.
BRCA1/2 mutasyonunun tespiti
Genetik testler, onaylanmış bir test kullanılarak deneyimli bir laboratuvar tarafından yapılmalıdır. Kan ve/veya tümör örnekleri üzerinde BRCA1/2 mutasyonları açısından lokal veya merkezi olarak uygulanan testler farklı çalışmalarda kullanılmıştır. Kullanılan teste ve uluslararası sınıflandırma konsensusuna bağlı olarak, BRCA1/2 mutasyonları zararlı/şüpheli zararlı veya patojenik/olası patojenik olarak sınıflandırılmıştır. Homolog rekombinasyon eksikliği (HRD) pozitif durumu, zararlı / şüpheli zararlı veya patojenik / muhtemelen patojenik olarak sınıflandırılan bir BRCA1 / 2 mutasyonunun saptanmasıyla tanımlanabilir.
Bu mutasyonların tespiti, HRD pozitif durumunu belirlemek için pozitif HRD skoru ile birleştirilebilir.
Genomik instabilitenin tespiti
PAOLA-1'de araştırılan HR eksikliği ile ilişkili genomik değişiklikler, önceden tanımlanmış kriterleri ve puanı olan sürekli ölçümler olan genom çapında heterozigotluk kaybı, telomerik alelik dengesizlik ve büyük ölçekli geçişi içerir. Bileşik genomik kararsızlık skoru (GIS, HRD skoru olarak da adlandırılır), tümör hücrelerinde biriken spesifik genomik anormalliklerin kapsamını değerlendirmek için birleştirilmiş ölçümler ve ilgili skorlar kullanılarak belirlenir. Daha düşük puan, DNA'ya zarar veren ajanlara maruz kalmaya göre numune alma sırasında tümör hücrelerinin HR eksikliği olasılığının daha düşük olduğunu tanımlar ve daha yüksek puan, tümör hücrelerinin HR eksikliği olasılığının daha yüksek olduğunu belirler. GIS pozitif durumunu belirlemek için valide edilmiş kesme noktaları kullanılmalıdır.
HRD pozitif durumu, valide edilmiş bir test kullanılarak deneyimli bir laboratuvar tarafından test edilen HR eksikliği ile ilişkili genomik değişiklikler için birleşik bir GIS puanı ile tanımlanabilir.
Klinik etkililik ve güvenlilik
BRCA mutasyonlu ileri over kanserinin birinci basamak idame tedavisi: SOLO1 Çalışması
Bir Faz III randomize, çift kör, plasebo kontrollü çok merkezli çalışmada birinci basamak platin bazlı kemoterapinin tamamlanmasının ardından olaparibin idame tedavisi olarak güvenliliği ve etkililiği yeni tanı konmuş ilerlemiş (FIGO Evre III-IV) yüksek dereceli seröz veya endometroid BRCA1//2 mutasyonlu (mBRCA1//2) over kanseri hastalarında araştırılmıştır. Bu çalışmada 391 hasta Lynparza (günde iki defa 300 mg [2 x 150 mg tablet]) veya plasebo almak üzere 2/1 oranında randomize edilmiştir .Hastalarbirincibasam ak platin kemoterapisine verilen
hastalığın radyolojik progresyonuna, kabul edilemez toksisiteye veya 2 yıla kadar tedaviye devam edilmiştir. Tam klinik yanıt durumunda kalan (yani, radyolojik hastalık kanıtı olmayan) hastalar için maksimum tedavi süresi 2 yıl olarak belirlenmiştir; bununla birlikte, stabil kalan bir hastalık kanıtı olan (yani, hastalık progresyonuna dair kanıt bulunmayan) hastalar, 2 yıldan uzun süre Lynparza almaya devam edebilmiştir.
Germ hattı veya somatik BRCA1/2 mutasyonları görülen hastalar ya lokal bir test (n=208) veya merkezi bir test (n=181) yoluyla kanda germ hattı testinden ya da lokal bir test kullanılarak bir tümör numunesinin test edilmesinden (n=2) prospektif şekilde tespit edilmiştir. Merkezi germ hattı testinde, patojen veya olası patojen mutasyonlar, hastaların sırasıyla %95,3'ünde (365/383) ve %4,7'sinde (18/383) tespit edilmiştir. Randomize edilen hastaların %5,5'inde (21/383) BRCA1/2 genlerinde büyük yeniden düzenlenmeler tespit edilmiştir. Yerel test yoluyla kaydedilen hastaların gBRCAm durumu merkezi testle retrospektif şekilde doğrulanmıştır. Tümör örnekleri mevcut olan hastalara uygulanan retrospektif testler merkezi test kullanılarak gerçekleştirilmiştir ve %95'inde uygun bir mutasyon bulunan (bilinen [n = 47] veya muhtemel patojenik [n = 277]) 341 hastada başarılı sonuçlar elde edilmiştir ve 2 gBRCAwt hastasının sadece sBRCAm taşıdığı doğrulanmıştır. SOLO1'de BRCA1/2m germ hattı görülen 389 hasta tespit edilmiştir ve bunların 2'sinin somatik BRCA1/2m olduğu görülmüştür.
Demografik özellikler ve başlangıç özellikleri olaparib ve plasebo tedavisi kolları arasında genel olarak iyi bir denge sergilemiştir. Medyan yaşın her iki kolda 53 olduğu belirlenmiştir. Over kanserinin hastaların %85'inde primer tümör olduğu görülmüştür. En yaygın histolojik tipin seröz (%96) olduğu görülmüştür, hastaların %2'sinde endometrioid histoloji bildirilmiştir. Çoğu hastanın ECOG performans durumu 0 olarak belirlenmiştir (%78), performans durumu 2 ila 4 olan hastalarda herhangi bir veri mevcut değildir. Hastaların yüzde altmış üçüne (%63) önceden tümör rezeksiyon cerrahisi uygulanmış olduğu belirlenmiştir ve bunların çoğunluğunda (%75) makroskobik rezidüel hastalık gözlenmemiştir. Hastaların %35'ine aralıklı tümör rezeksiyon cerrahisi uygulanmıştır ve bunların %82'sinde makroskobik rezidüel hastalık bildirilmemiştir. Tümü evre IV olan yedi hastaya sitoredüktif cerrahi uygulanmamıştır. Tüm hastalar birinci basamak platin bazlı tedavi görmüştür. Çalışmaya girişte olaparib ve plasebo kollarındaki hastaların %73'ünde ve %77'sinde, araştırmacı tarafından sırasıyla radyolojik hastalık kanıtı bulunmaması ve kanser antijeni 125'in (CA-125) normal aralıkta olması şeklinde tanımlandığı üzere, hastalık kanıtı gözlenmemiştir (CR). Başlangıçta ölçülebilir veya ölçülemez lezyonların varlığı veya yüksek CA-125 şeklinde tanımlanan PR, olaparib ve plasebo kollarındaki hastaların sırasıyla %27'sinde ve %23'ünde bildirilmiştir. Hastaların yüzde doksan üçü (%93) son platin bazlı kemoterapi dozunu takip eden 8 hafta içinde randomize edilmiştir. Bevasizumab ile tedavi uygulanan hastalar çalışma dışı bırakılmıştır, dolayısıyla daha önce bevasizumab almış olaparib hastalarına ilişkin güvenlilik ve etkililik verisi bulunmamaktadır. Somatik BRCA mutasyonu görülen hastalara ilişkin çok sınırlı veri mevcuttur.
Primer sonlanma noktası modifiye Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST)
1.1 kullanılarak araştırmacı değerlendirmesi yoluyla belirlenen ve randomizasyondan progresyona kadar geçen süre şeklinde tanımlanan progresyonsuz sağkalım (PFS) veya ölümdür. Sekonder etkililik sonlanma noktaları randomizasyondan ikinci progresyona veya ölüme kadar geçen süre (PFS2);O S(genelsağkalım),randomizasyondan tedavinin kesilmesine
başlangıcına veya ölüme kadar geçen süre (TFST) ve sağlıkla ilişkili yaşam kalitesini (HRQoL) içermiştir. Hastalar başlangıçta ve 3 yıl boyunca her 12 haftada bir ve daha sonra randomizasyon tarihi baz alınarak objektif radyolojik hastalık progresyonuna kadar her 24 haftada bir tümör değerlendirmelerinden geçirilmiştir.
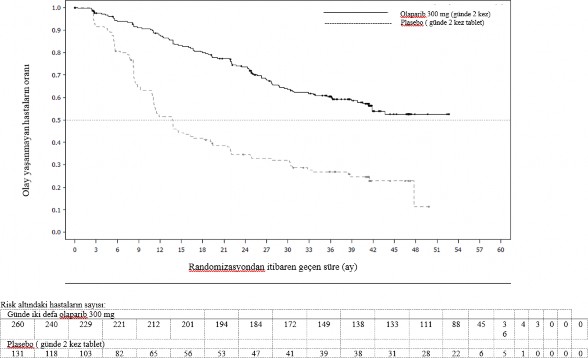
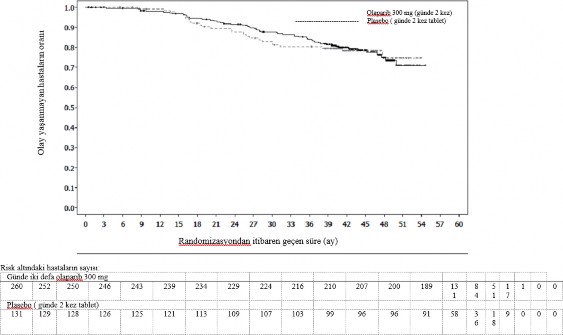
Çalışma araştırmacı tarafından değerlendirilen PFS'de plaseboya kıyasla olaparib için klinik anlamlılığa sahip olan ve istatistiksel açıdan anlamlı iyileşme ortaya koymuştur. PFS konusunda araştırmacı tarafından yapılan değerlendirme, PFS üzerinde yapılan bir körleştirilmiş bağımsız merkezi radyolojik (BICR) inceleme ile desteklenmiştir. PFS analizi sırasında, ara OS verileri olgunlaşmamıştı (% 21) ve HR 0,95'ti (%95 CI 0,60, 1,53; p değeri=0,9). Etkililik sonuçları Tablo 2 ve Şekil 1 ve 2'de sunulmaktadır.
Tablo 2 SOLO1'de BRCA1/2m ilerlemiş over kanseri görülen yeni tanı konmuş hastalara ait etkililik sonuçları
| Günde iki defa olaparib 300 mg | Plasebo |
PFS (%51 olgunluk) |
|
|
Olay sayısı: Toplam hasta sayısı (%) | 102:260 (39) | 96:131 (73) |
Medyan süre (ay) | NR | 13.8 |
HR (%95 CI) | 0.3 (0.23-0.41) |
|
P değeri (2 yanlı) | p<0,0001 |
|
PFS2 (%31 olgunluk) |
|
|
Olay sayısı: Toplam hasta sayısı (%) | 69:260 (27) | 52:131 (40) |
Medyan süre (ay) | NR | 41.9 |
HR (%95 CI) | 0.5 (0.35-0.72) |
|
P değeri (2 yanlı) | p=0,0002 |
|
TFST (%49 olgunluk) |
|
|
Olay sayısı: Toplam hasta sayısı (%) | 99:260 (38) | 94:131 (72) |
Medyan süre (ay) | 51.8 | 15.1 |
HR (%95 CI) | 0.3 (0.22-0.4) |
|
P değeri* (2 yanlı) | p<0,0001 |
|
a Kaplan-Meier hesaplamalarına göre 24 ve 36. aylarda progresyon gözlenmeyen hastaların oranı olaparib için %74 ve %60 plasebo içinse %35 ve %27 olmuştur; medyan takip süresi hem olaparib hem de plasebo kollarında 41 ay olmuştur.
b < 1 olan değerler olaparib lehinedir. Analiz, önceki platin kemoterapisine verilen yanıtı (CR veya PR) eş değişken olarak içeren bir Cox orantılı tehlikeler modeli kullanılarak gerçekleştirilmiştir.
c Plasebo kolunda takiben bir tedavi uygulanan 94 hastanın 49'u (%52) bir PARP inhibitörü almıştır.
* Multiplisite açısından kontrol edilmemiştir.
bd: günde iki kez; NR Erişilmemiştir; CI Güven aralığı; PFS progresyonsuz sağkalım; PFS2 İkinci progresyona veya ölüme kadar geçen süre; OS Genel sağkalım; TFST Randomizasyondan takip eden ilk anti-kanser tedaviye veya ölüme kadar geçen süre.
Şekil 1 SOLO1: Yeni tanı konmuş BRCA1/2m ilerlemiş over kanseri hastalarında Kaplan-Meier PFS grafiği (%51 olgunluk - araştırmacı değerlendirmesi)
Şekil 2 SOLO1: Yeni tanı konmuş BRCA1/2m ilerlemiş over kanseri hastalarında Kaplan-Meier OS grafiği (%21 olgunluk)
Çalışmaya girişteki hastalık kanıtına göre oluşturulmuş hasta alt gruplarında tutarlı sonuçlar gözlenmiştir. Araştırmacı tarafından tanımlanan CR görülen hastalarda HR 0,34 (%95 CI 0,24- 0,47) olmuştur; olaparibte medyan PFS'ye ulaşılmamıştır, plaseboda ise medyan PFS 15,3 aydı.
24. ve 36. ayda, olaparib kolunda hastaların sırasıyla %68'i ve %45'i, plasebo kolundaki hastaların ise %34'ü ve%22'si CR durumunda kalmıştır. Çalışmaya girişte PR görülen hastalarda PFS HR 0,31 olarak tespit edilmiştir (%95 CI 0,18, 0,52; ortalama PFS olaparible 30,9 ay, plaseboyla ise 8,4 ay). Çalışmaya girişte PR görülen hastalar CR'ye ulaşmış (24. ayda olaparib kolunda %15 ve plasebo kolunda %4, 36. ayda CR durumunda kalmıştır) veya daha fazla PR/stabil hastalık sergilemiştir (24. ayda olaparib kolunda %43 ve plasebo kolunda %15, 36. ayda olaparib kolunda %17 ve plasebo kolunda %15). Son platin bazlı kemoterapi dozunu takip eden 6 ay içinde progresyon yaşayan hastaların oranı olaparib ile %3,5, plaseboyla ise
%8,4 olmuştur.
Platine duyarlı relaps yapmış (PSR) over kanserinin idame tedavisi
SOLO2 çalışması
Olaparibin idame tedavisi olarak güvenliliği ve etkililiği germline BRCA1/2-mutasyonlu, platine duyarlı, relaps yapmış (PSR) over, fallop tüpü veya primer peritoneal kanserli hastalarla gerçekleştirilen bir Faz III randomize, çift kör, plasebo kontrollü çalışmada değerlendirilmiştir. Bu çalışmada progresyona kadar alınan LYNPARZA (günde iki defa 300 mg [2 x 150 mg tablet]) idame tedavisinin etkililiği platin içeren kemoterapinin tamamlanmasının ardından yanıt (CR veya PR) sergilemekte olan 295 yüksek evre seröz veya endometrioid PSR over kanseri hastasında plasebo tedavisiyle karşılaştırılmıştır (2/1 randomizasyon: 196 olaparib ve 99 plasebo).
İki veya daha fazla platin içeren rejim uygulanan ve hastalıkları sondan önceki platin bazlı kemoterapinin tamamlanmasından > 6 ay sonra nükseden hastalar kaydedilmiştir. Hastaların daha önce olaparib veya başka bir PARP inhibitörü tedavisi almış olmasına izin verilmemiştir. Hastaların, randomizasyondan hemen önceki rejimde olmamak koşuluyla, daha önce bevasizumab almış olmasına izin verilmiştir.
Tüm hastalarda başlangıçta gBRCA1/2m kanıtı tespit edilmiştir. Hastalarda görülen BRCA1/2 mutasyonlarından germline mutasyonu, ya lokal bir test ya da Myriad CLIA Integrated BRACAnalysis® testi yoluyla yahut da tümör dokusundan lokal bir test kullanılarak saptanmıştır. Randomize edilen hastaların %4,7'sinde (14/295) BRCA1/2 genlerinde büyük rearanjmanlar tespit edilmiştir.
Demografik özellikler ve başlangıç özellikleri olaparib ve plasebo kolları arasında genel olarak iyi bir denge sergilemiştir. Medyan yaşın her iki kolda 56 olduğu belirlenmiştir. Over kanserinin, hastaların > % 80'inde primer tümör olduğu görülmüştür. En yaygın histolojik tipin seröz (> %90) olduğu görülmüştür, hastaların %6'sında endometrioid histoloji bildirilmiştir. Olaparib kolunda hastaların %55'inin daha önce yalnızca 2 basamak tedavi gördüğü belirlenmiştir ve hastaların %45'i daha önce 3 veya daha fazla basamak tedavi görmüştür. Plasebo kolunda hastaların %61'inin daha önce yalnızca 2 basamak tedavi gördüğü, %39'unun ise daha önce 3 veya daha fazla basamak tedavi gördüğü belirlenmiştir. Çoğu hastanın ECOG performans durumu 0 olarak belirlenmiştir (%81). Platin uygulanmayan dönem, hastaların
Primer sonlanım noktası RECIST 1.1 kullanılarak araştırmacı değerlendirmesiyle PFS'dir. Sekonder etkililik sonlanma noktaları, PFS2; OS TDT, TFST, TSST ve HRQoL içermiştir.
Çalışma primer amacına ulaşmıştır ve araştırmacı tarafından değerlendirilen PFS'de 0,30'luk HRplaseboya kıyasla olaparib lehine istatistiksel açıdan anlamlı bir iyileşme ortaya koymuştur (%95 CI 0,22 - 0,41; p < 0,0001; olaparible medyan 19,1 aya karşılık plaseboyla medyan 5,5 ay). Araştırmacı tarafından değerlendirilen PFS, körleştirilmiş bir bağımsız merkezi radyolojik inceleme ile desteklenmiştir (HR 0,25; %95 CI 0,18 â 0,35; p < 0,0001; olaparib için medyan 30,2 ay, plasebo için medyan 5,5 ay). Olaparibtedavisiuygulanan hastaların %43'ü 2. yılda progresyon sergilememeye devam etmiştir, plasebo alan hastalarda ise bu oran yalnızca %15'te kalmıştır.
SOLO2'de gBRCA1/2m PSR over kanseri hastalarında primer sonlanma noktası açısından elde edilen sonucun bir özeti Tablo 3 ve Şekil 3'de verilmiştir.
Tablo 3: SOLO2'de gBRCA1/2m PSR over kanseri hastalarında primer sonlanım noktası açısından elde edilen sonucun özeti
| Günde iki defa olaparib 300 mg tablet | Plasebo |
PFS (%63 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 107:196 (55) | 80:99 (81) |
Medyan süre (ay) (%95 CI) | 19,1 (16,3 â 25,7) | 5,5 (5,2 â 5,8) |
HR (%95 CI) | 0,30 (0,22 â 0,41) |
|
P değeri (2 yanlı) | P < 0,0001 |
|
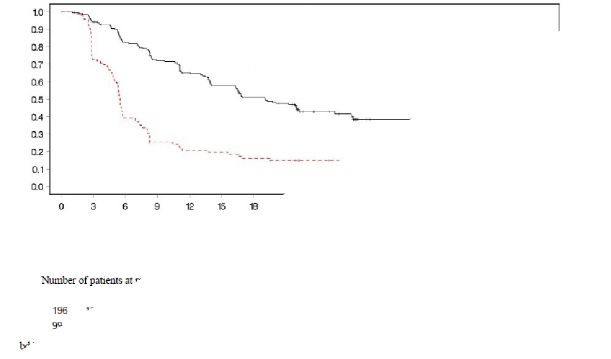
Şekil 3: SOLO2: gBRCA1/2m PSR over kanseri hastalarında Kaplan-Meier PFS grafiği (%63 olgunluk - araştırmacı değerlendirmesi)
bd Günde iki kez; PFS progresyonsuz sağkalım
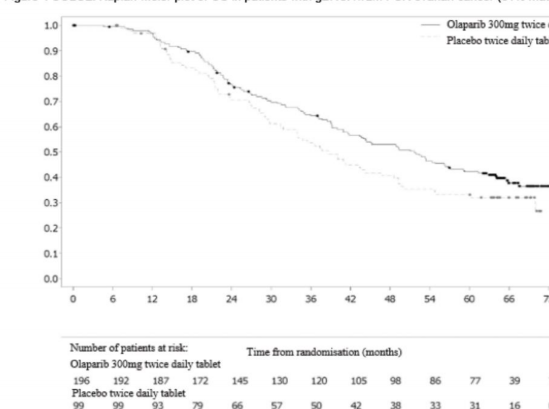
OS'nin son analizinde (%61 olgunluk) HR 0.74 idi (%95 GA 0,54-1.00; p=0.0537; plasebo için medyan 51,7 ay ve plasebo için 38,8 ay) ve istatistiksel anlamlılığa ulaşmadı.
Sekonder sonlanım noktaları olan TFST ve PFS2, plaseboya kıyasla olaparib için kalıcı ve istatistiksel açıdan anlamlı iyileşme sergilemiştir. OS, TFST ve PFS2 için sonuçlar Tablo 4 ve Şekil 4'te sunulmaktadır.
Tablo 4: SOLO2'de gBRCA1/2m PSR yumurtalık kanseri hastaları için kilit sekonder objektif sonuçların özeti
| Olaparib 300 mg tablet, günde iki kez | Plasebo |
OS (%61 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 116:196 (59) | 65:99 (66) |
Medyan süre (%95 GA), ay | 51,7 (41,5, 59,1) | 38,8 (31,4, 48,6) |
HR (%95 GA) | 0,74 (0,54 â 1,00) | |
P değeri (2-taraflı) | p=0,0537 | |
TFST (%71 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 139:196 (71) | 86:99(87) |
Medyan süre (%95 GA), ay | 27,4 (22,6 â NR) | 7,2 (6,3 â 8,3) |
HR (%95 GA) | 0,37 (0,28 â 0,48) | |
P değeri (2-taraflı) | p < 0,0001 | |
PFS2 (%40 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 70:196 (36) | 49:99 (50) |
Medyan süre (%95 GA), ay | NR (24,1 â NR) | 18,4 (15,4 â 22,8) |
HR (%95 GA) | 0,50 (0,34 â 0,72) | |
P değeri (2-taraflı) | p = 0,0002 | |
Hasta olaylarının oranı
Şekil 4 SOLO2: gBRCA1/2m PSR yumurtalık kanseri hastalarında Kaplan-Meier OS grafiği (%61 olgunluk)
Çalışmaya ölçülebilir hastalıkla (başlangıçta hedef lezyonlar) katılan hastalar arasında Lynparza kolunda %41'lik bir objektif yanıt oranına erişilmiştir, plaseboda ise bu oran
%17'ydi. Çalışmaya hastalık kanıtıyla (başlangıçta hedef veya hedef dışı lezyonlar) dahil edilen ve Lynparza ile tedavi uygulanan hastaların %15,0'ı tam yanıt elde ederken plasebo alan hastalarda ise bu oran %9,1'di.
PFS analizi sırasında medyan tedavi süresi olaparib için 19,4 ay, plasebo içinse 5,6 ay şeklindeydi. Hastaların çoğu günde iki kez 300 mg şeklindeki başlangıç dozunda kalmıştır. Advers olay nedeniyle doz duraklatma, azaltma, kesme insidansı sırasıyla %45,1,%25,1 ve
%10,8'di. Doz duraklatma en sık olarak tedavinin ilk 3 ayı içinde, doz azaltma ise 3-6 ayı içinde
meydana gelmiştir. Doz duraklatmaya veya doz azaltmaya neden olan en sık görülen advers olaylar anemi, bulantı ve kusmaydı.
FACT-O'ya ait TOI'da başlangıca göre meydana gelen değişiklik ile değerlendirildiği üzere, hasta tarafından bildirilen sonuç (PRO) verileri, plaseboya kıyasla olaparib ile tedavi edilen hastalar için herhangi bir farka işaret etmemektedir.
Çalışma 19 (D0810C00019)
Olaparibin platin temelli iki veya daha fazla tedaviyi takiben fallop tüpü veya primer peritoneal kanseri de içeren PSR over kanseri hastalarında idame tedavisi olarak güvenliliği ve etkililiği, büyük bir Faz II randomize, çift kör, plasebo kontrollü çalışmada (Çalışma 19) değerlendirilmiştir. Bu çalışmada progresyona kadar alınan LYNPARZA kapsül idame tedavisinin (günde iki defa 400 mg [8 x 50 mg kapsül]) etkililiği platin içeren kemoterapinin tamamlanmasının ardından yanıt (CR veya PR) sergilemekte olan 265 (136 olaparib ve 129 plasebo) PSR yüksek dereceli seröz over kanseri hastasında plasebo tedavisiyle karşılaştırılmıştır. Primer sonlanma noktası RECIST 1 kullanılarak araştırmacı değerlendirmesine göre belirlenen PFS'dir. Sekonder etkililik sonlanma noktaları OS'yi, CR/PR+ SD (stabil hastalık) şeklinde tanımlanan hastalık kontrol oranını (DCR), HRQoL'yi ve hastalıkla ilişkili semptomları içermiştir. Aynı zamanda araştırma amaçlı TFST ve TSST analizleri de gerçekleştirilmiştir.
Hastalıkları sondan önceki platin bazlı kemoterapinin tamamlanmasından > 6 ay sonra nükseden hastalar kaydedilmiştir. Kayıtta BRCA1/2 mutasyonu kanıtı şartı aranmamıştır (bazı hastaların BRCA mutasyonu durumu retrospektif şekilde belirlenmiştir). Hastaların daha önce olaparib veya başka bir PARP inhibitörü tedavisi almış olmasına izin verilmemiştir. Hastaların, randomizasyondan hemen önceki rejimde olmamak koşuluyla, daha önce bevasizumab almış olmasına izin verilmiştir. Olaparib tedavisi sırasında ortaya çıkan progresyonun ardından olaparible yeniden tedaviye izin verilmemiştir.
BRCA1/2 mutasyonları görülen hastalar ya lokal bir test ya da Myriad CLIA Integrated BRACAnalysis® testi yoluyla kandan germline mutasyon ya da Foundation Medicine tarafından gerçekleştirilen bir test kullanılarak bir tümör dokusunsunda mutasyon saptanmıştır. Randomize edilen hastaların %7,4'ünde (10/136) BRCA1/2 genlerinde büyük rearanjmanlar tespit edilmiştir.
Demografik özellikler ve başlangıç özellikleri olaparib ve plasebo kolları arasında genel olarak iyi bir denge sergilemiştir. Medyan yaşın her iki kolda 59 olduğu belirlenmiştir. Over kanserinin hastaların %86'sında primer tümör olduğu görülmüştür. Olaparib kolunda hastaların %44'ünün daha önce yalnızca 2 basamak tedavi gördüğü belirlenmiştir ve hastaların %56'sı daha önce 3 veya daha fazla basamak tedavi görmüştür. Plasebo kolunda hastaların %49'unun daha önce yalnızca 2 basamak tedavi gördüğü, %51'inin ise daha önce 3 veya daha fazla basamak tedavi gördüğü belirlenmiştir. Çoğu hastanın ECOG performans durumu 0 olarak belirlenmiştir (%77). Platin uygulanmayan dönem hastaların %60'ında > 12 ay, %40'ında ise > 6-12 ay olmuştur. Önceki platin kemoterapisine yanıt hastaların %45'inde tam, %55'inde ise kısmi olmuştur. Olaparib ve plasebo kollarında hastaların sırasıyla %6'sı ve %5'i daha önce bevasizumab almıştır.
Çalışma primer amacına ulaşmıştır ve genel popülasyonda PFS'de 0,35'lik HR ile plaseboya kıyasla olaparib lehine istatistikselaçıdananlamlı biriyileşme ortaya koymuştur (%95 CI 0,25
- 0,49; p < 0,00001; olaparible medyan 8,4 aya karşılık plaseboyla medyan 4,8 ay). Olgunluk düzeyi %79 olan son OS analizinde (veri kesme tarihi [DCO] 9 Mayıs 2016), olaparib ile plasebo karşılaştırıldığında gözlenen tehlike oranı 0,73 (%95 CI 0,55 â 0,95; p = 0,02138 [<0,0095'lik önceden belirlenmiş anlamlılık düzeyini karşılamamıştır]; olaparible medyan 29,8 aya karşılık plaseboyla medyan 27,8 ay) olmuştur. Olaparible tedavi uygulanan grupta hastaların %23,5'i (n=32/136) tedaviye ≥ 2 yıl süresince devam etmiştir, plasebo alan hastalarda ise bu oran %3,9 (n=5/128) olmuştur. Hasta sayıları sınırlı olmakla birlikte olaparible tedavi uygulanan grupta hastaların %13,2'si (n=18/136) tedaviye ≥ 5 yıl süresince devam etmiştir, plasebo grubunda ise bu oran %0,8 (n=1/128) olmuştur.
Önceden planlanmış alt grup analizinde BRCA1/2-mutasyonlu over kanseri görülen hastaların (n=136, %51,3; somatik tümör BRCA1/2 mutasyonu tespit edilen 20 hasta dahil) olaparib idame monoterapisinden en fazla klinik fayda elde eden alt grup olduğu tespit edilmiştir. Aynı zamanda BRCA1/2'nin yabanıl tipinin/anlamı belirsiz olan varyantlarının (BRCA1/2 wt/VUS) görüldüğü hastalarda da daha düşük boyutlu olmakla birlikte bir fayda gözlenmiştir. Alt grup analizleri için uygulamaya konmuş herhangi bir çoklu test stratejisi mevcut değildir.
Çalışma 19'da BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında primer sonlanma noktası açısından elde edilen sonucun bir özeti Tablo 5'te ve Çalışma 19'daki tüm hastalar için Tablo 5ve Şekil 5'de verilmiştir.
Tablo 5: Çalışma 19'da tüm hastalar ve BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında primer sonlanım noktası açısından elde edilen sonucun özeti
| Tüm hastalar | BRCA1/2- | BRCA1/2 wt/VUS | ||||
| mutasyonlu |
| |||||
Günde iki | Plasebo | Günde iki | Plasebo | Günde | Plasebo | ||
defa |
| defa |
| iki defa |
| ||
olaparib |
| olaparib |
| olaparib |
| ||
400 mg |
| 400 mg |
| 400 mg |
| ||
kapsül |
| kapsül |
| kapsül |
| ||
PFS â DCO 30 Haziran 2010 | |||||||
Olay | sayısı: | 60:136 (44) | 94:129 | 26:74 (35) | 46:62 | 32:57 | 44:61 |
Toplam | hasta |
| (73) |
| (74) | (56) | (72) |
sayısı (%) |
|
|
|
|
|
| |
Medyan süre (ay) | 8,4 | 4,8 | 11,2 | 4,3 | 7,4 | 5,5 | |
(%95 CI) | (7,4 â 11,5) | (4,0 â 5,5) | (8,3 â NR) | (3,0 â | (5,5 â | (3,7 â | |
|
|
|
| 5,4) | 10,3) | 5,6) | |
HR (%95 CL) | 0,35 | 0,18 | 0,54 | ||||
(0,25 â 0,49) | (0,10 â 0,31) | (0,34 â 0,85) | |||||
P değeri (2 yanlı) | p < 0,00001 | p < 0,00001 | p = 0,00745 | ||||
Tüm hastalar şu alt gruplardan oluşmaktadır: BRCA1/2-mutasyonu, BRCA1/2 wt/VUS ve BRCA1/2 durumu bilinmeyen (durumu bilinmeyen 11 hasta tabloda ayrı bir alt grup olarak gösterilmemektedir).
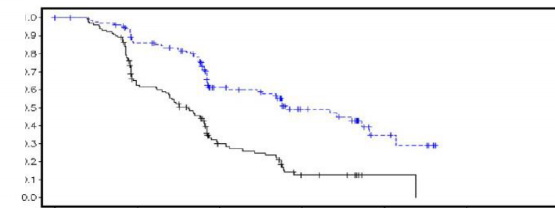
Şekil 5: Çalışma 19: DCO 30 Haziran 2010'da FAS'de (%58 olgunluk â araştırmacı değerlendirmesi) Kaplan-Meier PFS grafiği
Randomizasyondan itibaren geçen süre (ay)
Olaparib 400 mg bd
---- - - - - - - -
![]()
![]()
---------- - - - - - - - -
Risk altındaki hastaların sayısı:
136 | 106 | 53 | 24 | 7 | 0 | Günde iki defa olaparib 400 mg |
129 | 72 | 24 | 7 | 1 | 0 | Plasebo |
bd günde iki defa; DCO veri kesme tarihi; FAS Tam analiz seti; PFS Progresyonsuz sağkalım
Çalışma 19'da BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında kilit sekonder sonlanma noktaları açısından elde edilen sonucun bir özeti Tablo 4'te ve Çalışma 19'daki tüm hastalar için Tablo 6 ve Şekil 6'da verilmiştir.
Tablo 6: Çalışma 19'da tüm hastalar ve BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında kilit sekonder sonlanma noktaları açısından elde edilen sonucun özeti
| Tüm hastalar | BRCA1/2- mutasyonlu | BRCA1/2 wt/VUS | |||
Günde iki defa olapari b 400 mg kapsül | Plasebo | Günde iki defa olapari b 400 mg kapsül | Plasebo | Günde iki defa olapari b 400 mg kapsül | Plasebo | |
OS â DCO 09 Mayıs 2016 | ||||||
Olay sayısı: Toplam hasta sayısı (%) | 98:136 (72) | 112:129 (87) | 49:74 (66) | 50:62 (81) | 45:57 (79) | 57:61 (93) |
Medyan süre (ay) (%95 CI) | 29,8 | 27,8 | 34,9 | 30,2 | 24,5 | 26,6 |
| (26,9 â | (24,9 â | (29,2 â | (23,1 â | (19,8 â | (23,1 â |
| 35,7) | 33,7) | 54,6) | 40,7) | 35,0) | 32,5) |
HR (%95 CL) | 0,73 (0,55 â 0,95) | 0,62 (0,42 â 0,93) | 0,84 (0,57 â 1,25) | |||
p = 0,39749 | ||||||
TFST â DCO 09 Mayıs 2016 | ||||||
Olay sayısı: Toplam hasta sayısı (%) | 106:136 (78) | 124:128 (97) | 55:74 (74) | 59:62 (95) | 47:57 (83) | 60:61 (98) |
Medyan süre (ay) (%95 CI) | 13,3 | 6,7 | 15,6 | 6,2 | 12,9 | 6,9 |
| (11,3 â | (5,7 â | (11,9 â | (5,3 â | (7,8 â | (5,7 â |
| 15,7) | 8,2) | 28,2) | 9,2) | 15,3) | 9,3) |
HR (%95 CL) | 0,39 (0,30 â 0,52) | 0,33 (0,22 â 0,49) | 0,45 (0,30 â 0,66) | |||
P değeri (2 yanlı) | p < 0,00001 | p < 0,00001 | p = 0,00006 | |||
Tüm hastalar şu alt gruplardan oluşmaktadır: BRCA1/2-mutasyonu, BRCA1/2 wt/VUS ve BRCA1/2 durumu bilinmeyen (durumu bilinmeyen 11 hasta tabloda ayrı bir alt grup olarak gösterilmemektedir).
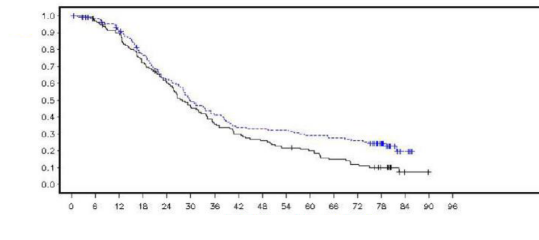
Şekil 6: Çalışma 19: DCO 09 Mayıs 2016'da FAS'de (%79 olgunluk) Kaplan-Meier OS grafiği
bd günde iki defa; DCO veri kesme tarihi; FAS Tam analiz seti; OS Genel sağkalım
PFS analizi sırasında medyan tedavi süresi olaparib için 8 ay, plasebo içinse 4 ay olarak belirlenmiştir. Hastaların çoğu günde iki defa 400 mg şeklindeki başlangıç dozunda kalmıştır. Advers olay nedeniyle doz duraklatma, azaltma, kesme insidansı sırasıyla %34,6, %25,7 ve
%5,9 olmuştur. Doz duraklatma ve azaltma en sık olarak tedavinin ilk 3 ayı içinde ortaya çıkmıştır. Dozun duraklatılmasınaveyaazaltılmasınaensıkneden olan advers olaylar bulantı,
anemi, kusma, nötropeni ve bitkinlik olmuştur. Anemi advers reaksiyonlarının insidansının
%22,8 (CTCAE derece ≥ 3 %7,4) olduğu belirlenmiştir.
TOI ve FACT-O toplam iyileşme ve kötüleşme oranları ile değerlendirildiği üzere, hasta tarafından bildirilen sonuç (PRO) verileri olaparib ile tedavi uygulanan hastalar ile plasebo arasında herhangi bir farka işaret etmemektedir.
OPINION Çalışması
Bir Faz IIIb tek kollu, çok merkezli çalışma olan OPINION'da olaparib, PSR yumurtalık, fallop tüpü veya primer periton kanseri olan ve bilinen bir zararlı veya zararlı olduğundan şüphelenilen gBRCA mutasyonu olmayan hastalarda, iki veya daha fazla basamak platin bazlı kemoterapiyi takiben idame tedavisi olarak araştırılmıştır. Platin bazlı kemoterapinin tamamlanmasının ardından hastalığı yanıt veren (CR veya PR) hastalar çalışmaya kaydedilmiştir. Toplam 279 hasta kaydedilmiş olup bu hastalara, hastalık progresyonuna veya kabul edilemez toksisiteye kadar olaparib tedavisi verilmiştir. Merkezi teste göre hastaların
%90,7'sinin durumu gBRCAm dışı olarak onaylanmış, ayrıca %9,7'sinin durumu ise sBRCAm olarak tanımlanmıştır.
Primer sonlanma noktası, değiştirilmiş RECIST v.1.1'e göre araştırmacı tarafından değerlendirilen PFS idi. Sekonder sonlanma noktaları OS'i içermiştir.
Olaparib, idame tedavisi olarak kullanıldığında, gBRCAm olmayan PSR yumurtalık kanserli hastalarda klinik aktivite göstermiştir. Primer PFS analizi sırasında, OS verileri %30 oranında matüriteye sahipti.
OPINION'da gBRCAm olmayan PSR yumurtalık kanserli hastalar için primer objektif sonucun bir özeti Tablo 7' de sunulmuştur.
Tablo 7: OPINION'da gBRCAm olmayan PSR yumurtalık kanserli hastaların progresyonsuz sağkalım özeti
| Olaparib tablet 300 mg bd |
PFS (%75 matürite) (DC2 2 Ekim 2020 | |
Olay sayısı: toplam hasta sayısı (%) | 210:279 (75.3) |
Medyan PFS (%95 CI), aya | 9.2 (7.6, 10.9) |
a Kaplan-Meier tekniği kullanılarak hesaplanmıştır.
Medyan PFS için güven aralıkları Brookmeyer Crowley yöntemine göre türetilmiştir. bd: Günde iki kez; PFD: Progresyonsuz sağkalım; DCO: Veri kesimi; CI: Güven aralığı.
HRD pozitif ileri evre yumurtalık kanserinin birinci basamak idame tedavisi
PAOLA-1 Çalışması
PAOLA-1, bevasizumab (her 3 haftada bir intravenöz infüzyon olarak verilen 15 mg/kg) ile kombinasyon halinde verilen Lynparza'nın (günde iki kez 300 mg [2 x 150 mg tablet]) etkililik ve güvenliliğini birinci basamak platin bazlı kemoterapi ve bevasizumabı takiben ileri evre (FIGO Evre III-IV) yüksek dereceli epitelyal over, fallop tüpü veya primer periton kanserinin idame tedavisi için plasebo ile kombine bevasizumab ile karşılaştıran bir Faz III randomize, çift
kör, plasebo kontrollü, çok merkezliçalışmaydı.Bevasizumabtedavisi, kemoterapi ile birlikte
Çalışmada 806 hasta (2:1 randomizasyon: 537 olaparib/bevasizumab: 269 plasebo/bevasizumab) randomize edilmiş olup bunlar tam cerrahi rezeksiyon nedeniyle hastalık belirtisi olmayan (NED) ya da platin ve bevasizumab içeren birinci basamak kemoterapinin tamamlanmasından sonra tam yanıt (CR) ya da kısmi yanıt (PR) veren hastalardı. Hastalar minimum 4 ve maksimum 9 kürü tamamlamış olup çoğu (%63), minimum 2 kür bevasizumab ile birlikte kemoterapinin son 3 kürü dahil olmak üzere 6 kür birinci basamak platin-taksan bazlı kemoterapi görmüştür. Randomizasyon öncesinde bevasizumab kürlerinin medyan sayısı 5'ti.
Hastalar, birinci basamak tedavinin sonucuna (sitoredüktif cerrahinin zamanlaması ve sonucu ile platin bazlı kemoterapiye yanıt) ve prospektif lokal testlerle belirlenen tBRCAm durumuna göre katmanlandırılmıştır. Hastalar idame ortamında bevasizumaba devam etmiş ve son kemoterapi dozlarının tamamlanmasından minimum 3 hafta ve maksimum 9 hafta sonra Lynparza tedavisine başlamıştır. Altta yatan hastalığın progresyonuna, kabul edilemez toksisiteye veya 2 yıla kadar Lynparza tedavisine devam edilmiştir. Tedaviyi uygulayan doktorun düşüncesine göre tedaviye devam edilmesinden daha da yarar sağlayabileceği düşünülen hastalar 2 yıldan daha uzun süre tedavi edilebilir.
Demografik ve başlangıç özellikleri, ITT popülasyonu ile tBRCAm (prospektif ve retrospektif olarak tanımlanan), GIS ve HRD durumuna (bu çalışmada her iki biyobelirteçin kombinasyonu şeklinde tanımlanan) göre biyobelirteç tanımlı alt gruplardaki her iki kolda dengeliydi. Hastaların medyan yaşı 61'di. Her iki koldaki çoğu hastanın ECOG performans durumu 0'dı (%70). Yumurtalık kanserinin hastaların %86'sında primer tümör olduğu görülmüştür. En yaygın histolojik tipin seröz (%96) olduğu görülmüştü ve hastaların %2'sinde endometrioid histoloji bildirilmiştir. Hastaların çoğuna FIGO evresi NIC'te tanı konmuştu (%63). Tüm hastalara birinci basamak platin bazlı tedavi ve bevasizumab verilmiştir. Hastaların %63'ünde ilk veya aralıklı tümör çıkarma cerrahisinde tam sitoredüksiyon ve %37'sinde rezidüel makroskopik hastalık olan hastalar cerrahi sonuçla sınırlanmamıştır. Her iki koldaki hastaların yüzde otuzu (%30) taramada tBRCAm idi. Biyobelirteç alt gruplarındaki demografik ve başlangıç özellikleri ITT popülasyonundakilerle tutarlıydı. HRD-pozitif alt grubunda, hastaların %65'i tam sitoredüksiyon görmüştü ve hastaların %35'inde rezidüel makroskopik hastalık vardı. Kaydolan genel hasta popülasyonunda, her iki koldaki hastaların %30'u lokal testlerle yapılan taramada tBRCAm idi (yıkıcı/patojenik mutasyon) ve hastaların %4'ü için BRCAm durumu bilinmiyordu. Mevcut klinik örneklerin retrospektif analizi, tBRCAm durumunu doğrulamak ve yukarıda açıklandığı gibi genomik instabiliteyi araştırmak üzere hastaların %97'si üzerinde gerçekleştirilmiştir.
tBRCAm olmayan hastaların %29'unda (genel popülasyonun %19'u) bu çalışmada bileşik skor
≥42 olarak önceden tanımlanmış pozitif GİS vardı. tBRCAm durumu ve pozitif GIS birleştirildiğinde, tümörleri HRD-pozitif, HRD-negatif ve HRD bilinmiyor durumunda olan hastalar genel hasta popülasyonunun %48'i, %34'ü ve %18'ini temsil ediyordu.
Primer sonlanma noktası modifiye Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST)
progresyonuna kadar her 24 haftada bir (klinik veya CA 125 progresyonu ise 12 haftada CT/MRI) RECIST 1.1 tümör değerlendirmeleri yapılmıştır.
Çalışma, plasebo/bevasizumab koluna kıyasla olaparib/bevasizumab kolu için araştırmacı tarafından değerlendirilen PFS'de istatistiksel açıdan önemli bir iyileşme sergileyen ITT popülasyonunda primer sonlanma noktasını karşılamıştır (plasebo/bevasizumab için medyan 16,6 ay karşısında olaparib/bevasizumab için 22,1 ay ile HR 0,59, %95 GA 0,49-0,72, p<0,0001). Bu, PFS'nin BICR analizi ile tutarlıydı. Bununla birlikte, biyobelirteç pozitif (tBRCAm ve/veya GIS pozitif olarak tanımlanan tBRCAm, GIS, HRD durumu pozitif) olarak tanımlanmış hastalar en çok faydayı görmüştür.
Genel popülasyonda nihai PFS2 analizi (DCO 22 Mart 2020, %53 olgunluk) istatistiksel açıdan önemliydi (HR 0,78, %95 GA, p=0,0125 plasebo/bevasizumab için 32,6 aya karşılık olaparib/bevasizumab için 36,5 aylık medyanla). Genel sağkalım verileri, genel popülasyon ve biyobelirteç alt gruplarında olgun değildi. Olaparib/bevasizumab kolundaki hastaların yüzde altmışı (%60) ile plasebo/bevasizumab kolundaki hastaların %74'ü daha sonra tedavi görmüştür ve olaparib/bevasizumab ve plasebo/bevasizumab kollarındaki bu hastaların sırasıyla %20 ve
%47'si bir PARP inhibitörü almıştır.
Randomize alt grup olarak tBRCAm'de (241/806 hasta) olaparib/bevasizumab kolu için medyan PFS 37,2 ay iken plasebo/bevasizumab kolu için 22,0 aydı (HR = 0,34, %95 GA 0,23,0,51) ve OS (DCO 22 Mart 2020) HR 0,68 (%95 GA 0,40, 1,19) idi.
Retrospektif olarak analiz edilen tümör örneklerine dayanan diğer biyobelirteç alt grup analizlerindeki etkililik sonuçları Tablo 8'de sunulmaktadır.
Tablo 8 PAOLA-1'de ileri evre yumurtalık kanseri hastalarında tBRCAm ve/veya GIS ile tanımlanan homolog rekombinasyon eksikliği (HRD) pozitif durumu olan hastalar için temel etkililik bulgularının özeti
| tBRCAm*, (n=235) | GIS pozitif *, (n=152) | HRD pozitif* (n=387) | |||
| Olaparib / bevasizumab | Plasebo / bevasizumab | Olaparib / bevasizumab | Plasebo / bevasizumab | Olaparib / bevasizumab | Plasebo / bevasizumab |
PFS, araştırmacı değerlendirmesi (%46 olgunluk) DCO 22 Mart 2019 | ||||||
Olay sayısı: Toplam hasta sayısı (%) |
44/158 (28) |
52/77 (68) |
43/97 (44) |
40/55 (73) |
87/255 (34) |
92/132 (70) |
Medyan süre (ay) | 37,2 | 18,8 | 28,1 | 16,6 | 37,2 | 17,7 |
HR (%95) GA | 0,28 (0,19, 0,42) | 0,43 (0,28, 0,66) | 0,33 (0,25, 0,45) | |||
PFS2, araştırmacı değerlendirmesi (%40 olgunluk) DCO 22 Mart 2019 | ||||||
Olay sayısı: Toplam hasta sayısı (%) |
44/158 (28) |
37/77(48) |
41/97 (42) |
33/55 (60) |
85/255 (33) |
70/132 (53) |
Medyan süre (ay) | NR | 42,2 | 50,3 | 30,1 | 50,3 | 35,4 |
HR (%95) GA | 0,53 (0,34, 0,82) | 0,60 (0,38, 0,96) | 0,56 (0,41, 0,77) //www.turkiye.gov.tr/saglik-titck-ebys | |||
Ara OS (%27 olgunluk) k) DCO 22 Mart 2020 | ||||||
Olay sayısı: Toplam hasta sayısı (%) |
31/158 (20) |
23/77 (30) |
30/97 (31) |
19/55 (35) |
61/255 (24) |
42/132 (32) |
Medyan süre (ay) | NR | NR | NR | 45,8 | NR | NR |
HR (%95) GA | 0,61 (0,36, 1,06) | 0,84 (0,48, 1,52) | 0,70 (0,47, 1,04) | |||
* Önceden planlanan alt grup
%71 ve %29 karşısında olaparib/bevasizumab için %89 ve %66 idi.
Myriad ile genomik instabilite skoru (GIS) ≥42 (önceden belirlenmiş eşik) GA Güven aralığı; HR Risk oranı; NR ulaşılamadı.
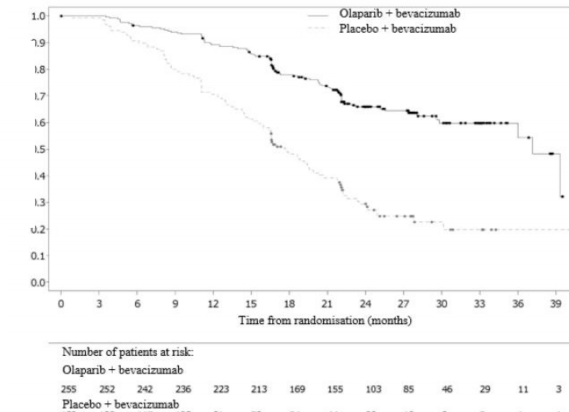
Olaysız hasta oranı
Şekil 7: PAOLA-1: PAOLA-1'de HRD pozitif olarak tanımlanmış ileri evre yumurtalık kanseri olan hastalar için Kaplan Meier PFS grafiği (%46 olgunluk - araştırmacı değerlendirmesi)
Germline BRCA mutasyonlu yüksek riskli erken evre meme kanserinin adjuvan tedavisi
OlympiA
Definitif lokal tedaviyi ve neoadjuvan veya adjuvan kemoterapiyi tamamlamış germline BRCA1/2 mutasyonları ve HER2-negatif yüksek riskli erken meme kanseri olan hastalarda adjuvan tedavi olarak olaparibin güvenliliği ve etkililiği, bir Faz III randomize, çift kör, paralel grup, plasebo kontrollü, çok merkezli çalışmada (OlympiA) incelenmiştir. Hastaların antrasiklin, taksan veya her ikisini birden içeren en az 6 kür neoadjuvan veya adjuvan kemoterapisini tamamlamaları gerekiyordu. Önceki kanser (ör. yumurtalık) için veya meme kanserinde adjuvan veya neoadjuvan tedavi olarak daha önce platine izin verilmiştir. Yüksek riskli erken meme kanseri hastaları şu şekilde tanımlanmıştır:
daha önce neoadjuvan kemoterapisi almış hastalar: üçlü negatif meme kanseri (TNBC) veya hormon reseptörü pozitif meme kanseri olan hastalarda, cerrahi sırasında memede ve/veya rezeke edilen lenf düğümlerinde (patolojik olmayan tam yanıt) rezidüel invazif kanser bulunmalıdır. Ek olarak, hormon reseptörü pozitif meme kanseri olan hastaların, Tablo 9'da gösterildiği gibi tedavi öncesi klinik ve tedavi sonrası patolojik evre (CPS), östrojen reseptörü (ER) durumu ve histolojik dereceye göre ≥ 3 CPS&EG skoruna sahip olması gerekir.
Tablo 9: Çalışmaya Kayıt için Erken Evre Meme Kanseri, Reseptör Durumu ve Derece Puanlama Gereklilikleri
Evre / özellik | Noktalar | |
Klinik evre (tedavi öncesi) | I/IIA | 0 |
IIB/IIIA | 1 | |
IIIB/IIIC | 2 | |
Patolojik Evre (tedavi sonrası) | 0/I | 0 |
IIA/IIB/IIIA/IIIB | 1 | |
IIIC | 2 | |
Reseptör durumu | ER pozitif | 0 |
ER negatif | 1 | |
Nükleer derece | Nükleer derece 1-2 | 0 |
Nükleer derece 3 | 1 | |
* Hormon reseptörü pozitif meme kanseri olan hastalar için toplam skorun ≥ 3 olması gerekiyordu.
5.2. Farmakokinetik özellikler
Genel özelliklerOlaparibin 300 mg tablet dozundaki farmakokinetiği, ~7 L/saatlik görünür plazma klirensi,
~158 L'lik görünür dağılım hacmi ve 15 saatlik terminal yarılanma ömrü ile karakterizedir. Çoklu dozlama ile 1.8'lik EAAbirikmeoranı gözlenmiştirve farmakokinetiğin düşük bir
Emilim:
Olaparibin tablet formülasyonu (2 x 150 mg) ile oral uygulanması sonrasında emilim hızlı olup, medyan doruk plazma konsantrasyonlarına tipik olarak doz uygulamasından 1.5 saat sonra ulaşılır.
Yiyecekler ile birlikte uygulama olaparib emiliminin hızını azaltmış (t2.5 saat gecikmiş ve Cyaklaşık %21 azalmıştır); fakat emilimin boyutunu anlamlı ölçüde etkilememiştir (EAA
%8 artmıştır). Dolayısıyla LYNPARZA, aç veya tok karnına alınabilir (bkz. Bölüm 4.2).
Dağılım:
İn vitro plazma proteinlerine bağlanması, klinik olarak anlamlı olan 10 µg/mL'lik konsantrasyonlarda yaklaşık %82'dir.
İn vitro koşullarda olaparibin insan plazma proteinlerine bağlanma oranı doza bağımlıdır; bağlanan kısım 1 μg/mL'de yaklaşık %91 iken, 10 μg/mL'de %82 ve 40 μg/mL'de %70'e düşmüştür. Saflaştırılmış protein çözeltilerinde albümine bağlanan olaparib fraksiyonu yaklaşık
%56 olup, olaparib konsantrasyonlarından bağımsızdır. Aynı analiz kullanılarak, alfa-1 asit glikoproteine bağlanan fraksiyon 10 μg/mL'de %29 iken, daha yüksek konsantrasyonlarda azalmış bağlanma eğilimi gözlenmiştir.
Biyotransformasyon:
İn vitro koşullarda CYP3A4/5'lerin olaparibin metabolizmasından esasen sorumlu izoenzimler olduğu gösterilmiştir (bkz. Bölüm 4.5).
Kadın hastalara 14C-olaparibin oral yolla verilmesinden sonra değişmemiş olaparib plazmadaki radyoaktivitenin büyük kısmını oluşturmuş (%70) ve gerek idrar gerekse feçeste bulunan ana bileşen olmuştur (dozun sırasıyla %15'i ve %6'sı). Olaparibin metabolizasyonu yaygındır. Metabolizmanın büyük kısmı oksidasyon reaksiyonlarına dayanmakta ve üretilen bileşenlerin bir kısmı sonrasında glukuronid veya sülfat konjügasyonuna uğramaktadır. Plazma, idrar ve feçeste sırasıyla 20, 37 ve 20'ye kadar metabolit tespit edilmiştir ve bunların çoğu dozlanan materyalin <%1'ini temsil etmektedir. Bir açık halkalı piperazin-3-ol kısmı ve iki mono- oksijenli metabolit (her biri yaklaşık %10) dolaşımdaki başlıca bileşenler olup, mono-oksijenli metabolitlerden birinin ayrıca dışkıdaki majör metabolit olduğu belirlenmiştir (idrar ve feçesteki radyoaktivitenin sırasıyla %6'sı ve %5'i).
Olaparib, in vitro olarak UGT1A4, UGT1A9, UGT2B7 veya CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 veya 2E1'i çok az inhibe etmiş/hiç inhibe etmemiştir ve bu CYP enzimlerinin herhangi birinin klinik olarak anlamlı, zamana bağlı bir inhibitörü olması beklenmez. Olaparib, UGT1A1'i in vitro olarak inhibe etmiştir, ancak PBPK simülasyonları bunun klinik önemi olmadığını düşündürmektedir. Olaparib, in vitro olarak dış akım taşıyıcısı P-gp'nin bir substratıdır, ancak bunun klinik olarak anlamlı olması olası değildir (bkz. bölüm 4.5).
İn vitro koşullardan elde edilen veriler olaparibin OATP1B1, OATP1B3, OCT1, BCRP veya MRP2 substratı olmadığını, ve OATP1B3, OAT1 veya MRP2'nin inhibitörü olmadığını göstermektedir.
Eliminasyon:
Tek bir 14C-olaparib dozundan sonra, radyoaktivitenin yaklaşık %86'sı 7 günlük toplama süresi içinde tespit edilmiştir. Bunun yaklaşık %44'ü idrar ile, yaklaşık %42'si feçes iledir. Materyalin çoğu metabolitler halinde atılmıştır.
Doğrusallık/Doğrusal olmayan durum:
LYNPARZA isimli ürünümüzün doz ve / veya zaman açısından etkin madde farmakokinetiğinin doğrusallığı / doğrusal olmaması durumu uygulanabilir değildir.
Hastalardaki karakteristik özellikler
Popülasyon bazlı farmakokinetik analizlerde hasta yaşı, vücut ağırlığı veya ırkı (Beyaz ve Japon hastaları içerir) anlamlı eşdeğişkenler olmamıştır.
Böbrek yetmezliği:
Böbrek fonksiyonları normal olan hastalar ile karşılaştırıldığında hafif derecede böbrek yetmezliği (kreatinin klirensi 51 ila 80 mL/dk) olan hastalarda EAA değeri %24, Cdeğeri
%15 artmıştır. LYNPARZA hafif derecede böbrek yetmezliği olan hastalara herhangi bir doz ayarlaması yapılmadan uygulanabilir.
Böbrek fonksiyonları normal olan hastalar ile karşılaştırıldığında orta derecede böbrek yetmeliği (kreatinin klirensi 31 ila 50 mL/dk) olan hastalarda EAA değeri %44, Cdeğeri
%26 artmıştır. Orta derecede böbrek yetmezliği olan hastalar için LYNPARZA dozunun ayarlanması önerilir (bkz. Bölüm 4.2).
Ağır derecede böbrek yetmezliği veya son evre böbrek yetmezliği (kreatinin klirensi < 30 mL/dk) olan hastalara ilişkin veri bulunmamaktadır.
Karaciğer yetmezliği:
Karaciğer fonksiyonu normal olan hastalarla karşılaştırıldığında hafif karaciğer yetmezliği (Child Pugh sınıflandırması A) görülen hastalarda EAA %15, Cmaks ise %13 artarken, orta dereceli karaciğer yetmezliği (Child Pugh sınıflandırması B) görülen hastalarda EAA %8, Cmaks ise %13 artmıştır. Hafif veya orta dereceli karaciğer yetmezliği bulunan hastalarda Lynparza dozunun ayarlanmasına gerek yoktur (bkz. bölüm 4.2). Şiddetli karaciğer yetmezliği (Child Pugh sınıflandırması C) olan hastalarla ilgili veri mevcut değildir.
Pediyatrik popülasyon:
Pediyatrik hastalarda olaparibin farmakokinetiğini incelemek üzere herhangi bir çalışma gerçekleştirilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeğiEkstrudat yardımcı maddeleri
Kopovidon K28 Kolloidal silikon dioksit
Ekstrüzyon sonrası yardımcı maddeler
Mannitol
Sodyum stearil fumarat Kolloidal silikon dioksit
Tablet kaplaması
Hipromelloz 2910
Makrogol 400
Titanyum dioksit (E171) Sarı demir oksit (E172) Saf su
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
48 ay
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında saklayınız. Nemden korumak için orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
Alu/Alu perfore olmayan blister. Ambalaj büyüklüğü:56 film kaplı tablet (7 blister)
112 film kaplı tablet içeren çoklu ambalaj (56 tabletlik iki paket)
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 50694.42 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 50694.42 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699786092907 |
| Etkin Madde | Olaparib |
| ATC Kodu | L01XK01 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |