LYNPARZA 150 mg film kaplı tablet (56 tablet) Farmakolojik Özellikler
{ Olaparib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastikler ve immunomodulatör ajanlar,antinoeplastik ajanlar, Poli (ADP-riboz) polimeraz(PARP) inhibitörleri
ATC kodu: L01XK01
Etki mekanizması ve Farmakodinamik etkiler:
Olaparib, insan poli (ADP-riboz) polimeraz enzimlerinin (PARP-1, PARP-2 ve PARP-3) potent bir inhibitörüdür ve ister tek başına tedavi olarak ister mevcut kemoterapiler ile kombinasyon halinde in vitro koşullarda seçili tümör hücre dizilerinin büyümesini ve in vivo ortamda tümör büyümesini inhibe ettiği gösterilmiştir.
PARP, DNA tek sarmal kırılmalarının etkin onarımı için gereklidir ve PARP kaynaklı onarımın önemli bir özelliği için kromatin modifikasyonu sonrasında PARP'nin kendi kendini modifiye etmesi ve DNA'dan ayrılarak baz eksizyon tamiri (BER) enzimlerinin erişimini kolaylaştırması gerekir. Olaparib, DNA bağlantılı PARP'ın aktif bölgesine bağlandığında PARP'ın ayrılmasını önler ve DNA'ya hapsederek onarımı bloke eder. Replike olan hücrelerde bu durum ayrıca replikasyon çatalı, PARP-DNA eklentileri ile karşılaştığında DNA çift sarmal kırılmaları (DSB'ler) oluşumuna da yol açar. Normal hücrelerde homolog rekombinasyon onarım (HRR) yolağı, bu DNA çift sarmal kırılmalarını onarmada etkilidir. BRCA1 veya 2 ve benzeri HRR fonksiyonel bileşenleri olmayan kanserlerde DNA DSB'ler doğru veya etkili şekilde tamir edilemez. Bunun yerine genomik instabilitede artışa yol açan klasik homolog olmayan uç birleşmesi (NHEJ) mekanizması gibi, alternatif ve hataya eğilimli mekanizmalar aktive edilir. Birkaç replikasyon turunun ardından genomik instabilite desteklenebilir olmayan düzeylere ulaşabilir ve kanser hücreleri normal hücrelere kıyasla halihazırda daha yüksek bir DNA hasarı yüküne sahip olduğundan, bu durum kanser hücresinin ölümü ile sonuçlanabilir. Neden olan bozukluk ve etkinlik tam olarak açıklanmamış olmakla birlikte, BRCA1 veya BRCA2 mutasyonlarının yokluğunda HRR mekanizması başka mekanizmalar tarafından bozulabilir. Tam fonksiyonel HRR mekanizmasının mevcut olmayışı over kanserlerinde ve diğer kanserlerde platin duyarlılığının kilit roldeki belirleyicilerinden biridir.
BRCA1/2-eksikliği bulunan in vivo modellerde platin tedavisinden sonra verilen olaparib, tek başına platin tedavisine kıyasla tümör progresyonunda bir gecikme ve genel sağkalımda bir artış ortaya çıkarmıştır ve bunlar olaparib idame tedavisi periyodu ile korelasyon göstermiştir.
BRCA1/2 mutasyonunun tespiti
Genetik testler, onaylanmış bir test kullanılarak deneyimli bir laboratuvar tarafından yapılmalıdır. Kan ve/veya tümör örnekleri üzerinde BRCA1/2 mutasyonları açısından lokal veya merkezi olarak uygulanan testler farklı çalışmalarda kullanılmıştır. Kullanılan teste ve uluslararası sınıflandırma konsensusuna bağlı olarak, BRCA1/2 mutasyonları zararlı/şüpheli zararlı veya patojenik/olası patojenik olarak sınıflandırılmıştır. Homolog rekombinasyon eksikliği (HRD) pozitif durumu, zararlı / şüpheli zararlı veya patojenik / muhtemelen patojenik olarak sınıflandırılan bir BRCA1 / 2 mutasyonunun saptanmasıyla tanımlanabilir. Bu mutasyonların tespiti, HRD pozitif durumunu belirlemek için pozitif HRD skoru ile birleştirilebilir.
Genomik instabilitenin tespiti
PAOLA-1'de araştırılan HR eksikliği ile ilişkili genomik değişiklikler, önceden tanımlanmış kriterleri ve puanı olan sürekli ölçümler olan genom çapında heterozigotluk kaybı, telomerik alelik dengesizlik ve büyük ölçekli geçişi içerir. Bileşik genomik kararsızlık skoru (GIS, HRD skoru olarak da adlandırılır), tümör hücrelerinde biriken spesifik genomik anormalliklerin kapsamını değerlendirmek içinbirleştirilmişölçümlerveilgili skorlar kullanılarak belirlenir.
Daha düşük puan, DNA'ya zarar veren ajanlara maruz kalmaya göre numune alma sırasında tümör hücrelerinin HR eksikliği olasılığının daha düşük olduğunu tanımlar ve daha yüksek puan, tümör hücrelerinin HR eksikliği olasılığının daha yüksek olduğunu belirler. GIS pozitif durumunu belirlemek için valide edilmiş kesme noktaları kullanılmalıdır.
HRD pozitif durumu, valide edilmiş bir test kullanılarak deneyimli bir laboratuvar tarafından test edilen HR eksikliği ile ilişkili genomik değişiklikler için birleşik bir GIS puanı ile tanımlanabilir.
Klinik etkililik ve güvenlilik
BRCA mutasyonlu ileri over kanserinin birinci basamak idame tedavisi: SOLO1 Çalışması
Bir Faz III randomize, çift kör, plasebo kontrollü çok merkezli çalışmada birinci basamak platin bazlı kemoterapinin tamamlanmasının ardından olaparibin idame tedavisi olarak güvenliliği ve etkililiği yeni tanı konmuş ilerlemiş (FIGO Evre III-IV) yüksek dereceli seröz veya endometroid BRCA1//2 mutasyonlu (mBRCA1//2) over kanseri hastalarında araştırılmıştır. Bu çalışmada 391 hasta LYNPARZA (günde iki defa 300 mg [2 x 150 mg tablet]) veya plasebo almak üzere 2/1 oranında randomize edilmiştir. Hastalar birinci basamak platin kemoterapisine verilen yanıta göre tam yanıt (CR) ve kısmi yanıt (PR) şeklinde basamaklandırılmıştır. Altta yatan hastalığın radyolojik progresyonuna, kabul edilemez toksisiteye veya 2 yıla kadar tedaviye devam edilmiştir. Tam klinik yanıt durumunda kalan (yani, radyolojik hastalık kanıtı olmayan) hastalar için maksimum tedavi süresi 2 yıl olarak belirlenmiştir; bununla birlikte, stabil kalan bir hastalık kanıtı olan (yani, hastalık progresyonuna dair kanıt bulunmayan) hastalar, 2 yıldan uzun süre LYNPARZA almaya devam edebilmiştir.
Germ hattı veya somatik BRCA1/2 mutasyonları görülen hastalar ya lokal bir test (n=208) veya merkezi bir test (n=181) yoluyla kanda germ hattı testinden ya da lokal bir test kullanılarak bir tümör numunesinin test edilmesinden (n=2) prospektif şekilde tespit edilmiştir. Merkezi germ hattı testinde, patojen veya olası patojen mutasyonlar, hastaların sırasıyla %95,3'ünde (365/383) ve %4,7'sinde (18/383) tespit edilmiştir. Randomize edilen hastaların %5,5'inde (21/383) BRCA1/2 genlerinde büyük yeniden düzenlenmeler tespit edilmiştir. Yerel test yoluyla kaydedilen hastaların gBRCAm durumu merkezi testle retrospektif şekilde doğrulanmıştır. Tümör örnekleri mevcut olan hastalara uygulanan retrospektif testler merkezi test kullanılarak gerçekleştirilmiştir ve %95'inde uygun bir mutasyon bulunan (bilinen [n = 47] veya muhtemel patojenik [n = 277]) 341 hastada başarılı sonuçlar elde edilmiştir ve 2 gBRCAwt hastasının sadece sBRCAm taşıdığı doğrulanmıştır. SOLO1'de BRCA1/2m germ hattı görülen 389 hasta tespit edilmiştir ve bunların 2'sinin somatik BRCA1/2m olduğu görülmüştür.
Demografik özellikler ve başlangıç özellikleri olaparib ve plasebo tedavisi kolları arasında genel olarak iyi bir denge sergilemiştir. Medyan yaşın her iki kolda 53 olduğu belirlenmiştir. Over kanserinin hastaların %85'inde primer tümör olduğu görülmüştür. En yaygın histolojik tipin seröz (%96) olduğu görülmüştür, hastaların %2'sinde endometrioid histoloji bildirilmiştir. Çoğu hastanın ECOG performans durumu 0 olarak belirlenmiştir (%78), performans durumu 2 ila 4 olan hastalarda herhangi bir veri mevcut değildir. Hastaların yüzde altmış üçüne (%63) önceden tümör rezeksiyoncerrahisiuygulanmışolduğu belirlenmiştir ve bunların
çoğunluğunda (%75) makroskobik rezidüel hastalık gözlenmemiştir. Hastaların %35'ine aralıklı tümör rezeksiyon cerrahisi uygulanmıştır ve bunların %82'sinde makroskobik rezidüel hastalık bildirilmemiştir. Tümü evre IV olan yedi hastaya sitoredüktif cerrahi uygulanmamıştır. Tüm hastalar birinci basamak platin bazlı tedavi görmüştür. Çalışmaya girişte olaparib ve plasebo kollarındaki hastaların %73'ünde ve %77'sinde, araştırmacı tarafından sırasıyla radyolojik hastalık kanıtı bulunmaması ve kanser antijeni 125'in (CA-125) normal aralıkta olması şeklinde tanımlandığı üzere, hastalık kanıtı gözlenmemiştir (CR). Başlangıçta ölçülebilir veya ölçülemez lezyonların varlığı veya yüksek CA-125 şeklinde tanımlanan PR, olaparib ve plasebo kollarındaki hastaların sırasıyla %27'sinde ve %23'ünde bildirilmiştir. Hastaların yüzde doksan üçü (%93) son platin bazlı kemoterapi dozunu takip eden 8 hafta içinde randomize edilmiştir. Bevasizumab ile tedavi uygulanan hastalar çalışma dışı bırakılmıştır, dolayısıyla daha önce bevasizumab almış olaparib hastalarına ilişkin güvenlilik ve etkililik verisi bulunmamaktadır. Somatik BRCA mutasyonu görülen hastalara ilişkin çok sınırlı veri mevcuttur.
Primer sonlanma noktası modifiye Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST)
1.1 kullanılarak araştırmacı değerlendirmesi yoluyla belirlenen ve randomizasyondan progresyona kadar geçen süre şeklinde tanımlanan progresyonsuz sağkalım (PFS) veya ölümdür. Sekonder etkililik sonlanma noktaları randomizasyondan ikinci progresyona veya ölüme kadar geçen süre (PFS2); OS (genel sağkalım), randomizasyondan tedavinin kesilmesine ölüme kadar geçen süre (TDT), randomizasyondan takip eden ilk anti-kanser tedavinin başlangıcına veya ölüme kadar geçen süre (TFST) ve sağlıkla ilişkili yaşam kalitesini (HRQoL) içermiştir. Hastalar başlangıçta ve 3 yıl boyunca her 12 haftada bir ve daha sonra randomizasyon tarihi baz alınarak objektif radyolojik hastalık progresyonuna kadar her 24 haftada bir tümör değerlendirmelerinden geçirilmiştir.
Çalışma araştırmacı tarafından değerlendirilen PFS'de plaseboya kıyasla olaparib için klinik anlamlılığa sahip olan ve istatistiksel açıdan anlamlı iyileşme ortaya koymuştur. PFS konusunda araştırmacı tarafından yapılan değerlendirme, PFS üzerinde yapılan bir körleştirilmiş bağımsız merkezi radyolojik (BICR) inceleme ile desteklenmiştir. PFS analizi sırasında, ara OS verileri olgunlaşmamıştı (% 21) ve HR 0,95'ti (%95 CI 0,60, 1,53; p değeri=0,9). Etkililik sonuçları Tablo 2 ve Şekil 1 ve 2'de sunulmaktadır.
Tablo 2 SOLO1'de BRCA1/2m ilerlemiş over kanseri görülen yeni tanı konmuş hastalara ait etkililik sonuçları
| Günde iki defa olaparib 300 mg | Plasebo |
PFS (%51 olgunluk) |
|
|
Olay sayısı: Toplam hasta sayısı (%) | 102:260 (39) | 96:131 (73) |
Medyan süre (ay) | NR | 13.8 |
HR (%95 CI) | 0.30 (0.23-0.41) |
|
P değeri (2 yanlı) | p<0,0001 |
|
PFS2 (%31 olgunluk) |
|
|
Olay sayısı: Toplam hasta sayısı (%) | 69:260 (27) | 52:131 (40) |
Medyan süre (ay) | NR | 41.9 |
HR (%95 CI) | 0.50 (0.35-0.72) |
|
P değeri (2 yanlı) | p=0,0002 |
|
TFST (%49 olgunluk) |
|
|
Olay sayısı: Toplam hasta sayısı (%) | 99:260 (38) | 94:131 (72) |
Medyan süre (ay) | 51.8 | 15.1 |
HR (%95 CI) | 0.30 (0.22-0.40) |
|
P değeri* (2 yanlı) | p<0,0001 |
|
a Kaplan-Meier hesaplamalarına göre 24 ve 36. aylarda progresyon gözlenmeyen hastaların oranı olaparib için %74 ve %60 plasebo içinse %35 ve %27 olmuştur; medyan takip süresi hem olaparib hem de plasebo kollarında 41 ay olmuştur.
b < 1 olan değerler olaparib lehinedir. Analiz, önceki platin kemoterapisine verilen yanıtı (CR veya PR) eş değişken olarak içeren bir Cox orantılı tehlikeler modeli kullanılarak gerçekleştirilmiştir.
c Plasebo kolunda takiben bir tedavi uygulanan 94 hastanın 49'u (%52) bir PARP inhibitörü almıştır.
* Multiplisite açısından kontrol edilmemiştir.
bd: günde iki kez; NR Erişilmemiştir; CI Güven aralığı; PFS progresyonsuz sağkalım; PFS2 İkinci progresyona veya ölüme kadar geçen süre; OS Genel sağkalım; TFST Randomizasyondan takip eden ilk anti-kanser tedaviye veya ölüme kadar geçen süre.
Şekil 1 SOLO1: Yeni tanı konmuş BRCA1/2m ilerlemiş over kanseri hastalarında Kaplan-Meier PFS grafiği (%51 olgunluk - araştırmacı değerlendirmesi)
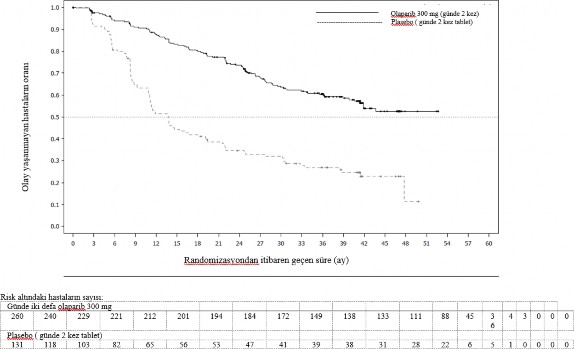
Şekil 2 SOLO1: Yeni tanı konmuş BRCA1/2m ilerlemiş over kanseri hastalarında Kaplan-Meier OS grafiği (%21 olgunluk)
Çalışmaya girişteki hastalık kanıtına göre oluşturulmuş hasta alt gruplarında tutarlı sonuçlar gözlenmiştir. Araştırmacı tarafından tanımlanan CR görülen hastalarda HR 0,34 (%95 CI 0,24- 0,47) olmuştur; olaparibte medyan PFS'ye ulaşılmamıştır, plaseboda ise medyan PFS 15,3 aydı.
24. ve 36. ayda, olaparib kolunda hastaların sırasıyla %68'i ve %45'i, plasebo kolundaki hastaların ise %34'ü ve%22'si CR durumunda kalmıştır. Çalışmaya girişte PR görülen hastalarda PFS HR 0,31 olarak tespit edilmiştir (%95 CI 0,18, 0,52; ortalama PFS olaparible 30,9 ay, plaseboyla ise 8,4 ay). Çalışmaya girişte PR görülen hastalar CR'ye ulaşmış (24. ayda olaparib kolunda %15 ve plasebo kolunda %4, 36. ayda CR durumunda kalmıştır) veya daha fazla PR/stabil hastalık sergilemiştir (24. ayda olaparib kolunda %43 ve plasebo kolunda %15, 36. ayda olaparib kolunda %17 ve plasebo kolunda %15). Son platin bazlı kemoterapi dozunu takip eden 6 ay içinde progresyon yaşayan hastaların oranı olaparib ile %3,5, plaseboyla ise
%8,4 olmuştur.
Platine duyarlı relaps yapmış (PSR) over kanserinin idame tedavisi SOLO2 çalışması
Olaparibin idame tedavisi olarak güvenliliği ve etkililiği germline BRCA1/2-mutasyonlu, platine duyarlı, relaps yapmış (PSR) over, fallop tüpü veya primer peritoneal kanserli hastalarla gerçekleştirilen bir Faz III randomize, çift kör, plasebo kontrollü çalışmada değerlendirilmiştir. Bu çalışmada progresyona kadar alınan LYNPARZA (günde iki defa 300 mg [2 x 150 mg tablet]) idame tedavisinin etkililiği platin içeren kemoterapinin tamamlanmasının ardından yanıt (CR veya PR) sergilemekte olan 295 yüksek evre seröz veya endometrioid PSR over kanseri hastasında plasebo tedavisiyle karşılaştırılmıştır (2/1 randomizasyon: 196 olaparib ve 99 plasebo).
İki veya daha fazla platin içerenrejimuygulananvehastalıkları sondan önceki platin bazlı
daha önce olaparib veya başka bir PARP inhibitörü tedavisi almış olmasına izin verilmemiştir. Hastaların, randomizasyondan hemen önceki rejimde olmamak koşuluyla, daha önce bevasizumab almış olmasına izin verilmiştir.
Tüm hastalarda başlangıçta gBRCA1/2m kanıtı tespit edilmiştir. Hastalarda görülen BRCA1/2 mutasyonlarından germline mutasyonu, ya lokal bir test ya da Myriad CLIA Integrated BRACAnalysis® testi yoluyla yahut da tümör dokusundan lokal bir test kullanılarak saptanmıştır. Randomize edilen hastaların %4,7'sinde (14/295) BRCA1/2 genlerinde büyük rearanjmanlar tespit edilmiştir.
Demografik özellikler ve başlangıç özellikleri olaparib ve plasebo kolları arasında genel olarak iyi bir denge sergilemiştir. Medyan yaşın her iki kolda 56 olduğu belirlenmiştir. Over kanserinin, hastaların > % 80'inde primer tümör olduğu görülmüştür. En yaygın histolojik tipin seröz (> %90) olduğu görülmüştür, hastaların %6'sında endometrioid histoloji bildirilmiştir. Olaparib kolunda hastaların %55'inin daha önce yalnızca 2 basamak tedavi gördüğü belirlenmiştir ve hastaların %45'i daha önce 3 veya daha fazla basamak tedavi görmüştür. Plasebo kolunda hastaların %61'inin daha önce yalnızca 2 basamak tedavi gördüğü, %39'unun ise daha önce 3 veya daha fazla basamak tedavi gördüğü belirlenmiştir. Çoğu hastanın ECOG performans durumu 0 olarak belirlenmiştir (%81). Platin uygulanmayan dönem, hastaların
%60'ında > 12 ay, %40'ında ise > 6 - 12 ay olmuştur. Önceki platin kemoterapisine yanıt hastaların %47'sinde tam, %53'ünde ise kısmi yanıt olmuştur. Olaparib ve plasebo kollarında hastaların sırasıyla %17'si ve %20'si daha önce bevasizumab almıştır.
Primer sonlanım noktası RECIST 1.1 kullanılarak araştırmacı değerlendirmesiyle PFS'dir. Sekonder etkililik sonlanma noktaları, PFS2; OS TDT, TFST, TSST ve HRQoL içermiştir.
Çalışma primer amacına ulaşmıştır ve araştırmacı tarafından değerlendirilen PFS'de 0,30'luk HR plaseboya kıyasla olaparib lehine istatistiksel açıdan anlamlı bir iyileşme ortaya koymuştur (%95 CI 0,22 - 0,41; p < 0,0001; olaparible medyan 19,1 aya karşılık plaseboyla medyan 5,5 ay). Araştırmacı tarafından değerlendirilen PFS, körleştirilmiş bir bağımsız merkezi radyolojik inceleme ile desteklenmiştir (HR 0,25; %95 CI 0,18 â 0,35; p < 0,0001; olaparib için medyan 30,2 ay, plasebo için medyan 5,5 ay). Olaparib tedavisi uygulanan hastaların %43'ü 2. yılda progresyon sergilememeye devam etmiştir, plasebo alan hastalarda ise bu oran yalnızca %15'te kalmıştır.
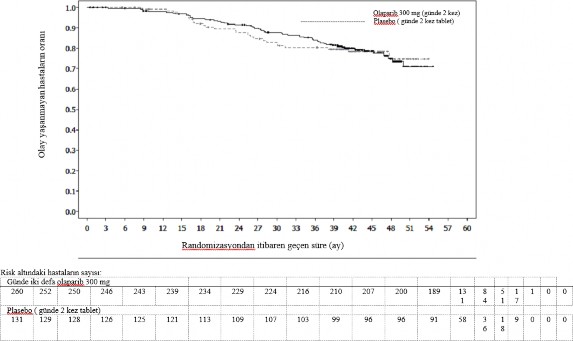
SOLO2'de gBRCA1/2m PSR over kanseri hastalarında primer sonlanma noktası açısından elde edilen sonucun bir özeti Tablo 3 ve Şekil 3'de verilmiştir.
Tablo 3: SOLO2'de gBRCA1/2m PSR over kanseri hastalarında primer sonlanma noktası açısından elde edilen sonucun özeti
| Günde iki defa olaparib 300 mg tablet | Plasebo |
PFS (%63 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 107:196 (55) | 80:99 (81) |
Medyan süre (ay) (%95 CI) | 19,1 (16,3 â 25,7) | 5,5 (5,2 â 5,8) |
HR (%95 CI) | 0,30 (0,22 â 0,41) |
|
P değeri (2 yanlı) | P < 0,0001 |
|
Şekil 3: SOLO2: gBRCA1/2m PSR over kanseri hastalarında Kaplan-Meier PFS grafiği (%63 olgunluk - araştırmacı değerlendirmesi)
bd Günde iki kez; PFS progresyonsuz sağkalım
OS'nin son analizinde (%61 olgunluk) HR 0.74 idi (%95 GA 0,54-1.00; p=0.0537; plasebo için medyan 51,7 ay ve plasebo için 38,8 ay) ve istatistiksel anlamlılığa ulaşmadı.
Sekonder sonlanma noktaları olan TFST ve PFS2, plaseboya kıyasla olaparib için kalıcı ve istatistiksel açıdan anlamlı iyileşme sergilemiştir. OS, TFST ve PFS2 için sonuçlar Tablo 4 ve Şekil 4'te sunulmaktadır.
Tablo 4: SOLO2'de gBRCA1/2m PSR yumurtalık kanseri hastaları için kilit sekonder objektif sonuçların özeti
| Olaparib 300 mg tablet, günde iki kez | Plasebo |
OS (%61 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 116:196 (59) | 65:99 (66) |
Medyan süre (%95 GA), ay | 51,7 (41,5, 59,1) | 38,8 (31,4, 48,6) |
HR (%95 GA) | 0,74 (0,54 â 1,00) | |
P değeri (2-taraflı) | p=0,0537 | |
TFST (%71 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 139:196 (71) | 86:99(87) |
Medyan süre (%95 GA), ay | 7,2 (6,3 â 8,3) | |
HR (%95 GA) | 0,37 (0,28 â 0,48) | |
P değeri (2-taraflı) | p < 0,0001 | |
PFS2 (%40 olgunluk) | ||
Olay sayısı: Toplam hasta sayısı (%) | 70:196 (36) | 49:99 (50) |
Medyan süre (%95 GA), ay | NR (24,1 â NR) | 18,4 (15,4 â 22,8) |
HR (%95 GA) | 0,50 (0,34 â 0,72) | |
P değeri (2-taraflı) | p = 0,0002 | |
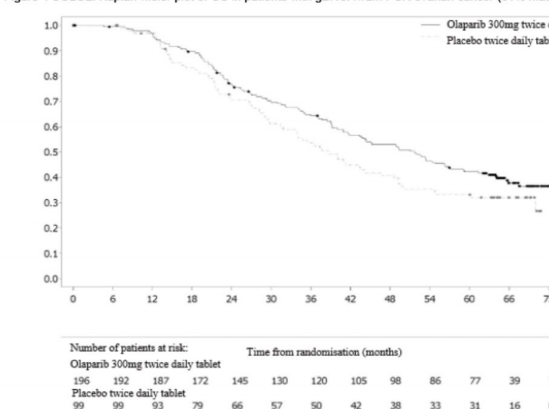
Hasta olaylarının oranı
Şekil 4 SOLO2: gBRCA1/2m PSR yumurtalık kanseri hastalarında Kaplan-Meier OS grafiği (%61 olgunluk)
Çalışmaya ölçülebilir hastalıkla (başlangıçta hedef lezyonlar) katılan hastalar arasında LYNPARZA kolunda %41'lik bir objektif yanıt oranına erişilmiştir, plaseboda ise bu oran
%17'ydi. Çalışmaya hastalık kanıtıyla (başlangıçta hedef veya hedef dışı lezyonlar) dahil edilen ve LYNPARZA ile tedavi uygulanan hastaların %15,0'ı tam yanıt elde ederken plasebo alan hastalarda ise bu oran %9,1'di.
%10,8'di. Doz duraklatma en sık olarak tedavinin ilk 3 ayı içinde, doz azaltma ise 3-6 ayı içinde meydana gelmiştir. Doz duraklatmaya veya doz azaltmaya neden olan en sık görülen advers olaylar anemi, bulantı ve kusmaydı.
FACT-O'ya ait TOI'da başlangıca göre meydana gelen değişiklik ile değerlendirildiği üzere, hasta tarafından bildirilen sonuç (PRO) verileri, plaseboya kıyasla olaparib ile tedavi edilen hastalar için herhangi bir farka işaret etmemektedir.
Çalışma 19 (D0810C00019)
Olaparibin platin temelli iki veya daha fazla tedaviyi takiben fallop tüpü veya primer peritoneal kanseri de içeren PSR over kanseri hastalarında idame tedavisi olarak güvenliliği ve etkililiği, büyük bir Faz II randomize, çift kör, plasebo kontrollü çalışmada (Çalışma 19) değerlendirilmiştir. Bu çalışmada progresyona kadar alınan LYNPARZA kapsül idame tedavisinin (günde iki defa 400 mg [8 x 50 mg kapsül]) etkililiği platin içeren kemoterapinin tamamlanmasının ardından yanıt (CR veya PR) sergilemekte olan 265 (136 olaparib ve 129 plasebo) PSR yüksek dereceli seröz over kanseri hastasında plasebo tedavisiyle karşılaştırılmıştır. Primer sonlanma noktası RECIST 1kullanılarak araştırmacı değerlendirmesine göre belirlenen PFS'dir. Sekonder etkililik sonlanma noktaları OS'yi, CR/PR+ SD (stabil hastalık) şeklinde tanımlanan hastalık kontrol oranını (DCR), HRQoL'yi ve hastalıkla ilişkili semptomları içermiştir. Aynı zamanda araştırma amaçlı TFST ve TSST analizleri de gerçekleştirilmiştir.
Hastalıkları sondan önceki platin bazlı kemoterapinin tamamlanmasından > 6 ay sonra nükseden hastalar kaydedilmiştir. Kayıtta BRCA1/2 mutasyonu kanıtı şartı aranmamıştır (bazı hastaların BRCA mutasyonu durumu retrospektif şekilde belirlenmiştir). Hastaların daha önce olaparib veya başka bir PARP inhibitörü tedavisi almış olmasına izin verilmemiştir. Hastaların, randomizasyondan hemen önceki rejimde olmamak koşuluyla, daha önce bevasizumab almış olmasına izin verilmiştir. Olaparib tedavisi sırasında ortaya çıkan progresyonun ardından olaparible yeniden tedaviye izin verilmemiştir.
BRCA1/2 mutasyonları görülen hastalar ya lokal bir test ya da Myriad CLIA Integrated BRACAnalysis® testi yoluyla kandan germline mutasyon ya da Foundation Medicine tarafından gerçekleştirilen bir test kullanılarak bir tümör dokusunsunda mutasyon saptanmıştır. Randomize edilen hastaların %7,4'ünde (10/136) BRCA1/2 genlerinde büyük rearanjmanlar tespit edilmiştir.
Demografik özellikler ve başlangıç özellikleri olaparib ve plasebo kolları arasında genel olarak iyi bir denge sergilemiştir. Medyan yaşın her iki kolda 59 olduğu belirlenmiştir. Over kanserinin hastaların %86'sında primer tümör olduğu görülmüştür. Olaparib kolunda hastaların %44'ünün daha önce yalnızca 2 basamak tedavi gördüğü belirlenmiştir ve hastaların %56'sı daha önce 3 veya daha fazla basamak tedavi görmüştür. Plasebo kolunda hastaların %49'unun daha önce yalnızca 2 basamak tedavi gördüğü, %51'inin ise daha önce 3 veya daha fazla basamak tedavi gördüğü belirlenmiştir. Çoğu hastanın ECOG performans durumu 0 olarak belirlenmiştir (%77). Platin uygulanmayan dönem hastaların %60'ında > 12 ay, %40'ında ise > 6-12 ay olmuştur. Önceki platin kemoterapisine yanıt hastaların %45'inde tam, %55'inde ise kısmi olmuştur. Olaparib ve plasebo kollarında hastaların sırasıyla %6'sı ve %5'i daha önce bevasizumab almıştır.
Çalışma primer amacına ulaşmıştır ve genel popülasyonda PFS'de 0,35'lik HR ile plaseboya kıyasla olaparib lehine istatistiksel açıdan anlamlı bir iyileşme ortaya koymuştur (%95 CI 0,25
- 0,49; p < 0,00001; olaparible medyan 8,4 aya karşılık plaseboyla medyan 4,8 ay). Olgunluk düzeyi %79 olan son OS analizinde (veri kesme tarihi [DCO] 9 Mayıs 2016), olaparib ile plasebo karşılaştırıldığında gözlenen tehlike oranı 0,73 (%95 CI 0,55 â 0,95; p = 0,02138 [<0,0095'lik önceden belirlenmiş anlamlılık düzeyini karşılamamıştır]; olaparible medyan 29,8 aya karşılık plaseboyla medyan 27,8 ay) olmuştur. Olaparible tedavi uygulanan grupta hastaların %23,5'i (n=32/136) tedaviye ≥ 2 yıl süresince devam etmiştir, plasebo alan hastalarda ise bu oran %3,9 (n=5/128) olmuştur. Hasta sayıları sınırlı olmakla birlikte olaparible tedavi uygulanan grupta hastaların %13,2'si (n=18/136) tedaviye ≥ 5 yıl süresince devam etmiştir, plasebo grubunda ise bu oran %0,8 (n=1/128) olmuştur.
Önceden planlanmış alt grup analizinde BRCA1/2-mutasyonlu over kanseri görülen hastaların (n=136, %51,3; somatik tümör BRCA1/2 mutasyonu tespit edilen 20 hasta dahil) olaparib idame monoterapisinden en fazla klinik fayda elde eden alt grup olduğu tespit edilmiştir. Aynı zamanda BRCA1/2'nin yabanıl tipinin/anlamı belirsiz olan varyantlarının (BRCA1/2 wt/VUS) görüldüğü hastalarda da daha düşük boyutlu olmakla birlikte bir fayda gözlenmiştir. Alt grup analizleri için uygulamaya konmuş herhangi bir çoklu test stratejisi mevcut değildir.
Çalışma 19'da BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında primer sonlanma noktası açısından elde edilen sonucun bir özeti Tablo 5'te ve Çalışma 19'daki tüm hastalar için Tablo 5 ve Şekil 4'de verilmiştir.
Tablo 5: Çalışma 19'da tüm hastalar ve BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında primer sonlanma noktası açısından elde edilen sonucun özeti
| ||||||
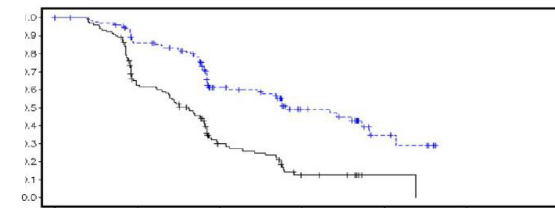
Şekil 4: Çalışma 19: DCO 30 Haziran 2010'da FAS'de (%58 olgunluk â araştırmacı değerlendirmesi) Kaplan-Meier PFS grafiği
Randomizasyondan itibaren geçen süre (ay)
Olaparib 400 mg
------ - - - - - - - -
![]()
![]()
-------- - - - - - - -
Risk altındaki hastaların sayısı:
136 | 106 | 53 | 24 | 7 | 0 | Günde iki defa olaparib 400 mg |
129 | 72 | 24 | 7 | 1 | 0 | Plasebo |
bd günde iki defa; DCO veri kesme tarihi; FAS Tam analiz seti; PFS Progresyonsuz sağkalım
Çalışma 19'da BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında kilit sekonder sonlanma noktaları açısından elde edilen sonucun bir özeti Tablo 4'te ve Çalışma 19'daki tüm hastalar için Tablo 6 ve Şekil 5'te verilmiştir.
Tablo 6: Çalışma 19'da tüm hastalar ve BRCA1/2-mutasyonlu ve BRCA1/2 wt/VUS PSR over kanseri hastalarında kilit sekonder sonlanma noktaları açısından elde edilen sonucun özeti
| ||||||
Şekil 5: Çalışma 19: DCO 09 Mayıs 2016'da FAS'de (%79 olgunluk) Kaplan-Meier OS grafiği

bd günde iki defa; DCO veri kesme tarihi; FAS Tam analiz seti; OS Genel sağkalım
PFS analizi sırasında medyan tedavi süresi olaparib için 8 ay, plasebo içinse 4 ay olarak belirlenmiştir. Hastaların çoğu günde iki defa 400 mg şeklindeki başlangıç dozunda kalmıştır. Advers olay nedeniyle doz duraklatma, azaltma, kesme insidansı sırasıyla %34,6, %25,7 ve
%5,9 olmuştur. Doz duraklatma ve azaltma en sık olarak tedavinin ilk 3 ayı içinde ortaya çıkmıştır. Dozun duraklatılmasına veya azaltılmasına en sık neden olan advers olaylar bulantı, anemi, kusma, nötropeni ve bitkinlik olmuştur. Anemi advers reaksiyonlarının insidansının
%22,8 (CTCAE derece ≥ 3 %7,4) olduğu belirlenmiştir.
TOI ve FACT-O toplam iyileşme ve kötüleşme oranları ile değerlendirildiği üzere, hasta tarafından bildirilen sonuç (PRO) verileri olaparib ile tedavi uygulanan hastalar ile plasebo arasında herhangi bir farka işaret etmemektedir.
OPINION Çalışması
Bir Faz IIIb tek kollu, çok merkezli çalışma olan OPINION'da olaparib, PSR yumurtalık, fallop tüpü veya primer periton kanseri olan ve bilinen bir zararlı veya zararlı olduğundan şüphelenilen gBRCA mutasyonu olmayan hastalarda, iki veya daha fazla basamak platin bazlı kemoterapiyi takiben idame tedavisi olarak araştırılmıştır. Platin bazlı kemoterapinin tamamlanmasının ardından hastalığı yanıt veren (CR veya PR) hastalar çalışmaya kaydedilmiştir. Toplam 279 hasta kaydedilmiş olup bu hastalara, hastalık progresyonuna veya kabul edilemez toksisiteye kadar olaparib tedavisi verilmiştir. Merkezi teste göre hastaların
%90,7'sinin durumu gBRCAm dışı olarak onaylanmış, ayrıca %9,7'sinin durumu ise sBRCAm
olarak tanımlanmıştır.
Primer sonlanma noktası, değiştirilmiş RECIST v.1.1'e göre araştırmacı tarafından değerlendirilen PFS idi. Sekonder sonlanma noktaları OS'i içermiştir.
Olaparib, idame tedavisi olarak kullanıldığında, gBRCAm olmayan PSR yumurtalık kanserli hastalarda klinik aktivite göstermiştir. Primer PFS analizi sırasında, OS verileri %30 oranında matüriteye sahipti.
OPINION'da gBRCAm olmayan PSR yumurtalık kanserli hastalar için primer objektif sonucun bir özeti Tablo 7' de sunulmuştur.
Tablo 7: OPINION'da gBRCAm olmayan PSR yumurtalık kanserli hastaların progresyonsuz sağkalım özeti
| Olaparib tablet 300 mg bd |
PFS (%75 matürite) (DC2 2 Ekim 2020 | |
Olay sayısı: toplam hasta sayısı (%) | 210:279 (75.3) |
Medyan PFS (%95 CI), aya | 9.2 (7.6, 10.9) |
a Kaplan-Meier tekniği kullanılarak hesaplanmıştır.
Medyan PFS için güven aralıkları Brookmeyer Crowley yöntemine göre türetilmiştir. bd: Günde iki kez; PFD: Progresyonsuz sağkalım; DCO: Veri kesimi; CI: Güven aralığı.
HRD pozitif ileri evre yumurtalık kanserinin birinci basamak idame tedavisi
PAOLA-1 Çalışması
PAOLA-1, bevasizumab (her 3 haftada bir intravenöz infüzyon olarak verilen 15 mg/kg) ile kombinasyon halinde verilen Lynparza'nın (günde iki kez 300 mg [2 x 150 mg tablet]) etkililik ve güvenliliğini birinci basamak platin bazlı kemoterapi ve bevasizumabı takiben ileri evre (FIGO Evre III-IV) yüksek dereceli epitelyal over, fallop tüpü veya primer periton kanserinin idame tedavisi için plasebo ile kombine bevasizumab ile karşılaştıran bir Faz III randomize, çift kör, plasebo kontrollü, çok merkezli çalışmaydı. Bevasizumab tedavisi, kemoterapi ile birlikte verildiği ve idame olarak verildiği dönem dahil olmak üzere toplam 15 ay/22 kürdü.
Çalışmada 806 hasta (2:1 randomizasyon: 537 olaparib/bevasizumab: 269 plasebo/bevasizumab) randomize edilmiş olup bunlar tam cerrahi rezeksiyon nedeniyle hastalık belirtisi olmayan (NED) ya da platin ve bevasizumab içeren birinci basamak kemoterapinin tamamlanmasından sonra tam yanıt (CR) ya da kısmi yanıt (PR) veren hastalardı. Hastalar minimum 4 ve maksimum 9 kürü tamamlamış olup çoğu (%63), minimum 2 kür bevasizumab ile birlikte kemoterapinin son 3 kürü dahil olmak üzere 6 kür birinci basamak platin-taksan bazlı kemoterapi görmüştür. Randomizasyon öncesinde bevasizumab kürlerinin medyan sayısı 5'ti.
Hastalar, birinci basamak tedavinin sonucuna (sitoredüktif cerrahinin zamanlaması ve sonucu ile platin bazlı kemoterapiye yanıt) ve prospektif lokal testlerle belirlenen tBRCAm durumuna göre katmanlandırılmıştır. Hastalar idame ortamında bevasizumaba devam etmiş ve son kemoterapi dozlarının tamamlanmasından minimum 3 hafta ve maksimum 9 hafta sonra Lynparza tedavisine başlamıştır. Altta yatan hastalığın progresyonuna, kabul edilemez toksisiteye veya 2 yıla kadar Lynparza tedavisine devam edilmiştir. Tedaviyi uygulayan doktorun düşüncesine göretedaviyedevamedilmesindendaha da yarar sağlayabileceği
Demografik ve başlangıç özellikleri, ITT popülasyonu ile tBRCAm (prospektif ve retrospektif olarak tanımlanan), GIS ve HRD durumuna (bu çalışmada her iki biyobelirteçin kombinasyonu şeklinde tanımlanan) göre biyobelirteç tanımlı alt gruplardaki her iki kolda dengeliydi. Hastaların medyan yaşı 61'di. Her iki koldaki çoğu hastanın ECOG performans durumu 0'dı (%70). Yumurtalık kanserinin hastaların %86'sında primer tümör olduğu görülmüştür. En yaygın histolojik tipin seröz (%96) olduğu görülmüştü ve hastaların %2'sinde endometrioid histoloji bildirilmiştir. Hastaların çoğuna FIGO evresi NIC'te tanı konmuştu (%63). Tüm hastalara birinci basamak platin bazlı tedavi ve bevasizumab verilmiştir. Hastaların %63'ünde ilk veya aralıklı tümör çıkarma cerrahisinde tam sitoredüksiyon ve %37'sinde rezidüel makroskopik hastalık olan hastalar cerrahi sonuçla sınırlanmamıştır. Her iki koldaki hastaların yüzde otuzu (%30) taramada tBRCAm idi. Biyobelirteç alt gruplarındaki demografik ve başlangıç özellikleri ITT popülasyonundakilerle tutarlıydı. HRD-pozitif alt grubunda, hastaların %65'i tam sitoredüksiyon görmüştü ve hastaların %35'inde rezidüel makroskopik hastalık vardı. Kaydolan genel hasta popülasyonunda, her iki koldaki hastaların %30'u lokal testlerle yapılan taramada tBRCAm idi (yıkıcı/patojenik mutasyon) ve hastaların %4'ü için BRCAm durumu bilinmiyordu. Mevcut klinik örneklerin retrospektif analizi, tBRCAm durumunu doğrulamak ve yukarıda açıklandığı gibi genomik instabiliteyi araştırmak üzere hastaların %97'si üzerinde gerçekleştirilmiştir.
tBRCAm olmayan hastaların %29'unda (genel popülasyonun %19'u) bu çalışmada bileşik skor
≥42 olarak önceden tanımlanmış pozitif GİS vardı. tBRCAm durumu ve pozitif GIS birleştirildiğinde, tümörleri HRD-pozitif, HRD-negatif ve HRD bilinmiyor durumunda olan hastalar genel hasta popülasyonunun %48'i, %34'ü ve %18'ini temsil ediyordu.
Primer sonlanma noktası modifiye Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST)
1.1 kullanılarak araştırmacı değerlendirmesi yoluyla belirlenen ve randomizasyondan progresyona kadar geçen süre şeklinde tanımlanan progresyonsuz sağkalım (PFS) veya ölümdü. Sekonder etkililik sonlanma noktaları arasında randomizasyondan ikinci progresyona veya ölüme kadar geçen süre (PFS2); genel sağkalım (OS), randomizasyondan takip eden ilk kanser tedavisinin başlangıcına veya ölüme kadar geçen süre (TFST) ve sağlıkla ilişkili yaşam kalitesi (HRQoL) bulunuyordu. Hastalara başlangıçta ve 42 aya kadar veya objektif radyolojik hastalık progresyonuna kadar her 24 haftada bir (klinik veya CA 125 progresyonu ise 12 haftada CT/MRI) RECIST 1.1 tümör değerlendirmeleri yapılmıştır.
Çalışma, plasebo/bevasizumab koluna kıyasla olaparib/bevasizumab kolu için araştırmacı tarafından değerlendirilen PFS'de istatistiksel açıdan önemli bir iyileşme sergileyen ITT popülasyonunda primer sonlanma noktasını karşılamıştır (plasebo/bevasizumab için medyan 16,6 ay karşısında olaparib/bevasizumab için 22,1 ay ile HR 0,59, %95 GA 0,49-0,72, p<0,0001). Bu, PFS'nin BICR analizi ile tutarlıydı. Bununla birlikte, biyobelirteç pozitif (tBRCAm ve/veya GIS pozitif olarak tanımlanan tBRCAm, GIS, HRD durumu pozitif) olarak tanımlanmış hastalar en çok faydayı görmüştür.
Genel popülasyonda nihai PFS2 analizi (DCO 22 Mart 2020, %53 olgunluk) istatistiksel açıdan önemliydi (HR 0,78, %95 GA, p=0,0125 plasebo/bevasizumab için 32,6 aya karşılık olaparib/bevasizumab için 36,5 aylık medyanla). Genel sağkalım verileri, genel popülasyon ve biyobelirteç alt gruplarında olgun değildi. Olaparib/bevasizumab kolundaki hastaların yüzde altmışı (%60) ile plasebo/bevasizumab kolundaki hastaların %74'ü daha sonra tedavi görmüştür ve olaparib/bevasizumab ve plasebo/bevasizumab kollarındaki bu hastaların sırasıyla %20 ve
%47'si bir PARP inhibitörüalmıştır.
Randomize alt grup olarak tBRCAm'de (241/806 hasta) olaparib/bevasizumab kolu için medyan PFS 37,2 ay iken plasebo/bevasizumab kolu için 22,0 aydı (HR = 0,34, %95 GA 0,23,0,51) ve OS (DCO 22 Mart 2020) HR 0,68 (%95 GA 0,40, 1,19) idi.
Retrospektif olarak analiz edilen tümör örneklerine dayanan diğer biyobelirteç alt grup analizlerindeki etkililik sonuçları Tablo 8'de sunulmaktadır.
Tablo 8 PAOLA-1'de ileri evre yumurtalık kanseri hastalarında tBRCAm ve/veya GIS ile tanımlanan homolog rekombinasyon eksikliği (HRD) pozitif durumu olan hastalar için temel etkililik bulgularının özeti
| tBRCAm*, (n=235) | GIS pozitif *, (n=152) | HRD pozitif* (n=387) | |||
| Olaparib / bevasizumab | Plasebo / bevasizumab | Olaparib / bevasizumab | Plasebo / bevasizumab | Olaparib / bevasizumab | Plasebo / bevasizumab |
PFS, araştırmacı değerlendirmesi (%46 olgunluk) DCO 22 Mart 2019 | ||||||
Olay sayısı: Toplam hasta sayısı (%) |
44/158 (28) |
52/77 (68) |
43/97 (44) |
40/55 (73) |
87/255 (34) |
92/132 (70) |
Medyan süre (ay) | 37,2 | 18,8 | 28,1 | 16,6 | 37,2 | 17,7 |
HR (%95) GA | 0,28 (0,19, 0,42) | 0,43 (0,28, 0,66) | 0,33 (0,25, 0,45) | |||
PFS2, araştırmacı değerlendirmesi (%40 olgunluk) DCO 22 Mart 2019 | ||||||
Olay sayısı: Toplam hasta sayısı (%) |
44/158 (28) |
37/77(48) |
41/97 (42) |
33/55 (60) |
85/255 (33) |
70/132 (53) |
Medyan süre (ay) | NR | 42,2 | 50,3 | 30,1 | 50,3 | 35,4 |
HR (%95) GA | 0,53 (0,34, 0,82) | 0,60 (0,38, 0,96) | 0,56 (0,41, 0,77) | |||
Ara OS (%27 olgunluk) k) DCO 22 Mart 2020 | ||||||
Olay sayısı: Toplam hasta sayısı (%) |
31/158 (20) |
23/77 (30) |
30/97 (31) |
19/55 (35) |
61/255 (24) |
42/132 (32) |
Medyan süre (ay) | NR | NR | NR | 45,8 | NR | NR |
HR (%95) GA | 0,61 (0,36, 1,06) | 0,84 (0,48, 1,52) | 0,70 (0,47, 1,04) | |||
* Önceden planlanan alt grup
%71 ve %29 karşısında olaparib/bevasizumab için %89 ve %66 idi.

Olaysız hasta oranı
Şekil 6: PAOLA-1: PAOLA-1'de HRD pozitif olarak tanımlanmış ileri evre yumurtalık kanseri olan hastalar için Kaplan Meier PFS grafiği (%46 olgunluk - araştırmacı değerlendirmesi)
gBRCA1/2-mutasyonlu HER2-negatif metastatik meme kanseri
OlympiAD (Çalışma D0819C00003)
HER2-negatif metastatik meme kanseri olan gBRCA1/2-mutasyonlu hastalarda olaparibin etkililiği ve güvenliliği randomize, açık-etiketli, kontrollü bir Faz III çalışmasında (OlympiAD) çalışılmıştır. Bu çalışmada, belgelendirilmiş zararlı veya şüpheli zararlı bir gBRCA mutasyonu bulunan 302 hasta progresyona veya kabul edilemez toksisiteye kadar 2:1 oranında Lynparza (300 mg [2 x 150 mg tablet] günde 2 kez) veya hekimin kemoterapi seçimini (kapesitabin %42, eribulin %35, orvinorelbin %17) alacak şekilde randomize edilmişlerdir. BRCA1/2 mutasyonları olan hastalar lokal bir test veya Myriad'da merkezi bir test yoluyla germ hattının test edilmesiyle tanımlanmışlardır. Hastalar şunlara göre basamaklandırılmıştır: metastatik meme kanseri için daha önce kemoterapi rejimi alıcısı (evet/hayır), hormon reseptörü (HR) pozitife karşı üçlü negatif (TNBC), meme kanseri için daha önce platinum tedavisi (evet/hayır). Primer sonlandırma noktası, körleştirilmişbağım sızmerkez i denetleme (BCIR) tarafından
RECIST 1.1 kullanılarak değerlendirilen PFS idi. Sekonder sonlandırma noktaları PFS2, OS, objektif yanıt oranı (ORR) ve HRQoL'yi içermekteydi.
Hastalar kontrendike değilse bir antrasiklin ve (neo)adjuvan veya metastatik bir ortamda bir taksan almış olmalıydı. HR+ (ER ve/veya PgR pozitif) tümörleri olan hastalar en az bir endokrin tedavi (adjuvan veya metastatik) almış ve bu tedavi esnasında progresyon göstermiş olmalı veya tedaviyi yürüten hekim tarafından endokrin tedavi için uygun olmayan bir hastalıklarının olması gerekmekteydi. Platinum tedavisi sırasında hastalık progresyon kanıtlarının olmaması şartıyla metastatik ortamda ve son dozun randomizasyondan en az 12 ay önce alınmış olması şartıyla (neo)adjuvan ortamda daha önceden platinum tedavisi alınmış olmasına izin verilmiştir. Olaparib dahil olmak üzere bir PARP inhibitörüyle daha önceki tedaviye izin verilmemiştir.
Demografik ve bazal karakteristikler olaparib ve karşılaştırma kollarında genellikle iyi dengeliydi (Bkz. Tablo 9).
Tablo 9: OlympiAD'da hasta demografik ve bazal karakteristikleri
| Olaparib 300 mg bd n = 205 | Kemoterapi n = 97 |
Yaş â yıl (medyan) | 44 | 45 |
Cinsiyet (%) |
|
|
Kadın | 200 (98) | 95 (98) |
Erkek | 5 (2) | 2 (2) |
Irk (%) |
|
|
Beyaz | 134 (65) | 63 (65) |
Asyalı | 66 (32) | 28 (29) |
Diğer | 5 (2) | 6 (6) |
ECOG performans durumu (%) | ||
0 | 148 (72) | 62 (64) |
1 | 57 (28) | 35 (36) |
Genel hastalık sınıflandırması | ||
Metastatik | 205 (100) | 97 (100) |
Lokal olarak ilerlemiş | 0 | 0 |
Yeni metastatik meme kanseri (%) | 26 (13) | 12 (12) |
Hormon reseptör durumu (%) | ||
HR+ | 103 (50) | 49 (51) |
TNBC | 102 (50) | 48 (49) |
gBRCA mutasyon tipi (%) | ||
gBRCA1 | 117 (57) | 51 (53) |
gBRCA2 | 84 (41) | 46 (47) |
gBRCA1 ve gBRCA2 | 4 (2) | 0 |
≥2 Metastatik yer (%) | 159 (78) | 72 (74) |
Metastaz lokalizasyonu (%) | ||
Sadece kemik | 16 (8) | 6 (6) |
Diğer | 189 (92) | 91 (94) |
BICR ile Ölçülebilir hastalık (%) | 167 (81) | 66 (68) |
159 (78) | 73 (75) https://www.turkiye.gov.tr/saglik-titck-ebys | |
Tanı anında tümör derecesi | ||
İyi diferansiye (G1) | 5 (2) | 2 (2) |
Orta derecede diferansiye (G2) | 52 (25) | 23 (24) |
Kötü diferansiye (G3) | 108 (53) | 55 (57) |
Diferansiye olmayan (G4) | 4 (2) | 0 |
Değerlendirilemeyen (GX) | 27 (13) | 15 (16) |
Eksik | 9 (4) | 2 (2) |
Metastatik meme kanser için daha önceki kemoterapi serisi sayısı (%) | ||
0 | 68 (33) | 31 (32) |
1 | 80 (39) | 42 (43) |
2 | 57 (28) | 24 (25) |
Daha önceki platinum-bazlı tedavi (%) | 55 (27) | 21 (22) |
Sadece (neo)adjuvan ortamda | 12 (6) | 6 (6) |
Sadece metastatik ortamda | 40 (20) | 14 (14) |
(neo)adjuvan ve metastatik ortamda | 3 (1) | 1 (1) |
Daha önceki antrasiklin tedavisi | ||
Sadece (neo)adjuvan ortamda | 169 (82) | 76 (78) |
Metastatik ortam | 41 (20) | 16 (17) |
Daha önceki taksan tedavisi | ||
Sadece (neo)adjuvan ortamda | 146 (71) | 66 (68) |
Metastatik ortam | 107 (52) | 41 (42) |
Daha önceki antrasiklin ve taksan tedavisi | 204 (99,5) | 96 (99) |
Takip eden tedavi olarak, tedavi ve karşılaştırma kollarında hastaların sırasıyla %0,5 ve %8'i bir PARP inhibitörü almıştır; hastaların sırasıyla %29 ve %42'si takip eden platinum tedavisi almışlardır.
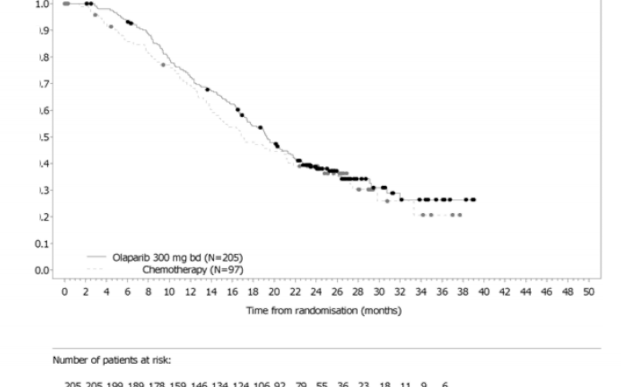
Karşılaştırma kolu ile kıyaslandığında olaparib ile tedavi edilen hastalar için primer etkililik sonucu olan PFS'de istatistiksel olarak anlamlı bir iyileşme gösterilmiştir (Bkz. Tablo 10 ve Şekil 7).
Tablo 10: OlympiAD'da gBRCA1/2 mutasyonlu HER2-negatif metastatik meme kanserli hastalar için anahtar etkililik bulgularının özeti
| Olaparib 300 mg bd | Kemoterapi |
PFS (%77 olgunluk) â DCO 09 Aralık 2016 | ||
Olay sayısı: Toplam hasta sayısı (%) | 163:205 (80) | 71:97 (73) |
Medyan süre (ay) (%95 GA) | 7,0 (5,7 â 8,3) | 4,2 (2,8 â 4,3) |
HR (%95 GA) | 0,58 (0,43 â 0,80) | |
p-değeri (2-yönlü) | p = 0,0009 | |
PFS2 (%65 olgunluk) - DCO 25 Eylül 2017 | ||
Olay sayısı: Toplam hasta sayısı (%) | 130:205 (63) | 65:97 (67) |
Medyan süre (ay) (%95 GA) | 12,8 (10,9 â 14,3) | 9,4 (7,4 â 10,3) |
HR (%95 GA) | 0,55 (0,39 â 0,77) | |
p-değeri (2-yönlü) | p = 0,0005 | |
OS (%64 olgunluk) â DCO 25 Eylül 2017 | ||
Olay sayısı: Toplam hasta sayısı (%) | 130:205 (63) | 62:97 (64) |
Medyan süre (ay) (%95 GA) | 19,3 (17,2 â 21,6) | 17,1 (13,9 â 21,9) |
HR (%95 GA) | 0,90 (0,66 â 1,23) | |
p-değeri (2-yönlü) | p = 0,5131 | |
ORR â DCO 09 Aralık 2016 | ||
Objektif yanıt verenlerin sayısı: ölçülebilir hastalığı olan hastaların toplam sayısı (%) | 87:167 (52) | 15:66 (23) |
%95 GA | 44,2 â 59,9 | 13,3 â 35,7 |
DOR â DCO 09 Aralık 2016 | ||
Medyan, (ay) (%95 GA) | 6,9 (4,2, 10,2) | 7,9 (4,5, 12,2) |
%1,5'inde tam yanıt vardı; olaparib kolunda 74/178 (%44) hastada parsiyel yanıt varken kemoterapi kolunda 14/66 (%21) hastada parsiyel yanıt vardı. TNBC hasta alt-grubunda teyit edilmiş ORR olaparib kolunda %48 (41/86) ve karşılaştırma kolunda %12 (4/33) idi. HR+ hasta alt-grubunda teyit edilmiş ORR olaparib kolunda %57 (46/81) ve karşılaştırma kolunda %33 (11/33) idi.
bd Günde 2 kez; DOR Yanıt süresi; DCO Veri kesme noktası; HR Tehlike oranı; HR+ Hormon reseptörü pozitif, ORR Objektif yanıt oranı; OS genel sağkalım; PFS progresyonsuz sağkalım; PFS2 İkinci progresyona veya ölüme kadar geçen süre, TNBC üçlü negatif meme kanseri.
Şekil 7: OlympiAD: gBRCA1/2-mutasyonlu HER2-negatif metastatik meme kanseri hastalarında Kaplan-Meier BICR PFS eğrisi (%77 olgunluk) DCO 09 Aralık2016
Progresyonsuzluk olasılığı
Randomizasyondan sonra geçen süre (ay)
Önceden tanımlanmış bütün hasta alt-gruplarında tutarlı sonuçlar gözlenmiştir (Bkz. Şekil 9). Alt-grup analizi TNBC (HR 0,43; %95 GA: 0,29 â 0,63, n = 152) ve HR+ (HR 0,82; %95 GA:
0,55 â 1,26, n = 150) hasta alt-gruplarında karşılaştırma ilacına karşı olaparibin PFS yararını göstermiştir.
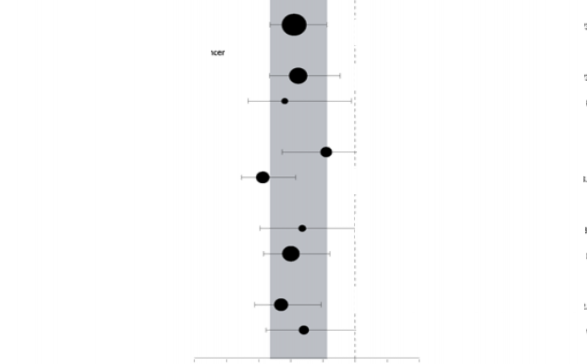
Şekil 8: PFS (BICR), meta-analiz diyagramı, önceden belirlenmiş alt-gruba göre
Platinum dışında başka bir kemoterapide progresyon göstermeyen hasta alt-grubunun post-hoc analizinde medya PFS olaparib kolunda (n=22) 8,3 aya karşı (%95 GA 3,1 â 16,7) kemoterapi kolunda 2,8 ay (%95 GA 1,4 â 4,2) (n = 16) olup HR 0,54 (%95 GA 0,24 â 1,23) idi. Ancak hastaların sayısı bu alt-grupta etkililik konusunda anlamlı sonuçlar çıkartılamayacak kadar sınırlıydı.
Yedi erkek hasta randomize edilmiştir (5 olaparib ve 2 karşılaştırma ilacı). PFS analizi anında olaparib kolundaki bir hastada 9,7 aylık yanıt süreli teyit edilmiş bir parsiyel yanıt vardı. Karşılaştırma kolunda teyit edilmiş yanıtlar yoktu.
Randomizasyondan sonra geçen süre (ay)
Genel sağkalım olasılığı
Şekil 9: OlympiAD: gBRCA1/2-mutasyonlu HER2-negatif metastatik meme kanseri hastalarında Kaplan-Meier OS grafiği (%64 olgunluk) DCO 25 Eylül 2017
Metastatik meme kanseri için daha önce kemoterapi almayan hastalarda OS analizi, bu hastalarda 0,45 HR (%95 GA 0,27 â 0,77) ile birlikte bir yararı gösterirken daha fazla tedavi serisi için HR'nin 1'i geçtiğini göstermiştir.
Germ hattı BRCA mutasyonlu metastatik pankreas adenokarsinomunun birinci basamak tedavisinden sonra idame:
POLO Çalışması
İdame tedavisi olarak olaparibin etkililiği ve güvenliliği metastatik pankreas adenokarsinomu bulunan germ hattı BRCA1/2 Mutasyonlu 154 hastada yapılan randomize (3:2), çift-kör, plasebo-kontrollü, çok-merkezli bir çalışmada çalışılmıştır. Hastalar hastalık progresyonuna veya kabul edilemez toksisiteye kadar günde iki kez 300 mg Lynparza (2 x 150 mg tablet) veya plasebo (n = 62) almıştır. Hastalar birinci-basamak platinum-bazlı kemoterapi esnasında progresyon göstermemiş olmalı ve daha sonra kabul edilemez toksisite sebebiyle herhangi bir zamanda sonlandırılabilecek olan minimum 16 haftalık sürekli platinum tedavisi almış olmalıyken geri kalan ajanlar planlanmış rejime göre veya diğer komponent(ler) için kabul edilemez toksisiteye göre devam ettirilebilmiştir. Progresyona kadar bütün platinum-içeren kemoterapi rejimini tolere edebilen hastalar bu çalışma için düşünülmemiştir. Progresyon yokluğunda veya daha önceki anti-kanser tedavisinin alopesi, derece 3 periferik nöropati ve Hgb ≥ 9 g/dL dışındaki diğer bütün toksisiteleri CTCAE derece 1'e çözülmemişse birinci- basamak kemoterapi komponent(ler)inin son dozundan 4 ila 8 hafta sonra başlanmıştır.
Germ hattı BRCA1/2 mutasyonlu hastaların 31'i (%31) daha önceki yerel test sonuçlarından ve
%69'u merkezi testlerden tanımlanmıştır. Olaparib kolunda hastaların %32'si bir germ hattı BRCA1 mutasyonu, %64'ü bir germ hattı BRCA2 mutasyonu ve %1'i hem BRCA1 hem de BRCA2 mutasyonlarını taşımaktaydı. Plasebo kolunda hastaların %26'sı germ hattı BRCA1 mutasyonu, %73'ü Germ hattı BRCA2 mutasyonu taşımaktaydı ve hiçbir hasta hem BRCA1 hem de BRCA2 mutasyonunu taşımamaktaydı. Daha önceki lokal test sonuçları kullanılarak tanımlanan bütün hastaların BRCAm durumu merkezi teste gönderilerek teyit edilmiştir. Hastaların %98'i zararlı bir mutasyon ve %2'si şüpheli zararlı bir mutasyon taşımaktaydı. Randomize edilen hastaların %5,2'sinde (8/154) BRCA1/2 genlerinde büyük yeniden düzenlenmeler tespit edilmiştir.
Demografik ve bazal karakteristikler olaparib ve plasebo kolları arasında genellikle iyi dengeliydi. Medyan yaş her iki kolda 57 yıl idi; olaparib kolunda hastaların %30'u ≥ 65 yaşındaken bu oran plasebo kolunda %20 idi. Olaparib kolundaki hastaların %58'i ve plasebo kolundaki hastaların %50'si erkekti. Olaparib kolunda hastaların %89'u beyazdı ve %11'i beyaz değildi. Plasebo kolunda hastaların %95'i beyazdı ve %5'i beyaz değildi. Hastaların çoğu ECOG performans durumu 0 idi (olaparib kolunda %71 ve plasebo kolunda %61). Genelde kemoterapi öncesnde metastaz yerleri karaciğer %72, akciğer %10 ve diğer yerler %50 idi. Her iki kolda orijinal tanıdan randomizasyona kadar geçen süre 6,9 ay idi (3,6 â 38,4 ay).
Hastaların toplamda %75'i medyan 9 siklusla (değer aralığı:4-61 siklus) FOLFIRINOX almış,
%8'i FOLFOX veya XELOX, %4'ü GEMOX ve %3'ü gemsitabin artı cisplatin almıştır; hastaların %10'u başka kemoterapi rejimleri almıştır. Metastatik hastalık için birinci-basamak kemoterapi süresi hastaların sırasıyla %77, %19 ve %4'ünde 4-6 ay, >6-<12 ay ve ≥ 12 ay iken bu oranlar plasebo kolunda sırasıyla %80, %17 ve %3 olup her iki kolda birinci-basamak kemoterapi komponent(ler)inin son dozundan çalışma tedavisinin başlamasına kadar geçen süre yaklaşık 1 ay civarındaydı. Birinci-basamak kemoterapide en iyi yanıt olarak olaparib hastalarının %7'sinde ve plasebo hastalarının %5'inde tam yanıt, olaparib hastalarının
%44'ünde ve plasebo hastalarının %44'ünde parsiyel yanıt ve olaparib hastalarının %49'unda ve plasebo hastalarının %50'sinde stabil hastalık vardı. Randomizasyon anında ölçülebilir hastalık olaparib ve plasebo kollarındaki hastaların sırasıyla %85 ve %84'ünde bildirilmiştir. Birinci-basamak platinum-bazlı kemoterapiye başlanmasından randomizasyona kadar geçen medyan süre 5.7 ay idi (değer aralığı: 3,4 â 33,4 ay).
PFS analiz tarihinde olaparib kolundaki hastaların %33'ü ve plasebo kolundaki hastaların
%13'ü çalışma tedavisinde kalmıştı. Olaparib kolundaki hastaların %49'u ve plasebo kolundaki hastaların %74'ü takip eden tedavi almıştı. Olaparib kolundaki hastaların %42'si ve plasebo kolundaki hastaların %55'i takip eden tedavi olarak platinum almıştı. Olaparib kolundaki hastaların %1'i ve plasebo kolundaki hastaların %15'i takip eden tedavi olarak PARP inhibitörü almıştı. Olaparib ve plasebo kollarında birinci takip eden platinum-içeren tedavi alan hastaların 33'ünden (%36) ve 28'inden (%45) sırasıyla 8 ve 6 hastada stabil hastalık bildirilirken sırasıyla 1 ve 2 hastada yanıt vardı.
Primer sonlandırma noktası, randomizasyondan hastalık kanıtları veya ölüm olmayan hastaları değerlendirmek üzere modifiye edilen Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST) 1.1 kullanılarak BICR ile belirlenen progresyona kadar geçen süre şeklinde tanımlanmıştır. Sekonder etkililik sonlandırma noktaları genel sağkalım (OS), randomizasyondan ikinci progresyona veya ölüme kadar geçen süre (PFS2), randomizasyondan birinci takip eden anti-kanser tedavisine veya ölüme kadar geçen süre (TFST), objektif yanıt oranı (ORR), yanıt süresi (DoR), yanıt oranı, yanıta kadar geçen süre ve sağlıkla ilişkili yaşam kalitesini (HRQoL) içermekteydi.
Çalışma, plaseboya karşı olaparib için PFS'de istatistiksel açıdan anlamlı bir iyileşmeyi göstermiştir (Tablo 11). BCIR ile yapılan PFS değerlendirmesi araştırmacı değerlendirmesi ile uyumluydu.
En son OS analizinde hayatta ve izlemde kalan hastaların yüzdesi olaparib kolunda %28 ve plasebo kolunda %18 idi.
Tablo 11: POLO'da pankreasın gBRCAm metastatik adenokarsinomu olan hastalar için etkililik sonuçları
| Olaparib 300 mg bd | Plasebo |
PFS (68% olgunluk) (BICR, DCO 15 Ocak 2019) | ||
Olay sayısı: Toplam hasta sayısı (%) | 60:92 (65) | 44:62 (71) |
Medyan süre, ay (%95 GA) | 7,4 (4,14 â 11,01) | 3,8 (3,52 â 4,86) |
HR (%95 GA) | 0,53 (0,35 â 0,82) | |
P değeri (2-yönlü) | p = 0,0038 | |
OS (%70 olgunluk) (DCO 21 Temmuz 2020) | ||
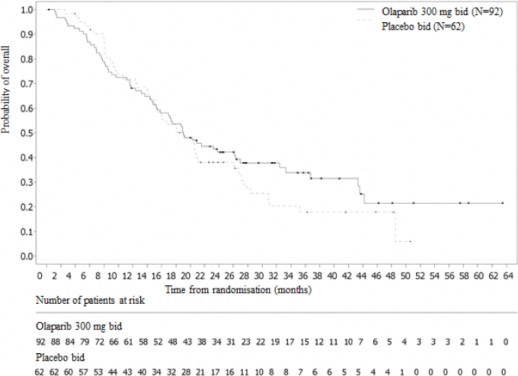
Olay sayısı/toplam hasta sayısı (%) | 61:92 (66) | 47:62 (76) |
Medyan süre, ay (%95 GA) | 19,0 (15,28 â 26,32) | 19,2 (14,32 â 26,12) |
HR (%95 GA) | 0,83 (0,56 â 1,22) | |
P değeri (2-yönlü) | p = 0,3487 | |
bd Günde 2 kez; CI Güven aralığı; HR Tehlike oranı; OS Genel Sağkalım; PFS Progresyonsuz sağkalım.
Şekil 10: POLO: gBRCAm metastatik adenokarsinomlu hastalar için Kaplan-Meier PFS grafiği (%68 olgunluk â BICR, DCO 15 Ocak 2019)
Progresyonsuz sağkalım olasılığı
Randomizasyondan sonra geçen süre (ay)
Şekil 11: POLO: gBRCAm metastatik adenokarsinomlu hastalar için Kaplan-Meier OS grafiği (%70 olgunluk, DCO 21 Temmuz 2020)
BRCA1/2-mutasyonlu metastatik kastrasyona dirençli prostat kanseri:
PROfound Çalışması
Lynparza'nın etkililiğinin araştırmacı tarafından seçilen NHA ([yeni hormonal ajan] enzalutamid veya abirateron asetat) sınıfı bir karşılaştırma ilacı kolu ile karşılaştırmalı şekilde değerlendirilmiş olduğu bir Faz III randomize, açık etiketli, çok merkezli çalışmada olaparibin güvenliliği ve etkililiği metastatik kastrasyona dirençli prostat kanseri (mCRPC) görülen erkeklerde araştırılmıştır.
Hastaların metastatik prostat kanserine ve/veya CRPC'ye yönelik önceki tedavi için uygulanan NHA sırasında progresyon sergilemiş olması gerekiyordu. A Kohortuna dahil edilmeleri için hastaların BRCA1 ya da BRCA2 genlerinde yıkıcı ya da şüpheli yıkıcı mutasyonlar olması gerekiyordu. ATM mutasyonları olan hastalar da A Kohortuna randomize edilmişti ancak bu hasta alt grubunda pozitif fayda-risk kanıtlanamamıştır. Diğer genlerde mutasyonları olan hastalar B Kohortuna randomize edilmiştir.
Bu çalışmada 387 hasta olaparib Lynparza (günde iki defa 300 mg [2 x 150 mg tablet]) veya karşılaştırma ilacı almak üzere 2/1 oranında randomize edilmiştir. Kohort A'da 245 hasta (162 olaparib, 83 karşılaştırma ilacı), Kohort B'de ise 142 hasta (94 olaparib, 48 karşılaştırma ilacı) yer almıştır. Hastalar önceki taksan kullanımına ve ölçülebilir hastalık kanıtına göre basamaklandırılmıştır. Tedavi hastalık progresyonuna kadar sürmüştür. Karşılaştırma ilacına randomize edilmiş olan hastalara, BICR ile radyolojik progresyonun doğrulanması durumunda, olaparibe geçiş yapma seçeneği sunulmuştur. Tümörlerinde BRCA1m, BRCA2m tespit edilmiş olan hastalar, lokal test sonucu kullanılarak kaydedilen 3 hasta dışında prospektif Merkezi testlere göre kaydedilmiştir. PROfound'da BRCA1 ya da BRCA2 mutasyonu olan 160 hastadan 114 hasta tanımlanmış BRCA1/2 mutasyonunun köken olarak germ hattı mı yoksa somatik mi olduğunu belirlemek üzere retrospektif olarak test edilmiştir. Bu hastalar içerisinde germ hattı kan örneğinde 63 BRCA1/2 mutasyonu tanımlanmış ve bu nedenle germ hattı kökenli oldukları belirlenmiştir. Kalan 51 hastada germ hattı kan örneğinde BRCA1/2 mutasyonu tanımlanmış tümör tespit edilmemiş bu nedenle BRCA1/2 mutasyonlarının somatik kökenli olduğu belirlenmiştir. Kalan 46 hasta için somatik ya da germ hattı kökeni bilinmemektedir.
Demografik özellikler ve başlangıç özellikleri, BRCA1/2 mutasyonları olan hastalarda olaparib ve karşılaştırma ilacı kolları arasında genellikle iyi dengelenmişti. Medyan yaş, olaparib ve karşılaştırma ilacı kollarında sırasıyla 68 yaş ve 67 yaştı. Olaparib kolundaki önceki tedavi %71 taksan, %41 enzalutamid, %37 abirateron asetat ve %20 enzalutamid ve abirateron asetat şeklindeydi. Karşılaştırma ilacı kolundaki önceki tedavi %60 taksan, %50 enzalutamid, %36 abirateron asetat ve %14 enzalutamid ve abirateron asetat şeklindeydi. Olaparib kolundaki hastaların yüzde elli sekizi (%58) ile karşılaştırma ilacı kolundaki hastaların %55'inde çalışmaya girişte ölçülebilir hastalık vardı. Kemik, lenf düğümü, solunum yolları ve karaciğer metastazları olan hastaların oranı olaparib kolunda sırasıyla %89, %62, %23 ve %12 ilen karşılaştırma ilacı kolunda sırasıyla %86, %71, %16 ve %17 idi. Her iki tedavi kolundaki hastaların çoğunda ECOG 0 ya da 1'di (%93). Başlangıç ağrı skorları (BPI-SF en kötü ağrı), olaparib kolunda 0-<2 (552), 2-3 (%10)) ya da >3 (%34) ve karşılaştırma ilacı kolunda ise 0-
<2 (%45), 2-3 (%7) ya da >3'tü (%45). Medyan başlangıç PSA olaparib kolunda 57,48 µg/L ve karşılaştırma ilacı kolunda 103,95 µg/L idi.
Çalışmanın primer sonlanma noktası, Kohort A'da RECIST 1.1 (yumuşak doku) ve Prostat Kanseri Çalışma Grubu (PCWG3)(kemik)kullanılaraktespitedilen radyolojik progresyonsuz
sağkalım (rPFS) olarak belirlenmiştir. Kilit sekonder sonlanma noktaları arasında BICR tarafından doğrulanmış objektif yanıt oranı (ORR), BICR tarafından tespit edilen rPFS, ağrı progresyonuna kadar geçen süre (TTPP) ve genel sağkalım (OS) bulunuyordu.
Çalışma, Kohort A'da karşılaştırma ilacı karşısında olaparib için BICR tarafından değerlendirilen rPFS ve nihai OS için istatistiksel açıdan önemli iyileşmeyi kanıtlamıştır.
BRCA1/2 mutasyonları olan hastalar için sonuçlar Tablo 12'de sunulmaktadır. BRCA1/2m hastalarında araştırmacının seçtiği NHA koluna karşı olaparib için BICR tarafından değerlendirilen rPFS'te istatistiksel açıdan önemli iyileşme vardı. Nihai OS analizi, Lynparza ve karşılaştırma ilacına randomize edilmiş BRCA1/2m hastalarında nominal olarak istatistiksel açıdan önemli iyileşme göstermiştir.
Tablo 12: PROfound'da BRCA1 /2-mutasyonlu mCRPC hastalarındaki kilit etkililik bulgularının özeti
| Günde iki defa olaparib 300 mg (N=102) | Araştırmacı tarafından seçilen NHA (N=58) |
BICR ile rPFS DCO 4 Haziran 2019 | ||
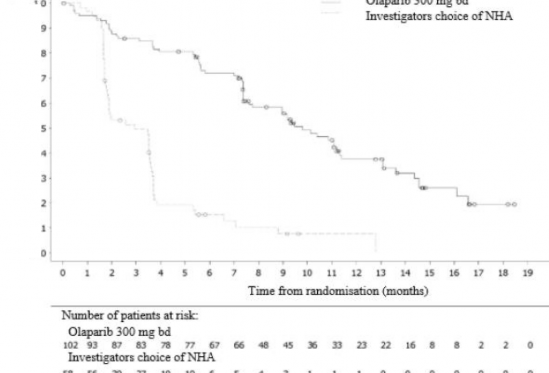
Olay sayısı / toplam hasta sayısı (%) | 62/102 (61) | 51/58 (88) |
Medyan rPFS (%95 GA) [ay] | 9,8 (7,6, 11,3) | 3,0 (1,8, 3,6) |
HR (%95 GA) | 0,22 (0,15, 0,32) | |
BICR ile doğrulanmış ORR | ||
Objektif yanıt verenlerin sayısı/başlangıçta ölçülebilir hastalığı olan toplam hasta sayısı (%) | 25/57 (44) | 41/58 (71) |
Olasılık oranı (%95 GA) | NC (NC, NC) | |
OS DCO 20 Mart 2020 | ||
Olay sayısı / toplam hasta sayısı (%) | 53/102 (52) | 41/58 (71) |
Medyan OS (%95 GA) [ay] | 20,1 (17,4, 26,8) | 14,4 (10,7, 18,9) |
HR (%95 GA) | 0,63 (0,42, 0,95) | |
Günde iki defa olaparib 300 mg Araştırmacı tarafından seçilen NHA
Radyolojik progresyonsuz sağkalım olasılığı
Şekil 12: BRCA1/2m hastaları: Kaplan Meier rPFS grafiği (BICR ile)

Günde iki defa olaparib 300 mg Araştırmacı tarafından seçilen NHA
Progresyonsuz sağkalım olasılığı
Şekil 13: BRCA1/2m hastaları: Kaplan-Meier OS grafiği
Pediyatrik popülasyon
Avrupa İlaç Kurumu, LYNPARZA ile over karsinomunda (rabdomiyosarkoma ve germ hücreli tümörler hariç) tüm pediyatrik popülasyon alt gruplarında çalışma sonucu sunma yükümlülüğü konusunda muafiyet getirmiştir (pediyatrik kullanım hakkında bilgi için bkz. bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerOlaparibin 300 mg tablet dozundaki farmakokinetiği, ~7 L/saatlik görünür plazma klirensi,
~158 L'lik görünür dağılım hacmi ve 15 saatlik terminal yarılanma ömrü ile karakterizedir. Çoklu dozlama ile 1.8'lik EAA birikme oranı gözlenmiştir ve farmakokinetiğin düşük bir ölçüde zamana bağımlı olduğu görülmüştür.
Emilim:
Olaparibin tablet formülasyonu (2 x 150 mg) ile oral uygulanması sonrasında emilim hızlı olup, medyan doruk plazma konsantrasyonlarına tipik olarak doz uygulamasından 1.5 saat sonra ulaşılır.
Yiyecekler ile birlikte uygulama olaparib emiliminin hızını azaltmış (t2.5 saat gecikmiş ve Cyaklaşık %21 azalmıştır); fakat emilimin boyutunu anlamlı ölçüde etkilememiştir (EAA
%8 artmıştır). Dolayısıyla LYNPARZA, aç veya tok karnına alınabilir (bkz. Bölüm 4.2).
Dağılım:
İn vitro plazma proteinlerine bağlanması, klinik olarak anlamlı olan 10 µg/mL'lik konsantrasyonlarda yaklaşık %82'dir.
İn vitro koşullarda olaparibin insan plazma proteinlerine bağlanma oranı doz bağımlıdır; bağlanan kısım 1 μg/mL'de yaklaşık %91 iken, 10 μg/mL'de %82 ve 40 μg/mL'de %70'e düşmüştür. Saflaştırılmış protein çözeltilerinde albümine bağlanan olaparib fraksiyonu yaklaşık
%56 olup, olaparib konsantrasyonlarından bağımsızdır. Aynı analiz kullanılarak, alfa-1 asit glikoproteine bağlanan fraksiyon 10 μg/mL'de %29 iken, daha yüksek konsantrasyonlarda azalmış bağlanma eğilimi gözlenmiştir.
Biyotransformasyon:
İn vitro koşullarda CYP3A4/5'lerin olaparibin metabolizmasından esasen sorumlu izoenzimler olduğu gösterilmiştir (bkz. Bölüm 4.5).
Kadın hastalara 14C-olaparibin oral yolla verilmesinden sonra değişmemiş olaparib plazmadaki radyoaktivitenin büyük kısmını oluşturmuş (%70) ve gerek idrar gerekse feçeste bulunan ana bileşen olmuştur (dozun sırasıyla %15'i ve %6'sı). Olaparibin metabolizasyonu yaygındır. Metabolizmanın büyük kısmı oksidasyon reaksiyonlarına dayanmakta ve üretilen bileşenlerin bir kısmı sonrasında glukuronid veya sülfat konjügasyonuna uğramaktadır. Plazma, idrar ve feçeste sırasıyla 20, 37 ve 20'ye kadar metabolit tespit edilmiştir ve bunların çoğu dozlanan materyalin <%1'ini temsil etmektedir. Bir açık halkalı piperazin-3-ol kısmı ve iki mono- oksijenli metabolit (her biri yaklaşık %10) dolaşımdaki başlıca bileşenler olup, mono-oksijenli metabolitlerden birinin ayrıca dışkıdaki majör metabolit olduğu belirlenmiştir (idrar ve feçesteki radyoaktivitenin sırasıyla %6'sı ve %5'i).
Olaparib, in vitro olarak UGT1A4, UGT1A9, UGT2B7 veya CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 veya 2E1'i çok az inhibe etmiş/hiç inhibe etmemiştir ve bu CYP enzimlerinin herhangi birinin klinik olarak anlamlı, zamana bağlı bir inhibitörü olması beklenmez. Olaparib, UGT1A1'i in vitro olarak inhibe etmiştir, ancak PBPK simülasyonları bunun klinik önemi olmadığını düşündürmektedir. Olaparib, in vitro olarak dış akım taşıyıcısı P-gp'nin bir substratıdır, ancak bunun klinik olarak anlamlı olması olası değildir (bkz. bölüm 4.5).
İn vitro koşullardan elde edilen veriler olaparibin OATP1B1, OATP1B3, OCT1, BCRP veya MRP2 substratı olmadığını ve OATP1B3, OAT1 veya MRP2'nin inhibitörü olmadığını göstermektedir.
Eliminasyon:
Tek bir 14C-olaparib dozundan sonra, radyoaktivitenin yaklaşık %86'sı 7 günlük toplama süresi içinde tespit edilmiştir. Bunun yaklaşık %44'ü idrar ile, yaklaşık %42'si feçes iledir. Materyalin çoğu metabolitler halinde atılmıştır.
Doğrusallık/Doğrusal olmayan durum:
LYNPARZA isimli ürünümüzün doz ve / veya zaman açısından etkin madde farmakokinetiğinin doğrusallığı / doğrusal olmaması durumu uygulanabilir değildir.
Hastalardaki karakteristik özellikler
Popülasyon bazlı farmakokinetik analizlerde hasta yaşı, vücut ağırlığı veya ırkı (Beyaz ve Japon hastaları içerir) anlamlı eşdeğişkenler olmamıştır.
Böbrek yetmezliği:
Böbrek fonksiyonları normal olan hastalar ile karşılaştırıldığında hafif derecede böbrek yetmezliği (kreatinin klirensi 51 ila 80 mL/dk) olan hastalarda EAA değeri %24, Cdeğeri
%15 artmıştır. LYNPARZA hafif derecede böbrek yetmezliği olan hastalara herhangi bir doz ayarlaması yapılmadan uygulanabilir.
Böbrek fonksiyonları normal olan hastalar ile karşılaştırıldığında orta derecede böbrek yetmeliği (kreatinin klirensi 31 ila 50 mL/dk) olan hastalarda EAA değeri %44, Cdeğeri
%26 artmıştır. Orta derecede böbrek yetmezliği olan hastalar için LYNPARZA dozunun ayarlanması önerilir (bkz. Bölüm 4.2).
Ağır derecede böbrek yetmezliği veya son evre böbrek yetmezliği (kreatinin klirensi < 30 mL/dk) olan hastalara ilişkin veri bulunmamaktadır.
Karaciğer yetmezliği:
Karaciğer fonksiyonu normal olan hastalarla karşılaştırıldığında hafif karaciğer yetmezliği (Child Pugh sınıflandırması A) görülen hastalarda EAA %15, Cmaks ise %13 artarken, orta dereceli karaciğer yetmezliği (Child Pugh sınıflandırması B) görülen hastalarda EAA %8, Cmaks ise %13 artmıştır. Hafif veya orta dereceli karaciğer yetmezliği bulunan hastalarda LYNPARZA dozunun ayarlanmasına gerek yoktur (bkz. bölüm 4.2). Şiddetli karaciğer yetmezliği (Child Pugh sınıflandırması C) olan hastalarla ilgili veri mevcut değildir.
Pediyatrik popülasyon:
Pediyatrik hastalarda olaparibin farmakokinetiğini incelemek üzere herhangi bir çalışma gerçekleştirilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
AstraZeneca Türkiye İlaç Sanayi ve Ticaret Ltd.Şti.
| Satış Fiyatı | 50967 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 50967 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699786092921 |
| Etkin Madde | Olaparib |
| ATC Kodu | L01XK01 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |