MEKINIST 0.5 mg film kaplı tablet (30 tablet) Kısa Ürün Bilgisi
{ Trametinib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MEKİNİST 0,5 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet; 0,5 mg trametinibe eşdeğer 0,5635 mg trametinib dimetil sülfoksit içerir.
Yardımcı maddeler
Kroskarmelloz sodyum 4,35 mg
Sodyum lauril sülfat 0,017 mg Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet (tablet)
Bir yüzünde âGS' diğer yüzünde âTFC' işareti bulunan sarı, modifiye oval, bikonveks film kaplı tabletler
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
MEKİNİST'in, daha önce herhangi bir RAF yolağı inhibitörü kullanmamış, ECOG performans skoru 0-1 olan, lokal tedaviler sonrası progresyon göstermiş ve lokal tedavilerin tekrar kullanılamadığı lokal relaps veya metastatik BRAF V600 mutasyonu pozitif malign melanom hastalarında dabrafenib ile kombine olarak progresyona kadar kullanımı endikedir. Hastalık progresyonu sonrası, MEKİNİST'e tek ajan veya kombinasyon olarak devam edilemez.
MEKİNİST, dabrafenib ile kombinasyon halinde BRAF V600 E mutasyonu olan Evre III melanomu olan yetişkin hastaların, tam rezeksiyonu takiben adjuvan tedavisi için endikedir. Advujan tedavide en fazla 12 ay süreyle kullanılabilir. Bu süre içerisinde progresyon gelişen hastalarda kullanılamaz. MEKİNİST tek başına kullanılamaz.
BRAF V600 E mutasyonu akredite laboratuvarda saptanmış olup EGFR veya ALK mutasyonu olmayan veya bilinmeyen, ECOG performans skoru 0-1, kemik iliği rezervi yeterli olan (nötrofil sayısı 1500, trombosit sayısı 100000 üzerinde olan), karaciğer ve renal fonksiyonları yeterli olan (ALT, AST, bilurubin ve serum kreatinin normalin en fazla 1,5 katı olan) lokal ileri veya metastatik akciğer adenokanserli hastaların sol ventrikül ejeksiyon fraksiyonu normal sınırlarda olması durumunda dabrafenib ile birlikte progresyona kadar kullanımında endikedir.
MEKİNİST'in tek ajan olarak ilgili endikasyonlarda kullanımı uygun değildir.
4.2. Pozoloji ve uygulama şekli
MEKİNİST ile tedavi sadece kanser ilaçlarının uygulamasında deneyimli bir hekim tarafından başlatılmalı ve onların gözetimi altında tutulmalıdır.
MEKİNİST tedavisi, ancak anti-kanser tıbbi ürünlerin uygulamasında deneyimli bir hekim tarafından başlatılmalı ve gözetiminde uygulanmalıdır.
MEKİNİST almadan önce, valide edilmiş bir test ile malign melanom hastaları için BRAF V600 ve küçük hücreli dışı akciğer kanseri hastaları için BRAF V600 E mutasyonu taşıdığı doğrulanmalıdır.
Dabrafenib doz ve uygulama şekli bilgileri için dabrafenib Kısa Ürün Bilgisi, Pozoloji ve uygulama şekli bölümünü inceleyiniz.
Pozoloji
Dabrafenib ile kombinasyon halinde uygulandığında, önerilen MEKİNİST dozu günde bir kez (QD) 2 mg'dır. Dabrafenibin önerilen dozu, MEKİNİST ile kombinasyon halinde kullanıldığında günde iki kez (BID) 150 mg'dır.
Uygulama sıklığı ve süresi:
Hastaların, artık herhangi bir fayda görmeyene ya da kabul edilemez toksisite gelişene kadar MEKİNİST tedavisine devam etmeleri önerilir (bkz. Tablo 2). Adjuvan melanom durumunda, hastalar hastalık nüksü veya kabul edilemez toksisite görülmediği müddetçe 12 aylık bir süre boyunca tedavi edilmelidir.
Atlanan dozlar
Bir MEKİNİST dozunun unutulması durumunda, söz konusu dozu yalnızca bir sonraki planlanan doza 12 saatten uzun bir süre olması halinde alınır.
MEKİNİST, dabrafenib ile birlikte verilirken eğer bir dabrafenib dozu atlanırsa, sadece planlı bir sonraki doza 6 saatten fazla varsa dabrafenib dozu alınır.
Doz modifikasyonu
Advers reaksiyonların yönetilmesi, dozun azaltılması, tedaviye ara verilmesi ya da tedavinin kesilmesini gerektirebilir (bkz. Tablo 1 ve Tablo 2).
Kutanöz skuamöz hücreli karsinom (cuSCC) ya da yeni primer melanom advers reaksiyonları için doz modifikasyonları önerilmez (daha ayrıntılı bilgi için bkz. dabrafenib KÜB'ü).
Tablo 1 Önerilen doz seviyesi azaltımları
Doz Seviyesi | MEKİNİST Dozu Dabrafenib ile kombinasyon | Dabrafenib Dozu* Sadece MEKİNİST ile kombine kullanıldığında |
Başlangıç dozu | Günde bir kez 2 mg | Günde iki kez 150 mg |
İlk doz azaltımı | Günde bir kez 1,5 mg | Günde iki kez 100 mg |
İkinci doz azaltımı | Günde bir kez 1 mg | Günde iki kez 75 mg |
Üçüncü doz azaltımı (Sadece kombinasyon) | Günde bir kez 1 mg | Günde iki kez 50 mg |
MEKİNİST dozunun dabrafenib ile kombinasyon halinde kullanıldığında günde bir kez 1 mg'ın altına düşürülmemesi önerilmektedir. Dabrafenib dozunun, MEKİNİST ile kombinasyon halinde kullanıldığında, günde iki kez 50 mg'ın altına düşürülmemesi önerilmektedir. | ||
*Dabrafenib monoterapisi ile tedavinin dozlama talimatları için lütfen dabrafenib KÜB, Pozoloji ve uygulama şekli bölümüne bakınız.
Tablo 2 Herhangi bir advers reaksiyon derecesine göre doz modifikasyon şeması (pireksi hariç)
Derece (CTC-AO)* | MEKİNİST için önerilen doz değişikliği Dabrafenib ile kombinasyon halinde kullanılır |
Derece 1 veya derece 2 (tolere edilebilir) | Tedaviye devam edin ve klinik olarak gerektiği şekilde izleyin. |
Derece 2 (tolere edilemez) veya derece 3 | Toksisite derece 0 - 1 olana dek tedaviye ara verin ve tedaviye yeniden başlarken, dozu bir doz düzeyinde azaltın. |
Derece 4 | Tedaviyi kalıcı olarak durdurun ya da derece 0 â 1'e kadar tedaviye ara verin ve tedaviye yeniden başlarken, dozu bir doz düzeyinde azaltın. |
* Advers reaksiyonlar için Ortak Terminoloji Kriterleri v4.0 (CTC-AO) tarafından sınıflandırılan klinik yan etkilerin şiddeti
Bir kişideki yan etkiler etkili bir şekilde kontrol altına alındığında, dozun azaltılması ile aynı doz uygulaması takip edilerek dozun tekrar artırılması göz önünde bulundurulmalıdır. MEKİNİST dozu günde bir kere 2 mg'ı aşmamalıdır.
Pireksi
Hastanın ateşi ≥ 38ºC ise tedaviye ara verilmelidir (monoterapi olarak kullanıldığında MEKİNİST ve kombinasyon halinde kullanıldığında hem MEKİNİST hem de dabrafenib). Nüks durumunda, pireksinin ilk belirtisinde de tedavi kesilebilir. İbuprofen veya asetaminofen/parasetamol gibi ateş düşürücü ilaçlarla tedaviye başlanmalıdır. Ateş düşürücü ilaçların yetersiz kaldığı durumlarda oral kortikosteroid kullanımı düşünülmelidir. Hastalar enfeksiyon belirti ve bulguları açısından değerlendirilmeli ve gerekirse yerel uygulamalara göre tedavi edilmelidir (bkz. Bölüm 4.4). MEKİNİST veya kombinasyon halinde kullanıldığında hem MEKİNİST hem de dabrafenib, (1) eğer hasta en az 24 saat süreyle semptomsuzsa aynı doz seviyesinde veya (2) pireksi tekrarlıyorsa ve/veya dehidratasyon, hipotansiyon veya böbrek yetmezliği gibi başka bulgular eşlik ediyorsa, bir doz düzeyinde azaltılarak yeniden başlatılmalıdır.
MEKİNİST, dabrafenib ile kombinasyon halinde kullanıldığında tedaviyle ilgili toksisite oluşursa, her iki tedavide de aynı anda doz azaltılmalı, tedaviye ara verilmeli ya da tedavi kesilmelidir. İki tedaviden sadece birinde doz modifikasyonunun gerekli olduğu istisnai durumlar şu durumlar için aşağıda detaylı tarif edilmektedir: Üveit, RAS mutasyonu pozitif kutanöz olmayan maligniteler (temelde dabrafenib ile ilişkili), sol ventrikül ejeksiyon fraksiyonu (LVEF) azalması, retinal ven oklüzyonu (RVO), retinal pigment epitel dekolmanı (RPED) ve interstisyel akciğer hastalığı (ILD)/pnömonit (temelde MEKİNİST ile ilişkili).
Belirli advers reaksiyonlarda doz modifikasyonu için istisnai durumlar (iki tedaviden sadece birinde dozun azaltıldığı durumlar)
Üveit
Etkili lokal tedaviler oküler enflamasyonu kontrol edebildiği sürece üveit için herhangi bir doz modifikasyonu gerekmez. Eğer üveit lokal oküler tedaviye yanıt vermezse, oküler enflamasyon iyileşene kadar dabrafenib durdurulmalıdır ve ardından bir doz düzeyinde azaltılarak dabrafenib yeniden başlatılmalıdır. Dabrafenib ile kombinasyon halinde alındığında MEKİNİST için doz modifikasyonu gerekli değildir (bkz. Bölüm 4.4).
RAS mutasyonu pozitif kutanöz dışı maligniteler
RAS mutasyonu pozitif kutanöz dışı maligniteleri olan hastalarda dabrafenib tedavisine devam etmenin faydaları ve riskleri göz önünde bulundurulmalıdır. Dabrafenib ile kombinasyon halinde alındığında MEKİNİST için doz modifikasyonu gerekli değildir.
Sol ventrikül ejeksiyon fraksiyonunda (LVEF) azalma/Sol ventrikül disfonksiyonu
Başlangıca kıyasla LVEF'te asemptomatik > %10'luk bir mutlak azalma görülen ve ejeksiyon fraksiyonu, kurum tarafından belirlenen normalin alt sınırının (LLN) altında olduğu hastalarda MEKİNİST tedavisine ara verilmelidir (bkz. Bölüm 4.4). MEKİNİST, dabrafenib ile kombinasyon halinde alındığında dabrafenib için doz modifikasyonu gerekli değildir. LVEF'in iyileşmesi halinde MEKİNİST tedavisi yeniden başlatılabilir fakat doz, dikkatli izlem ile bir doz düzeyinde azaltılmalıdır (bkz. Bölüm 4.4).
MEKİNİST, derece 3 veya 4 sol ventriküler kardiyak disfonksiyonu ya da 4 hafta içinde düzelmeyen klinik olarak anlamlı LVEF azalması olan hastalarda bir daha başlanmamak üzere kesilmelidir (bkz. Bölüm 4.4).
Retinal ven oklüzyonu (RVO) ve retinal pigment epiteli dekolmanı (RPED)
Hastalar MEKİNİST tedavisi sırasında herhangi bir zamanda azalmış merkezi görme, bulanık görme veya görme kaybı gibi yeni görme bozuklukları bildirirse acil bir oftalmolojik değerlendirme önerilmektedir. RVO tanılı hastalarda dabrafenib ile kombinasyon halinde uygulanan MEKİNİST tedavisi bir daha başlanmamak üzere kesilmelidir. MEKİNİST, dabrafenib ile kombinasyon halinde uygulandığında dabrafenib için doz modifikasyonu gerekli değildir. RPED tanısı konulursa MEKİNİST için aşağıdaki Tablo 3'te sunulan doz modifikasyonu programı takip edilmelidir (bkz. Bölüm 4.4).
Tablo 3 RPED için MEKİNİST'e ilişkin doz değişikliği önerileri
Derece 1 RPED | Düzelene kadar ayda bir retinal değerlendirme ile tedavi sürdürülür. RPED kötüleşirse aşağıdaki talimatlar izlenir ve MEKİNİST 3 haftaya kadar kesilir. |
Derece 2-3 RPED | MEKİNİST 3 haftaya kadar kesilir. |
3 haftada içinde derece 0-1'e iyileşen derece 2-3 RPED | MEKİNİST daha düşük bir dozda (0,5 mg azaltılmış) yeniden başlatılır veya günlük 1 mg MEKİNİST kullanan hastalarda bırakılır. |
3 hafta içinde en azından derece 1'e iyileşmeyen derece 2-3 RPED | MEKİNİST kalıcı olarak bırakılır. |
İnterstisyel akciğer hastalığı (ILD)/Pnömonit
Yeni veya progresif pulmoner semptomlar ve öksürük, dispne, hipoksi, plevral efüzyon veya infiltratı da içeren bulguları olan hastalar dahil ILD veya pnömonit şüphesi olan hastalarda, klinik tetkikleri beklerken MEKİNİST kesilmelidir. Tedaviyle ilişkili ILD veya pnömonit tanısı almış hastalarda MEKİNİST kalıcı olarak bırakılmalıdır. ILD veya pnömonit olgularında MEKİNİST, dabrafenib ile kombinasyon halinde alındığında dabrafenib için doz modifikasyonu gerekli değildir.
Uygulama şekli
Her iki tıbbi ürün de bir bardak su ile oral yoldan alınmalıdır. MEKİNİST tabletleri ve dabrafenib kapsülleri çiğnenmemeli ya da ezilmemelidir. Her iki tıbbi ürün de yiyeceklerle birlikte alınmamalı ve yemeklerdenenaz1saatönceyada2saat sonra alınmalıdır.
MEKİNİST dozunun her gün benzer saatlerde alınması önerilir. MEKİNİST ve dabrafenib kombinasyon halinde alındığında, MEKİNİST'in günlük tek dozu her gün aynı saatte, dabrafenibin ya sabah dozuyla ya da akşam dozuyla birlikte alınmalıdır.
Eğer hasta MEKİNİST aldıktan sonra kusarsa, hasta dozu yeniden almamalı, vakti geldiğinde bir sonraki planlı dozunu almalıdır.
MEKİNİST ile kombinasyon halinde verildiğindeki uygulama yöntemine dair bilgi için lütfen dabrafenib KÜB'üne bakınız.
Özel popülasyonlara ilişkin ek bilgiler Böbrek yetmezliği
Hafif ya da orta şiddette böbrek yetmezliği olan hastalarda dozun ayarlanması gerekli değildir (bkz. Bölüm 5.2). Şiddetli böbrek yetmezliği görülen hastalarda MEKİNİST tedavisi ile ilgili veri bulunmamaktadır, dolayısıyla başlangıç dozunun ayarlanmasının gerekli olup olmadığı belirlenememektedir. Şiddetli böbrek yetmezliği olan hastalarda monoterapi olarak veya dabrafenib ile kombinasyon halinde uygulanan MEKİNİST dikkatle kullanılmalıdır.
Karaciğer yetmezliği
Hafif düzeyde karaciğer yetmezliği olan hastalarda dozun ayarlanması gerekli değildir. Bir klinik farmakoloji çalışmasından elde edilen mevcut veriler, orta ila şiddetli karaciğer yetmezliğinin MEKİNİST maruziyeti üzerinde sınırlı bir etkisi olduğunu göstermektedir (bkz. Bölüm 5.2). Orta ila şiddetli karaciğer yetmezliği olan hastalarda monoterapi olarak veya dabrafenib ile kombinasyon halinde uygulanan MEKİNİST dikkatle kullanılmalıdır.
Pediyatrik popülasyon:
MEKİNİST'in güvenliliği ve etkililiği, çocuklar ve adölesanlarda (18 yaş altı) kanıtlanmamıştır. Veri mevcut değildir. Yavru hayvanlardaki çalışmalar, MEKİNİST'in erişkin hayvanlarda gözlenmemiş olan advers etkilerini göstermiştir (bkz. Bölüm 5.3).
Geriyatrik popülasyon:
65 yaş üstü hastalarda başlangıçta doz ayarlaması gerekli değildir.
65 yaş üstü hastalarda, daha sık doz ayarlamaları (bkz. Tablo 1 ve Tablo 2) gerekebilir (bkz. Bölüm 4.8).
Beyaz ırka mensup olmayan hastalar:
MEKİNİST'in güvenliliği ve etkililiği beyaz ırka mensup olmayan hastalarda kanıtlanmamıştır. Veri mevcut değildir.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
MEKİNİST, dabrafenib ile kombinasyon halinde verildiğinde tedavi başlatılmadan önce dabrafenib KÜB'üne başvurulmalıdır. Dabrafenib tedavisi ile ilgili uyarı ve önlemler hakkında ek bilgi için lütfen dabrafenib KÜB'üne bakınız.
BRAF V600 testi
MEKİNİST'in güvenliliği ve etkililiği, melanomu BRAF V600 mutasyonu bakımından negatif test sonucu veren hastalarda değerlendirilmemiştir.
BRAF inhibitörlerine kıyasla MEKİNİST monoterapisi
BRAF V600 mutasyonu pozitif rezeke edilemeyen veya metastatik melanomlu hastalarda yapılan bir klinik çalışmada MEKİNİST monoterapisi BRAF inhibitörü ile kıyaslanmamıştır. Çapraz çalışma kıyaslarına göre, genel sağkalım ve progresyonsuz sağkalım verileri MEKİNİST ve BRAF inhibitörleri arasında benzer etkililik göstermektedir, ancak genel yanıt oranları MEKİNİST ile tedavi edilen hastalarda BRAF inhibitörleri ile tedavi edildiği raporlanmış hastalardan daha düşüktür.
Bir BRAF inhibitörü ile tedavi sırasında progrese olan melanom hastalarında dabrafenib ile kombinasyon halinde MEKİNİST
Önceki BRAF inhibitörü tedavisinde progrese olan, MEKİNİST+dabrafenib kombinasyonu kullanmakta olan hastalarda sınırlı veri mevcuttur. Veriler, bu kombinasyonun etkiliğinin bu hastalarda daha düşük olacağını göstermektedir (bkz. Bölüm 5.1). Dolayısıyla, önceden BRAF inhibitörü tedavisi görmüş olan bu popülasyonda söz konusu kombinasyon ile tedaviye başlanmadan önce diğer tedavi seçenekleri göz önünde bulundurulmalıdır. Bir BRAF inhibitör tedavisi sırasında progresyon sonrasında tedavilerin ardışık kullanımı belirlenmemiştir.
Yeni maligniteler
Dabrafenib ile kombinasyon halinde MEKİNİST uygulandığında kutanöz ve kutanöz dışı yeni maligniteler görülebilir.
Kutanöz maligniteler
Kutanöz skuamöz hücreli karsinom (cuSCC)
Dabrafenib ile kombinasyon halinde MEKİNİST ile tedavi edilen hastalarda cuSCC (keratoakantom dahil) vakaları bildirilmiştir. cuSCC olguları eksizyon ile tedavi edilebilir ve tedavi modifikasyonu gerektirmez. Lütfen dabrafenib KÜB'üne bakınız (bkz. Bölüm 4.4).
Yeni primer melanom
Dabrafenib ile kombinasyon halinde MEKİNİST ile tedavi gören hastalarda yeni primer melanom bildirilmiştir. Yeni primer melanom olguları eksizyon ile tedavi edilebilir ve tedavi modifikasyonu gerektirmez. Lütfen dabrafenib KÜB'üne bakınız (bkz. Bölüm 4.4).
Kutanöz olmayan maligniteler
Etki mekanizmasına dayalı olarak, dabrafenib, RAS mutasyonları mevcudiyetinde kutanöz dışı malignitelerin gelişim riskini artırabilir. MEKİNİST'in dabrafenib ile kombinasyon halinde kullanıldığı durumlarda lütfen dabrafenib KÜB'üne bakınız (bkz. Bölüm 4.4). Dabrafenib ile kombinasyon halinde kullanımda RAS mutasyonu pozitif maligniteler için MEKİNİST dozunda herhangi bir modifikasyon gerekmez.
Hemoraji
Monoterapi olarak ve dabrafenib ile kombinasyon halinde MEKİNİST kullanan hastalarda majör hemorajik olaylar ve ölümle sonuçlanan hemorajik olaylar dahil hemorajik olaylar meydana gelmiştir (bkz. Bölüm 4.8).
Düşük trombosit sayısına (< 75,000) sahip hastalar klinik çalışmalara dahil edilmediğinden bu hastalarda bu olayların potansiyeli tespit edilmemiştir. Antitrombosit ya da antikoagülan tedavinin eşzamanlı kullanımı ile hemoraji riski artabilir. Hemoraji ortaya çıkarsa hasta, klinik durumun gerektirdiği şekilde tedavi edilmelidir.
LVEF azalması/Sol ventrikül fonksiyon bozukluğu
MEKİNİST'in, dabrafenib ile kombinasyon halinde kullanıldığında LVEF'i azalttığı bildirilmiştir (bkz. Bölüm 4.8). Klinik çalışmalarda, ilk sol ventrikül fonksiyon bozukluğu, kalp yetmezliği ve LVEF azalması olayının başlangıcına kadar geçen medyan süre 2 ve 5 ay arasındadır.
MEKİNİST sol ventrikül fonksiyonu bozulmuş hastalarda dikkatle kullanılmalıdır. Sol ventrikül fonksiyon bozukluğu olan, New York Kalp Derneği Sınıf II, III veya IV kalp yetmezliği olan, son 6 ay içinde akut koroner sendrom geçiren, klinik anlamlı kontrol edilmeyen aritmiler yaşayan ve kontrol edilemeyen hipertansiyonu olan hastalar klinik çalışmalara dahil edilmemiştir, dolayısıyla bu popülasyonda kullanımın güvenliliği bilinmemektedir. LVEF, tüm hastalarda MEKİNİST ile tedavi başlatılmadan önce, tedavinin başlatılmasından bir ay sonra ve ardından tedavi sırasında yaklaşık olarak 3 aylık aralarla değerlendirilmelidir (doz modifikasyonu ile ilgili olarak bkz. Bölüm 4.2.
MEKİNİST'i dabrafenib ile kombinasyon halinde kullanan hastalarda, miyokardite bağlı akut, şiddetli sol ventrikül fonksiyon bozukluğuna dair nadir raporlar alınmıştır. Tedavi durdurulduğunda tam iyileşme gözlenmiştir. Hekimler yeni veya kötüleşen kardiyak belirti veya bulguların görüldüğü hastalarda miyokardit olasılığı açısından tetikte olmalıdır.
Pireksi
Dabrafenib ile kombinasyon halinde MEKİNİST ile yürütülen klinik çalışmalarda ateş bildirilmiştir (bkz. Bölüm 4.8). Ateşin insidansı ve şiddeti kombinasyon tedavisi ile artmaktadır (bkz. dabrafenib KÜB'ü Bölüm 4.4). Dabrafenib ile kombinasyon halinde MEKİNİST alan hastalarda ateşe şiddetli titreme, dehidratasyon ve bazı durumlarda akut böbrek yetmezliğine gidebilen hipotansiyon eşlik edebilir.
Hastanın ateşi ≥ 38ºC ise tedavi (monoterapi olarak kullanıldığında MEKİNİST ve kombinasyon halinde kullanıldığında hem MEKİNİST hem de dabrafenib) kesilmelidir (bkz. Bölüm 5.1). Nüks durumunda, ateşin ilk belirtisinde de tedavi kesilebilir. İbuprofen veya asetaminofen/parasetamol gibi ateş düşürücü ilaçlarla tedaviye başlanmalıdır. Ateş düşürücü ilaçların yetersiz kaldığı durumlarda oral kortikosteroid kullanımı düşünülmelidir. Hastalar enfeksiyon belirti ve bulguları açısından değerlendirilmelidir. Ateş düzeldiğinde tedavi yeniden başlatılabilir. Ateş, diğer şiddetli belirti veya bulgularla ilişkiliyse, ateş düzeldiğinde ve klinik olarak uygun olduğunda tedaviye azaltılmış bir dozla yeniden başlanmalıdır (bkz. Bölüm 4.2).
Hipertansiyon
Önceden hipertansiyonu olan ya da olmayan hastalarda, dabrafenib ile kombinasyon halinde uygulanan MEKİNİST ile ilişkili olarak kan basıncında yükselmeler bildirilmiştir (bkz. Bölüm 4.8). Kan basıncı, MEKİNİST ile tedavi başlangıcında ölçülmeli ve tedavi süresince izlenmeli, gerektiğinde hipertansiyon standart tedavi ile kontrol altına alınmalıdır.
İnterstisyel akciğer hastalığı (ILD)/Pnömonit
Bir Faz III çalışmada, MEKİNİST monoterapisi ile tedavi edilen hastaların %2,4'ünde (5/211) ILD veya pnömonit gelişmiştir; 5 hastanın hepsinin hastaneye yatırılması gerekmiştir. MEK115306 ve MEK116513 çalışmalarında dabrafenib ile kombinasyon halinde MEKİNİST ile tedavi edilen hastaların sırasıyla < %1 (2/209) ve %1'i (4/350) pnömonit ya da ILD geliştirmiştir (bkz. Bölüm 4.8).
Yeni veya progresif pulmoner semptomlar ve öksürük, dispne, hipoksi, plevral efüzyon veya infiltratı da içeren bulguları olan hastalar dahil ILD veya pnömonit şüphesi olan hastalarda, klinik tetkiklerin sonuçları gelene kadar MEKİNİST'e ara verilir. Tedaviyle ilişkili ILD veya pnömonit tanısı almış hastalarda MEKİNİST bir daha başlanmamak üzere kesilmelidir (bkz.
Bölüm 4.2). MEKİNİST dabrafenib ile kombinasyon halinde kullanılırken dabrafenib ile tedaviye aynı dozda devam edilebilir.
Görme bozuklukları
Dabrafenib ile kombinasyon halinde uygulanan MEKİNİST ile ilişkili olarak RPED ve RVO dahil görme ile ilgili bozukluklar görülebilir. MEKİNİST ile klinik çalışmalarda bulanık görme, görme keskinliğinde azalma gibi semptomlar ve görmeyle ilgili diğer fenomenler bildirilmiştir (bkz. Bölüm 4.8). Klinik çalışmalarda, dabrafenib ile kombine MEKİNİST ile tedavi edilen hastalarda üveit ve iridosiklit de bildirilmiştir.
RVO öyküsü olan hastalarda MEKİNİST önerilmemektedir. Kontrol altına alınmamış glokom ya da oküler hipertansiyonu, kontrol altına alınmamış hipertansiyon, kontrol altına alınmamış diyabet veya hiperviskozite ya da hiperkoagülabilite sendromları dahil RVO'ya predispozan faktörleri olan hastalarda MEKİNİST'in güvenliliği tespit edilmemiştir.
Eğer hastalar MEKİNİST tedavisi sırasında herhangi bir zamanda azalmış santral görme, bulanık görme ya da görme kaybı gibi yeni görsel bozukluklar bildirirse, vakit geçirmeden bir oftalmolojik muayene yapılması önerilir. RPED tanılanırsa Tablo 3'teki doz modifikasyon planı takip edilir (bkz. Bölüm 4.2), üveit tanılanırsa lütfen dabrafenib KÜB'ü Bölüm 4.4'e başvurunuz. RVO teşhis edilen hastalarda MEKİNİST ile tedavi bir daha başlanmamak üzere bırakılmalıdır. RVO ya da RPED tanısından sonra, MEKİNİST ile kombinasyon halinde alınan dabrafenib için herhangi bir doz modifikasyonu gerekli değildir. Üveit tanısından sonra, dabrafenib ile kombinasyon halinde alınan MEKİNİST için herhangi bir doz modifikasyonu gerekli değildir.
Döküntü
MEKİNİST+dabrafenib kombinasyon çalışmalarında hastaların yaklaşık %24'ünde döküntü gözlenmiştir (bkz. Bölüm 4.8).
Olguların büyük çoğunluğu derece 1 ya da 2 olup dozlara ara verilmesini ya da dozun azaltılmasını gerektirmemiştir.
Rabdomiyoliz
Dabrafenib ile kombinasyon halinde MEKİNİST kullanan hastalarda rabdomiyoliz bildirilmiştir (bkz. Bölüm 4.8). Bazı durumlarda, hastalar MEKİNİST kullanmaya devam edebilmiştir. Daha şiddetli vakalarda hastaneye yatırılma, MEKİNİST tedavisine ara verilmesi veya kalıcı olarak bırakılması gerekmiştir. Rabdomiyoliz belirti veya bulguları, endike olduğu şekilde uygun klinik değerlendirme ve tedavi gerektirmelidir.
Böbrek yetmezliği
Klinik çalışmalarda dabrafenib ile kombinasyon halinde MEKİNİST ile tedavi edilen hastalarda böbrek yetmezliği tanımlanmıştır. Lütfen dabrafenib KÜB'üne bakınız (bkz. Bölüm 4.4).
Pankreatit
Klinik çalışmalarda dabrafenib ile kombinasyon halinde MEKİNİST ile tedavi edilen hastalarda pankreatit bildirilmiştir. Lütfen dabrafenib KÜB'üne bakınız (bkz. Bölüm 4.4).
Hepatik olaylar
Dabrafenib ile kombinasyon halinde MEKİNİST ile yürütülen klinik çalışmalarda hepatik advers reaksiyonlar bildirilmiştir (bkz. Bölüm 4.8). Dabrafenib ile kombinasyon halinde MEKİNİST tedavisi gören hastalarda karaciğer fonksiyonunun, MEKİNİST ile tedaviye
başlandıktan sonra 6 ay süreyle her 4 haftada bir izlenmesi önerilir. Daha sonra klinik olarak belirtildiği şekilde karaciğer takibine devam edilebilir.
Karaciğer yetmezliği
Metabolizma ve biliyer atılım MEKİNİST eliminasyonunun başlıca yolları olduğundan, MEKİNİST orta ila şiddetli karaciğer yetmezliği olan hastalarda dikkatle uygulanmalıdır (bkz. Bölüm 4.2 ve 5.2).
Derin ven trombozu (DVT)/Pulmoner embolizm (PE)
MEKİNİST dabrafenib ile kombinasyon halinde kullanıldığında derin ven trombozu veya pulmoner emboli meydana gelebilir. Hastalarda nefes darlığı, göğüs ağrısı veya kol ya da bacakta şişme gibi DVT veya PE bulguları gelişirse hasta derhal tıbbi yardım almalıdır. Hayatı tehdit edici pulmoner emboli durumunda MEKİNİST ve dabrafenib bir daha başlanmamak üzere kesilir.
Şiddetli kutanöz advers reaksiyonlar (SCAR)
MEKİNİST/dabrafenib kombinasyon tedavisi sırasında, Stevens-Johnson's sendromu (SJS) dahil olmak üzere SCAR vakaları ve hayatı tehdit edebilen ya da ölümcül olabilen eozinofili ve sistemik semptomlar ile birlikte ilaç reaksiyonu (DRESS) bildirilmiştir. Tedavi başlatılmadan önce, hastalar deri reaksiyonlarının belirti ve bulguları konusunda bilgilendirilmeli ve bu reaksiyonlar açısından yakından takip edilmelidir. Eğer SCAR düşündüren belirti ve bulgular ortaya çıkarsa, MEKİNİST ve dabrafenib ile tedavi durdurulmalıdır.
Gastrointestinal bozukluklar
Dabrafenib ile kombinasyon halinde MEKİNİST kullanan hastalarda ölümcül sonlanımı da içeren kolit ve gastrointestinal perforasyon bildirilmiştir (bkz. Bölüm 4.8). Monoterapi olarak veya dabrafenib ile kombinasyon halinde MEKİNİST tedavisi, divertikülit öyküsü olan, gastrointestinal sistem metastazları ve gastrointestinal perforasyon riski olduğu bilinen tıbbi ürünlerin eş zamanlı kullanımı dahil olmak üzere gastrointestinal perforasyon için risk faktörleri olan hastalarda dikkatli kullanılmalıdır.
Sarkoidoz
Dabrafenib ile kombinasyon halinde MEKİNİST ile tedavi edilen hastalarda, çoğunluklu deri, akciğer, göz ve lenf nodlarını tutan sarkoidoz vakaları bildirilmiştir. Vakaların çoğunda MEKİNİST ve dabrafenib ile tedaviye devam edilmiştir. Sarkoidoz tanısı durumunda ilgili tedavi düşünülmelidir. Sarkoidozun hastalık progresyonu olarak yanlış yorumlanmaması önemlidir.
Sodyum
MEKİNİST, tablet başına 1 mmol'den (23 mg) daha az sodyum içerir, yani esasında "sodyum içermez".
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer tıbbi ürünlerin MEKİNİST üzerindeki etkileri:
MEKİNİST, efluks transporterı P-gp'nin in vitro substratıdır. Hepatik P-gp'nin güçlü inhibisyonunun daha yüksek MEKİNİST düzeylerine yola açabileceği olasılığı dışlanamadığından, MEKİNİST, P-gp'nin güçlü inhibitörleri olan tıbbi ürünler (örn. verapamil, siklosporin, ritonavir, kinidin, itrakonazol) ile bir arada uygulanırken dikkatli olunmalıdır.
MEKİNİST'in diğer tıbbi ürünler üzerindeki etkileri:
In vitro ve in vivo verilere dayanarak, MEKİNİST'in CYP enzimleri veya transporterlar ile etkileşim aracılığıyla diğer tıbbi ürünlerin farmakokinetiğini anlamlı olarak etkilemesi olası değildir (bkz. Bölüm 5.2). MEKİNİST bağırsakta BCRP substratlarının (örn. pitavastatin) geçici inhibisyonu ile sonuçlanabilir ki bu durum bu ajanların ve MEKİNİST dozlarının aşamalı olarak uygulanması (2 saatlik arayla) ile azaltılabilir.
Dabrafenib ile kombinasyon:
MEKİNİST, dabrafenib ile kombinasyon halinde kullanıldığında, etkileşimler için dabrafenib KÜB'ü Bölüm 4.4 ve 4.5'e bakınız.
Yiyeceklerin MEKİNİST üzerindeki etkisi:
Hastalar MEKİNİST'i, yiyeceklerin MEKİNİST emilimi üzerindeki etkisinden dolayı yemeklerden en az 1 saat önce ya da 2 saat sonra dabrafenib ile kombinasyon halinde almalıdır (bkz. Bölüm 4.2 ve 5.2).
4.6. Gebelik ve laktasyon
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar tedavi süresince ve MEKİNİST tedavisinin kesilmesinden sonra 16 hafta boyunca etkili doğum kontrol yöntemlerini uygulamak zorundadırlar.
Klinik verilere göre, trametinib monoterapisi ile birlikte uygulandığında hormonal kontraseptiflerin etkinlik kaybı beklenmemektedir (bkz. Bölüm 5.2).
Dabrafenib ile kullanım, hormonal kontraseptiflerin etkisini azaltabilir ve dolayısıyla MEKİNİST, dabrafenib ile kombinasyon halinde kullanıldığında bariyer yöntemi gibi alternatif bir doğum kontrol yöntemi kullanılmalıdır. Daha fazla bilgi için dabrafenib KÜB'üne bakınız.
Gebelik dönemi
Gebe kadınlarda, MEKİNİST ile ilgili yeterli ve iyi kontrollü çalışma bulunmamaktadır. Hayvanlar üzerinde yapılan çalışmalarda üreme toksisitesi görülmüştür (bkz. Bölüm 5.3). MEKİNİST'in gebelik ve / veya fetus / yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. MEKİNİST, gebe kadınlarda kullanılmamalıdır.
MEKİNİST, gebelik döneminde kullanıldığında veya hasta MEKİNİST tedavisi sırasında gebe kaldığında, hasta fetüs için potansiyel risk konusunda bilgilendirilmelidir.
Laktasyon dönemi
MEKİNİST'in anne sütüne geçip geçmediği bilinmemektedir. Birçok tıbbi ürün anne sütüne geçtiğinden, emzirilen bebekte oluşabilecek risk göz ardı edilemez. MEKİNİST, emziren annelerde uygulanmamalıdır. Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak, emzirmenin kesilmesine ya da MEKİNİST tedavisinin kesilmesine karar verilmelidir.
Üreme yeteneği/fertilite
Dabrafenib ile kombinasyon halinde MEKİNİST için insanlarda herhangi bir veri mevcut değildir. Hayvanlarda, herhangi bir fertilite çalışması gerçekleştirilmemiştir fakat dişi üreme organlarında yan etkiler görülmüştür (bkz. Bölüm 5.3). MEKİNİST, insanlarda fertiliteyi bozabilir.
Dabrafenib ile kombinasyon halinde MEKİNİST uygulanan erkekler:
Dabrafenib uygulanan hayvanlarda spermatogenez üzerinde etkiler gözlemlenmiştir. Dabrafenib ile kombinasyon halinde MEKİNİST uygulanan erkek hastalar, irreversibl olabilen potansiyel spermatogenezde bozulma riski konusunda bilgilendirilmelidir. Daha fazla bilgi için dabrafenib Kısa Ürün Bilgisi'ne bakınız.
4.7. Araç ve makine kullanımı üzerindeki etkiler
MEKİNİST araç ya da makine kullanımı üzerinde çok düşük etkiye sahiptir. Hastanın muhakeme, motor ve kognitif beceriler gerektiren işleri yerine getirme yeteneği değerlendirilirken, hastanın klinik durumu ve yan etki profili de göz önünde bulundurulmalıdır. Hastalar, bu aktiviteleri etkileyebilecek yorgunluk, sersemlik ya da göz problemleri potansiyeli konusunda bilgilendirilmelidir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti:
Dabrafenib ile kombinasyon halindeki MEKİNİST'in güvenliliği, günde 1 kez 2 mg MEKİNİST ve günde 2 kez 150 mg dabrafenib ile tedavi edilen BRAF V600 mutant rezeke edilemeyen ya da metastatik melanomlu, tam rezeksiyonu takiben (adjuvan tedavi) evre III BRAF V600 mutasyonlu melanomlu ve ileri evre küçük hücreli dışı akciğer kanseri (KHDAK) olan 1076 hastadan oluşan entegre güvenlilik popülasyonunda değerlendirilmiştir. Bu hastaların 559'u MEK115306 (COMBI-d) ve MEK116513 (COMBI-v) olmak üzere iki randomize Faz III çalışmada BRAF V600 mutant melanom için kombinasyonla, 435'i randomize Faz III çalışma BRF115532'de (COMBI-AD) tam rezeksiyon sonrasında evre III BRAF V600 mutasyonlu melanomun adjuvan tedavisinde kombinasyonla ve 82'si çok kohortlu, randomize olmayan Faz II çalışma BRF113928'de BRAF V600 mutant KHDAK için kombinasyonla tedavi edilmiştir (bkz. Bölüm 5.1).
MEKİNİST ve dabrafenib kombinasyon tedavisinin en yaygın advers reaksiyonları (≥%20 insidans) ateş, yorgunluk, bulantı, üşüme, baş ağrısı, ishal, kusma, eklem ağrısı ve döküntüyü içermektedir.
Aşağıda, yan etkiler MedDRA vücut sistem organ sınıflandırmasına göre liste halinde sunulmaktadır. Sıklık sınıflandırılması için aşağıdaki sınıflandırma ölçeği kullanılmıştır:
Sıklık tanımlaması: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kategoriler, klinik çalışma verilerindeki mutlak sıklıklara göre atanmıştır. Her bir sıklık grubu içerisinde advers reaksiyonlar azalan ciddilik sırasında göre sunulmaktadır.
MEK115306, MEK116513, BRF113928 ve BRF115532 çalışmalarında dabrafenib ile kombinasyon halindeki MEKİNİST'in birleştirilmiş güvenlilik popülasyonunda bildirilen advers reaksiyonlar (n=1076)
Enfeksiyonlar ve enfestasyonlar
Çok yaygın: Nazofarenjit
Yaygın: İdrar yolu enfeksiyonu, selülit, folikülit, paronişi, püstüler döküntü
İyi huylu, kötü huylu ve tanımlanmamış neoplazmalar (kist ve polipler dahil)
Yaygın: Kutanöz skuamöz hücreli karsinom, papillom, seboreik keratoz Yaygın olmayan: Yeni primer melanom, akrokordon (et beni)
Kan ve lenf sistemi hastalıkları
Yaygın: Nötropeni, anemi, trombositopeni, lökopeni
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Aşırı duyarlılık, sarkoidoz Metabolizma ve beslenme hastalıkları Çok yaygın: Azalmış iştah
Yaygın: Dehidratasyon, hiponatremi, hipofosfatemi, hiperglisemi,
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı, baş dönmesi
Göz hastalıkları
Yaygın: Bulanık görme, görme bozukluğu, üveit
Yaygın olmayan: Koryoretinopati, retina dekolmanı, periorbital ödem
Kardiyak hastalıklar
Yaygın: Azalmış ejeksiyon fraksiyonu Yaygın olmayan: Bradikardi Bilinmiyor: Miyokardit
Vasküler hastalıklar
Çok yaygın: Hipertansiyon, hemoraji Yaygın: Hipotansiyon, lenfödem
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Çok yaygın: Öksürük Yaygın: Dispne
Yaygın olmayan: Pnömonit
Gastrointestinal hastalıklar
Çok yaygın: Karın ağrısı, kabızlık, ishal, bulantı, kusma Yaygın: Ağız kuruluğu, stomatit
Yaygın olmayan: Pankreatit, kolit Seyrek: Gastrointestinal perforasyon Deri ve deri altı doku hastalıkları
Çok yaygın: Cilt kuruluğu, kaşıntı, döküntü, eritem
Yaygın: Dermatitis akneiform, aktinik keratoz, gece terlemesi, hiperkeratoz, alopesi, palmar- plantar eritrodizestezi sendromu, deri lezyonu, hiperhidroz, pannikülit, deri fissürleri, fotosensitivite
Bilinmiyor: Stevens-Johnson's sendromu, eozinofili ve sistemik semptomlar ile birlikte ilaç reaksiyonu, jeneralize eksfolyatif dermatit
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları Çok yaygın: Artralji, miyalji, ekstremitelerde ağrı, kas spazmları Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Böbrek yetmezliği, nefrit
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Yorgunluk, üşüme, asteni, periferik ödem, ateş, grip benzeri hastalık Yaygın: Mukoza enflamasyonu, yüz ödemi
Araştırmalar:
Çok yaygın: ALT düzeyinde artış, AST düzeyinde artış
Yaygın: Kan ALP düzeyinde artış, gamma-glutamiltransferaz (GGT) düzeyinde artış, kan CPK düzeyinde artış
Şu advers reaksiyonların sıklığı MEK115306 ile karşılaştırıldığında daha yüksektir: Kas spazmı (çok yaygın), böbrek yetmezliği ve lenfödem (yaygın), akut böbrek yetmezliği (yaygın olmayan),
4.9. Doz aşımı ve tedavisi
MEKİNİST ile yapılan klinik çalışmalarda bir kazara doz aşımı vakası bildirilmiştir; 4 mg'lık tek bir doz. Bu MEKİNİST doz aşımı olayından sonra herhangi bir advers olay (AO) bildirilmemiştir. MEKİNİST+dabrafenib kombinasyonu ile yürütülen klinik çalışmalarda 11 hasta MEKİNİST doz aşımı bildirmiştir (4 mg), herhangi bir ciddi advers olay bildirilmemiştir. Doz aşımı için spesifik bir tedavi yoktur. Doz aşımı meydana gelirse, gerekli izlem de yapılarak hastaya destekleyici tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörü, mitojenle aktive edilen protein kinaz inhibitörleri
ATC kodu: L01EE01
Etki mekanizması:
MEKİNİST mitojen tarafından aktive edilen ekstrasellüler sinyalle regüle edilen kinaz 1 (MEK1) ve MEK2 aktivasyonunun ve kinaz aktivitesinin reversibl, oldukça seçici, allosterik inhibitörüdür. MEK proteinleri, ekstrasellüler sinyalle-ilişkili kinaz (ERK) yolağının bileşenleridir. Melanom ve diğer kanserlerde, bu yolak genellikle MEK'i aktive eden BRAF'ın mutasyona uğramış formları tarafından aktive edilmektedir. MEKİNİST, BRAF tarafından MEK aktivasyonunu ve MEK kinaz aktivitesini inhibe eder. MEKİNİST, BRAF V600 mutant melanom hücre dizilerinin büyümesini inhibe eder ve BRAF V600 mutant melanom hayvan modellerinde anti-tümör etki gösterir.
Dabrafenib ile kombinasyon:
Dabrafenib, RAF kinazlarının bir inhibitörüdür. BRAF'ın onkojenik mutasyonları, RAS/RAF/MEK/ERK yolağının yapısal aktivasyonuna yol açar. Bu şekilde, MEKİNİST ve dabrafenib bu yolakta MEK ve RAF olmak üzere iki kinazı inhibe eder ve dolayısıyla kombinasyon, yolakta eş zamanlı inhibisyon sağlar. MEKİNİST'in dabrafenib ile kombinasyonu, in vitro koşullarda BRAF V600 mutasyonu pozitif melanom hücre dizilerinde anti-tümör aktivite göstermiştir ve in vivo koşullarda BRAF V600 mutasyonu pozitif melanom ksenograftlarında direnç gelişimini geciktirmiştir.
BRAF mutasyon durumununbelirlenmesi:
Dabrefinib ile kombinasyon halinde MEKİNİST almadan önce, hastaların valide edilmiş bir testle doğrulanmış olan BRAF V600 mutasyonu pozitif tümör durumuna sahip olması gerekmektedir.
Klinik çalışmalarda, BRAF mutasyon tayini kullanarak BRAF V600 mutasyonu için merkezi test, mevcut olan en yeni tümör örneği ile gerçekleştirilmiştir. Primer tümör ya da metastaz bölgesinden alınan tümör, Response Genetics Inc. tarafından geliştirilen valide edilmiş bir polimeraz zincir reaksiyonu (PCR) testi ile test edilmiştir. Test, özellikle V600E ve V600K mutasyonları arasında ayırım yapmak için tasarlanmıştır. Çalışmaya yalnızca BRAF V600E ya da V600K mutasyonu pozitif tümörleri olan hastalar katılmıştır.
Daha sonra, tüm hasta numuneleri CE uygunluk işareti olan valide edilmiş bioMerieux (bMx) THxID BRAF tayini ile tekrar test edilmiştir. bMx THxID BRAF tayini, FFPE tümör dokusundan ekstrakte edilen DNA üzerinde gerçekleştirilen allele özgü bir PCR'dir. Test, BRAF V600E ve V600K mutasyonlarını yüksek hassasiyetle tespit etmek üzere tasarlanmıştır (FFPE tümör dokusundan ekstrakte edilen DNA kullanarak arka planda yabanıl tip dizilere karşı
%5 V600E ve V600K dizisine kadar). Retrospektif iki yönlü Sanger dizi tespit analizi ile gerçekleştirilen klinik ve klinik dışı çalışmalar, testin aynı zamanda daha az yaygın olan BRAF V600D mutasyonunu ve V600E/K601E mutasyonunu daha düşük hassasiyetle tespit ettiğini göstermiştir. THxID BRAF testi ile mutasyon için pozitif sonuç veren ve daha sonra referans yöntemle dizi tespiti gerçekleştirilen klinik dışı ve klinik çalışmalardaki numunelerde (n = 876), testin özgünlüğü %94 bulunmuştur.
Farmakodinamik etkiler:
MEKİNİST, BRAF mutant melanom tümör hücre dizisinde ve melanom ksenograft modellerinde fosforlanmış ERK düzeylerini baskılar.
BRAF ve NRAS mutasyonu pozitif melanomlu hastalarda, MEKİNİST uygulaması, fosforlanmış ERK'nın inhibisyonu, Ki67'nin inhibisyonu (hücre proliferasyon markerı) ve p27'de (bir apoptoz markerı) artışlar dahil olmak üzere tümör biyomarkerlarında doza bağlı değişikliklere neden olmuştur. Günde bir kez 2 mg dozun tekrarlı uygulamasını takiben gözlenen ortalama MEKİNİST konsantrasyonları, 24-saatlik dozlama aralığında klinik öncesi hedef konsantrasyonu geçmekte ve bu şekilde, MEK yolağının sürekli inhibisyonunu sağlamaktadır.
Klinik etkililik ve güvenlilik
Rezeke edilemeyen veya metastatik melanom
Klinik çalışmalarda sadece kutanöz melanomu olan hastalarla çalışılmıştır. Oküler veya mukozal melanomu olan hastalarda etkililik değerlendirilmemiştir.
Dabrafenib ile kombinasyon halinde MEKİNİST:
Önceden tedavi görmemiş hastalar
BRAF V600 mutasyonlu rezeke edilemeyen veya metastatik melanomlu yetişkin hastaların tedavisinde dabrafenib (günde iki kez 150 mg) ile kombinasyon halinde MEKİNİST (günde bir kez 2 mg) için önerilen dozun etkililiği ve güvenliliği iki Faz III ve bir destekleyici Faz I/II çalışmada çalışılmıştır.
MEK115306 (COMBI-d)
MEK115306 (COMBI-d) rezeke edilemeyen (derece IIIC) veya metastatik (derece IV) BRAF V600E/K mutasyonu pozitif kutanöz melanomu olan gönüllüler için birinci basamak tedavi olarak MEKİNİST ve dabrafenibkombinasyonunundabrafenib ve plasebo ile karşılaştırıldığı
bir Faz III, randomize, çift kör çalışmadır. Çalışmanın birincil sonlanım noktası araştırıcı tarafından değerlendirilen progresyonsuz sağkalım (PFS) ve kritik ikincil sonlanım noktası genel sağkalım (OS) olmuştur. Gönüllüler laktat dehidrogenaz (LDH) düzeyi (ï£ normalin üst sınırına (ULN) karşı >ULN) ve BRAF mutasyonuna (V600K'ya karşı V600E) göre sınıflandırılmıştır.
Toplam 423 gönüllü kombinasyon tedavisi (N=211) ya da dabrafenib (N=212) almak üzere 1:1 oranında randomize edilmiştir. Hastaların çoğu beyaz ırktan (>%99) ve erkek (%53) olup medyan yaş 56'dır (%28'i ≥65 yaşındadır). Hastaların büyük çoğunluğu Evre IV M1c hastalığa (%67) sahiptir. Çoğu hastada başlangıçta LDH ï£ ULN (%65), ECOG performans skoru 0'dır (%72) ve bir visseral hastalık vardır (%73). Hastaların büyük çoğunluğunda BRAF V600E mutasyonu söz konusudur (%85). Beyin metastazları olan gönüllüler çalışmaya dahil edilmemiştir.
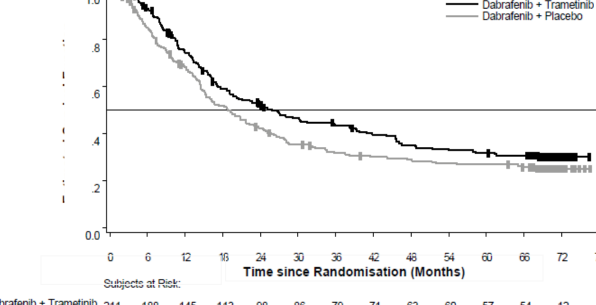
Medyan OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık, 4 yıllık ve 5 yıllık sağkalım oranları Tablo 4'te sunulmaktadır. 5 yılda gerçekleştirilen bir OS analizinde, kombinasyon kolu için ortalama OS, dabrafenib monoterapisine göre yaklaşık 7 ay daha uzun olmuş (25,8 aya karşı 18,7 ay), 5 yıllık sağkalım oranları dabrafenib monoterapisi için %27'ye karşılık kombinasyon için %32 bulunmuştur (Tablo 4, Şekil 1). Kaplan-Meier OS eğrisinin 3 ila 5 yıl arasında stabilize olduğu görülmektedir (bkz. Şekil 1). 5 yıllık OS oranı, tedavi başlangıç LDH düzeyleri normal olan hastalar için kombinasyon kolunda %40 (%95 GA: 31,2; 48,4) iken, dabrafenib monoterapi
kolunda %33 (%95 GA: 25,0; 41) olmuştur. Başlangıcında LDH düzeyleri yüksek olan hastalar için ise dabrafenib monoterapi kolunda %14'e (%95 GA: 6,8; 23,1) karşı kombinasyon kolunda
%16 (%95 GA: 8,4; 26) bulunmuştur.
Tablo 4 Çalışma MEK115306 (COMBI-d) için OS sonuçları
OS analizi (veri kesme tarihi: 12 Ocak 2015) | 5 yıllık OS analizi (veri kesme tarihi: 10 Aralık 2018) | |||
| Dabrafenib + MEKİNİST (n=211) | Dabrafenib + Plasebo (n=212) | Dabrafenib + MEKİNİST (n=211) | Dabrafenib+ Plasebo (n=212) |
Hasta sayısı |
|
|
|
|
Ölen (olay), n (%) | 99 (47) | 123 (58) | 135 (64) | 151 (71) |
OS tahminleri (ay) | ||||
Medyan (%95 GA) | 25,1 (19,2; NR) | 18.7 (15,2; 23,7) | 25,8 (19,2; 38,2) | 18,7 (15,2; 23,1) |
Tehlike oranı (%95 GA) | 0,71 (0,55; 0,92) | 0,8 (0,63; 1,01) | ||
p değeri | 0,011 | NA |
| |
Genel sağkalım tahmini, % (%95 GA) | Dabrafenib + MEKİNİST (n=211) | Dabrafenib + Plasebo (n=212) | ||
1 yılda | 74 (66,8; 79) | 68 (60,8; 73,5) | ||
2 yılda | 52 (44,7; 58,6) | 42 (35,4; 48,9) | ||
3 yılda | 43 (36,2; 50,1) | 31 (25,1; 37,9) | ||
4 yılda | 35 (28,2; 41,8) | 29 (22,7; 35,2) | ||
5 yılda | 32 (25,1; 38,3) | 27 (20,7; 33) | ||
NR = Ulaşılmadı, NA = Geçerlideğil |
| |||
Randomizasyondan İtibaren Geçen Süre (Ay)
Risk altındaki gönüllüler:
Tahmini Sağkalım Fonksiyonu
Şekil 1 Çalışma MEK115306 için Kaplan-Meier OS Eğrileri (ITT Popülasyonu)
Birincil sonlanım noktası PFS'de iyileşmeler, dabrafenib monoterapisine kıyasla, kombinasyon kolunda 5 yıllık bir zaman dilimi içinde sürdürülmüştür. Genel yanıt oranı (ORR) için de iyileşmeler gözlenmiştir ve kombinasyon kolunda dabrafenib monoterapisine kıyasla daha uzun bir yanıt süresi (DoR) izlenmiştir (Tablo 5).
Tablo 5 MEK115306 (COMBI-d) çalışmasının etkililik sonuçları
| Birincil analiz (veri kesme tarihi: 26 Ağustos 2013) | Güncellenmiş analiz (veri kesme tarihi: 12 Ocak 2015) | 5 yıllık analiz (veri kesme tarihi: 10 Aralık 2018) | |||
Sonlanımnoktası | Dabrafenib + | Dabrafenib + | Dabrafenib + | Dabrafenib + | Dabrafenib + | Dabrafenib + |
MEKİNİST | (Plasebo (n=212) | MEKİNİST | Plasebo (n=212) | MEKİNİST | Plasebo (n=212) | |
(n=211) |
| (n=211) |
| (n=211) |
| |
PFS |
|
| ||||
Progresif hastalık veya ölüm, n (%) | 102 (48) | 109 (51) | 139 (66) | 162 (76) | 160 (76) | 166 (78) |
Medyan PFS (ay) | 9,3 | 8,8 | 11 | 8,8 | 10,2
(8,1; 12,8) | 8,8
(5,9; 9,3) |
(%95 GA) |
(7,7; 11,1) |
(5,9; 10,9) |
(8; 13,9) |
(5,9; 9,3) | ||
Tehlike oranı | 0,75 | 0,67 | 0,73 (0,59; 0,91) | |||
(%95 GA) | (0,57; 0,99) | (0,53; 0,84) | ||||
P değeri | 0,035 | <0,001 | NA | |||
ORR | 67 | 51 | 69 | 53 | 69 | 54 |
% (%95 GA) | (59,9; 73) | (44,5; 58,4) | (61,8; 74,8) | (46,3; 60,2) | (62,5; 75,4) | (46,8; 60,6) |
ORR farkı | 15 (5,9; 24,5) | 15 | NA | |||
(%95 GA) | (6; 24,5) | |||||
P değeri | 0,0015 | 0,0014 | NA | |||
DoR (ay) |
|
|
|
|
|
|
Medyan | 9,2 | 10,2 | 12,9 | 10,6 | 12,9 | 10,2 |
(%95 GA) | (7,4; NR) | (7,5; NR) | (9,4; 19,5) | (9,1; 13,8) | (9,3; 18,4) | (8,3; 13,8) |
a â Progresyonsuz Sağkalım (araştırıcı tarafından değerlendirilen)
b - Genel Yanıt Oranı = Tam Yanıt + Kısmi Yanıt
c - Yanıt Süresi
d - Bildirim zamanında araştırıcı tarafından değerlendirilen yanıtların çoğu (>%59) halen devam etmektedir
e - Yuvarlanmamış ORR bulgusu temelinde hesaplanmış ORR farkı
f - Güncellenmiş analiz önceden planlı değildir ve p değeri çoklu test için düzeltilmemiştir. NR = Ulaşılmamıştır
NA = Geçerli değildir
MEK116513 (COMBI-v)
MEK116513 çalışması, BRAF mutasyonu pozitif rezeke edilemeyen veya metastatik melanomda MEKİNİST ve dabrafenib kombinasyon tedavisini vemurafenib monoterapisi ile karşılaştıran 2 kollu, randomize, açık etiketli bir Faz III çalışmadır. Çalışmanın birincil sonlanım noktası OS olup kritik ikincil sonlanma noktası PFS'dir. Gönüllüler laktat dehidrogenaz (LDH) düzeyi (ï£ULN'ye karşı >ULN) ve BRAF mutasyonuna (V600K'ya karşı V600E) göre sınıflandırılmıştır.
Toplam 704 gönüllü kombinasyon ya da vemurafenib almak üzere 1:1 oranında randomize edilmiştir. Hastaların çoğu beyaz ırktan (>%96) ve erkek (%55) olup medyan yaş 55'tir (%24'ü
≥65 yaşındadır). Hastaların büyük çoğunluğu evre IV M1c hastalığa (%61 genel) sahiptir. Çoğu hastada başlangıçta LDH ï£ ULN (%67), ECOG performans skoru 0'dır (%70) ve bir visseral hastalık vardır (%78). Genel olarak gönüllülerin %54'ünde çalışma başlangıcında < 3 hastalık bölgesi vardır. Hastaların büyük çoğunlunda BRAF V600E mutasyonu söz konusudur (%89). Beyin metastazları olan gönüllüler çalışmaya dahil edilmemiştir.
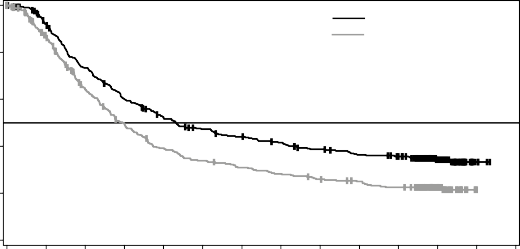
Medyan OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık, 4 yıllık ve 5 yıllık sağkalım oranları Tablo 6'da sunulmaktadır. 5 yılda gerçekleştirilen bir OS analizinde, kombinasyon kolu için ortalama OS, vemurafenib monoterapisine göre yaklaşık 8 ay daha uzun olmuş (26 aya karşı 17,8 ay), 5 yıllık sağkalım oranları vemurafenib monoterapisi için %23'e karşılık kombinasyon için %36 bulunmuştur (Tablo 6, Şekil 2). Kaplan-Meier OS eğrisinin 3 ila 5 yıl arasında stabilize olduğu görülmektedir (bkz. Şekil 2). 5 yıllık OS oranı, tedavi başlangıcında LDH düzeyleri normal olan hastalar için kombinasyon kolunda %46 (%95 GA: 38,8; 52) iken, vemurafenib monoterapi
kolunda %28 (%95 GA: 22,5; 34,6) olmuştur. Başlangıç LDH düzeyleri yüksek olan hastalar için ise vemurafenib monoterapi kolunda %10'a (%95 GA: 5,1; 17,4) karşı kombinasyon kolunda %16 (%95 GA: 9,3; 23,3) bulunmuştur.
Tablo 6 Çalışma MEK116513 (COMBI-v) için OS sonuçları
OS analizi (veri kesme tarihi: 13 Mart 2015) | 5 yıllık OS analizi (veri kesme tarihi: 08 Ekim 2018) | |||
| Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) |
Hasta sayısı |
|
|
|
|
Ölen (olay), n (%) | 155 (44) | 194 (55) | 216 (61) | 246 (70) |
OS tahminleri (ay | ) |
|
|
|
Medyan (%95 GA) | 25,6 (22,6; NR) | 18 (15,6; 20,7) | 26 (22,1; 33,8) | 17,8 (15,6; 20,7) |
Düzeltilmiş tehlike oranı (%95 GA) | 0,66 (0,53; 0,81) | 0,70 (0,58; 0,84) | ||
p değeri | <0,001 |
| NA |
|
Genel sağkalım tahmini, % (%95 GA) | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) | ||
1 yılda | 72 (67; 77) | 65 (59; 70) | ||
2 yılda | 53 (47,1; 57,8) | 39 (33,8; 44,5) | ||
3 yılda | 44 (38,8; 49,4) | 31 (25,9; 36,2) | ||
4 yılda | 39 (33,4; 44) | 26 (21,3; 31) | ||
5 yılda | 36 (30,5; 40,9) | 23 (18,1; 27,4) | ||
NR = Ulaşılmamıştır, NA = Geçerli değildir |
| |||
Şekil 2 MEK116513 çalışması için güncel OS analizinin Kaplan-Meier eğrileri
Tahmini Sağkalım Fonksiyonu
Randomizasyondan itibaren geçen süre (ay)
İkincil sonlanım noktası PFS'de sağlanan iyileşmeler, vemurafenib monoterapisine kıyasla, kombinasyon kolunda 5 yıllıkbirzamandilimiiçindesürdürülmüştür. ORR için de iyileşmeler
gözlenmiştir ve kombinasyon kolunda vemurafenib monoterapisine kıyasla daha uzun bir DoR izlenmiştir (Tablo 7).
Tablo 7 MEK116513 (COMBI-v) çalışması için etkililik sonuçları
| Birincil analiz (Veri kesme tarihi: 17 Nisan 2014) | 5 yıllık analiz (Veri kesme tarihi: 08 Ekim 2018) | ||
Sonlanım noktası | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) |
PFS |
|
| ||
Progresif hastalık veya ölüm, n (%) | 166 (47) | 217 (62) | 257 (73) | 259 (74) |
Medyan PFS (ay) (%95 GA) | 11,4 (9,9; 14,9) | 7,3 (5,8; 7,8) | 12,1 (9,7; 14,7) | 7,3 (6; 8,1) |
Tehlike oranı (%95 GA) | 0,56 (0,46; 0,69) | 0,62 (0,52; 0,74) | ||
P değeri | <0,001 | NA | ||
ORR % (%95 GA) | 64 (59,1; 69,4) | 51 (46,1; 56,8) | 67 (62,2; 72,2) | 53 (47,2; 57,9) |
ORR farkı (%95 GA) | 13 (5,7; 20,2) | NA | ||
P değeri | 0,0005 | NA | ||
DoR (Ay) Medyan (%95 GA) |
13,8 (11; NR) |
7,5 (7,3; 9,3) |
13,8 (11,3; 18,6) |
8,5 (7,4; 9,3) |
a â Progresyonsuz sağkalım (araştırmacı tarafından değerlendirilen) b â Genel Yanıt Oranı = Tam Yanıt + Kısmi Yanıt c â Yanıt süresi d â Raporlama sırasında, araştırmacı tarafından değerlendirilen yanıtların çoğunluğu (dabrafenib+MEKİNİST %59 ve vemurafenib %42) halen devam etmektedir. NR = Ulaşılmamıştır NA = Geçerli değildir | ||||
Önceki BRAF inhibitör tedavisi:
Önceki BRAF inhibitör tedavisinde progrese olmuş hastalarda MEKİNİST+dabrafenib kombinasyonu ile sınırlı veri mevcuttur.
BRF113220 çalışması Bölüm B, bir BRAF inhibitör tedavisinde progrese olmuş 26 hastadan oluşan bir grubu içermiştir. MEKİNİST 2 mg QD ve dabrafenib 150 mg BID kombinasyonu, bir BRAF inhibitörü tedavisinde progrese olan hastalarda sınırlı klinik aktivite göstermiştir (bkz. Bölüm 4.4). Araştırmacı tarafından değerlendirilen doğrulanmış yanıt oranı %15 (%95 GA: 4,4;
34,9) ve medyan PFS 3,6 ay (%95 GA: 1,9; 5,2) bulunmuştur. Bu çalışmanın C bölümünde dabrafenib monoterapisinden MEKİNİST 2 mg QD+dabrafenib 150 mg BID kombinasyonuna geçiş yapan 45 hastada da benzer sonuçlar görülmüştür. Bu hastalarda 3,6 ay (%95 GA: 2; 4) medyan PFS ile %13'lük (%95 GA: 5; 27) bir doğrulanmış yanıt oranı gözlenmiştir.
Beyin metastazları olan hastalar:
Beyne metastaz yapmış BRAF V600 mutant-pozitif melanomu olan hastalarda dabrafenib ile kombinasyon halinde MEKİNİST'in etkililik ve güvenliliği, randomize olmayan, açık etiketli, çok merkezli bir Faz II çalışmada (COMBI-MB çalışması) incelenmiştir. Toplam 125 hasta dört kohorta kaydedilmiştir:
Kohort A: Daha önce beyin hedefli lokal tedavinin yapılmadığı, asemptomatik beyin metastazları ile birlikte BRAFV600E mutant melanomun olduğu, ECOG performans skoru 0 ya da 1 olan hastalar.
5.2. Farmakokinetik özellikler
Emilim:
MEKİNİST oral yolla emilmekte olup, doruk konsantrasyonlara erişmek için geçen medyan süre dozlamadan sonra 1,5 saattir. Tekli 2 mg tablet dozunun ortalama mutlak bioyararlanımı, intravenöz (IV) mikrodoza kıyasla %72'dir. Maruziyette artış (Cve EAA), tekrarlı dozları
takiben dozla orantısal olmuştur. Günlük 2 mg dozunun uygulanmasını takiben, kararlı durum geometrik ortalama C, EAAve doz öncesi konsantrasyon, düşük dip-tepe noktası oranı ile (1,8) sırasıyla 22,2 ng/mL, 370 ng*s/mL ve 12,1 ng/mL olmuştur. Bireyler arası değişkenlik düşük bulunmuştur (< %28).
MEKİNİST 2 mg günde bir kez dozda ortalama birikim oranı 6 olacak şekilde tekrarlanan günlük doz uygulaması ile birikir. Kararlı durum 15. gün itibariyle elde edilmiştir.
Tek doz MEKİNİST'in yüksek yağ içerikli, yüksek kalorili bir öğünle birlikte uygulanması, açlık koşullarına kıyasla Cve EAA parametrelerinde sırasıyla %70 ve %10 düşüşle sonuçlanmıştır (bkz. Bölüm 4.2 ve 4.5).
Dağılım:
MEKİNİST, insan plazma proteinlerine % 97,4 oranında bağlanır. MEKİNİST'in dağılım hacmi, 5 mcg IV mikrodoz uygulamasından sonra belirlendiği şekilde 1200 L'dir.
Biyotranformasyon:
In vitro ve in vivo çalışmalar, MEKİNİST'in daha çok tek başına deasetilasyon ya da mono- oksijenasyon ile kombinasyon halinde metabolize olduğunu göstermiştir. Deasetilemetaboliti ek olarak glukuronidasyon ile metabolize olmuştur. CYP3A4 oksidasyonunun minör bir metabolizma yolağı olduğu kabul edilir. Deasetilasyona, diğer hidrolitik enzimlerin olası katkıları ile karboksil-esteraz 1b, 1c ve 2 aracılık eder.
Bununla birlikte, MEKİNİST'in tek yada tekrarlı dozunda MEKİNİST plazmada dolaşan ana maddedir.
Eliminasyon:
Ortalama terminal yarı ömür, tek doz uygulamadan sonra 127 saattir (5,3 gün). MEKİNİST plazma IV klirensi, 3,21 L/saattir.
Uzun eliminasyon yarı ömründen dolayı, çözelti şeklinde radyolojik olarak işaretlenmiş MEKİNİST'in tekli oral dozunun uygulanmasını takiben 10 günlük bir toplama periyodundan sonra toplam doz geri kazanımı düşüktür (< %50). İlaca bağlı madde çoğunlukla feçesle atılmıştır (atılan radyoaktivite >%80'i) ve düşük miktarda idrar ile atılmıştır (≤%19). Atılan dozun %0,1'inden azı idrarda ana ilaç olarak geri kazanılmıştır.
Doğrusallık/ doğrusal olmayan durum:
Veri mevcut değildir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
MEKİNİST'in düşük renal atılımı göz önüne alındığında böbrek yetmezliğinin MEKİNİST farmakokinetiğinde klinik açıdan anlamlı bir etkisinin olması olası değildir. MEKİNİST'in farmakokinetiği, MEKİNİST ile yapılan klinik çalışmalarda yer alan ve hafif düzeyde böbrek yetmezliği görülen 223 hastada ve orta düzeyde böbrek yetmezliği görülen 35 hastada bir popülasyon farmakokinetik analizi kullanılarak karakterize edilmiştir. Hafif ve orta düzeyde böbrek yetmezliği, MEKİNİST maruziyeti üzerinde herhangi bir etki oluşturmamıştır (her bir grup için <%6). Şiddetli böbrek yetmezliği olan hastalarla ilgili herhangi bir veri mevcut değildir (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Popülasyon farmakokinetik analizleri ve karaciğer fonksiyonu normal olan veya hafif, orta veya şiddetli bilirubin ve/veya AST yükselmeleri (Ulusal Kanser Enstitüsü [NCI] sınıflandırmasına göre) olan hastalarda yapılan bir klinik farmakoloji çalışmasından elde edilen veriler, karaciğer fonksiyonunun MEKİNİST'in oral klirensini anlamlı oranda etkilemediğini göstermektedir.
Pediyatrik popülasyon:
Pediyatrik hastalarda MEKİNİST'in farmakokinetiğini incelemek için herhangi bir çalışma gerçekleştirilmemiştir.
Geriyatrik popülasyon:
Popülasyon farmakokinetik analizine göre (19 ila 92 yaş aralığı), yaşın MEKİNİST farmakokinetiği üzerinde anlamlı bir klinik etkisi yoktur. ≥75 yaş hastalarda güvenlilik verileri sınırlıdır (bkz. Bölüm 4.8).
Irk:
Klinik deneyim beyaz ırkla sınırlı olduğundan, ırkın MEKİNİST farmakokinetiği üzerindeki potansiyel etkisini değerlendirmek için yeterli veri mevcut değildir.
Cinsiyet/kilo:
Popülasyon farmakokinetiği analizi temelinde, cinsiyet ve vücut ağırlığının MEKİNİST oral klirensini etkilediği bulunmuştur. Daha ufak kadın gönüllülerin daha ağır erkek gönüllülerden daha yüksek maruziyetlere sahip olacağı öngörülse de, bu farkların klinik ilişkiye sahip olması olası değildir ve dozaj ayarlanması gerekmemektedir.
Tıbbi ürün etkileşimleri
MEKİNİST'in ilaç metabolize edici enzimler ve transporterler üzerindeki etkileri: In vitro ve in vivo veriler, MEKİNİST'in diğer tıbbi ürünlerin farmakokinetiğini etkileme olasılığının bulunmadığını göstermektedir. In vitro çalışmalara göre, MEKİNİST, CYP1A2, CYP2A6, CYP2B6, CYP2D6 ve CYP3A4 enzimlerinin inhibitörü değildir. MEKİNİST'in, in vitro koşullarda CYP2C8, CYP2C9 ve CYP2C19 inhibitörü, CYP3A4 indükleyicisi ve OAT1, OAT3, OCT2, MATE1, OATP1B1, OATP1B3, P-gp ve BCRP transporterlerinin inhibitörü olduğu bulunmuştur. Diğer yandan, inhibisyon veya indüksiyon değerlerinin in vitro potensine oranla düşük klinik sistemik maruziyet ve düşük doza dayanılarak, MEKİNİST'in in vivo koşullarda bu enzim ya da transporterlerinhibitörü ya da indükleyicisi olduğu düşünülmemektedir ancak bağırsakta BCRP substratlarının geçici inhibisyonu söz konusu olabilir (bkz. Bölüm 4.5).
Diğer ilaçların MEKİNİST üzerindeki etkisi: In vivo ve in vitro veriler MEKİNİST'in farmakokinetiğinin diğer tıbbi ürünlerden etkilenmesinin olası olmadığını düşündürmektedir. MEKİNİST, CYP enzimlerinin substratı ya da BCRP, OATP1B1, OATP1B3, OATP2B1, OCT1, MRP2, ve MATE1'in trasporterideğildir. MEKİNİST, in vitro ortamda efluks transporteri P-gp ve BSEP'nin substratıdır. MEKİNİST maruziyetinin BSEP inhibisyonundan etkilenmesi olası değilken hepatik P-gp'nin kuvvetli inhibisyonu ile birlikte MEKİNİST düzeylerinde artış olasılık dışı bırakılamamaktadır (bkz. Bölüm 4.5).
MEKİNİST'in diğer tıbbi ürünler üzerindeki etkileri: MEKİNİST'in tekrarlı dozlarının kombine oral kontraseptiflerin, noretindron ve etinil estradiolün kararlı durum farmakokinetiği üzerindeki etkisi, solid tümörleri olan 19 kadın hastayı kapsayan bir klinik çalışmada değerlendirilmiştir. MEKİNİST ile birlikte uygulandığında noretindron maruziyeti %20 artmıştır ve etinil estradiol maruziyeti benzer olmuştur. Bu sonuçlara dayalı olarak, MEKİNİST
monoterapisi ile birlikte uygulandığında hormonal kontraseptiflerde etkililik kaybı beklenmemektedir.
5.3. Klinik öncesi güvenlilik verileri
MEKİNİST ile herhangi bir karsinojenite çalışması gerçekleştirilmemiştir. MEKİNİST, bakterilerdeki revers mutasyonları, memeli hücrelerindeki kromozomal aberasyonları ve sıçanların kemik iliğindeki mikronükleuslarını değerlendiren çalışmalarda genotoksik bulunmamıştır.
MEKİNİST, kadınlarda fertiliteyi bozabilir. Tekrarlanan doz çalışmalarında, EAA bazında insan klinik maruziyeti altındaki maruziyetlerde dişi sıçanlarda kistik foliküllerde artış ve korpus luteumda azalmalar gözlenmiştir.
Buna ek olarak, MEKİNİST verilen jüvenil sıçanlarda, over ağırlıkları azalmış, dişi seksüel maturasyonunun ayırt edici bulgularında hafif gecikmeler (vajinal açıklık ve meme bezi içinde belirgin terminal uç tomurcuklarının insidansında artış) ve uterus yüzey epitelinde hafif hipertrofi gözlenmiştir. Tüm bu etkiler, tedavisiz bir periyodu takiben geri dönüşümlüdür ve farmakolojiye atfedilebilir. Ancak, sıçan ve köpek 13 haftalık bir süreçte gerçekleştirilen toksisite çalışmalarında, erkek üreme dokularında herhangi bir etki görülmemiştir.
Sıçanlar ve tavşanlarda yürütülen embriyo-fötal gelişim toksisitesi çalışmalarında MEKİNİST maternal ve gelişimsel toksisiteyi indüklemiştir. Sıçanlarda EAA bazında klinik maruziyetlerin altındaki veya biraz üzerindeki maruziyetlerde fötal ağırlıkta azalma ve implantasyon sonrası kayıpta artış gözlenmiştir. Tavşanlarda yürütülen embriyo-fötal gelişim toksisitesi çalışmalarında EAA bazında klinik altı maruziyetlerde fötal vücut ağırlığında azalma, abortus artışı, inkomplet ossifikasyon ve iskelet malformasyonu insidansında artış görülmüştür.
Tekrarlanan doz çalışmalarında MEKİNİST maruziyetinden sonra görülen etkiler başlıca deri, gastrointestinal sistem, hematolojik sistem, kemik ve karaciğerdedir. Çoğu bulgu ilaçsız dönem sonrasında geri dönüşümlüdür. Sıçanlarda, ≥ 0,062 mg/kg/gün dozunda (EAA bazında insan klinik maruziyetinin yaklaşık 0,8 katı) 8 hafta sonra hepatoselüler nekroz ve transaminaz düzeylerinde artışlar görülmüştür.
Farelerde, 3 haftaya kadar ≥ 0,25 mg/kg/gün MEKİNİST dozundan (EAA bazında insan klinik maruziyetinin yaklaşık 3 katı) 3 hafta sonra kardiyak histopatoloji olmadan düşük kalp hızı, kalp ağırlığı ve sol ventrikül fonksiyonu gözlemlenmiştir. Yetişkin sıçanlarda, çoklu organ mineralizasyonu, insan klinik maruziyetine benzer maruziyetlerde serum fosfor artışı ile ilişkilendirilmiş ve kalp, karaciğer böbrekte nekroz ve akciğerde hemoraji ile yakından ilişkili bulunmuştur. Sıçanlarda epifizyal plak hipertrofisi ve kemik döngüsü artışı gözlenmiş olmakla birlikte epifizyal plak hipertrofisinin yetişkin insanlar için klinik ilişkisi beklenmemektedir. Klinik maruziyet düzeylerinde veya bu düzeylerin altında MEKİNİST verilen sıçanlar ve köpeklerde immün fonksiyonu bozma potansiyeline sahip olan kemik iliği nekrozu, timus ve GALT'ta lenfoid atrofi ve lenf nodları, dalak ve timusta lenfoid nekroz gözlenmiştir. Jüvenil sıçanlarda 0,35 mg/kg/gün dozunda (EAA bazında erişkin insan klinik maruziyetinin yaklaşık 2 katı) kalp ağırlığında histopatoloji olmaksızın artış gözlenmiştir.
MEKİNİST, in vitro bir fare fibroblast 3T3 nötral kırmızısı alım testinde(NRU) klinik maruziyetten belirgin olarak yüksek konsantrasyonlarda (Cbazında klinik maruziyetin ≥ 130 katı, IC2,92 mcg/mL'de) fototoksik olmuştur. Bu durum MEKİNİST alan hastalarda fototoksisite riskinin düşük olduğunu göstermektedir.
Dabrafenib ile kombinasyon
Köpeklerle yürütülen, MEKİNİST ve dabrafenibin 4 hafta süreyle kombinasyon halinde verildiği bir çalışmada, tek başına MEKİNİST verilen köpeklere kıyasla gastrointestinal toksisite ve timus lenfoit selülaritesinde azalma bulguları daha düşük maruziyette gözlenmiştir. Bunun dışında, benzer monoterapi çalışmalarındakiler ile benzer toksisiteler gözlenmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mannitol Mikrokristallin sellüloz Hipromelloz (E464) Kroskarmelloz sodyum Sodyum lauril sülfat Kolloidal silikon dioksid Magnezyum stearat Titanyum dioksit (E171) Polietilen glikol 400 Sarı demir oksit (E172)
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
Açılmamış şişe: 24 ay
Açılan şişe: 30 gün (30 ºC'nin altındaki oda sıcaklığında)
6.4. Saklamaya yönelik özel tedbirler
MEKİNİST'i 2º ila 8º C da buzdolabında muhafaza ediniz. Işıktan ve nemden korumak için orijinal ambalajında saklayınız. Şişeyi sıkıca kapalı tutunuz.
Nem çekici içermektedir, çıkarmayınız ya da yutmayınız.
Şişe açıldıktan sonra 30 ºC'nin altındaki oda sıcaklığında saklanmalı ve 30 gün içinde kullanılmalıdır.
6.5. Ambalajın niteliği ve içeriği
Çocuk emniyetli polipropilen kapaklı yüksek yoğunluklu polietilen (HDPE) şişe. Bu ürün, bir nem çekici ile ambalajlanmaktadır.
Ambalaj boyutları: 7 ya da 30 tablet
Tüm ambalaj boyutları satışa sunulmayabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmelikâlerine uygun olarak imha edilmelidir.
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A16057 |
| Satış Fiyatı | 22681.82 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 22681.82 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504092202 |
| Etkin Madde | Trametinib |
| İthal ( ref. ülke : Avusturya ) ve Beşeri bir ilaçdır. |