MEKINIST 0.5 mg film kaplı tablet (30 tablet) Farmakolojik Özellikler
{ Trametinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, protein kinaz inhibitörü, mitojenle aktive edilen protein kinaz inhibitörleri
ATC kodu: L01EE01
Etki mekanizması:
MEKİNİST mitojen tarafından aktive edilen ekstrasellüler sinyalle regüle edilen kinaz 1 (MEK1) ve MEK2 aktivasyonunun ve kinaz aktivitesinin reversibl, oldukça seçici, allosterik inhibitörüdür. MEK proteinleri, ekstrasellüler sinyalle-ilişkili kinaz (ERK) yolağının bileşenleridir. Melanom ve diğer kanserlerde, bu yolak genellikle MEK'i aktive eden BRAF'ın mutasyona uğramış formları tarafından aktive edilmektedir. MEKİNİST, BRAF tarafından MEK aktivasyonunu ve MEK kinaz aktivitesini inhibe eder. MEKİNİST, BRAF V600 mutant melanom hücre dizilerinin büyümesini inhibe eder ve BRAF V600 mutant melanom hayvan modellerinde anti-tümör etki gösterir.
Dabrafenib ile kombinasyon:
Dabrafenib, RAF kinazlarının bir inhibitörüdür. BRAF'ın onkojenik mutasyonları, RAS/RAF/MEK/ERK yolağının yapısal aktivasyonuna yol açar. Bu şekilde, MEKİNİST ve dabrafenib bu yolakta MEK ve RAF olmak üzere iki kinazı inhibe eder ve dolayısıyla kombinasyon, yolakta eş zamanlı inhibisyon sağlar. MEKİNİST'in dabrafenib ile kombinasyonu, in vitro koşullarda BRAF V600 mutasyonu pozitif melanom hücre dizilerinde anti-tümör aktivite göstermiştir ve in vivo koşullarda BRAF V600 mutasyonu pozitif melanom ksenograftlarında direnç gelişimini geciktirmiştir.
BRAF mutasyon durumununbelirlenmesi:
Dabrefinib ile kombinasyon halinde MEKİNİST almadan önce, hastaların valide edilmiş bir testle doğrulanmış olan BRAF V600 mutasyonu pozitif tümör durumuna sahip olması gerekmektedir.
Klinik çalışmalarda, BRAF mutasyon tayini kullanarak BRAF V600 mutasyonu için merkezi test, mevcut olan en yeni tümör örneği ile gerçekleştirilmiştir. Primer tümör ya da metastaz bölgesinden alınan tümör, Response Genetics Inc. tarafından geliştirilen valide edilmiş bir polimeraz zincir reaksiyonu (PCR) testi ile test edilmiştir. Test, özellikle V600E ve V600K mutasyonları arasında ayırım yapmak için tasarlanmıştır. Çalışmaya yalnızca BRAF V600E ya da V600K mutasyonu pozitif tümörleri olan hastalar katılmıştır.
Daha sonra, tüm hasta numuneleri CE uygunluk işareti olan valide edilmiş bioMerieux (bMx) THxID BRAF tayini ile tekrar test edilmiştir. bMx THxID BRAF tayini, FFPE tümör dokusundan ekstrakte edilen DNA üzerinde gerçekleştirilen allele özgü bir PCR'dir. Test, BRAF V600E ve V600K mutasyonlarını yüksek hassasiyetle tespit etmek üzere tasarlanmıştır (FFPE tümör dokusundan ekstrakte edilen DNA kullanarak arka planda yabanıl tip dizilere karşı
%5 V600E ve V600K dizisine kadar). Retrospektif iki yönlü Sanger dizi tespit analizi ile gerçekleştirilen klinik ve klinik dışı çalışmalar, testin aynı zamanda daha az yaygın olan BRAF V600D mutasyonunu ve V600E/K601E mutasyonunu daha düşük hassasiyetle tespit ettiğini göstermiştir. THxID BRAF testi ile mutasyon için pozitif sonuç veren ve daha sonra referans yöntemle dizi tespiti gerçekleştirilen klinik dışı ve klinik çalışmalardaki numunelerde (n = 876), testin özgünlüğü %94 bulunmuştur.
Farmakodinamik etkiler:
MEKİNİST, BRAF mutant melanom tümör hücre dizisinde ve melanom ksenograft modellerinde fosforlanmış ERK düzeylerini baskılar.
BRAF ve NRAS mutasyonu pozitif melanomlu hastalarda, MEKİNİST uygulaması, fosforlanmış ERK'nın inhibisyonu, Ki67'nin inhibisyonu (hücre proliferasyon markerı) ve p27'de (bir apoptoz markerı) artışlar dahil olmak üzere tümör biyomarkerlarında doza bağlı değişikliklere neden olmuştur. Günde bir kez 2 mg dozun tekrarlı uygulamasını takiben gözlenen ortalama MEKİNİST konsantrasyonları, 24-saatlik dozlama aralığında klinik öncesi hedef konsantrasyonu geçmekte ve bu şekilde, MEK yolağının sürekli inhibisyonunu sağlamaktadır.
Klinik etkililik ve güvenlilik
Rezeke edilemeyen veya metastatik melanom
Klinik çalışmalarda sadece kutanöz melanomu olan hastalarla çalışılmıştır. Oküler veya mukozal melanomu olan hastalarda etkililik değerlendirilmemiştir.
Dabrafenib ile kombinasyon halinde MEKİNİST:
Önceden tedavi görmemiş hastalar
BRAF V600 mutasyonlu rezeke edilemeyen veya metastatik melanomlu yetişkin hastaların tedavisinde dabrafenib (günde iki kez 150 mg) ile kombinasyon halinde MEKİNİST (günde bir kez 2 mg) için önerilen dozun etkililiği ve güvenliliği iki Faz III ve bir destekleyici Faz I/II çalışmada çalışılmıştır.
MEK115306 (COMBI-d)
MEK115306 (COMBI-d) rezeke edilemeyen (derece IIIC) veya metastatik (derece IV) BRAF V600E/K mutasyonu pozitif kutanöz melanomu olan gönüllüler için birinci basamak tedavi olarak MEKİNİST ve dabrafenibkombinasyonunundabrafenib ve plasebo ile karşılaştırıldığı
bir Faz III, randomize, çift kör çalışmadır. Çalışmanın birincil sonlanım noktası araştırıcı tarafından değerlendirilen progresyonsuz sağkalım (PFS) ve kritik ikincil sonlanım noktası genel sağkalım (OS) olmuştur. Gönüllüler laktat dehidrogenaz (LDH) düzeyi (ï‚£ normalin üst sınırına (ULN) karşı >ULN) ve BRAF mutasyonuna (V600K'ya karşı V600E) göre sınıflandırılmıştır.
Toplam 423 gönüllü kombinasyon tedavisi (N=211) ya da dabrafenib (N=212) almak üzere 1:1 oranında randomize edilmiştir. Hastaların çoğu beyaz ırktan (>%99) ve erkek (%53) olup medyan yaş 56'dır (%28'i ≥65 yaşındadır). Hastaların büyük çoğunluğu Evre IV M1c hastalığa (%67) sahiptir. Çoğu hastada başlangıçta LDH ï‚£ ULN (%65), ECOG performans skoru 0'dır (%72) ve bir visseral hastalık vardır (%73). Hastaların büyük çoğunluğunda BRAF V600E mutasyonu söz konusudur (%85). Beyin metastazları olan gönüllüler çalışmaya dahil edilmemiştir.
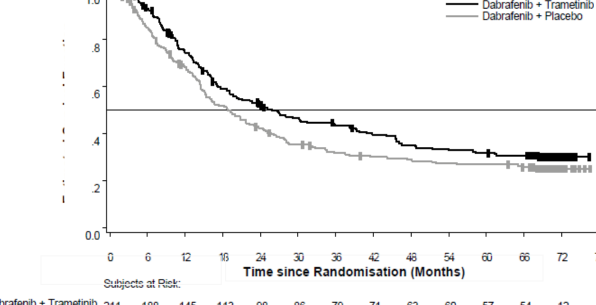
Medyan OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık, 4 yıllık ve 5 yıllık sağkalım oranları Tablo 4'te sunulmaktadır. 5 yılda gerçekleştirilen bir OS analizinde, kombinasyon kolu için ortalama OS, dabrafenib monoterapisine göre yaklaşık 7 ay daha uzun olmuş (25,8 aya karşı 18,7 ay), 5 yıllık sağkalım oranları dabrafenib monoterapisi için %27'ye karşılık kombinasyon için %32 bulunmuştur (Tablo 4, Şekil 1). Kaplan-Meier OS eğrisinin 3 ila 5 yıl arasında stabilize olduğu görülmektedir (bkz. Şekil 1). 5 yıllık OS oranı, tedavi başlangıç LDH düzeyleri normal olan hastalar için kombinasyon kolunda %40 (%95 GA: 31,2; 48,4) iken, dabrafenib monoterapi
kolunda %33 (%95 GA: 25,0; 41) olmuştur. Başlangıcında LDH düzeyleri yüksek olan hastalar için ise dabrafenib monoterapi kolunda %14'e (%95 GA: 6,8; 23,1) karşı kombinasyon kolunda
%16 (%95 GA: 8,4; 26) bulunmuştur.
Tablo 4 Çalışma MEK115306 (COMBI-d) için OS sonuçları
OS analizi (veri kesme tarihi: 12 Ocak 2015) | 5 yıllık OS analizi (veri kesme tarihi: 10 Aralık 2018) | |||
| Dabrafenib + MEKİNİST (n=211) | Dabrafenib + Plasebo (n=212) | Dabrafenib + MEKİNİST (n=211) | Dabrafenib+ Plasebo (n=212) |
Hasta sayısı |
|
|
|
|
Ölen (olay), n (%) | 99 (47) | 123 (58) | 135 (64) | 151 (71) |
OS tahminleri (ay) | ||||
Medyan (%95 GA) | 25,1 (19,2; NR) | 18.7 (15,2; 23,7) | 25,8 (19,2; 38,2) | 18,7 (15,2; 23,1) |
Tehlike oranı (%95 GA) | 0,71 (0,55; 0,92) | 0,8 (0,63; 1,01) | ||
p değeri | 0,011 | NA |
| |
Genel sağkalım tahmini, % (%95 GA) | Dabrafenib + MEKİNİST (n=211) | Dabrafenib + Plasebo (n=212) | ||
1 yılda | 74 (66,8; 79) | 68 (60,8; 73,5) | ||
2 yılda | 52 (44,7; 58,6) | 42 (35,4; 48,9) | ||
3 yılda | 43 (36,2; 50,1) | 31 (25,1; 37,9) | ||
4 yılda | 35 (28,2; 41,8) | 29 (22,7; 35,2) | ||
5 yılda | 32 (25,1; 38,3) | 27 (20,7; 33) | ||
NR = Ulaşılmadı, NA = Geçerlideğil |
| |||
Randomizasyondan İtibaren Geçen Süre (Ay)
Risk altındaki gönüllüler:
Tahmini Sağkalım Fonksiyonu
Şekil 1 Çalışma MEK115306 için Kaplan-Meier OS Eğrileri (ITT Popülasyonu)
Birincil sonlanım noktası PFS'de iyileşmeler, dabrafenib monoterapisine kıyasla, kombinasyon kolunda 5 yıllık bir zaman dilimi içinde sürdürülmüştür. Genel yanıt oranı (ORR) için de iyileşmeler gözlenmiştir ve kombinasyon kolunda dabrafenib monoterapisine kıyasla daha uzun bir yanıt süresi (DoR) izlenmiştir (Tablo 5).
Tablo 5 MEK115306 (COMBI-d) çalışmasının etkililik sonuçları
| Birincil analiz (veri kesme tarihi: 26 Ağustos 2013) | Güncellenmiş analiz (veri kesme tarihi: 12 Ocak 2015) | 5 yıllık analiz (veri kesme tarihi: 10 Aralık 2018) | |||
Sonlanımnoktası | Dabrafenib + | Dabrafenib + | Dabrafenib + | Dabrafenib + | Dabrafenib + | Dabrafenib + |
MEKİNİST | (Plasebo (n=212) | MEKİNİST | Plasebo (n=212) | MEKİNİST | Plasebo (n=212) | |
(n=211) |
| (n=211) |
| (n=211) |
| |
PFS |
|
| ||||
Progresif hastalık veya ölüm, n (%) | 102 (48) | 109 (51) | 139 (66) | 162 (76) | 160 (76) | 166 (78) |
Medyan PFS (ay) | 9,3 | 8,8 | 11 | 8,8 | 10,2
(8,1; 12,8) | 8,8
(5,9; 9,3) |
(%95 GA) |
(7,7; 11,1) |
(5,9; 10,9) |
(8; 13,9) |
(5,9; 9,3) | ||
Tehlike oranı | 0,75 | 0,67 | 0,73 (0,59; 0,91) | |||
(%95 GA) | (0,57; 0,99) | (0,53; 0,84) | ||||
P değeri | 0,035 | <0,001 | NA | |||
ORR | 67 | 51 | 69 | 53 | 69 | 54 |
% (%95 GA) | (59,9; 73) | (44,5; 58,4) | (61,8; 74,8) | (46,3; 60,2) | (62,5; 75,4) | (46,8; 60,6) |
ORR farkı | 15 (5,9; 24,5) | 15 | NA | |||
(%95 GA) | (6; 24,5) | |||||
P değeri | 0,0015 | 0,0014 | NA | |||
DoR (ay) |
|
|
|
|
|
|
Medyan | 9,2 | 10,2 | 12,9 | 10,6 | 12,9 | 10,2 |
(%95 GA) | (7,4; NR) | (7,5; NR) | (9,4; 19,5) | (9,1; 13,8) | (9,3; 18,4) | (8,3; 13,8) |
a – Progresyonsuz Sağkalım (araştırıcı tarafından değerlendirilen)
b - Genel Yanıt Oranı = Tam Yanıt + Kısmi Yanıt
c - Yanıt Süresi
d - Bildirim zamanında araştırıcı tarafından değerlendirilen yanıtların çoğu (>%59) halen devam etmektedir
e - Yuvarlanmamış ORR bulgusu temelinde hesaplanmış ORR farkı
f - Güncellenmiş analiz önceden planlı değildir ve p değeri çoklu test için düzeltilmemiştir. NR = Ulaşılmamıştır
NA = Geçerli değildir
MEK116513 (COMBI-v)
MEK116513 çalışması, BRAF mutasyonu pozitif rezeke edilemeyen veya metastatik melanomda MEKİNİST ve dabrafenib kombinasyon tedavisini vemurafenib monoterapisi ile karşılaştıran 2 kollu, randomize, açık etiketli bir Faz III çalışmadır. Çalışmanın birincil sonlanım noktası OS olup kritik ikincil sonlanma noktası PFS'dir. Gönüllüler laktat dehidrogenaz (LDH) düzeyi (ï‚£ULN'ye karşı >ULN) ve BRAF mutasyonuna (V600K'ya karşı V600E) göre sınıflandırılmıştır.
Toplam 704 gönüllü kombinasyon ya da vemurafenib almak üzere 1:1 oranında randomize edilmiştir. Hastaların çoğu beyaz ırktan (>%96) ve erkek (%55) olup medyan yaş 55'tir (%24'ü
≥65 yaşındadır). Hastaların büyük çoğunluğu evre IV M1c hastalığa (%61 genel) sahiptir. Çoğu hastada başlangıçta LDH ï‚£ ULN (%67), ECOG performans skoru 0'dır (%70) ve bir visseral hastalık vardır (%78). Genel olarak gönüllülerin %54'ünde çalışma başlangıcında < 3 hastalık bölgesi vardır. Hastaların büyük çoğunlunda BRAF V600E mutasyonu söz konusudur (%89). Beyin metastazları olan gönüllüler çalışmaya dahil edilmemiştir.
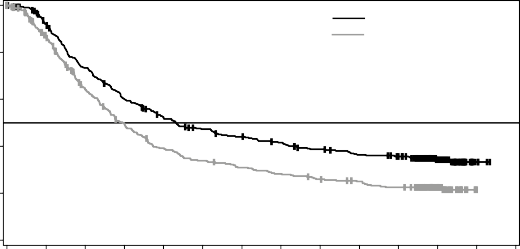
Medyan OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık, 4 yıllık ve 5 yıllık sağkalım oranları Tablo 6'da sunulmaktadır. 5 yılda gerçekleştirilen bir OS analizinde, kombinasyon kolu için ortalama OS, vemurafenib monoterapisine göre yaklaşık 8 ay daha uzun olmuş (26 aya karşı 17,8 ay), 5 yıllık sağkalım oranları vemurafenib monoterapisi için %23'e karşılık kombinasyon için %36 bulunmuştur (Tablo 6, Şekil 2). Kaplan-Meier OS eğrisinin 3 ila 5 yıl arasında stabilize olduğu görülmektedir (bkz. Şekil 2). 5 yıllık OS oranı, tedavi başlangıcında LDH düzeyleri normal olan hastalar için kombinasyon kolunda %46 (%95 GA: 38,8; 52) iken, vemurafenib monoterapi
kolunda %28 (%95 GA: 22,5; 34,6) olmuştur. Başlangıç LDH düzeyleri yüksek olan hastalar için ise vemurafenib monoterapi kolunda %10'a (%95 GA: 5,1; 17,4) karşı kombinasyon kolunda %16 (%95 GA: 9,3; 23,3) bulunmuştur.
Tablo 6 Çalışma MEK116513 (COMBI-v) için OS sonuçları
OS analizi (veri kesme tarihi: 13 Mart 2015) | 5 yıllık OS analizi (veri kesme tarihi: 08 Ekim 2018) | |||
| Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) |
Hasta sayısı |
|
|
|
|
Ölen (olay), n (%) | 155 (44) | 194 (55) | 216 (61) | 246 (70) |
OS tahminleri (ay | ) |
|
|
|
Medyan (%95 GA) | 25,6 (22,6; NR) | 18 (15,6; 20,7) | 26 (22,1; 33,8) | 17,8 (15,6; 20,7) |
Düzeltilmiş tehlike oranı (%95 GA) | 0,66 (0,53; 0,81) | 0,70 (0,58; 0,84) | ||
p değeri | <0,001 |
| NA |
|
Genel sağkalım tahmini, % (%95 GA) | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) | ||
1 yılda | 72 (67; 77) | 65 (59; 70) | ||
2 yılda | 53 (47,1; 57,8) | 39 (33,8; 44,5) | ||
3 yılda | 44 (38,8; 49,4) | 31 (25,9; 36,2) | ||
4 yılda | 39 (33,4; 44) | 26 (21,3; 31) | ||
5 yılda | 36 (30,5; 40,9) | 23 (18,1; 27,4) | ||
NR = Ulaşılmamıştır, NA = Geçerli değildir |
| |||
Şekil 2 MEK116513 çalışması için güncel OS analizinin Kaplan-Meier eğrileri
Tahmini Sağkalım Fonksiyonu
Randomizasyondan itibaren geçen süre (ay)
İkincil sonlanım noktası PFS'de sağlanan iyileşmeler, vemurafenib monoterapisine kıyasla, kombinasyon kolunda 5 yıllıkbirzamandilimiiçindesürdürülmüştür. ORR için de iyileşmeler
gözlenmiştir ve kombinasyon kolunda vemurafenib monoterapisine kıyasla daha uzun bir DoR izlenmiştir (Tablo 7).
Tablo 7 MEK116513 (COMBI-v) çalışması için etkililik sonuçları
| Birincil analiz (Veri kesme tarihi: 17 Nisan 2014) | 5 yıllık analiz (Veri kesme tarihi: 08 Ekim 2018) | ||
Sonlanım noktası | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) | Dabrafenib + MEKİNİST (n=352) | Vemurafenib (n=352) |
PFS |
|
| ||
Progresif hastalık veya ölüm, n (%) | 166 (47) | 217 (62) | 257 (73) | 259 (74) |
Medyan PFS (ay) (%95 GA) | 11,4 (9,9; 14,9) | 7,3 (5,8; 7,8) | 12,1 (9,7; 14,7) | 7,3 (6; 8,1) |
Tehlike oranı (%95 GA) | 0,56 (0,46; 0,69) | 0,62 (0,52; 0,74) | ||
P değeri | <0,001 | NA | ||
ORR % (%95 GA) | 64 (59,1; 69,4) | 51 (46,1; 56,8) | 67 (62,2; 72,2) | 53 (47,2; 57,9) |
ORR farkı (%95 GA) | 13 (5,7; 20,2) | NA | ||
P değeri | 0,0005 | NA | ||
DoR (Ay) Medyan (%95 GA) |
13,8 (11; NR) |
7,5 (7,3; 9,3) |
13,8 (11,3; 18,6) |
8,5 (7,4; 9,3) |
a – Progresyonsuz sağkalım (araştırmacı tarafından değerlendirilen) b – Genel Yanıt Oranı = Tam Yanıt + Kısmi Yanıt c – Yanıt süresi d – Raporlama sırasında, araştırmacı tarafından değerlendirilen yanıtların çoğunluğu (dabrafenib+MEKİNİST %59 ve vemurafenib %42) halen devam etmektedir. NR = Ulaşılmamıştır NA = Geçerli değildir | ||||
Önceki BRAF inhibitör tedavisi:
Önceki BRAF inhibitör tedavisinde progrese olmuş hastalarda MEKİNİST+dabrafenib kombinasyonu ile sınırlı veri mevcuttur.
BRF113220 çalışması Bölüm B, bir BRAF inhibitör tedavisinde progrese olmuş 26 hastadan oluşan bir grubu içermiştir. MEKİNİST 2 mg QD ve dabrafenib 150 mg BID kombinasyonu, bir BRAF inhibitörü tedavisinde progrese olan hastalarda sınırlı klinik aktivite göstermiştir (bkz. Bölüm 4.4). Araştırmacı tarafından değerlendirilen doğrulanmış yanıt oranı %15 (%95 GA: 4,4;
34,9) ve medyan PFS 3,6 ay (%95 GA: 1,9; 5,2) bulunmuştur. Bu çalışmanın C bölümünde dabrafenib monoterapisinden MEKİNİST 2 mg QD+dabrafenib 150 mg BID kombinasyonuna geçiş yapan 45 hastada da benzer sonuçlar görülmüştür. Bu hastalarda 3,6 ay (%95 GA: 2; 4) medyan PFS ile %13'lük (%95 GA: 5; 27) bir doğrulanmış yanıt oranı gözlenmiştir.
Beyin metastazları olan hastalar:
Beyne metastaz yapmış BRAF V600 mutant-pozitif melanomu olan hastalarda dabrafenib ile kombinasyon halinde MEKİNİST'in etkililik ve güvenliliği, randomize olmayan, açık etiketli, çok merkezli bir Faz II çalışmada (COMBI-MB çalışması) incelenmiştir. Toplam 125 hasta dört kohorta kaydedilmiştir:
Kohort A: Daha önce beyin hedefli lokal tedavinin yapılmadığı, asemptomatik beyin metastazları ile birlikte BRAFV600E mutant melanomun olduğu, ECOG performans skoru 0 ya da 1 olan hastalar.
5.2. Farmakokinetik özellikler
Emilim:
MEKİNİST oral yolla emilmekte olup, doruk konsantrasyonlara erişmek için geçen medyan süre dozlamadan sonra 1,5 saattir. Tekli 2 mg tablet dozunun ortalama mutlak bioyararlanımı, intravenöz (IV) mikrodoza kıyasla %72'dir. Maruziyette artış (Cve EAA), tekrarlı dozları
takiben dozla orantısal olmuştur. Günlük 2 mg dozunun uygulanmasını takiben, kararlı durum geometrik ortalama C, EAAve doz öncesi konsantrasyon, düşük dip-tepe noktası oranı ile (1,8) sırasıyla 22,2 ng/mL, 370 ng*s/mL ve 12,1 ng/mL olmuştur. Bireyler arası değişkenlik düşük bulunmuştur (< %28).
MEKİNİST 2 mg günde bir kez dozda ortalama birikim oranı 6 olacak şekilde tekrarlanan günlük doz uygulaması ile birikir. Kararlı durum 15. gün itibariyle elde edilmiştir.
Tek doz MEKİNİST'in yüksek yağ içerikli, yüksek kalorili bir öğünle birlikte uygulanması, açlık koşullarına kıyasla Cve EAA parametrelerinde sırasıyla %70 ve %10 düşüşle sonuçlanmıştır (bkz. Bölüm 4.2 ve 4.5).
Dağılım:
MEKİNİST, insan plazma proteinlerine % 97,4 oranında bağlanır. MEKİNİST'in dağılım hacmi, 5 mcg IV mikrodoz uygulamasından sonra belirlendiği şekilde 1200 L'dir.
Biyotranformasyon:
In vitro ve in vivo çalışmalar, MEKİNİST'in daha çok tek başına deasetilasyon ya da mono- oksijenasyon ile kombinasyon halinde metabolize olduğunu göstermiştir. Deasetilemetaboliti ek olarak glukuronidasyon ile metabolize olmuştur. CYP3A4 oksidasyonunun minör bir metabolizma yolağı olduğu kabul edilir. Deasetilasyona, diğer hidrolitik enzimlerin olası katkıları ile karboksil-esteraz 1b, 1c ve 2 aracılık eder.
Bununla birlikte, MEKİNİST'in tek yada tekrarlı dozunda MEKİNİST plazmada dolaşan ana maddedir.
Eliminasyon:
Ortalama terminal yarı ömür, tek doz uygulamadan sonra 127 saattir (5,3 gün). MEKİNİST plazma IV klirensi, 3,21 L/saattir.
Uzun eliminasyon yarı ömründen dolayı, çözelti şeklinde radyolojik olarak işaretlenmiş MEKİNİST'in tekli oral dozunun uygulanmasını takiben 10 günlük bir toplama periyodundan sonra toplam doz geri kazanımı düşüktür (< %50). İlaca bağlı madde çoğunlukla feçesle atılmıştır (atılan radyoaktivite >%80'i) ve düşük miktarda idrar ile atılmıştır (≤%19). Atılan dozun %0,1'inden azı idrarda ana ilaç olarak geri kazanılmıştır.
Doğrusallık/ doğrusal olmayan durum:
Veri mevcut değildir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
MEKİNİST'in düşük renal atılımı göz önüne alındığında böbrek yetmezliğinin MEKİNİST farmakokinetiğinde klinik açıdan anlamlı bir etkisinin olması olası değildir. MEKİNİST'in farmakokinetiği, MEKİNİST ile yapılan klinik çalışmalarda yer alan ve hafif düzeyde böbrek yetmezliği görülen 223 hastada ve orta düzeyde böbrek yetmezliği görülen 35 hastada bir popülasyon farmakokinetik analizi kullanılarak karakterize edilmiştir. Hafif ve orta düzeyde böbrek yetmezliği, MEKİNİST maruziyeti üzerinde herhangi bir etki oluşturmamıştır (her bir grup için <%6). Şiddetli böbrek yetmezliği olan hastalarla ilgili herhangi bir veri mevcut değildir (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Popülasyon farmakokinetik analizleri ve karaciğer fonksiyonu normal olan veya hafif, orta veya şiddetli bilirubin ve/veya AST yükselmeleri (Ulusal Kanser Enstitüsü [NCI] sınıflandırmasına göre) olan hastalarda yapılan bir klinik farmakoloji çalışmasından elde edilen veriler, karaciğer fonksiyonunun MEKİNİST'in oral klirensini anlamlı oranda etkilemediğini göstermektedir.
Pediyatrik popülasyon:
Pediyatrik hastalarda MEKİNİST'in farmakokinetiğini incelemek için herhangi bir çalışma gerçekleştirilmemiştir.
Geriyatrik popülasyon:
Popülasyon farmakokinetik analizine göre (19 ila 92 yaş aralığı), yaşın MEKİNİST farmakokinetiği üzerinde anlamlı bir klinik etkisi yoktur. ≥75 yaş hastalarda güvenlilik verileri sınırlıdır (bkz. Bölüm 4.8).
Irk:
Klinik deneyim beyaz ırkla sınırlı olduğundan, ırkın MEKİNİST farmakokinetiği üzerindeki potansiyel etkisini değerlendirmek için yeterli veri mevcut değildir.
Cinsiyet/kilo:
Popülasyon farmakokinetiği analizi temelinde, cinsiyet ve vücut ağırlığının MEKİNİST oral klirensini etkilediği bulunmuştur. Daha ufak kadın gönüllülerin daha ağır erkek gönüllülerden daha yüksek maruziyetlere sahip olacağı öngörülse de, bu farkların klinik ilişkiye sahip olması olası değildir ve dozaj ayarlanması gerekmemektedir.
Tıbbi ürün etkileşimleri
MEKİNİST'in ilaç metabolize edici enzimler ve transporterler üzerindeki etkileri: In vitro ve in vivo veriler, MEKİNİST'in diğer tıbbi ürünlerin farmakokinetiğini etkileme olasılığının bulunmadığını göstermektedir. In vitro çalışmalara göre, MEKİNİST, CYP1A2, CYP2A6, CYP2B6, CYP2D6 ve CYP3A4 enzimlerinin inhibitörü değildir. MEKİNİST'in, in vitro koşullarda CYP2C8, CYP2C9 ve CYP2C19 inhibitörü, CYP3A4 indükleyicisi ve OAT1, OAT3, OCT2, MATE1, OATP1B1, OATP1B3, P-gp ve BCRP transporterlerinin inhibitörü olduğu bulunmuştur. Diğer yandan, inhibisyon veya indüksiyon değerlerinin in vitro potensine oranla düşük klinik sistemik maruziyet ve düşük doza dayanılarak, MEKİNİST'in in vivo koşullarda bu enzim ya da transporterlerinhibitörü ya da indükleyicisi olduğu düşünülmemektedir ancak bağırsakta BCRP substratlarının geçici inhibisyonu söz konusu olabilir (bkz. Bölüm 4.5).
Diğer ilaçların MEKİNİST üzerindeki etkisi: In vivo ve in vitro veriler MEKİNİST'in farmakokinetiğinin diğer tıbbi ürünlerden etkilenmesinin olası olmadığını düşündürmektedir. MEKİNİST, CYP enzimlerinin substratı ya da BCRP, OATP1B1, OATP1B3, OATP2B1, OCT1, MRP2, ve MATE1'in trasporterideğildir. MEKİNİST, in vitro ortamda efluks transporteri P-gp ve BSEP'nin substratıdır. MEKİNİST maruziyetinin BSEP inhibisyonundan etkilenmesi olası değilken hepatik P-gp'nin kuvvetli inhibisyonu ile birlikte MEKİNİST düzeylerinde artış olasılık dışı bırakılamamaktadır (bkz. Bölüm 4.5).
MEKİNİST'in diğer tıbbi ürünler üzerindeki etkileri: MEKİNİST'in tekrarlı dozlarının kombine oral kontraseptiflerin, noretindron ve etinil estradiolün kararlı durum farmakokinetiği üzerindeki etkisi, solid tümörleri olan 19 kadın hastayı kapsayan bir klinik çalışmada değerlendirilmiştir. MEKİNİST ile birlikte uygulandığında noretindron maruziyeti %20 artmıştır ve etinil estradiol maruziyeti benzer olmuştur. Bu sonuçlara dayalı olarak, MEKİNİST
monoterapisi ile birlikte uygulandığında hormonal kontraseptiflerde etkililik kaybı beklenmemektedir.
5.3. Klinik öncesi güvenlilik verileri
MEKİNİST ile herhangi bir karsinojenite çalışması gerçekleştirilmemiştir. MEKİNİST, bakterilerdeki revers mutasyonları, memeli hücrelerindeki kromozomal aberasyonları ve sıçanların kemik iliğindeki mikronükleuslarını değerlendiren çalışmalarda genotoksik bulunmamıştır.
MEKİNİST, kadınlarda fertiliteyi bozabilir. Tekrarlanan doz çalışmalarında, EAA bazında insan klinik maruziyeti altındaki maruziyetlerde dişi sıçanlarda kistik foliküllerde artış ve korpus luteumda azalmalar gözlenmiştir.
Buna ek olarak, MEKİNİST verilen jüvenil sıçanlarda, over ağırlıkları azalmış, dişi seksüel maturasyonunun ayırt edici bulgularında hafif gecikmeler (vajinal açıklık ve meme bezi içinde belirgin terminal uç tomurcuklarının insidansında artış) ve uterus yüzey epitelinde hafif hipertrofi gözlenmiştir. Tüm bu etkiler, tedavisiz bir periyodu takiben geri dönüşümlüdür ve farmakolojiye atfedilebilir. Ancak, sıçan ve köpek 13 haftalık bir süreçte gerçekleştirilen toksisite çalışmalarında, erkek üreme dokularında herhangi bir etki görülmemiştir.
Sıçanlar ve tavşanlarda yürütülen embriyo-fötal gelişim toksisitesi çalışmalarında MEKİNİST maternal ve gelişimsel toksisiteyi indüklemiştir. Sıçanlarda EAA bazında klinik maruziyetlerin altındaki veya biraz üzerindeki maruziyetlerde fötal ağırlıkta azalma ve implantasyon sonrası kayıpta artış gözlenmiştir. Tavşanlarda yürütülen embriyo-fötal gelişim toksisitesi çalışmalarında EAA bazında klinik altı maruziyetlerde fötal vücut ağırlığında azalma, abortus artışı, inkomplet ossifikasyon ve iskelet malformasyonu insidansında artış görülmüştür.
Tekrarlanan doz çalışmalarında MEKİNİST maruziyetinden sonra görülen etkiler başlıca deri, gastrointestinal sistem, hematolojik sistem, kemik ve karaciğerdedir. Çoğu bulgu ilaçsız dönem sonrasında geri dönüşümlüdür. Sıçanlarda, ≥ 0,062 mg/kg/gün dozunda (EAA bazında insan klinik maruziyetinin yaklaşık 0,8 katı) 8 hafta sonra hepatoselüler nekroz ve transaminaz düzeylerinde artışlar görülmüştür.
Farelerde, 3 haftaya kadar ≥ 0,25 mg/kg/gün MEKİNİST dozundan (EAA bazında insan klinik maruziyetinin yaklaşık 3 katı) 3 hafta sonra kardiyak histopatoloji olmadan düşük kalp hızı, kalp ağırlığı ve sol ventrikül fonksiyonu gözlemlenmiştir. Yetişkin sıçanlarda, çoklu organ mineralizasyonu, insan klinik maruziyetine benzer maruziyetlerde serum fosfor artışı ile ilişkilendirilmiş ve kalp, karaciğer böbrekte nekroz ve akciğerde hemoraji ile yakından ilişkili bulunmuştur. Sıçanlarda epifizyal plak hipertrofisi ve kemik döngüsü artışı gözlenmiş olmakla birlikte epifizyal plak hipertrofisinin yetişkin insanlar için klinik ilişkisi beklenmemektedir. Klinik maruziyet düzeylerinde veya bu düzeylerin altında MEKİNİST verilen sıçanlar ve köpeklerde immün fonksiyonu bozma potansiyeline sahip olan kemik iliği nekrozu, timus ve GALT'ta lenfoid atrofi ve lenf nodları, dalak ve timusta lenfoid nekroz gözlenmiştir. Jüvenil sıçanlarda 0,35 mg/kg/gün dozunda (EAA bazında erişkin insan klinik maruziyetinin yaklaşık 2 katı) kalp ağırlığında histopatoloji olmaksızın artış gözlenmiştir.
MEKİNİST, in vitro bir fare fibroblast 3T3 nötral kırmızısı alım testinde(NRU) klinik maruziyetten belirgin olarak yüksek konsantrasyonlarda (Cbazında klinik maruziyetin ≥ 130 katı, IC2,92 mcg/mL'de) fototoksik olmuştur. Bu durum MEKİNİST alan hastalarda fototoksisite riskinin düşük olduğunu göstermektedir.
Dabrafenib ile kombinasyon
Köpeklerle yürütülen, MEKİNİST ve dabrafenibin 4 hafta süreyle kombinasyon halinde verildiği bir çalışmada, tek başına MEKİNİST verilen köpeklere kıyasla gastrointestinal toksisite ve timus lenfoit selülaritesinde azalma bulguları daha düşük maruziyette gözlenmiştir. Bunun dışında, benzer monoterapi çalışmalarındakiler ile benzer toksisiteler gözlenmiştir.
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A16057 |
| Satış Fiyatı | 22681.82 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 22681.82 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504092202 |
| Etkin Madde | Trametinib |
| ATC Kodu | L01XE25 |
| Birim Miktar | 0.5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Avusturya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |