MEMORIX 10 mg/G 100 gr oral çözelti Kısa Ürün Bilgisi
{ Memantin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MEMORİX® 0 mg/g oral çözelti2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her bir ml çözelti;
Memanrin HCl (8.31 mg memantine eşdeğer)..........................................10 mg
Her bir ml çözeltide:
Sorbitol (%70) solüsyon Potasyum sorbat..........
.300 mg 1.50 mg
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Oral çözelti
Çözelti şeffaf, renksiz veya beyaz-sanmsı renktedir.
4.1. Terapötik endikasyonlar
4.2. Pozoloji ve uygulama şekli
Pozoloji /uygulama sıklığı ve süresi
Tedavi, Alzheimer hastalığı tanı ve tedavisinde deneyimli bir hekim tarafından başlatılmalı ve kontrol edilmelidir. Tedaviye sadece, hastanın ilaç almasını düzenli olarak izleyecek bir bakıcının varlığında başlanmalıdır. Tam, güncel rehberler doğrultusunda yapılmalıdır. Memantinin tolere edilmesi ve dozlaması, tercihen tedavi başlangıcından sonraki üç ay içinde düzenli aralıklarla değerlendirilmelidir. Sonrasında, memantinin sağladığı klinik yarar ve hastanın tedaviye toleransı güncel klinik rehberler doğrultusunda düzenli olarak değerlendirilmelidir. Terapötik fayda olumlu olduğu ve hasta memantini iyi tolere ettiği sürece, idame tedavisine devam edebilir, Terapötik etkinin artık olmadığına dair bir kanıt varlığında veya hasta tedaviyi tolere etmiyorsa memantinin bırakılması düşünülmelidir.
Yetişkinler:
Doz titrasyonu
önerilen maksimum günlük doz günde 20 mgdır. İstenmeyen etki riskini azaltmak için, idame dozuna ilk üç hafta boyunca, haftada 5 mglik artışlarla şu şekilde ulaşılmalıdır:
1. hafta (gün 1-7):
Hasta 7 gün boyunca, günde 5 mg (0.5 ml çözelti) almalıdır.
2. hafta (gün 8-14):
Hasta 7 gün boyunca, günde 10 mg (1.0 ml çözelti) almalıdır.
3. hafta (gün 15-21):
Hasta 7 gün boyunca günde, 15 mg (1.5 ml çözelti) almalıdır.
4. haftadan itibaren:
Hasta günde, 20 mg (2.0 ml çözelti) almalıdır.
İdame dozu:
Önerilen idame dozu günde 20 mg (2.0 ml çözelti)dir.
Uygulama şekli
MEMORİX® günde bir defa ve her gün aynı saatte alınmalıdır. Yemeklerle veya ayn olarak alınabilir, Çözelti direkt olarak şırıngadan yutulmak ya da önce küçük bir bardak içinde suyla kanştınlmah ve kanşımın tümü içilmelidir.
Ürünün hazırlanması ve kullanımına ilişkin detaylı bilgi için bkz. 6.6.
Özel popülasyonlara ilişkin ek bilgiler
yetmezliği: Hafif şiddette böbrek yetmezliği olan hastalarda (kreatinin klerensi 50-80 ml/dak) doz ayar aması gerekmez. Orta şiddette böbrek yetmezliği olan hastalarda (kreatinin klerensi 30-49 ml/dak) günlük doz 10 mg (1.0 ml çözelti) olmalıdır. Tedavinin en az 7 günü yunca ıyı tolere edilirse, standart titrasyon programı uygulanmak koşuluyla, günlük doz. 20
, yfeyıne ,aı^niabilir- A§ır böbrek yetmezliği olan hastalar (kreatinin klerensi 5-29 ml/dak) için günlük doz 10 mg (1.0 ml çözelti) olmalıdır.
Karaciğer yetmezliği: Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda (Child-Pugh A ve Child-Pugh B) doz ayarlamasına gerek yoktur. Ağır karaciğer yetmezliği olan hastalarda memantın kullanımı hakkında veri bulunmamaktadır. Ağır karaciğer yetmezliği olan hastalarda MEMORIX kullanılması önerilmez.
P®d1,^axtnk popö,asy°n:
Memantinin çocuklar ve adolesanlar üzerindeki güvenlilik etkililiği saptanmamıştır. Bu nedenle 18 yaşından küçük çocuklarda kullanılması önerilmez.
ve
4.3. Kontrendikasyonlar
4.4. Özel kullanım uyarıları ve önlemleri
Epilepsisi, geçmişinde konvülsiyon öyküsü veya epilepsiye eğilimi olan hastalarda dikkatli olunmalıdır.
Amantadın ketamin veya dekstrometorfan gibi NMDA antagonistleri ile birlikte kullanımından kaçınılmalıdır. Bu bileşikler memantin ile aynı reseptör sistemine etki edip advers etkılenn (özellikle santral sinir sistemi ile İlişkili olanlar) daha sık ya da daha kuvvetli
Idrâr
p Hsını yükselten faktörler var ise (bkz. 5.2
"Eliminasyon )
hastanın dikkatli izlenmesi gerekebilir. Bu fakt rler diyetteki köklü değişim (örneğin etoburluktan vejetaryen diyete geçiş ı ^,alkaHzan 1111(16 tamponlarının çok miktarda alınmasını içerir. İdrar pHsı avnca renal -tabu er asidoz (RTA) vty^Proteus^bacteridmn
neden olduğu ciddi üriner sistem enfeksiyonlan ile de yükselebilir.
Birçok klinik çalışmada yakın tarihte geçirilmiş miyokard enfarktüsü, kompanse edilmemiş konjestif kalp yetmezliği (New York Kalp Cemiyeti (NYHA) endeks III-IV) veya kontrol altında olmayan hıpertansıyonlu hastalar çalışma dışı bırakılmıştır. Sonuç olarak, sınırlı veri mevcut olduğundan nu durumdaki hastalar yakın gözlem ıhında bulundurulmalıdır.
MEMORİX® oral çözelti, sorbitol içerir. Nadir kalıtımsal fruktoz ıntolerans problemi olan hastalann bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Memantinin farmakolojik etkileri ve etki mekanizması nedeni ile aşağıdaki etkileşmeler oluşabilir:
Memantinin etki seldi sebebiyle; L-dopa, dopaminerjik agonistler ve antikolineriiklerin etLien, memantın gibi NMDA antagonistleri ile birlikte kullanıldığında artabilir Barbıturatlann ve nöroleptiklerin etkilerini azaltabilir. Memantinin antispazmodik aianlar dantrolen veya baklofen ile birlikte kullanımı; etkilerini modifiye edebilir ve doz ayarlaması gerektirebilir.
V Farmakotoksik psikoz riski nedeni ile memantinin amantadin ile birlikteJaıllanımından
kaçınılmalıdır. Her ıkı madde de NMDA-antagonistidir. Aym yaklaşım ketamin ve
4.4. Özel kullanım uyarıları ve önlemleri
Memamın ve fenıtomm kombine kullanımının olası riskine ilişkin yayınlanmış bir tane vaka raporu bulunmaktadır.
Amantadin ile aynı renal katyonik taşıyıcı sistemini kullanan simetidin, ranitidin, prokamamid, kinidin, kinin ve nikotin de muhtemel olarak memantin ile etkileşip plazma düzeyinde artış riski oluşturabilir.
Memantin, hidroklorotiyazid (HCT) veya HCTli herhangi bir kombinasyon ile birlikte kullanılırsa, HCT serum seviyesinde azalma muhtemeldir.
Pazarlama sonrası deneyimlerde varfarin ile birlikte memantin kullanan hastalarda INR (Uluslararası normalize edilmiş oran) artışı olan izole durumlar rapor edilmiştir. Nedensel bir ilişki kurulmamış olsa da oral antikoagülanlarla birlikte tedavi edilen hastalar için protrombin zamanının veya INRnin yakından izlenmesi tavsiye edilmektedir.
Karbonik anhıdraz inhibitörleri ve sodyum bikarbonat ile kullanımında klerens düşebilir.
Sağlıklı genç gönüllülerde yürütülen tek-doz farmakokinetik çalışmalannda memantin ile glıburid/metformin kombinasyonu veya donezepil arasında anlamlı bir ilaç etkileşimi gözlenmemiştir. - - - - -
Sağlıklı genç gönüllülerde yürütülen bir klinik çalışmada, memantinin galantamin farmakokinetiği üzerinde hiçbir anlamh etkisi gözlenmemiştir.
Memantin; CYP1A2, 2A6, 2C9, 2D6, 2E1, 3A, flavin içeren monoksijenaz, epoksit hidrolaz veya sülfasyonu in vitro
olarak İnhibe etmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi Cdir.
Çocuk doğurma potansiyeli bulunan kadınlar /Doğum kontrolü/Kontrasepsiyon
Memantinin gebelikte kullanımına ilişkin klinik bilgi mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya!
doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. 5.3 Klinik öncesi güvenlilik verileri).
insanlara yönelik potansiyel risk bilinmemektedir.
MEMORIX® gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Gebelik dönemi
İnsanlardaki potansiyel riski bilinmemektedir. Memantin kesinlikle gerekli olmadıkça gebelikte kullanılmamalıdır.
Laktasyon dönemi
Memantinin insan sütüne geçişine ilişkin bilgi yoktur. Ancak, maddenin lipofilitesi nedeni ile bunun olması muhtemeldir. Memantin kullanan kadınlar emzirmemelidir.
Üreme yeteneği/Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
Hafif, orta ve şiddetli demansta yapılan ve memantin ile tedavi edilen 1784 ve plasebo ile tedavi edilen 1595 hastayı kapsayan klinik çalışmalarda memantin İle görülen advers olaylann toplam insidans oranı plasebo ile görülenlerden farklılık göstermemiştir; advers olaylar genellikle hafif ve orta şiddettedir. Memantin grubunda plasebo grubundan daha yüksek insidans ile en sık oluşan advers olaylar: sersemlik hali (sırasıyla %6.3-%5.6), baş ağrısı
(°/o5.2-%3.9), kabızlık (%4.6-%2.6), uyuklama hali (%3.4-%2.2) ve hipertansiyon (%4.1-%2.8).
Aşağıdaki tabloda listelenen advers ilaç reaksiyonlan memantinin klinik çalışmalanndan ve tıbbın hizmetine sunumundan itibaren toplanmıştır. Her sıklık grubunda istenmeyen etkiler ciddiyetteki azalmaya göre sunulmuştur.
Advers etkiler sistem-organ sındına göre şu esaslar kullanılarak sıralandınlmaktadır: çok yaygın (> 1/10), yaygın (> 1/100 - <1/10), yaygın olmayan (> 1/1,000 - <1/100), seyrek (>1/10,000 - < 1/,1000), çok seyrek (< 1/10,000), bilinmiyor (mevcut veriden tahmin edilemeyen).
Enfeksiyonlar ve enfestasyonlar | Yaygın olmayan | Mantar enfeksiyonları |
Bağışıklık sistemi bozuklukları | Yaygm | Hipersenstivite |
Psikiyatrik hastalıklar | Yaygm | Uyuklama hali |
Yaygın olmayan | Konfüzyon | |
Yaygın olmayan | ı ............... Halüsinasyon | |
Bilinmeyen | 2 Psikotik reaksiyonlar | |
Sinir sistemi | Yaygm | Sersemlik hali |
hastalıkları | Yaygm | Denge bozuklukları |
Yaygın olmayan | Yürüyüş anormalliliği | |
Çok seyrek | Nöbetler | |
Kardiyak hastalıklar | Yaygın olmayan | Kardiyak yetmezlik |
Vasküler hastalıklar | Yaygm | Hipertansiyon |
Yaygın olmayan | Venöz tromboz/tromboembolizm | |
Solunum sistemi, göğüs ve mediastinal hastalıklar | Yaygm | Dispne |
Gastrointestinal | Yaygın | Kabızlık |
HdMeU livicU | Yaygın olmayan | Kusma |
Bilinmiyor | l Pankreatit | |
Hepato-bilİer hastalıklar | Yaygın | Artmış karaciğer fonksiyon testi |
Bilinmeyen | Hepatit | |
Genel bozukluklar ve | Yaygın | Baş ağrısı |
uygulama bölgesine ilişkin hastalıklar | Yaygm olmayan | Yorgunluk |
^Halüsinasyonlar çoğunlukla şiddetli Alzheimer hastalarında gözlemlenmiştir.
Pazarlama sonrası deneyimlerde bildirilen izole durumlar.
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda veya pazarlama sonrası aşamalarda elde edilen aşın doz ile ilgili deneyim
sınırlıdır.
Semptomlar.
Göreceli büyük aşırı dozlar (sırası ile 3 gün süreyle günde 200 mg ve 105 mal ya sadece yorgunluk, güçsüzlük ve/veya diyare semptomlan ile ilişkilendirilmiştir ya da ıçbır semptom görülmemiştir, ilacın 140 mgın altında veya bilinmeyen dozda alındığı asın doz vakalar! santral sınır sistemi (konfuzyon, uyuklama, uyku basması, vertigo, ajitasyon, ıdırganlık, halusınasyon ve yürüyüş bozukluklan) ve/veya gastrointestinal (kusma ve diyare) kaynaklı semptomlar göstermiştir.
En uç doz aşımı vakasında, hasta oral yolla toplam 2000 mg memantin alımından sonra santral sınır sistemi üzerine etkiler ile (10 gün koma ve ardından diplopi ve ajitasyon) hayatta
i^l^rniştir^ senıptomatık tedavi ve plazmaferez almıştır. Hasta daimi sekel kalmadan
Başka bir büyük doz aşımı vakasında da hasta yaşamış ve iyileşmiştir. Hasta oral yolla 400 mg memantın almıştır. Hasta, huzursuzluk, psikoz, görsel halüsinasyonlar, prokonvulsiflik
uyuklama haıı, stupor ve bilinç kaybı gibi santral sinir sistemi semptomlan yaşamıştır.
Tedavj: D°z
a?ıml durumunda, tedavi semptomatik olmalıdır. Zehirlenme veya doz aşımı için spesifik bir antıdot mevcut değildir, ilaç maddesini uzaklaştırmak için Standard klinik prosedürler, om. gastrik lavaj, aktif kömür (potansiyel entero-hepatik geri dönüşün durdurulması), ıdrann asrileştirilmesi, zorunlu diürez uygun olan şekilde kullanılmalıdır.
Genel santral sı t i "istemi aşırı uyarılmasına dair belirtiler veya semptomlar varsa, dikkatli semptomatik klinik tedavi düşünülmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antidemans ilaçlan
ATC kodu: N06DX01
Özellikle N-metıl-D-aspartat (NMDA) reseptörlerindeki glutamateıjik nörotransmisyon fonksiyon bozukluğunun, nörodejeneratif demansta semptomlann ortaya çıkması ve hastalığın ilerlemesine katkıda bulunduğuna dair gittikçe artan kanıtlar mevcuttur.
V°ltajba®imİ1 orta aflniteli ve kompetitif olmayan bir N-metil-D-aspartat (NMDA) reseptör antagonistidir. Patolojik olarak yükselmiş, nöron işlev kaybına yol açabilen glutamat tonik seviyelerinin etkilerini modüle eder.
Klmik çalışmalar:
Orta ve şiddetli Alzheimer hastalarında (MMSE-Mini mental durum
muayenesi başlangıç toplam skorlan 3-14 olan) yapılan bir pivotal monoterapi çalışmasına
ayaktan tedavi gören 252 basta dahil edilmiştir. Çalışma, 6 ayda, memantin tedavisinin,
plaseboya kıyasla yararlı etkilen olduğunu göstermiştir (CIBIC-plus (Klinisyenin görüşmeye
dayalı değişim izlenimi): p-0.025; ADCS-ADLsev (Alzheimer Hastalığı İşbirhği Çalısması-
Gunluk yaşam aktiviteleri): p=0.003; SIB-Şiddetli yıkım ölçeği: p=0.002 için gözlenrienen vakalann analizi).
Hafif ve orta şiddette Alzheimer hastalığı (MMSE başlangıç toplam skorları 10 - 22 olan) tedavisinde memantin pıvotal monoterapi çalışmasına 403 hasta dahil edilmiştir. Memantin ile tedavi edilen hastalar, plasebo ile tedavi edilen hastalara göre, şu primer sonlanma noktaları açısından istatistiksel olarak anlamlı şekilde daha iyi etki göstermiştir: 24. haftada (LOCF-
*İn_5??en^ ADASC°8 (Alzheimer hastalığı değerlendirme Ölçeği) (p=0.003) ve CIBIC-plus (p-0^004). Hafif ve orta şiddetli Alzheimer Hastalığının bir başka monoterapi çalışmasına toplam 470 hasta (MMSE başlangıç toplam skorları 11 - 23) randomize edilmiştir Prospektıf olarak tanımlanmış primer analizde, 24. haftada primer etkinlik sonlanma noktasında istatistiksel olarak anlam taşıyan bir değere ulaşılmamıştır.
Orta ve şiddetli Alzheimer hastalığı (MMSE toplam skorları <20) olan hastalarla yürütülen 6 [f2 IH ?^s®bo kontrollü, 6 aylık çalışmadaki (monoterapi çalışmaları ve asetilkolinesteraz inhibitörlerinin stabil bir dozunu alan hastalann katıldığı çalışmalar dahil) hastalann meta-analızı, memantin tedavisinin, kognitif, global ve fonksiyonel alanlarda istatistiksel olarak anlamlı şekilde daha iyi etki oluşturduğunu göstermiştir. Hastalar bu üç alanda eşzamanlı meydana gelen kötüleşme ile tanımlandığında, sonuçlar, plasebo verilen birçok hastada bu kötüleşmenin memantin tedavisi gören hastaların iki katı şeklinde ortaya
5.2. Farmakokinetik özellikler
Memantin yaklaşık %100lük mutlak biyoyararlanana sahiptir, t** değeri 3-8 saattir Memantın emilimi gıda alımından etkilenmez.
Dağıhm: Günlük olarak alınan 20 mg dozlar, 70-150 ng/ml (0.5-1 pmol) arasında kişiden kişiye büyük değişim gösteren sabit durum plazma konsantrasyonları ile sonlanmıştır. 5-30 mg lık günlük dozlar alındığında, ortalama beyin omurilik sıvısı (BOS)/serum oranı 0 52 olarak hesaplanmıştır. Dağılım hacmi yaklaşık 10 1/kgdır. Memantinin % 45i plazma proteinlerine bağlanır. p
gıyotraıı fo
rmapgn: İnsanlarda dolaşımdaki memantinle ilişkili maddelerin % 80i ana bileşik biçimindedir, insanlardaki ana metabolitler N-3,5-dimetil-gludantan, 4- ve 6-hidroksi-memantın ızomerik karışımı ve 1 -nitrozo-3,5-dimetil-adamantandır.
Bu metabolıtlerın hiçbirinin NMDA-antagonisti aktivitesi yoktur. İn vitro
çalışmalarda sitokrom P450 enzımlennin katalizlediği metabolizma tespit edilmemi
ştir
Oral yoldan alınan 14C-memantin ile yapılan bir çalışmada, %99dan fazlası renal yoldan olmak üzere dozun ortalama %84ü 20 gün içerisinde atılmıştır.
Eliminasyon:
Memantin terminal yan ömrü (t1/2) 60-100 saattir. Monoeksponansiyel biçimde
T?,?
af?11 b°brck fonksiy°nuna sahiP gönüllülerde, toplam klerens (Cltot) 170 ml/dak/1.73 m dır ve toplam renal klerensin bir kısmı tübüler sekresyon ile sağlanır.
Renal klerens, muhtemelen katyon nakil proteinleri vasıtasıyla, tübüler reabsorbsıyonu da ıçenr. Memantınm renal eliminasyon hızı alkali idrar koşullarında 7-9 faktör azaltılabilir (bkz.
x kullanım uyarılan ve önlemleri).
İdrar alkalizasyonu, diyetteki köklü değişim (örneğin etoburluktan vejetaryen diyete geçiş gibi) veya alkalizan mide tamponlarının çok miktarda alınması sonucu oluşabilir.
Doğrusallık:
Gönüllülerde yapılan çalışmalarda, 10-40 mglik dozlarda lineer farmakokinetik gösterdiği saptanmıştır.
5.3. Klinik öncesi güvenlilik verileri
Sıçanlarda yapılan kısa dönem çalışmalarında, memantin, benzeri diğer NMDA-antagonistleri gibi, sadece çok yüksek düzeyde serum konsantrasyonlarına neden olan dozlardan sonra, nöronal vakuolizasyon ve nekroz (Olney lezyonları) oluşturmuştur. Ataksi ve diğer preklinik işaretler, vakuolizasyon ve nekrozdan önce görülmektedir. Kemirgen ve kemiıgen olmayan deney hayvanlarında uzun süreli yapılan çalışmalarda bu etkiler görülmediğinden, bu bulguların klinik bağlantısı bilinmemektedir.
Tekrarlanan doz toksisite çalışmalannda kemirgenlerde ve köpeklerde, oküler değişiklikler
gözlemlenmiştir fakat bu durum maymunlarda görülmemiştir. Memantin ile yapılan klinik
çalışmalarda, özgün oftalmoskopik incelemeler, herhangi bir oküler değişikliği ortaya koymamıştır.
Lizozomlarda memantin birikimine bağlı olarak, pulmoner makrofajlardaki fosfolipidoz, kemirgenlerde gözlemlenmiştir. Bu etki, katyonik amfifılik özellikteki diğer ilaçlarla da görülmektedir. Bu birikme ile akciğerlerde görülen vakuolizasyon arasında bir ilişki olması olasıdır. Etki, kemirgenlerde, sadece yüksek dozlarda görülmektedir. Bu bulguların klinik bağlantısı bilinmemektedir.
Memantin ile yapılan standart deneyler sonucu, genotoksisite gözlenmemiştir. Fareler ve sıçanlarda, Ömür boyu yapılan çalışmalarda, hiçbir karsinojenite bulgusuna rastlanmamıştır. Memantin, matemal toksik dozlarda dahi, sıçanlarda ve tavşanlarda teratojenik etki göstermemiş ve üretkenliğe ilişkin hiçbir advers etki saptanmamıştır.
Sıçanlarda, insanlara uygulanan düzeydeki dozlara eşdeğer veya biraz yüksek oranlarda yapılan uygulamalarda, fetal büyümenin azaldığı görülmüştür.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sorbitol (E420)
6.2. Geçimsizlikler
Yoktur.
6.3. Raf ömrü
24 ay.
6.4. Saklamaya yönelik özel tedbirler
6.5. Ambalajın niteliği ve içeriği
Amber renkli cam şişelerde. Oral çözeltinin ambalajında kapaklı bir muhafaza kabının içinde yer alan bir daldırma tüpü, kendinden hizalayıcılı bir tıpa ve bir oral doz uygulama şırıngası bulunmaktadır.
6.6. Tıbbi ürünlerden arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmam
ış olan ürünl
er ya da atık
materyaller
Tıbhi Atıkların
Kontrolü
Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.
Daldırma tüpü ve kendinden hizalayıcılı tıpayı koruyucu kabından çıkarın (Şekil 1).


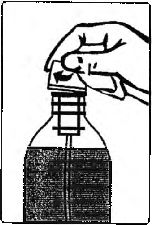
Şişeyi açın (Şekil 2). Kendinden hizalayıcılı tıpayı ve daldırma tüpünü şişenin ağız kısmına takın (Şekil 3).
2. 3.

Oral doz uygulama şırıngasını koruyucu kabından^ıkarm (Şekil 4).
Şırınganın uç kısmını tıpanın ağız kısmına sokun (Şekil 5). Reçetelenmiş miktarda çözeltiyi şişeden çekin (Şekil 6).
5. 6.

Reçetelenmiş m ard; dozu içeren şırıngayı çıkarmadan önce çekme pistonuna birkaç defa bastırarak büyük hava kabarcıklarını çıkarın (Şekil 7). Birkaç küçük hava kabarcığı bulunmasının önemi yoktur ve bunlar dozu herhangi bir şekilde etkilemeyecektir.
7.
MEMORİX10 mg/g oral çözeltiyi direkt olarak şırıngadan yutun ya da önce küçük bir bardak içinde suyla karıştırın ve karışımın tümünü için (Şekil 8).
8.

Kullandıktan sonra şırınganın dış yüzeyini temiz bir peçeteyle silin ve şırıngayı muhafazası içine yerleştirin (Şekil 9).
9.
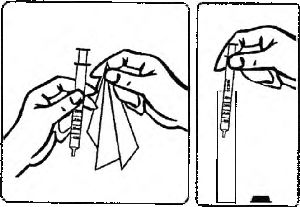
Kendinden hizalayıcılı tıpayı ve daldırma tüpünü şişenin içinde bırakın. Şişenin kapağını kapatın (Şekil 10).
10.
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ALIOS | 8699844090296 | |
| ALMENTA | 8699293090014 | 1,240.80TL |
| ALZANT | 8699569090687 | 1,240.80TL |
| ALZER | 8680053090030 | |
| ALZIA | 8697473097525 | |
| Diğer Eşdeğer İlaçlar |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ GENEL BİLGİLERİ
Sanofi Sağlık Ürünleri Ltd.Şti
| Satış Fiyatı | 1264.72 TL [ 7 Aug 2023 ] |
| Önceki Satış Fiyatı | 1264.72 TL [ 31 Jul 2023 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699502590397 |
| Etkin Madde | Memantin |
| ATC Kodu | N06DX01 |
| Birim Miktar | 10 |
| Birim Cinsi | MG/G |
| Ambalaj Miktarı | 100 |
| Sinir Sistemi > Anti Demans İlaçlarAlzheimer İlaçları > Memantin |
| Yerli ve Beşeri bir ilaçdır. |