MEPACT 4 mg infüzyonluk DISPERSIYON konsantreSI için toz Farmakolojik Özellikler
{ Mifamurtid }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmünostimülanlar, diğer immünostimülanlar ATC kodu: L03AX15
Etki mekanizması:
Mifamurtid (muramil tripeptid fosfatidil etanolamin, MTP-PE), Mycobacterium suşlarının hücre duvarının en küçük doğal bağışıklık uyarıcı bileşeni olan muramil dipeptid (MDP)'in tam sentetik bir türevidir. Doğal muramil dipeptid (MDP) ile benzer immünostimülatör etkilere sahiptir. MEPACT, intravenöz infüzyon yoluyla makrofajları in vivo olarak hedef almak üzere özellikle tasarlanmış lipozomal bir formülasyondur.
Farmakodinamik etkiler
MTP-PE, öncelikle monositlerde, dendritik hücrelerde ve makrofajlarda bulunan NOD2 reseptörünün spesifik bir ligandı ve monositlerle makrofajların güçlü bir aktivatörüdür. İnsan makrofajlarının MEPACT ile aktivasyonuna; tümör nekroz faktörü alfa (TNF-α), interlökin-1 (IL-1β), IL-6, IL-8, ve IL-12 dahil sitokinlerin ve LFA-1 (lenfosit fonksiyonunun eşlik ettiği antijen-1) ve ICAM-1 (hücre-içi adezyon molekülü) gibi adezyon moleküllerinin üretilmesi eşlik eder. In vitro MEPACT'a maruz bırakılan insan monositleri; allojenik ve otolog tümör hücrelerini (melanoma, over, kolon ve renal karsinoma hücreleri dahil) öldürmüş, ancak normal hücrelerde toksik etki göstermemiştir.
In vivo MEPACT verilmesi; fare ve sıçanlardaki akciğer metastazı, deri ve karaciğer kanseri ve fibrosarkom modellerinde tümör büyümesini inhibe etmiştir. Adjuvan tedavi olarak MEPACT kullanılan köpeklerdeki hemanjiyosarkomda ve osteosarkomda hastalıksız sağkalım süresinin anlamlı şekilde uzadığına tanık olunmuştur. MEPACT tedavisinin hayvanlarda ve insanlarda monositlerin ve makrofajların aktivasyonunun hangi mekanizmayla anti-tümör aktivite sağladığı henüz bilinmemektedir.
Klinik güvenlilik ve etkililik:
Liposomal mifamurtidin güvenliliği, çeşitli türlerde ve evrelerde kanserleri olan >700 hastada ve sağlıklı, erişkin 21 denekte değerlendirilmiştir (bkz. bölüm 4.8).
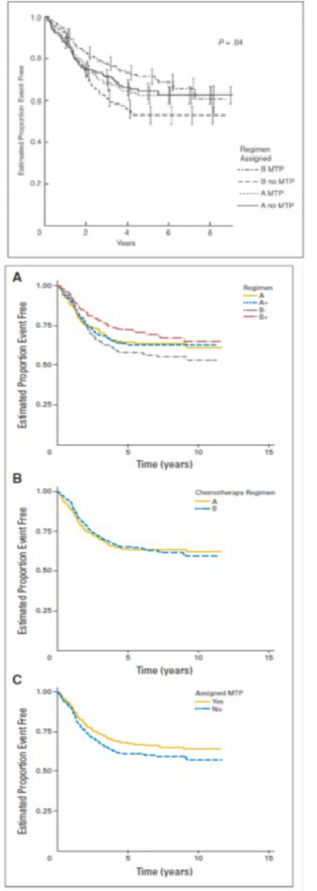
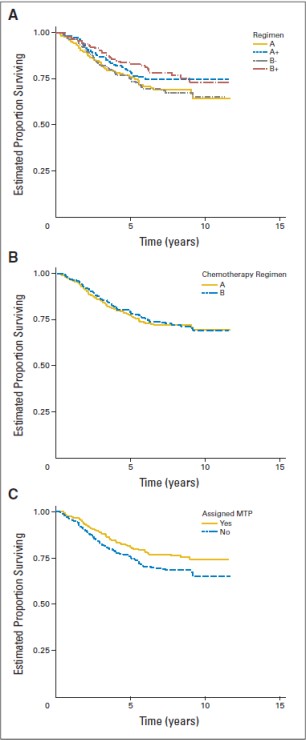
MEPACT kemoterapi ile birlikte kullanıldığında; yeni tanı konulmuş, rezeksiyonu mümkün, yüksek evreli osteosarkom hastalarında sağkalımı, yalnızca kemoterapiyle karşılaştırıldığın da anlamlı şekilde uzatmıştır.
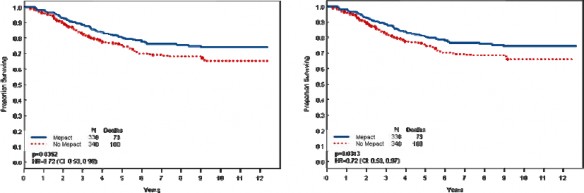
Yaşları 1.4-30.6 arasında değişen ve yeni tanı konulmuş, rezeksiyonu mümkün, yüksek evreli osteosarkomu olan 678 hastadaki randomize bir faz III çalışmasında; ifosfamidle birlikte ya da ifosfamid olmaksızın doksorubisin, sisplatin ve metotreksat kombinasyon tedavisine yardımcı (adjuvan) olarak MEPACT ilave edilmesi, 6 yıllık genel sağkalımı anlamlı ölçüde uzatmış ve ölüm riskinde %28 nispi azalmayla sonuçlanmıştır (p = 0.0313, tehlike oranı (TO)
= 0.72 [%95 Güven aralığı(GA): 0.53, 0.97]).
1, 5, 6 yıl için genel sağkalım verileri (1 yıl verileri tam olmadığından grafik yalnızca 5 ve 6 yıl verilerini göstermektedir)
Şekil a. Genel Sağkalım: 2006 (sol) ve 2007 (sağ) veri setleri (ITT Hastaları)
Tablo a. Genel Sağkalım: 2003, 2006 ve 2007 veri setleri (ITT popülasyonu)
| ||||||||||||
|
|
|
|
|
|
|
|
| ||||
Hastalıksız sağkalım (HS) analizinde, ara çalışma sonlanım noktası, nüksetme veya ölüm riskinde %20-25'lik azalma ile benzer şekilde zaman içinde tutarlılık gösterir (Tablo b.).
Tablo b. Hastalıksız Sağkalım: 2003, 2006 ve 2007 veri setleri
| ||||||||||||
|
|
|
|
|
|
|
|
| ||||
MEPACT | 340 | --- | 1.00 | --- | 340 | --- | 1.00 | --- | 340 | --- | 1.00 | --- |
olma dan | (126) |
|
|
| (133) |
|
|
| (133) |
|
|
|
MEPACT | 338 | 0.0245 | 0.74 | (0.57, | 338 | 0.0623 | 0.78 | (0.61, | 338 | 0.0586 | 0.78 | (0.61, |
ile | (102) |
|
| 0.96) | (107) |
|
| 1.01) | (107) |
|
| 1.01) |
5. Yıl Analizi
|
|
|
|
6. Yıl Analizi
|
|
Pediyatrik popülasyon:
Hastalığın prevalansına göre, pivotal denemede çocuklar ve genç yetişkinler üzerinde çalışılmıştır. Ancak, 18 yaş altı hastalar için ve 18 yaş ve üzeri hastalar için spesifik alt küme etkililik analizleri mevcut değildir.
5.2. Farmakokinetik özellikler
Genel özelliklerMifamurtidin farmakokinetiği sağlıklı yetişkin deneklerde 4 mg intravenöz infüzyondan sonra ve osteosarkomu olan çocuk ve yetişkin hastalarda 2 mg/mintravenöz infüzyondan sonra tanımlanmıştır.
21 sağlıklı yetişkin denekte mifamurtid 2,05 ± 0,40 saat yarı-ömürle serumdan (dakikalar içinde) hızla temizlenmiş, sonuçta serumda çok düşük miktarda toplam (lipozomal ve serbest) mifamurtid kalmıştır. Ortalama EEA (eğri altındaki alan) 17,0 ± 4,86 h x nM ve Cmaks (maksimum konsantrasyon) 15,7 ± 3,72 nM olmuştur.
Yaşları 6 ile 39 arasında değişen 28 osteosarkom hastasında serumdaki toplam (lipozomal ve serbest) mifamurtid konsantrasyonları ortalama 2,04 ± 0,456 saat yarı-ömürle süratle gerilemiştir. BSA normalize klerensi ve yarı-ömrü yaş aralığında buna benzer biçimde olmuştur ve önerilen dozun 2 mg/molduğu sağlıklı yetişkin deneklerden alınan sonuçlarla birbirini tutmaktadır.
14 hastayla yapılan başka bir çalışmada, MEPACT'ın ilk infüzyonundan ve 11 veya 12 hafta sonraki son bir infüzyondan sonra değerlendirilen toplam ve serbest mifamurtidin ortalama serum konsantrasyonu-zaman eğrileri, neredeyse üzerine eklenebilir miktardadır ve serbest mifamurtidin ilk ve son infüzyondan sonraki ortalama EEA değerleri de buna benzer olmuştur. Bu veriler ne toplam ne de serbest mifamurtidin tedavi süresi içinde birikmediğini göstermektedir.
Emilim:
Geçerli değildir. Dağılım:
1 mg mifamurtid içeren radyoaktif işaretli lipozomların enjeksiyonundan 6 saat sonra,
karaciğer, dalak, nazofarenks, tiroit ve daha az miktarda da akciğerde radyoaktivite bulunmuştur. Lipozomlar retiküloendoteliyal sistem hücreleri tarafından fagositoza uğramıştır. Akciğer metastazlı 4 hastadan 2'sinde, radyoaktivite akciğer metastazında bulunmuştur.
Biyotransformasyon
İnsanlarda, mifamurtid (L-MTP-PE)'nin metabolizması çalışılmamıştır, ancak osteosarkomlu hastalarda 4 adet faz I klinik çalışma (Protokol 02, MTP-OS-402, C23001, ve C23002 ) ve 1 adet insani amaçlı erken erişim çalışması (Çalışma MTP-OS-403) ile mifamurtidin farmakokineniği karakterize edilmiş ve ilacın özelliklerindeki değişkenlik kaynaklarının (yaş, renal fonksiyon, hepatik fonksiyon) anlaşılması amaçlanmıştır. Ayrıca, Protokol 02'de muramil tripeptid fosfatidil etanolamin (MTP-PE) içeren teknesyum-99 (99mTc) işaretli lipozomlar karakterize edilmiştir ve sonuçlar retiküloendotelyal sistem dokularına dağılımı ve dolayısıyla etki mekanizmasını desteklemektedir. Bu çalışmalar birlikte, renal yetmezlik (C23001) ve hepatik yetmezlik (C23002) etkileri de dahil olmak üzere mifamurtidin klinik farmakolojisi üzerine kapsamlı bir değerlendirme sağlar. Kollektif sonuçlar göstermektedir ki:
mifamurtidin osteosarkomlu hastalardaki farmakokinetik parametreleri, sağlıklı yetişkin gönüllülerde gözlemlenenlerle uyumludur; orteosarkom hasta popülasyonunda yaş ile vücut yüzey alanı (VYA)-normalize klerensi arasında belirgin bir ilişki yoktur; ve 2 mg/m2'lik ortak bir VYA bazlı doz desteklenmektedir. Önemli olarak, hafif ila orta şiddette hepatik veya renal yetmezliği olan deneklere mifamurtid verilmesi mifamurtidin farmakokinetiği üzerinde anlamlı etkiler oluşturmamıştır ve bu özel hasta popülasyonları için başlangıç dozunun ayarlanmasına gerek yoktur.
Eliminasyon:
Mifamurtid içeren radyoaktif-işaretli lipozomların enjekte edilmesinden sonra, radyoaktif işaretli maddenin ortalama yarı-ömrü bir α fazıyla 15 dakika civarı bifazik olmuş ve termin al yarı-ömür yaklaşık 18 saat olmuştur.
Yetişkin gönüllülere 4 mg dozda lipozomal mifamurtid intravenöz infüzyonundan sonra muramil tripeptid fosfatidil etanolamin (MTP-PE)'nin idrardaki konsantrasyonları tayin limitinin altında çıkmıştır. Bu nedenle muramil tripeptid fosfatidil etanolamin (MTP-PE)'n in renal klerensi ihmal edilebilir.
Muramil tripeptid fosfatidil etanolamin (MTP-PE)'nin spesifik eliminasyon yolağı araştırılmamıştır. Yukarıda bahsi geçen radyoaktif işaretleme çalışmasında teknesyum-99 işaretli lipozomlar kullanılmıştır. Böylece, muramil tripeptid fosfatidil etanolamin (MTP- PE)'nin eliminasyon yolağı karakterize edilmemiştir. İki çalışmada 4 mg dozdan sonra muramil tripeptid fosfatidil etanolamin (MTP-PE)'nin idrardaki konsantrasyonu tayin limitinin altında olduğundan renal klerensi ihmal edilebilir.
Hastalardaki karakteristik özellikler
Renal yetmezlik
Tek bir 4 mg'lık mifamurtid dozunun 1 saatlik intravenöz infüzyondan sonraki farmakokinetiği hafif (n=9) veya orta derecede (n=8) böbrek yetmezliği olan yetişkin gönüllülerde ve aynı yaş, cinsiyet ve ağırlık özelliklerinde olan normal böbrek f onksiyonlu sağlıklı yetişkinlerde değerlendirilmiştir (n=16). Hafif (50 ml/dak ≤ CLcr ≤80 ml/dak) veya orta derecede (30 ml/dak ≤ kreatinin klerensi [CLcr] < 50 ml/dak) böbrek yetmezliğinin normal böbrek fonksiyonlu (CLcr > 80 ml/dak) sağlıklı deneklerde gözlenenlerle karşılaştırıldığında toplam muramil tripeptid fosfatidil etanolamin (MTP-PE) klerensi üzerinde bir etkisi olmamıştır. Ayrıca, hafif veya orta şiddette renal yetmezlikte serbest (lipozomla bağlantılı olmayan) muramil tripeptid fosfatidil etanolamin (MTP-PE)'nin sistemik maruziyetleri sıfırdan sonsuza kadar eğri altındaki alan (EEAsonsuz), normal renal fonksiyonu olan sağlıklı yetişkin deneklerde gözlenenler ile benzer idi.
Hepatik yetmezlik
1 saatlik intravenöz infüzyonun ardından tek dozluk 4 mg mifamurtidin farmakokinetiği, hafif (Child Pugh sınıf A; n=9) veya orta şiddette (Child Pugh sınıf B; n=8) hepatik yetmezliği olan yetişkin gönüllüler ile yaş, cinsiyet ve kilo bakımından aynı olan normal hepatik f onksiyon (n=19) gösteren sağlıklı yetişkinlerde incelendi. Total muramil tripeptid fosfatidil etanola min (MTP-PE)'nin sistemik maruziyeti (EEAsonsuz) üzerinde hafif hepatik yetmezliğin herhangi bir etkisi olmamıştır. Orta şiddette hepatik yetmezlik ise, total muramil tripeptid fosfatidil etanolamin (MTP-PE)'nin EEAsonsuz'unda küçük bir artışa yol açmış, normal hepatik fonksiyon grubuna nazaran orta şiddette hepatik yetmezliğin geometrik en küçük kare oranı
%119 (%90 güven aralığı [GA]: %94.1-%151) olmuştur. Orta şiddette hepatik yetmezlik grubunda farmakokinetik değişkenlik daha yüksek olmuştur. Sistemik maruziyetteki değişkenlik katsayısı [EEAsonsuz], diğer hepatik fonksiyon gruplarındaki <%30'a karşılık
%50 olmuştur.
Hafif hepatik yetmezlikte total ve serbest muramil tripeptid fosfatidil etanolamin (MTP- PE)'nin ortalama yarı-ömürleri sırasıyla 2.02 saat ve 1.99 saat şeklinde gerçekleşmiş olup bu değerler normal hepatik fonksiyon gösteren deneklerinki (sırasıyla 2.15 saat ve 2.26 saat) ile benzerdir. Orta şiddette hepatik yetmezlikte total ve serbest MTP-PE'nin ortalama yarı- ömürleri sırasıyla 3.21 saat ve 3.15 saattir. Ayrıca, hafif ve orta şiddette hepatik yetmezlikte serbest (lipozomla ilgili olmayan) muramil tripeptid fosfatidil etanolamin (MTP-PE)'nin geometrik ortalama plazma EEAsonsuz'u, karşılaştırma yapılan normal hepatik fonksiyon gruplarından %47 daha yüksek çıkmıştır. Mifamurtid'in maksimum tolere edilebilir dozu (4-6 mg/m2), tavsiye edilen dozun (2 mg/m2) 2-3 katı olduğu için bu değişiklikler klinik olarak anlamlı değildir.
5.3. Klinik öncesi güvenlilik verileri
Duyarlı hayvan türlerinde (tavşan ve köpek) advers etkilere yol açmayan, en yüksek günlük mifamurtid dozunun 0.1 mg/kg (sırasıyla 1.2 ve 2 mg/ m) olduğu bulunmuştur. MEPACT'ın hayvanlardaki herhangi bir advers etkiye yol açmayan düzey değerinin kabaca, insanlarda önerilen terapötik doza (2 mg/m) takabül ettiği hesaplanmıştır.
Köpeklerde her gün intravenöz olarak 0.5 mg/kg'a (10 mg/m) varan MEPACT verilerek yapılan bir çalışma klinik toksisite açısından, insanlarda kullanılması amaçlanan doza eşlik edenin 8-19 katı kümülatif maruziyet güvenlilik sınırı konusunda bilgi sağlamıştır. Her gün verilen yüksek ve kümülatif dozlarda başlıca toksisite olarak öncelikle aşırı artmış farmakolojik etkiler: ateş, kendisini sinovit, bronkopnömoni, perikardit ve karaciğerle kemik iliğinin inflamatuvar nekrozu gibi belirtilerle gösteren belirgin inflamatuar cevaptır. Ayrıca, şu olaylar da gözlenmiştir: kanama ve pıhtılaşma zamanlarının uzaması, infarktüsler, küçük arterlerin duvarlarında morfolojik değişiklikler, merkezi sinir sisteminde ödem ve konjestiyon, minör kardiyak etkiler ve hafif hiponatremi. MEPACT, sıçanlarda ve tavşanlarda mutajen etki göstermemiş ve teratojen etkilere yol açmamıştır. Embriyotoksik etkiler yalnızca anne için toksik olan dozlarda görülmüştür.
Genel toksisite çalışmalarında erkek veya dişi üreme organlarında zararlı etkiler görüldüğü izlenimini veren herhangi bir sonuç elde edilmemiştir. Üreme fonksiyonu, perinatal toksisite ve karsinojen potansiyel konusunda spesifik çalışmalar yapılmamıştır.
50 mL, 9 mg/mililitrelik (% 0.9) enjeksiyonluk sodyum klorür çözeltisi; iğne ve enjektör kullanılarak torbadan çekilmelidir.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A16228 |
| Satış Fiyatı | 98345.73 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 98345.73 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699456790041 |
| Etkin Madde | Mifamurtid |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |