MIACALCIC 200 IU 28 doz nasal sprey Kısa Ürün Bilgisi
{ Salmon Kalsitonini }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MİACALCİC 200 IU nazal sprey2. KALİTATİF VE KANTİTATİF BİLEŞİM
Sentetik salmon kalsitonini 2200 IU/ml
Bir Uluslararası Birim (= IU) yaklaşık 0.2 mcg sentetik salmon kalsitoninine karşılık gelir.
Her sprey şişesi en az 14 ölçülü doz içerir; her sıkım 200 IUlik dozlara tekabül eder.
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Nazal sprey çözeltisi.
Her sıkımda 200 IU salmon kalsitonini uygulayan, bir ölçme pompası takılı, en az 14 ölçülü doz içeren nazal sprey çözeltisi.
4.1. Terapötik endikasyonlar
MİACALCİC,
Postmenapozal osteoporoz tedavisi,
4.2. Pozoloji ve uygulama şekli
MİACALCİC ® nazal spreyin her sıkımda farklı bir burun deliğine uygulanması önerilir. Doktor tarafından başka şekilde tavsiye edilmediği takdirde aşağıdaki dozlar uygulanır:
Osteoporoz tedavisinde pozoloji:
MİACALCİC nazal spreyinin osteoporoz tedavisinde önerilen dozu günde 200 IUdir. İlerleyen kemik kütle kaybını önlemek için MİACALCİCin yeterli kalsiyum ve D vitamini alımı ile birlikte uygulanması önerilir.
Uygulama sıklığı ve süresi:
Postmenopozal osteoporoz tedavisinde MİACALCİCle tedavi uzun süreli olarak uygulanmalıdır (Bkz. Bölüm 5.1. Farmakodinamik Özellikler).
Osteoliz ve/veya osteopeniye bağlı kemik ağrılarının tedavisinde pozoloji:
Osteoliz ve/veya osteopeniye bağlı kemik ağrılarında önerilen doz günde 200-400 IUdur. 200 IUye kadar tek doz halinde uygulanabilir. Daha yüksek doz gerektiğinde bölünmüş dozlar halinde uygulanmalıdır. Doz, her hastanın ihtiyacına göre bireysel olarak ayarlanmalıdır.
Uygulama sıklığı ve süresi:
Analjezik etki tamamen görülmeye başlayıncaya kadar belli bir süre gerekebilir. İdame tedavisi için başlangıç dozu genellikle azaltılabilir ve/veya uygulama aralıkları uzatılabilir.
Sudek hastalığı veya Algodistrofi tedavisinde pozoloji:
Sudek hastalığı veya algodistrofınin erken teşhisi önemli olup, tedaviye teşhis
konulduktan hemen sonra başlanmalıdır.
Önerilen doz 2-4 hafta boyunca günlük 200 IU tek dozdur.
Uygulama sıklığı ve süresi:
Klinik tablodaki gelişmeye göre 6 haftaya kadar her iki günde bir 200 IU ilave olarak uygulanabilir.
Uygulama şekli:
Kutunun içinden çıkan cihaz aracılığı ile burundan nefesle çekmek suretiyle kullanılır. Damlatma tüpüne hava kabarcığının kaçmasını engellemek için nazal sprey şişesi daima dik olarak tutulmalıdır.
Uzun süreli tedavi
Uzun süreli tedavi gören hastalarda kalsitoninlere karşı antikor oluşabilirse de bu durum genellikle klinik etkinliği etkilemez.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği :
Böbrek ya da karaciğer yetmezliği olan hastalarda, hiçbir resmi çalışma yapılmamış olmasına rağmen, MİACALCİCin uygulanması ile ilgili geniş deneyime göre bu hasta popülasyonlarında tolerabilitenin azaldığına ya da doz ayarına gerek duyulduğuna dair herhangi bir kanıt saptanmamıştır.
Pediyatrik popülasyon:
Çocuklarda MİACALCİCin kullanımına ait sınırlı deneyim olduğundan bu hasta grubu için hiçbir öneride bulunulamamaktadır.
Geriyatrik popülasyon:
4.3. Kontrendikasyonlar
4.4. Özel kullanım uyarıları ve önlemleri
, Bölüm 4.8. İstenmeyen Etkiler ve Bölüm 6.1. Yardımcı Maddelerin Listesi.).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Kalsitonin ve lityumun eş zamanlı kullanımı plazma lityum konsantrasyonlarının düşmesine yol açabilir. Lityum dozunun ayarlanması gerekebilir.
Özel popülasyonlara ilişkin ek bilgiler:
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
MİACALCİCin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
MİACALCİC, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Gebelik dönemi
Gebe kadınlarda çalışma yapılmadığından, MİACALCİC gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Emziren annelerde çalışma yapılmadığından ve salmon kalsitonininin anne sütüne geçip geçmediği bilinmediğinden, tedavi sırasında annenin bebeğini emzirmesi tavsiye edilmemektedir.
Üreme yeteneği / Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
), bu da hastanın tepkilerini zayıflatabilir. Bu nedenle, hastalar, bu etkilerin meydana gelebileceği ve böyle durumlarda araç ya da makine kullanmamaları konusunda uyarılmalıdır.
Lokal advers olaylar, genellikle hafif (raporların yaklaşık %80inde) olmakla birlikte tedavinin kesilmesine vakaların %5ten azında gerek duyulmaktadır.
Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır.
Çok yaygın (> 1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Bağışıklık sitsemi hastalıkları
Seyrek: Aşırı duyarlılık.
Çok seyrek: Anafilaktik ve anafilaktoid reaksiyonlar, anafilaktik şok.
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı, baş dönmesi, disgözi (tat alma duyusunda bozukluklar).
Göz hastalıkları
Yaygın olmayan: Görme bozukluğu.
Vasküler hastalıklar
Yaygın: Ateş basması, ciltte kızarıklık. Yaygın olmayan: Hipertansiyon.
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Çok yaygın: Burunda rahatsızlık, burun tıkanıklığı, burunda ödem, hapşırma, rinit,
burunda kuruluk, alerjik rinit, burun iritasyonu, burunda koku, burun mukozasında
eritem, mukoza eskoriasyonu.
Yaygın: Epistaksis, sinüzit, ülseratif rinit, farenjit.
Yaygın olmayan: Öksürük.
Gastrointestinal hastalıklar
Yaygın: Bulantı, diyare, karın ağrısı. Yaygın olmayan: Kusma.
Deri ve deri altı doku hastalıkları
Seyrek: Yaygın döküntü.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Artralji.
Yaygın olmayan: Kas-iskelet ağrısı.
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Yorgunluk.
4.9. Doz aşımı ve tedavisi
MİACALCİC parenteral uygulandığında bulantı, kusma, sıcak basması ve baş dönmesi doza bağlı bilinen etkilerdir. Bu olayların MİACALCİC nazal sprey aşırı kullanımı ile görülmesi beklenebilir. Bununla beraber, MİACALCİC nazal sprey tek doz olarak 1600 IUye kadar ve günde 800 IUye kadar üç gün uygulanmış ve ciddi advers etki görülmemiştir. Aşırı doz alan izole vakalar bildirilmiştir. Tedavi semptomatiktir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Kalsiyum homeostaz düzenleyici ATC kodu: H05B A01
Etki mekanizması:
Bütün kalsitonin yapıları, dizilim açısından türden türe farklılık gösteren N-terminalinde yedi aminoasit kalıntısından oluşmuş bir halka içeren tek zincir halinde 32 aminoasitten oluşmaktadır. Salmon kalsitonini, reseptör bağlantı bölgelerine, memelilerden elde edilen kalsitoninlerden daha çok afinite gösterdiğinden daha güçlü ve daha uzun etkilidir.
Spesifik reseptörleri üzerinden osteoklast aktivitesini inhibe eden salmon kalsitonini, kemik rezorpsiyon hızının arttığı osteoporoz gibi durumlarda kemik yıkımını belirgin olarak azaltarak normal bir düzeye indirir. Hem hayvan modellerinde hem de insanda salmon kalsitoninin, muhtemelen özellikle merkezi sinir sistemine doğrudan bir etki yolu ile analjezik aktivite gösterdiği saptanmıştır.
Farmakodinamik etkiler:
MİACALCİC, tek bir dozun ardından insanda, kalsiyum, fosfor ve sodyumun idrarla atımında (tübüler geri emilimlerini azaltarak) artış ve hidroksiprolinin idrarla atımında azalma ile görülen, klinik açıdan anlamlı bir biyolojik yanıt oluşturur. MİACALCİCin uzun süreli uygulanması kemik yıkımının biyokimyasal göstergeleri olan serum C-telopeptidleri (sCTX) ve alkalen fosfatazın iskelet izoenzimlerini 5 yıla kadar tedavide anlamlı olarak suprese eder.
MİACALCİC, lomber omurga Kemik Mineral Dansitesinde (KMD) 1 yıldan başlayarak ve 5 yıla kadar istatistiksel olarak anlamlı %1.0-2.0 artış sağlar. Kalça KMDsi korunur.
MİACALCİC, günde 200 IU uygulandığında, D vitamini ve tek başına kalsiyumla (plasebo) tedaviye göre, yeni vertebral kırık gelişme riskini ve istatistiksel ve klinik olarak anlamlı (%36) azaltır. Ek olarak multipl vertebral kırık insidansı yine "plasebo" ile karşılaştırıldığında %35 azalır.
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
MİACALCİC, nazal mukozadan hızlı emilir ve uygulamadan sonraki bir saat içinde (medyan süre yaklaşık 10 dakika) en yüksek plazma konsantrasyonlarına erişilir.
Dağılım:
Diğer polipeptid hormonlarda olduğu gibi salmon kalsitoninin de plazma değerleri terapötik yanıtın doğrudan göstergesi olmadığından salmon kalsitoninin plazma düzeylerinin izlenmesinin yararı çok azdır. Bu nedenle MİACALCİC aktivitesi, klinik etkililik parametreleri kullanılarak değerlendirilmelidir.
Biyotransformasyon:
200 IU dozun parenteral uygulamaya göre biyoyararlanımı %3 - 5dir. Önerilenden daha yüksek olarak uygulanan doz kan düzeylerinin yükselmesine (EAAda bir artma ile görülen) neden olur ancak, bağıl biyoyararlanım artmaz.
Eliminasyon:
Eliminasyon yarı ömrü yaklaşık 20 dakika olarak hesaplanmıştır ve çoklu doz uygulamasında herhangi bir birikme kanıtına rastlanmamıştır.
Doğrusallık/doğrusal olmayan durum:
Doğrusallık / doğrusal olmayan durum hakkında herhangi bir veri bulunmamaktadır.
Hastalardaki karakteristik özellikler
Böbrek / karaciğer yetmezliği:
Böbrek ya da karaciğer yetmezliği olan hastalarda, hiçbir resmi çalışma yapılmamış olmasına rağmen, MİACALCİCin uygulanması ile ilgili geniş deneyime göre bu hasta popülasyonlarında tolerabilitenin azaldığına ya da doz ayarına gerek duyulduğuna dair herhangi bir kanıt saptanmamıştır (bkz. bölüm 4.2.).
Pediyatrik popülasyon:
Çocuklarda MİACALCİCin kullanımına ait sınırlı deneyim olduğundan bu hasta grubu için hiçbir öneride bulunulamamaktadır.
Geriyatrik popülasyon:
5.3. Klinik öncesi güvenlilik verileri
Laboratuvar hayvanlarında geleneksel uzun-süreli toksisite, üreme, mutajenite ve karsinojenite çalışmaları yapılmıştır.
%0.01 benzalkonyum klorür içeren bir plasebonun ya da %0.01 benzalkonyum klorür içeren yüksek dozlardaki kalsitonin formülasyonunun 26 hafta boyunca günlük olarak intranazal yolla uygulanması maymunlarda iyi tolere edilmiştir. Solunum yollarında tedaviyle ilgili herhangi bir değişiklik gözlenmemiştir. 4 hafta boyunca intranazal yolla %0.01 benzalkonyum klorür içeren salmon kalsitonini verilen köpeklerde burun boşluğunda ve üst solunum yollarında herhangi bir anormal bulguya rastlanmamıştır.
Toksisite çalışmalarındaki minör etkiler, salmon kalsitoninin farmakolojik etkisine bağlanmaktadır. Salmon kalsitonini embriyotoksik, teratojenik ve mutajenik potansiyel göstermez. Toksisite ve karsinojenite çalışmaları salmon kalsitonininin klinik kullanımdan daha düşük miktarlarda, sıçanlarda hipofiz tümörlerinin insidansını artırdığını göstermiştir.
Bununla birlikte, yapılan diğer klinik öncesi çalışmalar, özellikle de farede yapılan ve maksimum maruziyetin insanda 200 IU dozu takiben oluşan maruziyetin 7000 katından fazla olduğu bir karsinojenite çalışması, hipofiz tümörü indüklenmesinin sıçanlara özgü bir durum olduğunu düşündürmüştür.
Eşleştirilmiş kontrollerle yapılan bir çalışmada 24 aya kadar tedavi edilen hastalarda elde edilenler de dahil olmak üzere klinik verilerde hipofizle ilgili herhangi bir değişiklik saptanmamıştır. Bunun yanında, insan hipofizinde kalsitonin reseptörlerinin sayıca çok az olduğu ya da hiç bulunmadığı gösterilmiştir.
Ayrıca, hastalarda hipofiz tümörleriyle ilgili hiçbir advers vaka bildirilmemiştir.
Dolayısıyla, hipofiz tümörü indüksiyonunun sıçana özgü bir vaka olduğu ve sıçanlardaki hipofiz tümörlerinin MİACALCİCin klinik kullanımı ile ilgili olmadığına dair yeterli kanıtın olduğu sonucuna varılmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
0.1 mg 8.5 mg
y.m. (pH ayarlaması için) y.m.
Benzalkonyum klorür
6.2. Geçimsizlikler
Geçerli değil.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
Kullanmaya başlayıncaya kadar buzdolabında 2 - 8oC de saklayınız. Dondurmayınız.
6.5. Ambalajın niteliği ve içeriği
Cihaz saydam, renksiz bir cam şişeden (tip I cam) ve entegre, otomatik bir doz sayma mekanizmasıyla yerleşik bir mekanik durdurucu içeren bir sprey mekanizmasından oluşmaktadır.
Ambalaj içerisinde,
2 ml nazal sprey çözelti içeren ve 200 IUluk en az 14 doz uygulayan ölçme pompası takılı bir şişe ya da
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.
MİACALCİC Nazal Sprey ilk kez kullanılmadan önce, spreyin kullanımı ve kullanıma hazırlanmasıyla ilgili olarak "Kullanma Talimatı"nda yer alan adımlar dikkatle okunmalıdır.
İlk kullanımdan önce pompa kullanıma hazırlanmalıdır: Koruyucu kapak çıkarılır, şişe dik tutularak üst kısma "tık" sesi çıkarıncaya kadar basılır. Bu işlem iki kez tekrarlanır.
İlk seferden sonra doz gösterge penceresinde beyaz ve kırmızı çizgiler, ikinci seferden sonra beyaz çizgi, üçüncü seferden sonra ise yeşil çizgi görünecektir. Sprey bu şekilde kullanıma hazır hale gelir.
Kullanma Talimatı
Nazal spreyin nasıl kullanılacağını öğrenmek için bu talimatların tamamını dikkatlice okuyunuz. Bu talimatlar sizi:
Nazal spreyin bölümleri
Yeni bir nazal spreyin kullanıma hazırlanması
Nazal spreyin kullanılması konusunda bilgilendirir.
Eğer sprey mekanizması tıkanırsa, bu pompaya kuvvetle basılarak çözümlenebilir, ancak hasar yaratabileceğinden
kesinlikle sivri uçlu objelerle tıkanıklığı açmaya çalışmayınız. Nazal spreyinizin uygun şekilde çalışmadığını düşünüyor iseniz eczacınıza iade ediniz.
Asla kendiniz tamir etmeye ya da parçalara ayırmaya kalkmayınız. Bu hareketler alınan dozu etkilemektedir.
Dozla ilgili doktorunuzun talimatlarına dikkatle uyunuz. Tekrar kullanabilmek için kullanma talimatını
kaybetmeyecek şekilde
saklayınız.
Nazal spreyin bölümleri
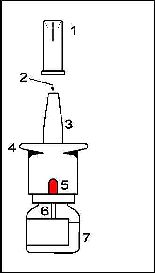
1. Koruyucu kapak: Burunluğu temiz tutar ve püskürtücü ucu korur. Nazal spreyi her kullanışınızdan sonra koruyucu kapağını kapatınız.
2. Püskürtücü uç: İlacın dışarı spreylendiği ince delik.
3. Burunluk: Burun deliğinize yerleştirilen bölüm.
4. Pompa: Spreyi çalıştırmak için bastırılan bölüm.
5. Gösterge: Yeni bir nazal spreydeki doz gösterge penceresi resimde görüldüğü gibi O pozisyonundadır. Pompayı her basışınızda göstergede sayı değişir.(Bkz. Göstergenin kontrolü)
6. Damlatma tüpü: Pompayı bastırdığınızda sprey şişesinin içindeki ilacı alan tüp.
7. Şişe: En az 14 ölçülü doza yeterli ilaç içerir.
Yeni bir nazal sprey şişesinin hazırlanması
Nazal sprey şişesini
ASLA ÇALKALAMAYINIZ, oluşan hava kabarcıkları dozunuzu etkileyebilir.
Yeni bir nazal sprey şişesinin doz gösterge penceresi resimde görüldüğü gibi O pozisyonundadır.
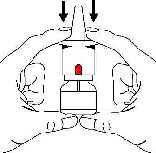
■ İlk olarak koruyucu kapağı çıkarınız
■ Nazal spreyi dik olarak bir ya da iki elinizle tutunuz ve pompanın üzerine
3 kez basınız.
Bu sayede damlatma tübündeki hava dışarı atılacak ve yeni spreyin kullanımına hazır hale gelmesinde ilk aşama tamamlanacaktır. Bu işlem sadece bir kez ve
yeni bir şişe kullanmaya başlamadan önce yapılmalıdır.
Az miktarda ilaç spreyle atılırsa endişelenmeyiniz, bu normaldir.
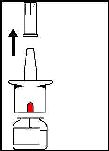
s
Pompayı bastırırken doz gösterge penceresindeki değişiklikleri seyrediniz.
^ n ^ n ^ n
Doz gösterge penceresi yeşil olduğunda yeni nazal spreyiniz kullanıma hazırdır.
"Nazal Spreyinizin Kullanımı" bölümündeki talimatlara uyunuz.
Koruyucu kapağın çıkarılmasından sonra başınızı hafif öne eğiniz ve burunluğu burun deliklerinizden birine yerleştiriniz. Nazal spreyi resimde görüldüğü gibi mümkün olduğunca dik tutmaya çalışınız. Pompayı kuvvetlice
sadece bir kez basınız. Nazal spreyi burnunuzdan çıkarınız ve burun deliğinizden derin bir nefes alarak ilacın burnunuzda kalmasına yardımcı olunuz. Eğer doktorunuz bir seferde iki sıkım almanızı önermişse, bu işlemi diğer burun deliğinize de uygulayınız. Kullanımdan sonra burunluğu kuru bir kağıt mendille temizledikten sonra koruyucu kapağı takınız.
Göstergenin kontrolü
Nazal spreyi her kullanışınızda doz gösterge penceresindeki sayı değişecektir. Görülen sayı o ana kadar aldığınız sıkım sayısını gösterir. Nazal Sprey 14 ölçülü doz uygulama garantisindedir. 2 ilave doz almanız mümkün olabilir.
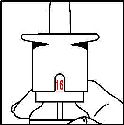
Resimde görüldüğü gibi doz gösterge penceresinde
kırmızı ^ görüldüğünde 16 sıkım kullanılmış demektir ve nazal spreyde ilaç bitmiştir. Nazal sprey şişesinde bir miktar sıvı görebilirsiniz ama bu normaldir.
Eğer sprey şişenizi nasıl kullanacağınızdan emin olamıyorsanız doktorunuza ya da eczacınıza danışınız.
 Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir.
Belsoğukluğu, Chlamydia ve Frengi
Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki
yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve
boğazda enfeksyona sebep olabilir. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| CALCİTONİNA | 8699650541272 | |
| CALSYNAR | 8699809540279 | |
| MIACALCIC | 8699504750409 | |
| NYLEX | 8699538545811 | |
| TONOCALCIN | 8699564752849 | |
| Diğer Eşdeğer İlaçlar |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504540413 |
| Etkin Madde | Salmon Kalsitonini |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |