MICTONORM 5 mg kaplı tablet (98 kaplı tablet) Kısa Ürün Bilgisi
{ Propiverin Hcl }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
MİCTONORM® 5 mg kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Propiverin hidroklorür 5 mg (4,55 mg propiverine eşdeğer)
Yardımcı maddeler
Laktoz monohidrat (sığır sütünden elde edilmiştir) 33,562 mg Glukoz monohidrat 0,31 mg
Sukroz 24,49 mg
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kaplı tablet
Beyaz renkte, bikonveks, kaplı tabletler
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
MİCTONORM, aşırı aktif mesane veya transvers lezyon paraplejisi gibi omurilik yaralanmalarına bağlı nörojenik detrüsör aşırı aktivitesi (detrüsör hiperrefleksi) olan hastalarda, ani idrar sıkışması ve sık idrara çıkma ve/veya idrar tutamama problemlerinin semptomatik tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
MİCTONORM 5 mg kaplı tablet vücut ağırlığı 35 kg'ın altındaki yetişkin, ergen ve çocukların kullanımı için geliştirilmiştir. Vücut ağırlığı 35 kg'ın üzerinde olan yetişkinler için MİCTONORM 15 mg kaplı tablet, MİCTONORM SR 30 mg Sürekli Salımlı Kapsül veya MİCTONORM SR 45 mg Sürekli Salımlı Kapsül önerilmektedir. Lütfen ilgili ürünlere ait KÜB bilgilerini inceleyiniz.
Pozoloji/uygulama sıklığı ve süresi
Yetişkinlerde:
Standart doz olarak; günde iki defa 15 mg propiverin hidroklorür alınması tavsiye edilmektedir. Bu doz günde üç defaya kadar çıkartılabilir. Bazı hastalar günde 15 mg (3 x 5 mg) gibi düşük bir doza da cevap verebilmektedir.
Nörojenik detrüsör aşırı aktivitesi için, günde üç defa 15 mg propiverin hidroklorür alınması
tavsiye edilir. Önerilen maksimum günlük doz 45 mg ‘dır.
Çocuklarda:
Günde ortalama 0,8 mg/kg vücut ağırlığındaki doz, 2 ya da 3'e bölünmüş olarak uygulanır. Vücut ağırlığı 35 kg'ın üzerinde olan çocuklarda maksimum doz, yetişkinlerde kullanılan standart kullanım dozu olan günde 2 defa 15 mg'dır (2 x 3 MİCTONORM 5 mg).
5 yaşından küçük çocuklarda gelişme süreci henüz tamamlanmadığından, MİCTONORM ile aşırı aktif mesane tedavisine başlanmamalıdır.
Omurilik yaralanmalarına bağlı nörojenik detrüsör aşırı aktivitesinin tedavisi ise, 5 yaşından küçük çocuklara da uygulanabilir.
Çocukların tedavisi, sadece genel bir terapötik yaklaşım çerçevesinde uygulanmalıdır (örneğin idiyopatik mesane aşırı aktivitesi durumunda "üroterapi" denilen).
Etkin madde
Önerilen dozlar vücut ağırlıkları temel alınarak, aşağıda yer alan tabloya göre belirlenebilir.
Vücut ağırlığı (kg) | MİCTONORM 5 mg kaplı tablet günlük doz |
12-16 | 1-0-1 |
17-22 | 1-1-1 |
23-28 | 2- 0-2 |
29-34 | 2-1-2 |
≥35 | 2 – 2 – 2 veya 3 – 0– 3 |
Uygulama şekli:
MİCTONORM oral kullanım içindir. Yemeklerden önce bir bardak su ile birlikte alınmalıdır. Çok yağlı yiyecekler, propiverinin biyoyararlanımını arttırmaktadır. Bu nedenle özellikle böbrek veya karaciğer yetmezliği olan hastalar, MİCTONORM'u yemeklerden önce almalıdır (Bkz. Bölüm 5.2).
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Hafif ve orta derecede böbrek yetmezliği olan hastalarda, doz ayarlaması gerekmemektedir ancak dikkatli bir şekilde tedavi edilmelidir. Ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <30 mL/dakika) önerilen maksimum günlük doz 30 mg'dır.
Karaciğer yetmezliği:
Hafif karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmemektedir; ancak tedavi dikkatle sürdürülmelidir. Orta veya ağır karaciğer yetmezliği olan hastalarda ise, bu tip hasta
grubunda propiverin uygulanmasının incelendiği herhangi bir çalışma gerçekleştirilmediğinden MİCTONORM kullanımı önerilmemektedir.
Pediyatrik popülasyon:
Propiverin hidroklorürün 1 yaşın altındaki çocuklarda güvenlilik ve etkililiği üzerine yeterli veri olmadığından, bu yaş grubunda kullanımı önerilmemektedir. 1 yaşın üzerindeki çocuklarda kullanımı için pozoloji /uygulama sıklığı ve süresi bölümüne bakınız.
Geriyatrik popülasyon:
Bu yaş grubunda doz ayarlaması gerekmemektedir. Doz yetişkinlerde olduğu gibidir (Bkz. Bölüm 5.2).
4.3. Kontrendikasyonlar
MİCTONORM aşağıdaki durumlarda kontrendikedir:
Propiverin veya ilaç bileşiminde yer alan yardımcı maddelerden herhangi birine karşı duyarlı olduğu bilinen kişilerde
Bağırsak obstrüksiyonu,
Üriner retansiyonun meydana gelebileceği önemli dereceli mesane çıkışı obstrüksiyonu
Miyastenia gravis
İntestinal atoni
Ciddi ülseratif kolit
Toksik megakolon
Kontrol edilememiş kapalı açılı glokom
Orta veya şiddetli karaciğer yetmezliği
Taşiartimi
4.4. Özel kullanım uyarıları ve önlemleri
Propiverin aşağıdaki rahatsızlıktan şikayetçi hastalarda dikkatli bir şekilde kullanılmalıdır:
Otonomik nöropati,
Böbrek yetmezliği (Bkz. Bölüm 4.2)
Karaciğer yetmezliği (Bkz. Bölüm 4.2)
Propiverin uygulamasını takiben aşağıda yer alan hastalıkların semptomları ağırlaşabilir;
Ciddi konjestif kalp yetmezliği (NYHA Evre IV)
Prostat hipertrofisi
Reflü özofajiti olan hastalardaki hiatüs hernisi (fıtık)
Kardiyak aritmi
Taşikardi
Diğer antikolinerjik ilaçlarda olduğu gibi propiverin de midriyazise neden olabilir. Bu nedenle, propiverinin, ön kamaradaki açının darlaşabileceği yetişkinlerdeki akut kapalı
açılı glokom başlatma riski artabilmektedir. Propiverin de dahil olmak üzere, bu sınıfa ait
Propiverin ile tedaviye başlamadan önce, böbrek hastalığına ya da konjestif kalp yetmezliğine bağlı pollaküri ve noktüri ve ayrıca organik mesane hastalıkları (örn: idrar yolu enfeksiyonları, malignite) tedavi edilmelidir.
Bu tıbbi ürün laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün sukroz içerir. Nadir kalıtımsal früktoz intoleransı, glukoz-galaktoz malabsorpsiyon veya sukraz-izomaltaz yetmezliği problemi olan hastaların bu ilacı kullanmamaları gerekir.
Bu tıbbi ürün glukoz monohidrat içerir. Nadir glukoz-galaktoz malabsorpsiyon hastalığı olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Trisiklik antidepresanlar (örn: imipramin), trankilizanlar (örn: benzodiazepinler), antikolinerjikler (sistematik uygulandığında), amantadin, nöroleptikler (örn: fenotiyazinler) ve beta-adrenoseptör agonistler (beta-sempatomimetikler) ile birlikte kullanıldığında, propiverinin etkisi artar.
Kolinerjik ilaçlarla birlikte kullanıldığında, propiverinin etkisi azalır. İzoniazid ile tedavi edilen hastalara propiverin uygulandığında, kan basıncında azalma görülür. Propiverin, metoklopramid gibi prokinetiklerin etkisini azaltabilir.
Sitokrom P450 3A4 (CYP 3A4) tarafından metabolize edilen diğer ilaçlar ile farmakokinetik etkileşimler olasıdır. Ancak, klasik enzim inhibitörleri ile (ör: ketokonazol ya da greyfurt suyu) karşılaştırıldığında propiverinin etkileri az olduğundan bu tip ilaçların konsantrasyonlarda belirgin bir artış beklenmemektedir. Propiverin, zayıf bir CYP 3A4 inhibitörü olarak düşünülebilir.
Eş zamanlı olarak, azol antifungaller (ör: ketokonazol, itrakonazol) ya da makrolid antibiyotikler (örn.: eritromisin, klaritromisin) gibi güçlü CYP 3A4 inhibitörlerini alan hastalar üzerinde farmakokinetik çalışmalar yapılmamıştır.
Metimazolle kombine halde CYP 3A4'ün potent inhibitörleri olan ilaçlarla eşzamanlı tedavi alan hastalar
Potent CYP 3A4/5 inhibitörleriyle metimazol gibi potent flavin-içeren monoksijenaz (FMO) inhibitörlerini kombine kullanan hastalarda, tedavi önerilen en düşük dozda başlamalıdır. Doz daha sonra yükseltilebilir. Ancak dikkatli kullanılmalıdır ve doktorlar hastaları yan etkiler açısından dikkatlice izlemelidir (Bkz. Bölüm 5.2).
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Herhangi bir veri bulunmamaktadır.
Gebelik dönemi
MİCTONORM'un gebe kadınlarda kullanımına ilişkin veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Propiverin kullanımı hamilelik süresince önerilmemektedir.
Laktasyon dönemi
Propiverinin veya metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Hayvan çalışmalarından elde edilen mevcut farmakodinamik/toksikolojik veriler propiverin veya metabolitlerinin süte geçtiğini göstermiştir (Bkz. Bölüm 5.3). Yeni doğanda veya infantta bu risk göz ardı edilemez. Emzirmenin çocuğa yararları ile hastanın tedaviden göreceği yarar dikkate alınarak emzirmenin veya propiverin tedavisinin durdurulması yönünde bir karar verilmesi gerekmektedir.
Üreme yeteneği/Fertilite
Propiverinin insan fertilitesi üzerine etkilerine dair veri bulunmamaktadır. Hayvan çalışmaları fertilite üzerine doğrudan ya da dolaylı zararlı etkiler göstermemektedir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı kabiliyeti üzerine herhangi bir çalışma yapılmamıştır.
Propiverin, uyuşukluğa ve bulanık görüşe neden olabilir. Bu durum makine ya da motorlu araç kullanımı ya da tehlikeli işlerde çalışılması gibi mental dikkat gerektiren aktivitelerin yapılma kabiliyetini etkileyebilir
Sedatif ilaçlar, propiverin hidroklorür kullanımına bağlı uyuşukluk durumunu artırıcı etki gösterirler.
4.8. İstenmeyen etkiler
Propiverin ile ilişkili olası istenmeyen etkiler sistem organ sınıfına ve aşağıdaki sıklık sıralamasına göre listelenmiştir:
Çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
İstenmeyen etkilerin tümü geçicidir ve dozun azaltılması ya da tedavinin sonlandırılmasından sonraki, en fazla 1–4 gün içinde kaybolur.
Bağışıklık sistemi hastalıkları
Seyrek: Hipersensitivite
Psikiyatrik hastalıklar
Çok seyrek: Huzursuzluk, konfüzyon
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Yaygın olmayan: Baş dönmesini de içeren sersemlik hali, tremor, tat alma duyusunda değişiklikler
Bilinmiyor: Konuşma bozuklukları
Göz hastalıkları
Yaygın: Akomodasyon bozuklukları, görüş anormallikleri
Kardiyak hastalıklar
Seyrek: Taşikardi
Çok seyrek: Palpitasyon
Vasküler hastalıklar
Yaygın olmayan: Kızarıklık, uyuşuklukla beraber seyreden düşük kan basıncı
Gastrointestinal hastalıklar
Çok yaygın: Ağız kuruluğu
Yaygın: Karın ağrısı, dispepsi, konstipasyon Yaygın olmayan: Bulantı, kusma
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Kaşıntı Seyrek: Döküntü
Böbrek ve idrar hastalıkları
Yaygın olmayan: Üriner retansiyon, mesane ve üretral semptomlar
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Yorgunluk, bitkinlik
Pediyatrik popülasyon:
Ek olarak çocuklar üzerinde yapılan klinik çalışmalarda iştahsızlık, uyku bozuklukları ve konsantrasyon bozuklukları bildirilmiştir.
Uzun süreli tedavi esnasında, nadir vakalarda karaciğer enzimlerinde geri dönüşümlü değişiklikler oluşabileceğinden, karaciğer enzimleri izlenmelidir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine
olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye
Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0800 314 00 08; faks: 0312 218 35 99).
4.9. Doz aşımı ve tedavisi
Semptomlar
Muskarinik reseptör antagonisti olan propiverin ile doz aşımı potansiyel olarak şiddetli antikolinerjik etkiler oluşturabilir. Aşağıda yer alan periferik ve merkezi sinir sistemi bozukları meydana gelebilir:
Şiddetli ağız kuruluğu
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Ürolojikler / Sık işeme ve üriner inkontinans tedavisinde kullanılan ilaçlar
ATC Kodu: G04BD06
Etki Mekanizması
Propiverin, kalsiyumun içeri alımını inhibe eder ve muskulotropik spazmolize neden olan mesane düz kas hücrelerinde hücre içi kalsiyumun modülasyonunu engeller.
Propiverin antikolinerjik etkiye bağlı olarak pelvik sinirin efferent bağlantısını da inhibe eder.
Farmakodinamik etkiler
Hayvan modellerinde propiverin hidroklorür, intravezikal basınçta doza bağlı azalmaya ve mesane kapasitesinde artışa neden olur. Bu etki, propiverinin ve ayrıca insan ve hayvan kaynaklı izole detrusor şeritlerde gösterilen üç aktif üriner metabolitinin, farrnakolojik özelliklerinin toplamına dayanmaktadır.
Pediyatrik popülasyon
Randomize, plasebo kontrollü, çift kör bir faz-III çalışmasında, çocuklarda propiverin kullanılması ile anlamlı etkililik (inkontinans ataklarında azalma ve işeme sıklığı, boş hacimde artış) gösterilmiştir.
5.2. Farmakokinetik özellikler
Genel özellikler:Etkin madde
Propiverin'in gastrointestinal sistem tarafından hemen hemen tamamı absorbe edilir. Büyük oranda ilk geçiş metabolizmasına uğrar. Mesane düz kas hücreleri üzerindeki etkileri ana bileşene ve aynı zamanda idrara hızla atılan üç aktif metabolitine bağlıdır.
Emilim:
15 mg propiverin hidroklorürün oral alımını takiben propiverin, 2,3 saatten sonra ulaşılan maksimum plazma konsantrasyonları ile birlikte gastrointestinal sistem tarafından hızla absorbe edilir. Propiverin hidroklorür 15 mg'ın ortalama mutlak biyoyararlanımı %40,5'tir (EAA (p.o) /EAA(i.v) için aritmetik ortalama değer).
Yiyecek alımı propiverinin biyoyararlanımını arttırır (ortalama artış 1,3 kat), ancak propiverinin ya da onun ana metaboliti olan propiverin-N-oksitin maksimum plazma konsantrasyonlarını önemli ölçüde etkilemez. Biyoyararlanımdaki bu farklılık klinik olarak anlamlı değildir fakat böbrek ve karaciğer yetmezliği olan hastalarda gıda alımı ile ilişkili olarak doz ayarlaması yapmak gerekebilir. Bu nedenle ilacın düzenli olarak yemeklerden önce alınması önerilmektedir.
Dağılım:
Günde üç defa 15 mg propiverin hidroklorür alımından sonra, tek bir doz uygulamasına nazaran daha yüksek bir konsantrasyonda 4 ile 5 gün içerisinde kararlı duruma ulaşılır (C=61 ng/mL).
21 sağlıklı gönüllüde intravenöz propiverin hidroklorür uygulaması sonrasında dağılım hacmi 125-473 litre (ortalama 279 litre) olarak tahmin edilmiştir. Bu da propiverin hidroklorürün büyük bir kısmının periferal kompartmanlara ulaştığını göstermektedir. Plazma proteinlerine bağlanma, ana bileşen için %90-95 ve ana metabolit için yaklaşık %60'tır.
16 sağlıklı gönüllüye 15 mg propiverin hidroklorür'ün tek doz ve tekrarlayan dozlarla
tek doz çoklu doz
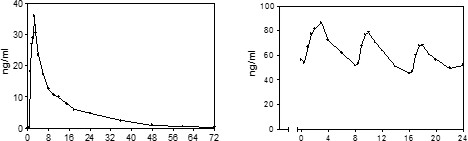
Zaman (saat) Zaman (saat)
16 sağlıklı gönüllüye 15 mg propiverin hidroklorür'ün çoklu-doz uygulanması (6 gün süreyle günde 3 defa) sonrasında, propiverin kararlı durum karakteristikleri:
Doz aralığı (saat) | EAA | PTF | C | |||
[ng.h/mL] | CV [%] | [%] | CV [%] | [ng/mL] | CV [%] | |
0 -8 | 515 | 35 | 57 | 16 | 64 | 36 |
8 -16 | 460 | 33 | 70 | 25 | 57 | 33 |
16 -24 | 421 | 36 | 52 | 39 | 52 | 36 |
CV: varyasyon katsayısı PTF: vadi-tepe dalgalanması | ||||||
Biyotransformasyon:
Propiverin, bağırsak ve karaciğer enzimleri tarafından büyük oranda metabolize edilir. Başlıca metabolik yol, piperidil-N'in oksidasyonunu içerir. Piperidinil-N'in oksidasyonu, CYP 3A4 ve flavin-içeren monoksijenaz (FMO) 1 ve 3 ile yürütülür ve bu oksidasyonun sonucunda daha az etkili olan N-oksit oluşur. N-oksitin plazma konsantrasyonu ana metabolitinkinden fazladır. İdrarda dört metabolit tanımlanmıştır: bunlardan üçü farmakolojik olarak aktiftir ve MİCTONORM terapötik etkinliğine katkıda bulunabilmektedir.
Terapötik plazma konsantrasyonlarının 10 ila 100 katı üzerine çıkıldığında in vitro olarak CYP 3A4 ve CYP 2D6 enzimlerinin hafif inhibisyonu tespit edilmiştir (Bkz. Bölüm 4.5).
Eliminasyon:
Sağlıklı gönüllülerde, karbon 14'le işaretlenen 30 mg propiverin hidroklorür, oral yoldan bir doz olarak alındıktan sonra ilacın yaklaşık %60'si idrarla ve yaklaşık %21'i de ilacın kullanılmasından sonraki 12 gün içinde dışkı ile vücuttan atılır. Bir oral dozun %1'den daha az bir kısmı idrarla değişime uğramadan atılmaktadır. Tek bir 30 mg doz alımından sonra ortalama toplam klerens 371 mL/dk'dır (191–870 mL/dk). Toplam 37 sağlıklı gönüllü üzerinde yapılan üç çalışmanın sonucunda tespit edilen ortalama yarılanma ömürleri sırasıyla 14,1, 20,1 ve 22,1 saattir.
Doğrusallık/Doğrusal olmayan durum:
Oral yolla 10-30 mg propiverin hidroklorür uygulanmasını takiben propiverin ve propiverin- N-oksitin farmakokinetik parametreleri doza bağlı olarak doğrusaldır. Tek doz uygulama ile karşılaştırıldığında kararlı durum sırasındaki farmakokinetiğinde değişiklik olmamıştır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Kreatinin klerensi <30 mL/dk olan 12 hasta üzerindeki tek doz çalışmasından elde edilen verilere göre, ciddi böbrek yetmezliği, propiverin ve başlıca metaboliti olan propiverin-N- oksidin dispozisyonunu önemli ölçüde etkilememektedir. Toplam günlük doz 30 mg'ı geçmediği sürece herhangi bir doz ayarlaması önerilmez. Yüksek doz uygulamasının yapılması gerektiği durumlarda, antikolinerjik etkilerin tolere edilebilirlik belirtisi olduğu göz önünde bulundurularak dozun dikkatli şekilde titrasyonu önerilir.
Karaciğer yetmezliği:
Karaciğer yağlanmasına bağlı olarak hafif ila orta derecede karaciğer fonksiyon bozukluğu olan 12 hastanın kararlı durum farmakokinetikleri, 12 sağlıklı gönüllüden oluşan kontrol grubu ile benzer bulunmuştur. Ciddi karaciğer yetmezliğine ilişkin veri bulunmamaktadır.
Pediyatrik hastalar:
Çocuklarda yapılan bir doz artışı çalışması, günde ortalama 0,8 mg / kg vücut ağırlığı için etkinlik ve tolerabilite arasında dengeli bir ilişki olduğunu göstermiştir. Önerilen doz aralığına kadar, farmakokinetik özellikler (örn., AUC, C, C) doza orantılıdır. Günde 2 defa 0,4 mg / kg vücut ağırlığı dozun uygulanmasından sonra, 5-10 yaş arası çocuklarda serum seviyeleri, yetişkinlerde günde iki kez 15 mg propiverin hidroklorürün terapötik dozunun uygulanmasıyla yaklaşık olarak aynı değerlere ulaşmaktadır.
Geriyatrik hastalar:
Kararlı durumda (propiverin hidroklorür 15 mg günde 3 defa, 28 gün boyunca) vadi plazma konsantrasyonları karşılaştırıldığında yaşlı hastalar (60-85 yaş; yaş ortalaması 68) ve genç sağlıklı gönüllüler arasında fark görülmemiştir. Ana ilacın metabolite oranı yaşlı hastalarda değişmeden kalmıştır. Bu durum propiverinin ana metaboliti olan propiverin-NÂ okside metabolik dönüşümünün yaşa bağlı ya da atılımı sınırlandırıcı bir aşama olmadığını göstermektedir.
Glokomlu hastalar:
7 gün süreyle günde 3 defa uygulanan propiverin hidroklorür 15 mg ile tedavi, açık açılı glokomlu hastalarda ve tedavi altındaki (kontrollü) kapalı açılı glokomlu hastalarda intraoküler basıncın artmasına neden olmamaktadır. Bu durum yapılan iki plasebo-kontrollü çalışma ile gösterilmiştir.
5.3. Klinik öncesi güvenlilik verileri
İki memeli türünde yapılan uzun süreli oral doz çalışmalarında ana tedavi ile ilişkili etki olarak karaciğerdeki değişimler (karaciğer enzimlerinde artış gibi) tespit edilmiştir. Karaciğerdeki değişimler, karaciğer hipertrofisi ve yağ dejenerasyonu olarak tanımlanmıştır.
Yağ dejenerasyonu, tedavinin kesilmesi ile geri dönüşlü olmuştur.
Doküman https://www.turkiye.gov.tr/saglik-titck-ebys
Sıçanlarda gerçekleştirilen toksikolojik çalışmalarda erkek ve dişi fertilitesi ile üreme davranışları üzerine herhangi bir etki görülmemiştir
Hayvan çalışmalarında, propiverin gebe dişilere oral yolla yüksek dozlarda uygulandığında, yavrularda iskelet gelişiminde gerileme gözlenmiştir. Emziren memelilerde propiverin anne sütüne geçmektedir.
Mutajenite ile ilgili herhangi bir kanıt yoktur. Erkek farelerde yapılan yüksek doz karsinojenite çalışmalarında hepatoselüler adenom ve karsinom insidansında artış meydana gelmiştir. Sıçanlar üzerinde yapılan karsinojenite çalışmasında, yüksek doz alan erkek sıçanlarda hepatoselüler adenoma, böbrek adenomu ve mesane papillomu görülürken, dişi sıçanlarda yüksek doz seviyelerinde endometriyal stromal polipler artmıştır. Hem sıçan hem de fare tümörlerinin türe spesifik olduğu düşünüldüğü için klinik ile ilişkili olmadığına karar verilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (sığır sütünden elde edilmiştir) Selüloz tozu
Magnezyum stearat Kalsiyum karbonat Sukroz
Glukoz monohidrat Akasya zamkı Makrogol 6000
Titanyum dioksit (E171) Koloidal susuz silika Talk
Ağır kaolin
6.2. Geçimsizlikler
Bilinen herhangi bir geçimsizliği yoktur.
6.3. Raf ömrü
60 ay
6.4. Saklamaya yönelik özel tedbirler
25ºC altındaki oda sıcaklığında saklayınız. Orijinal ambalajında saklayınız.
6.5. Ambalajın niteliği ve içeriği
MİCTONORM 5 mg kaplı tablet, 98 kaplı tablet içeren PVC/ PVDC/ Al blisterlerde.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Ürünlerin Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| INCONT | 8699536170084 | 996.48TL |
| MICTONORM | 8699559120141 | 923.65TL |
| PROVEREL | 8699569092025 | |
| Diğer Eşdeğer İlaçlar |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Mide Kanseri Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Recordati İlaç Sanayi ve Ticaret A.Ş.
| Satış Fiyatı | 506.21 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 506.21 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699559120165 |
| Etkin Madde | Propiverin Hcl |
| ATC Kodu | G04BD06 |
| Birim Miktar | 5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 98 |
| Ürogenital Sistem ve Cinsiyet Hormonları > DİĞER ÜROLOJİK ÜRÜNLER > Propiverin |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |