MYLOTARG 5 mg infüzyonluk çözelti HAZIRLAMADA KULLANILACAK konsantre için toz (1 flakon) Farmakolojik Özellikler
{ Gemtuzumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar ve antikor ilaç konjugatları, diğer monoklonal antikorlar ve antikor ilaç konjugatları
ATC kodu: L01FX02.
Etki mekanizması
Gemtuzumab ozogamisin, CD33-hedefli bir antikor ilaç konjugatı (ADC)'dir. Gemtuzumab, özellikle insan CD33'ünü tanıyan bir hümanize immünoglobulin sınıf G alt tip 4 (IgG4) antikorudur. Antikor bölümü, miyeloid lösemik blastların veya miyelomonositik seri immatür normal hücrelerin yüzeyinde bulunan, fakat normal hematopoetik kök hücrelerinin yüzeyinde bulunmayan, siyalik aside bağımlı bir adhezyon proteini olan CD33 antijenine özel olarak bağlanır. Küçük molekül, N-asetil-gama- kalikeamisin, sitotoksik yarı sentetik bir doğal üründür. N-asetil-gama-kalikeamisin, bir AcBut (4-(4- asetilfenoksi) bütanoik asit) bağlayıcı aracılığıyla antikora kovalent olarak bağlanır. Klinik olmayan veriler gemtuzumab ozogamisinin antikanser aktivitesinin; ADC'nin CD33- ekprese eden kanser hücrelerine bağlanmasının, ADC-CD33 kompleksinin hücre içine alınması sonrası bağlayıcının hidrolitik yolla parçalanmasıyla N-asetil-gama-kalikeamisin dimetilhidrazidin hücre içinde serbest kalması yoluyla olduğunu göstermektedir. N-asetil-gama-kalikeamisin dimetilhidrazidin aktivasyonu, çift sarmallı DNA kırılmalarına neden olur ve sonrasında hücre döngüsünü durdurma ve apoptotik hücre ölümünü tetikler.
Kalikeamisinin lösemik blast hücrelerine en yüksek düzeydeiletilmesi için, CD33 antijenik bölgelerinin yüksek bir yüzdesinin satürasyonunun gerekeceği kabul edilmektedir. Çeşitli monoterapi çalışmalarda, relaps ya da refrakter AML'li hastalarda MYLOTARG dozu sonrasındaki CD33 satürasyonu ölçülmüştür. Tüm çalışmalarda, 2 mg/m² ve üstü düzeylerdeki MYLOTARG dozunun ardındanen yüksek değere yakın periferik CD33 satürasyonu gözlenmiştir, bu da düşük bir gemtuzumab ozogamisin dozunun mevcut tüm CD33 bölgelerini bağlamak için yeterli olduğunu göstermektedir.
Klinik etkililik ve güvenlilik
De novo AML'li olup daha önce tedavi edilmeyen hastalar üzerindeki ALFA-0701 çalışması
Daunorubisin ve sitarabinden (DA) oluşan standart bir kemoterapi indüksiyonuna MYLOTARG eklenmesinin, tek başına DA ile karşılaştırıldığı çok merkezli, randomize, açık etiketli bir Faz 3 çalışmasında, MYLOTARG'ın etkililiği ve güvenliliği değerlendirilmiştir. Uygun hastalar, de novo AML'li olup daha önce tedavi edilmeyen 50 ve 70 yaş arasındaki kişiler olmuştur (ALFA-0701 Çalışması). Akut promiyelositik lösemili hastalar (APL, AML3) ve miyelodisplastik sendrom kaynaklı AML hastaları (MDS) ya da ikincil AML'li hastalar çalışmanın dışında tutulmuştur.
Birincil sonlanım noktası, olaysız sağkalım (EFS) olmuştur. İkincil sonlanım noktaları CR ve CRp oranlarını, relapssız sağkalımı (RFS), genel sağkalımı (OS) ve MYLOTARG dahil edildiğinde veya edilmediğine kombinasyon DA'nın güvenliliği olmuştur.
Bu çalışmada, 135'i 3+7 DA ile birlikte fraksiyone 3 mg/m à 3 doz MYLOTARG ve 136'sı tek başına 3+7 DA indüksiyon tedavisiyle, toplamda 271 hasta randomize edilmiştir (bkz. Bölüm 4.2). Randomizasyon koluna bakılmaksızın, DA olarak uygulanan ancak MYLOTARG içermeyen ikinci bir indüksiyon kürüne izin verilmiştir. Bu iki koldan birinde yer alan, ikinci indüksiyon tedavisi kürünü almayan ve indüksiyonun ardından bir CR elde etmeyen hastalar, idarubisin, AraC ve granülosit koloni stimüle edici faktörden (G-CSF) oluşan bir kurtarma kürü alabilmiştir.
CR veya CRp'li hastalar, ilk randomizasyonlarına göre MYLOTARG dahil edilerek veya edilmeyerek DNR ve AraC'yi içeren 2 tedavi kürüyle konsolidasyon tedavisi almıştır. Remisyona giren hastalar, allojenik transplantasyon için de uygun olmuştur. Son MYLOTARG dozu ve transplantasyon arasında en az 2 aylık bir süre olması önerilmiştir.
Genel olarak, hastaların medyan yaşı 62 olmuş (aralık 50 ila 70 yaş) ve çoğu hastanın (% 87,8) Doğu Kooperatif Onkoloji Grubu (Eastern Cooperative Oncology Group) performans durumu (ECOG PS) başlangıçta 0 ila 1 olmuştur. Tedavi kolları arasında başlangıçtaki özellikler dengeli olmuştur, bunun tek istisnası olan cinsiyette, kaydolan erkek yüzdesi tek başına DA koluna (% 44,1) kıyasla MYLOTARG kolunda (% 54,8) daha yüksek olmuştur. Amerikan Ulusal Gelişmiş Kanser Ağı (National Comprehensive Cancer Network) (NCNN) ve European LeukaemiaNet (ELN) 2010 risk sınıflandırmalarıyla, toplamda hastaların sırasıyla % 59'unda ve % 65,3'ünde iyi/orta riskli hastalık belgelenmiştir. Yerel laboratuvar sonuçlarından uyumlu hale getirilen akım sitometrisiyle, AML blastları üzerindeki CD33 ekspresyonu toplamda 194/271 (% 71,6) hastada belirlenmiştir. Az sayıda hastada (% 13,7) CD33 ekspresyonu düşük bulunmuştur (blastların % 30'undan azı).
Çalışmada, de novo AML'li olup daha önce tedavi edilmemiş hastalar için standart indüksiyon kemoterapisine fraksiyone dozlarda eklenen MYLOTARG'ın (3 mg/m à 3 doz) EFS'de istatistiksel açıdan önemli ve klinik açıdan anlamlı iyileşmeye yol açtığı ortaya konarak, birincil sonlanım noktasına ulaşılmıştır. Medyan EFS, MYLOTARG kolunda 17,3 ay (% 95 GA: 13,4-30) ve tek başına DA kolunda 9,5 ay (% 95 GA: 8,1-12) olmuştur; tehlike oranı (HR) 0,562 (% 95 GA: 0,415-0,762); log-rank testiyle 2-yönlü p=0,0002. ALFA-0701 çalışmasında elde edilen etkililik verileri Tablo 6'da özetlenmektedir ve EFS için Kaplan-Meier grafiği Şekil 1'de sunulmaktadır.
Tablo 6. ALFA 0701 çalışmasından etkililik sonuçları (mITT popülasyonu)
| MYLOTARG + daunorubisin + sitarabin |
Daunorubisin + sitarabin |
Olaysız sağkalım (Araştırmacı incelemesi) | N=135 | N=136 |
Olay sayısı, n (%) | 73 (54,1) | 102 (75) |
Medyan EFS (ay olarak) [% 95 GA] | 17,3 [13,4-30] | 9,5 [8,1-12] |
2 yıllık EFS olasılığı [% 95 GA] | 42,1 [32,9-51] | 18,2 [11,1-26,7] |
3 yıllık EFS olasılığı [% 95 GA] | 39,8 [30,2-49,3] | 13,6 [5,8-24,8] |
Tehlike oranı [% 95 GA] | 0,562 [0,415, 0,762] |
|
p-değeri | 0,0002 |
|
Relapssız sağkalım (Araştırmacı incelemesi) |
N=110 |
N=100 |
Olay sayısı, n (%) | 49 (44,5) | 66 (66) |
Medyan RFS (ay olarak) [% 95 GA] | 28 [16,3-NE] | 11,4 [10-14,4] |
Tehlike oranı [% 95 GA] | 0,526 [0,362-0,764] |
|
p-değeri | 0,0006 |
|
Genel sağkalım | N=135 | N=136 |
Ölüm sayısı, n (%) | 80 (59,3) | 88 (64,7) |
Medyan OS (ay olarak) [% 95 GA] | 27,5 [21,4-45,6] | 21,8 [15,5-27,4] |
Tehlike oranı [% 95 GA] | 0,807 [0,596-1,093] |
|
p-değeri | 0,1646 |
|
Yanıt oranı (Araştırmacı incelemesi) | N=135 | N=136 |
Genel yanıt % [% 95 GA] | 81,5 [73,89-87,64] | 73,5 [65,28-80,72] |
CR | 70,4 | 69,9 |
CRp | 11,1 | 3,7 |
Risk farkı [% 95 GA] | 7,95[-3,79-19,85] |
|
p-değeri | 0,1457 |
|
EFS'nin ana tanımına dayanılarak: Araştırmacı değerlendirmesiyle belirlenen olay tarihleri (indüksiyon başarısızlığı, relaps ya da ölüm).
mITT popülasyonu, tedaviye başlanmadan önce onamın geri çekilmediği takdirde randomize edilen ve ilk randomizasyon koluna göre analiz edilen tüm hastaları içermiştir.
Kısaltmalar: CR=Tam remisyon; CRp=Tamamlanmamış trombosit düzelmesiyle tam remisyon; GA=Güven aralığı; EFS=Olaysız sağkalım; mITT=Modifiye ITT; n=Sayı; N=Sayı; NE=Tahmin edilemez; OS=Genel sağkalım; RFS=Relapssız sağkalım.
Sağkalım Olasılığı
Şekil 1. ALFA-0701 çalışmasından araştırmacı değerlendirmesiyle Kaplan-Meier olaysız sağkalım grafiği (mITT popülasyonu)
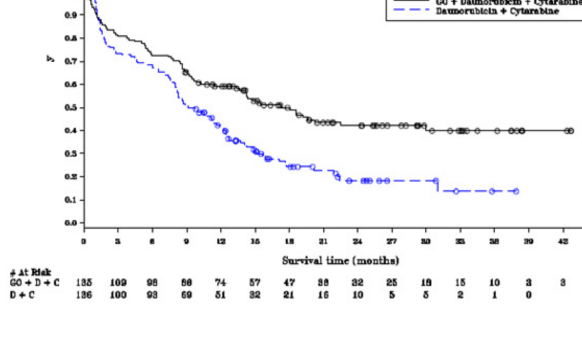
Notlar: Daireler, sansürlenen gözlemleri belirtmektedir.
D + C, Daunorubisin + Sitarabin'i ifade etmektedir.
Sağkalım süresi (Ay)
- GO + Daunorubisin + Sitarabin
- Daunorubisin + Sitarabin
Kısaltmalar: C=Sitarabin; D=Daunorubisin; GO=Gemtuzumab ozogamisin; mITT= Modifiye ITT.
Advers risk sitogenetikleriyle AML'de kullanım
ALFA-0701 çalışmasındaki alt grup analizlerinde, standart kombine kemoterapiye MYLOTARG eklenmesiyle, advers risk sitogenetikleri olan hasta alt grubunda EFS'de iyileşme olmamıştır (HR 1,11; % 95 GA: 0,63-1,95). Sitogenetik risk sınıflandırması ve sitogenetik/moleküler risk sınıflandırmasıyla analiz edilen EFS ve OS, aşağıda Tablo 7'da ve 8'de sunulmaktadır.
Tablo 7. ALFA-0701 çalışmasından AML risk sınıflandırmalarıyla araştırmacı değerlendirmesinden olaysız sağkalım (mITT Popülasyonu)
| MYLOTARG + daunorubisin + sitarabin | Daunorubisin + sitarabin |
Sitogenetik (iyi/orta), N | 94 | 95 |
Olay sayısı, n (%) | 44 (46,8) | 68 (71,6) |
Medyan EFS (ay olarak) [% 95 GA] | 22,5 [15,5-NE] | 11,6 [8,3-13,7] |
Tehlike oranı [% 95 GA] | 0,460 [0,313-0,676] |
|
p-değeri | < 0,0001 |
|
Sitogenetik (advers), N | 27 | 30 |
Olay sayısı, n (%) | 23 (85,2) | 26 (86,7) |
Medyan EFS (ay olarak) [% 95 GA] | 4,5 [1,1-7,4] | 2,8 [1,6-8,7] |
Tehlike oranı [% 95 GA] | 1,111 [0,633-1,949] |
|
p-değeri | 0,7151 |
|
ELN (iyi/orta), N | 86 | 91 |
Olay sayısı, n (%) | 40 (46,5) | 63 (69,2) |
Medyan EFS (ay olarak) [% 95 CI] | 22,5 [15,5-NE] | 12,2 [8,5-14,3] |
Tehlike oranı [% 95 GA] | 0,485 [0,325-0,724] |
|
p-değeri | 0,0003 |
|
ELN (zayıf/advers), N | 37 | 36 |
Olay sayısı, n (%) | 27 (73) | 32 (88,9) |
Medyan EFS (ay olarak) [% 95 GA] | 7,4 [3,7-14,3] | 4 [1,7-8,6] |
Tehlike oranı [% 95 GA] | 0,720 [0,430-1,205] |
|
p-değeri | 0,2091 |
|
ALFA-0701 çalışması, MYLOTARG'ın alt gruplardaki faydasını geleceğe yönelik olarak değerlendirmek için tasarlanmamıştır; analiz yalnızca tanımlayıcı amaçlarla sunulmuştur.
EFS'nin ana tanımına dayanılarak: Araştırmacı değerlendirmesiyle belirlenen olay tarihleri (indüksiyon başarısızlığı, relaps ya da ölüm).
mITT popülasyonu, tedaviye başlanmadan önce onamın geri çekilmediği takdirde randomize edilen ve ilk randomizasyon koluna göre analiz edilen tüm hastaları içermiştir.
Kısaltmalar: AML=Akut miyeloid lösemi; GA=Güven aralığı; EFS=Olaysız sağkalım; ELN=European LeukaemiaNet; mITT= Modifiye ITT; n=Sayı; N=Sayı; NE=Tahmin edilemez.
Tablo 8. ALFA-0701 çalışmasından AML risk sınıflandırmalarıyla genel sağkalım (mITT Popülasyonu)
| MYLOTARG + daunorubisin + sitarabin | Daunorubisin + sitarabin |
Sitogenetik (iyi/orta), N | 94 | 95 |
Ölüm sayısı, n (% ) | 51 (54,3) | 57 (60) |
Medyan OS (ay olarak) [% 95 GA]a | 38,6 [24,4-NE] | 26 [18,9-39,7] |
Tehlike oranı [% 95 GA]b | 0,747 [0,511-1,091] |
|
p-değeric | 0,1288 |
|
Sitogenetik (advers), N | 27 | 30 |
Ölüm sayısı, n (% ) | 24 (88,9) | 24 (80) |
Medyan OS (ay olarak) [% 95 GA]a | 12 [4,2-14,2] | 13,5 [9,4-27,3] |
Tehlike oranı [% 95 GA]b | 1,553 [0,878-2,748] |
|
p-değeric | 0,1267 |
|
ELN (iyi/orta), N | 86 | 91 |
Ölüm sayısı, n (% ) | 44 (51,2) | 53 (58,2) |
Medyan OS (ay olarak) [% 95 GA]a | 45,6 [25,5-NE] | 26,9 [19,3-46,5] |
Tehlike oranı [% 95 GA]b | 0,730 [0,489-1,089] |
|
p-değeric | 0,1216 |
|
ELN (zayıf/advers), N | 37 | 36 |
Ölüm sayısı, n (% ) | 31 (83,8) | 29 (80,6) |
Medyan OS (ay olarak) [% 95 GA]a | 13,2 [7-18,5] | 13,5 [10,8-19,8] |
Tehlike oranı [% 95 GA]b | 1,124 [0,677-1,867] |
|
p-değeric | 0,6487 |
|
ALFA-0701 çalışması, MYLOTARG'ın alt gruplardaki faydasını geleceğe yönelik olarak değerlendirmek için tasarlanmamıştır; analiz yalnızca tanımlayıcı amaçlarla sunulmuştur.
mITT popülasyonu, tedaviye başlanmadan önce onamın geri çekilmediği takdirde randomize edilen ve ilk randomizasyon koluna göre analiz edilen tüm hastaları içermiştir.
Kısaltmalar: AML=Akut miyeloid lösemi; GA=Güven aralığı; ELN=European LeukaemiaNet; mITT=Modifiye ITT; n=Sayı; N=Sayı; NE=Tahmin edilemez; OS=Genel sağkalım.
Pediyatrik popülasyon
Daha önce tedavi edilmemiş AML
1.063 adet yeni tanı konmuş AML'li çocuk (hastaların % 93,7'si < 18 yaş) ve genç yetişkinde (hastaların % 6,3'ü); ortalama yaş 8,9 (aralık: 0-29 yaş), tek başına standart kemoterapi veya MYLOTARG ile kombine kemoterapinin değerlendirildiği randomize bir çalışmada (COG AAML0531) de novo AML'li hastalar, tek başına standart 5 kürlük kemoterapiye veya aynı kemoterapiye indüksiyonun 1. küründe bir kez ve yoğun doz uygulamanın 2. küründe bir kez verilen 2 MYLOTARG dozu eklenerek (3 mg/m/doz) randomize edilmiştir. Çalışmada, yoğun kemoterapiye MYLOTARG eklenmesinin, de novo AML'de, daha düşük bir relaps riski sağlaması sayesinde EFS'yi iyileştirdiği (3 yıl: % 50,6'ya karşılık % 44; HR 0,838; % 95 GA: 0,706-0,995; p=0,0431) ortaya konmuştur ve MYLOTARG kolunda daha uzun OS eğilimi görülmüştür ancak bu, istatistiksel açıdan anlamlı olmamıştır (3 yıl: % 72,4'e karşılık % 67,6; HR 0,904; % 95 GA: 0,721-1,133; p=0,3799). Ancak, düşük riskli AML'li hastalarda yüksek toksisite (remisyon sonrası toksisite ile ilişkili mortalite) gözlendiği saptanmıştır ve bu, yoğun doz uygulamanın 2. küründe gemtuzumab ozogamisin aldıktan sonra gerçekleşen uzun süreli nötropeniye atfedilmiştir (bkz. Bölüm 4.2 ve 4.8). Genel olarak MYLOTARG kolundaki hastaların 29'u (% 5,5'i) ve karşılaştırma kolundaki 15 (% 2,8) hasta remisyon sırasında ölmüştür. Bu nedenle, pediyatrik hastalar için optimum gemtuzumab ozogamisin dozu belirlenmemiştir (bkz. Bölüm 4.2).
Relaps veya refrakter AML
Relaps veya refrakter AML'li pediyatrik hastalarda MYLOTARG'ı değerlendirmek için MYLOTARG'ı monoterapi (tek veya fraksiyone doz) veya kombinasyon olarak alan 454 hastayı kapsayan; yayınlanmış 16 makaleye ek olarak US Expanded Access Study çalışmalarının sistematik bir literatür taraması yapılmıştır (bkz. Bölüm 4.8). Bu çalışmalardaki hasta sayısı 5-105 arasında olup medyan çalışma büyüklüğü 15 hastadır. Genel en küçük ve en büyük yaş aralığı 0 ile 22,3 yaş arasında olup tedavi sırasında genel medyan yaş 8,7 olarak belirlenmiştir.
Çoğu çalışma, insani amaçlı ilaca erken erişim programı kapsamında (% 70,6) yapılmıştır. MYLOTARG, çalışmaların % 47,1'inde monoterapi, % 23,5'inde kombinasyon ve % 29.4'ünde monoterapi ve kombinasyon olarak verilmiştir. MYLOTARG'ın toplam dozu 1,8 mg/m ile 9 mg/m arasında değişmiştir. MYLOTARG kombinasyon olarak verildiğinde, 9 çalışmanın 8'inde sitarabin içeren bir tedavi rejimi kullanılmıştır. Çalışmaların % 23,5'inde hastaların büyük çoğunluğu fraksiyone (1, 4, 7. günlerinde 3 mg/m) MYLOTARG dozları alırken; çalışmaların % 35,3'ünde 3 mg/m'den yüksek dozlar verilmiştir. MYLOTARG çoğu çalışmada indüksiyon tedavisi olarak verilmiştir (% 82,4).
MYLOTARG monoterapisi ile yanıt oranı (CR/CRp/CRi; çalışmalar arasında ağırlıklı ortalama) fraksiyone dozlama (1 çalışma) ile % 33,3 ve fraksiyone olmayan dozlama (9 çalışma) ile % 24,3 olmuştur. Kombinasyon tedavisinde; yanıt oranı, fraksiyone olmayan MYLOTARG (3 çalışma) ile % 49 ve fraksiyone MYLOTARG (2 çalışma) ile % 38,8 olmuştur.
MYLOTARG için bilinen advers olaylar olan miyelosupresyon, enfeksiyonlar, genel VOD ve HKHN sonrası VOD ve ölüm hakkındaki güvenlilik bilgileri (bkz. Bölüm 4.8 ve Tablo 5) literatürden elde edilmiştir.
Bu analizin sınırlamaları, bazı çalışmaların küçük örneklem büyüklükleri, çalışmaların heterojenliği ve bu ortamda kontrol verilerinin eksikliğini içerir.
Kardiyak elektrofizyoloji
MYLOTARG'ın düzeltilmiş QT aralığı üzerindeki etkisi, B1761031 monoterapi çalışmasında, relaps veya refrakter CD-33-pozitif AML'si olan 50 yetişkin hastada değerlendirilmiştir. Terapötik plazma konsantrasyonlarında başlangıca göre en büyük ortalama QTcF aralığı değişikliği 5,1 milisaniye olmuştur (%90 GA: 2,15, 8,06 milisaniye). Başlangıçtan itibaren maksimum QTcF artışı > 60 milisaniye ve QTcF > 480 milisaniye olan hasta bulunmamaktadır. Aynı hastada atriyal fibrilasyon (Derece 3) ve supraventriküler taşikardi (Derece 3) olayı meydana gelmiştir. Derece 4 veya Derece 5 kardiyak iletim yan etkileri bildirilmemiştir.
Konsantrasyon-QTc aralığı analizine dayalı olarak, toplam hP67.6 antikoru için başlangıca göre QTcF'de beklenen medyan değişiklik, gözlemlenen ortalama plazma Cdeğerinde 0,842 milisaniye (%95 GA: -1,93, 3,51 milisaniye) olmuştur. Konjuge olmayan kalikeamisin için, QTcF'de başlangıçtan itibaren beklenen medyan değişim, MYLOTARG'ın önerilen doz rejiminde uygulanmasının ardından gözlemlenen yaklaşık plazma Cdeğerinde 0,602 milisaniye (%95 GA:- 2,17, 2,72 milisaniye) olmuştur.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerGemtuzumab ozogamisin, sitotoksik ajan N-asetil-gama-kalikeamisine kovalent olarak bağlanan CD33 hedefli monoklonal antikordan (hP67.6) oluşan bir antikor-ilaç konjugatıdır (ADC). Gemtuzumab ozogamisinin farmakokinetiği (PK), antikorun (hP67.6) PK özellikleriyle birlikte, konjuge ve konjuge olmayan kalikeamisin türevleri ölçülerek açıklanır..
Emilim:
Klinik PK verileri, MYLOTARG'ın bir monoterapi doz rejimini (1, 4, 7. günlerde 3 mg/m ila bir 5 mg'lık flakon) takiben toplanmıştır. Konjuge kalikeamisin ve toplam hP67.6 antikoru için çoklu dozları takiben geometrik ortalama AUCve Cile ölçülen maruz kalmalar, sırasıyla 461.500 pgâsa/mL ve 11.740 pg/mL ve 26.820 ngâsa/mL ve 585,6 ng/mLdir. Konjuge olmayan kalikeamisin için PK verileri, plazmadaki istikrarsızlık nedeniyle sunulmamıştır.
Dağılım
İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazidin insan plazması proteinlerine bağlanma oranı yaklaşık % 97'dir. İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazid, P-glikoproteinin (P-gp) bir substratıdır. Hastalarda, hP67.6 antikorunun (V1 [13 L] ve V2 [6,91 L] toplamı) toplam dağılım hacmi yaklaşık 20 L olarak saptanmıştır.
Biyotransformasyon
Gemtuzumab ozogamisinin birincil metabolik yolağının, N-asetil-gama-kalikeamisin dimetil hidrazidin hidrolitik salımı olduğu öngörülmektedir. İn vitro çalışmalarda, N-asetil-gama- kalikeamisin dimetil hidrazidin, esas olarak disülfür kısmının enzimatik olmayan indirgenmesi yoluyla yaygın olarak metabolize olduğu gösterilmiştir. Sonuçta ortaya çıkan metabolitlerin aktivitesinin (sitotoksisite), önemli ölçüde azalmış olacağı beklenmektedir.
Diğer tıbbi ürünlerle etkileşimler
Diğer tıbbi ürünlerin gemtuzumab ozogamisin üzerindeki etkisi
İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazid ağırlıklı olarak, enzimatik olmayan indirgeme yolu ile metabolize edilir. Bu nedenle, gemtuzumab ozogamisinin sitokrom P450 (CYP) veya üridin difosfat glukuronosiltransferaz (UGT) ilaç metabolizma enzim inhibitörleri ya da indükleyicileriyle birlikte uygulanmasının, N-asetil-gama-kalikeamisin dimetil hidrazide maruziyeti değiştirmesi olası değildir.
Popülasyon farmakokinetik (PK) analizlerine dayanılarak, gemtuzumab ozogamisinin hidroksiüre, DNR ve AraC ile kombinasyonunun, hP67.6 PK'sında ya da konjuge olmayan kalikeamisinde klinik açıdan anlamlı değişikliklere neden olmayacağı tahmin edilmektedir.
Gemtuzumab ozogamisinin diğer tıbbi ürünler üzerindeki etkisi CYP substratları üzerindeki etki
İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazid ve gemtuzumab ozogamisinin, klinik açıdan anlamlı konsantrasyonlarda, CYP1A2, CYP2A6 (yalnızca gemtuzumab ozogamisin kullanılarak test edilmiştir), CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ve CYP3A4/5'in aktivitelerini engelleme potansiyeli düşük bulunmuştur. İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazid ve gemtuzumab ozogamisinin, klinik açıdan anlamlı konsantrasyonlarda, CYP1A2, CYP2B6 ve CYP3A4 aktivitelerini başlatma (indükleme) potansiyeli düşük bulunmuştur.
UGT substratları üzerindeki etki
İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazidin, klinik açıdan anlamlı konsantrasyonlarda, UGT1A1, UGT1A4, UGT1A6, UGT1A9 ve UGT2B7 aktivitelerini engelleme potansiyeli düşüktür.
İlaç taşıyıcı substratlar üzerindeki etki
İn vitro, N-asetil-gama-kalikeamisin dimetil hidrazidin, klinik açıdan anlamlı konsantrasyonlarda, P-gp, meme kanserine direnç proteini (BCRP), safra tuzu atma pompası (BSEP), çoklu ilaç direnci ilişkili protein (MRP) 2, çoklu ilaç ve toksin dışa atım proteini (MATE)1 ve MATE2K, organik anyon taşıyıcı (OAT)1 ve OAT3, organik katyon (OCT)1 ve OCT2, ve organik anyon taşıyıcı polipeptid (OATP)1B1 ve OATP1B3 aktivitelerini engelleme potansiyeli düşük olmuştur.
Birlikte uygulanan kemoterapötikler üzerindeki etki
Popülasyon farmakokinetik (PK) analizlerine dayanılarak, gemtuzumab ozogamisinin DNR ve AraC ile kombinasyonunun, bu maddelerin PK'sında klinik açıdan anlamlı değişikliklere neden olmayacağı tahmin edilmektedir.
Eliminasyon
Gemtuzumab ozogamisin farmakokinetiği, doğrusal ve zamana bağlı klerens bileşenlerine sahip 2 bölmeli bir modelle iyi karakterize edilmiştir. MYLOTARG'ın bir monoterapi dozlama rejimini (1, 4, 7. günlerde 3 mg/m ila bir 5 mg'lık flakon) takiben relaps veya refrakter AML'si olan 50 hastada, toplam hP67.6 antikorunun klerensi 0,288 L/saat olmuştur ve terminal eliminasyon yarı ömrünün (t½) 96,6 saat olduğu tahmin edilmiştir.
Spesifik gönüllü veya hasta gruplarındaki farmakokinetik
Yaş, ırk ve cinsiyet
Popülasyon PK analizine dayalı olarak, yaşın, ırkın ve cinsiyetin gemtuzumab ozogamisin eğilimini kayda değer oranda etkilemediği tespit edilmiştir.
Karaciğer yetmezliği
Karaciğer yetmezliği bulunan hastalarda gemtuzumab ozogamisin için resmi PK çalışmaları gerçekleştirilmemiştir.
Popülasyon PK analizine dayanılarak, gemtuzumab ozogamisin klirensinin (hP67.6 antikoru ve konjuge olmayan kalikeamisin), Ulusal Kanser Enstitüsü Organ Disfonksiyonu Çalışma Grubu (National Cancer Institute Organ Dysfunction Working Group - NCI ODWG) tarafından tanımlandığı şekilde, hafif karaciğer yetmezliği durumundan etkilenmesi beklenmemektedir. Analiz, şu NCI ODWG yetmezlik durumu kategorilerinde 405 hasta ile yapılmıştır: Hafif (B1, n=58 ve B2, n=19), orta (C, n=6) ve normal hepatik fonksiyon (n=322) (bkz. Bölüm 4.2).
Böbrek yetmezliği
Böbrek yetmezliği bulunan hastalarda gemtuzumab ozogamisin için resmi PK çalışmaları gerçekleştirilmemiştir.
406 hasta üzerinde yapılan bir popülasyon PK analizine dayanılarak, hafif düzeyde böbrek yetmezliği bulunan hastalarda (kreatinin klirensi [CL60-89 mL/dk; n=149) veya orta düzeyde böbrek yetmezliği bulunan hastalarda (CL30-59 mL/dk; n=47) gemtuzumab ozogamisin klirensi, normal böbrek fonksiyonuna sahip hastalarla benzer (CL≥ 90 mL/dk; n=209) olmuştur. Gemtuzumab ozogamisinin PK'sı, şiddetli böbrek yetmezliği olan hastalarda araştırılmamıştır.
Pediyatrik popülasyon
Popülasyon modellemesinin sonuçları, gemtuzumab ozogamisinin PK davranışının (hP67.6 antikoru ve konjuge olmayan kalikeamisin), 9 mg/m doz uygulama rejiminin ardından yetişkin ve pediyatrik AML hastaları arasında benzer olduğunu göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Tekrarlı doz toksisitesi
En önemli toksik etkiler, karaciğer, kemik iliği ve lenfoid organlar, hematoloji parametreleri (düşük RBC kütle ve WBC sayıları, ağırlıklı olarak lenfositler), böbrek, göz ve erkek ile dişi üreme organlarında meydana gelmiştir. Sıçanlarda karaciğer, böbrek ve erkek üreme organları ve maymunlarda lenfoid dokular üzerindeki etkiler (EAA'e göre 3 mg/m değerindeki üçüncü insan dozundan sonra insan klinik maruziyetinin, sıçanlar için yaklaşık 18 katı ve maymunlar için 36 katı) geri dönüşlü olmamıştır. 12 haftalık çalışmada maymunlarda dişi üreme organları ve göz üzerindeki etkiler advers etkilerdir (EAA'e göre, 3 mg/m değerindeki üçüncü insan dozundan sonra insan klinik maruziyetinin sırasıyla yaklaşık 193 ve 322 katı). Hayvanlarda görülen geri dönüşsüz bulguların insanlar üzerindeki geçerliliği belirsizdir. Hayvanlarda, MYLOTARG uygulandıktan sonra sinir sistemine etkileri gözlenmemiştir. Sıçanlarda diğer antikor-kalikeamisin konjugatlarıyla, sıçanlarda sinir sistemi değişiklikleri belirlenmiştir.
Genotoksisite
Gemtuzumab ozogamisinin klastojenik olduğu saptanmıştır. Bu, kalikeamisinin ve diğer enedin antitümör antibiyotiklerinin bilinen DNA kırılmalarını indükleme etkisi ile tutarlı bir sonuçtur. N-asetil-gama-kalikeamisin DMH'nin (salınan sitotoksin) mutajenik ve klastojenik olduğu saptanmıştır.
Karsinojenisite
Gemtuzumab ozogamisin ile resmi karsinojenisite çalışmaları yapılmamıştır. Toksisite çalışmalarında, insanda üçüncü 3 mg/m dozu uygulandıktan sonra EAA'e göre insanın klinik olarak maruz kaldığı ilacın yaklaşık 54 katına maruziyette sıçanların karaciğerlerinde prenoeplastik lezyonlar (minimum ile hafif arası oval hücre hiperplazisi) meydana gelmiştir. Maymunlarda ise, insanda üçüncü 3 mg/m dozu uygulandıktan sonra EAA'e göre insanın klinik olarak maruz kaldığı ilacın yaklaşık 115 katına kadar maruziyette, preneoplastik ya da neoplastik lezyon gözlenmemiştir. Hayvanlarda görülen bu geri dönüşsüz bulguların insanlar üzerindeki geçerliliği belirsizdir.
Reprodüktif toksisite
Bir dişi sıçan fertilite çalışmasında, maternal toksisite varlığında (insanda üçüncü 3 mg/m dozu uygulandıktan sonra EAA'e göre insanın klinik olarak maruz kaldığı ilacın yaklaşık 9,7 katı) corpus luteum sayısında hafif bir azalma ve artmış embriyoletalite gözlenmiştir. 12 haftalık çalışmada, dişi maymunların üreme sistemi üzerinde etkiler gözlenmiştir (over, ovidükt, uterus ve serviks atrofisi; 3 mg/m değerindeki üçüncü dozdan sonraki insan klinik maruziyetinin yaklaşık 193 katı).
Bir erkek fertilite çalışmasında, erkek üremesi üzerindeki etkiler, düşük spermatogoni ve spermatositler, testiküler spermatidlerde ve epididimal spermde azalmalar, spermatidlerde nükleus boşluğu oluşumunu ve/veya dev hücre görülmesini içermiştir. Ek bulgular, testisler, epididimler, meme bezi ve fertilite üzerindeki etkiler şeklindedir. Erkek sıçanlar, doz uygulanmayan 9 haftalık süreden sonra tekrar çiftleştirildiğinde testislerinde, sperm ve fertilite üzerindeki etkiler daha kötü olmuş, ancak düşmüş olan spermatosit ve spermatogoni sayılarında kısmi toparlanma olmuştur. Erkek sıçanların üreme organları üzerindeki etkiler, geri dönüşsüz veya kısmen geri dönüşlü olmuştur (bkz. Bölüm 4.6). Maymunlarda erkek üremesi üzerine etkiler (testisler, epididimler, meni keseleri), 3 mg/m değerindeki üçüncü dozun ardından insan klinik maruziyetinin yaklaşık 66 katında gözlenmiştir.
Bir embriyo-fetal toksisite çalışmasında, daha düşük fetal vücut ağırlığı, daha yüksek fetal eğri kaburga sıklığı ve daha düşük fetal iskelet osifikasyon sıklığı gözlenmiştir. Yüksek embriyoletalite ve fetal morfolojik anormallikler arasında parmaklarda malformasyonlar, aort arkı yokluğu, üst ekstremitelerdeki uzun kemiklerde anomaliler, biçimsiz skapula, vertebral centrum yokluğu ve sternum kemiklerinde erime görülmüştür. Maternal toksisite varlığında yüksek embriyoletalite de gözlenmiştir. Embriyo-fetal etkiler ile ilişkilendirilen en düşük doz, insanda üçüncü 3 mg/m dozu uygulandıktan sonra EAA'e göre insanın klinik olarak maruz kaldığı ilacın yaklaşık 9,7 katı ile ilişkili bulunmuştur (bkz. Bölüm 4.6).
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir.
Kolon, Rektum yada Bağırsak Kanseri
Bağırsak kanseri kolon veya rektumda
(arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir
şekilde tedavi edilir. |
İLAÇ GENEL BİLGİLERİ
Pfizer İlaçları Ltd.Şti.
| Satış Fiyatı | 213112.88 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 206868.78 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681308271099 |
| Etkin Madde | Gemtuzumab |
| ATC Kodu | L01XC05 |
| Birim Miktar | 5 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Abd ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |