NABOTA 100 ünite enjeksiyonluk çözelti hazırlamak için liyofilize toz (1 flakon) Klinik Özellikler
{ Onabotulinum Toksin A }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
NABOTA;
20 ila 65 yaş arası yetişkinlerde korrugator kas ve/veya proserus kasının aktiviteleriyle ilişkili orta ila şiddetli glabella çizgilerinin (kaşlar arasındaki dikey çizgiler) görünümünde geçici iyileşme,
18 ila 65 yaş arası yetişkinlerde orbikülaris oküli kası aktiviteleriyle ilişkili orta dereceli lateral kantal çizgilerin (kaz ayağı çizgileri) görünümünde geçici iyileşme tedavilerinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji, uygulama sıklığı ve süresi/Uygulama şekli:
Botulinum toksin üniteleri, ürünler arasında birbiri yerine kullanılamaz. Önerilen dozlar, diğer botulinum toksin preparatlarından farklıdır.
NABOTA yalnızca tedavide ve ilgili branşda uzmanlığa sahip olan hekimler tarafından uygulanmalıdır.
Bu ürün yalnızca tek kullanım içindir ve kullanılmayan çözelti atılmalıdır. Glabella çizgileri için uygulama şekli;
100U/2,5 ml (4U/0,1 ml) konsantrasyonu elde etmek için koruyucu içermeyen, steril salin çözeltisiyle seyreltilerek sulandırılır, steril 30-gauge iğne kullanılarak 5 enjeksiyon bölgesinin her birine 0,1 ml doz enjekte edilir: Her bir korrugator kasa 2 enjeksiyon ve proserus kasına 1 enjeksiyon olmak üzere toplamda 20 Ünitelik doz. Pitoz komplikasyonunu azaltmak için, özellikle kaş depresör kompleksleri (depressor supercilii) daha büyük olan hastalarda, levator palpebrae superioris kasının yakınına enjeksiyon yapılmasından kaçınılmalıdır. İç korrugator kaslara ve kaş santraline enjeksiyonlar, kemikli supraorbital sırtın en az 1 cm yukarısına yapılmalıdır.
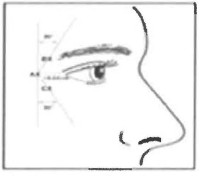
Şekil 1:

Bu ürünün kan damarına enjeksiyonunu önlemek için dikkatli özen gösterilmelidir. Orbital sınır altına ekstravazasyonu önlemek için, başparmak veya işaret parmağı orbital sınırın altına sıkıca yerleştirilmelidir. İğne, enjeksiyon sırasında süperior ve medial yönde tutulmalı ve doğru hacmin enjekte edilmesi için dikkatli özen gösterilmelidir.
Glabella yüz çizgileri, korrugator kas ve orbikülaris oküli kasının aktivitesiyle ortaya çıkar. Bu kaslar kaşı medial yönde hareket ettirir ve proserus kası ve depressor supercilii kası kaşı inferior yönde çeker. Bu kaş çatılmasını ya da âfissürlü kaşâ görünümü yaratır. Kasların yeri, boyutu ve kullanımı bireyler arasında belirgin değişkenlik gösterir. Yüz çizgileri için etkili doz, hastanın enjeksiyon yapılan yüzeyel kaslarını aktive etme yeteneğinin gözle kabaca gözlenmesiyle belirlenir. Her tedavinin etkisi yaklaşık üç-dört ay sürer. Güvenliliği ve etkililiği gösterilmediği için bu ürünün daha sık enjeksiyonu önerilmemektedir.
Tipik olarak botulinum toksininin başlangıç dozları, enjeksiyon yapılan kaslardaki kimyasal denervasyonu enjeksiyondan bir ila iki gün sonra, şiddeti ilk haftada artacak şekilde indükler.
Lateral kantal çizgiler (kaz ayağı çizgileri) için uygulama şekli;
Lateral kantal çizgiler, büyük ölçüde, göz kırpma ve göz kapağının kapanmasından sorumlu olan göz çevresindeki orbikülaris oküli kaslarının aktivitesinden kaynaklanır. Orbikülaris okülinin kuvvetli kasılması, lateral kantustan ileri gelen lateral ve radyal yönelimli kıvrımlara (kaz ayağı çizgileri) neden olur. Bu radyal çizgilerin dağılımı hastalar arasında farklılık gösterir.
Enjeksiyonlar, iğne ucu üst eğik şekilde, gözden uzak olacak şekilde yapılmalıdır. 30-33- gauge iğne kullanarak, her iki yanda bulunan lateral orbikülaris oküli kasındaki 3 enjeksiyon yerinin her birine (toplam 6 enjeksiyon yeri, toplam 24 Ünite) 0,1 mL (4U) sulandırılmış NABOTA enjekte edilir. İlk enjeksiyon, lateral kantusa yaklaşık 1.5-2.0 cm temporal ve orbital rime temporal yapılmalıdır. Maksimum gülüş durumunda lateral kantaldaki çizgiler lateral kantusun üstünde ve aşağısındaysa, "Şekil-2" ye göre enjeksiyon gerçekleştirilmelidir.
Şekil 2:
Hazırlama ve seyreltme tekniği
Enjeksiyon öncesinde, liyofilize ürün, koruyucu içermeyen, steril salin ile seyreltilir. %0,9 sodyum klorür enjeksiyonu önerilen seyrelticidir. Uygun boyutta enjektöre doğru miktarda seyreltici çekilir. Bu ürün, kabarcıklanma ya da benzeri bir kuvvetli çalkalama ile denatüre olduğu için seyreltici, flakon içine yavaşça enjekte edilmelidir. Eğer bir vakum oluşup seyreltici flakona çekilmezse flakonu atılmalıdır. Etiket üzerindeki boşluğa seyreltme tarihi ve saati kaydedilmelidir. Bu ürün, sulandırıldıktan sonraki 24 saat içinde uygulanmalıdır. Bu dönemde sulandırılan ürün buzdolabında saklanmalıdır (2 - 8C). Sulandırılan ürün berrak, renksiz olmalı ve parçacık içermemelidir. Parenteral müstahzarlar, uygulama öncesinde parçacık madde ve renk değişikliği açısından görsel olarak incelenmelidir. Bu ürün ve seyrelticisi herhangi bir koruyucu içermediği için, bu ürünün bir flakonu tek bir hasta için kullanılmalıdır. Tavsiye edilen doza göre uygulama yapıldıktan sonra geriye kalan çözelti atılmalıdır.
Tablo 1:
Eklenen seyreltici (%0,9 Sodyum Klorür Enjeksiyonu) | Oluşan doz Ünite/0,1 ml |
1,0 ml 2,0 ml 4,0 ml 8,0 ml | 10,0 Ünite 5,0 Ünite 2,5 Ünite 1,25 Ünite |
Not: Bu seyreltmeler 0,1 ml'lik enjeksiyon hacmi için hesaplanmıştır. Daha küçük veya daha büyük enjeksiyon hacmi uygulayarak dozda azalma veya artma sağlamak da mümkündür - 0,05 ml (%50 doz azalması) ila 0,15 ml (%50 doz artışı.)
Enjeksiyonluk tozun sulandırılması, flakonların taşınması ve imhasına ilişkin talimatlar için lütfen bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek ve karaciğer yetmezliğinde kullanımıyla ilgili veri bulunmamaktadır.
Pediyatrik popülasyon:
NABOTA'nın glabella ve lateral kantal çizgilerinin iyileşmesi endikasyonunda, çocuklarda ve 20 yaş altı adölesanlarda güvenliliği ve etkililiği ile ilgili veri bulunmamaktadır.
Geriyatrik popülasyon:
Yaşlılarda kullanımına yönelik özel doz ayarlaması önerisi bulunmamaktadır.
4.3. Kontrendikasyonlar
NABOTA aşağıdaki durumlarda kontrendikedir:
Botulinum toksini tip A'ya veya bu ürünün formülasyonundaki herhangi bir maddeye karşı aşırı duyarlılığı olan hastalar.
Önerilen enjeksiyon bölge(ler)inde enfeksiyon varlığı olan hastalarda.
4.4. Özel kullanım uyarıları ve önlemleri
Özel uyarılar
Bu tıbbi ürün, insan plazması ürünü olan albümin içermektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak Varyant Creutzfeldt-Jacob (v-CJD) gibi, çeşitli hastalıklara yol açabilen enfeksiyon yapıcı ajanlar içerebilirler. NABOTA'da Varyant Creutzfeldt-Jacob hastalığının bulaşma riski teorik olarak minimumken, klasik Creutzfeldt-Jacob hastalığının bulaşma riski hiçbir kanıtla desteklenmez. Alınan önlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalık bulaştırabilir.
Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadığının izlenmesi, belirli virüs enfeksiyonlarının halihazırda varlığının test edilmesi ve belirli virüslerin yok edilmesi ve/veya inaktivasyonu ile azaltılmıştır. Bütün bu önlemlere rağmen, bu ürünler hala potansiyel olarak hastalık bulaştırabilirler. Ayrıca, henüz bilinmeyen enfeksiyon yapıcı ajanların bu ürünlerin içerisinde bulunma ihtimali mevcuttur.
HIV, HBV, HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüsler için etkili önlemlerin alınmasına dikkat edilmelidir. Parvovirüs B19 gibi zarflı olmayan virüslere karşı alınan tedbirler sınırlı sayıda olabilir. Parvovirüs B19 enfeksiyonu, gebelikte (fetal infeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olan hastalarda tehlikeli olabilir (hemolitik anemi gibi).
Doktor, bu ilacı hastaya reçete etmeden veya uygulamadan önce hastası ile risk ve yararlarını tartışmalıdır.
Ayrıca;
NABOTA kullanılması gerekiyorsa hekim tarafından, hastalık yapıcı etkenlerin hastaya bulaşmasını önlemek için uygun aşıların (Hepatit A, Hepatit B vb.) yaptırılması önerilebilir.
Hastalar açısından NABOTA her uygulandığında, hastayla ürünün seri numarası arasındaki bağlantının korunabilmesi için, ürünün adı ve seri numarası kaydedilmelidir.
Bu tıbbi ürünün etkin maddesi Clostridium botulinum'dan üretilen Clostridium botulinum, toksin tip A olduğu için, bu bölümdeki bilgilerin tam olarak anlaşılmış olması ve önerilen dozaj ve uygulama yöntemlerine sıkı sıkıya uyulmalıdır. Bu tıbbi ürünü uygulayan hekimler, uygulama alanının ilgili nöromusküler ve/veya orbital anatomisini ve önceki cerrahi işlemler ve standart elektromiyografik teknikler nedeniyle anatomideki olası değişiklikleri yeterli düzeyde anlamalıdır. Önerilen dozajlar ve uygulama sıklıkları aşılmamalıdır.
Toksin etkisinin yayılması
Botulinum toksin ürünlerinin etkileri enjeksiyon alanında yayılıp, olumsuz belirtiler oluşturabilir. Bu belirtiler arasında asteni, yaygın kas zayıflığı, disfoni, dizartri, kekeleme, üriner inkontinans, nefes almada güçlükler, disfaji, diplopi, bulanık görme ve pitozis vardır. Yutma ve nefes alma güçlükleri hayatı tehdit edici olabilir ve toksin etkilerinin yayılmasıyla ilişkili ölüm raporları olmuştur. Bu semptomların oluşma riski olasılıkla spastik serebral palsi için tedavi edilen çocuklarda en yüksek düzeydedir, ancak spastik serebral palsi ve diğer nedenlerle tedavi edilen erişkinlerde de bu semptomlar gelişebilir. Yukarıdaki advers
reaksiyonların geliştiği olgular, servikal distoni tedavisinde kullanılan dozlar veya daha düşük dozlarda kullanımı ile gözlenmiştir.
Aşırı duyarlılık reaksiyonları
Diğer botulinum toksin ürünlerinde ciddi ve/veya ani aşırı duyarlılık reaksiyonları bildirilmiştir. Bu reaksiyonlar arasında anafilaksi, ürtiker, yumuşak doku ödemi ve dispne vardır. Lidokainin seyreltici olarak kullanıldığı bir fatal anafilaksi olgusu bildirilmiştir ve sonuç olarak nedensel ajan, güvenilir olarak belirlenmemiştir. Böyle bir reaksiyon görülürse bu müstahzardan daha fazla enjeksiyon yapılmamalı ve uygun tıbbi tedavi bir an önce başlatılmalıdır.
Önceden var olan nöromusküler bozukluklar
Periferik motor nöropatik hastalıkları (örn., amiyotrofik lateral skleroz veya motor nöropati) ya da nöromusküler bileşke bozuklukları (örn., miyastenya gravis veya Lambert-Eaton sendromu) olan bireylerde, bu ürünün tipik dozlarında şiddetli disfaji ve respiratuvar bozulma gibi klinik olarak anlamlı sistemik etkiler açısından risk artışı olabilir. Diğer botulinum toksini ürünleriyle yayınlanmış tıbbi literatürlerde, bilinen ya da tanı konmamış nöromusküler bozuklukları olan hastalara botulinum toksini uygulanması ve hastaların tipik klinik dozların sistemik etkilerine ciddi aşırı duyarlılık gösterdiği şeklinde seyrek olgular bildirilmiştir. Bazı olgularda disfaji, birkaç ay sürmüş ve gastrik beslenme tüpü yerleştirilmesi gerekmiştir.
Disfaji
Servikal distoni hastalarının botulinum toksinleri ile tedavisini takiben görülen disfaji, yaygın olarak bildirilen bir advers olaydır. Bu hastalarda, gastrik beslenme tüpü yerleştirilmesini gerektirecek ciddiyette nadir disfaji olguları da vardır. Aynı zamanda, bir hastada disfaji bulgusunu takiben aspirasyon pnömonisi gelişmesi ve ölüm görülmesi şeklinde nadir olgu raporları da vardır.
Diğer botulinum toksini ürünleri ile, aritmi ve miyokard enfarktüsü dahil olmak üzere kardiyovasküler sistemi içeren ve bazıları da fatal sonuçlar doğuran advers reaksiyonlar da bildirilmiştir. Bu hastaların bazılarında kardiyovasküler hastalık gibi risk faktörleri vardı.
Strabismus tedavisi için diğer botulinum toksin ürünlerinin uygulanması sırasında, iğnenin göz etrafındaki alanlara penetrasyonu nedeniyle retinal dolaşımı bozmaya yeterli retrobulber hemorajiler görülmüştür. Orbitayı dekomprese etmeye uygun araçların erişilebilir olması önerilir. İğnelerle, oküler (küre) penetrasyonlar da görülmüştür. Bu durumun tanısını koymak için bir oftalmoskop bulunmalıdır. Bir ya da daha fazla ekstraoküler kasta paralizi oluşturmak boyutsal dezoryantasyon, çift görme veya hedefteki objenin yerinin doğru tespit edilememesi ile sonuçlanabilir. Etkilenen gözün kapatılması bu belirtileri hafifletebilir.
Blefarospazm
Botulinum toksininin, orbikülaris kasına enjeksiyonundan kaynaklanan göz kırpması azalması, özellikle VII sinir bozuklukları olan hastalarda, korneal maruziyete, persistan epitelyal defekte ve korneal ülserasyona neden olabilir. Blefarospazm tedavisi için diğer botulinum toksin ürünlerinin kullanımında, bu etki nedeniyle afakik bir gözde, korneal greftleme gerektiren bir korneal perforasyon olgusu görülmüştür Önceden opere edilen gözlerde korneal his dikkatli test edilmeli ve ektropiyon riskini azaltmak için alt göz kapağı alanına enjeksiyondan kaçınılmalıdır. Herhangi bir epitelyal defekt için etkin tedavi uygulanmalıdır. Bu tedavi koruyucu damlaları, merhemi, terapötik yumuşak kontakt lensleri ya da gözün yamalama ya da diğer yöntemlerle kapatılmasını gerektirebilir.
Yumuşak göz kapağı dokularında kolayca ekimoz oluşur. Bu, enjeksiyondan hemen sonra enjeksiyon bölgesine hafif basınç uygulayarak en aza indirilebilir.
Botulinum toksininin antikolinerjik aktivitesi nedeniyle, anatomik olarak dar açıları olan hastalar dahil olmak üzere açı kapanması glokomu açısından risk olan hastaların tedavisinde dikkatli olunmalıdır.
Botulinum toksini ürünleri arasında değişiklik yapılamaması
Botulinum toksininin potens üniteleri, ürünlerin kendilerine spesifik olduğu için, diğer botulinum toksini ürünleriyle değiştirilebilir değillerdir. Bu nedenle, botulinum toksininin biyolojik aktivite üniteleri, başka bir spesifik analiz yöntemiyle değerlendirilen herhangi bir diğer botulinum toksini ürününün üniteleriyle kıyaslanamaz ya da bu ünitelere çevrilemez.
Korunmasız anatomik yapılardaki veya bunların yakınlarındaki enjeksiyonlar
Korunmasız anatomik yapılara ya da yakınlarına enjeksiyon yapılırken dikkatli olunmalıdır. Botulinum toksini, doğrudan tükürük bezlerine, oro-lingual-faringeal bölgeye, özefagusa ve mideye doğrudan enjeksiyon yapılan hastalarda fatal sonuçlar da dahil olmak üzere ciddi advers olaylar bildirilmiştir (bu enjeksiyon bölgeleriyle ilgili endikasyonlar için güvenlilik ve etkililik gösterilmemiştir). Botulinum toksininin toraksa yakın uygulanmasını takiben enjeksiyon işlemiyle ilişkili pnömotoraks bildirilmiştir. Akciğere özellikle apekslere yakın enjeksiyon yapılırken dikkat gerekmektedir.
Nörolojik durumla ilişkili spastisite ya da detrüsör aşırı aktivitesi tedavi alan ve respiratuvar durumu bozulmuş hastalarda botulinum toksininin pulmoner etkileri
Üst ekstremite spastisitesi ve respiratuvar bozukluğu olan hastalarda, üst solunum yolları enfeksiyonları ve akciğer fonksiyonundan azalma (Zorlu Vital Kapasitede [FVC] ≥ %15 azalma), plaseboya kıyasla diğer botulinum toksini ürünleri uygulandığında daha sık bildirilmiştir. Nörolojik bir durumla ilişkili detrüsör aşırı aktivitesi için diğer botulinum toksini ürünleriyle tedavi edilen hastalarda akciğer fonksiyonlarında azalmalar (Zorlu Vital Kapasitede [FVC] ≥ %15 azalma) da bildirilmiştir.
Spastisite tedavisi alan hastalarda bronşit ve üst solunum yolu enfeksiyonları
Üst ekstremite spastisitesi için botulinum toksini tedavisi alan hastalarda bronşit, advers reaksiyon olarak plaseboya kıyasla daha sık bildirilmiştir. Üst ekstremite spastisitesi tedavisi alan akciğer fonksiyonu azalmış hastalarda, üst solunum yolları enfeksiyonları da botulinum toksini alan hastalarda plaseboya kıyasla advers reaksiyonlar olarak daha sık bildirilmiştir. Üst ekstremite spastisitesi tedavisi alan 195 hastada terapötik faydaları doğrulamak için yapılan klinik çalışmada, test grubunda (NABOTA ile tedavi edilmiş) 2 ve kontrol grubunda 1 üst solunum yolu enfeksiyonu vakası bildirilmiştir.
Pediyatrik kullanım
NABOTA'nın bölüm 4.1'deki pediyatrik popülasyon için güvenliliği ve etkililiği gösterilmemiştir.
Aşağıdaki hastalara dikkatle uygulanmalıdır:
Diğer kas gevşeticileri (örn., tübokürarin klorür, dantrolen sodyum ve benzeri) ile tedavi altındaki hastalar - Kas gevşemesi güçlenebilir ya da disfaji riskleri artabilir.
Kas gevşetme aktivitesi olan ilaçlarla tedavi altındaki hastalar, örneğin, spektinomisin HCl, aminoglikozid antibiyotikler (gentamisin sülfat, neomisin sülfat ve benzeri), polipeptid antibiyotikler (polimiksin B sülfat ve benzeri), tetrasiklin antibiyotikler, linkomisin antibiyotikler (linkozamidler), kas gevşeticiler (baklofen ve benzeri), anti-kolinerjik ajanlar (skopolamin butilbromür, trihekzilfenidil HCl ve benzeri), benzodiazepin ve diğer benzer ilaçlar (diazepam, etizolam ve benzeri) ve benzamid ilaçlar (tiyaprid HCl, sülpirid ve benzeri). Kas gevşemesi güçlenebilir ya da disfaji riskleri artabilir.
Genel önlemler
Tedavi edilen hastalığın doğası gereği bu müstahzarın, araç ve makine kullanım yeteneği üzerindeki etkileri tahmin edilemez.
Glabella çizgisi
Botulinum toksininin, orbikülaris kasına enjeksiyonundan kaynaklanan göz kırpması azalması, özellikle VII. sinir bozuklukları olan hastalarda, korneal maruziyete, persistan epitelyal defekte ve korneal ülserasyona neden olabilir.
Enjeksiyon bölgesinde cilt hastalığı, enfeksiyon ve skarlar gibi cilt bozuklukları olan hastalar, glabella kısmında (alın dahil) yüz gerdirme ve kalıcı implant gibi tedavi öyküsü olan hastalar, fasyal sinir paralizisi ya da göz kapağı pitozis belirtileri öyküsü olan hastalar, glabella çizgileri el kullanılarak dahi düzleştirilemediği için fiziksel yöntemle tatmin edici bir şekilde düzelme gösteremeyecek hastalar, faz III güvenlilik ve etkililik çalışmalarında hariç tutulmuştur, bu nedenle uyarılmalıdır. Bu ürünün enjeksiyonu, üç ayda birden daha sık olmamalıdır ve minimum etkili doz kullanılmalıdır.
Sodyum
NABOTA her dozunda 1mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında âsodyum içermezâ.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Herhangi bir anti-trombosit (aspirin benzeri) ürün veya antikoagülan (kan sulandırıcı) kullanan hastalarda dikkatli olunmalıdır.
Botulinum toksini ürünlerinin etkileri genel olarak, aminoglikozid antibiyotiklerle ya da tübokürarin-tipi kas gevşeticiler gibi nöromusküler iletimi etkileyen diğer ilaçlarla birlikte kullanıldığında güçlenir. Aminoglikozidler veya spektinomisin ile birlikte kullanımı kontrendikedir. Bu ürün enjekte edilen hastalarda polimiksin, tetrasiklin ve linkomisin dikkatli kullanılmalıdır.
Farklı botulinum nörotoksin serotiplerinin aynı zamanda ya da birkaç ay içinde uygulanmasının etkileri bilinmemektedir. Daha önceden uygulanmış botulinum toksininin etkileri kaybolmadan başka bir botulinum toksini ürününün uygulanması ile aşırı nöromusküler güçsüzlük alevlenebilir.
Özel popülasyonlara ilişkin ek bilgiler
Özel veri bulunmamaktadır.
Pediyatrik popülasyon:
Çocuklarda etkileşim çalışması bulunmamaktadır.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlar tedavi süresince etkili doğum kontrol yöntemi uygulamalıdır.
Gebelik dönemi
Botulinum toksininin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. İnsanlara yönelik potansiyel risk bilinmemektedir.
Bu ilacın (0.5, 1, 4U/kg) organogenez döneminde (gebeliğin 6 ila 16. gestasyon günleri) gebe sıçanlara intramüsküler yoldan enjekte edilmesinden sonra, maternal durum ve embriyofetal gelişim üzerindeki etkisi değerlendirilmiştir. Sonuç olarak, 4U/kg doz grubunda anne sıçanlarda çekiç parmak deformitsi, paralitik yürüyüş, ayak parmaklarında kıvrılma ve fetüste osteopeni gözlenmiştir. Bunlar istatistiksel olarak anlamlı bulunmamıştır.
NABOTA kesinlikle gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Botulinum toksininin insan sütüyle atılıp atılmadığı bilinmemektedir. NABOTA emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/Fertilite
Botulinum toksini tip A'nin doğurganlık çağındaki kadınlarda kullanımının fertilite üzerindeki etkilerine ilişkin yeterli veri bulunmamaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.7. Araç ve makine kullanımı üzerindeki etkiler
Ancak hastalar, güç kaybı, kas güçsüzlüğü, bulanık görme ya da göz kapaklarında sarkma olması durumunda araç kullanmamaları ya da herhangi başka bir potansiyel olarak tehlikeli faaliyette bulunmamaları konusunda uyarılmalıdır.
4.8. İstenmeyen etkiler
Genel
Botulinum toksini tedavisi durumunda bazen disfaji, pnömoni ve/veya anlamlı debilite ya da anafilaksi ile ilişkili ölümün bildirildiği spontan raporlar olmuştur. Bazıları fatal sonuç doğuran aritmi ve miyokard enfarktüsü dahil olmak üzere kardiyovasküler sistemi içeren seyrek advers olay raporları da olmuştur. Bu olayların botulinum toksini enjeksiyonuyla tam ilişkisi gösterilmemiştir. Aşağıdaki olaylar diğer botulinum toksinleri ile bildirilmiştir ve
enjekte edilen botulinum toksiniyle nedensel ilişkisi bilinmemektedir: cilt döküntüsü (eritema multiforme, ürtiker ve psöriaziform erüpsiyon), kaşıntı ve alerjik reaksiyon.
Genelde advers reaksiyonlar enjeksiyonu takiben ilk hafta içinde meydana gelir ve genel olarak geçici olsalar da, birkaç ay sürenleri de olabilir. Enjeksiyon ile ilişkili olarak enjeksiyon bölgesinde ya da yakındaki kaslarda lokalize ağrı, hassasiyet, morarma, çekme (traksiyon), şişlik, sıcaklık hissi ya da hipertoni görülebilir. Enjeksiyon kasındaki ya da kaslarındaki lokal güçsüzlük, botulinum toksininin beklenen farmakolojik etkisini temsil etmektedir. Ancak toksinin yayılması nedeniyle yakın kaslarda güçsüzlük de görülebilir. Blefarospazm ya da servikal distoni hastalarına enjekte edildiğinde, enjeksiyon bölgesinden uzak bazı kaslarda, klinik güçsüzlükle ya da diğer elektrofizyolojik anomali tipleriyle ilişkili olmayan elektrofizyolojik seğirme artışı (bir dalga formunda hızlı varyasyon) görülebilir.
Glabella çizgileri
Bu ürünün güvenliliği, yaşları 20 ila 65 arasında değişken ve orta ila şiddetli glabella çizgileri olan 268 hastanın dahil edildiği çok merkezli, karşılaştırmalı, çift-kör, randomize çalışmada değerlendirilmiştir (test grubu 135, kontrol grubu 133). Advers reaksiyonlar test grubunun
%20,00'ında ve kontrol grubunun %18,05'inde gözlenmiştir.
Advers reaksiyonların çoğu hafifti ve hiçbiri şiddetli değildi. Bu ilacın test grubunda %1'den daha fazla bildirilen advers reaksiyonlar sıklıklarına göre; pitozis (%2,22), kaşlarda kalkma (%1,48) ve vertigo (%1,48) şeklinde listelenmektedir.
Glabella çizgilerinin görünümünü iyileştirme tedavisi için randomize, aktif-kontrollü klinik çalışmalarda değerlendirilen 20 ile 65 yaş arasındaki NABOTA ile tedavi grubunda (N=135) ve kontrol grubunda (N=133) raporlanan advers reaksiyonların listesi aşağıda verilmiştir.
Lateral kantal çizgiler (kaz ayağı çizgileri)
Bu ürünün güvenliliği, yaşları 18 ila 75 arasında orta ila şiddetli lateral kantal çizgileri olan 204 hastanın dahil edildiği çok merkezli, karşılaştırmalı, çift kör, randomize çalışmalarda değerlendirilmiştir. Deneklerin %9.8'inde (20/204 hasta, 28 vaka) lateral kantal çizgileriyle ilişkili olmayan advers olaylar gözlenmiştir. Dokuz vaka hafif, 19 vaka orta şiddette olmuştur. Bu vakaların hiçbiri akut reaksiyon değildir ve bu ürün tedavisi ile ilişkili bulunmamıştır. Hem test hem de kontrol grubunda 1 hastada (%0,49, her grupta 1 hasta) lateral kantal çizgilerle ilişkili advers ilaç reaksiyonları gözlenmiş olup bunların tümü hafif reaksiyonlar olarak bulunmuştur (Test ilacı enjeksiyon bölgesinde: kaşıntı, Referans ilaç enjeksiyon bölgesinde: hassasiyet).
Pazarlama sonrası gözetim bulguları
Glabella çizgileri
914 hasta ile 4 yıl boyunca yapılan pazarlama sonrası gözetim çalışması sonucunda, yurt içi kullanımda %2.5 oranında (23/914, 25 vaka) advers reaksiyon gözlenmiştir. Bu vakalar arasında bu ürünle nedensel ilişkisi dışlanamayan advers reaksiyon oranı sırasıyla %1.6 (15/914, 17 vaka) olup %0,5 (5/914, 5 vaka) oranında baş ağrısı, %0,2 (2/914, her birinden 2 vaka) oranında göz yorgunluğu ve göz çevresinde şişlik ve %0.1 (1/914, her birinden 1 vaka) oranında kas sertliği, yorgunluk, fasyal paraliz, enjeksiyon yeri reaksiyonu, döküntü, hassasiyet, enjeksiyon yerinde ağrı ve kaşıntı gözlenmiştir. Ciddi advers olay ve ciddi advers reaksiyon tespit edilmemiştir.
Beklenmeyen advers olay oranı %1.5(14/914, 16 vaka) olup %0.8(7/914, 7 vaka) oranında baş ağrısı, %0.2 (2/914, her birinden 2 vaka) oranında göz yorgunluğu ve farenjit ve %0.1 (1/914, her birinden 1 vaka) oranında sırt ağrısı, kas sertliği, yorgunluk, fasyal paraliz ve cilt kırışıklıkları gözlenmiştir. Bu ürünle nedensel ilişkisi dışlanamayan beklenmeyen advers olayların oranı %0,9'dur (8/914, 10 vaka). Bu vakalardan baş ağrısı %0.5(5/914, 5 vaka) oranında, göz yorgunluğu %0.2(2/914, 2 vaka) oranında ve kas sertliği, yorgunluk ve fasyal paraliz %0.1 oranında (1/914, her birinden 1 vaka) bildirilmiştir. Ciddi, beklenmeyen advers olay ve ciddi, beklenmeyen advers reaksiyon tanımlanmamıştır.
Bu ilacın yurt içindeki advers olay ve spontan yan etki raporlarının yeniden incelemesi, pazarlama onayı olan tüm yerli ilaçların advers olay raporları ile yapılan yeniden inceleme sonunda değerlendirilmiştir. Sonuç olarak, diğer tüm ilaçlara kıyasla bu ilaçta bildirilen istatistiksel olarak anlamlı yan etkiler arasında, yeni tespit edilen vakalar aşağıdaki gibidir. Ancak bu sonuç, bu bileşen ile aşağıdaki advers olaylar arasındaki nedensel ilişkinin kurulduğu anlamına gelmez.
Deri ve deri altı doku hastalıkları: göz çevresinde şişlik (göz kapaklarında şişme)
4.9. Doz aşımı ve tedavisi
Doz aşımı bulgu ve belirtileri, enjeksiyondan hemen sonra belirgin şekilde görülmez. Kaza eseri enjeksiyon ya da oral kullanım meydana gelmesi durumunda kişi, sistemik güçsüzlük veya kas paralizisinin bulgu ya da belirtileri açısından birkaç haftaya kadar tıbbi olarak izlenmelidir. Doz aşımı ya da yanlış uygulamanın hemen öğrenilmesi durumunda bir antitoksin kullanılabilir. Antitoksin, uygulanması zamanında halihazırda ortaya çıkmış herhangi bir botulinum toksini ile oluşan kas güçsüzlüğünü geri döndürmeyecektir.
Eğer orofarinks ve özefagus kasları etkilenirse, aspirasyon pnömonisine neden olacak şekilde aspirasyon görülebilir. Solunum kasları paralize olmuşsa veya tedavi sonucu güçsüzleşmişse, iyileşme gerçekleşene kadar hastanın entübasyonu gerekebilir. Destekleyici bakım, diğer genel destekleyici bakıma ek olarak trakeostomi ve/veya uzamış mekanik ventilasyon ihtiyacını içerebilir. Bu hastalar, daha ileri tıbbi değerlendirme için ele alınmalı ve hastaneye yatışı da içerebilen şekilde uygun tıbbi tedavi derhal başlatılmalıdır.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
İLAÇ GENEL BİLGİLERİ
SELTEK Estetik Pazarlama ve Tic. A.Ş.
| Satış Fiyatı | 6950.34 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 6950.34 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680869372016 |
| Etkin Madde | Onabotulinum Toksin A |
| ATC Kodu | M03AX01 |
| Birim Miktar | 100 |
| Birim Cinsi | IU |
| Ambalaj Miktarı | 1 |
| Kas İskelet Sistemi > Periferik Etkili Kas Gevşeticiler > Botulinum Toksini |
| İthal ( ref. ülke : Guney kore ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |