NEULASTIM 6 mg/0.6 ml S.C. enjeksiyon için kullanıma hazır 1 şırınga { Roche } Kısa Ürün Bilgisi
{ Pegfilgrastim }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
NEULASTIM 6 mg/0.6 mL S.C. enjeksiyon için kullanıma hazır şırınga Steril2. KALİTATİF VE KANTİTATİF BİLEŞİM
Bir enjeksiyon için kullanıma hazır şırınga 0.6 mL’de 6 mg pegfilgrastim (10 mg/mL*) içerir.
Yalnızca protein temel alınmıştır. PEG kısmı da dahil edildiğinde konsantrasyon 20 mg/mL olmaktadır.
Pegfilgrastim, fılgrastim (Rekombinant metiyonil insan G-CSF) ile N-terminal metiyonin kalıntısına kovalen bağla bağlanan 20 kDa polietilen glikol (PEG) molekülünden oluşmaktadır.
Filgrastim, E. coli içerisinde rekombinant DNA teknolojisi ile üretilmektedir.
Sodyum asetat : 0.35 mg Sorbitol : 30 mg
Sodyum hidroksit: pH ayarı için yeterli miktar içermektedir.
Sodyum asetat glasiyel asetik asidin sodyum hidroksit ile titre edilmesiyle oluşmuştur.
Yardımcı maddeler için 6.1.’e bakınız.
Yardımcı maddeler için 6.1.’e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyon için kullanıma hazır şırınga, 06 mL
Partikülsüz, berrak çözelti.
4.1. Terapötik endikasyonlar
NEULASTIM, solid tümörlerde sitotoksik kemoterapi sonrasında nötrofıl sayısının
o
4.2. Pozoloji ve uygulama şekli
Pozoloji/ uygulama sıklığı ve süresi:
NEULASTIM tedavisi yalnızca onkoloji ve/veya hematoloji alanında deneyimli hekimlerle işbirliği içerisinde verilmelidir.
Yetişkinler (>18 yaş): Her kemoterapi kürü için, sitotoksik kemoterapiyi takiben yaklaşık 24 saat sonrasında deri altı enjeksiyon olarak uygulanan bir adet 6 mg NEULASTIM dozu (Tek bir enjeksiyona hazır şırınga) önerilmektedir.
Uygulama şekli:
Subkutan enjeksiyon yoluyla uygulanır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Böbrek hastalığının son evresi dahil, böbrek yetmezliği olan hastalarda doz değişikliği tavsiye edilmemektedir (Bkz. bölüm 5.2).
Pediyatrik popülasyon:
NEULASTIM’in çocuklar ve 18 yaş altındaki adölesanlarda kullanımını önermek için yeterli veri mevcut değildir.
Geriyatrik popülasyon:
Bölüm 5.2’ye bakınız (Farmakokinetik Özellikler/Hastalardaki karakteristik özellikler).
4.3. Kontrendikasyonlar
Pegfilgrastim, fılgrastim, E. coli türevi proteinler veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda NEULASTIM kullanımı kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Sınırlı klinik veriler, pegfilgrastim ve fılgrastimin ciddi nötropeninin iyileşme süresi üzerindeki etkisinin de novo akut miyeloid lösemili (AML) hastalarda karşılaştırılabilir olduğunu göstermektedir (Bkz. bölüm 5.1). Ancak NEULASTIM’in uzun süreli etkileri AML’de tespit edilmemiştir; bu nedenle bu hasta popülasyonunda dikkatle kullanılmalıdır.
Granülosit koloni uyarıcı faktörü, malign hücreler dahil miyeloid hücrelerin büyümesini in vitro olarak destekleyebilir ve benzer etkiler bazı miyeloid olmayan hücrelerde in vitro görülebilir.
NEULASTIM’in güvenliliği ve etkinliği, miyelodisplastik sendromlu, kronik miyeloid lösemili hastalarda ve sekonder AML’li hastalarda araştırılmamıştır; bu nedenle bu tür hastalarda kullanılmamalıdır. Kronik miyeloid löseminin blast transformasyon tanısını akut miyeloid lösemiden ayırmaya özen gösterilmelidir.
Hücre genetiği t (15; 17) ile < 55 yaşındaki de novo AML hastalarında NEULASTIM uygulamasının güvenliliği ve etkinliği tespit edilmemiştir.
NEULASTIM’in güvenliliği ve etkinliği yüksek doz kemoterapi uygulanmakta olan hastalarda araştırılmamıştır. NEULASTIM, sitotoksik kemoterapinin dozunu artırmak amacıyla, belirlenmiş doz şemaları dışında kullanılmamalıdır.
G-CSF uygulaması sonrasında, özellikle interstisiyel pnömoni gibi yaygın olmayan pulmoner advers etkiler bildirilmiştir. Yakın zamanda pulmoner infıltrasyon veya pnömoni geçirmiş olan hastalar daha yüksek bir risk altında bulunabilir (Bkz. bölüm 4.8).
Pulmoner infıltrasyona dair radyolojik belirtilerle birliktelik gösteren öksürük, ateş ve dispne gibi pulmoner belirtilerin ortaya çıkması ve artan nötrofıl sayısı ile birlikte pulmoner fonksiyonların bozulması Yetişkin Solunum Sıkıntısı Sendromunun (Adult Respiratory Distress Syndrome; ARDS) ön belirtileri olabilir. Bu gibi durumlarda NEULASTIM hekimin takdirine bağlı olarak kesilmeli ve uygun tedavi uygulanmalıdır (Bkz. bölüm 4.8).
Pegfilgrastim uygulanması sonrasında, yaygın olmayan fakat genellikle asemptomatik dalak büyümesi vakaları ve bazı vakalarda ölümcül olabilen yaygın olmayan dalak yırtılması vakaları, bildirilmiştir (Bkz. bölüm 4.8). Bu sebeple dalak büyüklüğü dikkatlice izlenmelidir (Örneğin klinik muayene, ultrason). Sol üst batın ağrısı veya omuz ucunda ağrı bildiren hastalar dalak yırtılması açısından değerlendirilmelidir.
Tam doz miyelosupresif tedavi planlanan şemaya uygun olarak sürdürüldüğünden, tek başına NEULASTIM ile tedavi, trombositopeni ve aneminin önüne geçmek için yeterli değildir. Düzenli trombosit sayısı ve hematokrit takibi önerilmektedir. Ciddi trombositopeniye sebep oldukları bilinen tek veya kombinasyon halindeki kemoterapötik ajanların uygulanması sırasında özel dikkat gösterilmelidir.
Orak hücre krizleri, orak hücre hastalığı bulunan hastalarda pegfilgrastim kullanımıyla ilişkilendirilmiştir (Bkz. bölüm 4.8). Bu sebeple hekimler, orak hücre hastalığı bulunan hastalarda pegfilgrastim kullanırken dikkatli olmalı, uygun klinik parametreleri ve laboratuvar durumunu gözlemlemeli ve NEULASTIM’in dalak büyümesi ve vaso-oklusif krizlerle ilişkili olabileceği konusunda dikkatli olmalıdırlar.
NEULASTIM verilen hastaların % l’inden daha azında 100 x 109/1 veya daha yüksek akyuvar sayımı gözlenmiştir. Doğrudan bu düzeyde bir lökositoza bağlanabilecek hiçbir advers olay bildirilmemiştir. Akyuvar sayılarındaki bu tür yükselmeler geçici olup, tipik olarak uygulamanın 24 ile 48 saat sonrasında görülmektedir ve bu da NEULASTIM’in farmakodinamik etkileri ile tutarlıdır. NEULASTIM’in klinik etkileri ile tutarlı ve lökositoz için potansiyel olması sebebiyle, tedavi sırasında düzenli aralıklarla akyuvar sayımı yapılmalıdır. Lökosit sayısı beklenen alt seviyenin 50 x 109/L üzerinde ise, NEULASTIM tedavisi derhal kesilmelidir.
Eğer ciddi alerjik bir reaksiyon gelişirse, uygun bir tedavi verilmeli ve hasta birkaç gün boyunca yakından izlenmelidir. Ciddi aleıjik reaksiyon yaşayan hastalarda NEULASTIM tamamen kesilmelidir (Bkz. bölüm 4.8).
Hastalarda ve sağlıklı donörlerde progenitör kan hücrelerinin mobilizasyonunda, NEULASTIM’in güvenliliği ve etkinliği yeterince değerlendirilmemiştir.
Büyüme faktörü tedavisine yanıt olarak kemik iliğinin artan hematopoietik etkinliği geçici pozitif kemik görüntüleme değişiklikleriyle ilişkilendirilmiştir. Kemik görüntüleme sonuçlan yorumlanırken bu durum dikkate alınmalıdır.
NEULASTIM sorbitol içerir. Nadir kalıtımsal früktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir.
NEULASTIM her dozunda 1 mmol (23 mg)’dan daha az sodyum ihtiva eder; yani esasında “sodyum içermez”.
4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri
Hızlı bölünen miyeloid hücrelerin sitotoksik kemoterapiye karşı olan potansiyel duyarlılıkları nedeniyle, NEULASTIM sitotoksik kemoterapi uygulamasından yaklaşık 24 saat sonra uygulanmalıdır. Klinik çalışmalarda, NEULASTIM kemoterapiden 14 gün önce güvenli şekilde uygulanmıştır. NEULASTIM’in herhangi bir kemoterapi ajanı ile eş zamanlı kullanımı hastalarda değerlendirilmemiştir. Hayvan modellerinde NEULASTIM ve 5-florourasil (5-FU) veya diğer antimetabolitlerin eş zamanlı uygulanmasının miyelosupresyonu artırdığı gösterilmiştir.
Diğer hematopoietik büyüme faktörleri ve sitokinler ile olası etkileşimler klinik çalışmalarda özel olarak araştırılmamıştır.
Kendisi de nötrofıl salıverilmesini artıran bir madde olan lityum ile potansiyel etkileşim özel olarak araştırılmamıştır. Böyle bir etkileşimin zararlı olabileceği yolunda hiçbir kanıt yoktur.
NEULASTIM’in güvenliliği ve etkinliği nitrozüreler gibi gecikmiş miyelosupresyon ile ilişkili kemoterapi görmekte olan hastalarda değerlendirilmemiştir.
Spesifik etkileşim veya metabolizma çalışmaları gerçekleştirilmemiştir, bununla beraber klinik çalışmalar NEULASTIM’in herhangi bir diğer tıbbi ürün ile etkileşimine işaret etmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin hiçbir etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon:
Pediyatrik popülasyona ilişkin hiçbir etkileşim çalışması yürütülmemi ştir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (Kontrasepsiyon) uygulayanlarda ilacın kullanımı yönünden bir öneri bulunmamaktadır.
Gebelik dönemi
Pegfılgrastimin gebe kadınlarda kullanımı ile ilgili yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesinin bulunduğunu göstermiştir (Bkz. bölüm 5.3). İnsan embriyosuna veya fötusuna yönelik potansiyel risk bilinmemektedir.
Açık olarak gerekli olmadıkça, NEULASTIM gebelik sırasında kullanılmamalıdır.
Laktasyon dönemi
Emziren kadınlarla ilgili klinik deneyim mevcut değildir, bu nedenle NEULASTIM emziren kadınlara uygulanmamalıdır.
Üreme yeteneği/ Fertilite
Hayvanlardaki çalışmalar reprodüktif toksisite göstermiştir (Bkz. bölüm 5.3). İnsan embriyosuna ve fetüse olan potansiyel risk bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine etkileri ile ilgili bir çalışma yapılmamıştır.
4.8. İstenmeyen etkiler
4.8. İstenmeyen etkiler
, aşağıda tanımlanan sıklığa göre listelenmiştir:
Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1,000 ila < 1/100); seyrek (> 1/10,000 ila < 1/1,000); çok seyrek (< 1/10,000); bilinmiyor (Eldeki verilerden hareketle tahmin edilemiyor).
Güvenlilik profilinin özeti
En sık bildirilen advers olay kemik ağrısı (Çok yaygın) ve kas-iskelet sistemi ağrısıdır (Çok yaygın). Kemik ağrısı genel olarak hafıf-orta şiddette, geçici olmuş ve çoğu hastada standart ağrı kesicilerle kontrol altına alınabilmiştir.
NEULASTIM’in ilk veya takip eden tedavisi sırasında, deri döküntüsü, ürtiker, anjiyoödem, dispne, eritem, yüzde kızarıklık ve hipotansiyonu içeren hipersensitivite reaksiyonları bildirilmiştir (Yaygın olmayan sıklıkta). NEULASTIM kullanan hastalarda anafılaksiyi içeren ciddi aleıjik reaksiyonlar meydana gelebilir (yaygın olmayan sıklıkta) (Bkz. bölüm 4.4).
Yaygın olmayan sıklıkta, genellikle asemptomatik, splenomegali vakaları bildirilmiştir (Bkz. bölüm 4.4).
Pegfilgrastim uygulaması sonrasında bazıları ölümcül olabilen dalak yırtılması vakaları yaygın olmayan sıklıkta bildirilmiştir (Bkz. bölüm 4.4).
İnterstisyel pnömoni, pulmoner ödem, pulmoner infıltratlar ve pulmoner fıbrozisi içeren pulmoner advers olaylar yaygın olmayan sıklıkta bildirilmiştir. Yaygın olmayan sıklıkta, bu vakaların bazıları, ölümcül olabilen erişkin respiratuvar distres sendromu (ARDS) veya solunum yetmezliği ile sonuçlanmıştır (Bkz. bölüm 4.4).
Orak hücre hastalığı bulunan hastalarda izole orak hücre krizleri bildirilmiştir (Orak hücre hastalarında yaygın olmayan sıklıkta) (Bkz. bölüm 4.4).
Advers reaksiyonların özeti
Aşağıdaki veriler, klinik çalışmalardan alınan ve spontan raporlama yoluyla bildirilen advers reaksiyonları tanımlamaktadır. Her bir sıklık gruplandırmasında, istenmeyen etkiler azalan ciddiyet sıralamasına göre sunulmuşlardır.
Kan ve lenf sistemi hastalıkları
Yaygın: Trombositopeni1.
Yaygın olmayan: Orak hücre krizi2, lökositoz1.
Bağışıklık sistemi hastalıkları
Yaygın olmayan: Hipersensitivite reaksiyonları, anafılaksi.
Metabolizma ve beslenme hastalıkları
Yaygın olmayan: Ürik asit seviyelerinde yükselme.
Sinir sistemi hastalıkları
Çok yaygın: Baş ağrısı.
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Yaygın olmayan: Erişkin respiratuvar distres sendromu (ARDS)2, pulmoner advers olaylar (İnterstisyel pnömoni, pulmoner ödem, pulmoner infıltratlar ve pulmoner fıbrozis).
Gastrointestinal bozukluklar
Çok yaygın: Bulantı.
2 2 Yaygın olmayan: Dalak büyümesi , dalak yırtılması .
Deri ve deri altı doku ile ilgili bozukluklar
12 12
Yaygın olmayan: Sweet sendromu (Akut febril dermatoz) ’ , kütanoz vaskülit ’ .
Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları
Çok yaygın: Kemik ağrısı, kas-iskelet ağrısı (Miyalji, artralji, ekstremitelerde ağrı, sırt ağrısı, kas-iskelet ağrısı, boyun ağrısı).
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Enjeksiyon bölgesinde reaksiyon (Enjeksiyon bölgesinde ağrıyı da içerir).
Yaygın olmayan: Göğüs ağrısı (Kalple ilişkisi olmayan).
Araştırmalar
Yaygın olmayan: Laktat dehidrojenaz ve alkalin fosfataz seviyelerinde yükselme1, ALT veya AST’nin karaciğer fonksiyon testlerinde geçici yükselme1.
1 Seçilmiş advers reaksiyonlarla ilgili bölüme bakınız
2 Bu advers reaksiyon pazarlama sonrası izleme çalışmalarında tespit edilmiş ancak pazarlama onayını destekleyen ve yetişkinlerde yapılmış olan randomize, kontrollü klinik çalışmalarda gözlemlenmemiştir. Sıklık kategorisi, yedi adet randomize klinik çalışmadaki NEULASTIM kullanan 932 hastadan elde edilen verilerin istatistiksel hesaplaması yoluyla tayin edilmiştir.
Seçilmiş advers olaylar hakkında bilgilendirme
Yaygın olmayan sıklıkta Sweet sendromu vakaları bildirilmiştir. Bu vakaların bazılarında hematolojik malignansilerin rolünün olabileceği düşünülmektedir.
NEULASTIM ile tedavi edilen hastalarda yaygın olmayan sıklıkta kütanoz vaskülit vakaları bildirilmiştir. NEULASTIM kullanan hastalarda vaskülitin mekanizması bilinmemektedir.
NEULASTIM’in ilk veya takip eden tedavilerinde, yaygın sıklıkta, enjeksiyon bölgesinde ağrı ve enjeksiyon bölgesinde eritemi içeren enjeksiyon bölgesi reaksiyonları meydana gelmiştir.
Yaygın olmayan sıklıkta lökositoz ( [WBC]> 100xl09/l) bildirilmiştir.
Sitotoksik kemoterapi sonrasında, NEULASTIM verilen hastalarda, ürik asit ve alkalin fosfataz düzeylerinde, klinik etkisi olmayan, geri dönüşlü, yaygın olmayan oranda, hafif ile orta düzeylerde yükselmeler; laktat dehidrojenaz düzeylerinde klinik etkisi olmayan, geri dönüşlü, yaygın olmayan, hafif ile orta düzeylerde yükselmeler ortaya çıkmıştır.
Kemoterapi alan hastalarda, çok yaygın sıklıkta bulantı ve baş ağrısı gözlemlenmiştir.
Sitotoksik kemoterapi sonrası pegfilgrastim alan hastalarda, karaciğer fonksiyon testlerinden ALT (Alanin aminotransferaz) veya AST’de (Aspartat aminotrasferaz) yaygın olmayan sıklıkta yükselmeler gözlemlenmiştir. Bu yükselmeler geçici olmuş ve sonradan başlangıç seviyesine dönmüştür.
Yaygın trombositopeni vakaları bildirilmiştir.
Pediyatrik popülasyon
Çocuklardaki deneyim sınırlıdır. 0-5 yaş arası çocuklarda (%92), 6-11 ve 12-21 yaşındaki çocuklara (Sırasıyla %80 ve %67) ve yetişkinlere kıyasla daha yüksek sıklıkta ciddi advers reaksiyon gözlemlenmiştir. Bildirilen en sık advers reaksiyon kemik ağrısıdır (Bkz. bölüm
5.1 ve 5.2).
4.9. Doz aşımı ve tedavisi
Sınırlı sayıda sağlıklı gönüllüye ve küçük hücreli dışı akciğer kanseri hastalarına 300 mikrogram/kg’lik tek dozlar, ciddi advers etkiler görülmeden verilmiştir. Advers olaylar, daha düşük dozda pegfilgrastim alan hasta veya sağlıklı gönüllülerde görülenlere benzer düzeyde seyretmiştir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Hematopoietik büyüme faktörü/ Sitokinler ATC kodu: L03AA13 Etki mekanizması
İnsan granülosit koloni stimülan faktörü (G-CSF) kemik iliğinde nötrofıl oluşumu ve salıverilmesini düzenleyen bir glikoproteindir. Pegfilgrastim rekombinant G-CSF’nin (r-metHuG-CSF) tek 20 kDa polietilen glikol (PEG) moleküllü kovalent bileşiğidir. Pegfilgrastim azalmış renal klerens nedeniyle fılgrastimin uzun etki süreli bir formudur.
Lökosit sayımındaki artış (Lökositoz), pegfilgrastim uygulamasının beklenen bir sonucudur. Doğrudan lökositozla ilişkilendirilebilecek bir advers olay bildirilmemiştir. Lökosit sayımındaki artış geçicidir ve pegfılgrastimin farmakodinamik etkileriyle tutarlıdır.
Pegfilgrastim ve fılgrastimin, monositler ve/veya lenfositlerde minör yükselmelerle birlikte periferik kan nötrofıl sayılarında 24 saat içinde belirgin bir artışa neden olan, aynı etki tarzına sahip oldukları gösterilmiştir. Kemotaktik ve fagositik fonksiyon testleri ile gösterildiği üzere, pegfılgrastime yanıt olarak üretilen nötrofıller, fılgrastime benzer şekilde normal veya artmış fonksiyon göstermektedir. Diğer hematopoietik büyüme faktörleri ile olduğu gibi, G-CSF’nin insan endotelyel hücreleri üzerine in vitro stimülan özellikleri gösterilmiştir.
Doksorubisin ve dosetakselden oluşan miyelosupresif kemoterapi uygulanmakta olan yüksek riskli evre II-IV meme kanserli hastalarda gerçekleştirilen iki randomize, çift-kör pivotal çalışmada her kür başına tek doz olarak pegfilgrastim kullanılması, günlük fılgrastim uygulamaları (Ortanca değeri olarak 11 günlük uygulama) ile gözlenene benzer şekilde, nötropeni süresini ve febril nötropeni görülme sıklığını düşürmüştür. Büyüme faktörü desteği verilmediğinde, bu rejimin ortalama 5 ile 7 gün arasında evre 4 nötropeni süresine ve % 30-40 febril nötropeni görülme sıklığına neden olduğu bildirilmiştir.
6 mg sabit doz pegfilgrastim kullanılan ilk çalışmada (n= 157), evre 4 nötropeni ortalama süresi pegfilgrastim grubunda 1.8 gün olurken, fılgrastim grubunda 1.6 gün olmuştur (Fark
0.23 gün, %95 GA -0.15, 0.63). Tüm çalışma boyunca febril nötropeni oranı pegfılgrastimle tedavi edilen hastalarda % 13 olurken, fılgrastimle tedavi edilen hastalarda % 20 olmuştur (Fark - %7, %95 GA -%19, %5).
Vücut ağırlığına göre ayarlanmış (100 mikrogram/kg) doz kullanılan ikinci bir çalışmada (n= 310), evre 4 nötropeni ortalama süresi pegfilgrastim grubunda 1.7 gün, fılgrastim grubunda 1.8 gün olmuştur (Fark 0.03 gün, %95 GA -0.36, 0.30). Genel febril nötropeni oranı pegfılgrastimle tedavi edilen hastalarda % 9 ve fılgrastimle tedavi edilen hastalarda % 18 olmuştur (fark - %9, %95 GA -%16.8, -%1.1).
Plasebo kontrollü bir çalışmada pegfılgrastimin febril nötropeni sıklığı üzerindeki etkisi, %10-20’lik bir febril nötropeni oranıyla ilişkili olduğu bildirilen bir kemoterapi rejiminin (4 kür boyunca her 3 haftada bir 100mg/m2 dosetaksel) uygulanmasından sonra değerlendirilmiştir. Bu çalışmada 928 hasta her siklusta kemoterapiden yaklaşık 24 saat (Yani Gün 2’de) sonra tek bir doz pegfilgrastim veya plasebo almak üzere randomize edilmiştir. Febril nötropeni sıklığı, plaseboyla karşılaştırıldığında pegfilgrastim almak üzere randomize edilen hastalarda önemli ölçüde düşüktür (Sırasıyla %17’ye karşılık %1, p<0.001). Febril nötropeni klinik tanısıyla ilişkili hastaneye yatma ve IV anti-infektif kullanımı sıklığı, pegfilgrastim grubunda plasebo grubuyla karşılaştırıldığında önemli ölçüde düşüktür (Sırasıyla %1’e karşılık %14, p<0.001 ve %2’ye karşılık %10, p<0.001).
5.2. Farmakokinetik özellikler
Genel özellikler
Emilim:
Tek bir deri altı pegfilgrastim dozu sonrasında, pegfilgrastim doruk serum konsantrasyonu doz uygulamasının 16 ile 120 saat sonrasında ortaya çıkar.
Dağılım:
Pegfilgrastim serum konsantrasyonları miyelosupresif kemoterapi sonrasındaki nötropeni dönemi boyunca korunur. Pegfilgrastim dağılımı plazma kompartmanı ile sınırlıdır.
Biyotransformasyon:
Veri yoktur.
Eliminasyon:
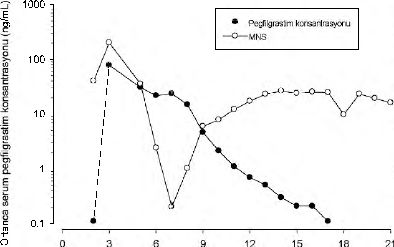
Pegfilgrastimin eliminasyonu doz açısından non-lineerdir: pegfılgrastimin serum klerensi doz arttıkça düşer. Pegfilgrastim başlıca olarak, yüksek dozlarda doyuma ulaşan, nötrofıl aracılı klerens ile (> %99) atılmaktadır. Kendini-düzenleyici bir klerens mekanizması ile tutarlı olarak, pegfilgrastim serum konsantrasyonu nötrofıl tablosunda düzelmenin ortaya çıkması ile birlikte hızla düşer (Bkz. Şekil 1).
Doğrusallık/ Doğrusal Olmayan Durum:
Pegfılgrastimin eliminasyonu doz açısından non-lineerdir.
Şekil 1. Kemoterapi ile tedavi edilen hastalarda tek 6 mg enjeksiyonu sonrasında ortanca pegfilgrastim serum konsantrasyonu ve mutlak nötrofil sayısı (MNS)
profili
r 100
7 10
7 1
L 0.1
Çalışma Günü
CO
Z
c75
S
t
o
Hastalardaki karakteristik özellikler
Böbrek/Karaciğer yetmezliği:
Nötrofıl aracılı klerens mekanizmasına bağlı olarak, pegfılgrastimin farmakokinetiğinin böbrek veya karaciğer bozukluğu tarafından etkilenmesi beklenmez.
Pediyatrik popülasyon:
NEULASTİM’in güvenliliği ve farmakokinetiği sarkoma hastası olan 37 pediyatrik hastada çalışılmıştır. NEULASTIM’in 100 mikrogram/kg subkutan uygulaması sonrasında elde edilen sistemik maruziyet (EAAo-mf, ortalama ± Standart Sapma) 6-11 yaş grubunda (n=10) 22.0 (±13.1) mikrogram.saat/mL, 12-21 yaş grubunda (n=13) 29.3 (±23.2) mikrogram.saat/mL ve en genç yaş grubunda (0-5 yaş, n=ll) 47.9 (±22.5) mikrogram.saat/mL olmuştur. İlgili yaş gruplarına karşılık gelen terminal yanlanma ömrü sırasıyla 20.2 (±11.3), 21.2 (±16.0) ve 30.1 (±38.2) saat olmuştur. En yaygın advers olay yetişkinlerde olduğu gibi kemik ağrısı olmuştur (Bkz. bölüm 4.8 ve bölüm 4.5).
Geriyatrik popülasyon:
Sınırlı veriler, yaşlı hastalardaki (>65 yaş) pegfilgrastim farmakokinetiğinin erişkinlerdeki ile benzer olduğunu göstermiştir.
Karsinoj eni site:
Belli malign hücrelerin, granülosit koloni uyarıcı faktör (G-CSF) reseptörlerini ifade ettiği gösterilmiştir. Pegfılgrastimin herhangi bir tümör tipi için büyüme faktörü olarak etki etme olasılığı göz ardı edilemez.
Pegfılgrastimin karsinoj enitik potansiyeli uzun süreli hayvan çalışmalarında değerlendirilmemiştir.
Haftada bir 1000 mcg/kg’a (İnsan için önerilen dozdan yaklaşık 23 kat fazla) kadar pegfılgrastimden oluşan subkutan enjeksiyon verilen sıçanlarda yapılan 6 aylık bir toksisite çalışmasında, prekanseröz veya kanseröz lezyon görülmemiştir.
Mutaj eni site:
Mutajenisite çalışmaları yapılmamıştır.
Teratoj eni site:
Subkutan olarak pegfilgrastim verilen gebe sıçanların yavrularında advers etki gözlenmemiştir ancak tavşanlarda pegfılgrastimin düşük subkutan dozlarda embriyo/fetal toksisiteye (Embriyo kaybı) yol açtığı gösterilmiştir. Sıçanlarla yapılan çalışmalarda pegfılgrastimin plasentayı geçebileceği gösterilmiştir. Bu bulguların insanlar açısından ilgisi bilinmemektedir.
Diğer:
Tekrarlayan doz toksisitesiyle ilgili geleneksel çalışmalardan alınan preklinik veriler, lökosit sayımında artışlar, kemik iliğinde miyeloid hiperplazi, ekstramedüler hematopoez ve dalak büyümesi dahil beklenen farmakolojik etkiler göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sodyum asetat*
Sorbitol Polisorbat 20 Enjeksiyonluk su
Sodyum hidroksit (pH 4’e ayarlamak için yeter miktar kullanılabilir)
6.2. Geçimsizlikler
NEULASTIM sodyum klorür solüsyonları ile geçimsizdir.
6.3. Raf ömrü
2-8 °C’de (Buzdolabında) saklayınız.
Dondurmayınız.
NEULASTIM steril ancak koruyucu içermeyen bir çözeltidir.
6.5. Ambalajın niteliği ve içeriği
NEULASTIM 6 mg/0.6 mL S.C. enjeksiyon için kullanıma hazır şırınga, 1 adet.
Paslanmaz çelik bir iğnesi olan, Tip I kalite camdan üretilmiş, 0.6 mL tek kullanımlık enjeksiyona hazır şırınga.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanmadan önce, NEULASTIM çözeltisi gözle görünen partiküller açısından incelenmelidir. Sadece berrak ve renksiz olan çözelti enjekte edilmelidir.
Aşırı çalkalama, pegfılgrastimi topaklaştırarark biyolojik olarak inaktif hale çevirebilir.
Enjeksiyon öncesinde enjeksiyona hazır şırınganın oda sıcaklığına ulaşmasına izin verilmelidir.
Farmasötik ürünlerin çevreye bırakılmasından kaçınılmalıdır. İlaçlar, atık suları ve evsel atık ile imha edilmemelidir. Varsa bulunduğunuz yerdeki donanımlı atık toplama sistemlerini kullanınız.
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği” ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği’ne” uygun olarak imha edilmelidir.
 Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz.
Ruh ve Akıl Sağlığımızı Geliştirmek
İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve
ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul
etmelisiniz. |
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| NEULASTIM | 8699862950145 | 14,137.81TL |
| ZIEXTENZO | 8681428951680 | 10,955.28TL |
| Diğer Eşdeğer İlaçlar |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Geri Ödeme Kodu | Geri Ödemede Değil |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505952048 |
| Etkin Madde | Pegfilgrastim |
| ATC Kodu | L03AA13 |
| Birim Miktar | 6+0,6 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünostimülan İlaçlar > Pegfilgrastim |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |