NEUTAXAN 60 mg/1.5 ml infüzyon için konsantre çözelti içeren 1 flakon + 1 çözücü flakon Farmasötik Özellikler
{ Kabazitaksel }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Konsantre çözelti:
Etanol anhidrus Sitrik asit anhidrus Polisorbat 80
Çözücü:
Etanol (%96) Enjeksiyonluk su
6.2. Geçimsizlikler
Bu tıbbi ürün Bölüm 6.6.'da verilenlerin dışında başka hiçbir tıbbi ürün ile karıştırılmamalıdır.
İnfüzyonluk çözeltinin hazırlanması ve uygulanması için PVC infüzyon kapları veya poliüretan infüzyon setleri kullanmayınız.
6.3. Raf ömrü
Açılmamış flakonlar: 36 ay
Açıldıktan sonra:
Konsantre ve çözücü flakonları açıldıktan sonra hemen kullanılmalıdır. Hemen kullanılmayacak ise, saklama süresi ve koşulları kullanıcının sorumluluğundadır.
Konsantre çözeltinin çözücü ile ilk seyreltilmesi sonrasında:
Kimyasal ve fiziksel kullanım stabilitesi oda sıcaklığında (15-30°C) 1 saat, buzdolabı koşullarında (2-8°C) ise 24 saattir. Mikrobiyolojik açıdan, konsantre-çözücü karışımı hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, saklama süresi ve koşulları kullanıcının sorumluluğundadır ve seyreltme işlemi kontrollü ve valide aseptik koşullar altında yapılmadığı takdirde, normalde 2-8°C'de 24 saati aşmamalıdır.
İnfüzyon poşetinde/torbasında final seyreltme sonrasında:
İnfüzyonluk çözeltinin kimyasal ve fiziksel stabilitesinin oda sıcaklığında (15-30°C) 8 saate kadar devam ettiği (1 saatlik infüzyon süresi dahil) ve buzdolabı koşullarında (2-8°C) 48 saat (1 saatlik infüzyon süresi dahil) devam ettiği gösterilmiştir.
Mikrobiyolojik açıdan, infüzyonluk çözelti hemen kullanılmalıdır. Hemen kullanılmadığı takdirde, saklama süresi ve koşulları kullanıcının sorumluluğundadır ve seyreltme işlemi kontrollü ve valide aseptik koşullar altında yapılmadığı takdirde, normalde 2-8°C'de 24 saati aşmamalıdır.
6.4. Saklamaya yönelik özel tedbirler
30°C altındaki oda sıcaklığında saklayınız. Dondurmayınız.
Seyreltilmiş tıbbi ürünün saklama koşulları için Bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
1 kutu, 1 adet konsantre çözelti içeren flakon ve 1 adet çözücü içeren flakon içerir.
Konsantre çözelti içeren flakon, şeffaf plastik flip-off kapak ile kaplanmış alüminyum kapak ve gri renkli klorobütil lastik tıpa içeren 15 ml'lik berrak cam (Tip I) flakon şeklindedir. Her flakon 1.5 ml nominal hacim içinde 60 mg kabazitaksel içerir (dolum hacmi: 1.83 ml/73.2 mg kabazitaksel). Bu dolum hacmi, ön karışımın hazırlanması sırasındaki sıvı kaybını telafi etmek amacıyla, kabazitakselin geliştirilmesi sırasında belirlenmiştir. Bu fazladan eklenen miktar, kabazitakselle birlikte verilen çözücü içeriğinin tamamı kullanılarak sulandırma sonrasında, flakondan 10 mg/ml (bir flakonda 60 mg) kabazitaksel içeren en az 6 ml ön karışım çekilebilmesini sağlamak içindir.
Çözücü içeren flakon, şeffaf plastik flip-off kapak ile kaplanmış alüminyum kapak ve gri renkli klorobütil lastik tıpa içeren 15 ml'lik berrak cam (Tip I) flakon şeklindedir. Her flakon 4.5 ml nominal volüm içerir (dolum hacmi: 5.67 mL). Bu dolum hacmi, ön karışım hazırlanması sırasındaki sıvı kaybını telafi etmek amacıyla, kabazitakselin geliştirilmesi sırasında belirlenmiştir. Bu fazladan eklenen miktar, çözücü içeriğinin tamamının 60 mg konsantre çözelti flakonuna eklenmesinden sonra, 10 mg/ml konsantrasyonunda kabazitaksel içeren bir ön karışımı garantilemek içindir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
NEUTAXAN yalnızca sitotoksik ilaçların hazırlanması konusunda eğitilmiş personel tarafından hazırlanmalı ve kullanılmalıdır. Ürün, gebe personel tarafından hazırlanmamalıdır. Diğer antineoplastik ilaçlarda olduğu gibi, NEUTAXAN çözeltisinin hazırlanması sırasında koruyucu araç kullanımı, kişisel koruyucu ekipman (eldiven vb.) ve hazırlama işlemleri dikkate alınmalıdır. Hazırlama sırasında NEUTAXAN deri ile temas ettiğinde hemen su ve sabun ile iyice yıkanmalıdır. Mukoza membranlarına teması halinde hemen ve iyice su ile yıkanmalıdır.
Karıştırma ve seyreltme öncesinde bu bölümün TAMAMINI dikkatlice okuyunuz. NEUTAXAN uygulama öncesinde İKİ kez seyreltilmelidir. Aşağıda sunulan hazırlama talimatlarına uyunuz. DİKKAT: Hem NEUTAXAN hem de çözücü flakonu, karışımın hazırlanması sırasında oluşan sıvı kaybını telafi etmek amacıyla fazladan eklenmiş bir miktar çözelti içermektedir. Bu fazladan eklenen miktar, çözücü içeriğinin TAMAMI İLE seyreltme sonrasında, 10 mg/ml konsantrasyonunda kabazitaksel içeren bir önkarışımı garantilemek içindir.
İnfüzyonluk konsantre çözeltiyi infüzyon çözeltisine eklemeden önce, her zaman ambalajda tedarik edilen çözücü ile seyreltiniz.
İnfüzyonluk çözeltinin hazırlanmasında aşağıdaki iki adımlı seyreltme işlemi aseptik koşullarda yürütülmelidir.

Adım 1: İnfüzyonluk konsantre çözeltinin tedarik edilen çözücü ile ilk seyreltilmesi işlemi
Adım 1.1
NEUTAXAN konsantre flakonu ve çözücüsü incelenir. Konsantre çözelti flakonu içindeki çözelti berrak olmalıdır.

Adım 1.2
Bir enjektör ile çözücü içeriğinin tümü flakon kısmen ters çevrilerek çekilir.
Adım 1.3
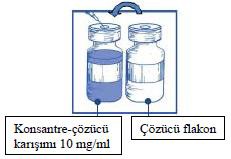
Tüm içerik NEUTAXAN konsantre flakonuna enjekte edilir.
Çözücü enjeksiyonu sırasında köpüklenmeyi önlemek için iğne konsantre flakonunun duvarına doğru tutularak yavaşça enjekte edilir.
Elde edilen konsantre-çözücü karışımı 10 mg/ml kabazitaksel içerir.
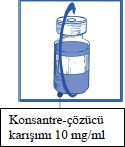
Adım 1.4
Enjektör ve iğne çıkarılır, el ile yavaşça, birkaç kez ters çevrilerek ve berrak/homojen bir çözelti elde edilinceye dek karıştırılır. Bu işlem yaklaşık 45 saniye sürmelidir.
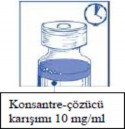
Adım 1.5
Çözelti yaklaşık 5 dakika dinlendirilir ve tekrar berrak/homojen olup olmadığı kontrol edilir.
Bu sürenin sonunda köpüğün olması normaldir.
Elde edilen konsantre-çözücü karışımı 10 mg/ml kabazitaksel içermektedir (en az 6 ml çekilebilir hacimli). Ardından hemen (1 saat içinde) ikinci adımdaki seyreltme işlemine geçilir.
Reçete edilen dozu uygulamak için birden fazla konsantre-çözücü flakon gerekebilir. Adım 2: İnfüzyonluk (final) çözeltinin hazırlanması
Adım 2.1
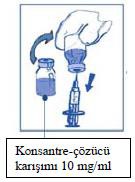
Hasta için gerekli olan doza uygun hacimde ve 10 mg/ml konsantrasyonundaki konsantre-çözücü karışımı dereceli bir enjektör ile aseptik olarak çekilir. Örneğin, 45 mg NEUTAXAN için Adım 1'i takiben hazırlanmış 4,5 ml konsantre-çözücü karışımı gerekmektedir.
Bu çözelti flakonunun duvarında köpük olabileceğinden enjektör iğnesinin çekilirken ortadan yerleştirilmesi tercih edilir.
Adım 2.2
PVC içermeyen infüzyon torbası kullanılır ve çekilen miktar %5 glukoz çözeltisi veya
%0,9 (9 mg/ml) sodyum klorür çözeltisi içine alınır. İnfüzyonluk çözeltinin konsantrasyonu 0,10-0,26 mg/ml olmalıdır.

Adım 2.3
Enjektör çıkarılır ve infüzyon poşeti/torbası içeriği el ile döndürülerek karıştırılır.
Adım 2.4
Tüm parenteral ürünlerde olduğu gibi, elde edilen infüzyonluk çözelti kullanılmadan önce görsel olarak incelenmelidir. İnfüzyonluk çözelti aşırı doymuş olduğundan zaman içinde kristalleşebilir. Bu durumda çözelti kullanılmamalı ve imha edilmelidir.
NEUTAXAN infüzyonluk çözelti hemen kullanılmalıdır. Bununla birlikte, kullanım sırasındaki saklama süresi bölüm 6.3'de belirtilen özel koşullarda daha uzun olabilir.
NEUTAXAN'ın hazırlanması ve uygulanması için PVC infüzyon kapları ve poliüretan infüzyon setleri kullanılmamalıdır.
Uygulama sırasında 0,22 µm'lik (0,2 mikrometre olarak da adlandırılır) dahili filtre kullanılması önerilmektedir.
NEUTAXAN belirtilenler dışında herhangi bir tıbbi ürünle karıştırılmamalıdır.
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| JEVTANA | 8699809760707 | 73,277.80TL |
| NEUTAXAN | 8699541761116 | 73,277.80TL |
| Diğer Eşdeğer İlaçlar |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Gensenta İlaç Sanayi A.Ş.
| Geri Ödeme Kodu | A16787 |
| Satış Fiyatı | 73277.8 TL [ 14 Apr 2025 ] |
| Önceki Satış Fiyatı | 73277.8 TL [ 7 Apr 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699541761116 |
| Etkin Madde | Kabazitaksel |
| ATC Kodu | L01CD04 |
| Birim Miktar | 60 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Alkaloidler ve Diğer Doğal İlaçlar (64 ilaç) > Kabazitaksel |
| Yerli ve Beşeri bir ilaçdır. |