NINLARO 2.3 mg 3 kapsül Kısa Ürün Bilgisi
{ Iksazomib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
NINLARO® 2.3 mg kapsül Sitotoksik
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her kapsül 2,3 mg iksazomibe eşdeğer 3,3 mg iksazomib sitrat içerir.
Yardımcı maddeler
Yardımcı maddelerin tam listesi için Bölüm 6.1'e bakınız
3. FARMASÖTİK FORMU
Kapsül.
Siyah mürekkeple kapak kısmında "Takeda" ve gövde kısmında "2.3 mg" ifadeleri basılı, açık pembe jelatin kapsül.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
NINLARO, lenalidomid ve deksametazon ile kombinasyon halinde, daha önce en az bir tedavi görmüş yetişkin multipl miyelom hastalarının tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Pozoloji /uygulama sıklığı ve süresi:
Multipl miyelom tedavisinde deneyimli bir hekim tarafından tedaviye başlanmalı ve takibi
yapılmalıdır. NINLARO'nun önerilen başlangıç dozu, 28 günlük bir tedavi siklusunun 1.,
8. ve 15. günlerinde haftada bir kez, oral yolla uygulanan 4 mg'lık bir kapsüldür.
Lenalidomidin önerilen başlangıç dozu, 28 günlük bir tedavi siklusunun 1. günü ile 21. günü
arasında günde bir kez 25 mg uygulanacak şekildedir.
Deksametazonun önerilen başlangıç dozu, 28 günlük bir tedavi siklusunun 1., 8., 15. ve 22. günlerinde, 40 mg uygulanacak şekildedir.
Lenalidomid ve Deksametazon ile Birlikte Alınan NINLARO İçin Dozaj Planı
28 Günlük Siklus (4 haftalık siklus) | ||||||||
| 1. Hafta | 2. Hafta | 3. Hafta | 4. Hafta | ||||
| 1. Gün | 2.-7. Günler | 8. Gün | 9.-14. Günler | 15. Gün | 16.-21. Günler | 22. Gün | 23.- 28. Günler |
NINLARO | ï¡ |
| ï¡ |
| ï¡ |
|
|
|
Lenalidomid | ï¡ | ï¡ Günlük | ï¡ | ï¡ Günlük | ï¡ | ï¡ Günlük |
|
|
Deksametazon | ï¡ |
| ï¡ |
| ï¡ |
| ï¡ |
|
ï¡=İlaç alımı
Lenalidomid ve deksametazon hakkında daha fazla bilgi için bu ilaçların kısa ürün bilgilerine
bakınız.
Yeni tedavi siklusu başlatılmadan önce:
Mutlak nötrofil sayımı ≥ 1.000/mm3 olmalıdır.
4.3. Kontrendikasyonlar
Etkin madde
hipersensitivite.
NINLARO'nun lenalidomid ve deksametazon ile birlikte uygulanmasından dolayı ilave kontrendikasyonlar için bu tıbbi ürünlerin Kısa Ürün Bilgilerine (KÜB) bakınız.
4.4. Özel kullanım uyarıları ve önlemleri
NINLARO'nun lenalidomid ve deksametazon ile birlikte uygulanmasından dolayı ilave özel
kullanım uyarıları ve önlemleri için bu tıbbi ürünlerin KÜB'üne bakınız.
Trombositopeni
NINLARO kullanımı ile trombositopeni bildirilmiş, en düşük trombosit sayımı tipik olarak her 28 günlük siklusun 14.-21. günleri arasında ve başlangıç düzeyine iyileşme bir sonraki siklusun başlangıcında gerçekleşmiştir (Bkz. Bölüm 4.8).
NINLARO ile tedavi sırasında trombosit sayımı en az aylık olarak izlenmelidir. Lenalidomidin kısa ürün bilgisine göre ilk üç siklus sırasında daha sık izleme uygulanması düşünülmelidir. Trombositopeni, standart tıbbi kılavuzlar uyarınca doz modifikasyonları (Bkz. Bölüm 4.2) ve
trombosit transfüzyonları ile tedavi edilmelidir.
Gastrointestinal Toksisiteler
NINLARO kullanımı sonucunda, zaman zaman antidiyareik ve antiemetik ilaç kullanımı ve destekleyici bakım gerektiren diyare, kabızlık, mide bulantısı ve kusma bildirilmiştir (Bkz. Bölüm 4.8). Şiddetli semptomlar (Grad 3-4) için doz ayarlanmalıdır (Bkz. Bölüm 4.2). Eğer şiddetli gastrointestinal olaylar olursa serum potasyum seviyesinin izlenmesi önerilmektedir.
Periferik nöropati
NINLARO kullanımı ile periferik nöropati bildirilmiştir (Bkz. Bölüm 4.8). Hasta, periferik nöropati belirtileri için izlenmelidir. Yeni veya kötüye giden periferik nöropati yaşayan hastaların dozlarının ayarlanması gerekebilir (Bkz. Bölüm 4.2).
Periferik ödem
NINLARO kullanımı ile periferik ödem bildirilmiştir (Bkz. Bölüm 4.8). Hasta, altta yatan sebepler açısından değerlendirilmeli ve gerekli görüldüğü şekilde hastaya destekleyici bakım sağlanmalıdır. Deksametazon dozu, kısa ürün bilgisine ya da Grad 3 veya 4 için NINLARO'ya göre ayarlanmalıdır (Bkz. Bölüm 4.2).
Kutanöz reaksiyonlar
NINLARO kullanımı ile döküntü bildirilmiştir (Bkz. Bölüm 4.8). Grad 2 veya üzeri durumunda
döküntü, destekleyici bakım veya dozun ayarlanması ile tedavi edilmelidir (Bkz. Bölüm 4.2). NINLARO kullanımı ile Stevens-Johnson sendromu da bildirilmiştir. (bkz bölüm 4.8) Stevens- Johnson sendromu meydana gelirse NINLARO kullanımı kesilmelidir.
Trombotik mikroanjiyopati
NINLARO alan hastalarda, trombotik trombositopenik purpura (TTP)'yı da içeren trombotik mikroanjiyopati (TMA) vakaları bildirilmiştir. Bu olaylardan bazıları ölümle sonuçlanmıştır. TMA'nın belirtileri ve semptomları izlenmelidir. Eğer teşhis şüphesi varsa NINLARO tedavisi durdurulmalı ve hastalar olası TMA için değerlendirilmelidir. Eğer TMA teşhis edilmezse NINLARO tedavisi tekrar başlatılabilir. Daha önce TMA geçirmiş olan hastalarda yeniden başlatılan NINLARO tedavisinin güvenliliği bilinmemektedir.
Hepatotoksisite
NINLARO kullanımı ile ilaç ile indüklenmiş karaciğer hasarı, hepatoselüler hasar, hepatik steatoz, kolestatik hepatit ve hepatotoksisite yaygın olmayan biçimde bildirilmiştir (Bkz.
Bölüm 4.8). Grad 3 veya 4 belirtiler için hepatik enzimler düzenli şekilde izlenmeli ve doz
ayarlanmalıdır (Bkz. Bölüm 4.2).
Gebelik
Doğurganlık potansiyeline sahip kadınlara iksazomib tedavisi esnasında gebe kalmamaları gerektiği belirtilmelidir. İksazomib gebelik esnasında kullanılır veya hasta iksazomib kullanırken gebe kalırsa, hasta fötusa yönelik potansiyel zarar konusunda uyarılmalıdır. Doğurganlık çağındaki kadınlara NINLARO tedavisi esnasında ve en son dozdan sonraki 90 gün boyunca etkili bir doğum kontrol yöntemi kullanması gerektiğini söyleyiniz (Bkz. Bölüm 4.5 ve 4.6). Hormonal kontraseptif kullanan kadınların buna ek olarak bir bariyer doğum kontrol yöntemi kullanması gerekmektedir.
Posterior reversibl ensefalopati sendromu
NINLARO alan hastalarda posterior reversibl ensefalopati sendromu (PRES) meydana gelmiştir. PRES nöbet, hipertansiyon, baş ağrısı, bilinç değişkenliği ve görsel bozukluklar gibi belirtiler gösteren nadir, geri dönüşümlü, nörolojik bir bozukluktur. Tercihen Manyetik Rezonans Görüntüleme olmak üzere tanının doğrulanması için beyin görüntüleme kullanılmaktadır. PRES'in geliştiği hastalarda NINLARO kullanımı sonlandırılmalıdır.
Güçlü CYP3A indükleyiciler
Güçlü indükleyiciler NINLARO'nun etkisini azaltabileceğinden karbamazepin, fenitoin, rifampisin ve St. John's Wort (Hypericum perforatum) gibi güçlü CYP3A indükleyicilerin kullanımından kaçınılmalıdır (bkz bölüm 4.5 ve 5.2). Güçlü bir CYP3A indükleyici kullanımının kaçınılmaz olduğu durumlarda hastalık yakından takip edilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakokinetik etkileşimlerCYP inhibitörleri
İksazomib ile güçlü bir CYP3A inhibitörü olan klaritromisinin birlikte uygulanması, iksazomibin sistemik maruziyetinde klinik olarak anlamlı bir değişiklik ile sonuçlanmamıştır. İksazomib Cmaks %4 oranında azalmış ve EAA %11 oranında artmıştır. Bu nedenle güçlü CYP3A inhibitörlerinin birlikte uygulanması ile iksazomib için herhangi bir doz modifikasyonu gerekmemektedir.
Bir popülasyona ait farmakokinetik analizinin sonuçlarına dayanarak, iksazomib ile güçlü CYP1A2 inhibitörlerinin birlikte uygulanması, iksazomibin sistemik maruziyetinde klinik olarak anlamlı bir değişiklik ile sonuçlanmamıştır. Bu nedenle güçlü CYP1A2 inhibitörlerinin birlikte uygulanması ile iksazomib için herhangi bir doz modifikasyonu gerekmemektedir.
CYP indükleyicileri
İksazomibin rifampisin ile birlikte uygulanması, iksazomib Cmaks değerini %54 ve EAA'yı %74 oranında azaltmıştır. Bu nedenle güçlü CYP3A indükleyicilerinin iksazomib ile birlikte uygulanması önerilmemektedir (Bkz. Bölüm 4.4).
İksazomibin diğer tıbbi ürünler üzerinde etkisi
İksazomib geri dönüşümlü değildir ve 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 veya 3A4/5 CYP'lerinin zamana bağlı inhibitörleri değildir. İksazomib CYP1A2, CYP2B6 ve CYP3A4/5 aktivitesini veya ilgili immünoreaktif protein seviyelerini indüklememiştir. İksazomibin, CYP inhibisyonu veya indüksiyonu ile ilaç-ilaç etkileşimine neden olması beklenmemektedir.
Taşıyıcı bazlı etkileşimler
İksazomib, P-gp'nin düşük afiniteli substratıdır. İksazomib BCRP, MRP2 veya hepatik OATP'lerin substratı değildir. İksazomib P-gp, BCRP, MRP2, OATP1B1, OATP1B3, OCT2, OAT1, OAT3, MATE1 veya MATE2-K'nin inhibitörü değildir. İksazomibin, taşıyıcı aracılı ilaç-ilaç etkileşimlerine neden olması beklenmemektedir.
Oral kontraseptifler
NINLARO; diğer enzimlerin ve taşıyıcıların yanı sıra CYP3A4'ün zayıf ila orta derecede bir indükleyicisi olduğu bilinen deksametazon ile birlikte uygulandığında oral kontraseptiflerin azalmış etkililik riskinin göz önünde bulundurulması gerekmektedir. Hormonal doğum kontrol yöntemi kullanan kadınlar, ayrıca bariyer doğum kontrol yöntemi de kullanmalıdır.
Özel popülasyonlara ilişkin ek bilgiler
Spesifik bir veri bulunmamaktadır.
Pediatrik popülasyon
Spesifik bir veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
NINLARO'nun lenalidomid ve deksametazon ile birlikte uygulanmasından dolayı fertilite, gebelik ve laktasyon hakkında ilave bilgi için bu tıbbi ürünlerin KÜB'lerine bakınız.
Genel tavsiye
Gebelik kategorisi: D (Bkz. Bölüm 4.4)
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Kadın hastalar, fetüse yönelik potansiyel risk ve NINLARO tedavisi sırasında gebe kalmaktan kaçınmaları konusunda bilgilendirilmelidir. Üreme potansiyeli olan erkek ve kadın hastalar, tedavi sırasında ve tedaviden sonra 90 gün boyunca etkili doğum kontrol önlemleri almalıdır. Çocuk doğurma potansiyeli bulunan ancak doğum kontrolü (kontrasepsiyon) uygulamayan kadınlarda NINLARO kullanımı önerilmez.
NINLARO, zayıf ila orta dereceli bir CYP3A4 indükleyici ve başka enzim ve taşıyıcıların indükleyicisi olarak bilinen deksametazonla birlikte uygulandığı zaman, oral kontraseptiflerin etkililiğinde azalma riski göz önünde bulundurulmalıdır. Oral hormonal kontraseptif kullanan kadınlar buna ek olarak bir bariyer doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
Gebelik döneminde NINLARO kullanımı fetüs üzerinde zararlı farmakolojik etkilere yol açabileceği için gebelik döneminde kullanılmaması önerilir. Bu nedenle, NINLARO tedavisi alan kadın hastalar tedavi süresince gebe kalmaktan kaçınmalıdır.
NINLARO'nun gebe kadınlarda kullanımına ilişkin çalışma verileri yoktur. Hayvanlardaki çalışmalar üreme toksisitesi göstermiştir (Bkz. Bölüm 5.3.).
NINLARO lenalidomid ile kombinasyon halinde verilmektedir. Lenalidomid yapısal olarak talidomide benzerdir. Talidomid, insanlarda teratojenik etkisi olduğu bilinen ve yaşamı tehdit edici ciddi doğumsal kusurlara neden olan bir etkin maddedir. Eğer gebelik sırasında lenalidomid alınırsa, insanlarda teratojenik bir etki göstermesi beklenir. Çocuk doğurma potansiyeli olmadığını gösteren güvenilir kanıtlara sahip hastaların dışındaki tüm hastalarda, lenalidomid için gebelik önleme programı koşullarına mutlaka tam olarak uyulmalıdır. Mevcut lenalidomid KÜB'üne bakınız.
Laktasyon
NINLARO veya metabolitlerinin anne sütünde bulunup bulunmadığı bilinmemektedir. Hayvanlardan elde edilen veri yoktur. Ancak birçok ilaç anne sütünde bulunduğu için emzirilen
bebeklerde advers olay potansiyeli söz konusu olabilir. Emzirmenin kesilmesi gerekmektedir.
NINLARO lenalidomid ile kombinasyon halinde verilecektir ve lenalidomid kullanımdan dolayı emzirme durdurulmalıdır.
Üreme yeteneği/Fertilite
NINLARO ile fertilite çalışması yapılmamıştır (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
NINLARO'nun araç veya makine kullanma yeteneği üzerindeki etkisi minördür. Klinik çalışmalarda yorgunluk ve baş dönmesi bildirilmiştir. Hastalara, bu semptomlardan herhangi biri ortaya çıkarsa araç veya makine kullanmamaları gerektiği söylenmelidir.
4.8. İstenmeyen etkiler
NINLARO lenalidomid ve deksametazon ile birlikte kullanıldığından, istenmeyen diğer etkiler için söz konusu ilaçların kısa ürün bilgilerine bakılmalıdır.
Güvenlik profilinin özeti:
NİNLARO'nun güvenlilik profili, günümüze kadar elde edilmiş klinik deneme ve pazarlama sonrası deneyimine dayanmaktadır. Aşağıda ve Tablo 3'te tanımlanan advers reaksiyon sıklıkları klinik çalışmalardan elde edilen verilere dayanılarak belirlenmiştir.
Aksi belirtilmedikçe, aşağıda sunulan veriler pivotal Faz 3, global C16010 çalışması (n=720) ve çift kör, plasebo kontrollü C16010 Çin Devam Çalışmasındandır (n=115). NINLARO rejimindeki 418 hastada ve plasebo rejimindeki 417 hastada en sık bildirilen (≥%20) advers reaksiyonlar diyare (%47'ye karşılık %38), trombositopeni (%41'e karşılık %24), nötropeni (%37'ye karşılık %36), konstipasyon (%31'e karşılık %24), üst solunum yolu enfeksiyonu (%28'e karşılık %24) periferal nöropati (%28'e karşılık %22), bulantı (%28'e karşılık %20), sırt ağrısı (%25'e karşılık %21), döküntü (%25'e karşılık %15) periferal ödem (%24'e karşılık %19), kusma (%23'e karşılık %12) ve bronşittir (%20'ye karşılık %15). Hastaların %2 veya daha fazlasında bildirilen ciddi advers reaksiyonlar trombositopeni (%2) ve diyaredir (%2).
Advers reaksiyonlar tablosu:
Advers reaksiyonların sıklık grupları aşağıdaki şekilde tanımlanmaktadır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 3: Lenalidomid ve Deksametazonla Kombinasyon Halinde NINLARO Tedavisi Uygulanan Hastalarda Advers Reaksiyonlar (Tüm Gradlar, Grad 3 ve Grad 4)
Sistem Organ Sınıfı / Advers reaksiyonlar | Advers reaksiyonlar (Tüm Gradlar) | Grad 3 - Advers reaksiyonlar | Grad 4 - Advers reaksiyonlar |
Enfeksiyon ve enfestasyonlar | |||
Üst solunum yolu enfeksiyonu | Çok yaygın | Yaygın |
|
Bronşit | Çok yaygın | Yaygın |
|
Herpes zoster | Yaygın | Yaygın |
|
Kan ve lenf sistemi hastalıkları | |||
Trombositopeni* | Çok yaygın | Çok yaygın | Yaygın |
Nötropeni* | Çok yaygın | Çok yaygın | Yaygın |
Trombotik mikroanjiyopati | Seyrek |
| Seyrek |
Trombotik trombositopenik purpura | Seyrek | Seyrek | Seyrek |
Metabolizma ve beslenme hastalıkları | |||
Tümör lizis sendromuâ | Seyrek | Seyrek | Seyrek |
Sinir sistemi hastalıkları |
|
| |
Periferik nöropatiler* | Çok yaygın | Yaygın |
|
Posterior reversiblensefalopati | Seyrek | Seyrek | Seyrek |
Transvers miyelitâ | Seyrek | Seyrek |
|
Gastrointestinal hastalıklar | |||
Diyare | Çok yaygın | Yaygın |
|
Kabızlık | Çok yaygın | Yaygın olmayan |
|
Bulantı | Çok yaygın | Yaygın |
|
Kusma | Çok yaygın | Yaygın olmayan |
|
Deri ve derialtı doku hastalıkları | |||
Ürtiker* | Çok Yaygın | Yaygın |
|
Stevens-Johnson sendromuâ | Seyrek | Seyrek |
|
Akut febril nötrofilik dermatoz | Seyrek | Seyrek |
|
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | |||
Sırt ağrısı | Çok Yaygın | Yaygın olmayan |
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |||
Periferik ödem | Çok Yaygın | Yaygın |
|
Not: Tercih edilen terimler olarak dahil edilen advers reaksiyonlarda MedDRA versiyon
23.0 temel alınmıştır.
* Tercih edilen terimlerden oluşan bir havuzu ifade eder.
â Faz 3 çalışmalarının dışında rapor edilmiştir.
Seçili advers reaksiyonların tanımı
İlacın Kesilmesi
NINLARO rejimindeki hastaların ≤ %3'ünde her advers reaksiyon için tıbbi ürünlerin bir veya
daha fazlası kesilmiştir.
Trombositopeni
Gerek NINLARO rejimindeki, gerekse plasebo rejimindeki hastaların %2'si tedavi sırasında platelet sayımı ≤ 10.000/mm3 olmuştur. Her iki rejimdeki hastaların %1'inden azında tedavi sırasında platelet sayımı ≤ 5.000/mm3 olmuştur. Trombositopeni, NINLARO rejimindeki hastaların %2'sinde ve plasebo rejimindeki hastaların %3'ünde tıbbi ürünlerin bir veya daha
fazlasının kesilmesi ile sonuçlanmıştır. Trombositopeni, hemorajik olaylarda veya platelet
transfüzyonlarında artış ile sonuçlanmamıştır.
Gastrointestinal toksisiteler
Diyare, NINLARO rejimindeki hastaların %2'sinde ve plasebo rejimindeki hastaların
< %1'inde tıbbi ürünlerin bir veya daha fazlasının kesilmesi ile sonuçlanmıştır.
Ürtiker
Ürtiker, iki rejim karşılaştırıldığında, iksazomib rejimindeki hastalarda %25, plasebo rejimindeki hastalarda ise %15 oranında meydana gelmiştir. Her iki rejimde de en yaygın rapor edilen ürtiker tipi makülopapüler ve maküler döküntüler olmuştur. Grad 3 ürtiker, iksazomib rejimindeki hastalarda %3, plasebo hastalarında ise %2 olarak rapor edilmiştir
Döküntü her iki rejimde de hastaların <%1'inde üç ilaçtan bir veya birden fazlasının bırakılmasına yol açmıştır.
Periferik nöropati
Periferik nöropati advers reaksiyonları NINLARO rejimindeki hastaların %28'inde, plasebo rejimindekilerin ise %22'sinde meydana gelmiştir. Grad 3 periferik nöropati advers reaksiyonları iksazomib rejiminde %2, plasebo rejiminde ise %1 oranında bildirilmiştir. En yaygın olarak bildirilen reaksiyon periferik duyusal nöropatidir (NINLARO ve plasebo rejimlerinde sırasıyla %21 ve %15'dir). Periferik motor nöropati her iki rejimde de yaygın olarak bildirilmemiştir (%<1). Periferik nöropati, plasebo rejimindeki hastaların % <1'ine kıyasla NINLARO rejimindeki hastaların %3'ünde üç ilaçtan bir veya birden fazlasının bırakılmasına yol açmıştır.
Göz hastalıkları
Göz hastalıkları birçok tercih edilen terimle bildirilmiştir; ancak toplamda sıklığı NINLARO rejimindeki hastalarda %34 ve plasebo rejimindeki hastalarda %28 olmuştur. En yaygın advers reaksiyonlar bulanık görme (NINLARO rejiminde %6 ve plasebo rejiminde %5), göz kuruluğu (NINLARO rejiminde %6 ve plasebo rejiminde %1), konjonktivit (NINLARO rejiminde %8 ve plasebo rejiminde %2) ve katarakt (NINLARO rejiminde %13 ve plasebo rejiminde %17) olmuştur. İksazomib rejimindeki hastaların %6'sında ve plasebo rejimindeki hastaların %8'inde Grade 3 advers reaksiyonlar bildirilmiştir.
Diğer advers reaksiyonlar
Pivot Faz 3 global C16010 çalışmasından (n=720) ve çift kör, plasebo kontrollü, C16010 Çin Devam Çalışması'ndan (n=115) elde edilen havuzlanmış veri setinde NINLARO ve plasebo rejimlerinin arasında benzer bir oranda bitkinlik (%28 vs. %26), iştahsızlık (%13 vs. %11),
hipotansiyon (%5 vs %4), kalp yetmezliğiâ (her birinde %5), aritmiâ (%17 vs %16) ve enzim
değişikliklerini içeren karaciğer yetmezliğiâ (%11 vs %9) advers reaksiyonları meydana gelmiştir.
Şiddetli (Grad 3-4) hipokalemi olaylarının sıklığı, plasebo rejimine (%2) göre NINLARO rejiminde daha yüksek (%7) olmuştur.
NINLARO, lenalidomid ve deksametazon kombinasyonu verilen hastalarda ölümle sonuçlanan fungal ve viral pnömoni nadiren raporlanmıştır.
â Standardize MedDRA Sorgulamaları
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
NINLARO kullanan hastalarda doz aşımı rapor edilmiştir. Doz aşımının semptomları genellikle NINLARO'nun bilinen riskleri ile örtüşmektedir (bkz. bölüm 4.8). Bir kerede alınan 12 mg doz ciddi bulantı, aspirasyon pnömonisi, çoklu organ yetmezliği ve ölüm gibi ciddi advers olaylara yol açmıştır.
NINLARO doz aşımı için bilinen belirli bir antidot yoktur. Doz aşımı durumunda, hasta advers reaksiyonlar (Bkz. Bölüm 4.8) açısından yakın takip edilmeli ve uygun destekleyici bakım sunulmalıdır. İksazomib diyaliz edilemez (bkz. Bölüm 5.2).
Doz aşımları en çok NINLARO tedavisine başlayan hastalarda yaygınlık göstermiştir. Tedaviye başlayan hastalara tüm dozaj talimatlarına uyulmasının önemi anlatılmalıdır. Doz aşımı ölüme neden olabileceğinden hastaların tavsiye edilen dozu talimata uygun olarak almaları sağlanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ve immünomodülatör ajanlar, antineoplastik ajanlar, diğer
antineoplastik ajanlar, proteazom inhibitörleri ATC kodu: L01XG03
Etki mekanizması
Bir ön ilaç olan iksazomib sitrat, fizyolojik koşullarda hızlı bir şekilde hidrolize olarak biyolojik açıdan aktif olan formu iksazomib'e dönüşür.
İksazomib, oral, yüksek seçicilikte, tersinir bir proteazom inhibitörüdür. İksazomib, selektif bir şekilde 20S proteazomun beta 5 alt ünitesine bağlanarak kimotripsin benzeri aktivitesini inhibe eder.
İksazomib, in vitro birden fazla tümör hücresi tipinin apoptozunu indüklemiştir. İksazomib, daha önce bortezomib, lenalidomid ve deksametazonu da içeren birden fazla tedavi uygulandıktan sonra relaps yaşayan hastaların miyelom hücrelerine karşı in vitro sitotoksisite sergilemiştir. İksazomib ve lenalidomid kombinasyonu, multipl miyelom hücre hatlarında sinerjistik sitotoksik etkiler göstermiştir. İn vivo, iksazomib, multipl miyelom modelleri de dahil çeşitli tümör ksenogreft modellerinde antitümör aktivitesi sergilemiştir. İn vitro, iksazomib, vasküler endotelyel hücreler, osteoklastlar ve osteoblastlar dahil kemik iliği mikro-ortamında bulunan tüm hücre tiplerini etkilemiştir.
Kardiyak Elektrofizyoloji
245 hastadan elde edilen verilerin farmakokinetik-farmakodinamik analizine göre, NINLARO klinik açıdan önemli maruziyetlerde QTc aralığını uzatmamıştır. 4 mg dozunda, model bazlı analize göre; başlangıçtan itibaren QTcF'deki ortalama değişim 0,07 msn (%90 GA; -0,22, 0,36)
olarak tahmin edilmiştir.
İksazomib konsantrasyonu ve RR aralığının arasında iksazomibin kalp hızı üzerinde klinik olarak anlamlı bir etkisinin olduğunu düşündüren fark edilebilir hiçbir ilişki saptanmamıştır.
Klinik Etkililik ve Güvenlilik
Lenalidomid ve deksametazon ile kombinasyon olarak NINLARO'nun etkililiği ve güvenliliği, daha önce en az bir tedavi uygulanmış, relaps yapan ve/veya refrakter multipl miyelom hastaları üzerinde gerçekleştirilen randomize, çift kör, plasebo kontrollü, çok merkezli bir Faz 3 çalışmada (C16010) değerlendirilmiştir. Toplam 722 hasta (tedavi amaçlı popülasyon), hastalık progresyon gösterene kadar veya kabul edilemez toksisite gelişene kadar NINLARO, lenalidomid ve deksametazon kombinasyonu (N=360; NINLARO rejimi) veya plasebo, lenalidomid ve deksametazon kombinasyonu (N=362; plasebo rejimi) alacak şekilde 1:1 oranında randomize edilmiştir. Çalışmada yer alan hastalar serum ya da idrarda paraprotein veya serbest hafif zincir ölçümleriyle ölçülebilir ve hastalığı primer refrakter dahil (yani önceki tedaviye hiçbir şekilde cevap vermeyen) refrakter ve önceki tedaviden sonra nüks etmiş veya nüks etmiş ve önceki tüm tedavilere refrakter olan multipl miyelom hastalarıdır. Ayrıca kontrol altına alınmış kardiyovasküler hastalıkları olanlar ve hastalık progresyonu öncesinde tedavisini değiştiren hastalar çalışmaya kaydedilmek için uygun hastalar olarak değerlendirilmiştir. Lenalidomide veya proteazom inhibitörlerine dirençli hastalar ve daha önce üçten fazla tedavi almış hastalar faz 3 çalışmaya dahil edilmemiştir. Bu çalışma için refrakter hastalık, tedavi sırasında progresyon veya lenalidomid veya proteasom inhibitörünün son dozundan 60 gün içerisinde progresyon olarak tanımlanmıştır. Bu hastalardaki veriler sınırlı olduğundan NINLARO rejiminin başlatılmasından önce dikkatli bir risk fayda analizi tavsiye edilmektedir.
Lenalidomid kısa ürün bilgisine göre her iki tedavi grubundaki tüm hastalar için tromboprofilaksi önerilmiştir. Hastalara, hekimin takdirine göre profilaksi ve/veya semptom yönetimi amacıyla antiemetik, antiviral ve antihistaminik ilaçlar verilmiştir.
Hastalar, 28 günlük bir siklusun 1., 8. ve 15. gününde iksazomib 4 mg veya plaseboya ek
olarak 1. gün ile 21. gün arasında lenalidomid (25 mg) ve 1., 8., 15., ve 22. günlerde deksametazon (40 mg) almıştır.
Böbrek yetmezliği olan hastalara uygulanan lenalidomid başlangıç dozu, lenalidomidin KÜB'e göre belirlenmiştir. Tedavi, hastalık progresyon gösterene kadar veya kabul edilemez toksisite gelişene kadar devam etmiştir.
Başlangıç demografikleri ve hastalık özellikleri, çalışma rejimleri arasında dengeli ve karşılaştırılabilir olmuştur. Medyan yaş 66 ve yaş aralığı 38-91 olup, hastaların %58'sı 65 yaşın üzerindedir. Hastaların %57'si erkekti. Popülasyonun %85'i Beyaz, %9'u Asyalı ve %2'si Siyahi idi. Hastaların %93'ünün ECOG performans durumu 0-1 arasında olup, hastaların %12'sinde başlangıçta ISS evre III hastalığı olmuştur (N=90). Hastaların %25'inde < 60 mL/dk kreatinin klirensi vardı. Hastaların %23'ünde hafif zincir hastalığı ve hastaların %12'sinde sadece serbest hafif zincir analizi ile ölçülebilir hastalık vardı.
Hastaların %19'unda yüksek riskli sitogenetik anormallikler (del[17], t[4;14], t[14;16]) (N=137), %10'unda del(17) (N=69) ve %34'ünde 1q amplifikasyonu (1q21) (N=247) vardı. Hastalara daha önceden bortezomib (%69), karfilzomib (<%1), talidomid (%45), lenalidomid (%12), melfalan (%81) ile tedavi dahil olmak üzere bir ila üç (medyan: 1) tedavi uygulanmıştır. Hastaların %57'sine daha önceden kök hücre nakli yapılmıştır. Hastaların %77'si daha önce uygulanan tedavilerden sonra relaps geçirmiş ve %11'i daha önce uygulanan tedavilere dirençli olmuştur. Daha önce uygulanan tedavilerin tamamında hastalığın stabil kaldığına veya hastalığın ilerlediğine ilişkin en iyi yanıt olarak tanımlanan primer direnç
hastaların %6'sında belgelenmiştir.
Birincil sonlanım noktası, merkezi laboratuvar sonuçları doğrultusunda körlenmiş bir bağımsız inceleme kurulu (IRC) tarafından yapılan değerlendirmeye göre, 2011 Uluslararası Miyelom Çalışma Grubu (IMWG) Konsensüs Üniform Yanıt Kriterleri uyarınca belirlenen progresyonsuz sağkalımdır (PFS). Yanıt, hastalık progresyonuna kadar dört haftada bir değerlendirilmiştir. Birincil analizde (medyan takip süresi 14.7 ay ve medyan siklus sayısı 13) PFS, tedavi kolları arasında istatistiksel olarak anlamlı derecede farklı idi. İksazomib rejiminde görülen PFS iyileşmesi, genel yanıt oranındaki iyileşmelerle desteklenmiştir. PFS ve yanıt bulguları Tablo 4 ve Şekil 1'de özetlenmiştir.
Tablo 4: Lenalidomid ve Deksametazonla Kombinasyon halinde İksazomib veya Plasebo Tedavisi Uygulanan Multipl Miyelom Hastalarında Progresyonsuz Sağkalım ve Yanıt Bulguları (Tedavi Amaçlı Popülasyon, birincil analiz)
|
|
|
|
|
|
| ||
|
| |
|
|
|
| ||
|
|
|
|
|
|
|
|
|
| ||
| ||
| ||
| ||
* P-değeri sınıflandırılmış log-sıra testine dayanmaktadır.
â Tehlike oranı, sınıflandırılmış Cox orantılı tehlike regresyon modeline dayalıdır. 1'in
altındaki tehlike oranı NINLARO rejimine dönük avantaja işaret etmektedir..
â¡Genel yanıt oranı = tam yanıt + çok iyi kısmi yanıt + kısmi yanıt
§ Değerlendirilebilir-yanıt popülasyonundaki yanıt verenlere dayalıdır
Şekil 1: Tedavi Amaçlı Popülasyonda Progresyonsuz Sağkalıma ait Kaplan-Meier Grafiği (birincil analiz)
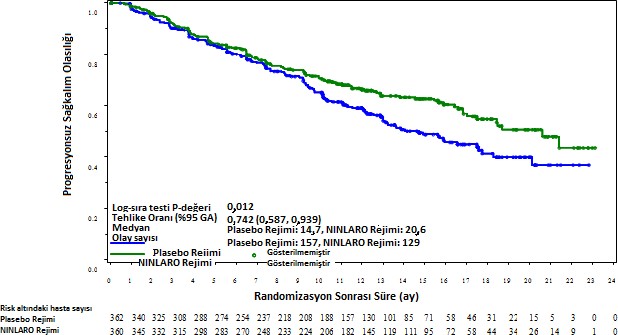
Medyan takip süresi 23 ay olan ikinci, çıkarımsal olmayan bir PFS analizi gerçekleştirilmiştir. Bu analizde, tedavi niyeti popülasyonunda ortalama medyan PFS analizi iksazomib rejiminde 20 ay ve plasebo rejiminde 15,9 ay olmuştur (Tehlike oranı=0,82 [%95% GA (0,67, 1,0)]). Önceden bir tedavi almış hastalar için, ortalama PFS iksazomib rejiminde 18.7 ay ve plasebo rejiminde 17,6 ay olmuştur (Tehlike oranı = 0,99). Önceden 2 veya 3 tedavi almış hastalar için PFS iksazomib rejiminde 22,0 ay ve plasebo rejiminde 13,0 ay olmuştur (Tehlike oranı = 0,62).
Medyan takip süresi yaklaşık 85 ay olan genel sağkalım final analizinde, tedavi niyeti popülasyonundaki medyan sağkalım iksazomib rejimindeki hastalar için 53,6 ay ve plasebo rejimindeki hastalar için 51,6 ay olmuştur. (Tehlike oranı = 0,94 [%95 güven aralığı: 0,78, 1,13; p=0,495]). Önceden bir tedavi almış hastalar için medyan genel sağkalım iksazomib rejiminde 54,3 ay ve plasebo rejiminde 58,3 aydır (Tehlike oranı = 1,02 [%95 güven aralığı: 0,80, 1,29]). Önceden 2 veya 3 tedavi almış hastalar için medyan genel sağkalım iksazomib rejiminde 53,0 ay, plasebo rejiminde ise 43,0 ay olmuştur. (Tehlike oranı = 0,85 [%95 güven aralığı: 0,64, 1,11]).
Çin'de benzer bir dizayn ve seçilebilirlik kriteri kullanılarak randomize, çift kör, plasebo kontrollü bir Faz 3 çalışma gerçekleştirilmiştir (N=115). Çalışmaya kaydolan hastaların çoğunun ilk teşhiste Durie-Salmon Aşama III şeklinde ilerlemiş hastalığı vardı (%69), önceden en az 2 tedavi almışlardı (%60) ve talidomid'e dirençiydiler (%63). Primer analizde (medyan takip 8 ay ve medyan 6 kür) progresyonsuz sağkalım NINLARO rejiminde 6,7 ay iken plasebo rejiminde 4 ay olmuştur (p değeri = 0,035, tehlike oranı=0,60). Medyan 19,8 ay takipteki final analizde genel sağkalım plaseboya kıyasla ikzazomib'le tedavi edilen hastalarda iyileşme göstermiştir [p değeri = 0,0014, tehlike oranı = 0,42; %95 güven aralığı: 0,242, 0,726].
Multipl miyolom heterojen bir hastalık olduğundan Faz III çalışmadaki (C16010) alt gruplar arasındaki fayda oranı değişkenlik gösterebilir (Bkz: Şekil 2).
Şekil 2: Alt gruplarda progresyonsuz sağkalımın meta analiz diyagramı
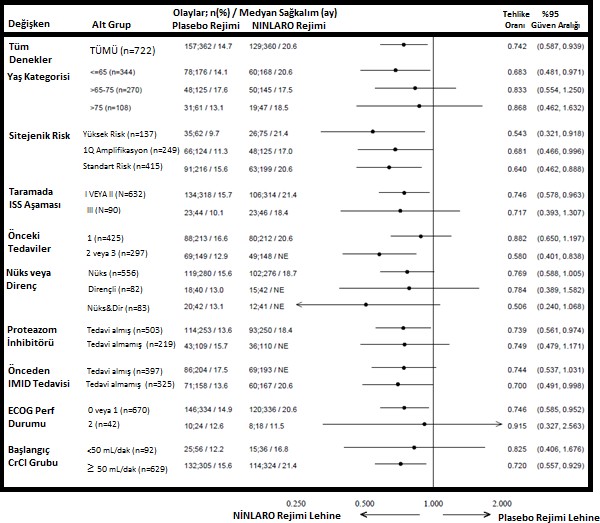
Faz 3 çalışmada (C16010) 10 hastada (her bir tedavi rejimindeki 5 hastada) başlangıçta ciddi renal bozukluk vardı. NINLARO rejimindeki 5 hastadan 1 hastada teyit edilmiş bir kısmi yanıt ve 3 teyit edilmiş stabil hastalık vardı (ancak 2'si teyit edilmemiş kısmi yanıt ve 1'i teyit edilmemiş çok iyi kısmi yanıt idi). Plasebo rejimindeki 5 hastadan 2'sinde ise teyit edilmiş çok iyi kısmi yanıt oluşmuştur.
Global sağlık skorlarıyla (EORTC QLQ-C30 ve MY-20) değerlendirilen yaşam kalitesi, tedavi boyunca korunmuştur ve Faz 3 çalışmanının (C16010) her iki tedavi rejiminde benzer olduğu görülmüştür.
Pediatrik popülasyon:
Avrupa İlaç Ajansı, multipl myelomda pediatrik popülasyonun tüm alt gruplarında NINLARO ile yapılan çalışmaların sonuçlarının gönderilme zorunluluğunu muaf tutmuştur. (Pediayatrik kullanım için Bkz. Bölüm 4.2)
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Oral uygulamadan sonra, pik iksazomib plazma konsantrasyonlarına dozlamadan yaklaşık bir saat sonra ulaşılmıştır. Ortalama mutlak oral biyoyararlanım %58'dir. İksazomib EAA'sı 0,2-10,6 mg'lık bir doz aralığında dozla orantılı bir şekilde artar. Yüksek yağ içerikli bir öğünle birlikte uygulanması, iksazomibin EAA'sı bir gecelik açlık sonrası uygulamaya kıyasla %28 oranında düşürmüştür (Bkz. Bölüm 4.2).
Dağılım:
İksazomib, plazma proteinlerine %99 oranında bağlanır ve 10 kan-plazma EAA oranıyla
eritrositlere dağılır. Kararlı durum dağılım hacmi 543 litredir.
Biyotransformasyon:
Radyoişaretli dozun oral yoldan uygulanmasından sonra, plazmadaki ilaçla ilgili materyalin
%70'inin iksazomibten oluştuğu görülmüştür. İksazomibin temel klirens mekanizmasının birden fazla CYP enzimi ve CYP dışı proteinler tarafından metabolizma olması beklenmektedir. Klinik olarak anlamlı iksazomib konsantrasyonlarında, insan cDNA tarafından eksprese edilen sitokrom P450 izoenzimler kullanılarak yapılan in vitro çalışmalar, iksazomib metabolizmasına baskın olarak katkıda bulunan spesifik bir CYP izoenzimi olmadığını ve CYP dışı proteinlerin genel metabolizmaya katkıda bulunduğunu göstermiştir. Klinik olarak gözlemlenen konsantrasyonların üzerindeki konsantrasyonlarda, iksazomib birden fazla CYP izoformu tarafından metabolize edilmiş olup, bunların tahmini rölatif katkıları şöyledir: 3A4 (%42,3), 1A2 (%26,1), 1A2 (%26,1), 2B6 (%16,0), 2C8 (%6,0), 2D6 (%4,8), 2C19 (%4,8) ve 2C9 (<%1).
Eliminasyon:
İksazomib çoklu üstel bir atılım profili sergiler. Bir popülasyon FK analizine göre, sistemik klirens (SK) yaklaşık 1,86 L/saat, bireyler arası değişkenlikse %44 olarak belirlenmiştir. İksazomibin terminal yarılanma ömrü (t1/2) 9,5 gündür. 15. günde, haftalık oral dozlama ile akümülasyon oranının yaklaşık 2 kat fazla olduğu gözlenmiştir.
14C-iksazomibin tek oral dozu ilerlemiş kanseri olan 5 hastaya uygulandıktan sonra, uygulanan radyoaktivitenin %62'si idrar ve %22'si dışkı ile atılmıştır. Değişmemiş iksazomib, idrarda geri kazanılan uygulanan dozun < %3,5'ini oluşturmuştur.
Hastalardaki karakteristik özellikler:
Karaciğer Yetmezliği:
Popülasyon FK analizine göre, karaciğer fonksiyonu normal olan hastalarda ve hafif karaciğer yetmezliği olan hastalarda (toplam bilirubin < ULN ve AST > ULN veya toplam bilirubin > 1- 1,5 x ULN ve herhangi bir AST) iksazomibin farmakokinetiği benzer bulunmuştur.
İksazomibin farmakokinetiği, karaciğer fonksiyonu normal olan hastalarda 4 mg (N=12), orta şiddette karaciğer yetmezliği olan hastalarda 2,3 mg (toplam bilirubin > 1,5-3 x ULN, N=13) veya şiddetli karaciğer yetmezliği olan hastalarda 1,5 mg dozunda (toplam bilirubin > 3 x ULN, N=18) karakterize edilmiştir. Serbest doza göre normalize edilen ortalama EAA, orta derece veya şiddetli karaciğer yetmezliği olan hastalarda, karaciğer fonksiyonu normal olan hastalara
göre %27 daha yüksek bulunmuştur (Bkz. Bölüm 4.2).
Böbrek Yetmezliği:
Popülasyon FK analizinde, böbrek fonksiyonu normal olan hastalarda ve hafif veya orta derece böbrek yetmezliği olan hastalarda (kreatinin klirensi ≥30 ml/dk.) iksazomibin farmakokinetiği benzer bulunmuştur.
İksazomibin FK'sı, böbrek fonksiyonu normal olan (kreatinin klirensi > 90 ml/dk., N=18), şiddetli böbrek yetmezliği olan (kreatinin klirensi < 30 ml/dk., N=14) veya diyaliz gerektiren ESRD'si (N=6) olan hastalarda 3 mg dozunda karakterize edilmiştir. Serbest EAA, şiddetli böbrek yetmezliği veya diyaliz gerektiren ESRD'si olan hastalarda, böbrek fonksiyonu normal olan hastalara göre %38 daha yüksek bulunmuştur. Hemodiyaliz seansı sırasında ölçülen diyaliz cihazı öncesi ve sonrası iksazomib konsantrasyonları benzer bulunması, iksazomibin diyaliz edilemediğine işaret etmektedir (Bkz. Bölüm 4.2)
Yaş, Cinsiyet, Irk:
Popülasyon FK analizine göre, yaş (aralık: 23-91 yaş), cinsiyet, vücut yüzey alanı (aralık: 1,2- 2,7 m2 ) veya ırkın iksazomibin klirensi üzerinde klinik olarak anlamlı bir etkisi yoktur. Ortalama EAA, Asya ırkındaki hastalarda % 35 daha yüksektir, ancak Beyaz ırk ve Asya ırkı hastaları karşılaştırıldığında iksazomib'in EAA değeri örtüşmektedir.
5.3. Klinik öncesi güvenlilik verileri
Mutajenisite
İksazomib, ne bakteriyel ters mutasyon testinde (Ames testi) mutajenik, ne de farelerde kemik iliği mikronükleus tayininde klastojenik bulunmamıştır. İksazomib, insan periferik kan lenfositlerindeki in vitro klastojenisite tayininde pozitif bulunmuştur. Bununla birlikte iksazomib farelerde mide ve karaciğerde kuyruk DNA %'si olarak değerlendirilen in vivo komet tayininde negatif sonuç vermiştir. Bu nedenle, kanıtlar NINLARO'nun bir genotoksik risk teşkil etmediğini desteklemektedir.
Üreme ve embriyo-fötal gelişimi:
İksazomib, gebe sıçanlar ve tavşanlarda yalnızca maternal olarak toksik dozlarda ve önerilen dozu alan hastalarda gözlenenlerden biraz daha yüksek maruziyetlerde embriyo-fötal toksisiteye neden olmuştur. İksazomib ile fertilite, erken embriyonik gelişim ve pre- ve post- natal toksikoloji çalışmaları yürütülmemiştir. Sıçanlarda 6 aya kadar ve köpeklerde 9 aya kadar süren çalışmalarda, erkek veya kadın üreme organlarında iksazomib tedavisine bağlı herhangi bir etki görülmemiştir.
Hayvan Toksikolojisi ve / veya Farmakolojisi
Sıçan ve köpeklerde yapılan çok kürlü tekrarlı doz toksisite çalışmalarında başlıca hedef organlar mide-bağırsak yolu, lenfoid dokuları ve sinir sistemini içermekteydi. Klinik rejimin (28 günlük kür) taklit edildiği dozlama programı ile köpeklere oral yoldan ilaç verilen aylık çalışmada (10 kür) mikroskobik nöronal etkiler genellikle yapısı itibariyle minimal olup yalnızca 0,2 mg/kg (4 mg/m2)'de gözlenmiştir. Lumbar dorsal kök gangliyon ve dorsal kolon haricinde hedef organ bulgularının çoğunluğunda tedavinin durdurulmasının ardından kısmi ya da tam iyileşme görülmüştür.
Sıçanlarda oral uygulamadan sonra doku dağılım çalışmasında, beyin ve omuriliğin en düşük düzeyin olduğu organlar arasında olduğu görülmüştür. Bu durum, iksazomib'in kan-beyin
bariyerinden penetrasyonunun sınırlı olduğunu göstermektedir. Ancak bu durumun insanlarda da geçerli olup olmadığı bilinmemektedir.
Gerek in vitro (hERG kanallarında) gerekse in vivo (tek oral uygulamanın ardından telemetreli köpeklerde) gerçekleştirilen non-klinik güvenlik farmakoloji çalışmalarında iksazaomib'in klinik değerin 8 katından fazla eğri altında kalan alanda kardiyovasküler veya solunum fonksiyonlarında hiçbir etkisi olmadığı gösterilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Kapsül içeriği:
Mikrokristalin selüloz Magnezyum stearat Talk
Kapsül Kabuğu:
Sığır jelatini
Titanyum dioksit (E171) Kırmızı demir oksit (E172)
Baskı Mürekkebi:
Şellak
Propilen glikol Potasyum hidroksit Siyah demir oksit (E172)
6.2. Geçimsizlikler
iGeçerli değildir.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altında saklayınız. Dondurmayınız.
Kapsülleri orijinal ambalajında saklayınız. Kapsüller doz uygulamasının hemen öncesine kadar
çıkarılmamalıdır.
6.5. Ambalajın niteliği ve içeriği
Kapsüller, PVC-Aluminyum/Aluminyum blisterde ayrı ayrı ambalajlanmaktadır. Bir kutuda üç
ayrı blister paketi bulunmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
İksazomib sitotoksiktir. Kapsüller açılmamalı ve ezilmemelidir. Kapsül içeriği ile doğrudan temastan kaçınılmalıdır. Kapsül kırılması durumunda kapsül içeriğinin deri ya da gözlerle temasından kaçınınız. Ciltle temas gerçekleşirse, cilt sabun ve su ile iyice yıkanmalıdır. Göz ile temas ederse su ile iyice yıkanmalıdır.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliği' ve âAmbalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir.
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A16944 |
| Satış Fiyatı | 102661.48 TL [ 19 Nov 2024 ] |
| Önceki Satış Fiyatı | 102661.48 TL [ 8 Nov 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699456150036 |
| Etkin Madde | Iksazomib |
| ATC Kodu | L01XG03 |
| Birim Miktar | 2.3 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 3 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Danimarka ) ve Beşeri bir ilaçdır. |