NINLARO 4 mg 3 kapsül Farmakolojik Özellikler
{ Iksazomib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ve immünomodülatör ajanlar, antineoplastik ajanlar, diğer
antineoplastik ajanlar, proteazom inhibitörleri ATC kodu: L01XG03
Etki mekanizması
Bir ön ilaç olan iksazomib sitrat, fizyolojik koşullarda hızlı bir şekilde hidrolize olarak biyolojik açıdan aktif olan formu iksazomib'e dönüşür.
İksazomib, oral, yüksek seçicilikte, tersinir bir proteazom inhibitörüdür. İksazomib, selektif bir şekilde 20S proteazomun beta 5 alt ünitesine bağlanarak kimotripsin benzeri aktivitesini inhibe eder.
İksazomib, in vitro birden fazla tümör hücresi tipinin apoptozunu indüklemiştir. İksazomib, daha önce bortezomib, lenalidomid ve deksametazonu da içeren birden fazla tedavi uygulandıktan sonra relaps yaşayan hastaların miyelom hücrelerine karşı in vitro sitotoksisite sergilemiştir. İksazomib ve lenalidomid kombinasyonu, multipl miyelom hücre hatlarında sinerjistik sitotoksik etkiler göstermiştir. İn vivo, iksazomib, multipl miyelom modelleri de dahil çeşitli tümör ksenogreft modellerinde antitümör aktivitesi sergilemiştir. İn vitro, iksazomib, vasküler endotelyel hücreler, osteoklastlar ve osteoblastlar dahil kemik iliği mikro-ortamında bulunan tüm hücre tiplerini etkilemiştir.
Kardiyak Elektrofizyoloji
245 hastadan elde edilen verilerin farmakokinetik-farmakodinamik analizine göre, NINLARO klinik açıdan önemli maruziyetlerde QTc aralığını uzatmamıştır. 4 mg dozunda, model bazlı analize göre; başlangıçtan itibaren QTcF'deki ortalama değişim 0,07 msn (%90 GA; -0,22, 0,36)
olarak tahmin edilmiştir.
İksazomib konsantrasyonu ve RR aralığının arasında iksazomibin kalp hızı üzerinde klinik olarak anlamlı bir etkisinin olduğunu düşündüren fark edilebilir hiçbir ilişki saptanmamıştır.
Klinik Etkililik ve Güvenlilik
Lenalidomid ve deksametazon ile kombinasyon olarak NINLARO'nun etkililiği ve güvenliliği, daha önce en az bir tedavi uygulanmış, relaps yapan ve/veya refrakter multipl miyelom hastaları üzerinde gerçekleştirilen randomize, çift kör, plasebo kontrollü, çok merkezli bir Faz 3 çalışmada (C16010) değerlendirilmiştir. Toplam 722 hasta (tedavi amaçlı popülasyon), hastalık progresyon gösterene kadar veya kabul edilemez toksisite gelişene kadar NINLARO, lenalidomid ve deksametazon kombinasyonu (N=360; NINLARO rejimi) veya plasebo, lenalidomid ve deksametazon kombinasyonu (N=362; plasebo rejimi) alacak şekilde 1:1 oranında randomize edilmiştir. Çalışmada yer alan hastalar serum ya da idrarda paraprotein veya serbest hafif zincir ölçümleriyle ölçülebilir ve hastalığı primer refrakter dahil (yani önceki tedaviye hiçbir şekilde cevap vermeyen) refrakter ve önceki tedaviden sonra nüks etmiş veya nüks etmiş ve önceki tüm tedavilere refrakter olan multipl miyelom hastalarıdır. Ayrıca kontrol altına alınmış kardiyovasküler hastalıkları olanlar ve hastalık progresyonu öncesinde tedavisini değiştiren hastalar çalışmaya kaydedilmek için uygun hastalar olarak değerlendirilmiştir. Lenalidomide veya proteazom inhibitörlerine dirençli hastalar ve daha önce üçten fazla tedavi almış hastalar faz 3 çalışmaya dahil edilmemiştir. Bu çalışma için refrakter hastalık, tedavi sırasında progresyon veya lenalidomid veya proteasom inhibitörünün son dozundan 60 gün içerisinde progresyon olarak tanımlanmıştır. Bu hastalardaki veriler sınırlı olduğundan NINLARO rejiminin başlatılmasından önce dikkatli bir risk fayda analizi tavsiye edilmektedir.
Lenalidomid kısa ürün bilgisine göre her iki tedavi grubundaki tüm hastalar için tromboprofilaksi önerilmiştir. Hastalara, hekimin takdirine göre profilaksi ve/veya semptom yönetimi amacıyla antiemetik, antiviral ve antihistaminik ilaçlar verilmiştir.
Hastalar, 28 günlük bir siklusun 1., 8. ve 15. gününde iksazomib 4 mg veya plaseboya ek
olarak 1. gün ile 21. gün arasında lenalidomid (25 mg) ve 1., 8., 15., ve 22. günlerde deksametazon (40 mg) almıştır.
Böbrek yetmezliği olan hastalara uygulanan lenalidomid başlangıç dozu, lenalidomidin KÜB'e göre belirlenmiştir. Tedavi, hastalık progresyon gösterene kadar veya kabul edilemez toksisite gelişene kadar devam etmiştir.
Başlangıç demografikleri ve hastalık özellikleri, çalışma rejimleri arasında dengeli ve karşılaştırılabilir olmuştur. Medyan yaş 66 ve yaş aralığı 38-91 olup, hastaların %58'sı 65 yaşın üzerindedir. Hastaların %57'si erkekti. Popülasyonun %85'i Beyaz, %9'u Asyalı ve %2'si Siyahi idi. Hastaların %93'ünün ECOG performans durumu 0-1 arasında olup, hastaların %12'sinde başlangıçta ISS evre III hastalığı olmuştur (N=90). Hastaların %25'inde < 60 mL/dk kreatinin klirensi vardı. Hastaların %23'ünde hafif zincir hastalığı ve hastaların %12'sinde sadece serbest hafif zincir analizi ile ölçülebilir hastalık vardı.
Hastaların %19'unda yüksek riskli sitogenetik anormallikler (del[17], t[4;14], t[14;16]) (N=137), %10'unda del(17) (N=69) ve %34'ünde 1q amplifikasyonu (1q21) (N=247) vardı. Hastalara daha önceden bortezomib (%69), karfilzomib (<%1), talidomid (%45), lenalidomid (%12), melfalan (%81) ile tedavi dahil olmak üzere bir ila üç (medyan: 1) tedavi uygulanmıştır. Hastaların %57'sine daha önceden kök hücre nakli yapılmıştır. Hastaların %77'si daha önce uygulanan tedavilerden sonra relaps geçirmiş ve %11'i daha önce uygulanan tedavilere dirençli olmuştur. Daha önce uygulanan tedavilerin tamamında hastalığın stabil kaldığına veya hastalığın ilerlediğine ilişkin en iyi yanıt olarak tanımlanan primer direnç
hastaların %6'sında belgelenmiştir.
Birincil sonlanım noktası, merkezi laboratuvar sonuçları doğrultusunda körlenmiş bir bağımsız inceleme kurulu (IRC) tarafından yapılan değerlendirmeye göre, 2011 Uluslararası Miyelom Çalışma Grubu (IMWG) Konsensüs Üniform Yanıt Kriterleri uyarınca belirlenen progresyonsuz sağkalımdır (PFS). Yanıt, hastalık progresyonuna kadar dört haftada bir değerlendirilmiştir. Birincil analizde (medyan takip süresi 14.7 ay ve medyan siklus sayısı 13) PFS, tedavi kolları arasında istatistiksel olarak anlamlı derecede farklı idi. İksazomib rejiminde görülen PFS iyileşmesi, genel yanıt oranındaki iyileşmelerle desteklenmiştir. PFS ve yanıt bulguları Tablo 4 ve Şekil 1'de özetlenmiştir.
Tablo 4: Lenalidomid ve Deksametazonla Kombinasyon halinde İksazomib veya Plasebo Tedavisi Uygulanan Multipl Miyelom Hastalarında Progresyonsuz Sağkalım ve Yanıt Bulguları (Tedavi Amaçlı Popülasyon, birincil analiz)
|
|
|
|
|
|
| ||
|
| |
|
|
|
| ||
|
|
|
|
|
|
|
|
|
| ||
| ||
| ||
| ||
* P-değeri sınıflandırılmış log-sıra testine dayanmaktadır.
â Tehlike oranı, sınıflandırılmış Cox orantılı tehlike regresyon modeline dayalıdır. 1'in
altındaki tehlike oranı NINLARO rejimine dönük avantaja işaret etmektedir..
â¡Genel yanıt oranı = tam yanıt + çok iyi kısmi yanıt + kısmi yanıt
§ Değerlendirilebilir-yanıt popülasyonundaki yanıt verenlere dayalıdır
Şekil 1: Tedavi Amaçlı Popülasyonda Progresyonsuz Sağkalıma ait Kaplan-Meier Grafiği (birincil analiz)
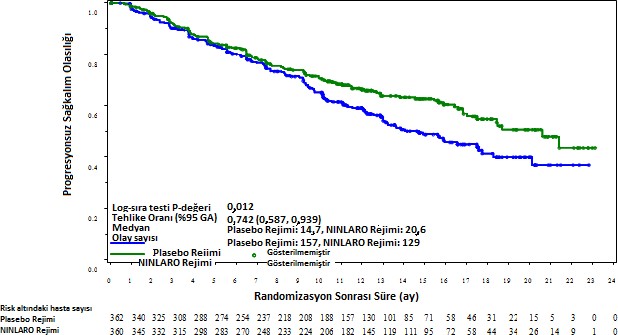
Medyan takip süresi 23 ay olan ikinci, çıkarımsal olmayan bir PFS analizi gerçekleştirilmiştir. Bu analizde, tedavi niyeti popülasyonunda ortalama medyan PFS analizi iksazomib rejiminde 20 ay ve plasebo rejiminde 15,9 ay olmuştur (Tehlike oranı=0,82 [%95% GA (0,67, 1,0)]). Önceden bir tedavi almış hastalar için, ortalama PFS iksazomib rejiminde 18.7 ay ve plasebo rejiminde 17,6 ay olmuştur (Tehlike oranı = 0,99). Önceden 2 veya 3 tedavi almış hastalar için PFS iksazomib rejiminde 22,0 ay ve plasebo rejiminde 13,0 ay olmuştur (Tehlike oranı = 0,62).
Medyan takip süresi yaklaşık 85 ay olan genel sağkalım final analizinde, tedavi niyeti popülasyonundaki medyan sağkalım iksazomib rejimindeki hastalar için 53,6 ay ve plasebo rejimindeki hastalar için 51,6 ay olmuştur. (Tehlike oranı = 0,94 [%95 güven aralığı: 0,78, 1,13; p=0,495]). Önceden bir tedavi almış hastalar için medyan genel sağkalım iksazomib rejiminde 54,3 ay ve plasebo rejiminde 58,3 aydır (Tehlike oranı = 1,02 [%95 güven aralığı: 0,80, 1,29]). Önceden 2 veya 3 tedavi almış hastalar için medyan genel sağkalım iksazomib rejiminde 53,0 ay, plasebo rejiminde ise 43,0 ay olmuştur. (Tehlike oranı = 0,85 [%95 güven aralığı: 0,64, 1,11]).
Çin'de benzer bir dizayn ve seçilebilirlik kriteri kullanılarak randomize, çift kör, plasebo kontrollü bir Faz 3 çalışma gerçekleştirilmiştir (N=115). Çalışmaya kaydolan hastaların çoğunun ilk teşhiste Durie-Salmon Aşama III şeklinde ilerlemiş hastalığı vardı (%69), önceden en az 2 tedavi almışlardı (%60) ve talidomid'e dirençiydiler (%63). Primer analizde (medyan takip 8 ay ve medyan 6 kür) progresyonsuz sağkalım NINLARO rejiminde 6,7 ay iken plasebo rejiminde 4 ay olmuştur (p değeri = 0,035, tehlike oranı=0,60). Medyan 19,8 ay takipteki final analizde genel sağkalım plaseboya kıyasla ikzazomib'le tedavi edilen hastalarda iyileşme göstermiştir [p değeri = 0,0014, tehlike oranı = 0,42; %95 güven aralığı: 0,242, 0,726].
Multipl miyolom heterojen bir hastalık olduğundan Faz III çalışmadaki (C16010) alt gruplar arasındaki fayda oranı değişkenlik gösterebilir (Bkz: Şekil 2).
Şekil 2: Alt gruplarda progresyonsuz sağkalımın meta analiz diyagramı
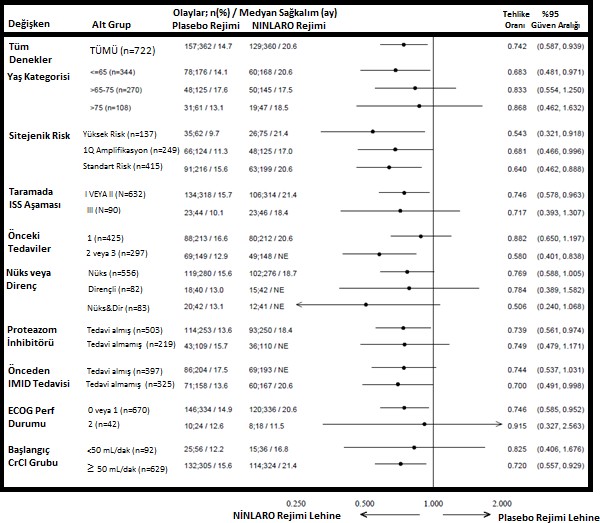
Faz 3 çalışmada (C16010) 10 hastada (her bir tedavi rejimindeki 5 hastada) başlangıçta ciddi renal bozukluk vardı. NINLARO rejimindeki 5 hastadan 1 hastada teyit edilmiş bir kısmi yanıt ve 3 teyit edilmiş stabil hastalık vardı (ancak 2'si teyit edilmemiş kısmi yanıt ve 1'i teyit edilmemiş çok iyi kısmi yanıt idi). Plasebo rejimindeki 5 hastadan 2'sinde ise teyit edilmiş çok iyi kısmi yanıt oluşmuştur.
Global sağlık skorlarıyla (EORTC QLQ-C30 ve MY-20) değerlendirilen yaşam kalitesi, tedavi boyunca korunmuştur ve Faz 3 çalışmanının (C16010) her iki tedavi rejiminde benzer olduğu görülmüştür.
Pediatrik popülasyon:
Avrupa İlaç Ajansı, multipl myelomda pediatrik popülasyonun tüm alt gruplarında NINLARO ile yapılan çalışmaların sonuçlarının gönderilme zorunluluğunu muaf tutmuştur. (Pediayatrik kullanım için Bkz. Bölüm 4.2)
5.2. Farmakokinetik özellikler
Genel özellikler:Emilim:
Oral uygulamadan sonra, pik iksazomib plazma konsantrasyonlarına dozlamadan yaklaşık bir saat sonra ulaşılmıştır. Ortalama mutlak oral biyoyararlanım %58'dir. İksazomib EAA'sı 0,2-10,6 mg'lık bir doz aralığında dozla orantılı bir şekilde artar. Yüksek yağ içerikli bir öğünle birlikte uygulanması, iksazomibin EAA'sı bir gecelik açlık sonrası uygulamaya kıyasla %28 oranında düşürmüştür (Bkz. Bölüm 4.2).
Dağılım:
İksazomib, plazma proteinlerine %99 oranında bağlanır ve 10 kan-plazma EAA oranıyla
eritrositlere dağılır. Kararlı durum dağılım hacmi 543 litredir.
Biyotransformasyon:
Radyoişaretli dozun oral yoldan uygulanmasından sonra, plazmadaki ilaçla ilgili materyalin
%70'inin iksazomibten oluştuğu görülmüştür. İksazomibin temel klirens mekanizmasının birden fazla CYP enzimi ve CYP dışı proteinler tarafından metabolizma olması beklenmektedir. Klinik olarak anlamlı iksazomib konsantrasyonlarında, insan cDNA tarafından eksprese edilen sitokrom P450 izoenzimler kullanılarak yapılan in vitro çalışmalar, iksazomib metabolizmasına baskın olarak katkıda bulunan spesifik bir CYP izoenzimi olmadığını ve CYP dışı proteinlerin genel metabolizmaya katkıda bulunduğunu göstermiştir. Klinik olarak gözlemlenen konsantrasyonların üzerindeki konsantrasyonlarda, iksazomib birden fazla CYP izoformu tarafından metabolize edilmiş olup, bunların tahmini rölatif katkıları şöyledir: 3A4 (%42,3), 1A2 (%26,1), 1A2 (%26,1), 2B6 (%16,0), 2C8 (%6,0), 2D6 (%4,8), 2C19 (%4,8) ve 2C9 (<%1).
Eliminasyon:
İksazomib çoklu üstel bir atılım profili sergiler. Bir popülasyon FK analizine göre, sistemik klirens (SK) yaklaşık 1,86 L/saat, bireyler arası değişkenlikse %44 olarak belirlenmiştir. İksazomibin terminal yarılanma ömrü (t1/2) 9,5 gündür. 15. günde, haftalık oral dozlama ile akümülasyon oranının yaklaşık 2 kat fazla olduğu gözlenmiştir.
14C-iksazomibin tek oral dozu ilerlemiş kanseri olan 5 hastaya uygulandıktan sonra, uygulanan radyoaktivitenin %62'si idrar ve %22'si dışkı ile atılmıştır. Değişmemiş iksazomib, idrarda geri kazanılan uygulanan dozun < %3,5'ini oluşturmuştur.
Hastalardaki karakteristik özellikler:
Karaciğer Yetmezliği:
Popülasyon FK analizine göre, karaciğer fonksiyonu normal olan hastalarda ve hafif karaciğer yetmezliği olan hastalarda (toplam bilirubin < ULN ve AST > ULN veya toplam bilirubin > 1- 1,5 x ULN ve herhangi bir AST) iksazomibin farmakokinetiği benzer bulunmuştur.
İksazomibin farmakokinetiği, karaciğer fonksiyonu normal olan hastalarda 4 mg (N=12), orta şiddette karaciğer yetmezliği olan hastalarda 2,3 mg (toplam bilirubin > 1,5-3 x ULN, N=13) veya şiddetli karaciğer yetmezliği olan hastalarda 1,5 mg dozunda (toplam bilirubin > 3 x ULN, N=18) karakterize edilmiştir. Serbest doza göre normalize edilen ortalama EAA, orta derece veya şiddetli karaciğer yetmezliği olan hastalarda, karaciğer fonksiyonu normal olan hastalara
göre %27 daha yüksek bulunmuştur (Bkz. Bölüm 4.2).
Böbrek Yetmezliği:
Popülasyon FK analizinde, böbrek fonksiyonu normal olan hastalarda ve hafif veya orta derece böbrek yetmezliği olan hastalarda (kreatinin klirensi ≥30 ml/dk.) iksazomibin farmakokinetiği benzer bulunmuştur.
İksazomibin FK'sı, böbrek fonksiyonu normal olan (kreatinin klirensi > 90 ml/dk., N=18), şiddetli böbrek yetmezliği olan (kreatinin klirensi < 30 ml/dk., N=14) veya diyaliz gerektiren ESRD'si (N=6) olan hastalarda 3 mg dozunda karakterize edilmiştir. Serbest EAA, şiddetli böbrek yetmezliği veya diyaliz gerektiren ESRD'si olan hastalarda, böbrek fonksiyonu normal olan hastalara göre %38 daha yüksek bulunmuştur. Hemodiyaliz seansı sırasında ölçülen diyaliz cihazı öncesi ve sonrası iksazomib konsantrasyonları benzer bulunması, iksazomibin diyaliz edilemediğine işaret etmektedir (Bkz. Bölüm 4.2)
Yaş, Cinsiyet, Irk:
Popülasyon FK analizine göre, yaş (aralık: 23-91 yaş), cinsiyet, vücut yüzey alanı (aralık: 1,2- 2,7 m2 ) veya ırkın iksazomibin klirensi üzerinde klinik olarak anlamlı bir etkisi yoktur. Ortalama EAA, Asya ırkındaki hastalarda % 35 daha yüksektir, ancak Beyaz ırk ve Asya ırkı hastaları karşılaştırıldığında iksazomib'in EAA değeri örtüşmektedir.
5.3. Klinik öncesi güvenlilik verileri
Mutajenisite
İksazomib, ne bakteriyel ters mutasyon testinde (Ames testi) mutajenik, ne de farelerde kemik iliği mikronükleus tayininde klastojenik bulunmamıştır. İksazomib, insan periferik kan lenfositlerindeki in vitro klastojenisite tayininde pozitif bulunmuştur. Bununla birlikte iksazomib farelerde mide ve karaciğerde kuyruk DNA %'si olarak değerlendirilen in vivo komet tayininde negatif sonuç vermiştir. Bu nedenle, kanıtlar NINLARO'nun bir genotoksik risk teşkil etmediğini desteklemektedir.
Üreme ve embriyo-fötal gelişimi:
İksazomib, gebe sıçanlar ve tavşanlarda yalnızca maternal olarak toksik dozlarda ve önerilen dozu alan hastalarda gözlenenlerden biraz daha yüksek maruziyetlerde embriyo-fötal toksisiteye neden olmuştur. İksazomib ile fertilite, erken embriyonik gelişim ve pre- ve post- natal toksikoloji çalışmaları yürütülmemiştir. Sıçanlarda 6 aya kadar ve köpeklerde 9 aya kadar süren çalışmalarda, erkek veya kadın üreme organlarında iksazomib tedavisine bağlı herhangi bir etki görülmemiştir.
Hayvan Toksikolojisi ve / veya Farmakolojisi
Sıçan ve köpeklerde yapılan çok kürlü tekrarlı doz toksisite çalışmalarında başlıca hedef organlar mide-bağırsak yolu, lenfoid dokuları ve sinir sistemini içermekteydi. Klinik rejimin (28 günlük kür) taklit edildiği dozlama programı ile köpeklere oral yoldan ilaç verilen aylık çalışmada (10 kür) mikroskobik nöronal etkiler genellikle yapısı itibariyle minimal olup yalnızca 0,2 mg/kg (4 mg/m2)'de gözlenmiştir. Lumbar dorsal kök gangliyon ve dorsal kolon haricinde hedef organ bulgularının çoğunluğunda tedavinin durdurulmasının ardından kısmi ya da tam iyileşme görülmüştür.
Sıçanlarda oral uygulamadan sonra doku dağılım çalışmasında, beyin ve omuriliğin en düşük düzeyin olduğu organlar arasında olduğu görülmüştür. Bu durum, iksazomib'in kan-beyin
bariyerinden penetrasyonunun sınırlı olduğunu göstermektedir. Ancak bu durumun insanlarda da geçerli olup olmadığı bilinmemektedir.
Gerek in vitro (hERG kanallarında) gerekse in vivo (tek oral uygulamanın ardından telemetreli köpeklerde) gerçekleştirilen non-klinik güvenlik farmakoloji çalışmalarında iksazaomib'in klinik değerin 8 katından fazla eğri altında kalan alanda kardiyovasküler veya solunum fonksiyonlarında hiçbir etkisi olmadığı gösterilmiştir.
 Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur.
Doğum Sonrası Depresyonu
Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından
tecrübe edilen stresli bir durumdur. |
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
İLAÇ GENEL BİLGİLERİ
Takeda İlaçları ve Ticaret Ltd.Şti.
| Geri Ödeme Kodu | A16946 |
| Satış Fiyatı | 102661.48 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 102661.48 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699456150050 |
| Etkin Madde | Iksazomib |
| ATC Kodu | L01XG03 |
| Birim Miktar | 4 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 3 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Danimarka ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |