NITINAB 200 mg sert kapsül (112 kapsül) Farmakolojik Özellikler
{ Nilotinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajan: Protein-tirozin kinaz inhibitörü ATC Kodu: L01EA03
Etki mekanizması:
Nilotinib, hem hücre dizilerinde hem de Philadelphia-kromozomu pozitif primer lösemi hücrelerinde, BCR-ABL onkoproteininin ABL tirozin kinaz aktivitesinin güçlü bir inhibitörüdür. İlaç, ATP bağlanma yerine son derece yüksek bir afinite ile bağlanarak, yabanıl- tip BCR-ABL'yi güçlü bir şekilde inhibe etmekte ve BCR-ABL'nin imatinibe karşı dirençli 32/33 mutant formuna karşı etkinlik sağlamaktadır. Bu biyokimyasal etkinliğin bir sonucu olarak, nilotinib KML hastalarından alınan Philadelphia-kromozomu pozitif primer lösemi hücrelerinde ve hücre dizilerinde selektif olarak proliferasyonu inhibe etmekte ve apopitozu indüklemektedir. KML sıçan modellerinde, nilotinib monoterapi olarak oral uygulamayı takiben tümör yükünü azaltmakta ve sağ kalımı uzatmaktadır.
Farmakodinamik etkiler:
Nilotinibin, KML tedavisi için önerilen terapötik dozlarda oral uygulamayı takiben elde edilen aralıktaki konsantrasyonlarda inhibe ettiği PDGF (Platelet kaynaklı büyüme faktörü), KIT CSF- 1R, DDR ve Efrin reseptör kinazları dışında, Src de dahil olmak üzere incelenen diğer protein kinazların çoğuna karşı herhangi bir etkisi yoktur ya da çok az bir etkisi vardır (Bkz. Tablo 3).
Tablo 3: Nilotinibin Kinaz Profili (Fosforilasyon ICnM)
BCR-ABL | PDGFR | KIT |
20 | 69 | 210 |
Klinik etkililik:
Yeni tanı almış kronik faz KML'de klinik çalışmalar
Sitogenetik olarak doğrulanmış yeni tanı konmuş yetişkin Ph+ KML-KF (kronik faz) hastalarında nilotinib ve imatinib etkililiklerinin karşılaştırılması amacıyla 846 yetişkin hastada açık etiketli, çok merkezli, randomize bir Faz III çalışması yürütülmüştür. Hastalar altı ay önce tanı almıştır ve hidroksiüre ve/veya anagrelid hariç önceden tedavi görmemişlerdir. Hastalar günde iki kez nilotinib 300 mg (n=282), günde iki kez nilotinib 400 mg (n=281) veya günde bir kez imatinib 400 mg (n=283) almak üzere 1:1:1 oranında randomize edilmiştir. Randomizasyon, tanı anındaki Sokal risk skoruna göre katmanlandırılmıştır.
Başlangıç karakteristikleri üç tedavi kolu arasında dengeli olmuştur. Medyan yaş her iki nilotinib kolunda 47 yıl ve imatinib kolunda 46 yıl olmuş, günde iki kez nilotinib 300 mg, günde iki kez nilotinib 400 mg ve günde bir kez imatinib 400 mg kollarında hastaların sırasıyla
%12,8, %10,0 ve %12,4'ünün ≥65 yaşında olduğu belirlenmiştir. Erkek hastaların sayısı kadın hastalardan biraz daha fazla olmuştur (günde iki kez nilotinib 300 mg, günde iki kez nilotinib 400 mg ve günde bir kez imatinib 400 mg kollarında sırasıyla %56,0, %62,3 ve %55,8). Hastaların %60'ından fazlası Beyazdır vetüm hastaların %25'i Asyalıdır.
Birincil veri analizi zaman noktası 846 hastanın tümünün 12 aylık tedaviyi tamamladığı (ya da daha önce ayrıldığı) zaman olmuştur. Müteakip analizler hastaların 24, 36, 48, 60 ve 72 aylık tedavi tamamladığı (ya da daha önce ayrıldığı) zamanları yansıtmaktadır. Tedavide geçen medyan süre nilotinib tedavi kollarında yaklaşık 70 ay ve imatinib grubunda 64 aydır. Kullanılan medyan doz yoğunluğu günde iki kez 300 mg nilotinib için 593 mg/gün, günde iki kez 400 mg nilotinib için 772 mg/gün ve günde bir kez 400 mg imatinib için 400 mg/gün şeklindedir. Bu çalışma devam etmektedir.
Birincil sonlanım noktası 12. ayda majör moleküler yanıt (MMY) olmuştur. MMY, RQPCR ile ölçülen uluslararası ölçeğe (IS) göre ≤%0,1 BCR ABL/ABL% şeklinde tanımlanmış olup standardize başlangıç değerinden ≥3 log BCR ABL transkript azalmasına karşılık gelmektedir.
12. ayda MMY oranı, günde iki kez 300 mg nilotinib grubunda, günde bir kez 400 mg imatinib grubu ile karşılaştırıldığında istatistiksel olarak anlamlı düzeyde daha yüksek olmuştur (%44,3 karşısında %22,3, p<0.0001). 12. ayda MMY oranı günde iki kez 400 mg nilotinib grubunda da, günde bir kez 400 mg imatinib grubu ile karşılaştırıldığında, istatistiksel olarak anlamlı düzeyde daha yüksek bulunmuştur (%42,7 karşısında %22,3, p<0.0001).
3, 6, 9 ve 12. aylarda MMY oranları günde iki kez 300 mg nilotinib grubu için sırasıyla %8,9,
%33,0, %43,3 ve %44,3, günde iki kez 400 mg nilotinib grubu için sırasıyla %5,0, %29,5%,
%38,1 ve %42,7 ve günde bir kez 400 mg imatinib için sırasıyla %0,7, %12,0, %18,0 ve %22,3 olmuştur.
12, 24, 36, 48, 60 ve 72. aylardaki MMY oranları Tablo 4'de gösterilmektedir.
Tablo 4 MMY oranı
| Nilotinib günde iki kez 300 mg n=282 (%) | Nilotinib günde iki kez 400 mg n=281 (%) | İmatinib günde bir kez 400 mg n=283 (%) |
12. ayda Major Moleküler Yanıt Yanıt için %95 GA | 44,3 (38,4, 50,3) | 42,7 (36,8, 48,7) | 22,3 (17,6, 27,6) |
24. ayda Major Moleküler Yanıt Yanıt için %95 GA | 61,7 (55,8, 67,4) | 59,1 (53,1, 64,9) | 37,5 (31,8, 43,4) |
36. ayda Major Moleküler Yanıt Yanıt için %95 GA | 58,5 (52,5, 64,3) | 57,3 (51,3, 63,2) | 38,5 (32,8, 44,5) |
48. ayda Major Moleküler Yanıt Yanıt için %95 GA | 59,9 (54,0, 65,7) | 55,2 (49,1, 61,1) | 43,8 (38,0, 49,8) |
60. ayda Major Moleküler Yanıt Yanıt için %95 GA | 62,8 (56,8, 68,4) | 61,2 (55,2, 66,9) | 49,1 (43,2, 55,1) |
72. ayda Major Moleküler Yanıt Yanıt için %95 GA | 52,5 (46,5, 58,4) | 57,7 (51,6, 63,5) | 41,7 (35,9, 47,7) |
Farklı zaman noktalarına göre MMY oranları (o zaman noktasında veya öncesinde yanıt veren hasta olarak MMY'ye ulaşan hastalar dahil), kümülatif MMY insidansında sunulmaktadır (Bkz. Şekil 1).
Şekil 1 Kümülatif MMY insidansı
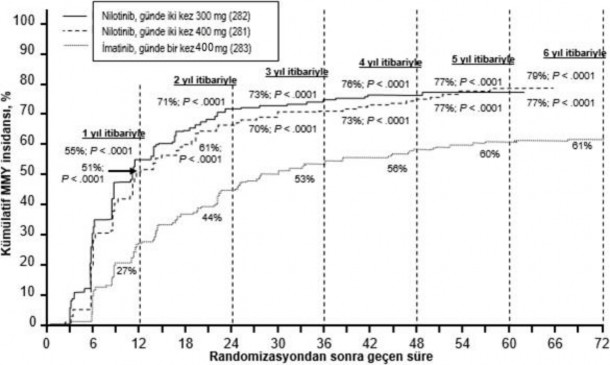
Tüm Sokal risk gruplarında (KML hastalarının sağkalımını belirlemede hasta yaşı, dalak büyüklüğü, periferik kanda blast ve trombosit sayısını içeren bir skorlama sistemidir) tüm zaman noktalarındaki MMY oranı iki nilotinib grubunda da imatinib grubundan daha yüksek olmuştur.
Retrospektif bir analizde, günde iki kez 300 mg nilotinib kullanan hastaların %91'i (234/258) tedavinin 3. ayında ≤%10 BCR-ABL düzeyleri elde ederken, bu oran günde bir kez imatinib
400 mg kullanan hastalarda %67'dir (176/264). Tedavinin 3. ayında ≤%10 BCR-ABL düzeylerine sahip hastalar, bu moleküler yanıt düzeyini elde etmeyenlere kıyasla 72 ayda daha fazla genel sağkalım göstermiştir (sırasıyla %94,5 karşısında %77,1 [p=0.0005]).
p<0.0001, günde iki kez 400 mg ile günde bir kez 400 mg imatinib arasında HR=1.88 ve katmanlandırılmış log sıra p<0.0001).
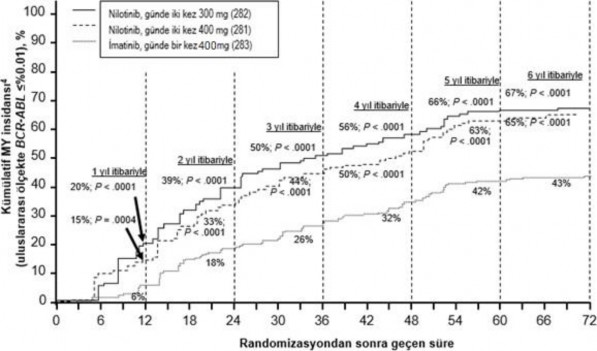
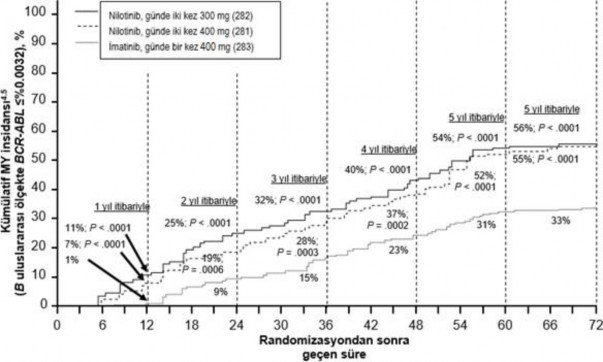
Farklı zaman noktalarında IS ile %≤0,01 ve ≤%0,0032 düzeylerinde moleküler yanıtı olan hastaların oranı Tablo 5'te sunulmakta ve farklı zaman noktalarına göre IS ile %≤0,01 ve
≤%0,0032 değerlerinde moleküler yanıtı olan hastaların oranı Şekil 2 ve 3'te gösterilmektedir. IS ile ≤%0,01 ve ≤%0,0032 moleküler yanıt oranları, standardize bir başlangıç değerinden sırasıyla ≥4 ve ≥4.5 log BCR ABL transkriptler azalmasına karşılık gelmektedir.
Tablo 5 %≤0,01 (4 log azalma) ve ≤%0,0032 (4.5 log azalma) düzeyinde moleküler yanıtı olan hastaların oranları
| Nilotinib günde iki kez 300 mg n=282 (%) | Nilotinib günde iki kez 400 mg n=281 (%) | İmatinib günde bir kez 400 mg n=283 (%) | |||
| ≤%0,01 | ≤%0,0032 | ≤%0,01 | ≤%0,0032 | ≤%0,01 | ≤%0,0032 |
12 ayda | 11,7 | 4,3 | 8,5 | 4,6 | 3,9 | 0,4 |
24 ayda | 24,5 | 12,4 | 22,1 | 7,8 | 10,2 | 2,8 |
36 ayda | 29,4 | 13,8 | 23,8 | 12,1 | 14,1 | 8,1 |
48 ayda | 33,0 | 16,3 | 29,9 | 17,1 | 19,8 | 10,2 |
60 ayda | 47,9 | 32,3 | 43,4 | 29,5 | 31,1 | 19,8 |
72 ayda | 44,3 | 31,2 | 45,2 | 28,8 | 27,2 | 18,0 |
Şekil 2 ≤%0,01 (4 log azalma) moleküler yanıtın kümülatif insidansı
Şekil 3 ≤%0,0032 (4.5 log azalma) moleküler yanıtın kümülatif insidansı
İlk MMY'nin süresine ilişkin Kaplan Meier tahminlerine dayalı olarak, MMY'ye ulaşan hastalar arasında yanıtını 72 ay sürdüren hastaların oranları günde iki kez 300 mg nilotinib grubunda %92,5 (%95 GA: %88,6 %96,4), günde iki kez 400 mg nilotinib grubunda %92,2
(%95 GA: %88,5 %95,9) ve günde bir kez 400 mg imatinib grubunda %88,0 (%95 GA: %83,0
%93,1) olmuştur.
Tam sitogenetik yanıt (TSY):
Tam sitogenetik yanıt (TSY), değerlendirilen minimum 20 metafaza dayalı olarak kemik iliğinde %0 Ph+ metafazı şeklinde tanımlanır. 12 ay itibariyle en iyi TSY oranı (yanıt veren hastalar olarak 12. ay zaman noktasında veya öncesinde TSY'ye ulaşan hastaları içerir), hem günde iki kez nilotinib 300 mg hem de günde iki kez 400 mg nilotinib için günde bir kez 400 mg imatinibe kıyasla istatistiksel olarak daha yüksektir.
24 ay itibariyle TSY oranı (yanıt veren hastalar olarak 24. ay zaman noktasında veya öncesinde TSY'ye ulaşan hastaları içerir), hem günde iki kez 300 mg nilotinib hem de günde iki kez 400 mg nilotinib için günde bir kez 400 mg imatinibe kıyasla istatistiksel olarak daha yüksektir.
Tablo 6 En iyi TSY oranı
| Nilotinib Günde iki kez 300 mg n=282 (%) | Nilotinib Günde iki kez 400 mg n=281 (%) | İmatinib Günde bir kez 400 mg n=283 (%) |
12 ay itibariyle |
|
|
|
Yanıt (%95 GA) | 80,1 (75,0; 84,6) | 77,9 (72,6; | 65,0 (59,2; 70,6) |
Yanıt yok | 19,9 | 22,1 | 35,0 |
Yanıt oranı için CMH testi p değeri (günde bir kez imatinib 400 mg karşısında) | <0,0001 | 0,0005 |
|
24 ay itibariyle |
|
|
|
Yanıt (%95 GA) | 86,9 (82,4; 90,6) | 84,7 (79,9; 88,7) | 77,0 (71,7; 81,8) |
Yanıt yok | 13,1 | 15,3 | 23,0 |
Yanıt oranı için CMH testi p değeri (günde bir kez imatinib 400 mg karşısında) | 0,0018 | 0,0160 |
|
Kaplan-Meier tahminlerine dayalı olarak, TSY'ye ulaşan hastalar arasında yanıtını 72 ay süreyle sürdüren hastaların oranları, günde iki kez 300 mg nilotinib grubunda %99,1 (%95 GA:
%97,9-%100), günde iki kez 400 mg nilotinib grubunda %98,7 (%95 GA: %97,1-%100) ve
günde bir kez imatinib 400 mg grubunda %97,0 (%95 GA: %94,7-%99,4) şeklindedir.
Tedavi sırasında akselere faza (AF) veya blast krize (BK) progresyon, randomizasyon tarihinden itibaren akselere faza veya blast krize ilk belgelenen hastalık progresyonuna ya da KML ilişkili ölüme kadar geçen süre şeklinde tanımlanmıştır. Tedavi sırasında akselere faza veya blast krize progresyon toplam 17 hastada gözlenmiştir: günde iki kez nilotinib 300 mg'da 2 hasta, günde iki kez nilotinib 400 mg'da 3 hasta ve günde bir kez imatinib 400 mg'da 12 hasta. 72. ayda akselere faza veya blast krize progresyonu olmayan hastaların tahmini oranları sırasıyla %99,3, %98,7 ve %95,2 olmuştur (HR=0.1599 ve katmanlandırılmış log sıra günde iki kez nilotinib 300 mg ile günde bir kez imatinib arasında p=0,0059, HR=0.2457 ve katmanlandırılmış log sıra günde iki kez nilotinib 400 mg ile günde bir kez imatinib arasında p=0,0185). 2 yıllık analizden sonra tedavide herhangi bir yeni AF/BK'ye progresyon olayı bildirilmemiştir.
Progresyon kriteri olarak klonal evrilme dahil, veri kesme tarihi itibariyle toplam 25 hasta tedavideyken akselere faza veya blast krize progrese olmuştur (günde iki kez nilotinib 300 mg grubunda 3, günde iki kez nilotinib 400 mg grubunda 5 ve günde bir kez imatinib 400 mg grubunda 17). 72. ayda klonal evrilme dahil akselere faza veya blast krize progresyonu olmayan hastaların tahmini oranları sırasıyla %98,7, %97,9 ve %93,2 olmuştur (HR=0.1626 ve katmanlandırılmış log sıra günde iki kez nilotinib 300 mg ile günde bir kez imatinib arasında p=0,0009, HR=0.2848 ve katmanlandırılmış log sıra günde iki kez nilotinib 400 mg ile günde bir kez imatinib arasında p=0,0085).
Toplam 55 hasta tedavi sırasında ya da tedavinin kesilmesinden sonrasındaki takip sırasında yaşamını kaybetmiştir (günde iki kez 300 mg nilotinib grubunda 21, günde iki kez 400 mg nilotinib grubunda 11 ve günde bir kez 400 mg imatinib grubunda 23). Bu 55 ölümün 26'sı KML ile ilişkili olmuştur (günde iki kez 300 mg nilotinib grubunda 6, günde iki kez 400 mg nilotinib grubunda 4 ve günde bir kez 400 mg imatinib grubunda 16). 72. ayda hayatta kalan hastaların tahmini oranı sırasıyla %91,6, %95,8 ve %91,4'tür (HR=0.8934 ve katmanlandırılmış log sıra günde iki kez 300 mg nilotinib ile imatinib arasında p=0.7085, HR=0.4632 ve katmanlandırılmış log sıra günde iki kez 400 mg nilotinib ile imatinib arasında p=0.0314). Olay olarak sadece KML ile ilişkili ölümler göz önünde bulundurulduğunda, 72. ayda tahmini genel sağkalım oranları sırasıyla %97,7, %98,5 ve %93,9 olmuştur (HR=0.3694 ve katmanlandırılmış log sıra günde iki kez 300 mg nilotinib ile imatinib arasında p=0.0302, HR=0.2433 ve katmanlandırılmış log sıra günde iki kez 400 mg nilotinib ile imatinib arasında
Kronik faz ve akselere fazda imatinibe dirençli veya imatinibi tolere edemeyen KML'de klinik çalışmalar
Kronik ve akselere fazdaki hastalık için ayrı tedavi kollarıyla imatinibe dirençli veya imatinibi tolere edemeyen KML'li hastalarda nilotinibin etkililiğini saptamak üzere açık etiketli, kontrolsüz, çok merkezli bir Faz II çalışma gerçekleştirilmiştir. Etkililik, çalışmaya alınan 321 KML-KF hastası ve 137 KML-AF hastasına dayanmıştır. Medyan tedavi süresi KML-KF hastalarında 561 gün ve KML-AF hastalarında 264 gün olmuştur (bkz. Tablo 7). Yetersiz yanıt ya da hastalık ilerlemesi yönünde bir kanıt olmadığı sürece nilotinib kesintisiz olarak uygulanmıştır (günde iki kez bir öğünden 2 saat sonra ve uygulamadan sonra en az bir saat süreyle besin alınmayarak). Doz günde iki kez 400 mg olmuş ve günde iki kez 600 mg'a doz yükseltmeye izin verilmiştir.
Tablo 7 Nilotinib ile maruziyet süresi
| Kronik faz n=321 | Akselere faz n=137 |
Medyan tedavi süresi (gün) (25-75. persentiller) | 561 (196-852) | 264 (115-595) |
İmatinibe direnç; tam hematolojik yanıt elde edememe (3 ayda), sitogenetik yanıt elde edememe (6 ayda) veya majör sitogenetik yanıt elde edememeyi (12 ayda) ya da önceki bir sitogenetik veya hematolojik yanıt sonrasında hastalık progresyonunu içermiştir. İmatinibe toleranssızlık, toksisite nedeniyle imatinib tedavisini bırakan ve çalışmaya giriş tarihinde majör sitogenetik yanıtta olmayan hastaları içermiştir.
Toplamda hastaların %73'ünün imatinibe dirençli olduğu, %27'sinin ise imatinibi tolere edemediği belirlenmiştir. Hastaların çoğunda, imatinib, hidroksiüre, interferon dahil diğer antineoplastik ajanlar ile önceki kapsamlı bir tedaviyi de içeren uzun KML öyküsünün olduğu, hatta bazılarında organ nakli başarısızlığının da bulunduğu saptanmıştır (Tablo 8). Önceki medyan en yüksek imatinib dozu 600 mg/gün olmuştur.
En yüksek önceki imatinib dozu, hastaların %74'ünde ≥ 600 mg/gün olup hastaların %40'ı
≥800 mg/gün dozları almıştır.
Tablo 8 KML hastalık öyküsü karakteristikleri
| Kronik faz (n=321) | Akselere faz (n=137)* |
Tanıdan sonra geçen süre (ay) (aralık) | 58 (5–275) | 71 (2–298) |
İmatinib Dirençli MSY olmadan toleranssız |
226 (70%) 95 (30%) |
109 (80%) 27 (20%) |
Medyan imatinib tedavisi süresi (gün) (25-75. persentiller) | 975 (519-1,488) | 857 (424-1,497) |
Hidroksiüre öyküsü | 83% | 91% |
İnterferon öyküsü | 58% | 50% |
Kemik iliği nakli öyküsü | 8% |
* Bir hasta için imatinib direnci/toleranssızlığı durumu hakkında eksik bilgi.
KF hastalarında birincil sonlanım noktası, Ph+ hematopoetik hücrelerin eliminasyonu (TSY, tam sitogenetik yanıt) veya <%35 Ph+ metafaz düzeyine anlamlı azalma (kısmi sitogenetik yanıt) şeklinde tanımlanan majör sitogenetik yanıt (MSY) olmuştur. KF hastalarında tam hematolojik yanıt (THY) ikincil sonlanım noktası olarak değerlendirilmiştir. AF hastalarında birincil sonlanım noktası genel doğrulanmış hematolojik yanıt (HY) olup ya tam hematolojik yanıt, lösemi kanıtının olmaması ya da kronik faza dönüş şeklinde tanımlanmıştır.
Kronik faz
321 KF hastasında MSY oranı %51 olmuştur. Yanıt veren hastaların çoğu MSY yanıtlarını hızla, nilotinib tedavine başladıktan sonra 3 ay içinde (medyan 2.8) elde etmiştir ve bu yanıtlar kalıcı olmuştur. TSY elde etmek için geçen medyan sürenin 3 aydan çok az daha uzun olduğu görülmüştür (medyan 3.4 ay). MSY elde eden hastaların %77'sinin (%95 GA: %70 - %84) 24 ayda yanıtı korudukları belirlenmiştir. Medyan MSY süresine o tarihte ulaşılmamıştır. TSY elde eden hastaların %85'inin (%95 GA: %78 - %93) 24 ayda yanıtı korudukları gözlenmiştir. Medyan TSY süresine o tarihte ulaşılmamıştır. Başlangıçta THY'si olan hastalar MSY'ye daha hızlı ulaşmıştır (1.9 karşısında 2.8 ay). Başlangıçta THY'si olmayan KF hastalarının %70'i THY elde etmiş olup THY'ye kadar geçen medyan süre 1 ay ve medyan THY süresi 32.8 ay bulunmuştur. KML-KF hastalarında hesaplanan 24 aylık genel sağkalım oranı % 87 olmuştur.
Akselere faz
137 AF hastasında genel doğrulanmış HY (Hematolojik Yanıt) oranı %50 olmuştur. Yanıt veren hastaların çoğu HY'yi nilotinib tedavisinin başlarında elde etmiş (medyan 1.0 ay) ve bu yanıtlar kalıcı olmuştur (doğrulanmış HY'nin medyan süresi 24.2 ay bulunmuştur). HY elde eden hastaların %53'ünün (%95 GA: %39 - %67) 24 ayda yanıtı korudukları saptanmıştır. MSY oranı %30 olup yanıta kadar geçen medyan süre 2.8 ay olmuştur. MSY elde eden hastaların
%63'ünün (%95 GA: %45 - %80) 24 ayda yanıtı korudukları görülmüştür. Medyan MSY süresi
32.7 ay olmuştur. KML-AF hastalarında hesaplanan 24 aylık genel sağkalım oranı % 70 olmuştur.
İki tedavi kolu için yanıt oranları Tablo 9'da bildirilmektedir.
Tablo 9 KML'de yanıt
(En iyi yanıt oranı) | Kronik faz | Akselere faz | ||||
| Tolere edemeyen (n=95) | Dirençli (n=226) | Toplam (n=321) | Tolere edemeyen (n=27) | Dirençli (n=109) | Toplam* (n=137) |
Hematolojik yanıt (%) | ||||||
Genel (%95 GA) Tam NEL KF'ye dönüş | - 87 (74-94) - - | - 65 (56-72) - - | - 70 (63-76) - | 48 (29-68) 37 7 4 | 51 (42-61) 28 10 13 | 50 (42-59) 30 9 11 |
Sitogenetik yanıt (%) | ||||||
Majör (95%CI) Tam Kısmi | 57 (46-67) 41 16 | 49 (42-56) 35 14 | 51 (46-57) 37 15 | 33 (17-54) 22 11 | 29 (21-39) 19 10 | 30 (22-38) 20 10 |
NEL = Kemik iliği yanıtı/Lösemikanıtıyok/
* Bir hasta için imatinib direnci/toleranssızlığı durumu hakkında eksik bilgi.
KML-BK hastalarında etkililik verileri henüz hazır değildir. İmatinibe ek olarak bir tirozin kinaz inhibitörü ajanını da içeren çoklu tedaviler ile önceden yoğun bir şekilde tedavi edilmiş olan KF ve AF hastalarından oluşan bir grupta nilotinibi araştırma amacıyla Faz II çalışmaya ayrı tedavi kolları da dahil edilmiştir. Bu hastaların 30/36'sı (%83) tedaviye dirençli olup tedaviye toleranssız değildir. Etkililik için değerlendirilen 22 KF hastasında nilotinib %32'lik MSY oranı ve %50'lik THY oranı sağlamıştır. Etkililik için değerlendirilen 11 AF hastasında ise tedavi %36'lık bir genel HY oranı sağlamıştır.
İmatinib ile başarısızlık sonrasında, mutasyonlar açısından değerlendirilen kronik faz KML hastalarının %42'sinde ve akselere faz KML hastalarının %54'ünde 24 farklı BCR-ABL mutasyonu tespit edilmiştir. Nilotinib, T315I hariç imatinib direnci ile bağlantılı çeşitli BCR- ABL mutasyonları taşıyan hastalarda etkililik göstermiştir.
Birinci basamak tedavi olarak nilotinib ile tedavi edilmiş ve sürekli derin moleküler yanıt elde etmiş olan kronik fazdaki yetişkin Ph+ KML hastalarında tedavinin kesilmesi
Açık etiketli, tek kollu bir çalışmada, birinci basamakta ≥ 2 yıl süreyle nilotinib ile tedavi edilip MolecularMD MRDxâ„¢ BCR-ABL testi ile ölçüldüğünde MY4.5 etmiş olan kronik fazdaki 215 yetişkin Ph+ KML hastası, 52 hafta daha nilotinibe devam edecekleri faza alınmıştır (nilotinib konsolidasyon fazı). 215 hastanın 190'ı (%88,4), konsolidasyon fazı sırasında aşağıdaki kriterler ile tanımlanan sürekli derin moleküler yanıt elde ettikten sonra Tedavisiz Faza (TFR) girmiştir:
üç ayda bir yapılan (12 haftada bir alınan) değerlendirmelerin en az 4'ü en az MY4 (BCR- ABL/ABL ≤%0.01 IS) olmuş ve bir yıl korunmuştur
5.2. Farmakokinetik özellikler
Genel özelliklerNİTİNAB (nilotinib) tirozin kinaz inhibitörüdür ve antineoplastik bir ajandır. Nilotinib beyaz ila hafif sarımsı renkte tozdur. Nilotinibin sulu çözeltilerdeki çözünürlüğü pH'nın yükselmesi ile azalır. Nilotinib optik olarak aktif değildir. pK'sı 2,1'dir.
Emilim:
Oral uygulamadan 3 saat sonra nilotinibin doruk konsantrasyonlarına ulaşılmaktadır. Oral uygulamayı takiben nilotinibin emilimi yaklaşık %30 olarak belirlenmiştir. Nilotinibin mutlak biyoyararlanımı henüz belirlenmemiştir. Bir oral çözeltiye kıyasla (pH 1.2 ila 1.3), nilotinib kapsülün bağıl biyoyararlanımı yaklaşık %50'dir. Sağlıklı gönüllülerde nilotinib yemekle birlikte verildiğinde, nilotinibin Cdeğeri ve konsantrasyon-zaman eğrisinin altında kalan alanı (EAA), aç karnına alınmasına kıyasla sırasıyla %112 ve %82 oranında artmıştır. Nilotinibin yemekten 30 dakika ya da 2 saat sonra alınması nilotinibin biyoyararlanımını sırasıyla %29 ve %15 oranında artırmıştır (bkz. bölüm 4.2., bölüm 4.4., bölüm 4.5.). Nilotinibin emilimi (bağıl biyoyararlanım) sırasıyla total gastrektomi ve kısmi gastroktemi geçirmiş hastalarda yaklaşık %48 ve %22 azalabilir.
Dağılım:
Nilotinibin kan-plazma oranı 0,71'dir. Plazma proteinlerine bağlanma, in vitro deneylere dayalı olarak yaklaşık %98 oranındadır.
Biyotransformasyon:
Sağlıklı deneklerde tanımlanan ana metabolik yollar karaciğerde oksidasyon ve hidroksilasyondur. Nilotinib, serumdaki başlıca dolaşan bileşendir. Metabolitlerin herhangi bir nilotinibin farmakolojik aktivitesine anlamlı bir katkıda bulunmamaktadır. Nilotinib CYP2C8'den olası minör bir katkı ile başlıca CYP3A4 ile metabolize edilir.
Eliminasyon:
Sağlıklı gönüllülerde radyoaktif madde ile işaretlenmiş nilotinibin tek bir dozunun uygulanmasından sonra, dozun %90'ından fazlası 7 gün içerisinde çoğunlukla feçes ile (dozun
%94'ü) atılmıştır. Değişmemiş ana ilaç, dozun %69'unu teşkil etmiştir.
Günlük doz uygulaması ile çoklu doz farmakokinetiğinden hesaplanmış belirgin eliminasyon yarılanma ömrü yaklaşık 17 saattir. Nilotinib farmakokinetiğinde hastalar arasında gözlenen değişkenlik orta düzeyde veya yüksektir (%Güven Aralığı: %33 ila %43).
Doğrusallık / doğrusal olmayan durum:
Kararlı durumda nilotinib maruziyetinin, günde bir kez 400 mg'ın üzerindeki doz düzeylerinde sistemik maruziyette doz ile orantılı artıştan daha az bir artış olmak üzere, doza bağımlı olduğu gözlenmiştir. Kararlı durumda, günde iki kez 400 mg'lık dozda uygulanan nilotinibe olan günlük sistemik maruziyetin, günde bir kez 800 mg'lık doza kıyasla %35 daha yüksek olduğu görülmüştür. Günde iki kez nilotinib 400 mg ile kararlı durumdaki sistemik maruziyet (EAA) günde iki kez 300 mg doza göre yaklaşık %13,4 daha yüksek bulunmuştur. 12 ayda nilotinib vadi ve tepe ortalama konsantrasyonu günde iki kez 400 mg ile günde iki kez 300 mg doza göre sırasıyla %15,7 ve %14,8 daha yüksek bulunmuştur. Doz, günde iki kez 400 mg'dan günde iki kez 600 mg'a çıkarıldığında, nilotinib maruziyetinde anlamlı bir artış olmamıştır.
Kararlı durum koşullarına 8. gün itibariyle erişilir. İlk doz ve kararlı durum arasında nilotinibe sistemik maruziyette bir artış, günde bir kez 400 mg doz uygulama için yaklaşık 2 katken, günde iki kez 400 mg doz uygulama için 3,8 kattır.
Hastalardaki karakteristik özellikler
Pediyatrik hastalar:
Pediatrik hastalarda en yakın 50 mg doza yuvarlanan günde iki kez 230 mg/m2 dozunda (maksimum tek doz 400 mg) nilotinib uygulanmasının ardından nilotinibin kararlı durum maruziyeti ve klirensinin, günde iki kez 400 mg ile tedavi edilen erişkinler ile benzer olduğu bulunmuştur (2 kat içinde). Tek ve çoklu dozlar sonrasında nilotinibin farmakokinetik maruziyetinin 2 ila <10 yaş hastalar ile ≥10 ila <18 yaş hastalar arasında birbirine yakın olduğu görülmüştür.
Yaşlılarda:
65 yaş ve üzeri hastalarda farmakokinetik açıdan herhangi bir farklılık gözlenmemiştir. Yaşlı hastalarda doz ayarlamasına gerek yoktur.
Böbrek yetmezliği:
Böbrek fonksiyonu bozulmuş hastalarda nilotinibin farmakokinetiği ile ilgili çalışmalar gerçekleştirilmemiştir. Klinik çalışmalara, serum kreatinin konsantrasyonu normal aralığın üst sınırının (1,2 mg/dl) 1,5 mislinden fazla olan hastalar dahil edilmemiştir.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda nilotinibin farmakokinetiği incelenmemiştir. Klinik çalışmalara ALT (40 U/L) ve/veya AST (40 U/L) düzeyi normal aralığın üst sınırının 2.5 mislinden fazla (ya da hastalığa bağlı ise 5 mislinden fazla) ya da toplam bilirubin (1,2 mg/dl) düzeyi normal aralığın üst sınırının 1,5 mislinden fazla olan hastalar dahil edilmemiştir. Nilotinib çoğunlukla karaciğer aracılığıyla metabolize edilmektedir. Bu nedenle, karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır.
Bireyler arası değişkenlik:
Sekizinci günde kararlı durum konsantrasyonu elde edilmiştir. İlk doz ile kararlı durum arasında serum nilotinib maruziyetindeki artışın günde bir uygulama için yaklaşık 2 misli ve günde iki kez uygulama için 3,8 misli olduğu gözlenmiştir. Günde bir uygulama ile çoklu doz farmakokinetiğinden hesaplanan eliminasyon yarılanma ömrü yaklaşık 17 saat olarak tayin edilmiştir. Nilotinibin farmakokinetiğinde hastalar arası değişkenlik orta ila yüksek dereceli bulunmuştur.
5.3. Klinik öncesi güvenlilik verileri
Nilotinib güvenilirlik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite, üreme sistemi toksisitesi, fototoksisite ve karsinojenisite (sıçan ve fare) çalışmalarında değerlendirilmiştir.
Güvenlilik farmakolojisi çalışmaları
Nilotinibin MSS ya da solunum fonksiyonları üzerinde herhangi bir etkisi olmamıştır. İn vitro kardiyak güvenlilik çalışmaları, nilotinib ile izole tavşan kalplerinde aksiyon potansiyeli süresinde uzama ve hERG dalgalarının bloke edilmesi temelinde QT uzaması için klinik öncesi bir sinyal göstermiştir. Köpeklerde özel bir telemetri çalışmasında veya 39 haftaya kadar tedavi edilen köpeklerde veya maymunlarda EKG ölçümlerinde hiçbir etki görülmemiştir.
Tekrarlı doz toksisitesi çalışmaları
4 haftalık bir süreye kadar köpeklerde ve 9 aylık bir süreye kadar sinomolog maymunlarında gerçekleştirilen tekrarlanan doz toksisite çalışmaları karaciğerin, nilotinibin toksisitesi için başlıca hedef organ olduğunu göstermiştir. Değişimler artmış alanin aminotransferaz ve alkalin fosfataz aktivitesini ve histopatoloji bulgularını (çoğunlukla sinüzoidal hücre ya da Kupffer hücresi hiperplazisi/hipertrofisi, safra kanalı hiperplazisi ve periportal fibrozit) kapsamıştır.
Genelde, klinik kimyadaki değişiklikler 4 haftalık bir iyileşme döneminden sonra tamamen düzelirken, histolojik değişiklikler yalnızca kısmi bir tersinirlik ortaya koymuştur. Karaciğer etkilerinin görüldüğü en düşük doz düzeylerindeki maruziyetlerin, insanlarda 800 mg/gün'lük bir dozdaki maruziyetten daha düşük olduğu gözlenmiştir. 26 haftaya kadar tedavi edilen farelerde ya da sıçanlarda yalnızca küçük karaciğer değişiklikleri gözlenmiştir.
Sıçan, köpek ve maymunlarda kolesterol düzeylerinde çoğunlukla geri dönüşümlü artışlar gözlenmiştir.
Genotoksisite çalışmaları
Bakteriyel in vitro sistemlerde ve in vitro ve in vivo memeli sistemlerinde metabolik aktivasyonla ve metabolik aktivasyon olmaksızın gerçekleştirilen genotoksisite çalışmaları, nilotinibin mutajenik potansiyeline ilişkin herhangi bir kanıt ortaya koymamıştır.
Karsinojenisite çalışmaları
Sıçanlar üzerinde yapılan 2 yıllık karsinojenisite çalışmasında neoplastik olmayan lezyonlar için başlıca hedef organın uterus olduğu görülmüştür (dilatasyon, vasküler ektazi, hiperplazi endotelyal hücre, enflamasyon ve/veya epitelyal hiperplazi). 5, 15 ve 40 mg/kg/gün dozlarında nilotinib uygulanmasını takiben karsinojenisite kanıtına rastlanmamıştır. En yüksek doz düzeyindeki maruziyetler (EAA cinsinden) insanlarda 800 mg/gün dozda nilotinibe günlük kararlı durum maruziyetinin (EAA'ya dayalı) yaklaşık 2 ila 3 katını temsil etmiştir.
Nilotinibin 30, 100 ve 300 mg/kg/gün dozunda uygulandığı 26 haftalık Tg.rasH2 fare karsinojenisite çalışmasında, 800 mg/kg'lık maksimum onaylı dozda (günde iki kez 400 mg olarak uygulanan) insan maruziyetinin yaklaşık 30 ila 40 katını (EAA cinsinden) temsil eden 300 mg/kg'da deri papillomu/karsinomları tespit edilmiştir. Deri neoplastik lezyonları için Etki Gözlenmeyen Düzey, 800 mg/kg'lık maksimum onaylı dozda (günde iki kez 400 mg olarak uygulanan) insan maruziyetinin yaklaşık 10 ila 20 katını temsil eden 100 mg/kg'dır. Neoplastik olmayan lezyonlar için başlıca hedef organlar deri (epidermal hiperplazi), gelişmekte olan dişler (üst kesici dişlerde enamel organın dejenerasyonu/atrofisi ve üst kesici dişlerin diş etleri odontojenik epitelyumunda enflamasyon) ve timus (lenfosit azalması insidansında ve/veya şiddetinde artış) olmuştur.
Üreme toksisitesi ve fertilite çalışmaları
Nilotinib teratojeniteyi indüklememiş, fakat maternal toksisiteye de yol açan dozlarda embriyo- ve fetotoksisiteye yol açmıştır. Hem erkeklerin hem de kadınların tedavi edildiği fertilite çalışmasında da, kadınların tedavi edildiği embriyotoksisite çalışmasında da artmış bir postimplantasyon kaybı gözlenmiştir. Embriyotoksisite çalışmalarında, sıçanlarda embriyo- letalite ve fötal etkiler (çoğunlukla azalmış fetus ağırlıkları, viseral ve iskeletsel değişimler) ve tavşanlarda ise artmış fetus rezorpsiyonu ve iskeletsel değişimler gözlenmiştir. Dişilerde Advers Etki Gözlenmeyen Düzeylerdeki nilotinib maruziyetinin genellikle, insanlarda 800 mg/gün ile elde edilenden daha düşük ya da buna eşit olduğu gözlenmiştir.
İnsanlar için önerilen dozun yaklaşık 5 katı olan test edilen en yüksek doza kadar, erkek ve dişi sıçanlarda sperm sayısı/motilitesi ya da fertilite üzerinde herhangi bir etki gözlenmemiştir.
Juvenil hayvan çalışmaları
Bir çalışmada, juvenil sıçanlara oral gavaj yoluyla doğumun ilk haftasından genç erişkinlik dönemine kadar (doğumdan sonra 70. güne kadar) 2, 6 ve 20 mg/kg/gün dozlarında nilotinib uygulanmıştır. Etkiler 20 mg/kg/gün dozunda sınırlı olmuş, vücut ağırlığı ve gıda tüketimi parametrelerinde azalmalardan oluşmuş ve dozun kesilmesinin ardından düzelmiştir. Juvenil sıçanlarda Etki Gözlenmeyen Düzey, 6 mg/kg/gün olarak kabul edilmiştir. Genelde juvenil sıçanlardaki toksisite profili erişkin sıçanlarda gözlemlenene benzer bulunmuştur.
Fototoksisite çalışmaları
Nilotinibin UV-B ve UV-A aralığında ışığı absorbe ettiği ve deriye dağılarak in vitro olarak fototoksik bir potansiyel gösterdiği ortaya konmuştur. Bununla birlikte, in vivo ortamda fototoksisite görülmemiştir. Bu nedenle, nilotinibin hastalarda fotosensitizasyona yol açma riski çok düşük kabul edilmektedir.
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Nobel İlaç Sanayii ve Tic. Anomim Şirketi
| Satış Fiyatı | 35561.29 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 35561.29 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699540023277 |
| Etkin Madde | Nilotinib |
| ATC Kodu | L01EA03 |
| Birim Miktar | 200 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 112 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |