NORDITROPIN NORDIFLEX 10 mg/1.5 ml enjeksiyonluk çözelti içeren kullanımahazır kalem Kısa Ürün Bilgisi
{ Somatropin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
Norditropin® NordiFlex® 10 mg/1.5 mL, enjeksiyonluk çözelti içeren kullanıma hazır kalem Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Somatropin… 6.7 mg/mL
(Somatropin, rekombinant DNA teknolojisi ile Eschericia coli kullanılarak üretilmiştir.) 1 mg somatropin, 3 IU (İnternasyonel Ünite) somatropine eşdeğerdir.
Yardımcı maddeler
Sodyum hidroksit (pH ayarı için) yeterli miktarda
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti içeren kullanıma hazır kalem. Berrak, renksiz çözelti
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Çocuklarda:
Büyüme hormonu eksikliğine (BHE) bağlı büyüme geriliği,
Kızlarda gonadal disgeneziye bağlı büyüme geriliği (Turner Sendromu), Puberte öncesi çocuklarda kronik böbrek hastalığına bağlı büyüme gecikmesi,
Doğum boyu ve/veya ağırlığı -2 standart sapmanın (SS) altında olan ve 4 yaşına veya daha sonrasına kadar normal büyüme hızını yakalayamamış [son yıl süresince büyüme hızı standart sapma skoru (SSS) < 0] gebelik yaşına göre küçük (small for gestational age = SGA) doğmuş kısa boylu çocuklarda büyüme geriliği (şu anki boy SSS < -2.5 ve parental düzeltilmiş boy SSS < -1).
Noonan sendromuna bağlı büyüme geriliği.
Erişkinlerde:
Çocukluk döneminde başlayan büyüme hormonu eksikliği:
Çocukluk döneminde başlayan büyüme hormonu eksikliği olanlar, büyüme tamamlandıktan sonra büyüme hormonu salgı kapasitesi bakımından tekrar değerlendirilmelidir. Üçten fazla hipofiz hormonu eksikliği olan kişilerde, tanımlanmış bir genetik sebebe, yapısal hipotalamo- hipofizer anomalilere, santral sinir sistemi tümörlerine veya yüksek doz kraniyal ışınlamaya bağlı şiddetli büyüme hormonu eksikliği (BHE) olan kişilerde ya da hipotalamo-hipofizer hastalık veya yetmezliğine sekonder BHE'li kişilerde, eğer büyüme hormonu tedavisini bıraktıktan en az dört hafta sonra serum insülin-benzeri büyüme faktörü-1 (IGF-1) < -2 SSS ise test gerekli değildir.
Diğer tüm hastalarda IGF-1 ölçümü ve bir büyüme hormonu stimülasyon testi gereklidir. Erişkinlik döneminde başlayan büyüme hormonu eksikliği:
Bilinen hipotalamo-hipofizer hastalıkta, kraniyal ışınlama ve travmatik beyin hasarında
belirgin BHE. BHE, prolaktin haricinde başka bir aksta eksiklikle ilişkili olmalıdır. BHE, akstaki diğer eksiklikler için yeterli replasman tedavisinin başlatılmasından sonra bir provokatif test ile gösterilmelidir.
Erişkinlerde, tercih edilen provokatif test, insülin tolerans testidir. İnsülin tolerans testi kontrendike olduğunda, alternatif provokatif testler uygulanmalıdır. Arjinin testi ile büyüme hormonu salıverdirici hormon testinin birlikte yapılması önerilmektedir. İnsülin tolerans testi kadar belirlenmiş tanısal değerleri olmasa da arjinin veya glukagon testleri de kullanılabilir.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi:
Norditropin®, yalnızca, endikasyonları konusunda uzman doktorlar tarafından reçetelenmelidir.
Doz hastaya göre belirlenir ve her zaman hastanın tedaviye verdiği klinik ve biyokimyasal yanıt göz önüne alınarak düzenlenmelidir.
Genel olarak önerilen dozlar:
Pediyatrik Popülasyon:
Büyüme hormonu yetersizliği
0.025-0.035 mg/kg/gün veya 0.7-1.0 mg/m2/gün
Büyüme tamamlandıktan sonra BHE devam ediyorsa, yağsız beden kütlesi ve kemik mineral oluşumu dahil olmak üzere tam somatik erişkin gelişimi elde edilecek şekilde büyüme hormonu tedavisine devam edilmelidir (dozlamaya yol göstermesi için, bakınız Erişkinlerde replasman tedavisi).
Turner Sendromu
0.045-0.067 mg/kg/gün veya 1.3-2.0 mg/m2/gün
Kronik böbrek hastalığı
0.050 mg/kg/gün veya 1.4 mg/m2/gün (bakınız Bölüm 4.4)
Gebelik yaşına göre küçük (SGA)
0.47 mg/kg/hafta'ya kadar (0.067 mg/kg/gün'e kadar)
Boy SSS < -3 olan çok kısa pediyatrik hastalarda ve yaşca daha büyük pubertal pediyatrik hastalarda, daha yüksek Norditropin® dozu (0.067 mg/kg/gün'e kadar) ile tedaviye başlanması düşünülebilir. Tedavinin ilk birkaç yılında önemli ölçüde büyüme yakalanırsa, dozajda kademeli bir azalma düşünülebilir. Boy kısalığı daha az şiddetli olan, başlangıç boy SSS değerleri -2 ile -3 arasında olan 4 yaşından küçük pediatrik hastalardatedaviye 0.033 mg/kg/gün ile başlanması ve dozun gerektiği gibi titre edilmesi düşünülebilir.
Uzama hızı +1 SSS'nun altında ise, tedavinin ilk yılından sonra tedavi sonlandırılmalıdır. Uzama hızı < 2 cm/yıl ise ve onaylanması gerekirse, epifiz büyüme plaklarının kapanmasına uygun şekilde, kemik yaşı kızlarda > 14 ya da erkeklerde > 16 ise tedavi sonlandırılmalıdır.
Noonan sendromu:
Önerilen doz 0.066 mg/kg/gündür, ancak bazı vakalarda 0.033 mg/kg/gün yeterli olabilir (bakınız Bölüm 5.1).
Epifizler kapandığında tedavi sonlandırılmalıdır (bakınız Bölüm 4.4).
Erişkin popülasyonunda:
Erişkinlerde replasman tedavisi
Doz, hastanın gereksinimine göre belirlenmelidir. Çocukluk döneminde başlayan BHE'si olan hastalarda tedaviye 0.2-0.5 mg/gün dozla başlanması ve sonrasında IGF-1 konsantrasyonlarına göre doz ayarlaması önerilmektedir.
Erişkinlikte başlayan BHE hastalarında tedaviye düşük dozla başlanması önerilir: 0.1-0.3 mg/gün. Dozun, hastanın tedaviye verdiği yanıt ve hastanın advers olaylar ile ilgili deneyimleri göz önüne alınarak birer aylık aralıklar ile artırılması önerilmektedir. Doz titrasyonuna kılavuz olarak serum IGF-1 kullanılabilir. Kadınlarda, erkeklere göre daha yüksek dozlar gerekebilir; erkekler zaman içinde artan IGF-1 duyarlılığı sergiler. Bu durum, özellikle oral östrojen replasman tedavisi almakta olan kadınlarda gerekenden az, erkeklerde ise gerekenden fazla tedavinin uygulanması riskinin söz konusu olduğu anlamına gelir.
Doz gereksinimi yaşla birlikte azalır. İdame dozu kişiler arasında önemli değişkenlik gösterir fakat nadiren 1.0 mg/gün dozajını aşar.
Uygulama şekli:
Genellikle, her gün akşamları cilt altına uygulama önerilmektedir. Lipoatrofiyi önlemek için, enjeksiyon yeri değiştirilerek uygulanmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Kronik böbrek hastalığı olan hastalarda, hastalığın doğal seyrinin bir parçası olarak böbrek fonksiyonlarında azalma gözlendiğinden, Norditropin® NordiFlex® tedavisi sırasında, önlem olarak, böbrek fonksiyonlarında aşırı bir düşme veya glomerüler filtrasyon hızında (hiperfiltrasyonu gösterebilecek) bir artış açısından böbrek fonksiyonları takip edilmelidir. Kronik böbrek yetmezliği olan çocuklarda, Norditropin® NordiFlex® tedavisi, renal transplantasyon yapılırken kesilmelidir.
Karaciğer yetmezliği:
Karaciğer yetmezliği bulunan hastalarda kullanımına ilişkin deneyim bulunmamaktadır.
Geriyatrik popülasyon:
Altmış yaşın üzerindeki popülasyonda kullanımına ilişkin deneyim sınırlıdır.
4.3. Kontrendikasyonlar
Etkin madde
Somatropin, tümör aktivitesini gösteren herhangi bir bulgu varlığında kullanılmamalıdır. Büyüme hormonu tedavisi başlanmadan önce intrakraniyal tümörler inaktif olmalı ve anti- tümöral tedavi tamamlanmış olmalıdır. Tümör büyümesini gösteren herhangi bir bulgu varlığında tedavi kesilmelidir.
Somatropin, epifizleri kapanmış çocuklarda boy uzamasının uyarılması için kullanılmamalıdır.
Açık kalp cerrahisi, abdominal cerrahi, kazaya bağlı çoklu travma, akut solunum yetmezliği veya benzer durumları takiben akut kritik hastalık komplikasyonları olan hastalar somatropinle tedavi edilmemelidir (bakınız Bölüm 4.4).
Kronik böbrek yetmezliği olan çocuklarda, Norditropin® NordiFlex® tedavisi, renal transplantasyon yapılırken kesilmelidir.
4.4. Özel kullanım uyarıları ve önlemleri
Somatropin tedavisi gören çocuklar, çocuk gelişimi konusunda uzman doktorlar tarafından düzenli olarak değerlendirilmelidir. Somatropin tedavisi, her zaman, büyüme hormonu yetmezliği ve tedavisi konusunda uzman olan bir doktor tarafından yapılmalıdır. Bu koşullar, Turner sendromu, kronik böbrek hastalığı ,SGA ve Noonan Sendromu tedavisi için de geçerlidir. Norditropin® kullanımını takiben erişkin dönemdeki final boy uzunlukları ile ilgili; Noonan Sendromlu çocuklar için veri sınırlıdır, kronik böbrek hastalığı olan çocuklarda ise veri yoktur.
Önerilen maksimum günlük doz aşılmamalıdır (bakınız 4.2).
Çocuklarda boy uzamasının uyarılması sadece epifiz kapanıncaya kadar beklenebilir. Çocuklar
Prader-Willi Sendromu olan hastalarda BHE tedavisi
Aşırı obezite, üst solunum yolu obstrüksiyonu veya uyku apnesi öyküsü yada tanımlanamamış solunum enfeksiyonu gibi risk faktörlerinden biri ya da birden fazlası olan Prader-Willi sendromlu hastalarda somatropin tedavisinin başlanması ile ani ölümler bildirilmiştir.
Gebelik yaşına göre küçük (SGA)
SGA'lı doğan kısa boylu çocuklarda, tedaviye başlamadan önce, büyüme bozukluğunu açıklayacak diğer tıbbi nedenler ya da tedaviler dışlanmalıdır.
Puberte başlangıcına yakın olan SGA'lı hastalarda tedaviye başlamak ile ilgili deneyimler sınırlıdır. Bu nedenle, puberte başlangıcına yakın hastalarda tedaviye başlanması önerilmemektedir.
Silver-Russell sendromlu hastalarla ilgili deneyim sınırlıdır. Turner Sendromu
Somatropin ile tedavi edilen Turner Sendromlu hastalarda el ve ayaklardaki büyümenin izlenmesi önerilmektedir. El ve ayaklarda büyüme artışı gözlenirse, dozun, doz aralığındaki daha düşük bir doza düşürülmesi düşünülmelidir.
Turner Sendromlu kızlarda otitis media riski genellikle artmış olduğundan, en azından yılda bir defa kulak muayenesi yapılması önerilmektedir.
Kronik böbrek hastalığı
Kronik böbrek hastalığı olan çocuklarda doz, kişiye göre değişir ve kişinin tedaviye verdiği bireysel yanıta göre belirlenmelidir (bakınız Bölüm 4.2). Somatropin tedavisine başlamadan önce, böbrek hastalığı uygun şekilde tedavi edilirken, büyüme en az bir yıl takip edilmeli ve büyüme bozukluğu tam olarak belirlenmelidir. Somatropin tedavisi süresince, konservatif üremi tedavisi alışılmış tıbbi ürünlerle devam etmeli ve gerekiyorsa diyaliz sürdürülmelidir.
Kronik böbrek hastalığı olan hastalarda, hastalığın doğal seyrinin bir parçası olarak, böbrek fonksiyonlarında azalma normal olarak gözlenir. Bununla birlikte, somatropin tedavisi sırasında, önlem olarak, böbrek fonksiyonlarında aşırı bir düşme veya glomerüler filtrasyon hızında (hiperfiltrasyonu gösterebilecek) bir artış açısından böbrek fonksiyonları takip edilmelidir.
Skolyoz
Somatropinle tedavi edilen bazı hasta gruplarında, örneğin Turner sendromu ve Noonan sendromu gibi, skolyozun daha sık görüldüğü bilinmektedir. Ayrıca, çocuklarda hızlı büyüme skolyoz ilerlemesine neden olabilir. Somatropinin skolyoz insidansında veya şiddetinde artışa neden olduğu gösterilmemiştir. Tedavi boyunca skolyoz bulguları izlenmelidir.
Kan şekeri ve insülin
Turner Sendromlu ve SGA'lı çocuklarda, tedaviye başlamadan önce ve sonrasında yılda bir kez açlık insülin ve kan glukoz değerlerinin ölçülmesi önerilmektedir. Diabetes mellitus riski yüksek olan hastalarda (örn. ailede diyabet öyküsü, obezite, ağır insülin direnci, akantozis nigrikans), oral glukoz tolerans testi (OGTT) yapılmalıdır. Belirgin diyabet ortaya çıkarsa büyüme hormonu tedavisi uygulanmamalıdır.
Somatropinin karbonhidrat metabolizmasını etkilediği saptanmıştır. Bu nedenle, hastalar glukoz intoleransı kanıtları açısından gözlenmelidir.
IGF-1
Turner Sendromlu ve SGA'lı çocuklarda tedaviye başlamadan önce ve daha sonra yılda iki kez IGF-1 düzeylerinin ölçülmesi önerilmektedir. Tekrarlayan ölçümlerde IGF-1 düzeyleri, yaş ve puberte durumuna göre referanslarla karşılaştırıldığında, +2 SS'yı geçerse, normal sınırlarda bir IGF-1 düzeyi elde etmek için doz azaltılmalıdır.
SGA'lı doğmuş kısa boylu çocukların tedavisi boy uzaması tamamlanmadan sonlandırılırsa, büyüme hormonu tedavisi ile elde edilen boy kazanımlarının bir kısmı kaybedilebilir
Erişkinler
Erişkinlerde büyüme hormonu eksikliği
Erişkinlerde büyüme hormonu eksikliği hayat boyu süren bir hastalıktır ve buna göre tedavi edilmelidir. Ancak 60 yaşın üzerindeki hastalar ve beş yıldan uzun süre erişkin BHE tedavisi gören hastalar ile ilgili deneyimler hala sınırlıdır.
Erişkinler ve Çocuklar Pankreatit
Her ne kadar nadir görülüyor olsa da, somatropin ile tedavi edilen, karın ağrısı geliştiren hastalarda, özellikle çocuklarda pankreatit değerlendirilmelidir.
Genel Neoplaziler
Somatropin tedavisi gören yetişkinlerde veya çocuklarda yeni primer kanser riskinin arttığına dair bir kanıt yoktur. Tümörler veya malign hastalığı tamamen remisyonda olan hastalarda, somatropin tedavisi, relaps oranının artması ile ilişkili bulunmamıştır.
En sık olarak intrakraniyal neoplaziler olmak üzere çocukluk çağı kanserini yenmiş, büyüme hormonu tedavisi gören kişilerde ikincil neoplazilerde hafif bir artış gözlenmiştir. İkincil neoplaziler için baskın olan risk faktörü, öncesinde radyasyona maruz kalınmasıdır.
Malign hastalığı tamamen remisyonda olan hastalar relaps açısından somatropin tedavisinin başlangıcından itibaren yakından izlenmelidir.
Lösemi
Somatropin tedavisi gören büyüme hormonu eksikliği olan hastaların çok az bir kısmında lösemi gözlendiği bildirilmiştir. Ancak, somatropin tedavisi gören hastalarda predispozan faktörü olmayan lösemi gelişme riskinin arttığına dair bir kanıt yoktur.
Benign intrakraniyal hipertansiyon
Şiddetli veya tekrarlayıcı baş ağrısı, görme sorunları, bulantı ve/veya kusma gibi belirtilerin varlığında papil ödemi için fundoskopi önerilmektedir. Papil ödemi doğrulanırsa, tanıda benign intrakraniyal hipertansiyon düşünülmeli ve uygun görülürse, büyüme hormonu tedavisi sonlandırılmalıdır.
İntrakraniyal hipertansiyonu düzelmiş hastalarda klinik kararı yönlendirecek yeterli kanıt halen yoktur. Büyüme hormonu tedavisine yeniden başlandığında, intrakraniyal hipertansiyon bulgularının dikkatle takip edilmesi gereklidir.
İntrakraniyal bir lezyona sekonder olarak büyüme hormonu eksikliği olan hastalar, altta yatan hastalığın ilerlemesi veya nüks etmesi bakımından sık sık kontrol edilmelidir.
Tiroid fonksiyonu
Somatropin, tiroid dışında T4'ün T3'e dönüşümünü artırır, bu sayede başlangıç aşamasında olan hipotirodiyi ortaya çıkarabilir. Bu yüzden tüm hastalarda tiroid fonksiyonları izlenmelidir. Hipopitüer hastalığı olan hastalarda somatropin tedavisi sırasında standart replasman tedavisi yakından izlenmelidir.
İlerleyen hipofiz hastalığı olan hastalarda hipotiroidi gelişebilir.
Turner Sendrom'lu hastalarda anti-tiroid antikorlarının görüldüğü primer hipotiroidi gelişme riski artmıştır. Hipotiroidi somatropine yanıtı etkileyeceği için, hastalara düzenli aralıklarla tiroid fonksiyon testleri uygulanmalı ve endike olduğunda, tiroid hormonu ile replasman tedavisi uygulanmalıdır.
İnsülin duyarlılığı
Somatropin insülin duyarlılığını azalttığı için, hastalar glukoz intoleransı bulguları açısından gözlenmelidir (bakınız Bölüm 4.5). Diabetes mellituslu hastalarda, somatropin tedavisi başladıktan sonra insülin dozunu ayarlamak gerekebilir. Diyabeti olan veya glukoz intoleransı olan hastalar somatropin tedavisi boyunca yakından izlenmelidir.
Antikorlar
Somatropin içeren tüm ürünlerde olduğu gibi, hastaların çok küçük bir grubunda somatropine karşı antikorlar gelişebilir. Bu antikorların bağlanma kapasiteleri düşüktür, ve büyüme hızının üzerine bir etkileri yoktur. Tedaviye cevap vermeyen her hastada somatropine karşı antikor testi yapılmalıdır.
Akut adrenal yetmezlik
Somatropin tedavisinin başlatılması 11βHSD-1 inhibisyonuna ve serum kortizol konsantrasyonlarının düşmesine neden olabilir. Somatropin uygulanan hastalarda daha önce teşhis edilmemiş olan santral (sekonder) hipoadrenalizm aşikar hale gelebilir ve glukokortikoid replasmanı gerekli olabilir. Ek olarak, daha önce teşhis edilmiş hipoadrenalizme yönelik glukokortikoid replasmanı tedavisi gören hastalar somatropin tedavisinin başlatılmasının ardından idame veya stres dozlarında artış yapılmasına gereksinim duyabilir (bakınız Bölüm 4.5).
Oral östrojen tedavisiyle birlikte kullanım
Somatropin almakta olan bir kadın oral östrojen tedavisine başladığı takdirde serum IGF-1 düzeylerinin yaşa uygun normal aralık içinde tutulması için somatropin dozunun artırılması gerekebilir. Bunun aksine, somatropin almakta olan bir kadın oral östrojen tedavisini bıraktığı takdirde büyüme hormonu fazlalığının ve/veya yan etkilerin önlenmesi için somatropin dozunun azalması gerekebilir (bakınız Bölüm 4.5).
Kapital femoral epifizin kayması
Büyüme hormonu eksikliği dahil, endokrin bozuklukları olan hastalarda, kalçada epifiz kayması genel popülasyona göre daha sık görülebilir. Somatropinle tedavi edilen ve topallama ya da kalça veya diz ağrısı şikayeti geliştiren hastalar doktor kontrolünden geçmelidir.
Klinik çalışma deneyimi
Yoğun bakım ünitelerinde gerçekleştirilen iki adet plasebo kontrollü klinik çalışma, açık kalp veya abdominal cerrahi, kazaya bağlı çoklu travma veya akut solunum yetmezliğini izleyen komplikasyonlara bağlı akut kritik hastalık yakınması olan ve yüksek doz (5.3-8 mg/gün) somatropin uygulanan hastalarda mortalitenin arttığını göstermiştir. Onaylanmış endikasyonlar için replasman dozu alıp aynı zamanda bu hastalıkları geliştiren hastalarda, büyüme hormonu tedavisini sürdürmenin güvenliliği saptanmamıştır. Bu nedenle, akut kritik hastalıkları olanlarda büyüme hormonu tedavisini sürdürmenin potansiyel yararları ile olası riskleri değerlendirilmelidir.
Turner Sendromlu hastalarda gerçekleştirilen açık etiketli, randomize bir klinik çalışma (0.045-0.090 mg/kg/gün doz aralığı), doza bağlı otitis eksterna ve otitis media riskine eğilim olduğunu göstermiştir. Bu çalışmada, düşük doz grubuyla karşılaştırıldığında, kulak enfeksiyonlarındaki artış daha fazla kulak ameliyatı/tüp takılması ile sonuçlanmamıştır.
İzlenebilirlik
Biyolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına açıkça kaydedilmelidir.
Norditropin® her “1.5 mLâ€de 1 mmol (23 mg)'dan daha az sodyum ihtiva eder, yani aslında “sodyum içermezâ€.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Glukokortikoidlerle eşzamanlı tedavi, Norditropinin büyümeyi destekleyici etkisini inhibe eder. ACTH yetmezliği olan hastaların glukokortikoid replasman tedavisi, büyüme üzerine olası bir inhibitör etkiyi önleyecek şekilde dikkatle düzenlenmelidir.
Büyüme hormonu kortizonun kortizole dönüşümünü azaltır ve daha önce keşfedilmemiş olan santral hipoadrenalizmi belirgin hale getirebilir veya düşük glukokortikoid replasmanı dozlarını etkisiz hale getirebilir (bakınız Bölüm 4.4).
Oral östrojen replasmanı almakta olan kadınlarda tedavi hedefine erişilebilmesi için daha yüksek bir büyüme hormonu dozu gerekli olabilir (bakınız Bölüm 4.4).
Büyüme hormonu eksikliği olan erişkinlerle gerçekleştirilmiş olan bir etkileşim çalışmasından bildirilen veriler, somatropin uygulamasının, sitokrom P450 izoenzimleri tarafından metabolize edilen bileşiklerin klerensini artırabileceğini göstermiştir. Sitokrom P450 3A4 tarafından metabolize edilen bileşiklerin (örn. seks hormonları, kortikosteroidler, antikonvülzanlar ve siklosporin) klerensi özellikle artabilir, bunun sonucunda da bu bileşiklerin plazma düzeyleri düşer. Bu durumun klinik önemi bilinmemektedir.
Somatropin büyüme hormonunun ulaşılan boy üzerindeki etkisi de gonadotropin, anabolik steroidler, östrojen ve tiroit hormonu gibi diğer hormonlarla ilave tedaviden etkilenebilir.
İnsülin tedavisi almış hastalarda, somatropin tedavisi başlatıldıktan sonra insülin dozunun ayarlanması gerekli olabilir (bakınız Bölüm 4.4).
Pediyatrik Popülasyon:
Etkileşim çalışmaları yalnızca erişkinler için yapılmıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Somatropin içeren ürünler çocuk doğurma potansiyeli olan kontrasepsiyon kullanmayan kadınlarda önerilmemektedir.
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik veya embriyonal-fetal gelisim veya doğum veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bakınız Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Hamile kadınlar üzerinde klinik veri yoktur. Dolayısıyla, somatropin içeren ürünler hamilelik sırasında önerilmemektedir.
Laktasyon dönemi
Emziren kadınlarda somatropin içeren ürünlere ilişkin klinik çalışma yapılmamıştır. Somatropinin insan sütüne geçip geçmediği bilinmemektedir. Dolayısıyla, somatropin içeren ürünler emziren kadınlara verileceği zaman dikkat edilmelidir.
Üreme yeteneği/Fertilite
Norditropin® NordiFlex® ile fertilite çalışmaları yapılmamıştır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Norditropin® NordiFlex®‘in araç ve makine kullanımı üzerine etkisi yok veya ihmal edilebilir düzeydedir.
4.8. İstenmeyen etkiler
Büyüme hormonu eksikliği olan hastaların özelliklerinden biri, ekstraselüler sıvı eksikliğidir. Somatropin tedavisine başlandığında, bu eksiklik düzeltilir. Özellikle erişkinlerde periferik ödem şeklinde sıvı tutulması oluşabilir. Karpal tünel sendromu yaygın değildir ama erişkinlerde gözlenebilir. Semptomlar, genellikle geçici ve doza bağlıdır ve bir süre için doz azaltılması gerekebilir.
Hafif artralji, kas ağrısı ve paresteziler de oluşabilir ama genellikle sınırlıdır. Çocuklarda advers reaksiyonlar yaygın değildir ya da seyrektir.
Klinik çalışmalarda gözlenen istenmeyen etkiler ve sıklıkları aşağıda verilmektedir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1,000 ila <1/100); seyrek (≥1/10,000 ila <1/1,000); çok seyrek (<1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Metabolizma ve beslenme hastalıkları
Yaygın olmayan: Erişkinlerde tip 2 Diabetes mellitus
Sinir sistemi hastalıkları
Yaygın: Erişkinlerde baş ağrısı ve parestezi
Yaygın olmayan: Erişkinlerde karpal tünel sendromu. Çocuklarda baş ağrısı
Deri ve deri altı doku hastalıkları Yaygın olmayan: Erişkinlerde kaşıntı Seyrek: Çocuklarda döküntü
Kas-iskelet ve bağ doku hastalıkları
Yaygın: Erişkinlerde artralji, eklem sertliği ve miyalji Yaygın olmayan: Erişkinlerde kas sertliği
Seyrek: Çocuklarda artralji ve miyalji
Üreme sistemi ve meme hastalıkları
Yaygın olmayan: Erişkinlerde ve çocuklarda jinekomasti
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Erişkinlerde periferik ödem (yukarıdaki metne bakınız)
Yaygın olmayan: Çocuklarda ve erişkinlerde enjeksiyon yerinde ağrı. Çocuklarda enjeksiyon yeri reaksiyonları
Seyrek: Çocuklarda periferik ödem
Turner Sendromlu çocuklarda büyüme hormonu tedavisi sırasında el ve ayaklarda büyümenin arttığı bildirilmiştir.
Açık etiketli, randomize bir klinik çalışmada, yüksek doz Norditropin® ile tedavi edilen Turner sendromlu hastalarda otitis media sıklığında artış eğilimi olduğu gözlenmiştir. Ancak, çalışmada, düşük doz grubuyla karşılaştırıldığında, kulak enfeksiyonlarındaki artış daha fazla kulak ameliyatı/tüp takılması ile sonuçlanmamıştır.
Pazarlama sonrası deneyim:
Yukarıda belirtilen advers ilaç reaksiyonlarına ek olarak, aşağıdakiler spontan olarak bildirilmiş ve genel olarak Norditropin® tedavisiyle muhtemel ilişkili olarak değerlendirilmiştir. Bu advers etkilerin sıklıkları eldeki veriler ile tahmin edilemez.
İyi huylu ve kötü huylu neoplazmlar (kist ve polipler de dahil olmak üzere)
Büyüme hormonu eksikliği olan hastaların çok azında lösemi bildirilmiştir (bakınız Bölüm 4.4).
Bağışıklık sistemi hastalıkları
Aşırı duyarlılık reaksiyonları (bakınız Bölüm 4.3).
Somatropine karşı antikor oluşumu. Bu antikorların titreleri ve bağlanma kapasiteleri çok düşüktür ve büyüme hızının üzerine bir etkileri yoktur.
Endokrin hastalıkları
Hipotiroidi. Serum tiroksin düzeylerinde azalma (bakınız Bölüm 4.4).
Metabolizma ve beslenme hastalıkları
Hiperglisemi (bakınız Bölüm 4.4).
Sinir sistemi hastalıkları
Benign intrakraniyal hipertansiyon (bakınız Bölüm 4.4)
Kas-iskelet ve bağ doku hastalıkları
Legg-Calvé-Perthes. Kısa boylu hastalarda Legg-Calvé-Perthes daha sık görülebilir.
Araştırmalar
Kan alkalen fosfataz düzeyinde artış.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Akut doz aşımı, başlangıçta kan glukoz değerinde düşmeye ve daha sonra kan glukoz değerinde artışa neden olabilir. Glukoz düzeylerindeki bu düşüş, hipogliseminin klinik bulguları görülmeksizin, biyokimyasal olarak belirlenmektedir. Uzun süreli doz aşımı büyüme hormonu fazlalığının bilinen belirti ve bulgularıyla sonuçlanabilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Hipofiz ön lob hormonları ve analogları, somatropin ve somatropin agonistleri.
ATC kodu: H01AC01
Etki mekanizması
Norditropin® NordiFlex®, rekombinant DNA teknolojisiyle üretilmiş insan büyüme hormonu olan somatropin içerir. İki disülfür köprüsüyle stabil hale getirilmiş 191 amino asidin oluşturduğu, molekül ağırlığı yaklaşık 22.000 dalton olan anabolik bir peptiddir.
Somatropin'in temel etkisi, iskelet büyümesinin ve somatik büyümenin stimülasyonudur ve vücudun metabolik süreçlerine belirgin etkisi vardır.
Farmakodinamik etkiler
Büyüme hormonu eksikliği tedavi edildiğinde, vücut yapısında bir normalleşme meydana gelir, yağsız vücut kitlesinde artış ve yağ kitlesinde azalma olur.
Somatropin, etkisinin çoğunu insülin benzeri büyüme faktörü 1 (IGF-1) aracılığı ile gösterir. IGF-1, başta karaciğer olmak üzere vücudun bütün dokularında üretilir.
IGF-1'in % 90'dan fazlası, en önemlisi IGFBP-3 olan bağlayıcı proteinlere (IGFBP) bağlanır. Stres sırasında hormonun lipolitik ve protein koruyucu etkisi özellikle önemli hale gelir.
Somatropin, aynı zamanda, kemik döngüsünü artırır ve bu, biyokimyasal kemik belirteçlerinin plazma düzeylerinde artış şeklinde gözlenir. Erişkinlerde, daha belirgin kemik rezorpsiyonuna bağlı olarak, tedavinin başlangıcındaki ilk birkaç ayda kemik kitlesi hafifçe azalır, ancak tedavinin devam etmesi ile kemik kitlesi artar.
Klinik etkililik ve güvenlilik
SGA'lı doğmuş kısa boylu çocuklarda yapılan klinik çalışmalarda boy uzaması tamamlanıncaya kadar tedavi için 0.033 ve 0.067 mg/kg/gün dozları kullanılmıştır. Sürekli tedavi edilmiş ve boy uzaması hemen hemen tamamlanmış 56 hastada, tedavinin başlangıcına göre ortalama boy değişikliği +1.90 SSS (0.033 mg/kg/gün) ve +2.19 SSS (0.067 mg/kg/gün) bulunmuştur. Erken spontan büyüme hızını yakalayamamış, tedavi edilmemiş SGA'lı çocuklarla ilgili literatür verileri 0.5 SSS'lık bir geç büyümeyi akla getirmektedir. Uzun süreli güvenlilik verileri hala sınırlıdır.
Noonan sendromuna bağlı boy kısalığı olan 3 ila <11 yaşındaki 51 çocukta 104 hafta (primer sonlanım noktası) ve 208 hafta boyunca günde bir kez 0.033 mg/kg/gün ve 0.066 mg/kg/gün Norditropin tedavisi uygulandıktan sonra, büyümeyi artırıcı bir etki görülmüştür.
0.033 mg/kg/gün (0.84 SSS) ve 0.066 mg/kg/gün (1.47 SSS) dozlarında 104. haftada (primer sonlanım noktası) ortalama boy SSS değerinde başlangıca göre istatistiksel açıdan anlamlı bir artış görülmüştür. 104. haftada gruplar arasında ortalama 0.63 SSS [%95 GA: 0.38, 0.88] fark gözlemlenmiştir; fark 208 haftadan sonra daha büyüktür ve ortalama fark 0.99 SSS'dir [%95 GA: 0.62; 1.36] (Şekil 1).
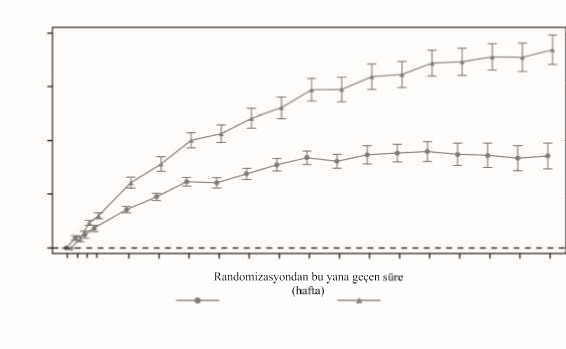
Şekil 1 Başlangıçtan 208 haftaya kadar boy SSS (ulusal) değişimi
Tedavinin ilk yılında ortalama boy hızı ve boy hızı SSS değeri başlangıca göre belirgin biçimde artmıştır ve 0.066 mg/kg/gün dozunda 0.033 mg/kg/gün dozuna göre daha büyük bir artış olmuştur. Ortalama boy hızı SSS değeri iki yıllık tedaviden sonra her iki grupta ve ayrıca
0.066 mg/kg/gün grubunda dört yıllık tedaviden sonra 0'ın üzerinde devam etmiştir. Çalışma dönemi boyunca boy hızı SSS değeri 0.066 mg/kg/gün dozunda 0.033 mg/kg/gün dozuna göre daha büyüktür (Şekil 2).
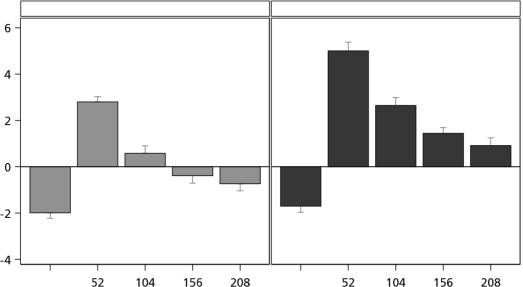
Başlangıç
Başlangıç
Boy Hızı SSS
Şekil 2 Başlangıçtan 208 haftaya kadar boy hızı SSS (ulusal)
24 pediyatrik hastada (18'i iki yıllık ileriye dönük, açık etiketli, randomize, paralel gruplu çalışmaya dahil olmuş, altısı protokolü randomizasyonsuz izlemiştir) final boy verileri toplanmıştır. İlk iki yıllık ileriye dönük çalışmadan sonra, Norditropin tedavisi final boya kadar devam etmiştir. Tedavinin sonunda, hastların çoğunluğu (16/24) normal ulusal referans aralığı dahilinde (> 2 SSS) bir final boya ulaşmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerFarklı dozlardaki Norditropin® NordiFlex®'in sağlıklı kişilere cilt altına enjeksiyonundan sonra, rekonstitüye Norditropin®'e ve birbirlerine biyoeşdeğer oldukları gösterilmiştir.
Emilim:
Norditropin® NordiFlex®'in (endojen somatropinleri sürekli somatostatin infüzyonu ile baskılanmış) 31 sağlıklı kişiye 2.5 mg/m2 cilt altı enjeksiyonundan yaklaşık 4 saat sonra 42-46 nanogram/mL'lik maksimum büyüme hormonu konsantrasyonu sağlanmıştır.
Dağılım:
Büyüme hormonu eksikliği olan dokuz hastaya 3 saat süreyle 33 nanogram/kg/dak. i.v. Norditropin® infüzyonunu takiben dağılım hacmi 67.6 ± 14.6 mL/kg olarak saptanmıştır.
Biyotransformasyon:
Norditropin® NordiFlex®'in amino asit zinciri 22kDa insan somatropinine benzerdir. Norditropin® NordiFlex®'in degradasyonunun (bozunma) insan somatropininin degradasyonu (bozunması) ile benzer olması beklenmektedir.
Eliminasyon:
Büyüme hormonu eksikliği olan dokuz hastaya 3 saat süreyle 33 nanogram/kg/dak. i.v. Norditropin® infüzyonu sonrasında serum yarılanma ömrü 21.1 ± 1.7 dakika ve metabolik klerens hızı dakikada 2.33 ± 0.58 mL/kg bulunmuştur.
Norditropin® NordiFlex®'in (endojen somatropinleri sürekli somatostatin infüzyonu ile baskılanmış) 31 sağlıklı kişiye 2.5 mg/m2 cilt altı enjeksiyonundan sonra insan büyüme hormonu yaklaşık 2.6 saatlik bir yarılanma ömrü ile azalmıştır.
Doğrusallık/Doğrusal olmayan durum:
Farmakokinetik doz orantılılığı çalışması yürütülmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuşun degradasyon yapılmış veya yapılmamış şekilde uygulanmasından sonra merkezi sinir sistemi, kardiyovasküler sistem ve solunum sistemi üzerindeki genel farmakolojik etkileri fare ve sıçanlarda araştırılmıştır; böbrek fonksiyonları da değerlendirilmiştir. Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş(sıvı formülasyon) ve Norditropin® (dondurularak-kurutulmuş) ile karşılaştırıldığında degrade olmuş (bozunmuş) ürünün etkisinde herhangi bir farklılık görülmemiştir. Her üç ürün de, idrar hacminde, beklenen doza bağlı azalma ve sodyum ve klorür iyonlarında retansiyon göstermiştir.
Sıçanlarda, Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş ile Norditropin®'in farmakokinetik özelliklerinin benzer olduğu gösterilmiştir. Degrade olmuş (bozunmuş) Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuşun da, Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuşile biyoeşdeğer olduğu gözlenmiştir.
Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş veya degrade olmuş (bozunmuş) ürünün tek dozda veya tekrarlanan dozlarda toksisite ve lokal tolerans çalışmalarında herhangi bir toksik etki veya kas dokusunda herhangi bir hasar görülmemiştir.
Poloksamer 188'in toksisitesi fare, sıçan, tavşan ve köpeklerde araştırılmış ve toksikolojik herhangi bir bulgu elde edilmemiştir.
Poloksamer 188, enjeksiyon bölgesinde belirgin bir birikim olmaksızın enjeksiyon bölgesinden hızla emilmiştir. Poloksamer 188 başlıca idrar ile atılmıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mannitol Histidin
Poloksamer 188 Fenol Enjeksiyonluk su
Hidroklorik asit (pH ayarlayıcı) Sodyum hidroksit (pH ayarlayıcı)
6.2. Geçimsizlikler
Geçimsizlik çalışmalarının olmamasından dolayı, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay.
Açıldıktan sonra: Buzdolabında (2°C-8°C) maksimum 4 hafta saklayınız. Ürün, alternatif olarak, 25°C'nin altında maksimum 3 hafta saklanabilir.
6.4. Saklamaya yönelik özel tedbirler
Kullanmaya başlamadan önce: Işıktan korumak için, buzdolabında (2°C-8°C) dış kartonu içinde saklayınız. Dondurmayınız.
Herhangi bir soğutma elemanının yakınında saklamayınız.
İlk açıldıktan sonra ürün saklama koşulları için gerekli bilgi Bölüm 6.3'te yer almaktadır. Dondurmayınız.
Kullanım sırasında, her enjeksiyondan sonra daima Norditropin® NordiFlex® kullanıma hazır kalemin üzerindeki kalem kapağını değiştiriniz. Her enjeksiyon için yeni bir iğne kullanınız.
Kullanmaya başlamadan önce iğne kullanıma hazır kalem üzerine takılmamalıdır.
6.5. Ambalajın niteliği ve içeriği
![]()
Norditropin® NordiFlex® 10 mg/1.5 mL plastik kalem enjektöre sabit bir şekilde oturtulan kartuştan (Tip I renksiz cam) oluşan çok dozlu tek kullanımlık kullanıma hazır kalemdir. Kartuşun alt kısmı piston şeklinde kauçuk bir tıpa (Tip 1 kauçuk kapak) ve üst kısmı da alüminyum kapak ile contalanmış disk şeklinde ince kauçuk tıpa (Tip 1 kauçuk kapak) ile kapatılmıştır. Kalem enjektör üzerindeki basma düğmesi mavi renktedir. 1 kullanıma hazır kalemlik ambalaj ve çoklu paketten (5 ve 10x1 kullanıma hazır kalem içeren) oluşan ambalaj boyutları bulunmaktadır. Tüm ambalaj boyutları pazarda bulunmayabilir.
Kullanıma hazır kalem karton içerisinde paketlenmiştir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği†gereklerine uygun olarak imha edilmelidir.
Norditropin® NordiFlex® 8 mm'ye kadar uzunluktaki NovoFine® veya NovoTwist® tek kullanımlık iğneler ile kullanılacak şekilde tasarlanmış kullanıma hazır kalemdir.
Norditropin® NordiFlex® 10 mg/1.5 mL 0.050 mg somatropin artışlarıyla doz başına maksimum 3.0 mg somatropin sağlar.
Uygun dozajı sağlamak ve hava enjeksiyonunu engellemek için, ilk enjeksiyondan önce büyüme hormonu akışı kontrol edilmelidir. İğne ucunda büyüme hormonu damlası görünmüyorsa, Norditropin® NordiFlex®'i kullanmayınız. Dozu, doz seçiciyi istenen doz gözetleme penceresinde görünene kadar çevirerek seçiniz. Eğer yanlış dozu seçerseniz, doz seçiciyi ters yönde çevirerek dozu düzeltebilirsiniz. Doz enjekte etmek için basma düğmesine basınız.
Norditropin® NordiFlex® hiçbir zaman şiddetle çalkalanmamalıdır.
Norditropin® NordiFlex® enjeksiyonluk büyüme hormonu çözeltisi rengi değişmiş veya bulanık ise kullanmayınız. Kalemi bir veya iki kez ters çevirerek kontrol ediniz.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| HUMATROPE | 8699673795102 | 2,399.53TL |
| NORDITROPIN | 8699676790180 | |
| OMNITROPE | 8699516953836 | 3,805.62TL |
| PITAMIN | 8697930022411 | |
| SAIZEN | 8699808794062 | 4,209.37TL |
| Diğer Eşdeğer İlaçlar |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ GENEL BİLGİLERİ
Novo Nordisk Sağlık Ürünleri Tic. Ltd. Şti.
| Geri Ödeme Kodu | A05496 |
| Satış Fiyatı | 5048.02 TL [ 2 May 2025 ] |
| Önceki Satış Fiyatı | 5048.02 TL [ 25 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699676950232 |
| Etkin Madde | Somatropin |
| ATC Kodu | H01AC01 |
| Birim Miktar | 10 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Endokrin Sistem > Ön Hipofiz Hormonları ve Analogları > Somatropin |
| İthal ( ref. ülke : Portekiz ) ve Beşeri bir ilaçdır. |