NORDITROPIN SIMPLEX 15 mg /1.5 ml 1 penfil kartuş Farmakolojik Özellikler
{ Somatropin }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Hipofiz ön lob hormonları ve analogları, somatropin ve somatropin agonistleri.
ATC kodu: H01AC01
Etki mekanizması
Norditropin® NordiFlex®, rekombinant DNA teknolojisiyle üretilmiş insan büyüme hormonu olan somatropin içerir. İki disülfür köprüsüyle stabil hale getirilmiş 191 amino asidin oluşturduğu, molekül ağırlığı yaklaşık 22.000 dalton olan anabolik bir peptiddir.
Somatropin'in temel etkisi, iskelet büyümesinin ve somatik büyümenin stimülasyonudur ve vücudun metabolik süreçlerine belirgin etkisi vardır.
Farmakodinamik etkiler
Büyüme hormonu eksikliği tedavi edildiğinde, vücut yapısında bir normalleşme meydana gelir, yağsız vücut kitlesinde artış ve yağ kitlesinde azalma olur.
Somatropin, etkisinin çoğunu insülin benzeri büyüme faktörü 1 (IGF-1) aracılığı ile gösterir. IGF-1, başta karaciğer olmak üzere vücudun bütün dokularında üretilir.
IGF-1'in % 90'dan fazlası, en önemlisi IGFBP-3 olan bağlayıcı proteinlere (IGFBP) bağlanır. Stres sırasında hormonun lipolitik ve protein koruyucu etkisi özellikle önemli hale gelir.
Somatropin, aynı zamanda, kemik döngüsünü artırır ve bu, biyokimyasal kemik belirteçlerinin plazma düzeylerinde artış şeklinde gözlenir. Erişkinlerde, daha belirgin kemik rezorpsiyonuna bağlı olarak, tedavinin başlangıcındaki ilk birkaç ayda kemik kitlesi hafifçe azalır, ancak tedavinin devam etmesi ile kemik kitlesi artar.
Klinik etkililik ve güvenlilik
SGA'lı doğmuş kısa boylu çocuklarda yapılan klinik çalışmalarda boy uzaması tamamlanıncaya kadar tedavi için 0.033 ve 0.067 mg/kg/gün dozları kullanılmıştır. Sürekli tedavi edilmiş ve boy uzaması hemen hemen tamamlanmış 56 hastada, tedavinin başlangıcına göre ortalama boy değişikliği +1.90 SSS (0.033 mg/kg/gün) ve +2.19 SSS (0.067 mg/kg/gün) bulunmuştur. Erken spontan büyüme hızını yakalayamamış, tedavi edilmemiş SGA'lı çocuklarla ilgili literatür verileri 0.5 SSS'lık bir geç büyümeyi akla getirmektedir. Uzun süreli güvenlilik verileri hala sınırlıdır.
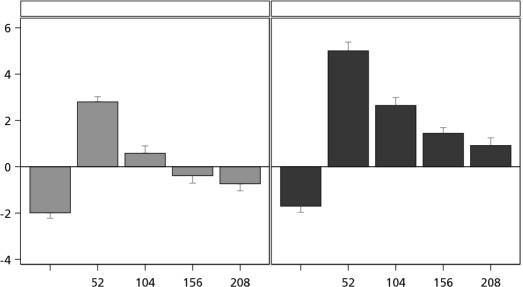
Noonan sendromuna bağlı boy kısalığı olan 3 ila <11 yaşındaki 51 çocukta 104 hafta (primer sonlanım noktası) ve 208 hafta boyunca günde bir kez 0.033 mg/kg/gün ve 0.066 mg/kg/gün Norditropin tedavisi uygulandıktan sonra, büyümeyi artırıcı bir etki görülmüştür.
0.033 mg/kg/gün (0.84 SSS) ve 0.066 mg/kg/gün (1.47 SSS) dozlarında 104. haftada (primer sonlanım noktası) ortalama boy SSS değerinde başlangıca göre istatistiksel açıdan anlamlı bir artış görülmüştür. 104. haftada gruplar arasında ortalama 0.63 SSS [%95 GA: 0.38, 0.88] fark gözlemlenmiştir; fark 208 haftadan sonra daha büyüktür ve ortalama fark 0.99 SSS'dir [%95 GA: 0.62; 1.36] (Şekil 1).

Şekil 1 Başlangıçtan 208 haftaya kadar boy SSS (ulusal) değişimi
Tedavinin ilk yılında ortalama boy hızı ve boy hızı SSS değeri başlangıca göre belirgin biçimde artmıştır ve 0.066 mg/kg/gün dozunda 0.033 mg/kg/gün dozuna göre daha büyük bir artış olmuştur. Ortalama boy hızı SSS değeri iki yıllık tedaviden sonra her iki grupta ve ayrıca
0.066 mg/kg/gün grubunda dört yıllık tedaviden sonra 0'ın üzerinde devam etmiştir. Çalışma dönemi boyunca boy hızı SSS değeri 0.066 mg/kg/gün dozunda 0.033 mg/kg/gün dozuna göre daha büyüktür (Şekil 2).
Başlangıç
Başlangıç
Boy Hızı SSS
Şekil 2 Başlangıçtan 208 haftaya kadar boy hızı SSS (ulusal)
24 pediyatrik hastada (18'i iki yıllık ileriye dönük, açık etiketli, randomize, paralel gruplu çalışmaya dahil olmuş, altısı protokolü randomizasyonsuz izlemiştir) final boy verileri toplanmıştır. İlk iki yıllık ileriye dönük çalışmadan sonra, Norditropin tedavisi final boya kadar devam etmiştir. Tedavinin sonunda, hastların çoğunluğu (16/24) normal ulusal referans aralığı dahilinde (> 2 SSS) bir final boya ulaşmıştır.
5.2. Farmakokinetik özellikler
Genel özelliklerFarklı dozlardaki Norditropin® NordiFlex®'in sağlıklı kişilere cilt altına enjeksiyonundan sonra, rekonstitüye Norditropin®'e ve birbirlerine biyoeşdeğer oldukları gösterilmiştir.
Emilim:
Norditropin® NordiFlex®'in (endojen somatropinleri sürekli somatostatin infüzyonu ile baskılanmış) 31 sağlıklı kişiye 2.5 mg/m2 cilt altı enjeksiyonundan yaklaşık 4 saat sonra 42-46 nanogram/mL'lik maksimum büyüme hormonu konsantrasyonu sağlanmıştır.
Dağılım:
Büyüme hormonu eksikliği olan dokuz hastaya 3 saat süreyle 33 nanogram/kg/dak. i.v. Norditropin® infüzyonunu takiben dağılım hacmi 67.6 ± 14.6 mL/kg olarak saptanmıştır.
Biyotransformasyon:
Norditropin® NordiFlex®'in amino asit zinciri 22kDa insan somatropinine benzerdir. Norditropin® NordiFlex®'in degradasyonunun (bozunma) insan somatropininin degradasyonu (bozunması) ile benzer olması beklenmektedir.
Eliminasyon:
Büyüme hormonu eksikliği olan dokuz hastaya 3 saat süreyle 33 nanogram/kg/dak. i.v. Norditropin® infüzyonu sonrasında serum yarılanma ömrü 21.1 ± 1.7 dakika ve metabolik klerens hızı dakikada 2.33 ± 0.58 mL/kg bulunmuştur.
Norditropin® NordiFlex®'in (endojen somatropinleri sürekli somatostatin infüzyonu ile baskılanmış) 31 sağlıklı kişiye 2.5 mg/m2 cilt altı enjeksiyonundan sonra insan büyüme hormonu yaklaşık 2.6 saatlik bir yarılanma ömrü ile azalmıştır.
Doğrusallık/Doğrusal olmayan durum:
Hiçbir farmakokinetik doz orantılılığı çalışması yürütülmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuşun degradasyon yapılmış veya yapılmamış şekilde uygulanmasından sonra merkezi sinir sistemi, kardiyovasküler sistem ve solunum sistemi üzerindeki genel farmakolojik etkileri fare ve sıçanlarda araştırılmıştır; böbrek fonksiyonları da değerlendirilmiştir., Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş (sıvı formülasyon) ve Norditropin® (dondurularak- kurutulmuş) ile karşılaştırıldığında degrade olmuş (bozunmuş) ürünün etkisinde herhangi bir farklılık görülmemiştir. Her üç ürün de, idrar hacminde, beklenen, doza bağımlı azalma ve sodyum ve klorür iyonlarında retansiyon göstermiştir.
Sıçanlarda, Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş ile Norditropin®'in farmakokinetik özelliklerinin benzer olduğu gösterilmiştir. Degrade olmuş (bozunmuş) Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuşun da, Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş ile biyoeşdeğer olduğu gözlenmiştir.
Norditropin® NordiFlex® içindeki enjeksiyonluk çözelti içeren kartuş veya degrade olmuş (bozunmuş) ürünün tek dozda veya tekrarlanan dozlarda toksisite ve lokal tolerans çalışmalarında herhangi bir toksik etki veya kas dokusunda herhangi bir hasar görülmemiştir.
Poloksamer 188'in toksisitesi fare, sıçan, tavşan ve köpeklerde araştırılmış ve toksikolojik herhangi bir bulgu elde edilmemiştir.
Poloksamer 188, enjeksiyon bölgesinde belirgin bir birikim olmaksızın enjeksiyon bölgesinden hızla emilmiştir. Poloksamer 188 başlıca idrar ile atılmıştır.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Novo Nordisk Sağlık Ürünleri Tic. Ltd. Şti.
| Geri Ödeme Kodu | A05497 |
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699676950645 |
| Etkin Madde | Somatropin |
| ATC Kodu | H01AC01 |
| Birim Miktar | 15 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Endokrin Sistem > Ön Hipofiz Hormonları ve Analogları > Somatropin |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |