NOVALGIN 500 mg tablet (20 tablet) { Opella } Kısa Ürün Bilgisi
{ Metamizol Sodyum }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
NOVALGİN® 500 mg tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Metamizol sodyum 500 mg
Yardımcı maddeler
Laktoz (sığır sütü kaynaklı) 43 mg
Sodyum bikarbonat 5,00 mg
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Tablet
Yuvarlak, hemen hemen beyaz, bir yüzü Novalgin baskılı, eşit yarımlara bölünebilmesi için her iki yüzü kırma çentikli tablet.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Yaralanma veya cerrahi sonrası akut şiddetli ağrı
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiDoz ağrının veya ateşin şiddetine ve hastanın NOVALGİN®'e reaksiyon hassasiyetine bağlıdır. Öncelikli olarak ağrıyı ve ateşi kontrol edebilecek en düşük etkili doz tercih edilmelidir.
Yetişkinler ve 15 yaş veya üzerindeki adolesanlar (> 53 kg) tek doz olarak 1.000 mg'a kadar metamizol alabilmekte olup doz, günde maksimum 4.000 mg olacak şekilde 6-8 saat arayla günde 4 defaya kadar alınabilir.
Oral kullanımı takiben 30 ila 60 dakikada belirgin bir etki beklenebilir.
Aşağıdaki tabloda yaşa ve ağırlığa göre tek doz ve günlük maksimum doz önerileri sunulmaktadır:
Vücut ağırlığı / Yaş | Tek doz | Maksimum günlük doz | |||
kg | yaş | tablet | mg | tablet | mg |
> 53 kg | > 15 yaş | 1-2 | 500-1.000 | 8 | 4.000 |
Uygulamanın süresi rahatsızlığın yapısına ve şiddetine bağlıdır. NOVALGİN® ile uzun süreli tedavi sırasında, diferansiyel kan sayımı da dahil olmak üzere düzenli kan sayımları gerçekleştirilmelidir.
Uygulama şekli
Ağızdan alınır.
Tabletler bol sıvıyla (örn. bir bardak su) çiğnenmeden yutulmalıdır.
NOVALGİN®'in farklı farmasötik formları mevcuttur. Uygulama yolu seçimi, istenilen terapötik etkiye ve hastanın durumuna bağlıdır. Çoğu vakada tatmin edici bir etki elde etmek için oral uygulama yeterlidir. Hızlı analjezik etki gerektiğinde ya da oral veya rektal uygulamanın endike olmadığı durumlarda intravenöz veya intramüsküler uygulama tavsiye edilir. Oral kullanımı takiben 30 ila 60 dakikada ve parenteral uygulamayı takiben yaklaşık 30 dakikada belirgin bir etki beklenebilir. Uygulama yolu tercih edilirken, ilacın parenteral uygulamasının anafilaktik veya anafilaktoid reaksiyonlarda risk artışı ile ilişkili olduğu dikkate alınmalıdır.
Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği:
Böbrek ya da karaciğer bozukluğu olan hastalarda, metamizolün eliminasyon hızı azaldığı için tekrarlanan yüksek dozlardan kaçınılmalıdır. Yalnızca, kısa süreli tedavi için dozun azaltılması gerekmez. Şiddetli böbrek ya da karaciğer yetmezliği olan hastalarda uzun dönemli tedavi ile ilgili olarak kazanılmış yeterli deneyim mevcut değildir.
Pediyatrik popülasyon:
Bir tablette 500 mg'lık sabit miktarda metamizol bulunduğundan NOVALGİN® film kaplı tabletin 15 yaşından küçük çocuklarda kullanılması önerilmez. Küçük çocuklarda kullanımı uygun başka farmasötik formları mevcuttur.
Geriyatrik popülasyon:
Metamizolün metabolik ürünlerinin eliminasyonunda gecikme olabileceğinden yaşlı hastalarda doz azaltılmalıdır.
Genel sağlık durumu bozuk olan ve kreatinin klirensi düşük olan hastalar:
Metamizolün metabolik ürünlerinin eliminasyonunda gecikme olabileceğinden genel sağlık
durumu bozuk olan hastalarda ve kreatinin klerensi düşük hastalarda doz azaltılmalıdır.
4.3. Kontrendikasyonlar
Metamizol ya da diğer pirazolonlara veya pirazolidinlere karşı alerji (aşırı duyarlılık), örn. bu maddelerden birine karşı önceden gelişen agranülositoz veya şiddetli cilt reaksiyonları (Bkz. Bölüm 4.4 ve Bölüm 4.8)
NOVALGİN®'in bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı alerji
Bozulmuş kemik iliği fonksiyonu (örn. sitostatik tedavi sonucu oluşan) ya da hematopoietik sistem hastalıkları
Bilinen analjezik astım sendromu olan veya bilinen ürtiker-anjiyoödem analjezik intoleransı olan hastalar (salisilatlar, parasetamol veya diklofenak, ibuprofen, indometazin, naproksen gibi diğer narkotik olmayan analjeziklere karşı bronkospazm ya da diğer anafilaktoid reaksiyonlar (örn. ürtiker, rinit, anjiyoödem) gelişen hastalar
Akut intermitan hepatik porfiria (porfiria ataklarının indüksiyon riski)
Konjenital glukoz -6- fosfat dehidrogenaz eksikliği (hemoliz riski)
Gebeliğin üçüncü trimesteri (Bkz. Bölüm 4.6)
Laktasyon (Bkz. Bölüm 4.6)
4.4. Özel kullanım uyarıları ve önlemleri
NOVALGİN® pirazolon türevi olan metamizol içerir ve nadir ancak yaşamı tehdit edici olabilen şok ve agranülositoz riski taşır (Bkz. Bölüm 4.8).
NOVALGİN®'e karşı anafilaktoid reaksiyon gösteren hastalar, diğer narkotik olmayan analjeziklere karşı da aynı reaksiyonu gösterecek şekilde özellikle risk altındadırlar.
NOVALGİN®'e karşı anafilaktik veya immünolojik kaynaklı reaksiyon gösteren hastalar (örneğin agranülositoz), diğer pirazolonlar ve pirazolidinlere karşı da aynı reaksiyonu gösterecek şekilde özellikle risk altındadırlar.
Diğer pirazolonlara, pirazolidinlere ve diğer narkotik olmayan analjeziklere anafilaktik veya başka bir immünolojik reaksiyon gösteren hastalarda, NOVALGİN®'e de benzer şekilde reaksiyon gösterme riski yüksektir.
Agranülositoz:
Nötropeni (< 1.500 nötrofil/mm3) söz konusu olduğunda, tedavi derhal kesilmeli ve tam kan sayımı acil olarak kontrol edilmeli ve normal değerlere dönünceye kadar izlenmelidir.
Tüm hastalara, aşağıdaki belirtilerden veya semptomlardan herhangi biri ortaya çıkarsa ilacı kesmeleri ve derhal doktorlarına danışmaları tavsiye edilmelidir: genel durumda beklenmedik bir bozulma (ateş, titreme, boğaz ağrısı, yutma güçlüğü gibi), kalıcı veya yeni ortaya çıkan
ateş ve özellikle ağız, burun ve boğaz bölgesinde veya genital veya anal bölgede ağrılı mukoza değişikliklerinde NOVALGİN® kullanımı derhal kesilmeli ve kan sayımı izlenmelidir (diferansiyel kan sayımı dahil). Laboratuvar testlerinin sonuçları beklenmeden tedavi kesilmelidir (bkz. Bölüm 4.8).
Trombositopeni:
Deride ve mukoz membranlarda artan kanama eğilimi ve peteşi gibi trombositopeni belirtileri (bkz. bölüm 4.8) görülürse, NOVALGİN® kullanımı derhal durdurulmalı ve kan sayımı izlenmelidir (diferansiyel kan sayımı dahil). Tedavi laboratuvar testlerinin sonuçlarını beklemeksizin durdurulmalıdır.
Pansitopeni:
Pansitopeni ortaya çıkması halinde tedavi hemen kesilmeli ve kan değerleri normale dönene
kadar tam kan sayımı ile takip yapılmalıdır (bkz. Bölüm 4.8).
Bütün hastalar, metamizol kullanımı sırasında kan diskrazisinin göstergesi olabilecek belirti ve semptomların (örn. genel kırıklık, enfeksiyon, düşmeyen ateş, çürükler, kanama, solukluk) görülmesi halinde hemen doktora başvurmaları konusunda uyarılmalıdır.
Şiddetli deri reaksiyonları:
Metamizol kullanımı sırasında Stevens-Johnson Sendromu (SJS) ve Toksik Epidermal Nekroliz (TEN)), eozinofili ve sistemik semptomlarla ilaç etkileşimi (DRESS) dahil olmak üzere yaşamı tehdit eden veya ölümcül deri reaksiyonları bildirilmiştir. Belirti veya semptomların gelişmesi halinde metamizol tedavisi hemen kesilmeli ve bir daha hiçbir zaman yeniden uygulanmamalıdır (bkz.Bölüm 4.3). Hastalar belirti ve bulgular konusunda bilgilendirilmeli ve özellikle tedavinin ilk haftalarında deri reaksiyonları yönünden sıkı takibe alınmalıdır.
Anafilaktik / anafilaktoid reaksiyonlar:
Uygulama yolu seçilirken parenteral uygulamanın anafilaktik/anafilaktoid reaksiyonlar açısından daha yüksek bir risk taşıdığı göz önüne alınmalıdır.
Özellikle aşağıdaki hastalar metamizole karşı olası şiddetli anafilaktoid reaksiyonlar açısından özel bir risk altındadırlar:
Analjezik astım sendromu veya ürtiker-anjiyoödem tipte analjezik intoleransı olan hastalar
(Bkz. Bölüm 4.3),
Bronşiyal astımı olan hastalar; özellikle de aynı anda rinosinüzit ve nazal polipleri olanlar
Kronik ürtikeri olan hastalar
Boyalara (örn. tartrazin) veya koruyucu maddelere (örn. benzoatlar) karşı intoleransı olan hastalar
Alkol intoleransı olan hastalar; yani, belli alkollü içeceklerin az bir miktarına dahi burun
akıntısı, lakrimasyon ve belirgin yüz kızarıklığı gibi semptomlarla reaksiyon veren hastalar.
Alkol intoleransı önceden tanı konmamış analjezik astım sendromunun göstergesi olabilir (Bkz. Bölüm 4.3).
Anafilaktik şok esas olarak duyarlı hastalarda ortaya çıkmaktadır. Bu nedenle, astımlı ya da atopik hastalarda metamizol kullanımı özel dikkat altında uygulanmalıdır.
NOVALGİN® uygulanmadan önce hastalar dikkatlice sorgulanmalıdır. Anafilaktoid reaksiyonlar açısından özel risk altında olduğu saptanan hastalarda, NOVALGİN® olası riskler ve beklenen yarar dikkatlice değerlendirildikten sonra uygulanmalıdır Bu koşullar altında NOVALGİN® kullanılacaksa sıkı bir tıbbi gözetim gerekir ve acil tedavi uygulaması için gerekli koşullar hazır olmalıdır.
İlaca bağlı karaciğer hasarı (DILI)
Metamizol ile tedavi edilen hastalarda, tedavinin başlangıcından birkaç gün ila birkaç ay sonra başlayan, ağırlıklı olarak hepatoselüler paternli akut hepatit vakaları bildirilmiştir. Belirti ve semptomlar, sıklıkla diğer ilaç aşırı duyarlılık reaksiyonları (örn. deri döküntüsü, kan diskrazileri, ateş ve eozinofili) bağlamında veya otoimmün hepatit özelliklerinin eşlik ettiği sarılık ile birlikte veya sarılık olmaksızın serum karaciğer enzimlerinde yükselmeyi içermektedir. Çoğu hasta metamizol tedavisinin kesilmesiyle iyileşmiştir; bununla birlikte, bazı izole vakalarda, karaciğer transplantasyonu gerektiren akut karaciğer yetmezliğine gidiş bildirilmiştir.
Metamizolün neden olduğu karaciğer hasarının mekanizması net olarak açıklanamamıştır, ancak veriler immüno-alerjik bir mekanizmaya işaret etmektedir.
Hastalar, karaciğer hasarını düşündüren semptomların ortaya çıkması durumunda doktorlarına başvurmaları konusunda bilgilendirilmelidir. Bu tür hastalarda metamizol kesilmeli ve karaciğer fonksiyonu değerlendirilmelidir.
Metamizol tedavisi sırasında karaciğer hasarının başka bir nedeninin belirlenmediği karaciğer hasarı epizodu olan hastalarda metamizol yeniden uygulanmamalıdır.
İzole hipotansif reaksiyonlar
Metamizol uygulaması hipotansif reaksiyonlara neden olabilir (bkz. bölüm 4.8). Bu reaksiyonlar muhtemelen doza bağımlıdır ve daha çok parenteral uygulamadan sonra ortaya çıkma eğilimindedir. Aşağıda belirtilen durumlarda da bu tür şiddetli hipotansif reaksiyonlarıngörülme riski artmaktadır:
İntravenöz enjeksiyonun çok hızlı uygulanması (Bkz. Bölüm 4.2),
Önceden mevcut hipotansiyonu olan; volüm kaybı veya dehidratasyonu olan hastalarla, dolaşım stabil olmadığı ya da başlangıç halinde dolaşım yetmezliği olan hastalar (örn. miyokard enfarktüsü veya çoklu yaralanması olan hastalar),
Yüksek ateşi olan hastalar.
Bu tür hastalarda metamizol endikasyonu özel bir hassasiyetle belirlenmelidir; eğer bu koşullar altında NOVALGİN® uygulanacaksa, sıkı bir medikal gözetim gerekir. Hipotansif reaksiyon riskini azaltmak için koruyucu önlemler (örn. dolaşım stabilizasyonu) gerekli olabilir.
Metamizol, şiddetli koroner kalp hastalığı ya da beyni besleyen kan damarları stenozları olan hastalar gibi, kan basıncının düşürülmesinden muhakkak kaçınılması gereken hastalarda yalnızca yakından hemodinamik izleme altında kullanılmalıdır.
NOVALGİN® böbrek ya da karaciğer bozukluğu olan hastalarda, yalnızca ciddi bir fayda-risk analizi yapıldıktan sonra ve gerekli önleyici tedbirler alınarak kullanılmalıdır (Bkz. Bölüm 4.2).
Bu tıbbi ürün 1 tablet içerisinde 1,42 mmol (32,7 mg) sodyum içerir. Bu, Dünya Sağlık Örgütü (DSÖ) tarafından bir yetişkin için önerilen günlük maksimum 2 g'lık sodyum alımının yaklaşık % 1,6'sına eşdeğerdir. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Metabolize edici enzimlerin farmakokinetik indüksiyonu
Metamizol, CYP2B6 ve CYP3A4 dahil olmak üzere metabolize edici enzimleri
indükleyebilir.
Metamizolün bupropion, efavirenz, metadon, valproat, siklosporin, takrolimus veya sertralin ile birlikte uygulanması, bu ilaçların plazma konsantrasyonlarında azalmaya ve klinik etkinlikte potansiyel bir azalmaya neden olabilir. Bu nedenle, metamizol eşzamanlı uygulandığında dikkatli olunması önerilir; klinik yanıt ve/veya ilaç seviyeleri uygun şekilde izlenmelidir.
NOVALGİN® klorpromazinle birlikte kullanıldığında şiddetli hipotermi oluşabilir.
Metotreksata metamizol eklenmesi, özelikle yaşlı hastalarda metotreksatın hematotoksisitesini artırabilir. Bu nedenle bu kombinasyondan kaçınılmalıdır.
Metamizol eş zamanlı alındığında asetilsalisilik asidin (aspirin) trombosit agregasyonu üzerindeki etkisini azaltabilir, Bu nedenle bu kombinasyon kardiyoproteksiyon amacıyla düşük doz aspirin kullanan hastalarda dikkatli kullanılmalıdır.
Pirazolonlar ile oral antikoagülanlar, kaptopril, lityum ve triamteren arasında etkileşimler olabildiği ve kombine kullanımda antihipertansiflerin ve diüretiklerin etkinliğinin değişebildiği bilinmektedir. Metamizolün bu etkileşimlere ne düzeyde neden olduğu bilinmemektedir.
Laboratuvar testleriyle etkileşim
Metamizol kullanan hastalarda, Trinder/Trinder-benzeri reaksiyonların kullanıldığı laboratuvar testleri (örneğin kreatinin, trigliseritler, HDL kolesterol ve ürik asit serum seviyelerini ölçmek için yapılan testler) ile etkileşim bildirilmiştir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: 1. ve 2. trimesterde C, 3. Trimesterde X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli olan kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadırlar.
Gebelik dönemi
1. ve 2. trimester:
Metamizol'ün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
NOVALGİN® gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
3. trimester:
Metamizol gebelik döneminde uygulandığı takdirde ciddi doğum kusurlarına yol açtığından şüphelenilmektedir. Metamizol gebelik döneminde kontrendikedir (bkz. Bölüm 4.3).
İlk trimesterde (n = 568) metamizole maruz kalan gebe kadınlara dair yayınlanan verilere göre, teratojenik veya embriyotoksik etkilere ilişkin bir kanıt saptanmamıştır. Seçili vakalarda, başka tedavi seçeneği olmadığında, birinci ve ikinci trimesterde tek doz metamizol kullanımı kabul edilebilir. Ancak genel olarak, birinci ve ikinci trimesterde metamizol kullanılması önerilmez. Üçüncü trimesterde metamizol kullanımı fetotoksisite (böbrek yetmezliği ve duktus arteriozus konstriksiyonu) ile ilişkilidir ve bu nedenle metamizol kullanımı gebeliğin üçüncü trimesterinde kontrendikedir (Bkz. Bölüm 4.3). Üçüncü trimesterde yanlışlıkla metamizol kullanılması durumunda amniyotik sıvı ve duktus arteriozus ultrason ve ekokardiyografi ile kontrol edilmelidir. Metamizol prostaglandin sentezinin sadece zayıf bir inhibitörü olmasına rağmen, fetal ve maternal trombosit agregasyonundaki azalmaya bağlı perinatal komplikasyon olasılığı göz ardı edilemez.
Metamizol, plasenta bariyerini geçer. Hayvanlarda metamizol üreme toksisitesi göstermiş ancak teratojenite göstermemiştir (bkz. Bölüm 5.3).
Laktasyon dönemi
Metamizolün parçalanma ürünleri kayda değer miktarda anne sütüne geçer ve emzirilen bebek için risk göz ardı edilemez. Özellikle emzirme döneminde tekrarlı şekilde metamizol kullanımından kaçınılmalıdır. Tek bir metamizol uygulaması durumunda, annelerin dozdan sonra 48 saat boyunca sütlerini sağmaları ve atmaları önerilir.
Üreme yeteneği/Fertilite
Hayvanlarda metamizol üreme toksisitesine neden olmaktadır.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Önerilen dozaj sınırları içinde konsantrasyon ve reaksiyon yeteneği üzerinde bilinen herhangi bir istenmeyen etki yoktur. Ancak yine de, tedbir amaçlı olarak en azından yüksek dozlarda, konsantrasyon ve reaksiyon yeteneğinin bozulabileceği göz önünde bulundurulmalı ve araç ya da makine kullanımından ve diğer riskli aktivitelerden kaçınılmalıdır (özellikle de alkol kullanımı söz konusu ise).
4.8. İstenmeyen etkiler
Advers ilaç reaksiyonları aşağıdaki sıklık derecesine göre belirtilmiştir:
Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila ≤ 1/10); yaygın olmayan (≥ 1/1.000 ila ≤ 1/100); seyrek (≥ 1/10.000 ila ≤ 1/1.000); çok seyrek (≤ 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Kan ve lenf sistemi hastalıkları
Seyrek: Lökopeni
Çok seyrek: Ölümle sonuçlanabilen agranülositoz, trombositopeni Bilinmiyor: Aplastik anemi, ölümle sonuçlanabilen pansitopeni
Bunlar, daha önce hiçbir komplikasyon olmaksızın birçok kez NOVALGİN® kullanılmış olmasına rağmen yine de oluşabilir.
Bunlar nadir endikasyonlardır ve NOVALGİN® bir haftadan daha uzun süre kullanıldığında agranülositoz riski artabilir.
Bu reaksiyon doza bağlı değildir ve tedavi sırasında herhangi bir zamanda oluşabilir. Agranülositozun tipik belirtileri yüksek ateş, titreme, boğaz ağrısı, yutkunma güçlüğü ve ağız, burun, boğaz ve genital veya anal bölgede inflamasyondur. Ancak, antibiyotik tedavisi uygulanan hastalarda agranülositozun tipik belirtileri minimal düzeyde olabilir. Lenf nodlarında veya dalakta büyüme düşüktür ya da büyüme söz konusu değildir. Eritrosit sedimentasyon hızı çok artmıştır, granülositler belirgin derecede azalmış ya da tümüyle yok olmuştur. Her zaman olmamakla beraber genel olarak, hemoglobin, kırmızı hücreler ve trombosit değerleri normaldir (Bkz. Bölüm 4.4).
İyileşme için tedavinin derhal kesilmesi önemlidir. Dolayısıyla hastanın genel durumu beklenmedik biçimde kötüleşir, ateşi düşmez ya da yeniden yükselirse veya özellikle ağız, burun ve boğazda olmak üzere mukoz membranlarda ağrılı değişiklikler gözlemlenirse, diagnostik laboratuvar araştırma sonuçlarını beklemeksizin NOVALGİN® tedavisinin, derhal kesilmesi kesin bir şekilde önerilmektedir.
Deri ve mukoz membranlarda kanamaya eğilim ve peteşi trompositopeninin tipik belirtilerindendir.
Pansitopeni durumunda, tedavi derhal durdurulmalı ve normal değerlere dönünceye kadar tam
kan sayımı takibi yapılmalıdır (Bkz. Bölüm 4.4).
Bağışıklık sistemi hastalıkları
Seyrek: Anafilaktik/anafilaktoid reaksiyonlar*
Çok seyrek: Analjezik kaynaklı astım sendromu. Analjezik astım sendromu olan hastalarda, bu intolerans reaksiyonları tipik olarak astım atakları şeklinde görülür.
Bilinmiyor: Anafilaktik şok*
*Bu reaksiyonlar özellikle parenteral uygulama sonrasında oluşabilir, şiddetli ve yaşamı tehdit eder bir hal alabilir ve hatta bazen ölümle sonuçlanabilir. Bu reaksiyonlar NOVALGİN® daha önce defalarca hiçbir şikayete yol açmadan kullanılmış olsa bile ortaya çıkabilir.
Bu tür reaksiyonlar; metamizol uygulamasının hemen sonrasında ya da saatler sonra ortaya çıkabilir. Ancak buradaki olağan durum; uygulamadan sonraki ilk bir saat içinde reaksiyonun oluşmasıdır. Daha hafif reaksiyonlar tipik olarak kutanöz ve mukozal semptomlar (kaşınma, yanma, kızarma, ürtiker, kabartılar gibi), dispne ve daha az sıklıkla gastrointestinal şikayetler halinde ortaya çıkar. Bu hafif reaksiyonlar zamanla jeneralize ürtiker, şiddetli anjiyoödem (hatta larinksi de kapsayacak şekilde), şiddetli bronkospazm, kardiyak aritmiler, kan basıncında düşüş (bazen öncesinde kan basıncı artışıyla) ve dolaşım şoku ile şiddetli formlara ilerleyebilir. Dolayısıyla eğer cilt reaksiyonları gelişirse, NOVALGİN® tedavisi derhal durdurulmalıdır.
Kardiyak hastalıklar
Bilinmiyor: Kounis sendromu
Vasküler hastalıkları
Yaygın olmayan: Uygulama esnasında ya da uygulamadan sonra hipotansif reaksiyonlar (muhtemelen farmakolojik kaynaklı olan ve anafilaktik/anafilaktoid reaksiyonun diğer belirtilerini içermeyen). Bu tipte bir reaksiyon kan basıncında ciddi olabilecek bir düşüşe neden olabilir. Hızlı enjeksiyon bu gibi hipotansif reaksiyon oluşma riskini arttırır.
Yüksek ateş durumunda, aşırı duyarlılık reaksiyonunun herhangi bir başka belirtisi olmaksızın, kan basıncında doza bağlı olarak kritik bir düşüş de oluşabilir.
Gastrointestinal hastalıklar
Bilinmiyor: Gastrointestinal kanama vakaları bildirilmiştir.
Hepatobiliyer hastalıklar
Bilinmiyor: Akut hepatit, sarılık, karaciğer enzimlerinde yükselme dahil ilaca bağlı karaciğer hasarı (Bkz. Bölüm 4.4).
Deri ve deri altı dokusu hastalıkları
Yaygın olmayan: Sabit ilaç erüpsiyonları Seyrek: Döküntü (örn. makülo-papüler döküntü)
Çok seyrek: Stevens-Johnson sendromu ya da Toksik Epidermal Nekroliz (tedaviyi
durdurunuz, Bkz. Bölüm 4.4)
Bilinmiyor: Eozinofili ve sistemik semptomlarla ilaç etkileşimi (DRESS)
Metamizol tedavisi ile ilişkili olarak Stevens-Johnson sendromu (SJS), toksik epidermal nekroliz (TEN) ve eozinofili ve sistemik semptomlarla ilaç etkileşimi (DRESS) dahil olmak üzere şiddetli kutanöz advers reaksiyonlar bildirilmiştir (Bkz. bölüm 4.4).
Böbrek ve idrar yolu hastalıkları
Çok seyrek: Böbrek fonksiyonunda akut kötüleşme, çok nadir olarak oligüri, anüri veya proteinüri, ve/veya akut böbrek yetmezliği gelişebilir, akut interstisyel nefrit
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Bazen idrarda kırmızı renklenme gözlenmiştir; bu, düşük konsantrasyonda bulunan zararsız
bir metamizol metabolitine (rubazonik asit) bağlı olabilir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmesi gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Belirtiler:
Akut doz aşımı sonrası bulantı, kusma, abdominal ağrı, böbrek fonksiyon bozukluğu/akut böbrek yetmezliği (örn. interstisyel nefrite bağlı olarak) ve daha nadir olarak merkezi sinir sistemi semptomları (baş dönmesi, somnolans, koma, konvülziyonlar), kan basıncında düşüş veya bazen şok ve kardiyak aritmiler (taşikardi) bildirilmiştir. Çok yüksek dozlardan sonra, rubazonik asit atılımı sonucu idrar rengi kırmızıya dönebilir.
Tedavi:
Metamizolün bilinen spesifik bir antidotu yoktur. Eğer ilaç yeni alınmışsa, etkin maddelerin daha fazla sistemik emilimini sınırlamak amacıyla primer detoksifikasyona yönelik (örn. gastrik lavaj) ya da emilimi azaltıcı (örn. aktif kömür) önlemler alınabilir. İlacın ana metaboliti (4-N-metil-amino-antipirin) diyaliz, hemofiltrasyon, hemoperfüzyon ya da plazma filtrasyonu yoluyla elimine edilebilir.
Zehirlenme tedavisi ve ciddi komplikasyonların önlenmesi, genel ve spesifik olarak yoğun
medikal takip ve tedavi gerektirir.
Ciddi aşırı duyarlılık reaksiyonları (şok) oluşması durumda derhal alınması gereken tedbirler:
İlk belirtiler görüldüğünde (örn. ürtiker ve ciltte kızarma , huzursuzluk, baş ağrısı, terleme, bulantı gibi kutanöz reaksiyonlar), enjeksiyon durdurulmalıdır. Kanül damarda bırakılır veya damar girişi açılır. Baş ve üst gövdeyi alçaltmak, solunum yolu sağlamak ve oksijen
uygulamayı içeren genel acil durum tedbirlerine ilave olarak, sempatomimetikler, volüm
değiştirme veya glukokortikoidlerin kullanımı gerekli olabilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Analjezikler, Diğer Analjezikler ve Antipiretikler, Pirazolonlar
ATC Kodu: N02BB02
Metamizol analjezik, antipiretik ve antispazmodik özellikleri olan bir pirazolon türevidir.
Etki mekanizması tam olarak anlaşılamamıştır. Bazı araştırmaların sonuçları metamizol ve ana metabolitinin (4-N-metil-amino-antipirin) kombine bir santral ve periferik etki modeline sahip olabileceğini göstermektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerMetamizol ve metabolitlerinin farmakokinetiği tam olarak araştırılmamıştır. Fakat aşağıdaki bilgiler verilebilir:
Emilim:
Oral uygulamadan sonra metamizol tamamen aktif metaboliti olan 4-N-metil-amino-antipirine (MAA) hidrolize olur. Metamizolün ana metaboliti MAA, karaciğerde oksidasyon, demetilasyon ve ardından asetilasyon ile daha fazla metabolize edilir. MAA'nın mutlak biyoyararlanımı yaklaşık olarak %90'dır ve oral uygulama sonrası intravenöz uygulamaya oranla biraz daha yüksektir. Metamizol besinlerle birlikte alındığında MAA'nın farmakokinetiği fark edilir bir değişikliğe uğramaz.
Dağılım:
Proteine bağlanma düzeyleri MAA için %58, AA için %48, FAA için %18 ve AAA için
%14'dür. Bir intravenöz doz sonrası metamizolün plazma yarılanma ömrü yaklaşık 14 dakikadır. Metamizol plasenta bariyerini geçer. Metabolitleri emziren annelerin sütüne geçer.
Biyotransformasyon:
Klinik etkiyi temel olarak MAA ve bir dereceye kadar da 4-amino-antipirin (AA) sağlar. AA'nın EAA değerleri MAA'nın EAA değerinin yaklaşık %25'ini oluşturur. 4-N-asetil- amino-antipirin (AAA) ve 4-N-formil-amino-antipirin (FAA) gibi metabolitlerin klinik etkileri yok gibi görünmektedir. Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalışmaya ihtiyaç vardır. Kısa dönemli tedavide metabolitlerin birikiminin fazla bir klinik anlamı yoktur.
Eliminasyon:
Radyoaktif işaretli intravenöz dozun yaklaşık %96'sı idrar, yaklaşık %6'sı ise feçes yoluyla atılır. Tek bir oral dozdan sonra metabolitlerin %85'i idrarla atılmış ve bunun %3ï±%1'i MAA, %6ï±%3'ü AA, %26ï±%8'i AAA ve %23ï±%4'ü FAA'dan oluşmuştur. 1 g'lık tek bir oral metamizol dozundan sonra renal klerens MAA için 5 mlï±2 ml/dk., AA için 38 mlï±13 ml/dk., AAA için 61 mlï±8ml/dk., ve FAA için 49 mlï±5 ml/dk olmuştur. Aynı dozdan sonraki plazma yarılanma ömürleri de MAA için 2,7ï±0,5 saat, AA için 3,7 +1,3 saat, AAA için 9,5ï±1,5 saat ve FAA için 11,2ï±1,5 saat olmuştur.
Doğrusallık/doğrusal olmayan durum:
Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalışmaya ihtiyaç vardır.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Yaşlı hastaların tedavisinde EAA 2-3 kat artar. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Karaciğer yetmezliği:
Karaciğer sirozu olan hastalarda, tek doz oral uygulama sonrasında, MAA ve FAA'nın yarılanma ömrü yaklaşık 3 kat artarken AA ve AAA'nın yarılanma ömürleri aynı dereceye yükselmez Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Pediyatrik populasyon:
Çocuklarda metabolitler yaşlı hastalara göre daha hızlı elimine olur.
Böbrek yetmezliği:
Böbrek fonksiyonu bozulmuş olan hastalara ait mevcut veriler bazı metabolitler için (AAA ve FAA) eliminasyonun azaldığını göstermektedir. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Biyoyararlanım:
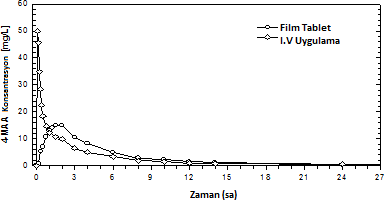
1987'de 12 gönüllü ile gerçekleştirilen, film kaplı tabletlerin referans ürünle (2 dakikalık IV uygulama) karşılaştırıldığı bir biyoyararlanım araştırmasında, 4-MAA için aşağıdaki sonuçlar gösterilmiştir:
| Film kaplı tablet (1 g) | i.v. uygulama (1 g) |
Doruk plazma konsantrasyonu (C) [mg/l] | 17,3 ï± 7,54 | 56,5 ï± 12,2 |
Doruk plazma konsantrasyonu süresi (t) [s] | 1,42 ï± 0,54 | Enjeksiyon sonu |
Konsantrasyon-zaman eğri altı alan (EAA) [mg s/l] | 80,9 ï± 34,1 | 71,2 ï± 13,7 |
(Değerler ortalama ve standart sapma olarak gösterilmektedir)
Film kaplı tabletin 4-MAA plazma konsantrasyonu için EAA ile ölçülen mutlak biyoyararlanımı %93 olmuştur.
Şekil 3: Konsantrasyon-zaman grafiğinde ortalama plazma eğrilerinin referans ürünle karşılaştırılması
5.3. Klinik öncesi güvenlilik verileri
Kronik toksisite:Farklı hayvan türlerinde subkronik ve kronik toksisite çalışmaları gerçekleştirilmiştir. Sıçanlarda 6 ay süreyle günlük 100-900 mg/kg vücut ağırlığı vücut ağırlığı dozunda metamizol uygulanmıştır. En yüksek dozda (900 mg/kg), 13. haftadan sonra retikülositlerde ve Heinz cisimciklerinde artış saptanmıştır.
Köpeklerde 6 ay süreyle günlük 30-600 mg/kg vücut ağırlığı dozlarında metamizol uygulanmıştır. Günde 300 mg/kg dozlarından itibaren, doza bağlı hemolitik anemi ve böbrek ve karaciğer işlevlerinde bozulma gözlenmiştir.
In vitro ve in vivo deneyler, aynı test sistemlerinde metamizol için çelişkili sonuçlar vermiştir.
Karsinojenite:
Sıçanlarda yapılan uzun süreli çalışmalarda karsinojenik potansiyeli gösteren bir bulguya rastlanmamıştır. Farelerde yapılan uzun süreli üç çalışmadan ikisinde, yüksek dozlarda karaciğer hücreli adenomlarda artış bildirilmiştir.
Üreme toksisitesi:
Sıçan ve tavşanlarda yapılan embriyotoksisite çalışmalarında teratojenik potansiyel gösterilmemiştir.
Tavşanlarda, maternal toksisite göstermeyen 100 mg/kg/gün dozunda letal etkiler bildirilmiştir. Sıçanlarda fatal embriyotoksik etkiler, maternal toksisite gözlenen doz aralığında ortaya çıkmıştır. Sıçanlarda 100 mg/kg/gün'ün üzerindeki dozlar, gestasyon süresinde uzama ve doğum sürecinde bozulmayla beraber, yavrularda mortalite artışına neden olmuştur.
Fertilite testlerinde, 250 mg/kg/gün'ün üzerindeki dozlarda döl veren jenerasyonun gebelik oranında hafif bir azalma gösterilmiştir. F1 jenerasyonun fertilitesi etkilenmemiştir.
Metamizol metabolitleri anne sütüne geçmektedir. Emzirenlerdeki etkilerine dair bir bilgi mevcut değildir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Mısır nişastası
Talk
Laktoz (sığır sütü kaynaklı) Sodyum bikarbonat Magnezyum stearat
6.2. Geçimsizlikler
Bildirilmemiştir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30ï°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
20 tabletlik PVC/Alu blister ambalajlarda
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi atıkların kontrolü yönetmeliği' ve
âAmbalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ANDOLOR | 8699508750016 | 129.40TL |
| DEVALJIN | 8699525750341 | 113.62TL |
| GERALGINE-M | 8681023750022 | |
| KAFALGIN | 8699550010090 | |
| KARMIZOL | 8680530620026 | |
| Diğer Eşdeğer İlaçlar |
 |
Sırt Ağrısı Sırt ağrısı birden bire ortaya çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun süreli sorunlara (kronik) neden olabilir. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
Opella Healthcare Tüketici Sağlığı A.Ş
| Satış Fiyatı | 77.65 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 77.65 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8683060010107 |
| Etkin Madde | Metamizol Sodyum |
| Yerli ve Beşeri bir ilaçdır. |