NUMETA PED G19 %E infüzyon için emülsiyon 1000 ml { Baxter Renal } Farmasötik Özellikler
{ Amino Asit + Elektrolit + Lipid + Karbonhidrat }
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Lipid emülsiyonu odacığı
Enjeksiyonluk yumurta fosfolipidleri (tavuk kaynaklı) Gliserol
Sodyum oleat
Sodyum hidroksit (pH ayarı için) Enjeksiyonluk su
Amino asit çözeltisi odacığı L-Malik asit (pH ayarı için) Enjeksiyonluk su
Glukoz çözeltisi odacığı Hidroklorik asit (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.
6.2. Geçimsizlikler
için ayrıca Bölüm 6.2'ye bakınız.
Herhangi bir parenteral beslenme karışımında olduğu gibi kalsiyum ve fosfatın oranı dikkate alınmalıdır. Aşırı kalsiyum ve fosfat eklemek, özellikle de bunların mineral tuzları kalsiyum fosfat şeklinde çökelmelere neden olabilir.
Her yaştaki hastada, farklı infüzyon yolları veya farklı infüzyon bölgeleri kullanılsa bile, seftriakson-kalsiyum tuzu şeklinde çökme riskinden dolayı, seftriakson, NUMETA PED G19%E de dahil olmak üzere, herhangi bir intravenöz kalsiyum içeren çözelti ile karıştırılmamalı veya eş zamanlı olarak kullanılmamalıdır.
Çökelme riskinden dolayı, NUMETA PED G19%E ampisilin, fosfenitoin veya furosemid ile aynı infüzyon yoluyla uygulanmamalıdır.
NUMETA PED G19%E kanla birlikte aynı infüzyon setinden uygulanmamalıdır (Bkz. Bölüm 4.5).
NUMETA PED G19%E, sitrat-antikoagüle/korunmuş kanda veya bileşenlerinde çökelmiş ek koagülasyon riski oluşturan kalsiyum iyonları içerir.
6.3. Raf ömrü
24 ay.
Rekonstitüsyon sonrası raf ömrü
İki ya da üç odacık arası separatörler açılarak karışım gerçekleştirildikten sonra, mümkün olan en kısa süre içinde kullanılması önerilmektedir. Bununla birlikte odacıklar arası separatörler açılarak karıştırıldıktan sonra, 2-8°C arasında 7 gün ve ardından 30°C'de 48 saat süreyle stabilitesini koruduğu gösterilmiştir.
İlaç eklemeleri (elektrolitler, eser elementler, vitaminler, su) yapıldıktan sonraki raf ömrü Spesifik karışımlar için, ilaç eklendikten sonra yapılan stabilite çalışmalarında 2 - 8°C arasında 7 gün ve ardından 30°C'de 48 saat süreyle stabilitenin korunduğu gösterilmiştir.
Mikrobiyolojik açıdan, ürünün hemen kullanılması önerilir. Hemen kullanılmadığı durumda, ilaç eklendikten sonraki kullanım öncesi saklama süresi ve koşulları uygulayıcının sorumluluğundadır ve rekonstitüsyon/seyreltme/ilaç eklemeleri kontrollü ve validasyonu aseptik koşullarda yapılmamışsa, ürün 2-8°C'de 24 saatten fazla bekletilmemelidir.
Lütfen aynı zamanda Bölüm 4.2 ve Bölüm 6.6'ya bakınız.
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklanmalıdır. Dondurulmamalıdır. Koruyucu dış ambalajı içinde saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Üç odacıklı PVC olmayan torba aşağıdaki bileşenlerden oluşur:
Çok katlı bir plastik tabaka.
Lipid emülsiyon içeren odacığa iliştirilmiş kör bir uç (Bu odacığa ekleme yapılmasını engellemek için odacığın doldurulmasını takiben bu uç kapatılmıştır).
Amino asit ve glukoz çözeltisi içeren odacıklara iliştirilmiş iki uç.
Glukoz içeren odacığın ucunu kapatan bir enjeksiyon ucu.
Amino asit odacığının ucunu kapatan bir uygulama ucu.
Hiçbir bileşen doğal lateks plastiği içermez.
Hava ile temasını engellemek için torba oksijen geçirmeyen bir dış torbayla kaplıdır. Dış torba ile çok katlı torba arasında oksijen absorbanı içeren bir saşe bulunmaktadır ve oksijen indikatörü de içerir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tek kullanımlıktır.
Hasarlı torbalar kullanılmamalıdır. Torbanın ve geçici separatörlerin sağlamlığı kontrol edilmelidir. Amino asit ile glukoz çözeltileri berrak, renksiz ya da hafif sarı renkteyse, partikül içermiyorsa ve emülsiyon homojen süt görünümündeyse kullanılmalıdır.
Dış torbayı açmadan önce oksijen indikatörünün rengi kontrol edilmelidir. Bu renk "OK" sembolünün yanında basılı ve indikatör etiketinin baskılı bölümünde gösterilmiş olan renkle karşılaştırılmalıdır. Oksijen indikatörünün rengi, "OK" sembolünün yanında basılı olan referans renkle aynı değilse ürün kullanılmamalıdır.
İlaç eklemeleri
Uygulama boyunca karışım açısından, eser element ve vitamin içeren karışımlar ışıktan korunmalıdır. Ortam ışığına maruziyet, ışık korunumu ile indirgenebilen peroksitleri ve diğer degradasyon ürünlerini oluşturur (Bkz. Bölüm 4.4).
Uygun eklemeler rekonstitüsyonu yapılan ürüne enjeksiyon bölgesinden yapılabilir (geçici separatörler ayrılarak iki ya da üç odacıktaki içeriğin karışımı gerçekleştirildikten sonra).
Vitamin eklemeler, karışım gerçekleştirilmeden önce (geçici separatörler ayrılarak 3 odacıktaki
içeriğin karışımı gerçekleştirilmeden önce) glukoz çözeltisi içeren odacığın içine de yapılabilir.
Tanımlanmış miktarlarda eklenme ihtimali olan, ticari olarak mevcut eser element çözeltileri (TE1, TE2 ve TE4 olarak tanımlanmıştır), vitaminler (liyofilizat V1 ve emülsiyon V2 olarak tanımlanmıştır) ve elektrolitler Tablo 1-6'da sunulmuştur.
TE4, V1 ve V2 ile geçimlilik
Tablo 1: Su ile seyreltme ile veya seyreltme olmadan üçü bir arada (Aktive 3 odacıklı torba) geçimliliği
Her bir 1000 mL için (lipidler ile 3 odacık karışımı) | ||||||
| Seyreltme olmadan karışım | Seyreltme ile karışım | ||||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 45,8 | 105 | 151 | 45,8 | 105 | 151 |
Potasyum (mmol) | 32 | 118 | 150 | 32 | 118 | 150 |
Magnezyum (mmol) | 2,6 | 7,8 | 10,4 | 2,6 | 7,8 | 10,4 |
Kalsiyum (mmol) | 3,8 | 20,5 | 24,3 | 3,8 | 20,5 | 24,3 |
Fosfat* (mmol) | 9,4 | 14,6 | 24 | 9,4 | 14,6 | 24 |
Eser elementler & vitaminler | - | 34 mL TE4 + 3,4 flakon V1 + 38 mL V2 | 34 mL TE4 + 3,4 flakon V1 + 38 mL V2 | - | 34 mL TE4 + 3,4 flakon V1 + 38 mL V2 | 34 mL TE4 + 3,4 flakon V1 + 38 mL V2 |
Enjeksiyonluk su | - | - | - | - | 1450 mL | 1450 mL |
Organik fosfat
Tablo 2: İkisi bir arada (Aktive 2 odacıklı torba) geçimliliği
Her bir 775 mL için (lipidler olmadan 2 odacık karışımı) | |||
Eklentiler | Mevcut seviye | Maksimum ekleme | Maksimum toplam seviye |
Sodyum (mmol) | 45,1 | 32 | 77,1 |
Potasyum (mmol) | 32 | 45,6 | 77,6 |
Magnezyum (mmol) | 2,6 | 5,2 | 7,8 |
Kalsiyum (mmol) | 3,8 | 19,4 | 23,2 |
Fosfat* (mmol) | 7,2 | 16 | 23,2 |
Eser elementler & vitaminler | - | 10mL TE4 +1 flakon V1 | 10mL TE4 + 1 flakon V1 |
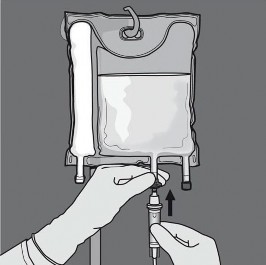
Basamak: Uygulama ucundaki koruyucu kapak çıkarılarak intravenöz uygulama seti buraya yerleştirilmelidir.
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Ürünlerin Kontrolüâ yönetmeliği ve âAmbalaj ve Ambalaj Atıklarının Kontrolüâ yönetmeliğine uygun olarak imha edilmelidir.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| AMINOMIX | 8699630697579 | |
| CLINIMIX | 8699556696809 | |
| EVILO | 8699606887478 | |
| glükoz-1100 | 8699788695366 | |
| KABIVEN | 8699630697234 | |
| Diğer Eşdeğer İlaçlar |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Baxter Turkey Renal Hizmetler A.Ş.
| Satış Fiyatı | 3304.99 TL [ 28 Jun 2024 ] |
| Önceki Satış Fiyatı | 3304.99 TL [ 14 Jun 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8681413881114 |
| Etkin Madde | Amino Asit + Elektrolit + Lipid + Karbonhidrat |
| ATC Kodu | B05BA10 |
| Birim Miktar | 1000 |
| Birim Cinsi | ML |
| Ambalaj Miktarı | 1 |
| Kan ve Kan Yapıcı Organlar > Damar İçine Enjekte Edilenler > Beslenme Serumu Kombinasyonları |
| İthal ( ref. ülke : Italya ) ve Beşeri bir ilaçdır. |